LADA (Piper nigrum L.) DI PROVINSI BANGKA BELITUNG
DAN POTENSINYA SEBAGAI AGENSIA HAYATI
KRISTIANA
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
ABSTRAK
KRISTIANA. Populasi Bakteri Endofit pada Pertanaman Lada (Piper nigrum L.) di Provinsi Bangka Belitung dan Potensinya sebagai Agensia Hayati. Dibimbing oleh ABDUL MUNIF.
Lada (Piper nigrum L.) merupakan salah satu komoditas penting di Indonesia. Provinsi Bangka Belitung merupakan salah satu sentra produksi lada yang penting di Indonesia. Produksi lada di wilayah ini mengalami penurunan dari setiap tahunnya. Salah satu penyebab penurunan tersebut adalah tingginya serangan penyakit kuning yang disebabkan oleh nematoda parasit oleh nematoda parasit terutama Meloidogyne incognita dan Radopholus simili. Penelitian ini bertujuan untuk mengetahui populasi dan kelimpahan bakteri endofit pada perkebunan lada di Bangka, baik pada kebun lada yang sehat ataupun yang sakit (yang terserang penyakit kuning) dan meneliti potensinya terhadap pertumbuhan tanaman serta sebagai agensia hayati. Penelitian dilakukan di Laboratorium Nematologi Departemen Proteksi Tanaman, IPB. Tahapan dari penelitian ini meliputi survei kebun lada sehat dan terserang. Contoh tanah dan akar tanaman lada diambil dari kebun sehat dan sakit untuk dilakukan ekstraksi nematoda parasit dan isolasi bakteri endofit dilakukan dengan teknik sterilisasi permukaan. Bakteri endofit yang diperoleh selanjutnya dilakukan pengujian terhadap perkecambahan benih tanaman tomat dan kultur fitrat bakteri endofit terhadap mortalitas larva Meloidogyne spp. Analisis data menggunakan rancangan acak lengkap (RAL). Data yang diperoleh diolah melalui sidik ragam yang dilanjutkan dengan uji Duncan pada taraf 5% dengan menggunakan program SAS 9.1.3. Hasil penelitian menunjukkan bahwa persentase kejadian penyakit kuning di Kabupaten Bangka lebih tinggi dibandingkan dengan Kabupaten Bangka Tengah. Kerapatan populasi bakteri endofit dari akar pada kebun sehat lebih tinggi dibandingkan dengan kebun sakit. Hasil pengujian isolat bakteri endofit terhadap perkecambahan menunjukkan bahwa sebanyak 5 isolat bakteri endofit yaitu EB4, EB7, EB10, EB12, dan EB14 mempunyai kemampuan mempercepat perkecambahan dan memacu pertumbuhan akar tanaman tomat. Hasil uji kultur filtrat isolat bakteri endofit menunjukkan bahwa isolat EB14 memberikan pengaruh paling tinggi terhadap mortalitas Meloidogyne spp. pada uji in vitro.
POPULASI BAKTERI ENDOFIT PADA PERTANAMAN
LADA (Piper nigrum L.) DI PROVINSI BANGKA BELITUNG
DAN POTENSINYA SEBAGAI AGENSIA HAYATI
KRISTIANA
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian pada
Departemen Proteksi Tanaman
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
Judul Usulan Penelitian : Populasi Bakteri Endofit pada Pertanaman Lada (Piper nigrum L.) di Provinsi Bangka Belitung dan Potensinya sebagai Agensia Hayati
Nama : Kristiana
Nomor Pokok : A34061108
Disetujui Pembimbing
Dr. Ir. Abdul Munif, M.Sc. NIP. 19630609 198903 1 002
Diketahui
Ketua Departemen Proteksi Tanaman
Dr. Ir. Dadang, M.Sc. NIP. 19640204 199002 1 002
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Allah SWT atas rahmat dan karuniaNya sehingga penulis dapat menyelesaikan skripsi yang berjudul “Populasi Bakteri Endofit pada Pertanaman Lada (Piper nigrum L.) di Provinsi Bangka Belitung dan Potensinya sebagai Agensia Hayati”.
Penulis mengucapkan terima kasih kepada Dr. Ir. Abdul Munif, M.Sc selaku dosen pembimbing dan Dr. Ir. Ali Nurmansyah, M.Si selaku dosen penguji tamu atas pengarahan, bimbingan, curahan pemikiran dan motivasi yang telah diberikan sejak proses penulisan proposal, pelaksanaan penelitian sampai penulisan skripsi.
Kepada ayahanda Harmo Miharjo (Alm), ibunda Sumiyem, dan semua keluarga yang senantiasa memotivasi dan mendukung penulis baik dalam bentuk doa maupun materil, selama menjalani perkuliahan hingga menyelesaikan skripsi ini.
Kepada teman-teman dan semua pihak yang tidak dapat disebutkan namanya satu persatu yang turut membantu dalam penelitian ini, sehingga skripsi ini dapat terselesaikan, penulis haturkan terima kasih.
Kritik dan saran sangat penulis harapkan, semoga skripsi ini dapat bermanfaat bagi pembaca dan pihak yang membutuhkannya.
Bogor, Februari 2011
RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 5 Oktober 1987, dari pasangan Bapak Harmo Miharjo (Alm) dan Ibu Sumiyem, di Kecamatan Tawangsari, Kabupaten Sukoharjo, Provinsi Jawa Tengah. Pendidikan yang telah ditempuh oleh penulis, yaitu SD Negeri Kateguhan II dan lulus pada tahun 2000. Pada tahun yang sama penulis melanjutkan pendidikan di MTs. Muhammadiyah Tawangsari Sukoharjo dan dinyatakan lulus pada tahun 2003.
Penulis melanjutkan jenjang pendidikan di SMU Negeri 2 Bogor dan lulus pada tahun 2006, kemudian melanjutkan studi di Institut Pertanian Bogor (IPB) melalui jalur USMI (Undangan Seleksi Masuk IPB) dan masuk Departemen Proteksi Tanaman, Fakultas Pertanian (FAPERTA) IPB dengan program keahlian minor Perlindungan Hutan Departemen Silvikultur Fakultas Kehutanan IPB.
Selama menempuh pendidikan di IPB, penulis pernah menjadi pengurus HIMASITA (Himpunan Mahasiswa Proteksi Tanaman) sebagai staf dari Departemen Komunikasi dan Informasi (Kominfo) periode 2007/2008 dan pada periode 2008/2009 penulis menjadi staf divisi Fasilitas dan Properti (Fasti). Pada tahun 2008, penulis magang di Klinik Tanaman Faperta IPB.
DAFTAR ISI
Halaman
DAFTAR ISI ... vii
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... ix DAFTAR LAMPIRAN ... x PENDAHULUAN ... 1 Latar Belakang ... 1 Tujuan Penelitian ... 2 Manfaat Penelitian ... 2 TINJAUAN PUSTAKA ... 3 Tanaman Lada... 3 Penyakit Kuning... 4 Pengendalian Hayati... 6 Bakteri Endofit ... 7
BAHAN DAN METODE ... 10
Tempat dan Waktu Penelitian ... 10
Metode Penelitian ... 10
Survei Tanaman Lada dan Penyakit Kuning ... 10
Pengambilan Contoh Akar dan Tanah Tanaman Lada ... 10
Ekstraksi Nematoda dari Akar dan Tanah ... 11
Isolasi Bakteri Endofit dari Perakaran Tanaman Lada ... 11
Pengujian Isolat Bakteri Endofit terhadap Pertumbuhan Tanaman Tomat ... 12
Uji Kultur Filtrat Isolat Bakteri Endofit terhadap Meloidogyne spp. 13 Analisis Data ... 14
HASIL DAN PEMBAHASAN ... 15
Persentase Kejadian Penyakit Kuning ... 15
Populasi Nematoda Meloidogyne spp. ... 16
Kelimpahan Populasi Bakteri Endofit ... 18
Pengujian Isolat Bakteri Endofit terhadap PertumbuhanTanaman Tomat ... 21
Uji Kultur Filtrat Isolat Bakteri Endofit terhadap Meloidogyne spp. ... 23
KESIMPULAN DAN SARAN ... 26
DAFTAR PUSTAKA ... 27
DAFTAR TABEL
Nomor Halaman
1. Kejadian penyakit kuning pada tanaman lada dari Kabupaten
Bangka dan Bangka Tengah ... 15 2. Karakterisasi morfologi isolat bakteri pada perakaran tanaman
lada yang berasal dari Kabupaten Bangka dan Bangka Tengah… 20 3. Pengaruh bakteri endofit terhadap perkecambahan dan panjang
akar pada tanaman tomat ... 23 4. Pengaruh kultur filtrat bakteri endofit terhadap mortalitas
DAFTAR GAMBAR
Nomor Halaman
1. Rata-rata populasi nematoda Meloidogyne spp. pada tanaman
lada dari Kabupaten Bangka ... 16 2. Rata-rata populasi nematoda Meloidogyne spp. pada tanaman
lada dari Kabupaten Bangka Tengah... 17 3. Rata-rata kerapatan bakteri endofit pada akar pertanaman lada
di Kabupaten Bangka ... 18 4. Rata-rata kerapatan bakteri endofit pada akar pertanaman lada
DAFTAR LAMPIRAN
Nomor Halaman
1. Gejala penyakit kuning pada tanaman lada ... 32 2. Pertanaman lada yang terserang penyakit kuning
(kebun sehat) ... 32 3. Perhitungan uji proporsi pada kejadian penyakit di Kabupaten
Bangka dan Bangka tengah... 33 4. Sidik ragam pengujian isolat bakteri endofit terhadap
perkecambahan benih tomat pada media cawan petri
(kertas saring) pada pengamatan 3HSP ... 34 5. Sidik ragam pengujian isolat bakteri endofit terhadap
perkecambahan benih tomat pada media cawan petri
(kertas saring) pada pengamatan 7HSP ... 34 6. Sidik ragam pengujian isolat bakteri endofit terhadap
perkecambahan benih tomat pada media sekam pada
pengamatan 7HSP ... 34 7. Sidik ragam pengujian isolat bakteri endofit terhadap
perkecambahan benih tomat pada media blotter test pada
pengamatan 7HSP ... 35 8. Sidik ragam pengujian isolat bakteri endofit terhadap
pertumbuhan panjang akar tomat ... 35 9. Sidik ragam pengujian kultur filtrat bakteri endofit terhadap
mortalitas larva Meloidogyne spp. pada pengamatan 12 jam ... 35 10. Sidik ragam pengujian kultur filtrat bakteri endofit terhadap
PENDAHULUAN
Latar Belakang
Lada (Piper nigrum L.) merupakan produk pertanian yang sudah tidak asing lagi bagi masyarakat. Lada juga merupakan salah satu komoditas ekspor yang sangat penting di Indonesia. Secara garis besar, pemanfaatan lada dibedakan menjadi empat, yaitu sebagai bumbu masak, campuran obat-obatan, campuran pembuatan minuman kesehatan dan penghangat tubuh, serta sebagai bahan pembuatan parfum (Sarpian 2003). Daerah sentra produksi lada utama di Indonesia adalah Provinsi Lampung, Bangka Belitung, Kalimantan Barat, Kalimantan Timur, Bengkulu dan Sulawesi Selatan (Deptan 2009).
Pada tahun 2001, luas areal pertanaman lada di Bangka Belitung tercatat 64.572 ha, namun areal tanam tersebut turun menjadi 45.834 ha pada tahun 2004, dan turun lagi menjadi 40.720 ha pada tahun 2006 (Dinas Pertanian dan Kehutanan Bangka Belitung 2007). Beberapa faktor yang diduga menjadi penyebab penurunan areal tanam dan produksi lada di wilayah Bangka Belitung yaitu: fluktuasi harga lada, gangguan organisme pengganggu tumbuhan (OPT), dampak penambangan timah ilegal, dan pengembangan komoditas perkebunan lain (Daras 2009).
Salah satu masalah dalam upaya meningkatkan produksi lada di wilayah Bangka Belitung adalah tingginya serangan penyakit kuning. Penyakit kuning disebabkan oleh nematoda parasit terutama Meloidogyne incognita dan Radopholus similis (Mustika 2005), Fusarium oxysporum (Duarte dan Chu 2005), dan faktor tanah (Waard 1979). Akibat dari serangan penyakit tersebut, pertumbuhan tanaman menjadi terhambat serta warna daun dan dahan menjadi kuning. Daun-daun yang menguning tidak menjadi layu, tetapi tergantung kaku dan sangat rapuh sehingga secara bertahap akan gugur. Penyakit tersebut biasanya menyerang lada pada tingkat segala umur, terutama antara 4-6 tahun, atau 7-9 tahun (Mustika 1996).
Pengendalian yang sering dilakukan oleh petani adalah dengan menggunakan pestisida. Namun, hal itu tidak sepenuhnya dapat membantu para petani dalam memecahkan masalah penyakit kuning tersebut. Teknologi
pengendalian penyakit kuning ini perlu terus dikembangkan guna mendapat strategi pengendalian yang tepat, khususnya ditingkat petani. Salah satunya adalah teknologi pengendalian biologi dengan pemanfaatan bakteri endofit. Bakteri endofit merupakan bakteri yang hidup dalam jaringan tanaman tanpa menimbulkan gejala penyakit pada tanaman tersebut dan dapat diisolasi dari jaringan tanaman yang sudah disterilisasi permukaannya atau diekstrak dari jaringan tanaman bagian dalam (Hallmann et al. 1997). Beberapa hasil penelitian menunjukkan bahwa bakteri endofit Enterobacter asburiae strain JM22 dari perakaran tanaman kapas dapat mengendalikan nematoda Meloidogyne incognita (Hallmann et al. 1998). Eksplorasi bakteri endofit sangat penting untuk mendapatkan bakteri yang berpotensi sebagai agensia hayati untuk mengendalikan OPT. Penelitian Munif (2001) menyebutkan bahwa penggunaan agensia hayati beberapa isolat bakteri endofit dari akar tanaman tomat dapat menekan perkembangan puru akar oleh Meloidogyne incognita pada tanaman tomat. Sejauh ini belum banyak dilaporkan perihal keberadaan bakteri endofit dari tanaman lada dan potensinya dalam mengendalikan nematoda parasit. Oleh karena itu kegiatan eksplorasi mikroba endofit yang bertujuan untuk pengendalian penyakit pada pertanaman lada sangat penting untuk dilakukan guna memperoleh kandidat agensia hayati yang potensial.
Tujuan Penelitian
Tujuan penelitian ini adalah mengetahui populasi dan kelimpahan bakteri endofit pada perkebunan lada rakyat di Provinsi Bangka Belitung baik pada kebun yang sehat maupun yang sakit (terserang penyakit kuning) dan potensinya sebagai agensiaia hayati.
Manfaat Penelitian
Hasil penelitian dapat memberikan informasi mengenai populasi dan kelimpahan bakteri endofit pada tanaman lada yang selanjutnya dapat digunakan sebagai informasi dasar dalam pengembangan program pengendalian organisme pengganggu tanaman maupun manfaatnya sebagai pemacu pertumbuhan tanaman.
TINJAUAN PUSTAKA
Tanaman Lada
Lada merupakan tanaman rempah yang menjadi komoditas penting dari zaman dahulu sampai sekarang. Diantara rempah-rempah lainnya, lada mendapat julukan sebagai “raja rempah-rempah” (The King of Spice) (Sutarno 2000). Lada yang mempunyai kasiat untuk menghangatkan badan, lada sangat diperlukan oleh masyarakat di negara-negara subtropis.
Tanaman lada bukanlah tanaman asli Indonesia melainkan dari India. Keberadaan tanaman lada sudah dikenal secara luas di India pada tahun 100-400M, ditemukan tumbuh secara liar di hutan-hutan belukar sekitar Malabar sampai daerah Ghat Barat (Sarpian 2003). Pada abad ke-6 SM, tanaman ini masuk ke Indonesia dibawa oleh saudagar-saudagar Hindu dari India melaui Selat Sunda. Di pesisir Selat Sunda, terutama Banten dan sekitarnya, tanaman ini dibudidayakan (Sutarno 2000).
Tanaman lada termasuk ke dalam divisi Spermatophyta, kelas Angiospermae, sub kelas Dicotyledoneae, ordo Piperales, famili Piperaceae, genus Piper, dan merupakan spesies Piper nigrum L. Lada tumbuh baik di daerah dengan ketinggian 0-500 mdpl. Hal ini berkaitan dengan suhu udara yang berpengaruh terhadap usia menghasilkan dan produktivitas tanaman (Wahid 1996). Tingkat kemiringan maksimal untuk pertumbuhan lada 15%, tekstur tanah yang dikehendaki liat berpasir. Tanaman lada dapat tumbuh pada tanah podsolik, andosol, latosol, grumosol, regosol yang memiliki drainase yang baik. Drainase yang kurang baik akan mengakibatkan perkembangan jamur lebih cepat. Untuk dapat berproduksi dengan baik tanaman lada menghendaki tanah yang subur dengan solum yang dalam dan mempunyai daya menahan air yang cukup tinggi. Tanaman lada dapat tumbuh dan menghasilkan dengan baik memerlukan jumlah pupuk yang relatif banyak (rakus unsur hara). Kandungan hara yang sesuai untuk tanaman lada adalah 0,266% N, 0,29% P2O5, 0,4% K2O, 0,18% MgO dan 0,5%
CaO dengan kemasaman tanah antara 5,5 – 6,9 (Direktorat Budidaya Tanaman Rempah dan Penyegar 2010).
Tanaman lada dapat tumbuh pada suhu antara 20˚C sampai 34˚C. Suhu optimum berkisar antara 23˚C sampai 32˚C dengan suhu rata-rata siang hari 29˚C. Adapun suhu tanah yang dikehendaki berkisar antara 25˚C samapi 30˚C pada kedalam 10 cm, kebutuhan suhu tanah optimal untuk pertumbuhan akar adalah 26˚C sampai 28˚C. Kelembaban optimal yang dibutuhkan adalah antara 60% sampai 80% (Zaubin 1979).
Varietas lada yang tersebar di Indonesia sampai saat ini tidak kurang dari 50 jenis varietas, diantaranya Varietas Cunuk, Jambi, Lampung Daun Lebar, Bangka, Kuching, dan Lampung Daun Kecil. Varietas yang sering ditanam oleh petani adalah Varietas Lampung Daun Lebar, karena varietas ini lebih banyak menghasilkan buah dibandingkan dengan varietas lain. Berdassarkann hasil penelitian dari Balittro Bogor ternyata ada 4 varietas lada unggul, yaitu Natar I, Natar II, Petaling I, dan Petaling II. Diantara varietas tersebut, Petaling I yang tahan terhadap penyakit kuning.
Produk utama yang diperoleh dari tanaman lada dan memiliki nilai komersial adalah buah yang sudah tua dan masak. Buah yang sudah tua diolah menjadi lada hitam, sedangkan buah yang dipanen saat masak akan diolah menjadi lada putih. Secara garis besar, pemanfaatan lada dibedakan menjadi lima, yaitu sebagai bumbu masak, sebagai bahan campuran obat-obatan, sebagai bahan campuran pembuatan minuman kesehatan dan penghangat tubuh, serta sebagai bahan pembuatan parfum (Sarpian 2003).
Penyakit Kuning
Penyakit kuning merupakan penyakit yang menimbulkan kerugian besar pada pertanaman lada. Penyakit kuning dapat dijumpai di Bangka dan Kalimantan. Penyebab penyakit ini adalah Radopholus similis, Meloidogyne incognita, dan Fusarium oxysforum, serta kesuburan dan kelembaban tanah yang rendah. Serangan nematoda R. similis dan M. incognita berlangsung secara bersamaan. Luka akibat serangan nematoda akan memudahkan infeksi cendawan F. oxysporum, serta menyebabkan tanaman peka kekeringan dan kekurangan unsur hara (Anonim 2007), serta keadaan lingkungan yang kurang baik (Mustika 1990, 1996).
Nematoda dewasa R. similis panjang sekitar 0,6-0,7 mm. nematoda betina mudah dikenali karena mempunyai bibir yang mendatar dan posisi vulva agak kebelakang dari pertengahan badan. Nematoda jantan mempunyai kepala yang membulat dan stilet yang kurang berkembang. Telur diletakkan satu-satu didalam akar, telur menetas setelah beberapa hari, dan larva yang keluar berkembang menjadi nematoda dewasa dalam 4-5 minggu. Nematoda jantan muncul agak lambat dan khusus di tempat-tempat yang paling sedikit nematodanya telah berkembang satu generasi. Jika jaringan akar telah rusak, nematoda betina meninggalkan akar yang terinfestasi dan bermigrasi melalui tanah ke akar atau tanaman lain yang masih sehat (Semangun 2000).
R. similis adalah nematoda luka akar yang semi-endoparasit, teutama hidup di dalam akar, tetapi dapat migrasi melalui tanah ke tanaman lain. Nematoda betina dewasa dapat hidup lama di dalam tanah yang lembab, tetapi dalam kondisi ini larva akan segera mati. Infestasi primer dilakukan oleh nematoda betina yang memasuki ujung rambut akar, kemudian membuat terowongan longitudinal melalui parenkim. Sel-sel yang sakit segera mati dan tampaklah bercak-bercak luka yang gelap. Nematoda juga bergerak ke akar-akar pokok dan membinasakannya dengan semua macam parenkim. Investasi ini segera diikuti oleh kerusakan sekunder karena nematoda, bakteri, dan jamur saprofit yang menyebabkan busuk akar.
Infeksi R. similis dibagian akar menyebabkan gejala penyakit kuning yang khas dan akan diperjelas apabila diikuti oleh infeksi M . incognita. serangan R. similis pada akar menyebabkan akar berlubang kecil-kecil (luka). Serangan M. incognita menyebabkan terbentuknya puru atau benjolan akar yang merupakan kumpulan dari nematoda tersebut. Akibat serangan nematoda tersebut akar menjadi tidak berfungsi, dan karena adanya luka yang dibuatnya, maka akan menjadi tempat masuknya cendawan F. oxysporum. Di lapangan, serangan kedua nematoda tersebut dapat berlangsung secara bersamaan.
Daur hidup M. incognita adalah 35 hari. Stadia larva nematoda betina 17 hari dan jantan 29 hari. Masa praoviposisi adalah 9 hari, jumlah telur yang dihasilkan nemaoda betina sampai 290 butir. Stadia telur 9 hari. Gejala puru akar mulai tampak 8 hari setelah inokulasi (Wiryadiputra et al. 1993).
Gejala yang nampak yaitu terjadinya penghambatan pertumbuhan tanaman, daun menjadi kuning, kaku tergantung tegak lurus dan makin lama akan makin mengarah ke batang. Daun-daun yang menguning tidak layu, tetapi sangat rapuh sehingga secara bertahap daun-daun tersebut gugur. Buah-buah akan lebih lama melekat pada tangkainya, dibandingkan daun. Cabang-cabang secara bertahap juga akan gugur, sehingga tanaman semakin gundul. Umumnya serangan penyakit kuning terjadi secara bekelompok, sehingga pada suatu areal kebun yang sakit terdapat kelompok tanaman yang masih sehat dan kelompok tanaman sakit pada berbagai stadia (Puslitbang Tanaman Perkebunan 2009).
Pengendaian Hayati
Agensia hayati adalah organisme yang dapat berkembang biak sendiri seperti parasitoid, predator, parasit, artropoda pemakan tumbuhan, dan patogen. Definisi terakhir mempunyai pengertian bahwa agensia hayati tidak hanya digunakan untuk mengendalikan OPT, tetapi juga mencakup pengertian penggunaannya untuk mengendalikan jasad pengganggu pada proses produksi dan pengolahan hasil pertanian. Menurut Agrios (2005) pengendalian hayati merupakan perlindungan pada tanaman dari patogen tanaman termasuk mikroorganisme antagonis pada saat setelah atau sebelum terjadinya infeksi patogen. Mekanisme biokontrol organisme yaitu dalam melemahkan atau membunuh patogen tanaman dengan perlawanan yaitu memparasit patogen secara langsung, memproduksi antibiotik (toksin), dan kemampuannya dalam kompetisi ruang dan nutrisi, produksi enzim untuk melawan komponen sel patogen, menginduksi respon ketahanan tanaman, dan produksi metabolisme tanaman dalam menstimulasi perkecambahan spora patogen.
Pengendalian hayati dapat dilakukan dengan beberapa cara misalnya dengan manipulasi lingkungan, introduksi agen antagonis, introduksi patogen avirulen alami serta mikroorganisme endofit untuk menginduksi sistem ketahanan tanaman inang (Cook dan Baker 1983). Pemanfaatan mikroorganisme endofit menjadi salah strategi satu pengendalian yang ramah lingkungan.
Keberhasilan pengembangan agensia hayati untuk pengendalian patogen tanaman adalah ketepatan dalam pemilihan jenis dan sumber agensia hayati yang akan dikembangkan. Pada umumnya jenis agensia hayati yang dikembangkan adalah mikroba alami, baik yang hidup sebagai saprofit di dalam tanah, air dan bahan organik, maupun yang hidup di dalam jaringan tanaman (endofit) yang bersifat menghambat pertumbuhan dan berkompetisi dalam ruang dan nutrisi dengan patogen sasaran, atau bersifat menginduksi ketahanan tanaman. Tahap pertama dalam pengembangan agensia hayati adalah seleksi agensia hayati nonpatogen. Seleksi dilakukan dengan mengisolasi calon agensia hayati dari populasi alaminya, seperti kelompok mikroba saprofit atau non patogen dari tanah atau dari bagian tanaman.
Bakteri Endofit
Bakteri endofit adalah bakteri yang hidup dalam jaringan tanaman tanpa menimbulkan gejala penyakit pada tanaman tersebut dan dapat diisolasi dari jaringan tanaman yang sudah disteilisasi permukaannya atau diekstrak dari jaringan tanaman bagian dalam (Hallmann et al. 1997). Hasegawa et al. (2006) mengemukakan bahwa bakteri endofit yang mengkolonisasi jaringan tanaman memperoleh nutrisi dan perlindungan dari tanaman inangnya. Bakteri ini dapat hidup pada bagian tanaman seperti akar, batang, daun, dan buah (Simartama et al; Bacon & Hinton 2006). Bakteri endofit gram positif dan gram negatif telah diisolasi dari beberapa jenis jaringan dalam berbagai jenis tumbuhan. Populasi bakteri endofit melimpah dan beragam. Bakteri endofit masuk ke dalam jaringan tanaman terutama melalui zona akar, bagian tanaman, seperti bunga, batang, dan kotiledon. Bakteri endofit dapat bersifat obligat ataupu fakultatif dalam mengkolonisasi inangnya. Meskipun bakteri ini memiliki kisaran inang yang luas, namun ada beberapa bakteri endofit yang hanya dapat berasosiasi dengan inang dari famili tertentu. Simbiosis antara tanaman dengan bakteri endofit bersifat netral, mutualisme, atau komensalisme (Bacon & Hinton 2006).
Simbiosis mutualisme antara endofit dan tanaman, dalam hal ini bakteri endofit mendapatkan nutrisi dari hasil metabolisme dari tanaman dalam melawan patogen, sedangkan tanaman mendapat derivat nutrisi dan senyawa aktif yang
diperlukan selama hidupnya (Tanaka et al 1999 dalam Simarmata et al. 2007). Karena tumbuh dalam jaringan tanaman, dimana tanaman yang satu tentunya berbeda dengan tanaman lainnya, maka tempat hidup bakteri sangat unik sifatnya. Bahkan, fisiologi tumbuhan tinggi termasuk yang berasal dari spesies yang sama akan beda di lingkungan yang berbeda. Karena itu keanekaragaman bakteri endofit sangatlah tinggi. Berdasarkan pertimbangan tersebut endofit dapat menjadi sumber berbagai metabolit sekunder baru yang berpotensi untuk dikembangkan dalam bidang medis, pertanian, dan industri.
Bakteri endofit yang hidup di dalam jaringan tanaman yang tidak merugikan bagi tanaman tersebut dapat digunakan sebagai kandidat yang baik untuk pengendalian secara biologi bagi beberapa hama dan penyakit. Bakteri endofit dapat berperan sebagai agensia pengendali hayati jika bakteri telah berasosiasi dengan tanaman sebelum patogen menyerang tanaman tersebut (Bacon & Hinton 2006). Banyak spesies dari bakteri endofit yang bersifat antagonis diantaranya: Bacillus subtilis, Ralstonia solanacearum, Pseudomonas fluorescens, Pseudomonas putida, Agrobacterium radiobacter, Agrobacterium tumifaciens, Erwinia herbicola, dan Serratia marcescens. Cara kerja dari bakteri endofit sebagai agensia pengendali hayati diantaranya: memproduksi bahan campuran antimikroba, kompetisi ruang dan nutrisi; kompetisi mikronutrisi seperti zat besi dan produksi siderofor; serta dapat menyebabkan tanaman inang menjadi resisten (Bacon & Hinton 2006). Disamping itu beberapa bakteri endofit juga menghasilkan senyawa antibiotik seperti phenazines, pyrolnitrin, pycocyanin, dan phloroglucianol dan enzim ekstraselluler serta asam pseudomonat. Keanekaragaman spesies bakteri endofit merefleksikan banyaknya cara kerja yang mungkin terjadi untuk melawan patogen, yang memungkinkan patogen memproduksi senyawa antibiotik untuk melawan bakteri endofit tersebut (Bacon & Hinton 2006).
Enzim ekstraselluler yang dihasilkan bakteri endofit diantaranya adalah kitinase, protease, dan selulase. Enzim kitinase merupakan enzim penting yang dihasilkan oleh bakteri antagonis untuk mengendalikan patogen tular tanah, karena enzim ini dapat mendegradasi dinding sel patogen yang terdiri dari kitin seperti dinding sel cendawan, nematoda, dan serangga. Enzim protease yang
dihasilkan oleh bakteri selain berperan dalam mendegradasi dinding sel patogen, protease dapat digunakan oleh bakteri tersebut untuk melakukan penetrasi secara aktif ke dalam jaringan tanaman. Benhamou et al. (1996) melaporkan enzim selulase dan pektinase yang dihasilkan Pseudomonas fluorescens dapat digunakan oleh bakteri tersebut untuk mengkolonisasi daerah interselluler jaringan korteks akar, sehingga terjadi penghambatan invasi patogen. Supramana et al. (2008) menyatakan bahwa Pseudomonas putida dapat menekan perkembangan penyakit tanaman dengan persaingan ruang dan nutrisi (unsur karbon), merangsang pertumbuhan tanaman dan menginduksi ketahanan tanaman. Huili et al (2009) melaporkan bahwa Bacillus sp. strain CHM1 dapat menghambat pertumbuhan miselium Fusarium oxysporum dan Rhizoctonia solani dalam uji in vitro. Satu agen biokontrol mungkin memiliki lebih dari satu mekanisme.
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Penelitian dilaksanakan di Laboratorium Nematologi Departemen Proteksi Tanaman, Institut Pertanian Bogor. Pengambilan contoh akar dan tanah tanaman lada dilakukan di kebun petani Kabupaten Bangka dan Kabupaten Bangka Tengah pada bulan Oktober hingga Desember 2010.
Metode Penelitian Survei Tanaman Lada dan Penyakit Kuning
Survei tanaman lada dan penyakit kuning dilakukan di wilayah Provinsi Bangka Belitung yaitu di Kabupaten Bangka dan Bangka Tengah. Survei dilakukan dengan cara menentukan kebun tanaman lada yang relatif sehat dan sakit. Selanjutnya dihitung kejadian penyakit kuning pada lahan tersebut dengan metode silang. Setiap lahan diambil 50 tanaman. Perhitungan kejadian penyakit dengan menggunakan rumus:
P =
Keterangan: P = Kejadian penyakit kuning n = Jumlah tanaman yang bergejala N = Jumlah tanaman yang diamati
Pengambilan Contoh Akar danTanah Tanaman Lada
Pengambilan contoh akar dan tanah tanaman lada dari setiap kabupaten diambil satu kebun sakit dan satu kebun sehat. Berdasarkan keadaan kebun di Kabupaten Bangka dan Bangka Tengah yang sangat sulit menemukan kebun yang benar-benar sehat maka diperoleh katergori sebagai berikut: kebun dikatakan sakit apabila kebun tersebut mempunyai kejadian penyakit lebih dari 60% (Lampiran 2), sedangkan kebun sehat apabila kebun lada yang terserang menunjukkan kejadian penyakit kurang dari 20% (Lampiran 3). Masing-masing kebun diambil 4 tanaman sehat. Setiap tanaman contoh diambil bagian akar dan tanah dengan menggunakan skop untuk dilakukan ekstraksi nematoda dan isolasi bakteri endofit. Kemudian akar dan tanah dimasukkan ke dalam kantong plastik dan diberi label.
Ekstraksi Nematoda dari Akar dan Tanah
Ekstraksi nematoda dilakukan untuk mengetahui populasi nematoda yang berada dalam tanah dan di dalam jaringan akar. Untuk ekstraksi nematoda dalam akar, akar ditimbang sebanyak 5 g berat basah, kemudian akar dipotong ± 2 cm dengan menggunakan gunting. Selanjutnya akar diletakkan ke dalam wadah yang telah dilandasi dengan saringan yang berdiameter 8 cm dan diberi label. Setelah itu akar diletakkan di dalam ruang pengabut selama 3 hari kemudian dilakukan pemanenan. Pemanenan nematoda dilakukan dengan cara suspensi nematoda yang sudah tertampung dalam wadah kemudian disaring dengan menggunakan saringan khusus nematoda yang berukuran 500 mesh. Setelah itu air yang tersisa di dalam saringan dimasukkan ke dalam botol dan diberi label kemudian dihitung dan diamati dengan menggunakan mikroskop.
Ekstraksi nematoda dalam tanah dengan menggunakan metode corong Baermann yang telah dimodifikasi yaitu tanah ditimbang sebanyak 20 g kemudian diletakkan diatas tisu dan saringan, kemudian dibiarkan tergenang pada wadah yang sudah berisi air dan diberi label selanjutnya diinkubasi selama 3 hari kemudian dilakukan pemanenan. Cara pemanenan sama seperti pemanenan nematoda dalam akar.
Isolasi Bakteri Endofit dari Perakaran Tanaman Lada
Bakteri endofit dieksplorasi dari beberapa tanaman lada yang diambil dari pertanaman lada di Kabupaten Bangka dan Bangka Tengah. Contoh akar yang diambil masing-masing dicuci dengan air mengalir sampai bersih, kemudian akar ditimbang sebanyak 1 g berat basah akar. Selanjutnya akar dipotong 2-3 cm dengan menggunakan gunting. Contoh akar yang sudah dipotong kemudian disterilisasi permukaan dengan direndam pada alkohol 70% selama satu menit, setelah itu direndam pada larutan NaOCl 2% selama dua menit, dibilas dengan air steril sebanyak tiga kali. Sebagai pembanding atau kontrol dilakukan dengan akar yang sudah disterilisasi permukaan (sebelum dihancurkan) ditumbuhkan pada TSA (Tryptic Soy Agar) 20%. Jika pada kontrol tumbuh bakteri maka terjadi kontaminasi atau isolasi yang dilakukan tidak berhasil. Contoh akar yang sudah
disterilkan kemudian dihancurkan dengan menggunakan mortar steril sampai halus. Selanjutnya dilakukan pengenceran sebanyak 4 kali pengenceran. Pengenceran dilakukan secara berseri. Setelah itu suspensi diambil sebanyak 1 ml dengan menggunakan pipet mikro kemudian dimasukkan ke dalam tabung reaksi yang berisikan air steril sebanyak 9 ml hingga mendapatkan pengenceran sebesar 10-4. Pada tingkat pengenceran 10-1, 10-2, 10-3, dan 10-4 ditumbuhkan pada media TSA 20% lalu diinkubasi selama 24 jam pada suhu ruang. Koloni bakteri yang tumbuh pada media TSA 20% dihitung dan dimurnikan pada media TSA 100%. Jumlah koloni yang tumbuh selanjutnya dikonversikan ke dalam satuan cfu/ml dengan rumus:
Populasi bakteri =
Keterangan: r = Jumlah koloni yang tumbuh pada cawan dengan faktor pengenceran ke- (cfu)
p = Faktor pengenceran ke-
v = Volume suspensi yang disebar pada cawan (ml)
Bakteri yang sudah murni kemudian dilakukan karakterisasi berdasarkan permukaan, tepian, bentuk, dan warna. Selanjutnya bakteri dimasukkan ke dalam eppendorf yang telah berisi media TSB (Tryptic Soy Broth) dan Gliserol 20% kemudian disimpan pada suhu -20˚C.
Pengujian Isolat Bakteri Endofit terhadap Pertumbuhan Tanaman Tomat Pengujian dilakukan pada benih tomat (sebagai tanaman model). Benih tomat direndam dalam suspensi isolat bakteri selama 24 jam. Sebelum dilakukan perendaman dalam bakteri, benih tomat direndam dalam air steril, benih tomat yang terapung dibuang dan benih yang tenggelam direndam pada suspensi bakteri endofit. Sebagai kontrol, benih direndam dalam air steril selama 24 jam. Selanjutnya benih tomat ditanam pada tiga media yang berbeda yaitu media sekam, cawan petri (kertas saring) dan dengan menggunakan metode blotter test.
Media sekam. Media sekam yang steril dimasukkan ke dalam tray atau tempat persemaian. Selanjutnya benih yang sudah direndam pada suspensi bakteri endofit ditanam pada media tersebut. Perlakuan yang digunakan sebanyak 16
perlakuan yaitu 15 perlakuan dengan isolat bakteri dan 1 perlakuan dengan menggunakan air steril (kontrol). Masing-masing perlakuan diulang sebanyak 3 kali, setiap ulangan ditanam 10 benih. Pengamatan dilakukan 7 hari setelah perlakuan (7 HSP) terhadap perkecambahan.
Cawan petri (kertas saring). Kertas saring dipotong menggunakan gunting sesuai dengan bentuk cawan petri. Kemudian kertas saring disterilkan dengan menggunakan autoklav pada suhu 121 °C selama 15 menit. Selanjutnya kertas saring yang sudah steril dimasukkkan ke dalam cawan petri steril lalu disemprot dengan air steril hingga lembab. Perlakuan yang digunakan sebanyak 16 perlakuan yaitu 15 perlakuan dengan isolat bakteri dan 1 perlakuan dengan menggunakan air steril (kontrol). Masing-masing perlakuan diulang sebanyak 3 kali, setiap ulangan ditanam 10 benih. Pengamatan dilakukan pada 3 HSP dan 6 HSP terhadap perkecambahan.
Blotter test. Kertas saring diletakkan di atas plastik. Kemudian kertas
saring dibasahi dengan air steril kemudian benih tomat yang telah diberi perlakuan ditanam pada media tersebut. Perlakuan yang digunakan sebanyak 16 perlakuan yaitu 15 perlakuan dengan isolat bakteri dan 1 perlakuan dengan menggunakan air steril (kontrol). Masing-masing perlakuan diulang sebanyak 3 kali, setiap ulangan ditanam 5 benih. Setelah benih ditanam pada kertas saring basah yang dibawahnya sudah diberi plastik kemudian digulung. Pengamatan dilakukan 7 HSP terhadap perkecambahan dan panjang akar.
Uji Kultur Filtrat Isolat Bakteri Endofit terhadap Meloidogyne spp.
Isolat bakteri endofit yang menunjukkan pengaruh terhadap pertumbuhan benih selanjutnya akan diuji terhadap larva Meloidogyne spp. Larva Meloidogyne spp. diperoleh dari hasil ekstraksi nematoda. Bakteri endofit yang sudah terpilih dari pengujian isolat bakteri endofit terhadap pertumbuhan tanaman tomat ditumbuhkan pada media TSA selama 48 jam pada suhu ruang. Koloni tunggal dari bakteri dipindahkan ke dalam 70 ml media TSB lalu diinkubasikan pada inkubator bergoyang dengan suhu 25 ˚C selama 48 jam dengan kecepatan 150 rpm. Kemudian kultur bakteri disentrifugasi dengan kecepatan 13.000 rpm selama 5 menit dengan suhu -4 ˚C. Untuk pengujian pengaruh filtrat bakteri terhadap
nematoda, 5 ml kultur filtrat bakteri dimasukkan ke dalam gelas hitung atau cawan sirakus, kemudian ditambahkan 50 ekor Meloidogyne spp. dan disimpan pada suhu ruang. Pengamatan dilakukan terhadap mortalitas nematoda setelah 12 jam dan 24 jam dengan menggunakan mikroskop.
Analisis Data
Data yang diperoleh dari kejadian penyakit selanjutnya diolah dengan uji proporsi. Percobaan isolat bakteri endofit terhadap pertumbuhan tanaman tomat dan kultur filtrat isolat bakteri endofit bersifat antagonis terhadap Meloidogyne spp. disusun dengan rancangan acak lengkap (RAL) dan data yang diperoleh diolah melalui sidik ragam yang dilanjutkan dengan uji Duncan pada taraf 5% dengan menggunakan program SAS 9.1.3.
HASIL DAN PEMBAHASAN
Persentase Kejadian Penyakit Kuning
Varietas lada yang banyak ditanam oleh petani daerah Bangka dan yang digunakan untuk pengambilan contoh dalam penelitian ini adalah varietas Lampung Daun Lebar (LDL). Varietas ini sering digunakan karena lebih banyak menghasilkan buah dibandingkan dengan varietas lain. Varietas LDL merupakan vairetas yang tahan terhadap penyakit kuning (Sapian 2003). Hampir semua kebun di Kabupaten Bangka dan Bangka Tengah yang diamati terinfeksi nematoda sehingga dengan adanya serangan lebih lanjut akan menimbulkan gejala penyakit kuning. Gejala dari penyakit kuning yang menyerang tanaman lada adalah daun menjadi kuning, kaku tergantung tegak lurus dan makin lama akan makin mengarah ke batang. Daun-daun yang menguning tidak layu, tetapi sangat rapuh sehingga secara bertahap daun-daun tersebut gugur dan pertumbuhan tanaman menjadi terhambat (Lampiran 1).
Kejadian penyakit di Kabupaten Bangka pada kebun sakit sebesar 82% sedangkan pada kebun sehat 16%. Di Kabupaten Bangka Tengah pada kebun yang sakit, kejadian penyakit yang terjadi sebesar 76% sedangkan pada kebun yang sehat 10% (Tabel 1). Berdasarkan uji proporsi, kejadian penyakit di Kabupaten Bangka lebih tinggi dibandingkan di Kabupaten Bangka Tengah (Lampiran 4).
Tabel 1 Kejadian penyakit kuning pada tanaman lada di Kabupaten Bangka dan Bangka Tengah
Lokasi Kejadian Penyakit (%)
Kabupaten Bangka
Kebun sakit 82
Kebun sehat 16
Kabupaten Bangka Tengah
Kebun sakit 76
Menurut Siahaan (2010) menyatakan bahwa habitat utama dari nematoda adalah pada tanah berpasir campur dengan lepung atau tanah ringan. Kondisi wilayah di Kabupaten Bangka dan Bangka Tengah mempunyai pH tanah rata-rata dibawah 5, di dalamnya mengandung mineral biji timah dan pasir. Oleh sebab itu nematoda dapat berkembang dengan baik di kedua kabupaten tersebut. Selain itu kesuburan tanah yang rendah juga dapat mempengaruhi perkembangan penyakit kuning. Kondisi wilayah dengan pH tanah rata-rata dibawah 5 dapat memperlemah keadaan tanaman lada sehingga dengan keadaan tersebut sangat mendukung perkembangan penyakit kuning. Berdasarkan kondisi wilayah di kedua kabupaten dapat dikatakan bahwa kebun di kedua kabupaten sudah terinfeksi oleh nematoda sehingga kejadian penyakit dapat dijumpai pada kebun sakit maupun kebun sehat.
Populasi Nematoda Meloidogyne spp.
Ekstraksi nematoda dilakukan untuk mengetahui populasi nematoda pada kebun lada, baik pada kebun sehat maupun kebun sakit. Populasi nematoda diperoleh dari perhitungan hasil ekstraksi nematoda Meloidogyne spp. yang berasal dari tanah dan jaringan akar.
Gambar 1 Rata-rata populasi nematoda Meloidogyne spp. pada tanaman lada dari Kabupaten Bangka 0 10 20 30 40 50 60 70 80 90 100
kebun sehat kebun sakit
P o pul a si l a rv a Me loi dogy ne s pp. (e ko r) akar tanah
Gambar 2 Rata-rata populasi nematoda Meloidogyne spp. pada tanaman lada dari Kabupaten Bangka Tengah
Populasi Meloidogyne spp. dari bagian akar pada kebun sakit di Kabupaten Bangka adalah 104 ekor per 5 gram berat basah akar dan bagian tanah sebanyak 40 ekor per 20 gram berat tanah, sedangkan pada kebun sehat dari bagian akar adalah 48 ekor per 5 gram berat basah akar dan pada tanah sebanyak 32 ekor per 20 gram berat tanah. Populasi Meloidogyne spp. di Kabupaten Bangka Tengah pada kebun sakit dari bagian akar didapatkan 100 ekor per 5 gram berat basah akar dan dari bagian tanah sebanyak 72 ekor per 20 gram berat tanah. Populasi Meloidogyne spp. pada kebun sehat dari bagian akar sebanyak 84 ekor per 5 gram berat basah akar dan pada tanah sebanyak 56 ekor per 20 gram berat tanah. Hal ini menunjukkan bahwa populasi Meloidogyne spp. pada kebun yang sakit lebih tinggi dibandingkan dengan kebun yang sehat. Menurut Dropkin (1992), nematoda parasit akan dapat berkembang biak lebih baik di dalam akar tanaman yang pertumbuhannya tidak baik karena pada tanaman yang mempunyai zat makanan yang kurang akan mendorong nematoda berkembang dibandingkan dengan tanaman yang menyediakan makanan yang optimal.
Siahaan (2010) melaporkan bahwa faktor-faktor yang mempengaruhi perkembangan nematoda parasit pada tanaman kopi antara lain temperatur tanah, keberadaan filum air baik di dalam tanah atau dalam tanaman. Filum air berperan bagi mobilitas nematoda, menentukan inaktif dan tidaknya nematoda, bahkan berpengaruh terhadap mortalitasnya. Porositas, kelembaban, dan aerasi tanah juga berperan dalam keberlangsungan hidup nematoda. Selain itu umumnya nematoda
0 10 20 30 40 50 60 70 80 90 100
kebun sehat kebun sakit
P o pul a si l a rv a Me loi dogy ne spp. (e ko r) akar tanah
ini terdapat pada semua jenis tanah, namun yang merupakan habitat utamanya adalah pada tanah berpasir campur dengan lepung atau tanah ringan. Hal ini disebabkan jenis tanah berpasir atau regosol memiliki pori atau rongga tanah yang besar sehingga nematoda dapat bergerak dengan bebas, selain itu juga kandungan udara dan air dalam tanah tersebut cukup bagi nematoda sehingga nematoda tersebut dapat hidup dan berkembang biak dengan baik. Selain pada tanah nematoda juga terdapat di dalam air tawar, air laut, dan di dalam tanaman.
Penelitian Djiwanti (2009) menyatakan bahwa tingkat kerusakan yang disebabkan oleh nematoda pada tanaman nilam sangat bervariasi, tergantung dari jenis nematodanya, tetapi pada dasarnya menyebabkan kerugian secara ekonomis. Serangan nematoda menyebabkan kerusakan akar sebanyak 72,24%-84,42%. Kerusakan tanaman meliputi terhambatnya pertumbuhan tanaman meliputi pertumbuhan pucuk dan ukuran daun, dan kehilangan hasil sampai 49,06%-60,67%. Pada tanaman lada serangan nematoda dapat merusak sekitar 32% (Sitepu dan Mustika 2000).
Kelimpahan Populasi Bakteri Endofit
Kerapatan populasi bakteri endofit di wilayah Kabupaten Bangka dan Bangka Tengah pada kebun sakit lebih sedikit dibandingkan kebun sehat (Gambar 3 & 4). Rata-rata populasi bakteri endofit di Kabupaten Bangka pada kebun sehat lebih tinggi dibandingkan kebun sakit yaitu sebesar 2,7x104 cfu/g berat basah akar (Gambar 3).
Gambar 3 Rata-rata kerapatan bakteri endofit pada akar pertanaman lada di Kabupaten Bangka 2,1 2,2 2,3 2,4 2,5 2,6 2,7
kebun sehat kebun sakit
kebun sehat kebun sakit K e ra p a ta n ba k te ri e ndof it (10 4 c fu /g be ra t b a sa h a ka r)
Populasi bakteri endofit di Kabupaten Bangka Tengah, pada kebun sehat lebih tinggi dibandingkan dengan kebun sakit. Pada kebun sehat, rata-rata populasi bakteri endofit sebesar 4,5x104 cfu/g berat basah akar, sedangkan pada kebun sakit, rata-rata populasi bakteri endofit sebesar 4,0x104 cfu/g berat basah akar (Gambar 4).
Gambar 4 Rata-rata kerapatan bakteri endofit pada akar pertanaman lada di Kabupaten Bangka Tengah
Perbedaan populasi bakteri endofit terjadi karena aktivitas agensia hayati di dalam tanah dan akar dipengaruhi oleh faktor biotik dan abiotik. Menurut Harni (2010) beragamnya populasi dapat dipengaruhi oleh faktor lingkungan (curah hujan, suhu) dan teknik budidaya. Cara budidaya tanaman lada, seperti pemupukan yang berlebih dan penggunaan pestisida yang tidak tepat sasaran, waktu, dosis/konsentrasi, jenis pestisida, dan cara aplikasi dapat menjadi salah satu faktor yang menyebabkan terjadinya perbedaan keragaman dan kerapatan populasi mikroba di dalam akar dan tanah. Oleh sebab itu, pada tanaman yang sakit sering diberi pestisida yang terkadang berlebih sehingga dapat menyebabkan sebagian mikroba mati baik mikroba penyebab penyakit ataupun mikroba yang bersifat antagonis terhadap patogen.
Intensitas curah hujan dan suhu antara kedua kabupaten tersebut agak berbeda, sehingga diduga mempengaruhi kerapatan populasi bakteri endofit. Beberapa penelitian juga melaporkan bahwa kerapatan suatu bakteri endofit dipengaruhi oleh jenis tanaman, tipe jaringan (akar, batang, daun), umur tanaman, habitat, dan amandemen tanah (Garbeva et al. 2004; Hallmann dan Berg 2006).
3,7 3,8 3,9 4,0 4,1 4,2 4,3 4,4 4,5
kebun sehat kebun sakit
kebun sehat kebun sakit K e ra p a ta n ba k te ri e ndof it (10 4 c fu /g be ra t b a sa h a ka r)
Tabel 2 Karakterisasi morfologi isolat bakteri endofit dari perakaran tanaman lada yang berasal dari Kabupaten Bangka dan Bangka Tengah
No Kode isolata
Permukaan Tepian Bentuk Warna
1 EB1 Datar Berombak Bundar Putih
2 EB2 Cembung Licin Bundar Kuning
3 EB3 Cembung Licin Bundar Kuning
4 EB4 Cembung Licin Bundar Kuning
5 EB5 Cembung Licin Bundar Kuning
6 EB6 Seperti tombol Licin Bundar Putih
7 EB7 Cembung Licin Bundar Putih
8 EB8 Timbul Licin Bundar Kuning
9 EB9 Cembung Licin Bundar Kuning
10 EB10 Cembung Licin Bundar Kuning
11 EB11 Cembung Licin Bundar Kuning
12 EB12 Cembung Licin Bundar Kuning
13 EB13 Cembung Licin Bundar Kuning
14 EB14 Berbukit-bukit Tidak beraturan Bundar Putih
15 EB15 Cembung Licin Bundar Putih
Ket: aEB = E: bakteri endofit
B: contoh tanaman lada dari Bangka
Hasil isolasi bakteri endofit pada perakaran lada di Kabupaten Bangka dan Kabupaten Bangka Tengah diperoleh 15 isolat murni. Karakterisasi isolat murni bakteri endofit yang diperoleh mempunyai ciri morfologi yang hampir sama (Tabel 2).
Hasil karakterisasi koloni bakteri menunjukkan bahwa sebagian besar isolat bakteri mempunyai permukaan yang cembung kecuali isolat EB1 mempunyai permukaan yang datar, EB6 mempunyai permukaan seperti tombol, EB8 mempunyai permukaan timbul, dan EB14 mempunyai permukaan berbukit-bukit. Isolat bakteri endofit hamper semua mempunyai tepian yang licin kecuali isolat EB1 dan EB14 yang masing-masing mempunyai tepian berombak dan tidak beraturan. Bentuk pada isolat bakteri endofit mempunyai bentuk yang bundar.
Warna dari isolat bakteri endofit sebagian besar berwarna kuning, namun terdapat 5 isolat yang berwarna putih yaitu isolat EB1, EB6, EB7, EB14, dan EB15. Dalam menentukan spesies bakteri tidak hanya dilihat dari ciri morfologi melainkan dengan ciri fisiologis atau biokimia. Jika dari ciri morfologi menunjukkan karakteristik yang sama, namun secara fisiologis belum tentu sama. Oleh sebab itu untuk menentukan spesies bakteri perlu dilakukan pengujian secara fisiologis terhadap isolat bakteri.
Pengujian Isolat Bakteri Endofit terhadap Pertumbuhan Tanaman Tomat
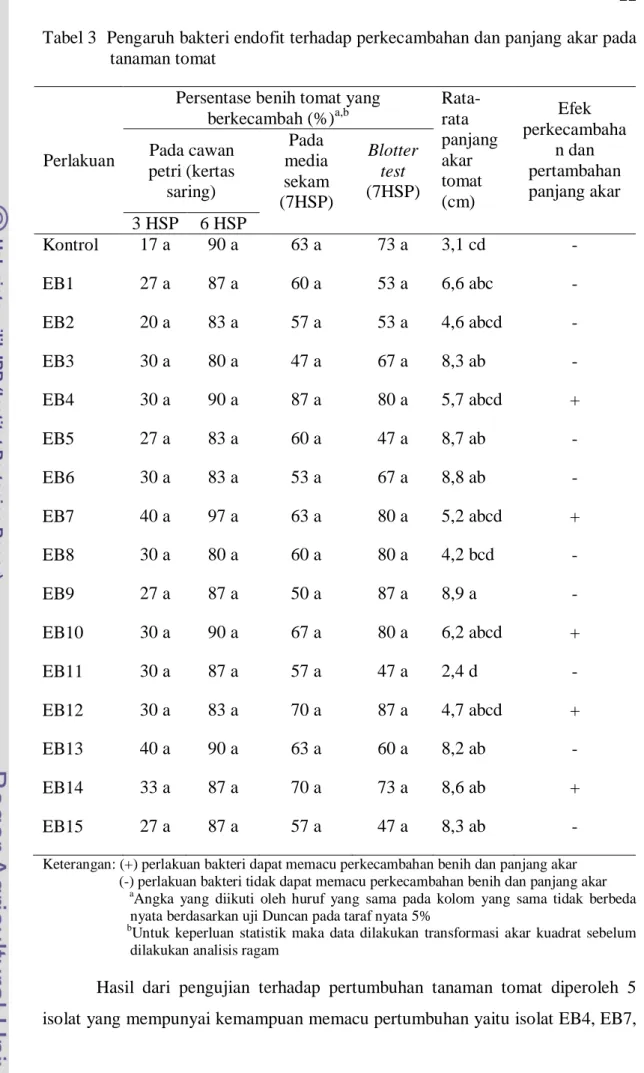
Sebanyak 15 isolat bakteri endofit diuji kemampuannya terhadap pertumbuhan tanaman tomat pada tiga media yang berbeda. Hasil pengujian bakteri endofit terhadap perkecambahan menunjukkan bahwa dari tiga metode yang digunakan tidak berbeda nyata namun jika dilihat dari rata-rata persentase perkecambahan tanaman tomat dan pertumbuhannya bahwa pengujian bakteri endofit pada cawan petri (kertas saring) memberikan pengaruh terhadap peningkatan perkecambahan. Pada pengamatan 3 HSP (hari setelah perlakuan) isolat EB7 dan EB13 yang mampu mempercepat perkecambahan lebih baik dari yang lain yaitu masing-masing sebesar 40% dan pada pengamatan 6 HSP isolat EB7 yang paling tinggi memberikan pengaruh terhadap perkecambahan sebesar 97%. Pada media sekam, isolat bakteri endofit EB4 memberikan pengaruh yang paling tinggi terhadap perkecambahan sebesar 87%. Pengujian dengan menggunakan metode blotter test, isolat EB9 dan EB12 paling tinggi menunjukkan pengaruh terhadap perkecambahan masing-masing sebanyak 87%. Pada pengujian isolat bakteri endofit terhadap rata-rata panjang akar, bahwa hampir semua isolat memberikan pengaruh memacu pertumbuhan akar tanaman tomat kecuali isolat EB11.
Tabel 3 Pengaruh bakteri endofit terhadap perkecambahan dan panjang akar pada tanaman tomat
Perlakuan
Persentase benih tomat yang berkecambah (%)a,b Rata-rata panjang akar tomat (cm) Efek perkecambaha n dan pertambahan panjang akar Pada cawan petri (kertas saring) Pada media sekam (7HSP) Blotter test (7HSP) 3 HSP 6 HSP Kontrol 17 a 90 a 63 a 73 a 3,1 cd - EB1 27 a 87 a 60 a 53 a 6,6 abc - EB2 20 a 83 a 57 a 53 a 4,6 abcd - EB3 30 a 80 a 47 a 67 a 8,3 ab - EB4 30 a 90 a 87 a 80 a 5,7 abcd + EB5 27 a 83 a 60 a 47 a 8,7 ab - EB6 30 a 83 a 53 a 67 a 8,8 ab - EB7 40 a 97 a 63 a 80 a 5,2 abcd + EB8 30 a 80 a 60 a 80 a 4,2 bcd - EB9 27 a 87 a 50 a 87 a 8,9 a - EB10 30 a 90 a 67 a 80 a 6,2 abcd + EB11 30 a 87 a 57 a 47 a 2,4 d - EB12 30 a 83 a 70 a 87 a 4,7 abcd + EB13 40 a 90 a 63 a 60 a 8,2 ab - EB14 33 a 87 a 70 a 73 a 8,6 ab + EB15 27 a 87 a 57 a 47 a 8,3 ab -
Keterangan: (+) perlakuan bakteri dapat memacu perkecambahan benih dan panjang akar (-) perlakuan bakteri tidak dapat memacu perkecambahan benih dan panjang akar
aAngka yang diikuti oleh huruf yang sama pada kolom yang sama tidak berbeda
nyata berdasarkan uji Duncan pada taraf nyata 5%
bUntuk keperluan statistik maka data dilakukan transformasi akar kuadrat sebelum
dilakukan analisis ragam
Hasil dari pengujian terhadap pertumbuhan tanaman tomat diperoleh 5 isolat yang mempunyai kemampuan memacu pertumbuhan yaitu isolat EB4, EB7,
EB10, EB12, dan EB14. Menurut Kloepper et al. (1999) menyatakan bahwa beberapa bakteri endofit disamping sebagai agen biokontrol, juga berfungsi sebagai pemacu pertumbuhan tanaman, dan menginduksi ketahanan tanaman terhadap patogen. Boyer & Sikora (1991) melaporkan bahwa peningkatan pertumbuhan tanaman oleh bakteri antagonis adalah melalui siderofor yang dihasilkan oleh bakteri endofit baik secara langsung maupun tidak langsung. Secara langsung, bakteri ini dapat menyediakan nutrisi bagi tanaman, seperti nitrogen, fosfat, dan mineral lainnya serta menghasilkan hormon pertumbuhan seperti etilen, auksin, dan sitokinin. Mekanisme peningkatan pertumbuhan tanaman oleh bakteri endofit dapat terjadi dengan beberapa proses diantaranya melarutkan senyawa fosfat, fiksasi nitrogen. Secara tidak langsung, bakteri terlebih dahulu menekan pertumbuhan mikroorganisme pengganggu yaitu melalui mekanisme kompetisi, predasi, dan antibiotik yang dihasilkannya (Kloepper et al. 1991). Bacon & Hinton (2006) melaporkan bahwa bakteri endofit dapat menghasilkan hormon pertumbuhan seperti etilen, auxin, dan sitokinin.
Uji Kultur Filtrat Isolat Bakteri Endofit terhadap Meloidogyne spp. Hasil pengujian kultur filtrat terhadap mortalitas nematoda Meloidogyne spp. menunjukkan bahwa bakteri endofit yang diaplikasikan memberikan pengaruh nyata terhadaplarva mortalitas nematoda Meloidogyne spp. (Tabel 4). Tabel 4 Pengaruh kultur filtrat bakteri endofit terhadap mortalitas Meloidogyne
spp. pada 12 jam dan 24 jam setelah perlakuan
No. Isolat bakteri endofit
Mortalitas nematoda (%)a,b
12 jam 24 jam 1. Kontrol 24 c 39 cd 2. EB4 26 c 52 b 3. EB7 30 bc 32 d 4. EB10 45 bc 48 bc 5. EB12 51 b 58 b 6. EB14 73 a 83 a a
Angka yang diikuti oleh huruf yang sama pada kolom yang sama tidak berbeda nyata berdasarkan uji Duncan pada taraf nyata 5%
b
Untuk keperluan statistik maka data dilakukan transformasi arcsin sebelum dilakukan analisis ragam
Pada pengamatan 12 jam dan 24 jam setelah perlakuan, perlakuan kultur filtrat EB14 memberikan pengaruh paling tinggi yaitu 73% dan 83% dibandingkan dengan perlakuan kultur filtrat bakteri endofit lainnya. Mortalitas nematoda berkaitan dengan kemampuan bakteri tersebut menghasilkan enzim ekstraselluler yang bersifat toksik terhadap Meloidogyne spp. Bakteri endofit menghasilkan antibiotik seperti phenazines, pyrolnitrin, pycocyanin, dan phloroglucianol dan enzim ekstraselluler serta asam pseudomonat. Enzim ekstraselluler yang dihasilkan diantaranya adalah kitinase, protease, dan selulase (Bacon & Hinton 2006). Harni (2010) melaporkan bahwa enzim kitinase yang dihasilkan oleh bakteri Achromobacter xylosoxidans TT2 yang bersifat toksik terhadap Pratylenchus brachyurus. Harni et al (2010) melaporkan bahwa kultur filtrat bakteri endofit TT2, EH11, NJ16, NJ57 dan MSK yang berasal dari akar nilam bersifat toksik terhadap P. brachyurus dengan daya bunuh sampai 100%. Pada penelitian Mekete et al (2009) menyatakan bahwa kultur filtrat dari isolat bakteri endofit Pseudomonas, Bacillus, Agrobacterium, Stenotrophomonas dan Enterobacter menunjukkan efek nematisidal antara 38% hingga 98%. Beberapa penelitian secara in vitro menunjukkan bahwa isolat bakteri endofit dapat menghambat perkembangan nematoda dan penetasan telur (Aravind et al 2009).
KESIMPULAN DAN SARAN
Kesimpulan
Kejadian penyakit kuning pada lada di Kabupaten Bangka lebih tinggi dibandingkan dengan di Kabupaten Bangka Tengah. Kelimpahan populasi bakteri endofit pada kebun lada yang sehat lebih tinggi dibandingkan dengan kebun sakit. Sebanyak 5 isolat bakteri endofit tersebut mempunyai kemampuan mempercepat perkecambahan dan memacu pertumbuhan akar tanaman tomat yaitu EB4, EB7, EB10, EB12, dan EB14 . Kultur filtrat dari isolat bakteri endofit EB14 paling tinggi pengaruhnya terhadap mortalitas Meloidogyne spp. lebih dari 70% pada uji in vitro.
Saran
Perlu dilakukan isolasi lebih lanjut berdasarkan varietas dan bagian dari tanaman lada untuk memperoleh bakteri endofit yang potensial sebagai agensia hayati. Selain itu perlu dilakukan pengujian lebih lanjut mengenai tingkat konsentrasi kultur filtrat bakteri endofit untuk mengetahui konsentrasi yang efektif dan pengujian lebih lanjut mengenai keefektifan isolat bakteri endofit yang diperoleh terhadap penyakit kuning secara in vivo.
DAFTAR PUSTAKA
Agrios, GN. 2005. Ilmu Penyakit Tumbuhan. Ed ke-3. Munzir Busnia, penerjemah. Yogyakarta: Gajah Mada University Press. Terjemahan dari: Plant Pathology.
[Anonim]. 2007. Hama dan penyakit utama tanaman lada dan pengendaliannya. Balittri 29: 4.
Aravind R, Antony D, Santosh J, Kumar A, Ramana KV. 2009. Isolation and evaluation of endophytic bacteria against plant parasitic nematodes infesting Black Pepper (Piper nigrum L.). Indian Journal of Nematology. Vol. 39 (2): 211-217.
Bacon CW, Hinton DM. 2006. Bacterial endophytes : the endophytic niche, its occupants, and its utility. Di dalam : Gnanamanickam SS, editor. Plant Associated Bacteria. Netherland : Springer.
Benhamou N, Kloepper JW, Quadt-Hallmann A, Tuzun S. 1996. Induction of Defense-related Ultrastructural Modification in Pea Toot Tissue Inoculated with Endophytic Bacteria.
Boyer MH, Sikora LJ. 1991. Rhizosphere interactions and siderophores. Di dalam: Keister DL, Cregan PB, editors. The rhizosphere and plant growth. Beltsuille symposia in agricultural research; Belsville, 8-11 May 1989. Dordrecht: Klower Academic Publishers. Hlm 263-269.
Cook RJ, Baker KF. 1983. The Nature and Practice of Biological Control of Plant Phatogens. Minnesota: The American Phytophatological Society. Daras U, Pranowo D. 2009. Kondosi Kritis Lada Putih Bangka Belitung dan
Alternatif Pemulihannya. Litbang Pertanian 28(1).
Departemen Pertanian. 2009. Lada, butiran kecil dan besar. http://www.litbang.deptan.go.id/berita/one/723/ [24 Januari 2011].
Djiwanti SR. 2009. Nematoda parasit dan teknologi pengendalian budidaya tanaman nilam (Pogostemon cablin) di Indonesia. Perkembangan teknologi tanaman rempah dan obat. Bogor: Balai penelitian obat dan rempah.
Direktorat Budidaya Tanaman Rempah dan Penyegar. 2010. Pedoman Teknis Pengembangan Lada Organik.Deptan: Direktorat Jenderal Perkebunan. http://www. ditjenbun.deptan.go.id/budtanreyar [20 Desember 2010]. Dinas Pertanian dan Kehutanan Provinsi Bangka-Belitung. 2007. Data dan
Statistik Perkebunan. Dinas Pertanian dan Kehutanan Provinsi Bangka-Belitung, Pangkal Pinang.
Dropkin VH. 1992. Pengantar Nematologi Tumbuhan. Yogyakarta: Gajah Mada University.
Duarte MLR and Chu EY. 2005. Management of root and viral diseases affecting black pepper in Brazil. Focus on Pepper (Piper nigrum L.). J. Pepper Induatry 02(2) : 1-14.
Garbeva P, Van Veen JA, Van Elsas JD. 2004. Microbial diversity in soil: Selection of microbial populations by plant and soil type and implications for disease suppressiveness. Annual Review of Phytopathology 42: 243-270.
Hallmann J, Berg G. 2006. Spectrum and population dynamics of bacterial root endophytes. In: Schulz B, Boyle C & Sieber T. (Eds). Soil biology microbial root endophyte, vol. 9. Berlin, Heidelberg, Springer-Verlag, pp. 15-31.
Hallmann J, Quadt-Hallmann A, Mahaffe WF, Kloepper JW. 1997. Bacterial endophytes in agricultural crop. Can J Microbiol. 43: 895-914.
Hallmann J, Quadt-Hallmann A, Rodriguez-Kabana R, Kloepper JW. 1998. Interactions between Meloidogyne incognita and endophytic bacteria in cotton and cucumber. Soil Biol. Biochem, vol. 30 (7) : 925-937.
Harni R. 2010. Bakteri endofit untuk mengendalikan nematoda peluka akar (Pratylenchus brachyurus (Godfrey) Filipjev & Stekhoven) pada tanaman nilam [Disertasi]. Bogor: Fakultas Pertanian, Institut Pertanian Bogor. Harni R, Supramana, Sinaga MS, Giyanto, Supriadi. 2010. Pengaruh filtrate
bakteri endofit terhadap mortalitas, penetasan telur dan populasi nematoda peluka akar Pratylenchus brachyurus pada akar nilam. Balai Penelitian Tanaman Rempah dan Aneka Industri, Pakuan Sukabumi. Jurnal Littri Vol. 16(1) : 43-47.
Hasegawa S, Meguro A, Shimizu M, Nishimura T, Kunoh H. 2006. Endophytic actinomycetes and their interaction with host plant. Actinomycetologica. 20: 72-81.
Huili W, Kai W, Xiuyun Z, Xuedong W, Ailing L, Huazu H. 2009. The inhibitory activity of endophytic Bacillus sp. strain CHM1 against plant pathogenic fungi and its plant growth-promoting effect. China: Crop Protection Vol. 28 (8): 634-639.
Irawati AFC, Wirasti CA, Herwan, Issukindarsyah, dan Panggabean MTL. 2009. Pengembangan teknologi budi daya lada ramah lingkungan di Provinsi Bangka Belitung. Makalah Seminar Inovasi Pertanian Spesifik Lokasi, Balai Besar Pengkajian dan Pengembangan Teknologi Pertanian, Bogor. Jeger MJ. 2001. Biotic interaction and plant-phatogen association. In: Jeger MJ,
Spence NJ. Biotic Interaction In Plant. Phatogen Association. New York (USA): CALB publishing.
Kennedy AC. 2005. Rhizosphere. Di dalam Principles and Applications of Soil Microbiology. Sylvia DM, et al. editor. 2005. 2nd Edition. New Jersey: Pearson Prentice Hall.
Kloepper JW, Zablotowiz RM, Tipping EM, Lifshitz R. 1991. Plant growth promotion mediated by bacterial rhizosphere colonizers. In: Keister DL, Cregan PB (ed). The Rhizosphere and Plant Growth. Netherlands. Kluwer Acad Publ. p 315-326.
Kloepper JW, Zablotowicz RM, Tipping EM, Lifshitz R. 1999. Plant root-bacterial interaction in biological control of soilborne disease and potential extension to systemic and foliar disease. Austral Plant Pathol 28: 21-26. Lynch JM. 1983. Soil Biotechnology: Microbiological Factors in Crop
Productivity. London: Blackwell Scientific Publication.
Mekete T, Hallmann J, Kiewnick S, Sikora R. 2009. Endophytic bacteria from Ethiopian coffee plants and their potential to antagonize Meloidogyne incognita. Indian Journal of Nematology. Vol. 11 (1): 117-127.
Munif A. 2001. Studies on the importance of endophytic bacteria for te biological control of the root-knot nematode Meloidogyne incognita on tomato. Inaugural-Dissertation. Institut fur Pflanzenkrankheiten der Rheinischen Friedrich-Wilhelms. Universitat Bonn.
Mustika I. 1990. Studiea on the interaction of Meloidogyne incognit, Radopholus similis,and Fusarium solani on black pepper (Peper nigrum). Wageningen Agric. University of Nederland. 127 p.
Mustika I. 1996. Penyakit kuning lada dan upaya pengendaliannya. Dalam: Monograf Tanaman Lada, Balai Penel. Tan. Rempah dan Obat. Bogor, 130-141.
Pusat Penelitian dan Pengembangan Tanaman Perkebunan. 2009. Kontroversi penggunaan bungkil jarak (Ricinus communis) pada penyakit busuk pangkal batang dan penyakit kuning tanaman lada. Departemen Pertanian. Vol 15:2.
Sarpian T. 2003. Pedoman Berkebun Lada dan Analisis Usaha Tani. Yogyakarta: Kanisius.
Siahaan IR. 2010. Pengenalan nematoda parasit akar pada tanaman kopi. Medan: Balai Besar Perbenihan dan Proteksi Tanaman Perkebunan. http://ditjenbun.deptan.go.id/bbp2tpmed/index.php?option=com_content& view=article&id=89:pengenalan-nematoda-parasit-akar-pada-tanaman-kopi [1 Maret 2011].
Simarmata R, Lekatompessy S, Sukiman H. 2007. Isolasi mikroba endofitik dari tanaman obat sambung nyawa (Gynura procumbens) dan analisi potensinya sebagai antimikroba. Berk Pene Hayati 13 : 85-90.
Sitepu D dan Mustika I. 2000. Disease of black pepper and their management in Indonesia. Dalam P.N. Ravindran (Ed): Black Pepper. Piper nigrum. Medicinal And Aromatic Plants – Industrial Profiles. Harwood Academic Publishers. P. 297-308.
Supramana, Supriadi, Harni R. 2008. Seleksi dan Karakterisasi Bakteri Endofit untuk Mengendalikan Nematoda Peluka Akar (Pratylenchus brachyurus) pada Tanaman Nilam. Laporan Hasil Penelitian Lembaga Penelitian dan Pengabdian Masyarakat. Institut Pertanian Bogor.
Sutarno, A Agus. 2000. Budidaya Lada: Si Raja Rempah-Rempah. Jakarta: Agromedia Pustaka.
Tate RL. 2000. Soil Microbiology. 2nd Edition. Kanada. John Wiley & sons, Inc. Waard PWF de. 1979. Yellow disease complex in black pepper on the Island of
Bangka, Indonesia. J. Plant. Crops 7 : 42-49
Wahid P. 1996. Identifikasi Tanaman Lada. Monograf Tanaman Lada. Balittro: p. 27-32.
Wiryadiputra S, Mustika I, s’Jacob JJ. 1993. Sejarah hidup nematoda Meloidogyne incognita pada lada. Kongr. Nas. XII PFI, Yogyakarta, September. 955-959.
Zaubin R. 1979. Pengarh keasaman tanah terhadap pertumbuhan tanaman lada. Pembr Littri 33: p. 23-27.
Lampiran 1 Gejala penyakit kuning pada tanaman lada
Lampiran 2 Pertanaman lada yang terserang penyakit kuning (kebun sehat)
Lampiran 4 Perhitungan uji proporsi pada kejadian penyakit di Kabupaten Bangka dan Bangka Tengah
Misalkan p1 dan p2 adalah proporsi kejadian penyakit di Kabupaten Bangka dan Kabupaten Bangka Tengah.
H0 : p1 = p2 H1 : p1 > p2 Taraf nyata (α) = 0,025 Wilayah kritik: z > 1,96 Perhitungan: p1 = = = 0,82 p2 = = = 0,76 p = = = 0,0158
Oleh karena itu,
Z =
Z =
Z = 2,41
Kesimpulan: Tolak H0 sehingga dapat dikatakan bahwa proporsi kejadian
penyakit di Kabupaten Bangka lebih tinggi daripada proporsi kejadian penyakit di Kabupaten Bangka Tengah.
Lampiran 5 Sidik ragam pengujian isolat bakteri endofit terhadap perkecambahan benih tomat pada media cawan petri (kertas saring) pada pengamatan 3HSP Sumber keragaman Derajat bebas (Db) Jumlah kuadrat (JK) Kuadrat tengah (KT) F-hitung Perlakuan 15 2,06326576 0,13755105 0,5366 Galat 32 4,69918300 0,14684947 Total 47 6,76244876
Lampiran 6 Sidik ragam pengujian isolat bakteri endofit terhadap perkecambahan benih tomat pada media cawan petri (kertas saring) pada pengamatan 6HSP Sumber keragaman Derajat bebas (Db) Jumlah kuadrat (JK) Kuadrat tengah (KT) F-hitung Perlakuan 15 0,48109828 0,03207322 0,1354 Galat 32 0,64928059 0,02029002 Total 47 1,13037887
Lampiran 7 Sidik ragam pengujian isolat bakteri endofit terhadap perkecambahan benih tomat pada media sekam pada pengamatan 7HSP
Sumber keragaman Derajat bebas (Db) Jumlah kuadrat (JK) Kuadrat tengah (KT) F-hitung Perlakuan 15 1,75967810 0,11731187 0,7099 Galat 32 4,94938956 0,15466842 Total 47 6,70906766
Lampiran 8 Sidik ragam pengujian isolat bakteri endofit terhadap perkecambahan benih tomat pada media blotter test pada pengamatan 7HSP
Sumber keragaman Derajat bebas (Db) Jumlah kuadrat (JK) Kuadrat tengah (KT) F-hitung Perlakuan 15 2,02812251 0,13520817 0,1659 Galat 32 2,89548458 0,09048389 Total 47 4,92360709
Lampiran 9 Sidik ragam pengujian isolat bakteri endofit terhadap pertumbuhan panjang akar tomat
Sumber keragaman Derajat bebas (Db) Jumlah kuadrat (JK) Kuadrat tengah (KT) F-hitung Perlakuan 15 10,36612251 0,69107483 0,0067 Galat 32 7,82482927 0,24452591 Total 47 18,19095178
Lampiran 10 Sidik ragam pengujian kultur filtrat isolat bakteri endofit terhadap mortalitas larva Meloidogyne spp. pada pengamatan 12 jam
Sumber keragaman Derajat bebas (Db) Jumlah kuadrat (JK) Kuadrat tengah (KT) F-hitung Perlakuan 5 2046,607509 409,321502 0,0021 Galat 12 655,515380 54,626282 Total 17 2702,122890
Lampiran 11 Sidik ragam pengujian kultur filtrat isolat bakteri endofit terhadap mortalitas larva Meloidogyne spp. pada pengamatan 24 jam
Sumber keragaman Derajat bebas (Db) Jumlah kuadrat (JK) Kuadrat tengah (KT) F-hitung Perlakuan 5 1820,705152 364,141030 0,0001 Galat 12 183,632381 15,302698 Total 17 2004,337533