pada jamur dan ganggang Reaktifitas kuinon yang tinggi biasanya lebih jauh memicu terjadinya reaksi kondensasi non enzimatik yang berperan dalam pembentukan melanin yang berwarna coklat (Eskin 1990; Lee 1993; Davidek et
al. 1990; Richardson dan Hyslop 1985). Oleh sebab itu, peningkatan kadar vanilin ekstrak buah vanili segar seiring dengan meningkatnya suhu, seperti terlihat pada Gambar 23 berkontribusi terhadap pembentukan warna coklat akibat reaksi pencoklatan enzimatik terutama oleh enzim polifenol oksidase.
Menurut Eskin (1990), suhu optimum aktifitas enzim polifenol oksidase bervariasi tergantung pada jenis buah atau sayuran. Berdasarkan hasil penelitian Hanum (1997), suhu optimum aktifitas polifenol oksidase pada buah vanili kering selama kuring adalah 450C. Aktifitas polifenol oksidase meningkat setelah killing dan menurun saat conditioning. Diduga panas yang tidak terlalu tinggi saat killing (60-650C selama 2 menit) merangsang aktifitas enzim sehingga lebih aktif atau terjadi penurunan ketegaran jaringan sel sehingga kontak antara enzim dan substrat berjalan lebih sempurna. Aktifitas polifenol oksidase tidak banyak berubah pada tahap pemeraman (suhu kamar, 24 jam) dan mencapai maksimal pada tahap pengeringan (600C selama 3 hari). Secara umum terjadi kecenderungan perubahan yang sama antara aktifitas polifenol oksidase, kadar vanilin dan warna coklat vanili kering selama kuring. Akan tetapi, belum dapat disimpulkan peran enzim ini terhadap pembentukan flavor mengingat selama ini polifenol oksidase hanya dikaitkan dengan pencoklatan dan rasa sepat buah-buahan.
Reaksi penting lainnya dalam pembentukan warna coklat adalah reaksi pencoklatan non enzimatik Maillard. Reaksi ini dapat terjadi dalam ekstrak vanili segar akibat dihasilkannya gula-gula pereduksi terutama glukosa, yang merupakan produk lain dari hidrolisis glukovanilin dan degradasi karbohidrat kompleks pada buah vanili segar. Tahap awal dari reaksi Maillard adalah kondensasi antara α-amino dari asam α-amino atau protein dengan gugus karbonil dari gula pereduksi. Tahap ini disebut reaksi karbonilamino dan produk awal yang terbentuk akan kehilangan air, membentuk basa Schiff diikuti dengan siklisasi menghasilkan glikosilamin yang tersubstitusi N. Senyawa ini sangat labil sehingga mengalami isomerisasi menjadi asam fruktosamino (1-amino-1-deoksi-1-ketosa). Reaksi ini disebut Amadori rearrangement. Selanjutnya, setidaknya ada 3 jalur pembentukan
warna coklat melanoidin dalam reaksi Maillard. Pertama, melalui senyawa
Amadori yang diubah menjadi 1,2-eneaminol dan 2,3-enediol. Kedua, kondensasi
aldol yang merupakan jalur alternatif. Ketiga, degradasi Strecker yang tidak secara langsung membentuk pigmen tapi menyediakan senyawa pereduksi penting untuk pembentukan warna coklat (Eskin 1990).
Pada tahap awal reaksi Maillard, gula pereduksi sangat penting keberadaannya karena menyediakan gugus karbonil untuk berinteraksi dengan amino bebas dan asam amino, peptida atau protein. Laju awal reaksi ini tergantung pada pembentukan cincin gula menjadi okso atau bentuk yang mudah tereduksi. Dilaporkan bahwa pembentukan warna coklat oleh D-fruktosa lebih cepat dibanding glukosa pada tahap awal reaksi pencoklatan, tapi menurun drastis setelahnya. Reyes et al. (1982) diacu dalam Eskin (1990), melaporkan bahwa pada sistem glukosa-glisin dan fruktosa-glisin suhu 600C, pH 3.5 selama 280 jam, pembentukan coklat oleh fruktosa lebih cepat pada 80 jam pertama, tapi pada periode selanjutnya konsumsi glukosa justru lebih tinggi.
Reaksi pencoklatan non enzimatik Maillard dipengaruhi beberapa faktor terutama suhu dan pH. Laju reaksi akan meningkat dengan meningkatnya suhu. Hal ini dapat ditunjukkan dengan menurunnya jumlah nitrogen amino bebas secara linier dalam sistem kasein-glukosa berdasarkan rumus Arrhenius, pada suhu 0-800C. Selain itu pada sistem albumin-glukosa suhu 370C selama 30 hari, ε-amino lisin mengalami penurunan hingga 89% (Eskin 1990). Menurut Davidek et
al. (1990), peningkatan suhu 100C akan menyebabkan laju reaksi meningkat 2-3 kali. Oleh sebab itu, pembentukan glukosa yang meningkat seiring meningkatnya suhu seperti terlihat pada Gambar 24 mempengaruhi pembentukan warna coklat ekstrak vanili segar. Disamping suhu, aspek penting lainnya adalah pH. Intensitas reaksi Maillard akan meningkat, seiring dengan meningkatnya pH antara 3-8 dan mencapai maksimum (warna coklat maksimum) pada pH basa (9-10) (Davidek et
al.1990). Dengan kata lain, reaksi Maillard dapat berlangsung pada kondisi basa maupun asam (Eskin 1990). Hal inilah yang mendukung kemungkinan terjadinya reaksi Maillard sebagai penyebab warna coklat pada ekstrak vanili segar walaupun memiliki pH agak asam (4.8-5.3).
Reaksi lain yang menyebabkan terbentuknya warna coklat pada ekstrak vanili adalah rusak atau hilangnya klorofil buah vanili segar. Reaksi utama adalah penggantian atom Mg2+ dalam klorofil oleh hidrogen di bawah kondisi asam dengan membentuk peofitin. Selanjutnya piropeofitin a dan b sebagai hasil degradasi peofitin a dan b dapat menimbulkan warna coklat (Eskin 1990). Kim et
al. (2003), meneliti perubahan kandungan klorofil pada adonan tepung yang mengandung bubuk bayam (Spinacea oleracea) yang digoreng dalam minyak kedelai pada suhu 1600C selama 1 menit dan disimpan dalam botol gelas. Setelah diinkubasikan pada suhu 600C dalam kondisi gelap selama 12 hari, ternyata terjadi penurunan klorofil, sedangkan kandungan peofitin meningkat lalu menurun.
Disamping peofitinisasi, enzim endogenous klorofilase mampu mengubah klorofil menjadi klorofilida dengan hilangnya gugus fitol. Kombinasi kerja klorofilase dan asam menyebabkan hilangnya Mg2+ dan gugus fitol, sehingga membentuk peoforbida. Perlu dicatat bahwa seluruh reaksi perubahan klorofil ini dapat berlangsung dengan adanya panas (Eskin 1990; Francis 1996).
EKSTRAKSI ENZIMATIK BUAH VANILI SEGAR
Penambahan 1 Jenis Enzim Komersial dengan Pelarut Air dan atau Etanol
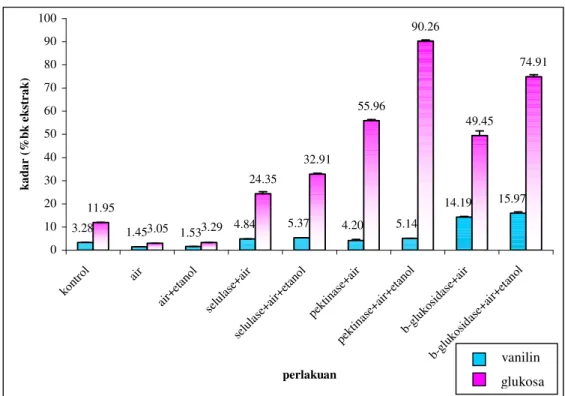
Ekstraksi enzimatik buah vanili segar yang dilakukan dalam penelitian ini menggunakan berbagai enzim komersial yang mampu mendegradasi dinding sel buah vanili segar sekaligus mengubah glukovanilin menjadi vanilin. Data hasil analisis kadar vanilin dan glukosa atas dasar berat kering ekstrak buah vanili segar dapat dilihat pada Gambar 25.
Pada Gambar 25 terlihat bahwa ekstraksi vanili segar tanpa penambahan enzim dengan pelarut air menghasilkan kadar vanilin paling rendah yakni sebesar 1.45%bk ekstrak. Sebaliknya kadar vanilin ekstrak tertinggi dicapai dengan penambahan β-glukosidase+air+etanol yakni sebesar 15.97%bk ekstrak. Perlakuan dengan enzim lainnya pun menghasilkan kadar vanilin yang lebih tinggi dibanding ekstrak vanili segar tanpa enzim dan kontrol (ekstrak vanili kering dengan pelarut air+etanol). Penambahan selulase+air, selulase+air+etanol, pektinase+air, pektinase+air+etanol dan β-glukosidase+air, berturut-turut menghasilkan kadar vanilin sebesar 4.84, 5.37, 4.20, 5.14 dan 14.19%bk ekstrak.
Hal ini disebabkan enzim berfungsi sebagai katalisator reaksi biokimia yang mampu mengaktifkan senyawa lain secara spesifik. Seperti katalis lainnya, enzim bekerja dengan menurunkan energi aktivasi sehingga reaksi berlangsung lebih cepat. (http://wikipedia.org/wiki/Enzyme 2006). Keberadaan sejumlah kecil enzim dapat mengkatalisis biokonversi sejumlah besar substrat (Tucker 1995).
Gambar 25 Kadar vanilin dan glukosa ekstrak buah vanili kering (kontrol) dan vanili segar dengan penambahan satu jenis enzim komersial dengan pelarut air dan atau etanol
Pada Gambar 25 dapat dilihat bahwa penambahan enzim β-glukosidase dengan ataupun tanpa etanol menghasilkan kadar vanilin yang lebih tinggi dibanding dengan perlakuan enzim lainnya. Hal ini dapat dipahami karena kadar padatan terlarut yang dihasilkan dengan penambahan β-glukosidase adalah lebih rendah dibanding penambahan dengan enzim selulase dan pektinase komersial sehingga kadar vanilin per berat kering ekstrak lebih tinggi (Lampiran 5). Kemungkinan lain penyebab lebih tingginya kadar vanilin yang dihasilkan dengan penambahan β-glukosidase adalah persiapan sampel yang dilakukan yakni pengeringan beku dengan penggilingan yang dapat menyebabkan dinding sel
11.95 24.35 32.91 55.96 90.26 49.45 74.91 3.28 1.45 1.53 4.84 5.37 4.20 5.14 14.19 15.97 3.05 3.29 0 10 20 30 40 50 60 70 80 90 100 kont rol air air+ etan ol selu lase +air selu lase +air+ etan ol pekt inas e+ai r pekt inas e+ai r+et anol b-gl ukos idas e+ai r b-gl ukos idas e+ai r+et anol perlakuan k a d a r (% b k e k st ra k ) vanilin glukosa
jaringan buah sebagian mengalami kerusakan sehingga enzim-enzim pendegradasi dinding sel seperti selulase dan pektinase komersial tidak lagi berperan nyata.
Namun demikian, penambahan enzim selulase dan pektinase komersial dengan atau tanpa etanol yakni penambahan selulase+air, selulase+air+etanol, pektinase+air, pektinase+air+etanol tetap menghasilkan kadar vanilin lebih tinggi dibanding perlakuan tanpa penambahan enzim. Hal ini disebabkan pektinase komersial mengandung aktifitas karbohidrase yang meliputi arabinase, selulase, β-glukanase, hemiselulase dan silanase, yang bersama-sama bekerja sinergis untuk memecah jaringan dinding sel, sehingga kontak antara enzim dengan substrat menjadi lebih mudah. Sedangkan selulase komersial mengandung aktifitas enzim selulase yang mampu mengubah selulosa menjadi glukosa, selobiosa dan polimer glukosa yang lebih tinggi (http://www.novozyme.com. 2005).
Menurut Taylor dan Leach (1995), beberapa enzim ditemukan bebas dalam sitoplasma sel, tapi sebagian lainnya terikat pada membran dan sering kontak langsung dengan substrat. Jika enzim dari luar digunakan untuk mempengaruhi perubahan dalam sel atau jaringan, maka enzim dapat lebih mudah melalui membran dan kontak dengan substrat. Metode ektraksi menggunakan enzim pendegradasi dinding sel ini telah banyak dikembangkan di berbagai industri karena mampu meningkatkan rendemen serta mempercepat reaksi pembentukan produk. Penelitian yang dilakukan Sreenath et al. (1994), menunjukkan bahwa penambahan enzim selulase, pektinase atau kombinasi keduanya pada konsentrasi enzim 0.025% pada suhu 27-300C selama 30 menit ekstraksi menghasilkan nilai perolehan kembali 81-86%. Nilai perolehan kembali ini lebih tinggi dibanding sampel yang tidak mengalami perlakuan enzim yakni sebesar 72%.
Selain itu, Brunerie (1998) (U.S. patent 5705205) menunjukkan bahwa penggunaan enzim pektinase dan hemiselulase 220 unit/g vanili segar bubuk yang mengandung aktivitas enzim β-glukosidase 7.2 unit/g vanili segar bubuk, mampu menghasilkan vanilin sebesar 3.9 g/100 g vanili segar bubuk. Nilai ini tercapai setelah 7 jam inkubasi enzim pada suhu 370C, dengan pH sekitar 5 yang merupakan pH alami buah dengan penambahan etanol 50%v/v setelah masa
inkubasi enzim berlangsung. Analisis vanilin dilakukan dengan menggunakan
High Performance Liquid Chromatography (HPLC).
Penelitian lainnya yang menggunakan enzim hidrolitik dalam pembuatan ekstrak vanili segar dilakukan oleh Ruiz-Teran et al. (2001). Ia melaporkan bahwa vanili segar dapat langsung diekstraksi, dimana reaksi terbaik adalah dengan 47,5% v/v larutan etanol selama 8 jam pada 500C, dalam 2 tahap reaksi enzimatik menggunakan Viscozyme L. Novo diikuti dengan Celluclast yang merupakan 2 produk enzim komersial yang mengandung aktifitas pektinase dan selulase. Analisis vanilin dilakukan dengan metode HPLC. Proses reaksi mempunyai efektifitas tinggi dengan jumlah vanilin ekstrak 3.13 kali lebih tinggi dibanding ekstrak vanili kering metode Soxhlet. Sedangkan proses kuring atau ekstraksi klasik hanya menghasilkan 1.1-1.8%bk buah.
Pada Gambar 25 dapat dilihat pula bahwa penambahan selulase+air+etanol mampu menghasilkan kadar vanilin yang lebih tinggi dibanding penambahan pektinase+air+etanol. Walaupun perbedaannya tidak nyata, kadar vanilin yang dihasilkan oleh perlakuan selulase+air pun lebih tinggi dibanding perlakuan pektinase+air. Lebih tingginya kadar vanilin yang dihasilkan dengan penambahan selulase komersial dibanding pektinase komersial kemungkinan besar disebabkan selulase komersial yang digunakan dalam penelitian ini hanya mengandung aktifitas selulase, dimana selulosa merupakan komponen utama penyusun dinding sel buah yang sangat rigid (http://food_oregonstate_edu 2006; http://www-biol.paisley.ac.uk/Courses/stfunmac/glossary/cellulose.html 2006). Pemutusan jalinan selulosa ini akan mempermudah kontak β-glukosidase dengan substrat sehingga dihasilkan kadar vanilin yang lebih tinggi. Mekanisme kerjanya yakni enzim 1,4- β-D-glukan selobiohidrolase (C1) dari selulase merombak selulosa tidak larut menjadi selulosa yang bersifat larut. Selanjutnya enzim lainnya dari selulase yakni 1,4- β-D-glukan 4-glukanohidrolase (Cx) menghasilkan selobiosa yang kemudian didegradasi menjadi glukosa oleh β-glukosidase (Eskin 1990). Hasil penelitian ini sesuai dengan hasil percobaan yang dilakukan oleh Ruiz-Teran et al. (2001), yang mendapatkan bahwa dengan penambahan enzim
Celluclast+air+etanol pada kondisi yang sama dengan percobaan ini (konsentrasi
yang lebih tinggi yakni sebesar 2.7%bk vanili segar, dibanding penambahan enzim Viscozyme+air+etanol yakni sebesar 2.45%bk vanili segar.
Pada Gambar 25 dapat dilihat bahwa penggunaan etanol mampu menghasilkan kadar vanilin yang lebih tinggi dibanding air. Perlakuan yang paling signifikan perbedaannya adalah perlakuan glukosidase+etanol dan β-glukosidase+air dengan kadar vanilin 14.19%bk ekstrak dan 15.97%bk ekstrak. Perlu dicatat bahwa dalam percobaan ini penambahan etanol 47.5%v/v dalam ekstraksi dilakukan selama 30 menit, melanjutkan proses ekstraksi enzimatik dengan pelarut air yang telah berlangsung selama 8 jam. Hal ini bertujuan untuk mempermudah pengamatan pengaruh etanol terhadap kadar vanilin yang dihasilkan (tanpa terjadinya bias akibat pengaruh aktifitas enzim yang ditambahkan) serta menghindari terjadinya perubahan struktur enzim yang menyebabkan enzim tidak aktif. Pelarut organik polar seperti etanol akan membatasi air esensial dari permukaan dan kemudian menyebabkan ketidakstabilan enzim. Efek destabilisasi pelarut organik polar ini terutama karena kompetisi antara enzim dan pelarut untuk mengikat molekul air (Goodenough 1995). Menurut Zaks (1991), pelarut organik mempengaruhi reaksi enzimatik dengan berbagai cara. Pertama, pelarut mempengaruhi distribusi air antara enzim dan medium reaksi. Kedua pelarut organik dapat langsung berinteraksi dengan enzim, berpengaruh negatif terhadap konformasi yang aktif secara katalitik. Terakhir, partisi dari substrat dan atau produk dari reaksi antara sisi aktif enzim dan medium dapat mempengaruhi sejumlah parameter kinetik dan termodinamik dari enzim. Klibanov (1993), menyatakan bahwa enzim benar-benar tidak aktif dengan penggunaan pelarut organik sekitar 50-60%.
Diketahui bahwa konsentrasi air pada enzim adalah pengaruh yang paling signifikan bagi aktifitasnya dalam pelarut organik. Hilangnya air esensial memiliki efek kuat dalam menurunkan aktifitas enzim. Oleh sebab itu, saat kebutuhan air terpenuhi lagi, aktifitas katalitik kembali pulih. Penambahan air pada pelarut organik polar menghasilkan peningkatan air yang moderat pada enzim, sehingga akan lebih banyak lagi air yang perlu ditambahkan dibanding pelarut non polar (Zaks 1991). Kemungkinan penggunaan enzim dalam pelarut organik polar konsentrasi rendah sehingga tidak mengganggu jumlah air esensial
pada permukaan enzim ini, dibuktikan oleh Waliszewski et al. (2002). Ia mendapatkan bahwa ekstraksi buah vanili segar selama 72 jam dengan etanol 5% tidak menurunkan kinetik dari enzim Crystalzyme PML-MX, Econase Ce-S,
Stonenzyme Plus, Macerex, Cellubrix L dan Cellulase. Disisi lain, Zymafilt L-300
dan Novozym 342 yang memiliki aktifitas enzimatik lebih rendah dalam air, dapat meningkat aktifitasnya yakni sebesar 10 dan 12.5% dalam etanol 5% dan aktifitasnya lebih meningkat lagi dalam etanol 10%. Selanjutnya Waliszewski et
al. (2003), menemukan bahwa setelah 26 jam dilakukan pretreatment ekstrak buah vanili dengan Novozym 342, Crystalzyme PML-MX dan Zymafilt L-300 pada konsentrasi etanol 5-12% serta 15 hari ekstraksi dengan etanol 60%, konsentrasi vanilin yang dianalisis dengan HPLC adalah 0.52, 0.59 dan 1.15%bk vanili segar. Sedangkan kadar vanilin blanko hanya 0.18%bk vanili segar. Jika buah vanili diperlakukan dengan cara yang sama, sampai 5.22%bk dapat diperoleh setelah 30 hari ekstraksi dan blanko hanya mencapai 2.56%bk vanili segar.
Reaksi yang dikatalisis enzim pada umumnya berlangsung dalam lingkungan aquous, yakni lingkungan reaksi dimana air berperan sebagai pelarut utama. Air secara mutlak diperlukan untuk aktifitas katalitik enzim. Hal ini disebabkan air berperan secara langsung maupun tidak langsung dalam seluruh interaksi non kovalen (ikatan hidrogen, interaksi hidrofobik, interaksi elektrostatik dan gaya van der Walls) yang mempertahankan konformasi katalitik alami dari enzim (Price dan Stevens 1991; Jakubowski 2006). Selain itu air juga berperan dalam dinamika enzim (Zaks 1991).
Namun demikian, tingginya kadar vanilin ekstrak yang dihasilkan dengan adanya penambahan etanol selama 30 menit setelah reaksi enzimatik berlangsung dibanding tanpa etanol, menunjukkan bahwa meskipun air merupakan medium reaksi konvensional, namun air memiliki beberapa keterbatasan. Keterbatasan air sebagai pelarut antara lain bahwa pada umumnya senyawa penting dalam bahan pangan tidak larut dalam air dan air sering memicu terjadinya reaksi samping yang tidak diinginkan. Selain itu, dalam beberapa reaksi kimia, hanya sedikit jumlah produk yang terbentuk serta karena tingginya titik didih air maka air jauh dari lingkungan yang ideal bagi perolehan kembali produk (Jakubowski 2006).
Kelarutan vanilin yang lebih tinggi dalam etanol dibanding air berhubungan dengan polaritas. Walaupun etanol bersifat hidrolitik, namun memiliki polaritas yang lebih rendah (0.654) dibanding air (1), sehingga ia lebih efektif melarutkan senyawa vanilin yang tidak begitu polar (Reichardt 1988). Dalam hal ini berlaku hukum ‘like dissolves like’, komponen yang kurang polar akan terlarut dalam pelarut yang kurang polar dan sebaliknya (http://en.wikipedia.org/wiki 2006). Disamping itu, meskipun proses ekstraksinya tidak sempurna, pelarut organik mampu melarutkan komponen flavor yang masih terikat dalam jaringan selulosa atau lignin. Selain etanol, pelarut yang dapat digunakan untuk mengekstrak vanili adalah pentana dan eter, seperti yang telah dilakukan Perez-Silva et
al. (2005). Sebanyak 64 komponen volatil teridentifikasi dalam ekstrak pentana/eter (1/1) yang merupakan perlakuan terbaik, melalui analisis GC-MS.
Ekstraksi padat-cair berhubungan dengan pemisahan komponen yang diinginkan (padatan) dari bahan pangan menggunakan cairan (pelarut) yang dapat melarutkan padatan. Selama proses ekstraksi (holding time) terjadi transfer massa padatan dari bahan pangan ke pelarut, yang terjadi 3 tahap yakni padatan terlarut dalam pelarut, larutan bergerak melalui partikel bahan pangan ke permukaan bahan pangan dan larutan menjadi terdispersi dalam pelarut (Fellow 2000).
Pada Gambar 25 dapat dilihat bahwa perlakuan tanpa penambahan enzim menghasilkan kadar glukosa ekstrak paling rendah yakni sebesar 3.05%bk. Sebaliknya kadar glukosa ekstrak tertinggi dicapai dengan penambahan pektinase+air+etanol yakni sebesar 90.26%bk dengan kadar padatan terlarut tertinggi yakni sebesar 120brix (Lampiran 6). Perlakuan enzim lainnya pun menghasilkan kadar glukosa lebih tinggi dibanding perlakuan tanpa enzim serta ekstrak vanili kering dengan pelarut air+etanol (kontrol), dengan kadar glukosa berturut-turut sebesar 3.05, 3.29 dan 11.95%bk ekstrak. Sedangkan perlakuan selulase+air, selulase+air+etanol, pektinase+air, glukosidase+air dan β-glukosidase+air+etanol berturut-turut menghasilkan kadar glukosa sebesar 24.35, 32.91, 55.96, 49.45 dan 74.91%bk.
Hal yang mencolok dari percobaan ini adalah pembentukan vanilin yang tinggi dalam ekstrak vanili segar tidak selalu diimbangi dengan tingginya glukosa yang terbentuk (Gambar 25). Enzim β-glukosidase berperan nyata dalam