180
STRUKTUR DAN SIFAT OPTIK LAPISAN TIPIS TiO
2(TITANIUM
OKSIDA) YANG DIHASILKAN DENGAN MENGGUNAKAN METODE
ELEKTRODEPOSISI
Elsa Agustina
1, Dahyunir Dahlan
1, Syukri
21
Jurusan Fisika FMIPA Universitas Andalas
2
Jurusan Kimia FMIPA Universitas Andalas Kampus Unand, Limau Manis, Padang, 25163
e-mail: [email protected] ABSTRAK
Telah dilakukan elektrodeposisi lapisan tipis TiO2 di atas substrat ITO (Indium Tin Oxide) dengan
menggunakan larutan elektrolit TiCl4 (Titanium (IV) klorida) dan katalis H3BO3 (Boric Acid).
Didapatkan hasil karakterisasi XRD pada lapisan tipis TiO2 yang dideposisi menggunakan 1.5M
TiCl4 tanpa menggunakan katalis H3BO3 berada dalam fase anatese sedangkan lapisan tipis TiO2
yang dideposisi menggunakan 1.5M TiCl4 dengan menggunakan katalis H3BO3 berada dalam fase
rutile. Spektrum UV-Vis menunjukkan lapisan tipis TiO2 dalam fase anatase memiliki energi gap
sebesar 3,25 eV sedangkan dalam fase rutile memiliki energi gap sebesar 3,7 eV. Hasil karaktarisasi SEM menunjukkan bahwa elektrodeposisi lapisan tipis TiO2 menghasilkan morfologi permukaan
yang lebih halus pada sampel tanpa menggunakan katalis dibandingkan dengan elektrodeposisi sampel yang menggunakan katalis.. Berdasarkan hasil yang diperoleh, maka deposisi lapisan tipis TiO2 ini dapat dijadikan acuan untuk pemanfaatan pada aplikasi sel surya DSSC.
Kata kunci : elektrodeposisi, TiO2, anatase, rutile, XRD, UV-Vis, SEM
ABSTRACT
An electrodeposition of a TiO2 thin film has been carried on ITO (Indium Tin Oxide) substrate using
a TiCl4 (Titanium (IV) klorida) electrolyte solution and a H3BO3 (Boric Acid) catalyst. The result of
XRD characterization on TiO2 thin film deposited through 1.5M TiCl4 without the use of H3BO3
catalyst is formed in an anatase phase while one with the H3BO3 catalyst is in a rutile phase. The
UV-Vis spectra shows that the TiO2 thin film in anatase phase has an energy gap of 3.25 eV while
the rutile one shows 3.7 eV. The SEM characterization results show that the TiO2 thin film
electrodeposition without catalyst use generates a smoother surface morfology than one with catalyst. In accordance to that, this TiO2 deposition can serve as reference for use in DSSC solar
cell.
Keywords: electrodeposition, TiO2, anatase, rutile, XRD, UV-Vis, SEM I. PENDAHULUAN
Material Titanium Oksida (TiO2) dewasa ini banyak dipelajari dalam bidang material
sains, bahan ini dikenal sebagai salah satu material semikonduktor. TiO2 memiliki tiga fase
kristal yaitu anatase, rutile dan brukit. TiO2 telah banyak digunakan pada berbagai aplikasi
antara lain sel surya (Hariyadi, 2010; Nadeak dkk, 2012; Septina, 2007; Timuda, 2009), fotokatalis (Rahmawati, 2010; Nugruho, 2011; Palupi, 2006), sensor biologis dan kimia (Kolmakov dkk, 2004 dalam Palupi, 2006), serta produk kesehatan hingga pigmentasi cat (Gratzel, 2003; Kong dkk, 2007 dalam Palupi, 2006). TiO2 sering digunakan karena memiliki
daya oksidatif dan stabilitas yang tinggi terhadap fotokorosi, murah, mudah didapat dan tidak beracun (Smestad, 1998). Pada aplikasi sel surya, TiO2 yang digunakan umumnya berada
dalam fase anatase yang memiliki energi gap 3,2 eV (Timuda, 2009). Seiring perkembangan nanoteknologi, hadir generasi baru dari sel surya yaitu Dye-Sensitized Solar Cell (DSSC). DSSC ditemukan oleh Professor Michael Graztel dari EPEL Swiss pada tahun 1991. DSSC adalah salah satu teknologi sel surya non-konvensional yang tidak memerlukan material dengan kemurnian tinggi sehingga biaya proses produknya relatif murah, namun aplikasinya dalam DSSC, TiO2 harus memiliki permukaan luas agar dye yang terserap lebih banyak sehingga dapat
meningkatkan arus keluaran sel surya. Untuk mendapatkan dimensi permukaan yang luas dapat dilakukan dengan cara membentuk bahan dalam bentuk lapisan tipis (Dahlan, 2009). Aplikasi TiO2 sebagai bahan semikonduktor yang bertipe lapisan tipis dapat dibuat dengan menggunakan
181
beberapa metode, diantaranya seperti dip-coating (Lei Ge, 2006) dan elektrodeposisi (Lokhande dkk, 2005). Setiap metode ini memiliki hasil pelapisan yang berbeda tergantung pada proses penumbuhannya.
Dari penelitian yang dilakukan oleh Lei Ge dkk. (2006) dengan menggunakan metode dip-coating berhasil mendapatkan lapisan tipis TiO2 dalam fase anatase dengan menggunakan
prekursor TiOSO4 (Titanium Sulfat) dan H2O2 (Peroksida) di atas substrat kaca preparat.
Sampel dipanaskan dengan suhu 100°C, 300°C dan 500°C, didapati kristal TiO2 dalam fase
anatase yang terbentuk setelah dilakukan pemanasan dan lapisan terlihat seragam ketika diberikan kenaikan pada suhu pemanasan.
Penelitian lain mengenai lapisan tipis TiO2 juga dilakukan oleh Lokhande dkk. (2005)
yaitu dengan menggunakan metode elektrodeposisi yang berhasil mendapatkan lapisan tipis TiO2 dalam fase anatase dengan menggunakan prekursor TiCl3 dan penambahan NaHCO3 di
atas substrat ITO. Morfologi lapisan yang dihasilkan berpori dan terdeposisi oleh kristal-kristal TiO2 yang tersebar secara merata dengan ukuran antara (50-60) nm.
Berbagai teknik dalam pembuatan lapisan tipis TiO2 terus dikembangkan, khususnya
dalam hal sintesis dengan menggunakan metode elektrodeposisi, hal ini dikarenakan metode elektodeposisi lebih mudah dilakukan, tingkat keseragaman lapisan yang dihasilkan lebih baik, dan rata-rata kemungkinan terdeposisinya tinggi serta adhesi yang bagus (Jiang dkk, 2001). Selain itu, metode ini telah banyak digunakan untuk sintesis nanopartikel dan nanolapisan karena metode ini menarik, disebabkan keadaan pertumbuhan partikel dapat dipantau berdasarkan variasi daya listrik yang digunakan, waktu deposisi, konsentrasi larutan dan aditif atau surfaktan yang ditambahkan pada larutan (Dahlan, 2009). Oleh karena itu, penelitian ini dilakukan untuk membuat lapisan tipis TiO2 menggunakan metode elektrodeposisi dengan
meneliti pengaruh konsentrasi larutan elektrolit TiCl4 dan tegangan saat pendeposisian, dalam
proses elektrodeposisi juga menggunakan H3BO3 sebagai katalis dan ITO sebagai substrat yang
bersifat konduktor dan transparansi secara optik. Karakterisasi sampel lapisan tipis TiO2 yang
telah dideposisi menggunakan XRD, SEM dan spektrofotometer UV-Vis. II. METODE
Lapisan tipis TiO2 ditumbuhkan dengan menggunakan metode elektrodeposisi di atas
substrat ITO dengan menggunakan larutan elektrolit TiCl4 dan katalis H3BO3. Alat yang
digunakan pada penelitian ini adalah catu daya DC, gelas kimia, gelas ukur kimia, pipet tetes, logam penjempit, alumina crucible, hot plate magnetic stirrer C-MAG HS 7, stopwatch, timbangan digital PWG 2502i, 1 set peralatan elektrodeposisi, furnace mode seri no. 112011, kertas amplas merck CC-1500-CW, XRD, SEM dan spektrofotometer UV-Vis.
Untuk sampel A, larutan elektrolit TiCl4 dibuat sebesar 1.5M sebanyak 25 mL
dipersiapkan dengan cara mencampurkan aquabides sebanyak 20.8 mL dengan 4.2 mL di dalam gelas kimia. Kemudian larutan tersebut diaduk dengan menggunakan magnetic stirrer selama 30 menit, tujuan dari pengadukan ini agar semua bahan yang dicampurkan dapat menjadi campuran yang homogen dan tidak mengendap.
Untuk sampel B, larutan elektrolit TiCl4 dibuat sebesar 1.5M sebanyak 25 mL dengan
menggunakan H3BO3 dipersiapkan dengan cara menimbang H3BO3 sebanyak 2,3 gram lalu
dilarutkan dengan menggunakan aquabides sebanyak 20 mL di dalam gelas kimia, lalu larutan tersebut diaduk dengan menggunakan magnetic stirrer selama 30 menit, kemudian setelah larutan tersebut menjadi campuran yang homogen, larutan tersebut dicampurkan dengan TiCl4
sebanyak 4,1 mL, lalu larutan diaduk lagi dengan menggunakan magnetic stirrer selama 1 jam, tujuan dari pengadukan ini agar semua bahan yang dicampurkan dapat menjadi campuran yang homongen dan tidak mengendap.
Setelah larutan selesai dibuat maka peralatan untuk proses elektrodeposisi dipersiapkan. Kaca ITO dipasang pada katoda (kutub negatif) dan plat platina dipasang pada anoda (kutub positif). Kedua elektroda tersebut dipasang dan dimasukkan secara bersamaan ke dalam set peralatan elektrodeposisi yang berbentuk bejana yang berisi larutan elektrolit yang telah dipersiapkan sebelumnya. Proses elektrodeposisi dilakukan selama 1 jam serta tegangan yang digunakan untuk sampel A sebesar 7,5V dan sampel B sebesar 10V. Setelah di deposisi lapisan
182
tipis TiO2 disintering dengan suhu 500°C selama 5 jam kemudian sampel dikarakterisasi dengan
menggunakan XRD, SEM dan spektrofotometer UV-Vis. III. HASIL DAN DISKUSI
3.1 Hasil Karakterisasi XRD
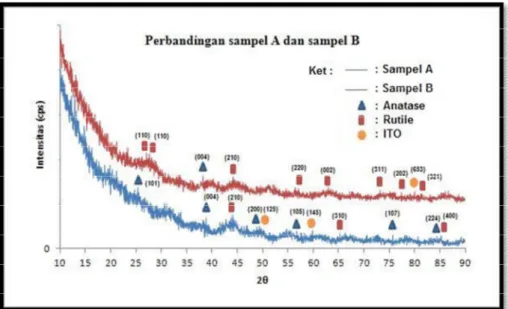
Data intensitas dan posisi puncak difraksi yang dihasilkan oleh difraktometer sinar-X kemudian dibandingkan dengan data standar JCPDS sehingga dapat diketahui fasa senyawa kristalin lapisan tipis TiO2 sampel A dan sampel B.
Gambar 1 Pola difraksi XRD lapisan tipis TiO2 sampel A dan sampel B
Tabel 1 Nilai 2θ dan intensitas puncak tertinggi kurva XRD sampel A Puncak 2θ Intensitas d (Å) Senyawa/hkl
1 25,621 92,96 3,47408 Anatase (101) 2 38,8513 100 2,31611 Anatase (004) 3 44,2911 85,27 2,04345 Rutile (210) 4 48,8639 56,27 1,86237 Anatase (200) 5 49,419 60,21 1,84274 ITO (125) 6 54,7426 49,07 1,67545 Anatase (105) 7 59,9819 56,81 1,54102 ITO (145) 8 65,2458 53,57 1,42884 Rutile (310) 9 75,7179 60,55 1,25513 Anatase (107) 10 84,4303 40,52 1,14642 Anatase (224) 11 85,2732 50,98 1,13723 Rutile (400)
Berdasarkan data karakterisasi XRD sampel A, dapat dilihat bahwa sampel menghasilkan 11 puncak (peak) difraksi sinar-X yaitu puncak-puncak pada sudut 2θ terhadap intensitas dengan nilai masing-masing ditunjukkan pada Tabel 1. Setiap peak memiliki nilai intensitas berbeda terhadap setiap posisi sudut 2θ dengan mencocokkan data pada JCPDS sehingga dapat diidentifikasi kristalnya. Hasil karakterisasi menunjukkan sampel A mengandung 3 fasa senyawa kristalin yaitu TiO2 dalam fasa anatase, TiO2 dalam fasa rutile dan
fasa senyawa kristalin ITO dengan nilai intensitas yang berbeda-beda. Intensitas tertinggi terletak pada posisi 2θ dengan sudut 38,8513°yaitu sebesar 100 yang merupakan peak dari
183
kristal TiO2 dalam fasa anatase dan dapat diketahui bidang kristal atau indeks Miller hkl yaitu
(004). Intensitas terendah terletak pada peak 10 yaitu sebesar 40,52 pada posisi 2θ dengan sudut 84,4303° yang merupakan peak dari kristal TiO2 dalam fasa anatase dengan orientasi hkl
(224). Intensitas yang besar menunjukkan bahwa kristal tersebut memiliki keteraturan kristal yang baik atau semakin banyak atom-atom yang tersusun teratur dan rapi.
Tabel 2 Nilai 2θ dan intensitas puncak tertinggi kurva XRD sampel B
Puncak 2θ Intensitas d (Å) Senyawa/hkl
1 27,107 100 3,28692 Rutile (110) 2 27,6416 94,61 3,22455 Rutile (110) 3 38,2247 54,19 2,35262 Anatase (004) 4 44,1514 53,29 2,04959 Rutile (210) 5 57,1592 28,14 1,61023 Rutile (220) 6 63,0146 30,83 1,47396 Rutile (002) 7 73,1955 24,55 1,29203 Rutile (311) 8 77,4049 20,05 1,23194 Rutile (202) 9 79,9764 21,85 1,19867 ITO (653) 10 83,1043 16,46 1,16131 Rutile (321)
Tabel 2 menunjukkan data XRD sampel B yang memiliki 10 peak difraksi sinar-X tertinggi dengan nilai intensitas yang berbeda-beda. Hasil identifikasi menunjukkan sampel B juga mengandung 3 fasa senyawa kristalin yaitu TiO2 dalam fasa anatase, TiO2 dalam fasa rutile
dan senyawa kristalin ITO dengan nilai intensitas yang berbeda-beda. Intensitas tertinggi terletak pada posisi 2θ pada sudut 27,107°yaitu sebesar 100 yang merupakan peak dari kristal TiO2 dalam fasa rutile dan dapat diketahui bidang kristal atau indeks Miller hkl yaitu (110).
Intensitas terendah terletak pada peak 10 yaitu sebesar 16,46 pada posisi 2θ dengan sudut 83,1043° yang merupakan peak dari kristal TiO2 dalam fasa rutile dengan orientasi hkl (321).
3.2 Hasil Karakterisasi SEM
Gambar 2 Foto SEM morfologi permukaan lapisan tipis TiO2 sampel A dan sampel B
pembesaran 40000 kali.
Gambar 2 hasil karakterisasi SEM terlihat bahwa pada sampel A permukaan lapisan tipis yang terdeposisi oleh partikel-partikel TiO2 relatif tidak menumpuk, penyebaran partikel
yang merata dan ukuran partikel yang dominan seragam. Ukuran-ukuran partikel TiO2 berkisar
antara 42,5 nm sampai 50 nm. Hasil foto SEM memperlihatkan adanya batas retakan pada permukaan hasil deposisi, hal ini diakibatkan oleh gelembung-gelembung larutan yang terjadi dipermukaan substrat pada saat proses elektrodeposisi.
Pada sampel B terlihat bahwa permukaan lapisan tipis memiliki pori yang bagus tetapi terjadi sedikit penumpukan dan terdeposisi oleh agregat atau cluster dari kristal-kristal TiO2
184
yang tersebar secara merata, ukurannya berkisar antara 30 nm sampai 92,5 nm. Hasil foto SEM memperlihatkan bahwa hasil deposisi didominasi oleh agregat dengan ukuran yang lebih kecil yaitu sekitar 30 nm. Terlihat jelas bahwa keberadaan katalis H3BO3 sangat mempengaruhi
bentuk dan ukuran partikel yang terdeposisi.
3.3 Hasil Karakterisasi Spektrofotometer UV-Vis
Absorbansi bahan semikonduktor menyebabkan terjadinya eksitasi elektron dari pita valensi ke pita konduksi. Nilai energi gap dapat ditentukan dari persamaan (1) :
2 / 1 ) (hv Eg C hv (1)
dengan α adalah koefisien absorbsi, C adalah konstanta, hv adalah energi foton dan Eg adalah energi gap. Dimana bila diplotkan pada sumbu kartesian maka C bertindak sebagai gradien, hv sebagai sumbu x, (α(hv))2 sebagai sumbu y dan dari kurva dapat ditentukan nilai energi gap dari masing-masing lapisan TiO2 yang diukur (Abdullah, 2009).
Gambar 3 Kurva (αhv)2 terhadap (hv) lapisan tipis TiO2 sampel A pada λ = (230-800) nm
Dari Gambar 3 dapat terlihat bahwa pada kurva (αhv)2 terhadap (hv) lapisan TiO2
sampel A untuk panjang gelombang (230-800) nm setelah dibuat garis dengan metode touc plot dari nilai (αhv)2 sampai pada perpotongan garis tersebut dengan sumbu x maka dari perpotongan akan diperoleh nilai energi gap sampel A yaitu sebesar 3,25 eV.
Gambar 4 Kurva (αhv)2 terhadap (hv) lapisan tipis TiO2 sampel B pada λ = (230-800) nm
Dari Gambar 4 dapat terlihat bahwa pada kurva (αhv)2 terhadap (hv) lapisan TiO2
sampel B untuk panjang gelombang (230-800) nm setelah dibuat garis dengan metode touc plot dari nilai (αhv)2 sampai pada perpotongan garis tersebut dengan sumbu x maka dari perpotongan akan diperoleh nilai energi gap sampel B yaitu sebesar 3,7 eV.
IV. KESIMPULAN
Hasil karakterisasi XRD menunjukkan lapisan tipis TiO2 dalam fasa anatase dengan
intensitas tertinggi 100 berada pada puncak 38,8513° sedangkan lapisan tipis TiO2 dalam fasa
185
menunjukkan morfologi permukaan lapisan tipis TiO2 fasa anatase memiliki bentuk
partikel-partikel yang hampir seragam, relatif tidak menumpuk, ketebalan partikel-partikel yang merata dan ukuran partikel yang dominan seragam, tetapi pada lapisan ini terbentuk sedikit retakan yang cukup besar di atas substrat. Sementara morfologi untuk lapisan tipis TiO2 dalam fasa rutile
memiliki permukaan lapisan tipis yang agak menumpuk dan berpori serta terdeposisi oleh agregat atau cluster dari kristal-kristal TiO2 yang tersebar secara merata.
Penambahan katalis H3BO3 mempengaruhi bentuk kristal dan morfologi permukaan
lapisan tipis TiO2 yang terbentuk. Hasil karakterisasi UV-Vis menunjukkan lapisan tipis TiO2
dalam fasa anatase memiliki energi gap sebesar 3,25 eV, sedangkan lapisan tipis TiO2 dalam
fasa rutile memiliki energi gap sebesar 3,7 eV. DAFTAR PUSTAKA
Abdullah, M., 2009, Pengantar Nanosains, Bandung, ITB.
Abdullah, M. dan Khairurrijal, 2009, Karakterisasi Nanomaterial, Jurnal Nanosains dan Nanoteknologi, Vol.2, No.1, ISSN 1979-0880.
Dahlan, D., 2009, Elektrodeposisi of Cu2O particles by Using Electrolyte Solution Containing
Glucopone as Surfactant, Jurnal Ilmiah Fisika (JIF) ISSN 1979-4657.
Gratzel, M., 2003, Review : Dye-Sensitized Solar Cells. Journal Of Photochemistry and Photobiology, Photochemistry Reviews, 4 : 145-153.
Hariyadi, H., 2010, Pengaruh Ukuran Partikel TiO2 Terhadap Efisiensi Sel Surya Jenis DSSC
(Dye Sensitized Solar Cell), Skripsi, Jurusan Fisika, FMIPA Univ Diponegoro, Semarang.
Lei Ge., Xu, M., Fang, H., dan Sun, M., 2006, Preparation of TiO2 Thin Film From Autoclaved Sol Containing Needle-like Anatase Crystals, Jurnal 720-725, Technology of Ministry of Education, Tianjin University, China.
Lokhande, C.D., Park, B.O., Park, H.S., Jung, K.D., dan Joo,O.S., 2005, Elektrodeposition of TiO2 and RuO2 Thin Film For Morphology Dependent Applications, Jurnal 267-274, Korea Institute of Science and Technology, University of Sogang, Korea.
Nadeak, S.M.R. dan Susanti, D., 2012, Variasi Temperatur dan Waktu Tahan Kalsinasi Terhadap Unjuk Kerja Semikonduktor TiO2 sebagai Dye Sensitized Solar Cell (DSSC)
Dengan Dye dari Ekstrak Buah Naga Merah, Jurnal Teknik ITS, Vol.1, ISSN 2301-9271.
Nugroho, I.A., 2011, Deposisi Lapisan Tipis Titania dan Pembuatan Sistem Pengolahan Air Limbah Organik Menggunakan Material Fotokatalis Titania (TiO2), Skripsi, Jurusan
Fisika, FMIPA Univ Diponegoro, Semarang.
Palupi, E., 2006, Degradasi Methylene Blue Dengan Metoda Fotokatalisis dan Fotoelektrokatalisis Menggunakan Film TiO2, Skripsi, Jurusan Fisika IPB, Bogor.
Rahmawati, F., Wahyuningsih, S. dan Pamularsih, A.W., 2006, Sintesis Lapisan Tipis TiO2
Pada Substrat Grafit Secara Chemical Bath Deposition, Jurnal Kimia Indonesia, Vol.6, No.2, Hal 121-126.
Rahmawati, Z., 2010, Deposisi Lapisan Tipis Titanium Dioxide (TiO2) Di atas Substrat Gelas
Dengan Metoda Spray-Coating Untuk Aplikasi Penjernihan Air Polder Tawang, Skripsi, Jurusan Fisika, FMIPA Univ Diponegoro, Semarang.
Septina, W., 2007, Pembuatan Prototipe Solar Cell Murah Dengan Bahan Organik-Inorganik (Dye-Sensitized Solar Cell), Laporan Penelitian Bidang Energi, Institut Teknologi Bandung, Bandung.
Smestad, G.P., 1998, Journal Chemistry Education, 75(6) 1.
Tatang, A.T., 2000. Teknologi Pelapisan Logam Secara Listrik, Website : http://www.iptek.net.id.
Timuda, G.E., 2009, Sintesis Nanopartikel TiO2 Dengan Menggunakan Metode Sonokimia
Untuk Aplikasi Sel Surya Tersensitasi Dye (Dye Sensitized Solar Cell-DSSC) Menggunakan Ekstrak Kulit Buah Manggis dan Plum Sebagai Photosensitizer, Tesis, Institut Pertanian Bogor, Bogor.