4 HASIL DAN PEMBAHASAN
4.1 Isolasi dan Purifikasi Bakteri
Isolasi merupakan proses pemindahan organisme dari habitat asli ke dalam suatu habitat baru untuk dapat dikembangbiakkan. Purifikasi merupakan serangkaian proses yang lakukan untuk mendapatkan isolat murni suatu mikroorganisme. Tahap isolasi dan purifikasi bakteri bertujuan untuk memperoleh galur murni dari bakteri target yang telah berhasil diisolasi, sehingga dapat pula dijadikan stock. Bakteri yang diisolasi dipilih berdasarkan ciri morfologi yang berbeda dari tiap cawan. Ciri morfologi tersebut meliputi warna koloni, bentuk, tepian dan permukaan. Ciri morfologi bakteri yang diisolasi dapat dilihat pada Tabel 2.
Tabel 2 Ciri morfologi bakteri terpilih yang diisolasi dari tiap cawan. Sampel Warna koloni Permukaan Tepian Bentuk Elevasi
TL 6A Putih Cembung Licin Bulat
(Cembung) TL 6B Kekuningan Cembung Licin Bulat
(Cembung) TL 8A Krem Cembung Berlekuk Bulat
(Cembung) TL 8B Oranye Cembung Berlekuk Bulat
berhimpit
(Cembung) TL 8C Putih Cembung Berlekuk Bulat
berhimpit (Cembung)
TR 7A Krem Cembung Licin Bulat
(Cembung)
TR 8A Krem
kemerahan
Cembung Licin Bulat
(Cembung)
TR 8B Putih Cembung Licin Bulat
(Cembung)
Berdasarkan Tabel 2 terlihat bahwa ciri morfologi koloni bakteri yang dipilih pada umumnya berbentuk bulat dengan permukaan cembung. Warna
koloni bakteri yang tumbuh didominasi putih kekuningan dengan tepian licin. Perbedaan morfologi dari koloni bakteri yang dipilih diharapkan dapat mewakili spesies bakteri yang berbeda, karena tiap-tiap spesies bakteri memiliki ciri morfologi yang berbeda yang meliputi parameter warna, permukaan, tepian, bentuk, dan elevasi koloni.
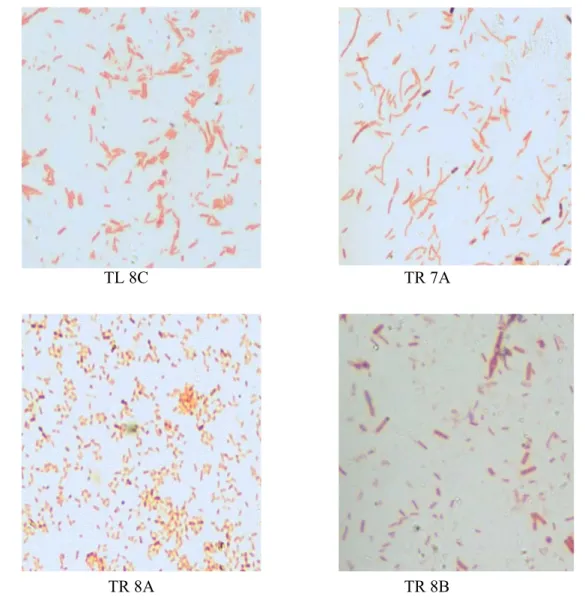
Tahap selanjutnya yaitu pewarnaan Gram bakrteri yang bertujuan untuk mengetahui jenis Gram isolat bakteri yang telah berhasil diisolasi. Hasil pengamatan pewarnaan Gram bakteri menggunakan mikroskop cahaya dengan perbesaran 10x100 dapat dilihat pada Gambar 11.
TL 6A TL 6B
TL 8A TL 8 B
TL 8C TR 7A
TR 8A TR 8B
Gambar 12 Karakteristik mikroskopis isolat bakteri dari ikan tenggiri
Hasil pewarnaan Gram bakteri yang telah berhasil diisolasi menunjukkan bahwa jenis bakteri tersebut termasuk ke dalam kelompok bakteri Gram negatif. Pewarnaan Gram memisahkan bakteri secara umum menjadi dua kelompok yaitu bakteri Gram positif dan bakteri Gram negatif. Organisme yang mampu menahan kompleks pewarna primer ungu kristal iodium disebut Gram positif. Organisme yang kehilangan kompleks warna ungu kristal kemudian terwarnai oleh pewarna tandingan safranin sehingga sel tampak merah muda disebut Gram negatif. Sel-sel Gram negatif memiliki kandungan lipid yang lebih tinggi pada dinding selnya dan lipid pada umumnya larut dalam alkohol dan aseton. Larutnya lipid oleh pemucat (alkohol 96%) yang digunakan dalam pewarnaan Gram diduga memperbesar
pori-pori dinding sel sehingga mampu menyerap pewarna tandingan safranin (Hadioetomo 1993). Hasil pengamatan pewarnaan Gram isolat bakteri yang berasal dari ikan tongkol (Euthynnus sp.) dan tenggiri (Scomberomorus commersonii) dapat dilihat pada Tabel 3.
Tabel 3 Hasil pengamatam pewarnaan Gram isolat bakteri
Pengenceran Gram Warna Koloni Bentuk Gambar Tongkol
10-6 A
Negatif Merah Terpisah Batang
Tongkol 10-6 B
Negatif Merah Terpisah Bulat
Tongkol 10-8 A
Negatif Merah Terpisah Batang
Tongkol 10-8 B
Negatif Merah Terpisah Batang
Tongkol 10-8 C
Negatif Merah Terpisah Batang
Tenggiri 10-7 A
Negatif Merah Terpisah Batang
Tenggiri 10-8 A
Negatif Merah Terpisah Batang
Tenggiri 10-8 B
Hasil pengamatan pewarnaan Gram isolat bakteri menunjukkan bahwa jenis bakteri yang telah diisolasi merupakan jenis bakteri Gram negatif yang pada umumnya berbentuk batang dan adapula yang bulat (TL 6B). Sekitar 80% jenis bakteri laut diketahui berbentuk batang dan Gram negatif yang sebagian besar memiliki alat gerak (flagella) dari hasil adaptasi kehidupan perairan, sedangkan bakteri berbentuk bulat banyak dijumpai di tanah dibandingkan habitat perairan (Sidharta 1991).
Berdasarkan ukurannya, terlihat bahwa isolat bakteri yang diperoleh memiliki ukuran yang tampak kecil. Bakteri laut jauh lebih kecil dibandingkan bakteri susu, air buangan, air tawar, dan tanah (Sidharta 1991). Selain itu, hasil isolasi bakteri tersebut memiliki persamaan dengan berbagai jenis bakteri yang mampu menghasilkan enzim histidin dekarboksilase (Hdc) termasuk famili Enterobacteriaceae dan Bacillaceae yang sebagian besar merupakan kelompok Gram negatif dan berbentuk batang (Staruszkiewicz 2002 dalam Allen 2004). Informasi ini semakin memperkuat dugaan bahwa bakteri yang diisolasi merupakan bakteri target, sehingga penelitian dilanjutkan ke tahap selanjutnya yaitu ekstraksi DNA bakteri.
4.2 Ekstrak DNA Bakteri
Tujuan utama dari tahapan ekstraksi DNA adalah untuk memperoleh DNA yang bebas dari pengotor seperti protein, RNA dan polisakarida dengan konsentrasi yang cukup untuk melakukan PCR. Hasil ekstraksi DNA akan sangat mempengaruhi untuk proses selanjutnya yaitu PCR. Hasil ekstraksi DNA yang telah diperoleh perlu diukur kuantitasnya untuk mengetahui seberapa banyak konsentrasi DNA yang telah berhasil diekstrak. Konsentrasi DNA dapat diukur dengan menggunakan spektrofotometer pada panjang gelombang 260 nm. Hasil pengukuran konsentrasi ekstrak DNA yang telah diperoleh dapat dilihat pada Tabel 4.
Tabel 4 Hasil pengukuran konsentrasi DNA
Sample Rasio DNA (μg/ml)
TL 6A 2,21 100 TL 6B 1,67 72 TL 8A 2,22 616 TL 8B 2,34 236 TL 8C 2,13 1488 TR 7A 2,03 84 TR 8A 1,71 48 TR 8B 2,22 72
Hasil pengukuran konsentrasi DNA yang diperoleh menunjukkan bahwa produk ekstraksi mengandung DNA yang cukup untuk melakukan PCR yaitu minimal 5 µg/ml (Yuwono 2001), dengan faktor pengenceran yang digunakan yaitu 40 kali. Rasio pengukuran konsentrasi DNA yang diperoleh cukup baik, namun masih terdapat beberapa jenis pengotor. Kemurnian DNA ditentukan oleh tingkat kontaminasi protein dalam larutan. Kemurnian larutan DNA tersebut dapat dilihat dengan membagi nilai OD260 dengan OD280. Molekul DNA dikatakan
murni jika rasio kedua nilai tersebut berkisar antara 1,8-2,0. Rasio yang lebih kecil dari 1,8 menunjukkan bahwa masih terdapat kontaminasi protein atau fenol di dalam larutan, sedangkan jika rasio lebih besar dari 2,0 menunjukkan bahwa masih terdapat pengotor berupa RNA (Sulandari dan Zein 2003).
Hasil kemurnian DNA tidak terlepas dari proses ekstraksi. Proses ekstraksi DNA bakteri dilakukan dengan metode CTAB 10% (Sambrook et al. 2001) menggunakan berbagai jenis bahan kimia utama seperti SDS, EDTA, kloroform, etanol 70%, dan Isopropanol. EDTA berfungsi sebagai perusak sel dengan cara mengikat ion magnesium (ion ini berfungsi untuk mempertahankan integritas sel maupun mempertahankan aktivitas enzim nuklease yang merusak asam nukleat). SDS merupakan sejenis deterjen yang berfungsi merusak membran sel. Kemudian molekul nukleotida (DNA dan RNA) yang telah dipisahkan dan dibersihkan dari protein yang masih ada dengan menggunakan fenol. Dalam proses ini, sebagian kecil RNA juga dapat dibersihkan. Kloroform digunakan untuk membersihkan sisa-sisa protein dan polisakarida dari larutan. Enzim RNAase digunakan untuk
menghilangkan komponen RNA sehingga DNA dapat diisolasi secara utuh (Sulandari dan Zein 2003).
Pemurnian atau purifikasi DNA dapat dilakukan dengan mencampur larutan DNA tersebut dengan NaCl yang berfungsi untuk memekatkan, memisahkan DNA dari larutan dan mengendapkan DNA sewaktu dicampur dengan etanol. Proses sentrifugasi dengan kecepatan tinggi bertujuan untuk mengendapkan tepung berwarna putih (DNA) sehingga menempel di dasar tabung efendorf (Sulandari dan Zein 2003). Hasil ekstraksi DNA dengan metode CTAB 10% cukup baik, dilanjutkan dengan amplifikasi DNA menggunakan metode PCR konvensional. Gen target yang diharapkan dapat diisolasi yaitu gen pengkode histidin dekarboksilase.
4.3 Identifikasi Bakteri dengan Metode 16S rDNA
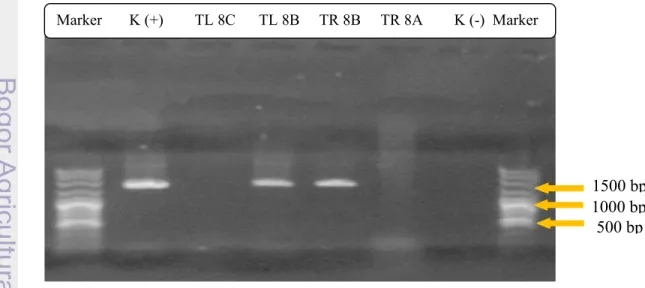
Teknik identifikasi secara biomolekuler dengan menggunakan metode 16S rDNA bertujuan untuk mengetahui spesies bakteri yang telah berhasil diisolasi. Metode ini dinilai lebih akurat dan lebih mudah dibandingkan dengan teknik identifikasi secara biokimiawi karena menggunakan teknik polymerase chain reaction (PCR) yang memiliki spesifisitas tinggi. Teknik identifikasi secara biomolekuler dengan menggunakan metode 16S rDNA kini banyak digunakan khususnya di bidang biologi molekuler. Visualisasi hasil PCR dengan menggunakan primer 27-F dan 1492-R dapat dilihat pada Gambar 13.
Gambar 13 Elektroforegram produk PCR 16S rDNA Marker K (+) TL 8C TL 8B TR 8B TR 8A K (-) Marker
1500 bp 1000 bp 500 bp
Berdasarkan Gambar 13, jenis bakteri yang berhasil teridentifikasi hanya dua sampel ukuran sudah sesuai dengan literatur yaitu TL 8B dan TR 8B, sedangkan sampel yang lain tidak teridentifikasi. Hal ini menunjukkan bahwa kemungkinan mikroorganisme yang diisolasi bukan merupakan bakteri melainkan mikroorganisme lain (kontaminan) karena identifikasi dengan metode 16S rDNA merupakan metode yang umum digunakan untuk mengidentifikasi jenis bakteri.
Berdasarkan hasil sekuensing produk PCR sampel TL 8B dan TR 8B telah berhasil diidentifikasi dengan memasukkan urutan pasang basa hasil sekuensing ke bank data. Hasil identifikasi menunjukkan bahwa sampel TL 8B merupakan jenis bakteri Aeromonas sp. kc3 sedangkan sampel TR 8B merupakan jenis bakteri Bacillus cereus. Hal ini membuktikan bahwa jenis bakteri yang diisolasi bukanlah jenis bakteri target penghasil enzim histidin dekarboksilase melainkan jenis bakteri kontaminan.
Dari berbagai teknik yang digunakan, RNA ribosomal paling banyak digunakan sebagai penanda molekuler. Terdapat tiga jenis RNA ribosomal pada prokaryot yaitu 5S, 16S, dan 23S rDNA. Di antara ketiganya, 16S rDNA yang paling sering digunakan. Molekul 5S rDNA memiliki urutan basa terlalu pendek, sehingga tidak ideal dari segi analisis statistika, sementara molekul 23S rDNA memiliki struktur sekunder dan tersier yang cukup panjang sehingga menyulitkan analisis. Analisis gen penyandi 16S rDNA telah menjadi prosedur baku untuk menentukan hubungan filogenetik dan menganalisis suatu ekosistem (Murray dan Stackebrandt 1995 dalam Pangastuti 2006).
Gen penyandi 16S rDNA dapat digunakan sebagai penanda molekuler karena molekul ini bersifat ubikuitus dengan fungsi yang identik pada seluruh organisme. Molekul ini juga dapat berubah sesuai jarak evolusinya, sehingga dapat digunakan sebagai kronometer evolusi yang baik. Molekul 16S rDNA memiliki beberapa daerah yang memiliki urutan basa yang relatif konservatif dan beberapa daerah urutan basanya variatif. Perbandingan urutan basa yang konservatif berguna untuk mengkonstruksi pohon filogenetik universal karena mengalami perubahan relatif lambat dan mencerminkan kronologi evolusi bumi. Sebaliknya, urutan basa yang bersifat variatif dapat digunakan untuk melacak keragaman dan menempatkan galur-galur dalam satu spesies. Apabila urutan basa
16S rDNA menunjukkan derajat kesamaan yang rendah antara dua taksa, deskripsi suatu takson baru dapat dilakukan tanpa hibridisasi DNA, namun jika derajat kesamaan urutan basa gen penyandi 16S rDNA kurang dari 97% dapat dianggap sebagai spesies baru (Stackebrandt dan Goebel 1995 dalam Pangastuti 2006).
4.4 Amplifikasi Gen hdc dengan Metode PCR
Amplifikasi atau replikasi DNA bertujuan untuk melipatgandakan jumlah DNA template sesuai dengan primer yang digunakan. Amplifikasi atau replikasi DNA secara in vitro dapat dilakukan dengan bantuan alat thermo cycler menggunakan metode polymerase chain reaction (PCR). Pada tahap ini, DNA yang telah berhasil diperoleh akan diperbanyak untuk mengetahui apakah DNA tersebut memiliki gen pengkode histidin dekarboksilase dengan menggunakan primer histidin dekarboksilase (Hdc), dan primer 106-107. Hasil visualisasi produk PCR dengan menggunakan primer Hdc melalui teknik elektroforesis menunjukkan bahwa tidak terdapat pita DNA yang terlihat. Optimasi telah dilakukan beberapa kali dengan menggunakan suhu annealing 56-60 oC, namun agarosa masih terlihat kosong dengan ukuran DNA target yaitu sekitar 709 bp.
Hal ini menunjukkan bahwa DNA bakteri yang telah diisolasi tidak mengandung gen pengkode histidin dekarboksilase dengan jenis primer Hdc, oleh karena itu primer Hdc diganti dengan primer yang lebih spesifik yaitu primer 106-107. Hasil pengamatan elektroforegram produk PCR dengan primer Hdc menunjukkan hasil yang negatif (tidak terdapat fragmen DNA target) yang berarti bahwa DNA bakteri tidak mengandung gen hdc pengkode histidin dekarboksilase, sehingga dilakukan penggantian primer dengan menggunakan primer 106-107 yang bersifat lebih spesifik.
Primer 106-107 merupakan primer yang lebih spesifik dibandingkan primer Hdc, karena memiliki ukuran target yang lebih kecil yaitu 534 kb. Suhu annealing yang digunakan berkisar antara 50-54 oC, hal ini bertujuan untuk mengetahui kondisi optimum penempelan primer (annealing) selama proses PCR berlangsung.
Hasil pengamatan visualisasi produk PCR dengan primer 106-107 masih menunjukkan hasil yang negatif, sehingga memperkuat dugaan bahwa besar
kemungkinan DNA mikroorganisme yang telah diisolasi tidak memiliki gen pengkode histidin dekarboksilase. Namun berdasarkan penelitian Mangunwardoyo et al. (2007) menyatakan bahwa, berbagai jenis bakteri yang mampu menghasilkan enzim histidin dekarboksilase (Hdc) termasuk kelompok Enterobacteriaceae. Morganella morganii merupakan bakteri pembentuk histamin yang berasal dari ikan tongkol dan ikan Scombridae lainnya, oleh karena itu memperkuat dugaan bahwa bahan baku yang digunakan bermasalah sehingga perlu dilakukan penelusuran (traceability) dengan melakukan uji formalin.
4.5 Uji Formalin
Uji formalin perlu dilakukan untuk menguji apakah bahan baku yang digunakan telah bebas dari penggunaan formalin. Formalin merupakan bahan pengawet mayat yang berbahaya apabila dikonsumsi dan terdapat dalam bahan pangan. Formalin bersifat bakterisidal sehingga mampu membunuh semua mikroba, oleh karena itu formalin dapat menjaga keawetan bahan yang menggunakannya (Lu 2006 dalam Rinto et al. 2009). Hasil pengujian formalin pada ikan tongkol dan ikan tenggiri dapat dilihat pada Gambar 14.
Keterangan gambar : A. Kontrol positif formalin
(ungu pekat) B. Ekstrak daging ikan
tenggiri (ungu) C. Ekstrak daging ikan
tongkol (ungu)
Gambar 14 Hasil pengujian formalin pada ekstrak daging ikan tongkol (Euthynnus sp.) dan tenggiri (Scomberomorus commersonii)
Hasil pengujian formalin menunjukkan hasil yang positif, berarti bahwa ikan tongkol dan tenggiri yang digunakan mengandung formalin. Kontrol positif berupa asam kromatofat yang telah ditambahkan formalin menghasilkan warna
ungu. Begitu pula dengan hasil pengujian sampel. Ekstrak daging ikan tenggiri dan tongkol setelah ditambahkan asam kromatofat berubah warna menjadi ungu, sehingga dapat disimpulkan bahwa bahan baku yang digunakan mengandung formalin.
Bahan baku yang tercemar oleh formalin menyebabkan mikroflora alami dari tubuh dan habitat ikan mati akibat adanya formalin yang bersifat sebagai bakterisidal kuat dan beracun (toksik). Kuat dugaan bahwa bakteri yang diisolasi bukanlah merupakan bakteri alami yang berasal dari mikroflora dari bahan baku melainkan bakteri kontaminan selama proses penanganan. Kecil kemungkinan DNA bakteri yang diisolasi memiliki gen pengkode enzim histidin dekarboksilase. Hal ini diperkuat dengan pernyataan Omura et al. (1978) yang menyatakan bahwa bakteri pembentuk histamin secara alami terdapat pada insang dan isi perut ikan. Hal ini sekaligus membuktikan bahwa program yang dicanangkan pemerintah untuk memberantas praktik penggunaan formalin masih gagal dan terbukti bahwa praktik penggunaan formalin di lapangan masih umum dilakukan oleh nelayan maupun pedagang. Selain itu hal ini juga membuktikan bahwa tingkat keamanan pangan di Indonesia masih jauh dari yang diharapkan karena bahan pengawet formalin dilarang keras penggunaannya dalam bahan pangan karena akan membahayakan kesehatan dan bersifat kronis.
Secara kimiawi, formalin atau formaldehide merupakan suatu golongan aldehid dari komponen organik alifatik dengan rumus molekul CH2O. Formalin
merupakan bahan yang mudah menguap pada suhu kamar dan dapat larut dengan air. Formalin bertindak sebagai bakterisidal kuat yang dapat membunuh maupun merusak sel-sel yang ada pada jaringan tubuh manusia sehingga pertumbuhan jaringan tidak teratur. Pertumbuhan atau pembelahan sel yang rusak dan tidak teratur menyebabkan rusaknya struktur jaringan tubuh yang dapat menyebabkan kanker (IARC 1987 dalam Rinto et al. 2009).