II. TINJAUAN PUSTAKA
2.1 Selulosa
Selulosa merupakan komponen utama penyusun dinding sel tumbuhan bersama-sama dengan hemiselulosa dan pektin. Komposisi selulosa dalam tumbuhan dapat mencapai 40-50% dari massa tumbuhan sehingga selulosa merupakan biopolimer terbarukan yang paling berlimpah di alam (Milala 2005). Produksi selulosa setiap tahun diperkirakan mencapai 4 x 1010 ton (Coughlan 1985). Selain pada tumbuhan, selulosa juga disintesis oleh berbagai jenis organisme lainnya, seperti bakteri, alga dan cendawan. Kandungan selulosa dari berbagai sumber disajikan pada Tabel 1.
Tabel 1 Kandungan selulosa dari berbagai sumber
Sumber Selulosa (%) Hemiselulosa (%) Lignin (%)
Tongkol jagung 45 35 15 Jerami padi 32.1 24 18 Jerami gandum 30 50 15 Kayu keras 40-55 24-40 18-25 Kayu lunak 45-50 25-35 25-35 Rumput 45 31,4 12
Sumber : Howard et al. (2003)
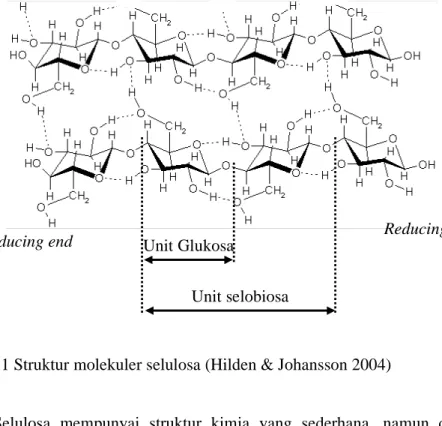
Selulosa merupakan polimer glukosa yang tersusun dari unit-unit glukosa yang dihubungkan dengan ikatan β-1,4-D-glikosidik. Polimer ini tersusun secara paralel dan berikatan silang membentuk sruktur kristalin yang disebut mikrofibril (Gambar 1). Panjang mikrofibril ini bervariasi dari 2000 - 15.000 unit glukosa, tergantung organismenya (Nieduszynski & Preston 1970). Bentuk mikrofibril selulosa ditentukan oleh kompleks geometri selulosa sintase dan lingkungan lokal. Pada tumbuhan, unit mikrofibril mempunyai lebar sekitar 3 nm dan terdiri dari sekitar 36 rantai selulosa dan seringkali di kemas dalam bentuk lebih besar (Doblin et al. 2002).
Gambar 1 Struktur molekuler selulosa (Hilden & Johansson 2004)
Selulosa mempunyai struktur kimia yang sederhana, namun demikian sifat-sifat fisiknya, seperti bentuk kristalin, derajat kristalinitas dan berat molekuler mempunyai variasi yang cukup tinggi. Di alam, kebanyakan selulosa diproduksi sebagai kristalin. Struktur ini terdiri dari dua bentuk yang berbeda, yaitu triclinic cellulose (Iα) dan monoclinic cellulose (Iβ). Kedua bentuk ini dibedakan berdasarkan pengemasan kristal, konformasi molekuler dan pola ikatan hidrogen intramolekuler. Perbedaan ini mungkin berpengaruh terhadap sifat-sifat fisik selulosa. Disamping struktur kristalin, selulosa juga tersusun dari struktur non kristalin (amorf). Jumlah dan perbandingan antara struktur kristalin dan non kristalin ini berbeda-beda tergantung organismenya (Saxena & Brown 2005).
2.2. Enzim Selulase
Enzim selulase merupakan salah satu kelompok enzim yang termasuk dalam sistem enzim lignoselulotik yang diproduksi mikroorganisme yang berperan dalam degradasi material sel tumbuhan. Enzim ini termasuk dalam famili glikosida hidrolase (GH). Enzim selulase berperan dalam hidrolisis selulosa
Unit selobiosa Unit Glukosa
dengan memecah ikatan β-1,4-D-glikosidik untuk menghasilkan oligosakarida maupun glukosa.
2.2.1 Klasifikasi enzim selulase
Enzim selulase dapat diklasifikasikan berdasarkan spesifisitas terhadap substrat, mekanisme reaksi atau kemiripan strukturnya. Berdasarkan struktur proteinnya, enzim selulase termasuk ke dalam famili glikosida hidrolase (GH). GH merupakan kelompok enzim yang mempunyai aktivitas memotong ikatan glikosisik antara dua atau lebih karbohidrat. GH diklasifikasikan berdasarkan similaritas urutan dan struktur asam aminonya (Henrissat 1991; Henrissat & Bairoch 1993; Henrissat & Bairoch 1996). Saat ini terdapat 113 famili GH yang dilaporkan secara online di website (http://www.cazy.org.) (Cantarel et al. 2009). Untuk selulase, saat ini tersebar sedikitnya ke dalam 11 famili GH, yaitu famili 5-9, 12, 26, 44, 45, 48 dan 61.
Tabel 2 Substrat selulosa dan turunannya
Substrat Enzim
Larut dalam air
Rantai pendek (DP rendah)
Silodekstrin
Radio-labelled silodekstrin Turunan silodekstrin
β-methyllumberlliferil oligosakarida p-nitrofenol oligosakarida
Turunan selulosa dengan rantai panjang Carboxymethylecellulose (CMC) Dyed CMC
Tidak larut dalam air
Selulosa kristalin – katun, selulosa mikrokristalin (Avicel), selulosa bakteri Selulosa amorf-PASC
Dyed cellulose
Kromogenik dan turunan fluoreforik
Trinitrofenil-karboksimetilselulosa (TNP-CMC) Fluram selulosa α-selulosa Endo, ekso, BG Endo, ekso, BG Endo, ekso, BG Endo, ekso, BG Endo Endo
Total, endo, ekso
Total, endo, ekso Total, endo
Endo Endo, total Total
Ket: Endo = endoglukanase; Ekso = eksoglukanase; BG = glukosidase; Total = ketiga tipe enzim selulase.
Aktivitas masing-masing enzim selulase dapat diuji menggunakan berbagai substrat selulosa maupun turunannya. Pada umumnya substrat ini dibagi menjadi dua kategori berdasarkan kelarutannya dalam air, yaitu substrat yang larut dalam air dan substrat yang tidak larut dalam air (Tabel 2). Substrat larut dalam air meliputi selodekstrin dengan DP (degree of polymerization) rendah dari 2 sampai 6 unit gula dan turunannya. Sementara itu substrat tidak larut meliputi selulosa yang hampir murni seperti katun, kertas saring Whatman no.1 dan selulosa bakteri, serta selulosa yang tidak murni seperti α-selulosa. Aktivitas enzim endoglukanase pada umumnya dapat diuji dengan substrat CMC (carboxymethyl cellulose) sehingga enzim endoglukanase juga dikenal dengan istilah CMCase. Sementara itu aktivitas enzim selobiohidrolase atau eksoglukanase seringkali diuji dengan substrat avicel sehingga enzim eksoglukanase disebut juga avicelase (Zhang et al. 2006).
2.2.2 Struktur organisasi enzim selulase
Pada umumnya enzim selulase terdiri dari dua domain utama, yaitu domain katalitik dan carbohydrate binding moduls (CBM). Kedua domain ini biasanya dihubungkan oleh suatu penghubung yang pendek dan fleksibel (linker). Domain katalitik merupakan bagian terbesar dari enzim dan merupakan tempat dimana hidrolisis selulosa terjadi. Enzim selulase sedikitnya mempunyai satu domain katalitik dan ukurannya bervariasi tiap organisme, dari yang berukuran pendek seperti CelS Erwinia corotovora (232 AA) sampai yang berukuran panjang seperti CelBb Caldochellum saccharolyticum (1.011 AA) (Gilkes 1991).
Carbohydrate binding modul (CBM) sebelumnya dikenal dengan cellulose binding domain. Saat ini CBM diklasifikasikan menjadi 45 famili berdasarkan
database CAZy (Hashimoto 2006). Domain CBM merupakan daerah yang miskin asam amino bermuatan, mempunyai kandungan asam hidroksiamino yang tinggi dan mengandung residu-residu Trp, Tyr dan Gly yang terkonservasi (Gilkes 1991). Fungsi utama domain CBM adalah meningkatkan efisiensi katalitik enzim terhadap substrat dengan membawa modul katalitik pada substrat (Hashimoto 2006).
Daerah penghubung (linker) merupakan daerah yang menghubungkan antara CBM dan domain katalitik (Gilkes 1991). Linker mempunyai ukuran yang pendek dan sangat bervariasi, dari 6-59 asam amino. Daerah ini kaya prolin, treonin dan serin. Linker berperan dalam menjaga jarak antara domain katalitik dan CBM. Percobaan yang dilakukan dengan menghilangkan daerah linker pada Cel7A T. reesei menunjukkan penurunan kecepatan degradasi selulosa kristalin secara drastis (Srisodsuk et al. 1993).
2.2.3 Mekanisme hidrolisis oleh selulase
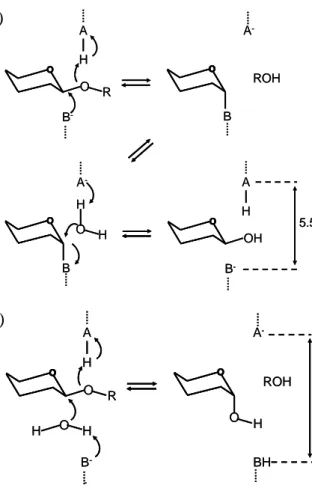
Hidrolisis enzimatik ikatan glikosidik oleh golongan glikosil hidrolase biasanya dilakukan melalui katalisis asam atau basa yang memerlukan dua residu, yaitu donor proton (HA) dan nukleofil/ basa (B-). Aktivitas katalitik ini disediakan oleh residu asam aspartat atau glutamat. Terdapat dua mekanisme yang dapat dibedakan, yaitu retaining mechanism dan inverting mechanism (Gambar 2) (Davies & Henrissat 1995).
Pada retaining mechanism, reaksi tejadi melalui mekanisme penggantian ganda. Pada tahap pertama, salah satu gugus karboksilat berfungsi sebagai katalis asam yang memprotonisasi oksigen dan secara bersamaan karbon C1 diserang oleh nukleofil (B-) dari gugus karboksilat kedua, menghasilkan bentuk antara enzim-glikosil. Pada tahap kedua, gugus karboksilat pertama sekarang berfungsi sebagai katalis basa yang mengaktifkan molekul air. Aktivasi ini menghasilkan nukleofil yang menghidrolisis bentuk antara enzim-glikosil, menghasilkan produk yang mempunyai stereokimia yang sama dengan substrat. Retaining mechanism ini biasanya terjadi pada dua karboksilat yang berjarak 5.5 Å. Sementara itu, pada
inverting mechanism, terjadi pengubahan konfigurasi pada karbon C1 anomerik
setelah pemutusan ikatan glikosidik. Reaksi terjadi melalui mekanisme penggantian tunggal. Basa (B-) melakukan deprotonasi molekul air yang kemudian menyerang karbon C1 dari cincin glukosa, menghasilkan pembalikan konfigurasi pada karbon C1 anomerik. Inverting mechanism ini biasanya terjadi pada dua karboksilat yang berjarak antara 6.5-9.5 Å.
Gambar 2 Mekanisme hidrolisis oleh selulase. (a). Retaining mechanism (b).
Inverting mechanism
2.3 Glikosida Hidrolase Famili 12
GH12 merupakan salah satu famili Glikosida hidrolase yang mempunyai aktivitas endoglukanase dan xyloglukan hidrolase. Mekanisme katalisisnya adalah
retaining dengan Glutamat (Glu) sebagai basa nukleofil maupun donor protonnya.
Berdasarkan database pfam, sampai saat ini GH12 mempunyai sekitar 151 anggota dengan 7 arsitektur domain yang berbeda (Gambar 3). Arsitektur pertama hanya terdiri dari domain katalitik famili GH12 (Sandgreen et al. 2003a), arsitektur kedua terdiri dari domain katalitik famili GH12 dan domain CBM2 (Sandgreen et al. 2003b), arsitektur ketiga terdiri dari domain katalitik famili GH12 dan CBM1 (Dean et al. 2005), arsitektur keempat terdiri dari domain katalitik famili GH12 dan risin-β-lektin (Copeland et al. 2006), arsitektur kelima
o o B -H A O R ROH B A -o B A -O H H o B -H A OH 5.5 Å o o oo B -H A O R ROH B A -o o B A -O H H o o B -H A OH 5.5 Å
(a)
(b)
o o B -H A O R ROH BH A -10 Å O H H O H o o oo B -H A O R ROH BH A -10 Å O H H O Hterdiri dari domain katalitik famili GH12 dan adh short (Birren et al. 2005), arsitektur keenam terdiri dari domain katalitik famili GH12, risin-β-lektin dan famili GH5 (Copeland et al. 2007a), dan arsitektur ketujuh terdiri dari domain katalitik famili GH6, CBM3, fn3, famili GH12 dan CBM2 (Copeland et al. 2007b).
Gambar 3 Arsitektur domain GH famili 12
2.4 Mikroorganisme Penghasil Enzim Selulase
Di alam, enzim selulase banyak dihasilkan oleh berbagai jenis cendawan dan bakteri. Namun demikian beberapa jenis organisme, seperti rayap (Watanabe & Tokuda 2001), remis (Xu et al. 2000) dan arabidobsis (Williamson et al. 2002) juga menghasilkannya. Beberapa contoh genus bakteri yang mempunyai aktivitas selulotik adalah Clostridium, Ruminococcus, Caldicellulosiruptor, Butyrivibrio,
Fibrobacter, Cellulomonas, Thermobifida, Cytophaga, dan Sporocytophaga,
Sementara itu beberapa genus cendawan yang mempunyai aktivitas selulolitik adalah Bulgaria, Chaetomium, Helotium, Coriolus, Phanerochaete, Poria,
Schizophyllum, Serpula, serta Aspergillus, Cladosporium, Fusarium, Geotrichum, Myrothecium, Paecilomyces, Penicillium, dan Trichoderma.
Di alam, degradasi selulosa kebanyakan dilakukan oleh mikroorganisme aerobik. Mikroorganisme ini menghasilkan enzim selulase non-kompleks yang (Sandgreen et al. 2003a)
(Copeland et al. 2007b) (Sandgreen et al. 2003b)
(Dean et al. 2005)
(Copeland et al. 2006)
(Birren et al. 2005)
(Copeland et al. 2007a)
GH5 GH5 GH5 GH5 GH5 GH5 GH5 GH6 CBM2 C B M 1 CBM3 Fn3 GH12 risin-β-lektin risin-β-lektin adh short
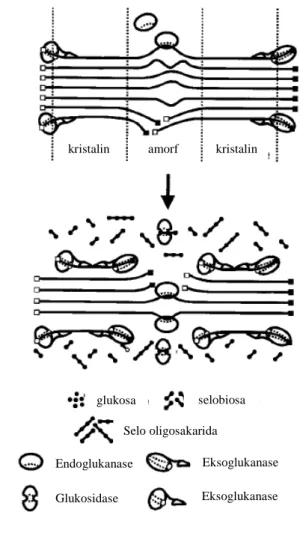
terdiri dari endoglukanase, eksoglukanase dan glukosidase yang bekerja secara sinergis untuk menghidrolisis selulosa (Gambar 4). Berbeda dengan mikroorganisme aerobik, mikroorganisme anaerobik menghasilkan enzim selulase kompleks yang disebut selulosom (Doi et al. 2003; Bayer et al. 2004). Walaupun mikroorganisme anaerobik hanya menyumbang sekitar 5-10% dari biodegradasi total selulosa di alam, namun peranannya sangat penting, karena bertanggung jawab terhadap degragasi daerah anoksik pada danau, laut, dan saluran pencernaan hewan pemamah biak maupun rayap, yang tidak dapat dilakukan mikroorganisme aerobik (Zhang et al. 2006).
Gambar 4 Sinergisme hidrolisis selulosa oleh selulase non-kompleks (Lynd et al. 2002)
kristalin amorf kristalin
glukosa selobiosa Glukosidase Endoglukanase Eksoglukanase Eksoglukanase Selo oligosakarida
Kelompok cendawan merupakan agen yang paling baik dalam mendekomposisi komponen organik, seperti selulosa, dibandingkan dengan bakteri. Kemampuan hidup dan daya saing yang tinggi (Landecker 1972) menjadikan cendawan lebih berperan dalam proses dekomposisi komponen organik di alam. Disamping itu, cendawan juga dikenal sebagai organisme penghasil selulase yang baik, sehingga banyak digunakan dalam produksi enzim selulase secara komersial. Kelompok cendawan berfilamen seperti Aspergillus dan
Trichoderma diketahui merupakan penghasil enzim selulase yang efisien
(Gielkens 1999) dan saat ini sebagian besar produksi komersial enzim selulase di dunia dihasilkan dari kedua kelompok cendawan ini.
2.5 Sistem Selulolitik pada Cendawan
Cendawan mempunyai sistem selulolitik yang berbeda dengan bakteri. Pada cendawan, enzim selulase diproduksi hanya jika diperlukan sedangkan pada bakteri enzim selulase diproduksi secara terus-menerus (konstitutif). Sistem selulolitik pada cendawan yang paling banyak dipelajari dan saat ini dijadikan model sistem selulolitik cendawan adalah sistem selulolitik pada Trichoderma
reesei. Sistem ini mengandung dua gen yang menyandi selobiohidrolase, cbh1
(Teeri et al.1983) dan cbh2 (Chen et al.1997); empat gen yang menyandi endoglukanase egl1 (Penttila et al. 1986), egl2 (Saloheimo et al. 1988), egl3 dan
egl5 (Saloheimo et al. 1994); dan satu gen yang menyandi glukosidase (Barnett et al. 1991). Sementara itu pada Aspergillus niger, tiga gen yang menyandi
endoglukanase, eglA, eglB (van Peij 1998) dan eglC (Hasper et al. 2002) dan dua gen yang menyandi selobiohidrolase, cbhA dan cbhB (Gielkens 1999), sudah dikarakterisasi. Gen-gen penyandi enzim selulase, pada cendawan maupun bakteri, terletak dalam kromosom. Gen-gen ini biasanya terdistribusi secara acak pada genom dan masing-masing mempunyai elemen regulasi sendiri. Pada umumnya gen-gen ini merupakan multidomain, kecuali beberapa gen seperti EGIII dari T. reesei dan EG28 dari P. chysosporium (Lynd 2002).
Sistem ekspresi enzim selulase pada cendawan diregulasi pada tingkat transkripsi dan mekanisme regulasinya sampai saat ini masih belum jelas (Ilmen 1997). Ketika cendawan ditumbuhkan pada media yang mengandung selulosa
sebagai satu-satunya sumber karbon, enzim diekspresikan, sedangkan ketika cendawan ditumbuhkan pada media yang mengandung glukosa, tidak ada ekspresi selulosa. Hal ini menandakan bahwa ekspresi enzim selulase diinduksi oleh selulosa dan dihambat oleh glukosa. Selain selulosa, beberapa molekul lain seperti, laktosa, saporosa, selobiosa, dan selotriosa diketahui dapat menginduksi ekspresi selulase (Kubicek et al. 1993).