EFEK PEMBERIAN GRANULOCYTE COLONY
STIMULATING FACTOR PADA MOBILISASI,
PROLIFERASI, DAN DIFERENSIASI
SEL PUNCA MESENKIMAL
TESIS
ERICA KHOLINNE 0906648030
FAKULTAS KEDOKTERAN UNIVERSITAS INDONESIA PROGRAM STUDI ILMU ORTHOPAEDI DAN TRAUMATOLOGI
EFEK PEMBERIAN GRANULOCYTE COLONY
STIMULATING FACTOR PADA MOBILISASI,
PROLIFERASI, DAN DIFERENSIASI
SEL PUNCA MESENKIMAL
TESIS
Diajukan sebagai salah satu syarat untuk memperoleh gelar Spesialis Orthopaedi dan Traumatologi
ERICA KHOLINNE 0906648030
FAKULTAS KEDOKTERAN UNIVERSITAS INDONESIA PROGRAM STUDI ILMU ORTHOPAEDI DAN TRAUMATOLOGI
JAKARTA DESEMBER 2014
segala rahmat, belas kasih dan karunia yang dilimpahkanNya kepada saya sehingga saya dapat menyelesaikan tugas penelitian akhir ini.
Saya menyadari sepenuhnya bahwa tugas ini akhirnya terselesaikan karena diberikan olehNya orang-orang baik dalam hidup saya serta semua fasilitas yang terbaik. Karena bimbingan, bantuan, dorongan, kesempatan, kerjasama dan pengorbanan dari merekalah sehingga tugas penelitian saya ini dapat terselesaikan.
Karena itu, dalam kesempatan ini, dalam halaman sederhana ini, saya ingin mengucapkan terima kasih dan penghargaan sebesar-besarnya kepada:
1. DR. dr. Ismail Hadisoebroto Dilogo, Sp.OT (K) selaku pembimbing penulisan karya ilmiah ini, yang telah memberikan inspirasi dan telah meluangkan waktu, tenaga dan pikiran untuk membimbing saya dalam penyusunan tesis. Selain menjadi panutan saya dalam melakukan penelitian selama pendidikan ini saya juga berterimakasih atas segala ilmu dan diskusi menarik yang telah beliau berikan selama menjalani pendidikan spesialis Orthopaedi dan Traumatologi ini.
2. Dr. Ifran Saleh SpOT (K-Spine), selaku Ketua Program Studi Orthopaedi dan Traumatologi FKUI-RSCM, Jakarta, atas didikan, bimbingan, ilmu, dan kesempatan belajar di RS Cipto Mangunkusumo selama masa pendidikan. 3. Seluruh staf pengajar Departemen Medik Orthopaedi dan Traumatologi
FKUI-RSCM, Jakarta atas didikan, bimbingan, ilmu, dan kesempatan belajar serta pelatihan keterampilan di RS Cipto Mangunkusumo selama masa pendidikan.
4. dr. M Sopiyudin Dahlan, M.Epid. selaku pembimbing statistik penulisan karya akhir ini;
Jessica Kholinne, dan Vanessa Kholinne dan juga keluarga lainnya yang tidak dapat saya sebutkan satu persatu yang selalu memberikan dukungan dan merelakan waktu bersama demi pelaksanaan penelitian dan penulisan tesis ini; 8. Teman-teman yang tidak dapat saya sebutkan satu persatu namanya di sini, yang telah banyak membantu dalam memberikan masukan, saran dan kritikan serta koreksi dalam penelitian dan penulisan tesis. Semoga kita bertujuh dapat lulus bersama menjadi orthopaed yang berkualitas;
Akhir kata, saya berharap Tuhan Yang Maha Esa berkenan membalas segala kebaikan semua pihak yang telah membantu. Semoga tesis ini membawa manfaat bagi pengembangan ilmu pengetahuan.
Jakarta, 22 Desember 2014
Judul : Efek pemberian Granulocyte Colony Stimulating Factor pada mobilisasi, proliferasi, dan diferensiasi sel Punca Mesenkimal. Pendahuluan. Sel punca mesenkimal yang dilaporkan mengaugmentasi penyembuhan fraktur umumnya diperoleh dari sumsum tulang. Donor sel punca dari sumsum tulang terbatas pada volume aspirat dan menimbulkan morbiditas donor sehingga diperlukan sumber alternatif. Darah perifer menutupi kekurangan tersebut walaupun memiliki kandungan sel punca yang lebih sedikit. Pemberian Granulocyte Colony Stimulating Factor (GCSF) dapat meningkatkan mobilisasi sel mononuklear pada teknik afaresis untuk sel punca hematopoetik. Bila pemberian GCSF diikuti dengan teknik kultur kearah sel punca mesenkimal maka dapat meningkatkan jumlah sel punca darah perifer sehingga memungkinkan penggunaan darah perifer sebagai donor alternatif sel punca. Oleh karena itu, diperlukan penelitian untuk mengevaluasi penggunaan darah perifer sebagai donor sel punca pasca pemberian GCSF dengan menilai kemampuan mobilisasi, proliferasi dan diferensiasi.
Metode Penelitian. Penelitian ini adalah penelitian eksperimental yang memakai hewan coba 14 ekor kelinci New Zealand White jantan, berat badan 2 kg di Pusat Studi Satwa Primata, Institut Pertanian Bogor. Sampel dibagi secara acak menjadi 4 kelompok yaitu kontrol dan perlakuan (injeksi GCSF dosis 10mcg/kg berat badan, subkutan, selama 7 hari) dimana pada masing-masing kelompok diambil aspirat darah perifer dan sumsum tulang (kelompok 1: kontrol sumsum tulang, kelompok 2: kontrol darah perifer, kelompok 3: perlakuan sumsum tulang, kelompok 4: perlakuan darah perifer). Pada tiap kelompok dilakukan isolasi, ekspansi dan diferensiasi menjadi osteoblas. Analisis statistik menggunakan uji one way Anova dan dilanjutkan uji posthoc untuk jumlah sel inisial, waktu konfluensi, jumlah sel konfluensi dan waktu diferensiasi.
Temuan dan Diskusi Penelitian. Sel punca mesenkimal pada seluruh kelompok penelitian mampu diisolasi, berproliferasi dan berdiferensiasi menjadi osteoblas. Rerata jumlah sel inisial kelompok 1: 3.07 x 106/mL, kelompok 2: 2.11 x 106/mL, kelompok 3: 2.89 x 106/mL dan kelompok 4: 7.35 x 106/mL (p< 0.001). Rerata waktu konfluensi kelompok 1: 25.8 hari, kelompok 2: 35.7 hari, kelompok 3: 26 hari, kelompok 4: 19.7 hari (p< 0.001). Rerata jumlah sel konfluensi kelompok 1: 6.54 x 106/mL, kelompok 2: 4.61 x 106/mL, kelompok 3: 5.94 x 106/mL, kelompok 4: 11.14 x 106/mL (p< 0.001). Rerata waktu diferensiasi kelompok 1: 15.5 hari, kelompok 2: 25.4 hari, kelompok 3: 15.4 hari, kelompok 4: 11.2 hari (p< 0.001). Uji posthoc jumlah sel inisial ditemukan perbedaan pada kelompok 1 dan 4 (p= 0.000), 2 dan 4 (p< 0.001), serta 3 dan 4 (p< 0.001). Uji posthoc waktu konfluensi, jumlah sel konfluensi dan waktu diferensiasi didapatkan perbedaan diantara semua kelompok
Kata kunci : Granulocyte Colony Stimulating Factor, Sel punca mesenkimal, mobilisasi, proliferasi, diferensiasi.
Title : The effect of Granulocute Stimulating Factor administration on mobilization, proliferation, and differentiation of Mesenchymal Stem cell.
Introduction. Mesenchymal stem cells, which had been reported to augment fracture healing, were routinely harvested from bone marrow. Bone marrow had several drawbacks regarding its limited aspiration volume and donor site morbidity, therefore alternative donor is needed. Peripheral blood may cover those disadvantages despite the fewer stem cells number. Granulocyte colony stimulating factor (GCSF) administration in aphaeresis technique could mobilized mononuclear cells to hematopoietic stem cells. If it is followed by culture for mesenchymal stem cells expansion, thus will increase peripheral mesenchymal stem cells number therefore might facilitate peripheral blood as an alternative donor. For that reason, further research is needed to evaluate the effect of GCSF induction to peripheral blood as stem cells alternative donor by assessing its capability on mobilization, proliferation and differentiation.
Methods. This is an experimental study using 14 male New Zealand White rabbit, weighted 2-3 kg in Primate Research Centre, Bogor Agricultural Institute. Sample was randomized into 4 groups as follow, control and treatment group (GCSF administration, 10mcg/kg body weight, subcutaneous, 7 days) in which peripheral blood and bone marrow aspiration was collected (group 1: control bone marrow, group 2: control peripheral blood, group 3: treatment bone marrow, group 4: treatment peripheral blood). Isolation, expansion and osteoblast differentiation were followed subsequently. Statistical analysis used one-way Anova and posthoc for initial cell number, confluency time, confluency cell number, and differentiation time. Result and Discussion. Mesenchymal stem cells in all groups were able to be isolated, proliferate and differentiate to osteoblast. Initial cell number (mean) group 1: 3.07 x 106/mL, group 2: 2.11 x 106/mL, group 3: 2.89 x 106/mL and group 4: 7.35 x 106/mL (p< 0.001). Confluency time (mean) group 1: 25.8 days, group 2: 35.7 days, group 3: 26 days, group 4: 19.7 days (p< 0.001). Confluency cell number (mean) group 1: 6.54 x 106/mL, group 2: 4.61 x 106/mL, group 3: 5.94 x 106/mL, group 4: 11.14 x 106/mL (p< 0.001). Differentiation time group 1: 15.5 days, group 2: 25.4 days, group 3: 15.4 days, group 4: 11.2 days (p< 0.001). Posthoc analysis for initial cell number was found significantly different for group 1 and 4 (p= 0.000), group 2 and 4 (p< 0.001) and group 3 and 4 (p< 0.001). Posthoc analysis for confluency time, confluency cell number and differentiation time was found significantly different for all groups except group 1 and 3 (p= 1.000, 0.670, 1.000).
Keywords: Granulocyte Colony Stimulating Factor, Mesenchymal stem cells, mobilization, proliferation, differentiation.
HALAMAN JUDUL ... i
HALAMAN PERNYATAAN ORISINALITAS ... ii
HALAMAN PENGESAHAN... iv
KATA PENGANTAR DAN UCAPAN TERIMA KASIH ... v
HALAMAN PERNYATAAN PERSETUJUAN PUBLIKASI TUGAS AKHIR UNTUK KEPENTINGAN AKADEMIS ... vii
ABSTRAK ... viii
ABSTRACT ... x
DAFTAR ISI... xii
DAFTAR TABEL ... xvi
DAFTAR GAMBAR... xv
DAFTAR LAMPIRAN ... xvi
DAFTAR SINGKATAN... xvii
BAB I. PENDAHULUAN ... 1 1.1 Latar Belakang……….1 1.2 Rumusan Masalah... 3 1.3 Tujuan Penelitian ... 3 1.3.1 Tujuan Umum ... 3 1.3.2 Tujuan Khusus ... 3 1.4 Kegunaan Penelitian... 4
BAB II. KAJIAN PUSTAKA, KERANGKA PEMIKIRAN, DAN HIPOTESIS ... 5
2.1 Rekayasa Jaringan dengan Sel Punca Mesenkimal ... 5
2.1.1 Sel Punca ...5
2.1.1.1 Sel Punca Mesenkimal ...7
2.1.1.2 Osteoblast... 7
2.2 Granulocyte Colony Stimulating Factor (GCSF) ...8
2.3 Kerangka Pemikiran...11 2.3.1 Kerangka Teori... 11 2.3.2 Kerangka Konsep ... 12 2.4 Hipotesis Penelitian ... 13 2.4.1 Hipotesis Utama... 13 2.4.2 Hipotesis Turunan ... 13
BAB III. METODE PENELITIAN ... 14
3.1 Desain dan Tempat Penelitian... 14
3.2 Populasi dan Sampel ... 14
3.5.1 Variabel Independen... 17
3.5.2 Variabel Dependen ... 17
3.6 Definisi Operasional... 17
3.7 Cara Kerja Penelitian ... 18
3.8 Analisis Data ... 21
3.9 Implikasi Penelitian... 21
3.10 Keterbatasan Penelitian... 22
BAB IV. HASIL PENELITIAN DAN PEMBAHASAN ... 23
4.1 Hasil Penelitian ...23
4.1.1 Profil Sel Inisial ... 23
4.1.2 Proliferasi Sel ... 27
4.1.3 Diferensiasi Sel... 28
4.2 Analisis Penelitian ... 29
4.3 Pembahasan ... ... 32
4.3.1 Karakteristik Sub yek dan Perlakuan Penelitian ... 32
4.3.2 Mobilisasi Sel Punca Mesenkimal Oleh GCSF ... 33
4.3.3 Proliferasi dan Diferensiasi Sel Punca Mesenkimal Setelah Pemberian GCSF ... 35
BAB V. KESIMPULAN DAN SARAN ... 37
5.1 Kesimpulan ... 37
5.2 Saran ... 37
DAFTAR PUSTAKA ... 38
Gambar 4.1. Diagram perbandingan jumlah sel inisial... 23
Gambar 4.2. Sel mononuclear ... 24
Gambar 4.3. Sel punca mesenkimal 1 minggu... 24
Gambar 4.4. Sel punca mesenkimal 2 minggu... 25
Gambar 4.5. Sel punca mesenkimal konfluensi ... 25
Gambar 4.6. Diagram perbandingan waktu konfluensi ... 26
Gambar 4.7. Diagram perbandingan jumlah sel konfluensi... 27
Gambar 4.8. Osteoblas ... 28
Gambar 4.9. Pewarnaan Alizarin Red... 28
Lampiran 3. Analisis Statistik ... 56 Lampiran 4. Surat pernyataan pengukuran acetabular index ... 55
CSF : Colony Stimulating Factor
FBS : Fetal Bovine Serum
GCSF : Granulocyte Colony Stimulating Factor HGF : Hepatocyte Growth Factor
HLA-DR : Human Leukocyte Antigen – D Related
IL-3 : Interleukin-3
IL-8 : Interleukin-8
MCP-1 : Monocyte Chemoattractant Protein-1 MIP-1 : Macrophage Inflammatory Protein-1 PBS : Phosphate Buffer Saline
SCF : Stem Cell Factor
SDF-1 : Stromal Derived Factor 1
TGF-B : Transforming Growth Factor Beta
BAB I PENDAHULUAN
1.1 Latar Belakang
Kecelakaan lalu lintas sebagai penyebab cedera terbanyak ke-9 merupakan salah satu masalah kesehatan utama di dunia.1 Di Indonesia, kecelakaan lalu lintas merupakan penyebab kematian tersering ke-6 di Indonesia pada tahun 2001.1
Cedera yang paling sering pada kecelakaan lalu lintas adalah fraktur. Perancis dan Yunani melaporkan fraktur sebagai temuan ke-2 tersering dalam kecelakaan lalu lintas.2,3Di Indonesia insidensi fraktur mencapai 9.1% pada kasus kecelakaan lalu lintas.4 Seiring dengan angka kecelakaan lalu lintas yang semakin meningkat, insiden fraktur diperkirakan juga akan meningkat.
Salah satu komplikasi dari fraktur yang paling ditakuti oleh ahli bedah ortopedi adalah delayed union ataupun non-union.5 Di Inggris insidensi non-union sekitar 5-10% dengan insidensi fraktur baru sekitar 850 000 kasus per tahun.5Non-union sering menyebabkan pasien harus menjalani perawatan dan operasi berulang sehingga memerlukan biaya pengobatan yang besar. Hal ini mengakibatkan penurunan fungsi dan produktivitas serta kualitas hidup pasien.6 Di Inggris pengobatan non-union memerlukan biaya mencapai Rp 133 000 000 hingga 1 500 000 000. Masalah ini menjadi beban kesehatan di masyarakat oleh karena itu diperlukan suatu strategi untuk mencegah maupun mengobati gangguan penyembuhan ini.
Konsep diamond menjelaskan bahwa pada penyembuhan fraktur, terdapat empat komponen penting, yaitu sel osteogenik, faktor osteoinduktif, scaffold dan fiksasi mekanik.7 Apabila terjadi gangguan pada salah satu faktor ini maka diprediksi akan terjadi gangguan penyembuhan fraktur. Maka dari itu hampir seluruh penelitian di bidang penyembuhan tulang mengacu pada konsep ini.
Banyak penelitian yang menemukan bahwa sel punca mesenkimal mampu mengaugmentasi penyembuhan fraktur tulang.8,9 Augmentasi fraktur selain terjadi pada kasus non-union, juga terjadi pada kasus dengan kehilangan jaringan tulang.8,9Oleh karena itu, sel punca mesenkimal menjadi topik penting penelitian manajemen fraktur.
Sel punca mesenkimal dapat diisolasi dari banyak sumber, terutama dari sumsum tulang.8,10-12Walaupun dilaporkan bahwa sumsum tulang merupakan sumber sel punca mesenkimal yang dapat diandalkan, sumsum tulang hanya mengandung sedikit sel punca mesenkimal sehingga dibutuhkan aspirasi sumsum tulang dalam jumlah yang cukup banyak.11-13 Akan tetapi, jumlah aspirasi sumsum tulang terbatas.12 Hal ini menjadi masalah penting karena jumlah awal sel punca mesenkimal yang cukup diperlukan untuk mencegah adanya proliferasi in vitro ekstensif yang dapat meningkatkan risiko penuaan dan transformasi sel.13 Selain itu, dibutuhkan waktu yang cukup lama, sekitar 3-4 minggu, hingga kultur sel punca hasil aspirasi sumsum tulang untuk mencapai konfluensi. Ekstraksi sumsum tulang juga seringkali menimbulkan trauma bagi donornya (donor site morbidity).12 Oleh karena itu, sumber sel punca mesenkimal lain yang lebih baik perlu dicari.
Isolasi sel punca mesenkimal dari darah perifer menutupi kekurangan yang ditemukan pada isolasi dari sumsum tulang. Jumlah darah yang cukup banyak dapat diperoleh dari sirkulasi perifer dan teknik pengambilannya lebih tidak traumatik dibandingkan pengambilan dari sumsum tulang. Darah perifer memiliki sel punca mesenkimal walaupun dengan jumlah sedikit.11-12 Pemberian Granulocyte Colony Stimulating Factor (GCSF) dapat meningkatkan mobilisasi sel mononuklear pada teknik afaresis untuk sel punca hematopoetik. 13-20
Sampai saat ini belum terdapat penelitian yang mempelajari efek pemberian GCSF pada sel punca mesenkimal darah perifer, maka diperlukan penelitian untuk mempelajari efek pemberian GCSF terhadap kemampuan proliferasi dan diferensiasi sel punca mesenkimal.
1.2 Rumusan Masalah
Hingga saat ini belum ada penelitian untuk mengevaluasi efek pemberian GCSF dalam mobilisasi, proliferasi dan diferensiasi sel punca mesenkimal. Menurut Diamond Concept, sel punca mesenkimal merupakan salah satu modalitas yang kuat dan potensial pada penyembuhan tulang. Sampai saat ini donor dari sel punca mesenkimal diperoleh dari krista iliaka dimana memiliki kelemahan berupa morbiditas donor site dan volume aspirat yang terbatas. Maka dari itu diperlukan suatu penelitian yang dapat mencari alternatif lain dari donor sel punca mesenkimal.
Sel punca mesenkimal yang telah didapat dari induksi GCSF donor seyogyanya memiliki kemampuan proliferasi dan diferensiasi yang sama dengan sel induk. Oleh karena itu diperlukan penelitian yang dapat mengevaluasi kemampuan proliferasi dan diferensiasi dari sel ini.
1.3 Tujuan Penelitian 1.3.1 Tujuan umum
Penelitian ini bertujuan untuk mengetahui efek pemberian GCSF pada mobilisasi, proliferasi dan diferensiasi sel punca mesenkimal.
1.3.2 Tujuan khusus
Diketahui efek GCSF pada jumlah sel punca mesenkimal inisial pada sumsum tulang dan darah perifer.
Diketahui efek GCSF pada waktu konfluensi sel punca mesenkimal inisial pada sumsum tulang dan darah perifer.
Diketahui efek GCSF pada jumlah sel punca mesenkimal konfluensi pada sumsum tulang dan darah perifer.
Diketahui efek GCSF pada kemampuan diferensiasi sel punca mesenkimal pada sumsum tulang dan darah perifer menjadi osteoblas.
mesenkimal inisial pada sumsum tulang dan darah perifer.
Diketahui potensi darah perifer sebagai donor sel punca mesenkimal.
1.4 Kegunaan Penelitian
Tatalaksana fraktur terutama pada kasus dengan penyulit non-union dan kehilangan jaringan masih menjadi masalah besar di bidang orthopaedi. Sel punca mesenkimal berpotensi menjadi solusi untuk masalah-masalah tersebut. Untuk memaksimalisasi keuntungan potensial sel punca mesenkimal, penelitian-penelitian pendukung sangat diperlukan terutama yang berkaitan dengan sumbernya.
BAB II
KAJIAN PUSTAKA, KERANGKA PEMIKIRAN, DAN HIPOTESIS
2. 1 Rekayasa Jaringan dengan Sel Punca Mesenkimal
Rekayasa jaringan adalah suatu ilmu pengetahuan multidisipliner mengenai regenerasi jaringan dan restorasi organ dengan implantasi sel atau jaringan yang dikembangkan diluar tubuh atau dengan stimulasi sel untuk tumbuh dalam suatu matriks yang diimpantasi.21 Langkah-langkah dalam proses rekayasa jaringan dimulai dari pengambilan sel dari donor, penanaman ke dalam scaffold, stimulasi proliferasi dan diferensiasi, serta penanaman kembali dalam organ pasien.22 Secara umum dapat dikatakan bahwa rekayasa jaringan membutuhkan 3 komponen, yaitu sel yang responsif (misalnya sel punca), stimulus yang merangsang pertumbuhan (growth factor), dan scaffold untuk menunjang formasi jaringan.22-23 Tujuan dari penggabungan tiga komponen ini adalah untuk menciptakan konstruksi tiga dimensi yang stabil dan berfungsi secara baik in vivo.
2. 1. 1 Sel punca
Untuk mendapatkan perbaikan jaringan yang stabil, beberapa kriteria harus terpenuhi:
21-25
1) Terdapatnya jumlah sel dan jaringan yang cukup untuk mengisi defek
2) Sel dapat berdiferensiasi menjadi fenotip yang tepat dan dapat tetap dipertahankan
3) Sel atau jaringan dapat hidup dalam lingkungan yang tepat dan menghasilkan matriks ekstraseluler
4) Sel atau jaringan secara struktur dan mekanis cocok dengan jaringan yang akan diperbaiki
5) Dapat membentuk vaskularisasi jika diperlukan 6) Bebas dari reaksi imunologis
Pemenuhan kriteria tersebut sangatlah bergantung pada kualitas dari materi awalnya dan ketersediaan sel yang cocok. Salah satu sel yang memenuhi kriteria di atas adalah sel punca.
Sel punca didefinisikan sebagai sel-sel klonogenik tinggi dengan kemampuan mengembangbiakkan dirinya sendiri dan berdiferensiasi multilineage.24 Sel punca merupakan sumber dari semua jaringan baru yang berperan dalam proses repair dan remodeling. Sel punca mula-mula dibebaskan dari jaringan dan di kultur dalam suatu kondisi yang mendorong aktivasi dan proliferasi dan sel punca dan sel progenitor. Sel punca kemudian diteruskan oleh sel progenitor dimana terdapat perbedaan pada kapasitas memperbarui diri dan kemampuan beregenerasi.23-25 Sel punca meneruskan diri menjadi sel progenitor kemudian diteruskan lagi menjadi preosteoblas lalu akhirnya menjadi osteoblas.
Tiga ukuran dasar dari potensi sel ini adalah: (i) totipoten, yang dapat membentuk seluruh sel dan jaringan yang berkontribusi dalam pembentukan sebuah organisme (misalnya, telur yang dibuahi atau zigot); (ii) pluripoten, yang dapat membentuk paling banyak, tetapi bukan seluruh sel atau jaringan dari sebuah organisme (misalnya, batang embrionik (embryonic stem) dan sel-sel benih (embryonic germ); dan (iii) multipoten, yang dapat membentuk sejumlah kecil sel atau jaringan yang sebenarnya terbatas pada suatu lapisan benih (germ) tertentu, seperti terlihat di dalam stroma sumsum tulang (bone marrow stromal) atau sel punca mesenkimal.
Berdasarkan sumbernya, sel punca dapat dikelompokkan menjadi: (i) sel punca somatis, yaitu yang dijumpai pada bagian atau jaringan tertentu di dalam tubuh dan penting untuk memelihara integritas jaringan, seperti kulit, tulang, dan darah. Termasuk dalam golongan ini adalah sel punca
dari sumsum tulang, sel punca saraf, sel punca dermal (keratinosit), dan sel punca dari darah tali pusat janin; (ii) sel punca embrionik, yaitu sel punca yang terisolasi dari massa sel di bagian dalam blastokis sebelum implantasi dan diturunkan oleh tikus, primata, dan manusia.24
2.1.1.1 Sel punca mesenkimal
Sel punca mesenkimal dapat ditemukan di stroma sumsum tulang, dan mampu melakukan replikasi jaringan secara ekstensif. Sel punca mesenkimal yang tidak terikat (uncommitted) telah diidentifikasi di dalam otot skeletal, dermis, sumsum tulang, dan membran sinovial pada manusia dewasa. Menurut International Society for Cellular Therapy terdapat 3 kriteria minimal suatu sel dinyatakan sebagai sel punca mesenkimal, yaitu : sel bersifat plastic-adherent saat proses kultur, bersifat imunoselektif positif pada CD105, CD73, CD90 dan imunoselektif negatif pada CD45, CD34, CD14 atau CD11b, CD97 alpha atau CD19 dan HLA-II. Yang terakhir adalah sel punca mesenkimal mampu berdiferensiasi invitro menjadi osteoblas, adipoblas, dan kondroblas. Diferensiasi ini dapat diperoleh dengan manipulasi sederhana pada lingkungan kultur dan media biokemikal.2 6
2.1.1.2 Osteoblas
Sel punca mesenkimal jika dikultur pada media yang tepat akan berdiferensiasi menjadi osteoblas.28-29 Media kultur yang digunakan untuk diferensiasi ini sangat spesifik diperuntukkan untuk osteoblas. Media kultur ini terdiri dari deksametason, asam askorbat, β-gliserofosfat. Setelah dua minggu diinduksi, sel punca mesenkimal yang fibroblastik akan menjadi sel osteoblastik.30 Tiga minggu kemudian, akan terbentuk nodul-nodul yang termineralisasi. Kemampuan diferensiasi osteoblas ini dapat dinilai dengan mengukur aktivitas fosfatase alkali dan nodul-nodul yang termineralisasi tersebut. Perubahan menjadi osteoblas terjadi secara bertahap melalui
perubahan morfologi menjadi bentuk kuboidal lalu diikuti oleh induksi transien dari fosfatase alkali.31 Kemudian mRNA mengekspresikan protein yang membentuk matriks tulang dan diikuti oleh deposisi dari mineral hidroksiapatit pada matriks ekstraseluler. Untuk mengetahui seluruh proses diatas dapat melalui observasi terhadap antibodi monoklonal dari permukaan sel punca mesenkimal. Antibodi ini spesifik untuk fenotipe osteoblas dan keberadaannya mampu membantuk kita untuk mengerti proses diferensiasi dan lineasi. Cara yang sederhana untuk mengevaluasi adanya osteoblas adalah mengukur kadar fosfatase alkali dan nodul yang termineralisasi dengan pewarnaan (staining) Alizarin Red. 32-33 Fosfatase alkali adalah cermin dari aktivitas osteoblas. Alizarin Red mampu memberikan pewarnaan oranye merah terang jika terdapat nodul deposit kalsium sebagai petanda terjadinya diferensiasi osteoblas. Cara yang paling mutakhir untuk identifikasi adalah dengan teknologi genetika yaitu PCR (polymerase chain reaction) dengan mengevaluasi sintesis mRNA dari berbagai gen spesifik osteoblas sebagai contoh Cbfa1 dan osteonectin.34
2.2 Granulocyte Colony Stimulating Factor (GCSF)
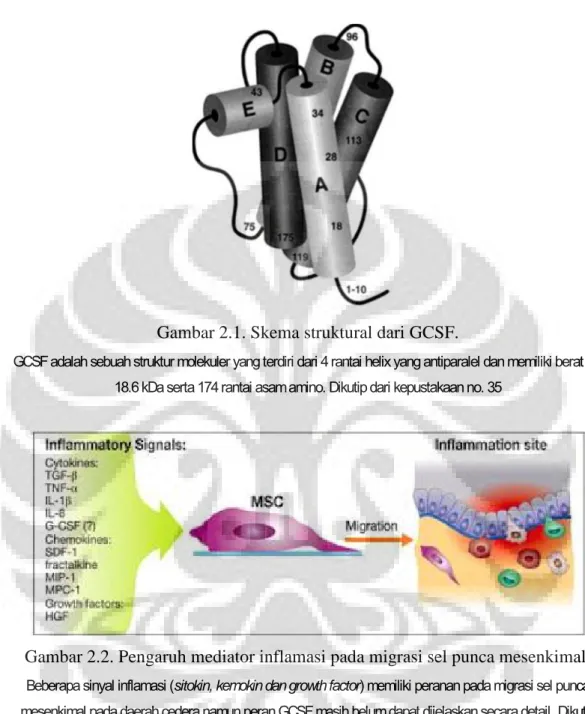
GCSF adalah suatu sitokin yang ditemukan secara tidak sengaja pada suatu penelitian yang bertujuan mencari regulator normal pada sel supernatan yang dapat menginduksi diferensiasi terminal pada sel leukemik mieloid murine.35 Sitokin ini memiliki berat inti sebesar 18.6 kDa, memiliki 174 rantai asam amino dan terdiri dari 4 rantai helix yang antiparalel (Gambar 2.1). GCSF diproduksi secara alami oleh tubuh dimana protein ini merupakan suatu colony-stimulating factor (CSF) yang mampu merangsang sumsum tulang untuk memproduksi galur granulosit terutama neutrofil.36 Dikenal pula CSF lain yang telah berhasil diisolasi dan dikarakterisasi selain GCSF yaitu granulocyte-macrophage CSF (GM-CSF), macrophage CSF (M-CSF) dan interleukin-3 (IL-3, atau disebut juga multi-CSF). Namun hanya dua preparat yaitu GCSF dan GM-CSF yang
tersedia secara komersial dalam bentuk rekombinan.37 GCSF endogen diproduksi oleh monosit, fibroblas dan sel endotelial. GCSF secara sintetik dihasilkan dari rekayasa genetik bakteri Escherichia Coli dengan nama generik r-metHuG-CSF atau lebih dikenal dengan nama r-GCSF (recombinant-GCSF). GCSF pertama kali diperkenalkan pada tahun 1984 dan telah lolos uji klinik dan FDA (Food and Drug Association) sejak tahun 1986 dengan nama dagang Filgastrim®.
Saat ini GCSF telah digunakan di 70 negara sebagai terapi augmentasi neutrofil pada pasien pasca kemoterapi dimana terjadi mielosupresi, severe chronic neutropenia, dan sindrom mielodisplastik. Penggunaan GCSF membuka jalan baru untuk para penderita kanker dimana mereka dapat diterapi dengan dosis penuh obat kemoterapi. GCSF juga telah diaplikasikan secara klinis dengan teknik afaresis untuk mengaugmentasi resistensi pasien terhadap infeksi dengan meningkatkan respons neutrofil pada pasien dengan granulositopenia.37-38 Dosis terapi yang digunakan untuk mencapai efek ini adalah sebesar 10mcg/kg berat badan/hari selama 7 hari. Pemberian GCSF ini dapat melalui subkutan maupun intravena. Secara farmakokinetik GCSF memiliki waktu paruh 3.5 jam (baik pada pemberian subkutan maupun intravena), klirens 0.5-0.7ml/menit/kg berat badan dan tidak terdapat akumulasi dari obat.
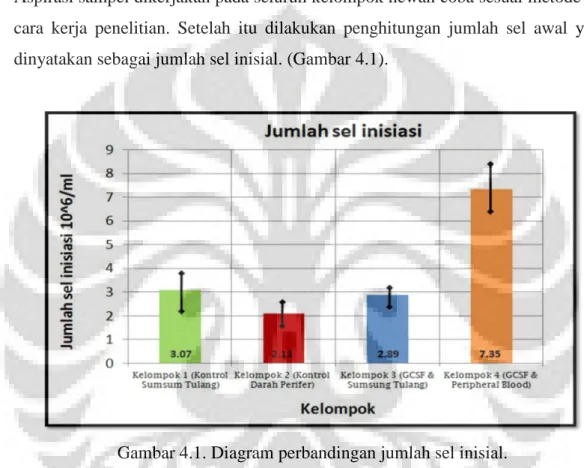
Pada tahun 1993, GCSF telah digunakan untuk mobilisasi sel progenitor pada darah perifer. Hal ini dibuktikan dengan adanya peningkatan dari sel progenitor pada darah perifer pada hari ke-lima setelah pemberian GCSF. Namun efek lebih lanjut dari mobilisasi ini belum banyak dipelajari.39-41 Pevsner-Fischer, dkk menyatakan bahwa terdapat beberapa sitokin (Transforming Growth Factor Beta / TGF-, Tumor Necrosis Factor alpha / TNF-, Interleukin-1B / IL-1B, Interleukin-8 / IL-8, GCSF), kemokin (Stromal derived factor-1 / SDF-1, Macrophage inflammatory protein-1 / MIP-1, fractalkine, Monocyte chemoattractant protein-1 / MCP-1) dan growth factor (Hepatocyte growth factor/ HGF) tertentu yang merangsang migrasi dan mobilisasi dari sel punca mesenkimal.42Namun, peran GCSF masih belum dapat dijelaskan. (Gambar 2.2)
Gambar 2.1. Skema struktural dari GCSF.
GCSF adalah sebuah struktur molekuler yang terdiri dari 4 rantai helix yang antiparalel dan memiliki berat inti 18.6 kDa serta 174 rantai asam amino. Dikutip dari kepustakaan no. 35
Gambar 2.2. Pengaruh mediator inflamasi pada migrasi sel punca mesenkimal. Beberapa sinyal inflamasi (sitokin, kemokin dan growth factor) memiliki peranan pada migrasi sel punca mesenkimal pada daerah cedera namun peran GCSF masih belum dapat dijelaskan secara detail. Dikutip
2. 3 Kerangka Pemikiran
2. 3.2 Kerangka Konsep
Kotak dengan garis putus-putus menandakan profil yang diobservasi dan kotak dengan garis tebal menandakan variabel yang diteliti.
2.4 Hipotesis Penelitian 2.4.1. Hipotesis utama
Sel punca mesenkimal yang diisolasi dari sumsum tulang, darah perifer, sumsum tulang dengan pemberian GCSF dan darah perifer dengan pemberian GCSF dapat diisolasi, berproliferasi dan berdiferensiasi menjadi osteoblas.
2.4.2. Hipotesis turunan
2.4.2.1 Terdapat perbedaan jumlah sel inisial antara sel punca mesenkimal yang diisolasi dari sumsum tulang, darah perifer, sumsum tulang dengan pemberian GCSF, dan darah perifer dengan pemberian GCSF. 2.4.2.2 Terdapat perbedaan waktu konfluensi antara sel punca mesenkimal
yang diisolasi dari sumsum tulang, darah perifer, sumsum tulang dengan pemberian GCSF, dan darah perifer dengan pemberian GCSF. 2.4.2.3 Terdapat perbedaan jumlah sel konfluensi antara sel punca
mesenkimal yang diisolasi dari sumsum tulang, darah perifer, sumsum tulang dengan pemberian GCSF, dan darah perifer dengan pemberian GCSF.
2.4.2.4 Terdapat perbedaan waktu diferensiasi antara sel punca
mesenkimal yang diisolasi dari sumsum tulang, darah perifer, sumsum tulang dengan pemberian GCSF, dan darah perifer dengan pemberian GCSF.
BAB III
METODE PENELITIAN
3.1 Desain dan Tempat Penelitian
Penelitian ini merupakan penelitian laboratorium eksperimental dengan desain post test only, one arm group, bertempat di Laboratorium Bimana, Pusat Studi Satwa Primata (PSSP) di Institut Pertanian Bogor.
3.2 Populasi dan Sampel
Sampel penelitian diambil dari kelinci New Zealand White.
Besar sampel untuk penelitian ditentukan dengan menggunakan rumus Federer.43 (n-1) (k-1) ≥ 15
(n-1) (4-1) ≥ 15 n-1 ≥ 5
n ≥ 6/kelompok
Untuk empat kelompok studi didapatkan besar sebesar 6 sampel per kelompok. Dengan asusmsi drop out sebesar 20% dibutuhkan 28 sampel dengan masing-masing 7 sampel di setiap kelompok. Sesuai dengan prinsip eksperimen pada hewan coba, jumlah sampel mempertimbangkan prinsip 3 R yaitu replacement, reduction dan refinement. Mengingat prinsip ini maka saran dari komite kaji etik, jumlah sampel direduksi menjadi 14 sampel. Hewan coba dibagi menjadi 2 kelompok besar yaitu kelompok dengan pemberian GCSF (perlakuan) dan tanpa pemberian GCSF (kontrol). Pada satu kelompok besar, masing-masing kelompok hewan akan diambil darah perifer dan sumsum tulangnya.
Secara sistematik kelompok penelitian dibagi menjadi 4:
Kelompok 1 : Kelompok kontrol sumsum tulang
Kelompok 2 : Kelompok kontrol darah perifer
Kelompok 3 : Kelompok perlakuan sumsum tulang
3.3 Kriteria Penelitian 3.3.1 Kriteria inklusi
1. Kelinci matur skeletal dengan berat badan 2 kg 2. Kelinci sehat
3.3.2 Kriteria eksklusi 1. Kelinci sakit
3.4 Alur Penelitian
14 kelinci New Zealand White matur skeletal
berat 2 kg Alokasi acak Kontrol Perlakuan Kelompok 1 (sumsum tulang) Kelompok 2 (darah perifer) Kelompok 3 (sumsum tulang) Kelompok 4 (darah tepi) Penyuntikan GCSF 10g/kg/hari selama 7 hari
Aspirasi sumsum tulang Aspirasi darah tepi Aspirasi sumsum tulang Aspirasi darah tepi
Kultur dengan DMEM pada suhu 37C, 5% CO2, 20% O2hingga konfluens
(waktu dan jumlah sel konfluensi dicatat)
Diferensiasi osteoblas dalam media osteogenik
3.5 Variabel Penelitian
3.5.1 Variabel independen : Pemberian GCSF 3.5.2 Variabel dependen :
Jumlah sel inisial
Waktu konfluensi
Jumlah sel konfluensi
Waktu diferensiasi
3.6 Definisi Operasional
1. Sel punca mesenkimal dinyatakan sebagai sel punca non hematogenik hasil isolasi dari sumsum tulang atau dari darah perifer yang memenuhi kriteria dari International Society for Cellular Therapy secara morfologi, karakteristik antibodi dan kemampuan diferensiasi.
2. GCSF (atau r-GCSF) adalah sitokin hasil rekayasa genetik dari bakteri Escherichia Coli dengan berat inti 18.6 kDa dan memiliki 174 rantai asam amino.
3. Proliferasi adalah kemampuan sel untuk memperbanyak diri, diukur dengan jumlah sel saat konfluensi dan waktu konfluensi.
4. Diferensiasi adalah adaptasi struktural untuk menjadi berbagai galur, salah satunya osteoblas.
5. Osteoblas adalah sel yang menghasilkan tulang melalui pembentukan matrik yang pada evaluasi mikroskopik memiliki bentuk kuboidal dan terwarnai dengan Alizarin Red sebagai nodul merah bata.
6. Jumlah sel inisial adalah jumlah sel saat isolasi sel punca mesenkimal dan dihitung memakai hemositometer (kamar hitung improved Neubauer) dalam mikroskop cahaya dan dinyatakan jumlahnya per mL.
7. Waktu konfluensi adalah waktu yang diperlukan kultur sel punca mesenkimal untuk mencapai konfluensi > 80% dari lapang pandang dalam evaluasi mikroskop cahaya. Waktu dinyatakan dalam hari,
terhitung dari hari pertama kultur.
8. Jumlah sel konfluensi adalah jumlah sel saat tercapai keadaan konfluensi dan dihitung memakai hemositometer (kamar hitung improved Neubauer) dalam mikroskop cahaya dan dinyatakan jumlahnya per mL.
9. Waktu diferensiasi adalah waktu yang diperlukan oleh sel punca mesenkimal untuk diinduksi menjadi galur osteoblas. Waktu dinyatakan dalam hari, terhitung dari hari pertama dalam induksi medium osteogenik.
3.7 Cara Kerja Penelitian 3.7.1 Persetujuan etik
Penelitian ini telah mendapat persetujuan etik dari Animal Care and Use Committee (ACUC) dari Laboratorium PSSP Bogor dengan nomor R.04-13-IR.
3.7.1 Aklimatisasi hewan coba
Sebelum dilakukan intervensi, seluruh hewan coba dipelihara selama 1 minggu untuk aklimatisasi.44
3.7.2 Pemeliharaan hewan coba
Hewan coba dipelihara dalam kandang tersendiri pada suhu ruangan 25-28C . Semua hewan coba diberikan pakan pelet khusus kelinci ad libitum dan memiliki akses ke air matang.
3.7.3 Anestesi hewan coba
Anestesi dilakukan dengan cara pemberian ketamin 35 mg/kilogram berat badan dan xylazine 5mg/kilogram berat badan secara intramuskular.
3.7.3 Aspirasi sumsum tulang
Setelah kelinci dianestesi, dalam posisi pronasi, sumsum tulang diaspirasi dari krista iliaka sebanyak 8 mL dengan menggunakan spuit 18G volume 10mL yang telah berisi heparin 1000 unit sebanyak 2 mL untuk mencegah pembekuan darah.
Jarum aspirasi dimasukkan ke krista iliaka dengan sudut 45°. Sumsum tulang diaspirasi dengan menarik karet plunger spuit ke belakang secara perlahan. Sumsum tulang hasil aspirasi tersebut dipindahkan ke tabung polipropilen 15 mL yang steril (Vacuette). Jarum aspirasi dilepaskan dan tekanan diberikan pada kulit dan dirawat dengan kassa steril dan plester. Sampel dibawa ke laboratorium kultur dalam wadah steril.
3.7.4 Aspirasi darah perifer
Setelah kelinci donor dianestesi, darah perifer diaspirasi dari vena di daerah telinga sebanyak 8 mL dengan menggunakan jarum wing needle dan spuit yang telah berisi heparin 1000 unit sebanyak 2 mL untuk mencegah pembekuan darah. Darah diaspirasi dengan menarik karet plunger spuit ke belakang secara perlahan. Darah hasil aspirasi tersebut dipindahkan ke tabung polipropilen 15 mL yang steril (vacuette). Jarum aspirasi dilepaskan dan tekanan diberikan pada kulit dan dirawat dengan kassa steril dan plester. Sampel dibawa ke laboratorium kultur dalam wadah steril.
3.7.5 Penyuntikan GCSF
Penyuntikan GCSF dilakukan secara subkutan setiap hari selama 7 hari dengan dosis 10 μg/kilogram berat badan/hari. Satu hari setelah injeksi terakhir, subjek penelitian siap digunakan sebagai donor sel punca kelompok perlakuan.
3.7.6 Isolasi dan kultur sel punca mesenkimal
Cairan Phosphate Buffer Saline (PBS) dalam jumlah yang sama yaitu 8 mL ditambahkan untuk mengencerkan aspirat. Selanjutnya PBS dan aspirat dicampur merata dengan menghisap ke atas dan ke bawah menggunakan pipet serologis 10 mL. Campuran kemudian disentrifus dengan kecepatan 2500 rpm selama 15 menit pada suhu 200 C. Proses kultur dikerjakan pada biological safety level cabinet level II. Pellet lalu diresuspensi dengan media low glucose Dulbecco’s modified eagles medium atau DMEM (Gibco, Grand Island, New York) dan kemudian dibagi dalam botol kultur berukuran 25 cm2 (Tissue Culture flasks)
ventilated cap. Sel tersebut dikultur dalam 8 mL media kultur DMEM yang mengandung 1000 mg/L D-glucose, L-glutamin, dan 110 mg/L sodium piruvat, dan 10% fetal bovine serum (FBS) dan diinkubasi selama satu minggu pada suhu 370, dengan aliran oksigen 20%, CO25%. Pada akhir minggu pertama, media dikeluarkan dengan hati-hati. Kultur dicuci beberapa kali dengan PBS, dan diisi kembali dengan medium kultur yang segar setiap 3 hari sampai terjadi konfluensi. Jumlah sel inisial, waktu konfluensi dan jumlah sel konfluensi dihitung.
3.7.7 Karakterisasi sel punca mesenkimal
Konfirmasi sel punca mesenkimal dilakukan dengan karakterisasi. Sel yang telah konfluens dicuci dengan PBS dan diinkubasi selama 30 menit dengan PE-conjugated mouse monoclonal anti-human CD73 (BD Biosciences, San Jose, CA), PE-conjugated mouse monoclonal anti-CD90 (Abcam, Cambridge, UK) dan FITC-conjugated mouse monoclonal anti-human CD34 (BD Biosciences, San Jose, CA). Ekspresi dari marker tersebut dideteksi oleh flowsitometri (FACSCalibur, Franklin Lakes, NJ).
3.7.8 Diferensiasi osteoblas
Kultur sel punca mesenkimal yang telah mengalami konfluensi siap untuk didiferensiasi menjadi osteoblas. Diferensiasi dilakukan dengan cara memindahkan sel punca mesenkimal ke dalam 8 mL medium osteogenik yang mengandung 100nM dexamethasone (Sigma, St Louis, MI, USA), 10 mm beta-glycerol phosphate (Sigma), and 50 µ m ascorbic acid 2- phosphate (Sigma) dan diinkubasi dalam suhu 37o, 20% O2, dan 5% CO2. Setelah 7 hari, kultur dicuci beberapa kali dengan PBS dan medium diganti dengan medium kultur yang segara setiap 3 hari hingga mencapai konfluensi. Morfologi sel diobservasi seiring pergantian medium dengan mikroskop cahaya. Sel osteoblas yang diamati akan berbentuk kuboidal dan berwarna tembaga gelap.
3.7.9 Konfirmasi diferensiasi
Sel yang diinkubasi dibuang mediumnya. Lalu dicuci dengan PBS yang tidak mengandung Ca2+ dan Mg2+. Setelah itu PBS diaspirasi secara perlahan dan dilakukan fiksasi pada sel monolayer dengan cairan buffered formalin (10%) selama 30 menit. Lalu cairan buffered formalin diaspirasi dengan hati-hati. Campurkan 2 gram Alizarin Red dalam 100 mL air destilasi hingga tercapai pH 4.1 - 4.3 dengan 0.1% NH4OH untuk mendapatkan solusio Alizarin Red. Sel monolayer yang sudah difiksasi diwarnai dengan solusio Alizarin Red selama 45 menit dalam suhu ruang dan di tempat yang gelap. Setelah itu solusio Alizarin Red diaspirasi dan sel monolayer dicuci kembali selama 4 kali dengan air destilasi dan dibuang. Evaluasi dari deposit kalsium diamati secara makroskopis dan mikroskopis. Hasil yang positif akan didapatkan deposit kalsium berbentuk nodul-nodul yang memberikan warna merah bata.
3. 8 Analisis data
Analisis data dilakukan dengan menggunakan uji ANOVA one way dan dilanjutkan dengan analisis posthoc bonferroni dan tamhane menggunakan program SPSS v.16. Hasil konfirmasi diferensiasi akan dipaparkan secara deskriptif dengan gambar.
3.9 Implikasi penelitian
Penelitian ini merupakan penelitian pertama kali yang menilai efek pemberian GCSF secara invivo terhadap kemampuan mobilisasi, proliferasi dan diferensiasi dari sel punca mesenkimal kearah osteoblas secara invitro. Pemberian GCSF meningkatkan jumlah sel inisial, mempersingkat durasi kultur, meningkatkan jumlah sel konfluensi dan mempersingkat waktu diferensiasi pada sel punca mesenkimal darah perifer. Sel punca mesenkimal darah perifer mampu menjadi donor sel punca mesenkimal. Selanjutnya diperlukan penelitian lebih lanjut untuk mengevaluasi efek pemberian GCSF pada sel punca mesenkimal manusia.
3.10 Keterbatasan Penelitian
Penelitian ini merupakan penelitian pada hewan coba kelinci namun memakai dosis GCSF pada manusia. Kelinci memiliki tingkat metabolisme yang berbeda dari manusia maka dari itu farmakodinamik dari GCSF pada kelinci akan berbeda. Dosis yang dipergunakan adalah dosis terapi pada pasien kemoterapi yang akan menjalani leukapheresis dimana belum didapatkan dosis baku untuk terapi sel punca mesenkimal saat ini.
Pada penelitian ini terlihat bahwa sel punca mesenkimal yang diterapi dengan GCSF mampu berdiferensiasi menjadi osteoblas. Pada penelitian ini eksistensi osteoblas hanya dibuktikan melalui morfologi dan pewarnaan Alizarin Red, tidak dilakukan pemeriksaan yang lebih detail seperti pemeriksaan fenotip osteoblas melalui metode PCR yaitu Cbfa1, osteocalcin dan osteonectin dan perwarnaan imunohistokimia yaitu antibodi monoklonal dari osteopontin dan osteocalcin.
BAB IV
HASIL PENELITIAN DAN PEMBAHASAN
4.1 Hasil Penelitian 4.1.1 Profil sel inisial
Aspirasi sampel dikerjakan pada seluruh kelompok hewan coba sesuai metode dan cara kerja penelitian. Setelah itu dilakukan penghitungan jumlah sel awal yaitu dinyatakan sebagai jumlah sel inisial. (Gambar 4.1).
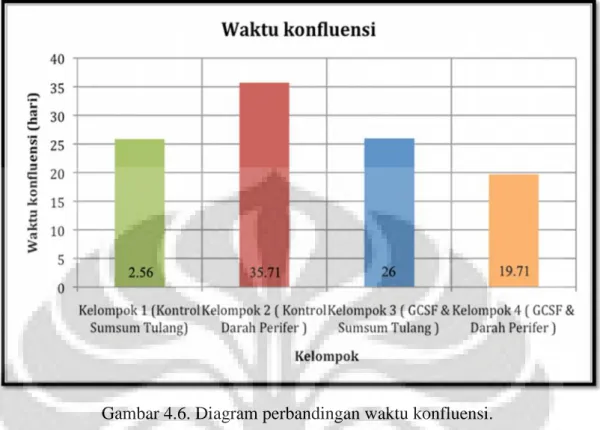
Gambar 4.1. Diagram perbandingan jumlah sel inisial.
Pada diagram batang diatas tampak kelompok perlakuan darah perifer memiliki jumlah sel inisial terbanyak (7,35x106/mL), diikuti secara berurutan oleh kelompok kontrol sumsum tulang (3.07x106/mL), kelompok
perlakuan sumsum tulang (2.88x106/mL), dan kelompok kontrol darah perifer (2.11x106/mL).
Pada diagram batang terlihat bahwa kelompok perlakuan darah perifer memiliki jumlah sel inisial terbanyak diikuti secara berurutan oleh kelompok kontrol sumsum tulang, perlakuan sumsum tulang, dan kelompok kontrol darah perifer. Kelompok perlakuan darah perifer memiliki jumlah sel inisial sekitar 2.3–3.4 kali lipat dibandingkan dengan kelompok lain. Observasi dari sel dilakukan setiap 3 hari (gambar 4.3, 4.4, 4.5).
Masing-masing kelompok sel dikultur sehingga tercapai konfluensi. Konfluensi sel dievaluasi dengan mikroskop cahaya (gambar 4.6). Waktu yang dibutuhkan untuk mencapai konfluensi dihitung dan dinyatakan dalam hari.
Gambar 4.2. Sel mononuklear.
Observasi sel inisial dengan mikroskop cahaya (pembesaran 80x), tampak sel mononuklear yang melekat pada dasar botol kultur setelah 1 minggu inkubasi.
Gambar 4.3. Sel punca mesenkimal minggu 1.
Gambar 4.4. Sel punca mesenkimal minggu 2.
Pada akhir minggu kedua sel tampak semakin padat dan melekat pada dasar botol kultur (pembesaran 80x).
Gambar 4.5. Sel punca mesenkimal konfluens.
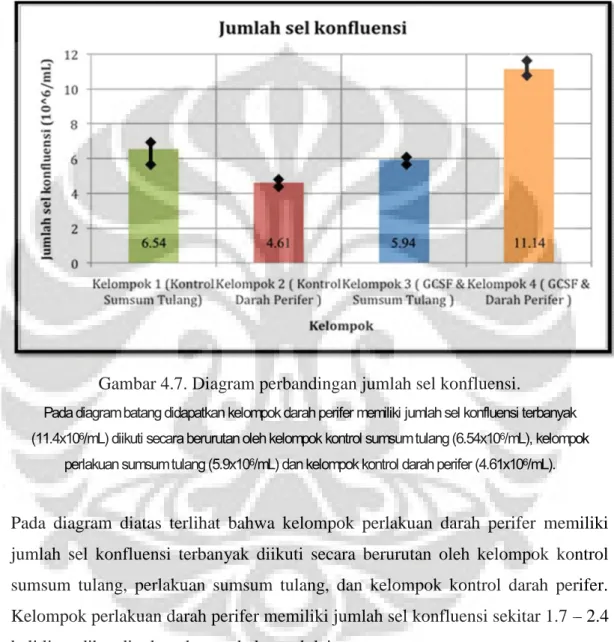
Gambar 4.6. Diagram perbandingan waktu konfluensi.
Pada diagram batang didapatkan kelompok darah perifer memiliki durasi konfluensi tersingkat (19.7 hari) diikuti secara berurutan oleh kelompok kontrol sumsum tulang (25.8 hari), kelompok perlakuan sumsum
tulang ( 26 hari) dan kelompok kontrol darah perifer (35.71 hari).
Pada diagram batang diatas terlihat bahwa kelompok perlakuan darah perifer memiliki waktu konfluensi tercepat diikuti secara berurutan oleh kelompok kontrol sumsum tulang, perlakuan sumsum tulang, dan kelompok kontrol darah perifer. Kelompok perlakuan darah perifer memiliki kecepatan konfluensi hampir 1.3 – 1.8 kali lipat dibandingkan dengan kelompok lain.
4.1.2 Proliferasi sel
Saat sel mengalami konfluensi, dilakukan pula penghitungan jumlah sel pada masing masing kelompok dan dinyatakan sebagai jumlah sel konfluensi.
Gambar 4.7. Diagram perbandingan jumlah sel konfluensi.
Pada diagram batang didapatkan kelompok darah perifer memiliki jumlah sel konfluensi terbanyak (11.4x106/mL) diikuti secara berurutan oleh kelompok kontrol sumsum tulang (6.54x106/mL), kelompok
perlakuan sumsum tulang (5.9x106/mL) dan kelompok kontrol darah perifer (4.61x106/mL).
Pada diagram diatas terlihat bahwa kelompok perlakuan darah perifer memiliki jumlah sel konfluensi terbanyak diikuti secara berurutan oleh kelompok kontrol sumsum tulang, perlakuan sumsum tulang, dan kelompok kontrol darah perifer. Kelompok perlakuan darah perifer memiliki jumlah sel konfluensi sekitar 1.7 – 2.4 kali lipat dibandingkan dengan kelompok lain.
4.1.3 Diferensiasi sel
Setelah mengalami konfluensi, sel diinduksi agar berdiferensiasi ke arah osteoblas (gambar 4.6). Hasil diferensiasi ke galur osteoblas dikonfirmasi dengan pewarnaan Alizarin Red (gambar 4.7).Waktu yang diperlukan untuk mencapai morfologi osteoblas dihitung dan dinyatakan dalam hari.
Gambar 4.8. Osteoblas.
Pada hasil diferensiasi sel punca mesenkimal, tampak sel menjadi lebih kuboidal sesuai dengan morfologi osteoblas (pembesaran 160x).
Gambar 4.9. Pewarnaan Alizarin Red.
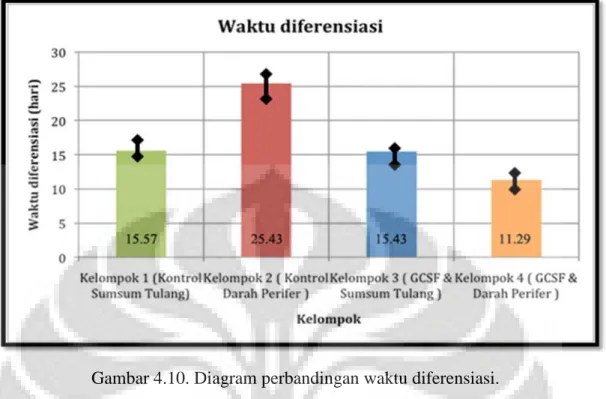
Gambar 4.10. Diagram perbandingan waktu diferensiasi.
Pada diagram batang didapatkan kelompok darah perifer memiliki durasi diferensiasi tersingkat (11.2 hari) diikuti secara berurutan oleh kelompok perlakuan sumsum tulang (15.4 hari), kelompok kontrol sumsum
tulang ( 15.57 hari) dan kelompok kontrol darah perifer (25.43 hari).
Pada diagram terlihat bahwa kelompok perlakuan darah perifer memiliki waktu diferensiasi tercepat diikuti secara berurutan oleh perlakuan sumsum tulang, kontrol sumsum tulang, dan kelompok kontrol darah perifer. Kelompok perlakuan darah perifer memiliki kecepatan diferensiasi hampir 1.6 – 2.2 kali lipat dibandingkan dengan kelompok lain.
4.2 Analisis Penelitian
Data penelitian diolah menggunakan SPSS v.16. Jenis analisis data yang dipakai mempertimbangkan skala pengukuran data, jumlah kelompok studi dan distribusi data. Pada penelitian ini digunakan analisis one way ANOVA karena skala pengukuran numerik, jumlah kelompok lebih dari dua kelompok dan distribusi data dianggap normal (koefisien varians < 30%). Koefisien varians didapatkan dari perbandingan antara simpangan baku dengan rerata.
Hasil analisis one way ANOVA dipaparkan pada tabel sebagai berikut
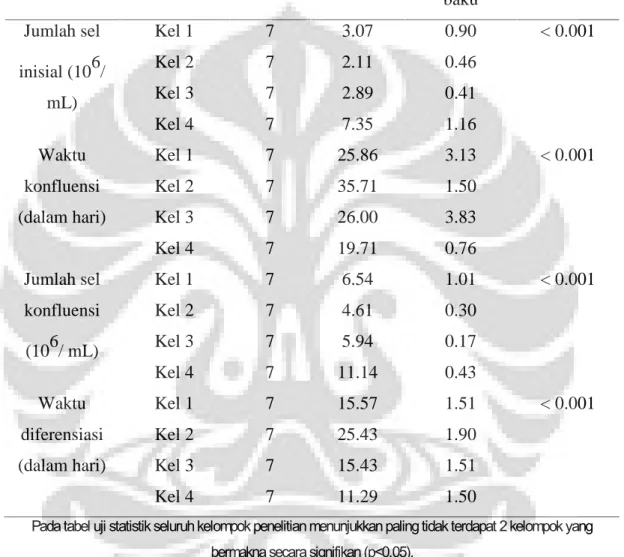
Tabel 4.1. Perbandingan jumlah sel, waktu konfluensi, jumlah sel konfluensi dan waktu diferensiasi antar kelompok
Variabel Kelompok N Rerata Simpangan
baku Nilai p Jumlah sel inisial (106/ mL) Kel 1 Kel 2 Kel 3 Kel 4 7 7 7 7 3.07 2.11 2.89 7.35 0.90 0.46 0.41 1.16 < 0.001 Waktu konfluensi (dalam hari) Kel 1 Kel 2 Kel 3 Kel 4 7 7 7 7 25.86 35.71 26.00 19.71 3.13 1.50 3.83 0.76 < 0.001 Jumlah sel konfluensi (106/ mL) Kel 1 Kel 2 Kel 3 Kel 4 7 7 7 7 6.54 4.61 5.94 11.14 1.01 0.30 0.17 0.43 < 0.001 Waktu diferensiasi (dalam hari) Kel 1 Kel 2 Kel 3 Kel 4 7 7 7 7 15.57 25.43 15.43 11.29 1.51 1.90 1.51 1.50 < 0.001
Pada tabel uji statistik seluruh kelompok penelitian menunjukkan paling tidak terdapat 2 kelompok yang bermakna secara signifikan (p<0.05).
Uji one way ANOVA memperlihatkan seluruh variabel yang diujikan memiliki nilai p < 0. 001 maka paling tidak ada dua kelompok yang berbeda secara bermakna (p < 0.05). Setelah uji ANOVA, untuk mengetahui kelompok mana yang berbeda dilanjutkan dengan uji post hoc. Untuk itu dilakukan analisis varians dari masing-masing variabel dahulu (tabel 2)
Tabel 4.2. Uji homogenisitas dari varians
Pada uji homogenisitas dari varians didapatkan variable jumlah sel inisial dan waktu diferensiasi memiliki nilai p > 0.05 yang berarti varians sama, maka dilanjutkan dengan analisis posthoc bonferroni. Pada variabel jumlah sel konfluensi dan waktu konfluensi didapatkan nilai p < 0.05 yang berarti varians tidak sama maka
dilanjutkan dengan analisis posthoc Tamhane.
Untuk variabel jumlah sel inisial dan waktu diferensiasi, analisis dilanjutan dengan analisis post hoc Bonferroni karena varians data antar kelompok sama (nilai p pada uji varians > 0.05). Untuk variabel jumlah sel konfluensi dan waktu konfluensi, analisis dilanjutkan dengan analisis post hoc Tamhane karena varians data kelompok tidak sama ( nilai p pada uji varians < 0.05).
Pada variabel jumlah sel inisial dilakukan analisis post hoc Bonferroni. Setelah analisis ini diketahui bahwa perbedaah tersebut ditemukan antara kelompok 1 (kelompok kontrol sumsum tulang) dan kelompok 4 (kelompok perlakuan darah perifer), kelompok 2 (kelompok kontrol darah perifer) dan 4 (kelompok perlakuan darah perifer), dan kelompok 3 (kelompok perlakuan sumsum tulang) dan 4 (kelompok pelakuan darah perifer).
Pada variabel waktu konfluensi dilakukan analisis post hoc Tamhane. Setelah analisis ini diketahui bahwa perbedaan tersebut ditemukan antara semua kelompok kecuali antara kelompok 1 (kelompok kontrol sumsum tulang) dan kelompok 3 (kelompok perlakuan sumsum tulang).
kecuali antara kelompok 1 (kelompok kontrol sumsum tulang) dan kelompok 3 (kelompok perlakuan sumsum tulang).
Pada variabel waktu diferensiasi dilakukan analisis post hoc Bonferroni. Setelah analisis ini diketahui bahwa pebedaan tersebut ditemukan antara semua kelompok kecuali antara kelompok 1 (kelompok kontrol sumsum tulang) dan kelompok 3 (kelompok perlakuan sumsum tulang).
4.3 Pembahasan
Penelitian ini merupakan suatu penelitian eksperimental dengan hewan coba kelinci New Zealand White. Dalam penelitian ini kelompok perlakuan hewan coba diberikan perlakuan berupa administrasi GCSF subkutan selama 1 minggu sebelum aspirasi sampel. Observasi dan evaluasi dilakukan pada semua sampel dan dibandingkan dengan kelompok kontrol. Observasi dan evaluasi ini dimaksudkan untuk menilai kemampuan mobilisasi, proliferasi dan diferensiasi sel punca mesenkimal pada masing-masing kelompok penelitian.
4.3.1 Karakteristik subyek dan perlakuan penelitian
Penelitian yang menggunakan hewan coba seyogyanya mempertimbangkan kepentingan ilmiah dan etik untuk memilih hewan coba. Hewan coba dipilih berdasarkan prinsip tiga “R” yaitu replacement, reduction dan refinement. Hewan coba yang dipilih juga diharapkan dapat mentranslasikan keadaan klinis pada manusia dan secara filogenetik mirip dengan manusia. Berbagai hal teknis seperti harga dan ketersediaan model hewan coba di lapangan juga menjadi bahan pertimbangan.45
Kelinci New Zealand White dipilih sebagai subyek pada studi ini karena memiliki berbagai kelebihan seperti perawatan yang mudah, sifat yang tidak agresif, lebih ekonomis dibandingkan hewan ukuran besar, memiliki jenis galur yang spesifik, memiliki siklus vital yang pendek, memiliki akses volume sumsum tulang dan darah perifer yang cukup memadai melalui sebagai sampel.46-47Selain itu kelinci
New Zealand White juga telah menjadi salah satu hewan coba dari penelitian
preklinik GCSF.48
GCSF memainkan peranan penting dalam proliferasi, maturasi, survival, dan aktivasi dari granulosit dan sel progenitor hematopoetik. GCSF juga merupakan
mobilizer dari sel punca hematopoetik yang efektif dan telah digunakan secara luas
pada prosedur transplantasi sumsum tulang dimana sel progenitor darah perifer diambil sebagai sumber donor.48
4.3.2 Mobilisasi sel punca mesenkimal oleh GCSF
Pada penelitian ini jumlah sel inisial terdapat paling banyak pada kelompok perlakuan darah perifer. Perbedaan yang bermakna diperlihatkan diantara kelompok kontrol darah perifer dengan seluruh kelompok lain. Maka dapat disimpulkan bahwa GCSF mampu meningkatkan sel punca mesenkimal pada darah perifer.
Mekanisme secara detail dari mobilisasi sel punca mesenkimal ke darah perifer selama pemberian GCSF belum dapat dijelaskan secara detil sepenuhnya. Diduga ini terjadi karena GCSF merangsang proliferasi sel tersebut dan kemampuan proliferasi ini menyebabkan pergeseran sel ini ke darah perifer.49Hal ini sebagai efek dari pergeseran sel left side yaitu kearah galur imatur. Salah satu contoh dari sel imatur ini adalah sel punca mesenkimal.50-55 Martinez, dkk56 secara invitro meneliti dalam migration chamber system, menunjukkan bahwa proporsi dari jumlah sumsum punca mesenkimal sumsum tulang berkurang pemberian GCSF. Peningkatan jumlah sel punca mesenkimal di darah perifer juga diduga sebagai efek dari sitokin yang merangsang “pergeseran”. Sitokin yang diduga berperan dalam migrasi sel punca mesenkimal adalah TGF-, IL-1, TNF-, dan SDF-1 dan GCSF. Namun efek GCSF belum dapat dijelaskan secara detail dalam penelitian ini. Hal ini menyimpulkan bahwa bukti langsung mobilisasi sel punca mesenkimal akibat sitokin belum lengkap secara invivo.
Peningkatan jumlah sel punca mesenkimal darah perifer juga diduga merupakan efek langsung dari deplesi sel ini dari sumsum tulang atau terdapat efek lain terhadap sel progenitor yang ada di darah perifer seperti koloni myeloid yaitu
Colony-Forming Unit Granulocyte-Macrophage (CFU-GM), dan koloni
multigalur seperti Colony Forming Unit-Granulocyte (CFU-G) dan koloni eritroid seperti Burst-Forming Unit-Erythroid (BFU-E) serta sel punca primitif.51
Pada beberapa penelitian menyatakan bahwa mobilisasi sel punca mesenkimal mungkin merupakan hasil dari proses rekonstitusi hematopoetik secara cepat. Proses rekonstitusi ini diperankan oleh GCSF yang memiliki kinetik yang bersifat meningkatkan jumlah sel matur maupun imatur baik dari galur hematopoetik maupun nonhematopoetik.
Terdapat pula beberapa studi yang menyatakan bahwa pemberian GCSF diduga dapat meningkatkan jumlah sel progenitor di sumsum tulang dan mengubah karakteristik sel punca mesenkimal tersebut.50-51Zaucha, dkk51menemukan bahwa pemberian GCSF jangka pendek mampu meningkatkan selularitas sumsum tulang secara signifikan melalui eritropoesis dan mielopoesis. Maka dari itu, peningkatan jumlah sel punca mesenkimal pada sirkulasi perifer maupun sumsum tulang dapat merupakan cerminan dari peningkatan seluraritas secara umum. Chatta dan Begley, dkk57-58mendukung hipotesis ini dengan mennyatakan bahwa peningkatan selularitas ini disebabkan oleh karena ekspansi dari mitotic pool terutama pada stadium promyelocyte dan myelocyte ditambah pula adanya percepatan perpindahan sel matur ke dalam sirkulasi perifer.
Namun temuan ini disanggah oleh Kovacs, dkk59 yang menyatakan bahwa peningkatan selularitas dari sumsum tulang disebabkan juga oleh proses leukapheresis yang disebabkan oleh kompensasi berupa apheresis loss dari leukosit dan sel progenitor hematopoetik.
4.3.3 Proliferasi dan diferensiasi sel punca mesenkimal setelah pemberian GCSF Pada penelitian ini kemampuan proliferasi dan diferensiasi dari sel punca mesenkimal tercermin dari variabel waktu konfluensi, jumlah sel konfluensi dan waktu diferensiasi. Waktu konfluensi pada kelompok perlakuan darah perifer tercatat paling singkat dan diikuti secara berurutan oleh kelompok kontrol sumsum tulang, kelompok perlakuan sumsum tulang dan kelompok kontrol darah perifer. Hal ini juga didapatkan pada jumlah sel konfluensi. Maka disimpulkan bahwa kemampuan proliferasi dari sel punca mesenkimal darah perifer yang diiinduksi oleh GCSF lebih unggul.
Sejauh yang kami telusuri belum terdapat penjelasan mengenai efek GCSF terhadap proliferasi dan diferensiasi sel punca mesenkimal. Telah diketahui bersama bahwa sitokin mampu meningkatkan migrasi sel dan menginduksi migrasi dari sel punca hematopoetik. Sel punca mesenkimal mengekspresikan beberapa reseptor kemokin terutama CXC Chemokine Receptor type 4 (CXCR4),
CX3C Chemokine receptor1 (CX3CR1), CXC ligand 12 (CXCL12) dan fractalkine. Kemokin ini diduga dapat mampu menstimulasi migrasi sel punca
mesenkimal secara tidak langsung. Pemberian GCSF dalam 24 jam mampu menginduksi downregulation dari SDF-1 dan upregulation dari ekspresi CXCR4.60 Telah diteliti pula bahwa sel punca hematopoetik yang dimobilisasi mampu mengekspresikan kemokin serupa juga terutama CXCR4 dan CX3CR1 yang menimbulkan potensi untuk proliferasi dan diferensiasi pada berbagai galur. Setelah termobilisasi, MSCs berubah sifat menjadi rapidly self-renewing MSC
(RS-MSC) dan memiliki kemampuan engraftment yang lebih baik secara invivo
dibandingkan dengan sel induk yang bersifat slowly self-renewing MSC
(SR-MSC).42RS-MSC memiliki potensi yang besar untuk multineage differentiation.
Pada uji post hoc pada variabel waktu jumlah sel konfluensi dan waktu konfluensi didapatkan bahwa terdapat perbedaan yang bermakna kecuali antara kelompok kontrol sumsum tulang dan kelompok perlakuan sumsum tulang. Hal ini mencerminkan kemampuan proliferasi yang sama diantara kelompok sumsum
tulang dengan dan tanpa pemberian GCSF. Pada penelitian ini, didapatkan seluruh sel punca mesenkimal pada keempat kelompok mampu berdiferensiasi menjadi osteoblas. Pada pengamatan didapatkan waktu diferensiasi pada kelompok perlakuan darah perifer tercatat paling singkat dan diikuti secara berurutan oleh kelompok perlakuan sumsum tulang, kelompok kontrol sumsum tulang dan kelompok kontrol darah perifer. Maka disimpulkan bahwa sel punca mesenkimal yang telah diinduksi oleh GCSF mampu diferensiasi menjadi osteoblas dan kemampuan diferensiasi yang baik. Efek pemberian GCSF pada diferensiasi dari sel punca mesenkimal belum diketahui secara jelas. Terdapat berbagai teori mengenai apakah efek GCSF pada diferensiasi merupakan suatu efek langsung atau tidak langsung. Fukunaga dan Dong, dkk61-62 menemukan bahwa pemberian GCSF secara invivo pada pasien acute myeloid leukemia berperan secara tidak langsung pada diferensiasi sel punca mesenkimal dengan mengirimkan sinyal transduksi untuk diferensiasi pada reseptor GCSF.
Namun Tang dkk,63mengemukakan bahwa ekspresi reseptor GCSF pada sel punca mesenkimal sumsum tulang sangat rendah dan menyimpulkan bahwa kemungkinan terdapat mekanisme tidak langsung pada proses ini. Pada penelitiannya, Tang, dkk melakukan pemberian GCSF dengan dan tanpa stem cell
factor (SCF) secara invitro dengan berbagai dosis pada sel punca mesenkimal
sumsum tulang dan mengobservasi kapasitas proliferasi dan diferensiasi. Mereka menemukan bahwa sel punca mesenkimal sumsum tulang yang diterapi GCSF secara invitro mampu berproliferasi namun kemampuan diferensiasinya tersupresi dan berbanding lurus dengan dosis. Hal ini menjelaskan adanya suatu patofisiologi lain yang berbeda antara peranan GCSF invivo dan invitro pada diferensiasi osteoblas. Sejalan dengan temuan ini, Begley, dkk dan Li, dkk64-65 melakukan penelitian pada kasus leukemia bahwa sel leukemia mampu berdiferensiasi dengan pemberian GCSF, namun mereka beranggapan bahwa GCSF memegang peranan yang lebih penting dalam hal survival dari sel yang matur daripada diferensiasi.
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
5.1.1. Kesimpulan umum
Pada penelitian ini disimpulkan bahwa pemberian GCSF mampu memobilisasi sel punca mesenkimal dari sumsum tulang ke darah perifer. Sel punca yang telah dimobilisasi ini memiliki kemampuan proliferasi dan diferensiasi. Darah perifer dapat menjadi donor sel punca mesenkimal.
5.1.2 Kesimpulan khusus
Sel punca mesenkimal darah perifer dengan pemberian GCSF memiliki jumlah sel terbanyak.
Sel punca mesenkimal darah perifer dengan pemberian GCSF memiliki waktu konfluensi tersingkat sehingga mempersingkat durasi kultur.
Sel punca mesenkimal darah perifer dengan pemberian GCSF juga mampu berdiferensiasi menjadi osteoblas.
Sel punca mesenkimal darah perifer dengan pemberian GCSF memiliki waktu diferensiasi osteoblas yang lebih cepat.
5.2 Saran
Pada penelitian ini dosis pemberian GCSF masih berpedoman pada terapi pansitopenia pasca kemoterapi pada subjek manusia. Diperlukan suatu studi lanjutan untuk meneliti dosis terapi GCSF untuk aplikasi sel punca mesenkimal pada manusia.
DAFTAR PUSTAKA
1. WHO. World report on road traffic injury prevention: summary. Geneva: WHO;2004.p. 1-52.
2. O’connor P. Injury to the spinal cord in motor vehicle traffic crashes. Accid Anal Prev. 2002;34(4):477-85.
3. Pikoulis E, Filias V, Pikoulis N, Daskalakis P, Avgerinos ED,
Tavernarakis G, et al. Patterns of injuries and motor-vehicle traffic accidents in Athens. Int J Inj Contr Saf Promot. 2006;13(3):190-3. 4. Woro Riyadina S, Meda Permana. The pattern and sociodemographic
determinant of traffic injury in Indonesia. Maj Kedokt Indones. 2009;59(10):464-72.
5. Brighton CT, Shaman P, Heppenstall RB, Esterhai JL, Jr., Pollack SR, Friedenberg ZB. Tibial nonunion treated with direct current, capacitive coupling, or bone graft. Clin Orthop Relat Res. 1995;321:223-34. 6. Dahabreh Z, Dimitrou R, Giannoudis PV. Health economics: a cost
analysis of treatment of persistent fracture non-unions using bone morphogenetic protein-7. Injury. 2007;38(3):371-7.
7. Giannoudis P, Psarakis S, Kontakis G. Can we accelerate fracture healing? A critical analysis of the literature. Injury. 2007;38 Suppl 1:S81-9. 8. Lee HB, Chung YS, Heo SY, Kim NS. Augmentation of bone healing
in non-union fracture using stem cell based tissue engineering in a dog: a case report. Veterinarni Med, 2009;54:198-203.
9. Kon E, Muraglia A, Corsi A, Bianco P, MarcamLi M, Martin I, et al. Autologous bone marrow stromal cells loaded onto porous hydroxyapatite ceramic amLelerate bone repair in critical-size
defects of sheep long bones. J Biomed Mater Res. 2000;49:328-37. 10. Arinzeh TL, Peter SJ, Archambault MP, van den Bos C, Gordon S, Kraus
K, et al. Allogeneic mesenchymal stem cells regenerate bone in a critical-sized canine segmental defect. J Bone J Surg (Am) 2003;85:1927-35
11. Wexler SA, Donaldson C, Denning-Kendall P, Rice C, Bradley B, Hows JM. Adult bone marrow is a rich source of human
mesenchymal ‘stem’ cells but umbilical cord and mobilized adult blood are not. Br J Haematology 2003;121: 368–74.
12. Kassis I, Zangi L, Rivkin R, Levdansky L, Samuel S, Marx G, et al. Isolation of mesenchymal stem cells from GCSF-mobilized human
peripheral blood using fibrin microbeads. bone marrow transplant 2006;37:967-76.
13. Brouard N, Driessen R, Short B, Simmons PJ. GCSF increases
mesenchymal precursor cell numbers in the bone marrow via an indirect mechanism involving osteoclast mediated bone resorption. Stem Cell Research 2010;5:65-75.
14. Tatsumi K, Otani H, Sato D, Enoki C, Iwasaka T, Imamura H, et al. GCSF increases donor mesenchymal stem cells in bone marrow and
their mobilization into peripheral circulation but does not repair dystrophic heart after bone marrow transplantation. Circ J
2008;72:1351-8.
15. Zhang C, Zhang X, Chen XH. GCSF-mobilized mesenchymal stem cells: A new resource for rapid engraftment in hematopoietic stem cell transplantation. Med Hypotheses 2011:76(2):241-3
16. Dawn B, Bolli R, Adult bone-derived cells: Regenerative potential,
plasticity, and tissue commitment. Basic Res Cardiol 2005;100(6);494-503
17. Nafar M, Parvin M, Sadeghi P, Ghoraishian M, Soleimani M, Tabibi A, et al. Effects of stem cells and granulocyte colony stimulating factor in reperfusion injury. Iran J Kidney Dis. 2010;4(3):207-13
18. Kothari S, Abrahamsen MS, Cole T, Hammond WP. Expression of granulocyte colony stimulating factor (GCSF) and
granulocyte/macrophage colony stimulating factor (GM-CSF) mRNA upon stimulation with phorbol ester. Blood Cells Mol Dis
19. Delgaudine M, Lambermont B, Lancellotti P, Roelants V, Walrand S, Vanoverschelde JL, et al. Effects of granulocyte-colony-stimulating factor on progenitor cell mobilization and heart perfusion and function in normal mice. Cryotherapy 2011;13(2):237-47
20. Zhdanov VV, Stavrova LA, Dygai AM, Goldberg ED. Mechanism of mobilization of mesenchymal stem cell under the effect of granulocyte colony-stimulating factor. Bull Exp Biol Med 2007;144(1):151-3. 21. Muschler GF, Nakamoto C, Girrfith LG. Engineering principles of clinical
cell-based tissue engineering. J Bone Joint Surg Am 2004;86A:841-58. 22. Vats A, TOlley NS, Buttery LDK, et al. The stem cell in orthopaedic
surgery. J Bone Joint Surg Br 2004;86B:159-64.
23. Lee EH, Hui JHP. The potential of stem cells in orthopaedic surgery. J Bone Joint Surg Br 2006;88B:841-51.
24. Bruder SP, Jaiswal N, Ricalton NS, et al. Mesenchymal stem cells in osteobiology and apllied bone regeneration. Clin Orthop
1888;355S:S247-56
25. Serakinci N, Keith WN. Therapeutic potential of adult stem cells. Eur J Cancer 2006;42:1243-6.
26. Dominici M, Le Blanc K, Mueller I, Slaper-Cortenbach I, Marini F, Krause D et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cryotherapy. 2006;8(4):315-7.
27. Rust PA, Kalsi P, Briggs TWR. Will mesenchymal stem cells differentiate into osteoblats on allograft? Clin Orthop Rel Res 2006;457:220-6. 28. Birmingham E, Niebur GL, McHugh PE, Shaw G, Barry FP, McNamara.
Osteogenic differentiation of mesenchymal stem cells is regulated by osteocyte and osteoblast cells in a simplified bone niche. Eur Cells Mater 2012;23:13-27.
29. Xia L, Zhang Z, Chen L, Zhang W, Zeng D, Zhang X, et al. Proliferation and osteogenic differentiation of human periodontal ligament cells on akermanite and beta-TCP bioceramics. Eur Cells Mater 2011;22:68-83.
30. Jasiwal N, Haynesworth SE, Caplan AI, Bruder SP. Osteogenic differentiation of purified, culture-expanded human mesenchymal stem cells in vitro. J Cell Biochem 1997;64(2):295-312.
31. Leung KS, Fung KP, Sher AH, Li CK, Lee KM. Plasma bone-specific alkaline phophatase as an indicator of osteoblastic activity. J Bone Joint Surg Br. 1993;75:288-92
32. Wang YH, Liu Y, Buhl K, Rowe DW. Comparison of the Action of Transient and Continuous PTH on Primary Osteoblast Cultures Expressing Differentiation Stage-Specific GFP. J Bone Miner Res. 2005;20:5–14.
33. Bilic-Curcic I, Kronenberg M, Jiang X, Bellizzi J, Mina M, Marijanovic I, Gardiner EM, Rowe DW. Visualizing levels of osteoblast
differentiation by a two-color promoter-GFP strategy: Type I collagen-GFPcyan and osteocalcin-GFPtpz. Genesis. 2005;43:87–98.
34. Sila-Asna M, Bunyaratvej A, Maeda S, Kitaguchi H, Bunyaratvej N. Osteoblast differentiation and bone formation gene expression in strontium-inducing bone marrow mesenchymal stem cell. Kobe J. Med. Sci 2007;53:25-35
35. Nicola NA. Granulocyte colony-stimulating factor. Immunology Series 1990;49:77-109.
36. Nagata S. Granulocyte colony-Stimulating factor. Peptide Growth Factors and Their Receptors. 1990. Berlin: Springer-Verlag Berlin Heidelberg; 1990.p. 700-1
37.Frumkin LR, Dale DC. The role of colony-stimulating factors in HIV disease. AIDS Reader 1996;6:185-93.
38.Frampton JR, Lee CR, Faulds D. Filgrastim: a review of its
pharmacological properties and therapeutic efficacy in neutropenia. Drugs 1994;48:731-60.
39.Demetri GD, Griffin JD. Granulocyte colony-stimulating factor and its receptor. Blood 1991;78:2791-808.