KARAKTERISTIK OPTIK DAN ELEKTRONIK EKSTRAK KLOROFIL
Spirulina fusiformis
JESSI LINAR TAMBUNAN
DEPARTEMEN FISIKA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
JESSI LINAR TAMBUNAN. Karakteristik Optik dan Elektronik Ekstrak Klorofil Spirulina fusiformis. Dibimbing oleh AKHIRUDDIN MADDU dan IRIANI SETYANINGSIH.
Pada penelitian ini dilakukan studi sifat optik dan elektronik klorofil Spirulina fusiformis hasil kultur pada media zarouk. Pertumbuhan diukur setiap hari dan dilakukan dua kali pemanenan, yaitu pada fase logaritmik dan fase stasioner. Kurva pertumbuhan diukur menggunakan spektrofotometer dan diperoleh lima fase pertumbuhan. Hasil panen diekstrak untuk mendapatkan larutan klorofil yang kemudian diuji absorbansi dan fluoresensinya. Setelah itu dilakukan evaporasi untuk mendapatkan padatan klorofil yang kemudian dilarutkan dengan asetil aseton, lalu ditempatkan antara kedua TCO dan dilakukan karakterisasi arus-tegangan (I-V).
Absorbansi larutan ekstrak klorofil memperlihatkan adanya pita serapan klorofil sekitar 430 nm. Pada fase logaritmik serapan tertinggi berada pada panjang gelombang sekitar 430 nm dan terdapat lima pita serapan, yaitu pada selang 400-450 nm, 450-500 nm, 550-600 nm, 600-625 nm, dan 625-675 nm. Pada fase stasioner serapan tertinggi berada pada panjang gelombang sekitar 470 nm dan terdapat dua pita serapan, yaitu pada selang 450-500 nm dan 625-675 nm. Puncak absorbansi maksimum menyatakan energi eksitasi klorofil. Besar energi eksitasi pada fase logaritmik untuk panjang gelombang 429,87 nm sebesar 2,892 eV dan panjang gelombang 661,89 nm sebesar 1,878 eV, lalu pada fase stasioner untuk panjang gelombang 468,47 nm sebesar 2,654 eV dan panjang gelombang 658,50 nm sebesar 1,888 eV.
Fluoresensi klorofil juga memperlihatkan adanya pita emisi fluoresensi. Pada fase logaritmik emisi tertinggi berada pada panjang gelombang 675,49 nm dengan energi emisi sebesar 1,840 eV. Pada fase stasioner emisi tertinggi berada pada panjang gelombang 678,02 nm dengan energi emisi sebesar 1,833 eV.
Pengukuran I-V ekstrak klorofil dilakukan pada kondisi gelap dan terang. Konduktivitas cenderung meningkat terhadap kenaikan intensitas cahaya, sehingga klorofil bersifat fotokonduktif.
KARAKTERISTIK OPTIK DAN ELEKTRONIK EKSTRAK KLOROFIL
Spirulina fusiformis
JESSI LINAR TAMBUNAN
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Fisika
DEPARTEMEN FISIKA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
SKRIPSI
Judul : Karakteristik Optik dan Elektronik Ekstrak Klorofil Spirulina fusiformis
Nama : Jessi Linar Tambunan
NIM : G74050570
Menyetujui
Dr. Akhiruddin Maddu Ir. Iriani Setyaningsih, M.S
Pembimbing I Pembimbing II
Mengetahui
Dr. drh. Hasyim, DEA
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
PRAKATA
Salam SejahteraPuji dan syukur kepada Tuhan Yesus Kristus atas berkat, kasih, dan penyertaan-Nya, sehingga penulis dapat menyelesaikan penyusunan skripsi yang berjudul ”Karakteristik Optik dan Elektronik Ekstrak Klorofil Spirulina fusiformis” sebagai salah satu syarat untuk memperoleh
gelar Sarjana Sains pada Departemen Fisika, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Selama pelaksanaan penelitian hingga tersusunnya skripsi ini penulis mendapatkan bantuan dari berbagai pihak. Pada kesempatan ini penulis ingin mengucapkan terima kasih kepada semua pihak yang telah banyak membantu, baik itu pada saat pelaksanaan penelitian maupun pada saat penyusunan dan penyelesaian skripsi, dalam hal ini khususnya kepada:
1. Bapak Dr. Akhiruddin Maddu dan Ibu Ir. Iriani Setyaningsih, M.S (selaku dosen pembimbing) atas segala nasehat dan bimbingannya.
2. Bapak Ir. Hanedi Darmasetiawan, M.S dan Bapak Faozan Ahmad, M.Si (selaku dosen penguji seminar dan sidang) atas segala masukan dan perbaikan yang diberikan.
3. Ibu Siti Nikmatin, M.Si (selaku dosen penguji kolokium) atas saran yang diberikan. 4. Bapak Dr. Ir. Djoko Prijono, MagrSc. (dosen Departemen Proteksi Tanaman) yang telah
mengizinkan dan membantu penulis menggunakan evaporator di Lab. Fisiologi dan Toksikologi DPT IPB.
5. Dinas Pendidikan kota Dumai atas dukungan biaya yang diberikan selama ini. 6. Seluruh dosen, staf, dan laboran Departemen Fisika FMIPA IPB.
7. Keluargaku tercinta Papa (Alm.), Mama, dan Adik-adik (Samuel, Hotniel, dan Putra) terima kasih atas doa, nasehat, dan dukungan semangatnya”.
8. Kak Desna dan bang Piator Pasaribu, serta ponakanku Teresya ”terima kasih atas dukungan semangat dan nasehat yang telah diberikan”.
9. Bang Benardo Nababan yang selalu sabar, penuh kasih, terus membimbing aku selama penelitian, men-support aku, dan selalu ada dalam suka maupun duka.
10. Teman-temanku: Adex, Ahmad, Deni, Ery, Hartip, Lili, Mei, Mena, Rizal, Roni, Tiur, dll. 11. Adik kelompok kecilku di PMK IPB: Adit, Janet, dan Kade atas dukungan doanya. 12. Kak Lina, bang Ricardo, bang Richard, bang Supardi, Mega, Suryana, dan Christina atas
dukungan semangat dan doanya selama ini.
13. Teman-teman Fisika 42 atas kebersamaan kita selama ini.
14. Pak Firman dan Pak Indro atas keikhlasan, bantuan, dan informasinya. 15. Kak Dika, Evy, Ita, Riska, Senna, dan mas Ipul atas kerjasamanya di lab. THP. 16. Teman-teman kostan: kak Dona, Acel, Cia, Kade, Lastri, Mayang, Ruli, dan Triva. 17. Komliterz atas pelayanan dan pembinaan yang kita jalani bersama dalam suka dan duka. 18. Pihak lain yang telah membantu penulis yang tidak dapat disebutkan satu per satu. Penulis menyadari bahwa penyusunan skripsi ini masih jauh dari kesempurnaan. Oleh karena itu, penulis sangat mengharapkan masukan baik berupa kritik, saran, dan koreksi lain yang membangun untuk mengisi kekurangan-kekurangan pada skripsi ini. Semoga skripsi ini dapat bermanfaat bagi penulis pada khususnya dan bagi para pembaca pada umumnya.
Bogor, November 2009
RIWAYAT HIDUP
Penulis dilahirkan di kota Dumai pada 07 Juli 1987 dari pasangan Arnold Chamberlin Tambunan, A.Md (Almarhum) dan Rukiah Lindayana Siahaan. Penulis merupakan putrid kedua dari lima bersaudara.
Penulis memulai pendidikan di Taman Kanak-kanak SANTO TARCISIUS Dumai pada tahun 1992, kemudian melanjutkan ke Sekolah Dasar 3 YKPP pada tahun 1993 dan lulus tahun 1999. Pada tahun yang sama penulis melanjutkan pendidikan ke Sekolah Lanjutan Tingkat Pertama YKPP Dumai dan lulus tahun 2002, kemudian melanjutkan pendidikan ke Sekolah Menengah Atas Negeri Binaan Khusus Dumai dan lulus pada tahun 2005. Pada tahun 2005 pula penulis diterima di Institut Pertanian Bogor melalui jalur BUD (Beasiswa Utusan Daerah), kemudian pada 2006 penulis diterima di Departemen Fisika, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor melalui program mayor-minor.
Selama mengikuti perkuliahan, penulis pernah aktif dalam berbagai organisasi. Pada tahun 2005-2009, penulis aktif dalam Unit Kegiatan Mahasiswa (UKM) Persekutuan Mahasiswa Kristen (PMK) IPB. Penulis dipercaya sebagai Sekretaris Komisi Literatur Persekutuan Mahasiswa Kristen IPB periode 2007-2008 dan sebagai anggota Departemen Instrumentasi dan Teknologi (INSTEK) Badan Eksekutif Mahasiswa Himpunan Mahasiswa Fisika (BEM HIMAFI) IPB periode 2006-2007. Selain itu, penulis juga aktif dalam berbagai kepanitiaan.
DAFTAR ISI
Halaman
DAFTAR ISI ... i
DAFTAR GAMBAR ... ii
DAFTAR LAMPIRAN ... iii
PENDAHULUAN Latar Belakang ... 1 Tujuan Penelitian ... 1 Manfaat Penelitian ... 1 TINJAUAN PUSTAKA Spirulina sp. ... 2 Klorofil ... 3 Porfirin ... 4
Fotosintesis dan Fluoresensi Klorofil ... 4
Absorbansi ... 5
Fotokonduktivitas Bahan Semikonduktor ... 6
BAHAN DAN METODE Waktu dan Tempat Penelitian ... 7
Alat dan Bahan ... 7
Metode Penelitian Kultivasi Spirulina fusiformis ... 7
Pemanenan dan Pengeringan ... 7
Analisis Kadar Air ... 8
Teknik Ekstraksi ... 8
Karakterisasi Optik ... 8
Uji Fotokonduktivitas ... 10
HASIL DAN PEMBAHASAN Kultivasi Spirulina fusiformis ... 11
Pemanenan dan Pengeringan ... 11
Analisis Kadar Air ... 12
Ekstraksi dan Kadar Klorofil ... 12
Absorbansi Klorofil ... 12
Fluoresensi Klorofil ... 13
Uji Fotokonduktivitas ... 14
Kurva Arus-Tegangan (I-V) ... 14
Resistansi ... 15
Resistivitas ... 16
Konduktivitas ... 16
KESIMPULAN DAN SARAN Kesimpulan ... 17
Saran ... 17
DAFTAR PUSTAKA ... 18
DAFTAR GAMBAR
Halaman
1 Sel Spirulina sp. ... 2
2 Kurva pertumbuhan mikroalga ... 2
3 Struktur klorofil ... 3
4 Spektra absorpsi ... 3
5 Senyawa porfirin ... 4
6 Fotoeksitasi klorofil ... 5
7 Transisi muatan klorofil ... 5
8 Prinsip pengukuran fotokonduktivitas ... 6
9 Kultur Spirulina fusiformis ... 7
10 Proses evaporasi ... 8
11 Rangkaian pengukuran absorbansi ... 9
12 Sampel yang berisi larutan untuk pengukuran absorbansi ... 9
13 Rangkaian pengukuran fluoresensi ... 9
14 Sampel yang berisi larutan untuk pengukuran fluoresensi ... 9
15 Skema pengukuran I-V untuk memperoleh fotokonduktivitas... 10
16 Sel Spirulina fusiformis ... 11
17 Kurva pertumbuhan Spirulina fusiformis ... 11
18 Spektrum absorbansi larutan klorofil pada fase logaritmik ... 12
19 Spektrum absorbansi larutan klorofil pada fase stasioner ... 13
20 Spektrum absorbansi larutan klorofil pada fase logaritmik dan fase stasioner ... 13
21 Spektrum fluoresensi fase logaritmik ... 14
22 Spektrum fluoresensi fase stasioner ... 14
23 Kurva I-V klorofil pada fase logaritmik ... 15
24 Kurva I-V klorofil pada fase stasioner ... 15
25 Kurva resistansi klorofil pada fase logaritmik dan fase stasioner ... 15
26 Kurva resistivitas klorofil pada fase logaritmik dan fase stasioner ... 16
DAFTAR LAMPIRAN
Halaman
1 Diagram alir penelitian ... 21
2 Komposisi media Zarouk untuk pertumbuhan Spirulina fusiformis ... 22
3 Data hasil pengamatan Optical Density (OD) kultur Spirulina fusiformis ... 22
4 Data absorbansi larutan klorofil ... 25
5 Data I-V klorofil terhadap intensitas cahaya ... 33
6 Data resistansi klorofil terhadap intensitas cahaya ... 34
7 Data resistivitas dan konduktivitas klorofil terhadap intensitas cahaya ... 35
8 Penentuan kadar klorofil ... 36
9 Transisi energi fluoresensi ... 37
PENDAHULUAN Latar Belakang
Dewasa ini, bahan semikonduktor organik sangat menarik untuk beberapa aplikasi optik dan elektronik. Senyawa tersebut menggabungkan kemudahan pembuatannya dengan struktur kimianya yang fleksibel yang dapat dirancang untuk maksud khusus (Sudanti 2006).
Sifat optik dan elektronik bahan organik sudah sejak lama menjadi bahan kajian yang menarik dari sisi sains maupun teknologi. Secara umum, bahan organik sering dianggap tidak dapat digunakan dalam aplikasi elektronik dan sejenisnya karena bersifat insulator. Akan tetapi, anggapan tersebut tidak sepenuhnya benar. Beberapa jenis bahan organik ternyata menunjukkan sifat optik dan listrik yang menarik, sehingga dapat dikembangkan untuk beberapa aplikasi elektronik, optoelektronik dan fotonik, seperti sel surya dan fotosensitizer (Anonim 2008).
Sejauh ini dye yang digunakan sebagai sensitizer dapat berupa dye sintesis maupun dye alami. Dye sintesis umumnya menggunakan organik logam berbasis ruthenium komplek yang cukup mahal, sedangkan dye alami dapat diekstrak dari bagian-bagian tumbuhan seperti daun, bunga atau buah. Berbagai jenis ekstrak tumbuhan telah digunakan sebagai fotosensitizer pada sistem sel surya tersensitisasi dye. Ekstrak dye atau pigmen tumbuhan yang digunakan sebagai fotosensitizer berupa ekstrak klorofil, karoten atau antosianin (Maddu et al 2007).
Biomolekul dari senyawa porfirin misalnya, merupakan bahan organik untuk dijadikan pembuatan devais optik dan elektronik. Keunggulan bahan organik alam ini dengan berat molekul yang kecil mempunyai nilai koefisien serapan optik yang tinggi. Porfirin merupakan salah satu pigmen organik yang banyak dikaji karena berperan untuk mengkonversi energi matahari menjadi energi kimia dalam proses fotosintesis dan merupakan salah satu bagian dari klorofil (Supriyanto et al 2008).
Kehidupan di bumi digerakkan oleh energi matahari. Klorofil tumbuhan menangkap energi cahaya yang telah menempuh jarak 160 juta kilometer dari matahari dan mengubahnya menjadi energi kimiawi yang disimpan dalam gula dan molekul organik lainnya. Proses ini disebut fotosintesis (Campbell et al 2000). Fotosintesis menyerap cahaya matahari dalam bentuk gelombang
elektromagnetik. Cahaya matahari yang sampai ke bumi, sekitar 23% digunakan untuk daur hidrologi, 46% untuk pemanasan atmosfer, permukaan bumi serta lautan, dan sekitar 30% dipantulkan kembali ke luar angkasa. Cahaya matahari kurang dari 1% digunakan untuk proses fotosintesis tumbuhan (Wirahadikusumah 1985).
Akhir-akhir ini, penelitian dan pengembangan fotosintesis buatan untuk konversi energi matahari kian banyak mendapat perhatian berbagai pusat penelitian dunia, khususnya untuk mengantisipasi krisis bahan bakar fosil dan ancaman pemanasan global di masa depan (Nasruddin & Limantara 2009).
Indonesia telah dikenal luas sebagai negara kepulauan yang 2/3 wilayahnya adalah lautan. Berbagai jenis mahluk hidup, baik berupa tumbuhan air maupun hewan air terdapat di perairan. Salah satu mahluk hidup yang tumbuh dan berkembang di perairan adalah Spirulina sp. (Dio 2008). Spirulina sp. adalah sejenis tumbuhan air yang mengandung satu sel saja. Oleh karena itu, ia tidak mempunyai akar, daun, bunga, dan sebagainya. Ia merupakan kumpulan alga yang berbentuk spiral dan berwarna hijau gelap. Warna ini disebabkan oleh kombinasi klorofil (hijau), fikosianin (biru), dan karotenoid (orange).
Beberapa hal yang akan dikaji dalam penelitian ini adalah sifat optik dari klorofil yang diekstrak dari bahan alam Spirulina fusiformis, kemudian mengkarakterisasi sifat listriknya dengan menentukan fotokonduktivitas dan responsivitas cahaya dari klorofil tersebut. Proses kultur Spirulina fusiformis dan fotosintesis juga akan dipelajari pada penelitian ini.
Tujuan Penelitian
Tujuan penelitian ini adalah mengkultur mikroalga Spirulina fusiformis, mengekstrak klorofil dari mikroalga Spirulina fusiformis, dan mengkarakterisasi sifat optik dan elektronik klorofil tersebut.
Manfaat Penelitian
Penelitian ini diharapkan dapat memberi informasi bagi masyarakat tentang sifat optik dan elektronik klorofil secara umum.
TINJAUAN PUSTAKA
Spirulina sp.
Spirulina sp. merupakan nama umum dari dua spesies Cyanobacteria (alga biru-hijau/blue green algae). Klasifikasi Spirulina sp. dalam sistematika (taksonomi) tumbuhan menurut Bold & Wynne 1985 adalah sebagai berikut:
kingdom : Protista divisi : Cyanophyta kelas : Cyanophyceae ordo : Nostocales famili : Oscilatoriaceae genus : Spirulina
spesies : Spirulina fusiformis Alga biru-hijau prokariotik (Cyanobacteria) termasuk dalam kelompok mikroalga. Mikroalga adalah mikroorganisme fotosintetik dengan morfologi sel yang bervariasi, baik uni-selular maupun multiselular (membentuk koloni kecil). Sebagian besar mikroalga tumbuh secara fototrofik, meskipun tidak sedikit jenis yang mampu tumbuh secara heterotrofik (Kurniawan & Gunarto 1999).
Spirulina sp. merupakan mikroorganisme autotrof berwarna hijau-kebiruan, dengan sel berkoloni membentuk filamen terpilin menyerupai spiral (helix), sehingga disebut alga biru-hijau berfilamen (Cyanobacterium). Bentuk tubuhnya yang menyerupai benang merupakan rangkaian sel (trichome) yang berbentuk silindris dengan dinding sel yang tipis, berdiameter 1-12 µm. Filamen Spirulina sp. hidup berdiri sendiri dan dapat bergerak bebas (Borowitzka 1988).
Gambar 1. Sel Spirulina sp. (Borowitzka 1988)
Spirulina sp. telah ada sejak 3,5 milyar tahun yang lalu dan telah dikonsumsi oleh suku Aztec kuno di Mexico sejak 5 abad yang lalu. Spirulina sp. dapat tumbuh pada rentang
kondisi yang luas di permukaan bumi. Spirulina sp. biasanya ditemukan pada tempat-tempat yang lembab atau lahan yang sering terkena air dan banyak hidup pada lingkungan berair di permukaan bumi. Spirulina sp. dapat hidup di semua tempat yang memiliki cukup sinar matahari, air, dan CO2. Spirulina sp. yang terdapat di dunia sekitar ± 2000 jenis (Dio 2008).
Manfaat dan nilai komersial Spirulina sp. bagi kepentingan industri telah cukup lama dikenal. Penelitian dan pengembangan secara intensif telah dilakukan di beberapa negara, baik dalam skala laboratorium maupun industri. Mikroorganisme fotosintetik ini telah dimanfaatkan dalam produksi biomassa, produksi energi, produksi berbagai produk bermanfaat, bioakumulasi senyawa tertentu, berbagai proses biotransformasi, serta dapat juga dimanfaatkan menjadi biodiesel dari minyak nabati yang dihasilkan. Spirulina sp. juga mampu menyerap karbondioksida dan mengkonversikannya menjadi oksigen sehingga dapat mengurangi polusi CO2 dan dapat mengurangi dampak pemanasan global.
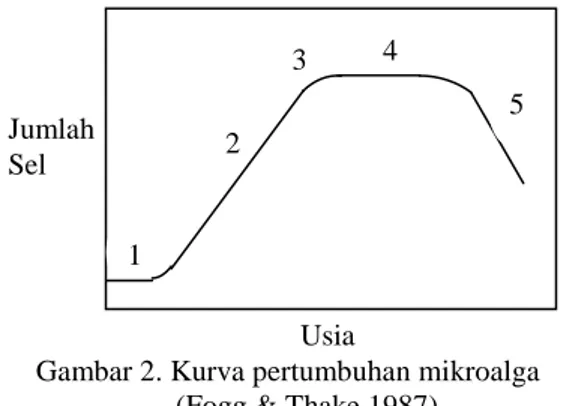
Pertumbuhan mikroalga berlangsung dalam 5 fase seperti pada Gambar 2.
Gambar 2. Kurva pertumbuhan mikroalga (Fogg & Thake 1987)
Keterangan:
1. Fase lag 2. Fase logaritmik 3. Fase penurunan laju 4. Fase stasioner 5. Fase kematian
Fase lag merupakan fase berpindahnya populasi ke media yang baru, sehingga Spirulina sp. harus beradaptasi dengan lingkungan yang baru. Fase logaritmik merupakan fase perkembangbiakan sel Spirulina sp. Fase penurunan laju pertumbuhan merupakan fase dimana kematian sel mulai terjadi, tetapi masih sedikit dibandingkan pertumbuhan selnya. Fase stasioner merupakan fase keseimbangan
Usia Kultur Jumlah Sel 1 2 3 4 5
pertumbuhan sel dengan kematian sel. Fase kematian merupakan fase dimana kematian sel lebih besar dibandingkan pertumbuhan sel (Fogg & Thake 1987).
Klorofil
Klorofil adalah pigmen hijau yang terdapat pada tumbuhan hijau, alga, dan bakteri fotosintesis. Klorofil merupakan kompleks antara porfin dengan magnesium. Porfin adalah struktur makrosiklik tak jenuh yang terdiri dari empat cincin pirol yang digabungkan oleh suatu jembatan karbon. Porfin tersubstitusi dinamai porfirin yang dianggap sebagai inti dari semua klorofil. Porfirin adalah pigmen makrosiklik tetrapirol dimana cincin pirol digabungkan oleh jembatan metana dan sistem ganda tertutup. Oleh karena itu, klorofil diklasifikasikan sebagai porfirin (Aryetti diacu dalam Mariyana 2003).
Struktur dari klorofil memiliki kesamaan dengan hemoglobin. Perbedaannya hanyalah terletak pada atom pusat dari molekul. Atom pusat klorofil adalah magnesium (Mg), sedangkan atom pusat hemoglobin adalah besi (Fe). Jika hemoglobin diidentikkan sebagai darah merah manusia, maka klorofil dapat diidentikkan sebagai darah hijau manusia. Oleh karena kemiripan struktur ini, maka klorofil adalah satu-satunya molekul di dunia yang secara alamiah dapat diterima oleh tubuh dan menjadi nutrisi vital bagi tubuh manusia (Campbell et al 2000).
Klorofil yang biasanya berikatan dengan protein, dapat diekstraksi dari daun tumbuhan dengan alkohol atau aseton dan dimurnikan dengan cara kromatografi. Tumbuhan umumnya mengandung 2 macam klorofil, yaitu klorofil-a dan klorofil-b (Gambar 3). Klorofil-a adalah suatu senyawa kompleks antara magnesium dan porfirin yang mengandung cincin siklopentanon. Keempat atom nitrogennya dihubungkan secara ikatan koordinasi dengan ion Mg2+ membentuk senyawa kompleks planar yang mantap. Pada porfirin melekat ekor hidrokarbon yang berinteraksi dengan daerah hidrofobik protein. Klorofil-b adalah klorofil kedua yang terdapat dalam tumbuhan hijau, sedangkan klorofil-c terdapat dalam ganggang coklat, diatom, dan dinoflagelata (Wirahadikusumah 1985).
Gambar 3. Struktur klorofil (Campbell et al 2000)
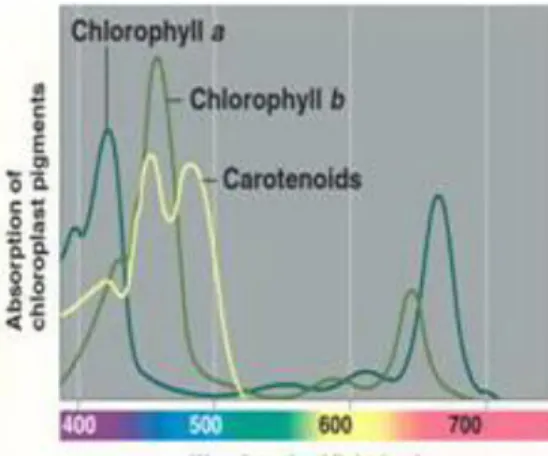
Daerah absorpsi klorofil dapat dilihat pada Gambar 4. Klorofil-a menyerap daerah dengan panjang gelombang 430 nm dan 660 nm, sedangkan klorofil-b menyerap daerah dengan panjang gelombang 460 nm dan 650 nm (Campbell et al 2000).
Gambar 4. Spektra absorpsi (Campbell et al 2000)
Klorofil berpotensi sebagai photosensitizer (obat pemicu yang aktif oleh rangsangan cahaya) untuk terapi tumor dan kanker. Pemanfaatan terapi fotodinamika (TFD) ini didasarkan pada asumsi bahwa photosensitizer (klorofil) akan dapat membunuh sel-sel kanker, ketika senyawa tersebut diekspos dengan cahaya tampak pada panjang gelombang tertentu (630-800 nm) dan dengan intensitas tertentu. Mekanisme kerja klorofil
sebagai sensitizer adalah ketika photosensitizer mengabsorpsi cahaya, maka photosensitizer akan tereksitasi pada keadaan singlet. Keadaan ini tidak berlangsung lama karena photosensitizer akan berubah ke keadaan triplet. Photosensitizer pada keadaan triplet ini akan bereaksi dengan oksigen yang tentunya ada dalam jaringan tubuh manusia, termasuk dalam jaringan kanker. Oksigen dalam keadaan dasar akan tereksitasi menjadi singlet oksigen yang bersifat sangat reaktif dan selanjutnya akan menghancurkan sel-sel kanker. Pada akhirnya, photosensitizer akan kembali ke keadaan normal (Putra & Bahri 2007).
Porfirin
Porfirin merupakan senyawa organik makrosiklik yang memiliki kedekatan struktural dengan senyawa klorofil dan bakteriklorofil. Klorofil dan bakterioklorofil yang menghijaukan dedaunan dan segenap biota hijau lainnya di bumi merupakan turunan dari protoporfirin. Bukti-bukti penelitian menunjukkan bahwa terdapat jalur evolusi yang menghubungkan antara keberadaan porfirin, klorofil, dan bakterioklorofil sebagai pigmen fotosintesis dominan. Selain itu, porfirin juga memiliki kedekatan struktural dengan senyawa hemin pada darah manusia dan hewan, yaitu sama-sama sebagai senyawa tetrapirol.
Porfirin menyerap cahaya yang membawa warna hijau pada klorofil dan berperan sebagai pusat dalam fotosintesis. Keunikan porfirin jumlahnya sangat banyak dan sebagai perantara kondisi elektronik ketika diiradiasi cahaya tampak. Hal ini menyebabkan porfirin tereksitasi, lalu terjadi proses transfer elektron dalam ruang grana kloroplas. Proses alami transfer elektron ini diikuti dalam bentuk acceptor/donor elektron (D/A) (Hecht et al 2006).
Gambar 5. Senyawa porfirin (Hecht et al 2006)
Fotosintesis dan Fluoresensi Klorofil Pada hakekatnya, semua kehidupan di bumi ini tergantung langsung dari adanya proses asimilasi CO2 menjadi senyawa kimia organik dengan energi yang didapat dari sinar matahari. Dalam proses ini energi sinar matahari (energi foton) ditangkap dan diubah menjadi energi kimia dengan proses yang disebut fotosintesis (Wirahadikusumah, 1985). Fotosintesis menyediakan makanan bagi hampir seluruh kehidupan di dunia, baik secara langsung maupun tidak langsung. Organisme memperoleh senyawa organik yang digunakannya untuk energi (Campbell et al 2000).
Fotosintesis merupakan suatu proses biokimia yang dilakukan oleh tumbuhan, alga, dan beberapa jenis bakteri untuk memproduksi energi terpakai (nutrisi) dengan memanfaatkan energi cahaya. Fotosintesis juga berjasa menghasilkan sebagian besar oksigen yang terdapat di atmosfer bumi. Organisme yang menghasilkan energi melalui fotosintesis (photos berarti cahaya) disebut sebagai fototrof. Fotosintesis merupakan salah satu cara asimilasi karbon karena dalam fotosintesis karbon bebas dari CO2 diikat (difiksasi) menjadi gula sebagai molekul penyimpan energi (Danang H 2008).
Tumbuhan menggunakan karbondioksida dan air untuk menghasilkan gula dan oksigen yang diperlukan sebagai makanannya. Energi untuk menjalankan proses ini berasal dari fotosintesis. Keseluruhan proses fotosintesis yang menghasilkan glukosa dituliskan dengan persaman reaksi: (Wirahadikusumah 1985)
6H2O + 6CO2 + cahaya → C6H12O6 + 6O2 Dari semua radiasi matahari yang dipancarkan, hanya panjang gelombang tertentu yang dimanfaatkan oleh tumbuhan untuk proses fotosintesis, yaitu panjang gelombang yang berada pada kisaran cahaya tampak (380-700 nm). Cahaya tampak terbagi atas cahaya merah (610-700 nm), hijau-kuning (510-600 nm), biru (410-500 nm), dan violet (< 400 nm). Masing-masing jenis cahaya berbeda pengaruhnya terhadap fotosintesis. Hal ini terkait pada sifat pigmen penangkap cahaya yang bekerja dalam fotosintesis. Pigmen yang terdapat pada membran grana menyerap cahaya yang memiliki panjang gelombang tertentu. Pigmen yang berbeda menyerap cahaya pada panjang gelombang yang berbeda. Kloroplast mengandung beberapa pigmen, sebagai contoh klorofil-a terutama menyerap cahaya
biru-violet dan merah. Klorofil-b menyerap cahaya biru dan orange dan memantulkan cahaya kuning-hijau. Klorofil-a berperan langsung dalam reaksi terang, sedangkan klorofil-b tidak secara langsung berperan dalam reaksi terang.
Ketika klorofil dan pigmen lain menyerap foton, warna yang bersesuaian dengan panjang gelombang yang diserap akan menghilang dari spektrum cahaya yang diteruskan dan dipantulkan, tetapi energinya tidak hilang. Ketika molekul menyerap suatu foton, salah satu elektron molekul dinaikkan ke suatu orbital di mana elektron tersebut memiliki energi potensial yang lebih tinggi. Ketika elektron berada pada orbital normalnya, molekul pigmen dikatakan berada dalam keadaan dasarnya. Setelah penyerapan foton mendorong elektron ke orbital yang energinya lebih tinggi, molekul pigmen dikatakan dalam keadaan tereksitasi (Campbell et al 2000).
Gambar 6. Fotoeksitasi klorofil (Campbell et al 2000)
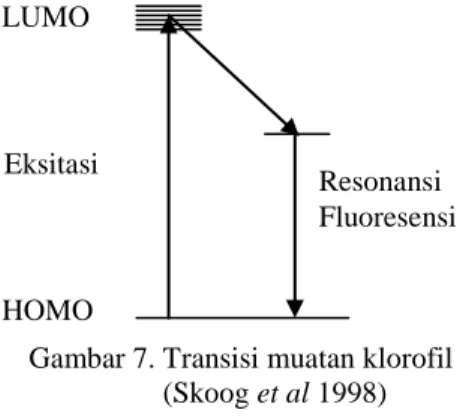
Gambar 7. Transisi muatan klorofil (Skoog et al 1998)
Penyerapan suatu foton menyebabkan perpindahan molekul klorofil dari keadaan dasar yang disebut HOMO (Highest Occupied Molecular Orbitals) ke keadaan tereksitasi yang disebut LUMO (Lowest Unoccupied Molecular Orbitals). Foton mendorong
elektron ke orbital di mana elektron itu memiliki energi potensial yang lebih tinggi. Jika larutan klorofil diterangi, elektron yang tereksitasi mengalami relaksasi dan segera turun kembali ke orbital keadaan dasarnya dengan melepaskan energi berlebih dan juga panas serta berfluoresensi (berpendar) dalam bagian spektrum merah (Campbell et al 2000). Absorbansi
Absorpsi disebabkan oleh ketidakmurnian pada suatu materi dan mengacu pada perubahan energi optik menjadi optoelektronik atau getaran molekul. Jumlah absorpsi dari ketidakmurnian bergantung pada konsentrasi dan panjang gelombang cahaya. Pada daerah infrared dan far infrared, berkas absorpsi juga terjadi, ekor dari spectrum absorpsi mendekati daerah infrared yang disebabkan oleh getaran molekul dalam materi (Tricker 2002).
Absorpsi mengakibatkan transisi dari tingkat dasar ke tingkat yang lebih tinggi, yakni tingkat tereksitasi. Pengidentifikasian dan analisa bahan dapat dilakukan dengan menelaah frekuensi absorpsi bahan yang tereksitasi. Bahan semikonduktor mempunyai kemampuan dalam menyerap energi foton untuk mengeksitasi elektron. Kemampuan dalam menyerap energi foton pada bahan semikonduktor disebut juga absorpsivitas semikonduktor (Kopkhar 1990).
Jika suatu radiasi elektromagnetik dipancarkan ke suatu materi dan pada materi tersebut terjadi absorpsi selektif, maka materi akan menyerap komponen radiasi pada panjang gelombang yang berbeda dan dalam jumlah yang berbeda pula. Perubahan tingkat serapan sebagai fungsi panjang gelombang disebut sebagai spektrum absorpsi. Spektrum absorpsi merupakan karakteristik kualitas suatu bahan. Tingkat absorpsi cahaya pada panjang gelombang tertentu dapat digunakan untuk menentukan jumlah konsentrasi suatu sampel. Dasar penentuan kuantitatifnya dengan menggunakan Hukum Beer Lambert: (Kurniawan & Gunarto 1999)
𝐼 = 𝐼0 𝑒𝑥𝑝 – 𝜀 𝑙 𝑐 ………... (1) dan
𝐴 = 𝑙𝑜𝑔𝐼0
𝐼 = −𝜀 𝑙 𝑐 ……….... (2) Keterangan:
A = serapan cahaya (absorbansi) sampel I0= intensitas datang
I = intensitas cahaya yang keluar lewat larutan sampel (transmisi) LUMO HOMO Eksitasi Resonansi Fluoresensi
𝑙 = ketebalan lapisan larutan sampel (jarak tempuh cahaya dalam substansi sampel)
𝜀 = koefisien absorpsi molekul (dengan konsentrasi molaritas)
c = konsentrasi analat
Fotokonduktivitas Bahan Semikonduktor Konduktivitas listrik merupakan ukuran dari kemampuan suatu bahan untuk menghantarkan arus listrik. Fenomena fotokonduktivitas muncul ketika seberkas sinar dikenakan pada bahan semikonduktor dan menyebabkan bahan semikonduktor tersebut bertambah konduktivitas listriknya. Hal ini dikarenakan eksitasi elektron melintasi celah energi semikonduktor. Eksitasi elektron ini juga menimbulkan bertambahnya jumlah pembawa muatan bebas (hole dan elektron). Eksitasi muncul apabila energi foton yang diberikan pada bahan semikonduktor lebih besar atau sama dengan lebar celah dua keadaan, yaitu valensi dan konduksi (hv ≥ pita energi antara 𝐸g) bahan tersebut.
Konduktivitas pembawa muatan dalam bahan semikonduktor mempengaruhi sifat konduksi bahan tersebut. Konduktivitas ideal bahan semikonduktor dipengaruhi oleh lebar celah pita energi, pembawa muatan bebas, dan temperatur. Rumusan konduktivitas bahan semikonduktor sebagai berikut: (Tjakrawadi 2002)
𝜎 = 𝜎0 exp −
𝐸g
2𝑘𝑇 ... (3) Keterangan:
𝜎0 = konduktivitas bahan semikonduktor sebelum disinari
𝐸g = lebar celah pita energi pada bahan semikonduktor
k = konstanta Boltzmann T = temperatur mutlak
Konduktivitas bahan semikonduktor dapat diperoleh dengan mengukur resistansi yang diperoleh dari hasil pengukuran arus dan tegangan (I-V) pada sampel. Hubungan antara konduktivitas dengan resistivitas dapat dilihat dari perumusan (4):
𝜎 =1𝜌 ... (4) Keterangan:
ρ = resistivitas bahan semikonduktor yang diukur (Ωm)
σ = konduktivitas listrik (Sm-1)
Resistivitas bahan semikonduktor dapat ditentukan dengan perumusan (5):
𝜌 = 𝑅𝐴𝐿 ... (5) Keterangan:
A = luas penampang sampel yang akan diukur (m2)
L = lebar sampel
R = resistansi yang diperoleh dari hasil pengukuran I-V (Ω)
Konsep fotokonduktivitas diilustrasikan pada Gambar 8. Arus mengalir pada potongan bahan semikonduktor. Seberkas sinar dikenakan pada bahan tersebut pada arah normal bidang permukaan. Sebelum sinar dikenakan pada potongan bahan semikonduktor tersebut, hubungan antara konduktivitas dengan pembawa muatan bebas dapat dirumuskan seperti persamaan (6):
𝜎0= 𝑒 𝑛0𝜇𝑒+ 𝑝0𝜇 ... (6) Keterangan:
no = konsentrasi muatan elektron
po = konsentrasi muatan hole kesetimbangan
σo = konduktivitas pada keadaan gelap (tidak
diberi sinar)
µe = mobilitas muatan elektron
µh = mobilitas hole
Ketika seberkas sinar dikenakan pada potongan bahan semikonduktor, konsentrasi pembawa muatan bebas bertambah sebesar Δn dan Δp dan arus juga meningkat dengan cepat (Tjakrawadi 2002).
Gambar 8. Prinsip pengukuran fotokonduktivitas
Karena elektron dan hole selalu berpasangan, sehingga berlaku Δn = Δp. Persamaan hubungan antara konduktivitas bahan semikonduktor dengan pembawa muatan bebas adalah:
𝜎 = 𝜎0+ 𝑒 ∆𝑛 𝜇𝑒+ 𝜇 ... (7)
𝜎 = 𝜎0+ 𝑒 ∆𝑛 𝜇 1 + 𝑏 ... (8) dengan 𝑏 = 𝜇𝑒 𝜇𝑛, rasio mobilitas.
I hv
Kenaikan relatif dalam konduktivitas dirumuskan dari persamaan 8:
∆𝜎
𝜎0= 𝑒 ∆𝑛 𝜇 1+𝑏
𝜎0 ... (9) dengan Δσ = σ - σo, yang artinya kenaikan
konduktivitas terinduksi foton relatif terhadap keadaan gelap. Dari persamaan 9, kenaikan relatif nilai konduktivitas sebanding dengan kenaikan jumlah elektron bebas akibat fotogenerasi oleh foton.
BAHAN DAN METODE Waktu dan Tempat Penelitian
Penelitian ini dilakukan mulai bulan Mei sampai dengan Juli 2009. Tempat penelitian dilakukan di Laboratorium Instrumentasi Fisika dan Laboratorium Biofisika Departemen Fisika, Laboratorium Bioteknologi Hasil Perairan 2 Departemen Teknologi Hasil Perairan, dan Laboratorium Fisiologi dan Toksikologi Departemen Proteksi Tanaman, Institut Pertanian Bogor. Alat dan Bahan
Alat-alat yang digunakan pada penelitian ini adalah stoples untuk media kultur, batang pengaduk, kain blacu, plastik mika, sendok, mortar dan pestle, aluminium foil, pipet tetes, tabung reaksi, labu erlenmeyer, gelas kimia, gelas ukur, corong, kertas saring, tissue, labu takar, neraca digital, evaporator, mikroskop, spektrofotometer, spektrofotometer UV-VIS (Ocean Optics), spektrofluorometer (Ocean Optics), kuvet, multimeter digital, mikrovoltmeter digital, potensiometer, source meter (I-V meter) dari Keithley, dan lampu Halogen.
Bahan-bahan yang digunakan pada penelitian ini adalah Spirulina fusiformis yang dikultivasi dengan media Zarouk, aseton, etanol, asetil aseton, aquades, dan substrat TCO (Transparant Conductive Oxide). Metode Penelitian
Kultivasi Spirulina fusiformis
Proses pengkulturan Spirulina fusiformis dilakukan dalam stoples terbuka dengan media Zarouk (Lampiran 2) yang dilarutkan dalam akuades sebanyak 8 liter. Inokulum Spirulina fusiformis dengan volume 800 ml dimasukkan ke dalam larutan tersebut. Media kultur tersebut dibagi dalam 5 stoples,
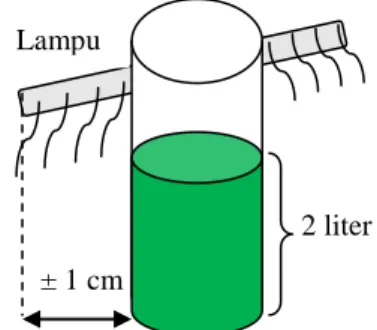
4 stoples masing-masing berisi 2 liter media kultur, sedangkan 1 stoples berisi 800 ml. Kelima stoples tersebut diletakkan dekat cahaya lampu TL (tube lamp) dengan intensitas 3000-4000 lux dan berjarak ± 1 cm dari lampu, seperti yang terdapat pada Gambar 9. Pengadukan dilakukan minimal satu kali sehari pada media kultur tersebut agar kandungan nutriennya merata.
Gambar 9. Kultur Spirulina fusiformis Kurva pertumbuhannya ditentukan dengan mengukur kerapatan optik (Optical Density) kultur setiap hari dengan menggunakan spektrofotometer pada panjang gelombang 480 nm (Panji & Suharyanto 2001). Kurva pertumbuhan ini diperlukan untuk menentukan fase pertumbuhan dan waktu pemanenan. Proses kultivasi dilakukan mulai 19 Mei 2009. Pengukuran OD mulai dilakukan pada 20 Mei 2009 yang dihitung sebagai hari ke-1 dan selanjutnya dilakukan setiap hari sampai kurva pertumbuhan memasuki fase kematian.
Pemanenan dan Pengeringan
Proses pemanenan Spirulina fusiformis dilakukan dua kali, yaitu pada fase logaritmik dan fase stasioner. Proses ini dilakukan dengan menyaring biomassa sel tersebut menggunakan nylon mezh. Penyaringan ini berakhir apabila sudah tidak ada lagi air yang menetes dari nylon mezh tersebut. Biomassa sel dicuci dengan aquades untuk membersihkan residu bahan kimia dari media yang masih bercampur dengan biomassa sel. Biomassa yang diperoleh ditimbang berat basahnya, lalu diratakan setipis mungkin pada plastik mika yang telah dilebarkan pada wadah dengan ketebalan 2-3 mm. Setelah itu biomassa sel dikeringkan menggunakan kipas pada suhu ruang. Biomassa sel yang telah mengering dikeruk menggunakan sendok, kemudian dimasukkan dalam plastik, dan diukur berat biomassa kering yang dihasilkan.
2 liter ± 1 cm
Analisis Kadar Air
Biomassa kering yang telah diperoleh diukur kadar airnya untuk mengetahui kandungan air yang masih terkandung pada biomassa kering tersebut. Proses pengukuran kadar air diawali dengan memasukkan cawan porselin kosong ke dalam oven pada suhu 105 oC selama 60 menit, lalu disimpan dalam desikator selama ± 30 menit dan diukur berat cawan tersebut.
Untuk pengukuran kadar air, sebanyak 0,5 g biomassa kering dimasukkan ke dalam cawan porselin kosong yang telah dikeringkan dalam oven, kemudian cawan beserta isinya dimasukkan kembali dalam oven selama ± 2,5 jam pada suhu yang sama dengan proses oven cawan kosong. Setelah itu, disimpan kembali dalam desikator selama ± 30 menit dan diukur beratnya. Kadar air yang terkandung pada biomassa kering tersebut dihitung, kemudian dilakukan kembali pengeringan bahan yang sama ke dalam oven dengan proses yang sama juga dan dihitung lagi kadar air yang terkandung. Apabila hasil perhitungan belum konstan dengan hasil perhitungan sebelumnya, maka bahan tersebut masih harus dikeringkan lagi dalam oven hingga hasil perhitungan kadar air konstan dengan perhitungan sebelumnya. Persentase kadar air dapat dihitung dengan rumus sebagai berikut: (AOAC 1995)
% 𝐾𝑎𝑑𝑎𝑟 𝑎𝑖𝑟 =𝐵1−𝐵2𝐵 × 100% ... (10) Keterangan:
B = massa sampel awal (g)
B1 = merupakan massa sampel + cawan sebelum dikeringkan (g)
B2 = massa sampel + cawan setelah dikeringkan (g)
Teknik Ekstraksi
Maserasi
Biomassa kering yang dihasilkan digerus menggunakan mortar dan pestle hingga halus dan berbentuk serbuk. Sebanyak 2 g serbuk Spirulina fusiformis dimasukkan ke dalam tabung dan dilarutkan dengan 8 ml aseton perlahan-lahan, lalu diaduk hingga merata dan ditutup rapat dengan dilapisi aluminium foil agar pelarutnya tidak menguap. Larutan tersebut didiamkan selama ± 24 jam, kemudian dipisahkan filtrat dari ekstraknya ke dalam tabung dan ditutup rapat dengan lapisi aluminium foil juga. Ekstrak yang tersisa digerus kembali, lalu dilarutkan lagi 8 ml aseton dan dipisahkan filtrat dari ekstraknya
ke dalam tabung semula. Hal ini dilakukan berulang-ulang sampai larutannya berwarna bening agar klorofil dari Spirulina fusiformis terserap seluruhnya (Sediadi & Edward 1993). Evaporasi
Evaporasi dilakukan untuk menguapkan pelarut dalam larutan ekstrak klorofil, sehingga diperoleh padatan klorofilnya. Sebanyak 50 ml larutan ekstrak klorofil dimasukkan ke dalam tabung evaporator melalui corong yang dilapisi kertas saring whatmann. Larutan klorofil dalam tabung tersebut diuapkan menggunakan evaporator selama satu jam pada suhu 40 oC dan tekanan 556 mbar. Evaporasi dihentikan bila sudah kering yang ditandai dengan menempelnya padatan klorofil pada dinding tabung evaporasi dan berakhirnya tetesan pelarut pada bagian tabung yang menampung pelarut dari larutan klorofil tersebut. Setelah itu, tekanan pada tabung evaporator diturunkan secara perlahan hingga mencapai tekanan minimum (0 mbar). Proses penurunan tekanan ini berlangsung selama sekitar 10 menit.
Gambar 10. Proses evaporasi
Karakterisasi Optik
Karakterisasi optik klorofil yang dilakukan adalah menguji absorbansi dan fluoresensinya. Pengujian absorbansi dilakukan dengan menggunakan spektrofotometer UV-VIS (Ocean Optics) untuk mengetahui panjang gelombang serapan klorofil, sedangkan untuk pengukuran fluoresensi digunakan spektrofluorometer (Ocean Optics). Pengukuran ini dilakukan setelah proses ekstraksi bahan.
Absorbansi
Pengukuran absorbansi tersebut dirangkai terlebih dulu dengan menghubungkan spektrofotometer UV-VIS ke komputer yang
telah diinstal program SpectraSuite (Ocean Optics). Setelah itu tempat kuvet dihubungkan ke spektrofotometer, lalu dihubungkan juga dengan sumber cahaya (Gambar 11 dan 12).
Proses pengukuran ini diawali dengan membuka program SpectraSuite. Kuvet yang berisi aseton sebagai blanko diletakkan pada tempatnya, kemudian lampu sebagai sumber cahaya dinyalakan dan kurva blanko diatur dengan menyesuaikan fiber optic terhadap cahaya lampu. Setelah itu lampu dimatikan tanpa membuat fiber optic bergeser, kemudian kuvet blanko diganti dengan kuvet yang berisi larutan hasil ekstraksi klorofil. Lampu dinyalakan kembali dan dapat dilihat kurva absorbansi yang terbentuk pada komputer.
Gambar 11. Rangkaian pengukuran absorbansi
Gambar 12. Sampel yang berisi larutan untuk pengukuran absorbansi
Fluoresensi
Pengukuran fluoresensi juga dirangkai terlebih dulu dengan menghubungkan spektrofluorometer ke komputer yang telah diinstal program SpectraSuite (Ocean Optics). Setelah itu tempat kuvet dihubungkan ke spektrofluorometer, lalu dihubungkan juga dengan sumber cahaya (Gambar 13 dan 14).
Proses pengukuran ini merupakan lanjutan dari pengukuran absorbansi, akan tetapi sumber cahaya yang digunakan adalah laser. Laser disinari langsung terhadap kuvet yang berisi larutan klorofil tersebut, sehingga diperoleh kurva fluoresensi yang terbentuk pada komputer. Kurva fluoresensi yang terbentuk ditandai dengan adanya pendaran cahaya merah pada larutan klorofil yang terkena laser tersebut.
Gambar 13. Rangkaian pengukuran fluoresensi
vv
Gambar 14. Sampel yang berisi larutan untuk pengukuran fluoresensi Detektor (Spektrofotometer) Larutan Klorofil Sinar Kuvet Sinar Laser (sumber eksitasi) Kuvet Detektor (Spektrofluorometer) Larutan Klorofil
Uji Fotokonduktivitas
Uji fotokonduktivitas dilakukan dengan mengukur karakteristik arus tegangan (I-V) dari sel elektrokimia yang mengandung ekstrak klorofil dalam kondisi gelap dan terang. Tegangan dipindahi dari -2 volt hingga +2 volt sambil diukur arusnya dalam kondisi gelap dan terang. Dalam kondisi terang digunakan lampu halogen dengan variasi intensitas 0,449 W/m2, 1,047 W/m2, 1,496 W/m2, 2,992 W/m2, dan 4,488 W/m2.
Pengkuran hubungan arus dan tegangan ini menggunakan alat I-V meter (SourceMeter, Keithley). Pengukuran dilakukan menggunakan komputer yang dihubungkan dengan software. Rangkaian pengukuran I-V ditunjukkan pada Gambar 15.
Gambar 15. Skema pengukuran I-V untuk memperoleh fotokonduktivitas Padatan klorofil yang merupakan hasil evaporasi dilarutkan dengan asetil aseton, kemudian diteteskan di atas kaca TCO pada bagian konduktif, lalu ditutup dengan kaca TCO yang lain dengan bagian konduktif saling berhadapan (seperti struktur sandwich). Kedua TCO tersebut dijepit pada bagian sisinya dan didiamkan hingga larutan klorofil mengering. Setelah larutan tersebut mengering, maka karakterisasi I-V dapat diukur.
Proses pengukuran I-V dilakukan dengan menjepit kedua ujung TCO menggunakan I-V meter, lalu tegangan dipindahi dari -2 V sampai +2 V sambil diukur arusnya. Proses ini dilakukan dalam kondisi gelap dan terang, sesuai intensitas yang telah ditentukan. Data keluarannya merupakan nilai arus dan tegangan, kemudian dibuat kurva hubungan menggunakan Microsoft Excel. Dari kurva tersebut dapat diketahui karakteristik lapisan tipis klorofil pada TCO.
Komputer I-V meter (SourceMeter , Keithley) TCO TCO hv Klorofil
HASIL DAN PEMBAHASAN Kultivasi Spirulina fusiformis
Pertumbuhan Spirulina fusiformis berlangsung selama 86 hari. Proses pertumbuhan diketahui dengan mengukur nilai kerapatan optik (Optical Density). Hasil OD yang diperoleh selama penelitian menunjukkan kurva pertumbuhan Spirulina fusiformis. Sel Spirulina fusiformis yang dikultur dapat dilihat pada Gambar 16.
Gambar 16. Sel Spirulina fusiformis Berdasarkan kurva pertumbuhan seperti yang terdapat pada Gambar 17, dapat diketahui bahwa fase lag terjadi mulai hari ke-1 sampai hari ke-7. Pada fase ini sel mulai mengalami pertumbuhan, tetapi sangat kecil karena sel tersebut masih beradaptasi dengan lingkungan barunya. Fase logaritmik (eksponensial) terjadi mulai hari ke-8 sampai hari ke-25. Pada fase ini pertumbuhan sel semakin tinggi karena terjadi pembelahan sel dan pemanenan pada fase logaritmik ini dilakukan pada hari ke-18. Fase penurunan
laju pertumbuhan terjadi mulai hari ke-26 sampai hari ke-41. Pada fase ini pertumbuhan sel masih terjadi, tetapi lebih kecil daripada fase logaritmik karena mulai terjadi kematian sel. Namun, pertumbuhan selnya masih lebih tinggi dibandingkan kematian selnya. Fase stasioner terjadi mulai hari ke-42 sampai hari ke-78. Pada fase ini terdapat keseimbangan antara sel yang tumbuh dan sel yang mati, lalu pemanenan pada fase ini dilakukan pada hari ke-49. Fase kematian mulai hari ke-79 dan pada fase ini kematian sel lebih tinggi daripada pertumbuhan selnya.
Pemanenan dan Pengeringan
Pemanenan dilakukan pada dua fase (fase logaritmik dan fase stasioner). Pada fase logaritmik dari kultur sebanyak 2 liter diperoleh biomassa sel basah sebesar 14,31 gram dan biomassa sel kering sebesar 1,23 gram, sedangkan pada fase stasioner diperoleh biomassa sel basah sebesar 19,85 gram dan biomassa sel kering sebesar 2,59 gram. Dengan demikian, biomassa sel yang diperoleh pada fase stasioner lebih banyak daripada fase logaritmik. Hal ini dapat dilihat berdasarkan kurva pertumbuhan dimana kerapatan biomassa sel dari fase logaritmik menuju fase stasioner semakin besar (Costa et al 2003). Semakin besar kerapatan biomassa sel tersebut menunjukkan bahwa biomassa sel yang dihasilkan semakin banyak.
Proses pengeringan yang dihasilkan dari kedua fase sama, yaitu berlangsung selama ± 3 jam.
Gambar 17. Kurva pertumbuhan Spirulina fusiformis -2.000 -1.500 -1.000 -0.500 0.000 0.500 1.000 1.500 2.000 2.500 3.000 0 5 10 15 20 25 30 35 40 45 50 55 60 65 70 75 80 85 ln O D (4 8 0 nm ) Hari
Analisis Kadar Air
Biomassa sel kering Spirulina fusiformis yang dihasilkan pada kedua fase, diukur kadar air serbuknya. Pada fase logaritmik kadar air yang diperoleh adalah sebesar 10%, sedangkan pada fase stasioner kadar air yang diperoleh adalah sebesar 12%. Berdasarkan hasil kadar air tersebut, dapat dilihat bahwa serbuk Spirulina fusiformis pada fase logaritmik memiliki kandungan air yang lebih sedikit dibandingkan fase stasioner.
Ekstraksi dan Kadar Klorofil
Biomassa sel yang dipanen pada fase logaritmik memerlukan waktu ekstraksi untuk klorofil lebih lama (14 hari) dibanding yang dipanen pada fase stasioner (8 hari).
Berdasarkan perhitungan kadar klorofil (Jeffrey & Humprey 1975), seperti yang terdapat pada Lampiran 8 diperoleh bahwa pada fase logaritmik kadar klorofil sebanyak 364,63 µg/l dengan persentasi sebesar 0,06% dan pada fase stasioner kadar klorofil sebanyak 240,93 µg/l dengan persentasi sebesar 0,02%. Hal ini menunjukkan bahwa kadar klorofil pada fase logaritmik lebih tinggi dibandingkan fase stasioner. Tingginya kadar klorofil yang dihasilkan pada fase logaritmik ini disebabkan karena kandungan nutrien medium lebih banyak dibandingkan fase stasioner (Fogg & Thake 1987). Nutrien merupakan makanan utama Spirulina fusiformis yang menghasilkan klorofil (Sediadi & Edward 1993).
Persentase klorofil spirulina umumnya sebesar 1% dari berat kering (Henrikson 1997 diacu dalam Mohammad), namun hasil perhitungan total klorofil yang diperoleh pada penelitian ini kurang dari 1%. Seperti diketahui bahwa unsur utama pembentuk klorofil adalah N, Mg, dan Fe, maka dapat diduga persentase klorofil yang kurang dari 1% disebabkan karena tidak terdapatnya unsur Mg dalam media pertumbuhan klorofil ini (Anonim 2009).
Absorbansi Klorofil
Sifat optik suatu larutan dapat diamati dengan menggunakan spektrofotometer. Berbagai sifat optik yang dapat diamati dengan alat tersebut antara lain absorbansi, transmitansi, dan reflaktansi. Pada penelitian ini yang diamati adalah absorbansi larutan klorofil terhadap panjang gelombangnya.
Hal ini bertujuan untuk melihat daerah serapan klorofil pada berbagai panjang gelombang.
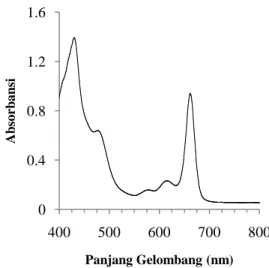
Pengukuran absorbansi klorofil pada fase logaritmik dilakukan pada rentang panjang gelombang 400-800 nm. Namun demikian nilai serapan klorofil lebih berfluktuasi pada selang 400-700 nm, sedangkan pada panjang gelombang yang lebih besar dari 700 nm tidak ada absorpsi oleh klorofil. Nilai absorbansi klorofil pada fase logaritmik dapat dilihat pada Gambar 18.
Gambar 18. Spektrum absorbansi larutan klorofil pada fase logaritmik Berdasarkan Gambar 18 dapat diketahui bahwa serapan tertinggi larutan klorofil berada pada panjang gelombang 429,87 nm dengan nilai absorbansi sebesar 1,393. Klorofil hampir tidak menyerap pada daerah inframerah. Kurva tersebut juga memperlihatkan bahwa serapan klorofil memiliki lima pita serapan, yaitu pada selang 400-450 nm, 450-500 nm, 550-600 nm, 600-625 nm, dan 625-675 nm.
Hasil pengukuran absorbansi klorofil pada fase stasioner menunjukkan hasil yang hampir serupa dengan fase logaritmik. Nilai absorbansi pada fase stasioner dilakukan pada rentang panjang gelombang 400-800 nm. Namun demikian nilai serapan klorofil lebih berfluktuasi pada selang 400-700 nm, sedangkan pada panjang gelombang yang lebih besar dari 700 nm tidak ada absorpsi oleh klorofil. Nilai absorbansi klorofil pada fase logaritmik dapat dilihat pada Gambar 19.
0 0.4 0.8 1.2 1.6 400 500 600 700 800 Ab so rb a n si Panjang Gelombang (nm)
Gambar 19. Spektrum absorbansi larutan klorofil pada fase stasioner Berdasarkan Gambar 19 dapat diketahui bahwa serapan paling tinggi berada pada panjang gelombang 468,47 nm dengan nilai absorbansi sebesar 2,241. Grafik tersebut juga memperlihatkan bahwa serapan klorofil memiliki dua pita serapan, yaitu pada selang 450-500 nm dan 625-675 nm.
Berdasarkan kedua perlakuan diatas dapat diperoleh kesimpulan bahwa secara umum absorbansi klorofil berada pada rentang panjang gelombang 400 nm sampai 700 nm. Klorofil hampir tidak menyerap pada daerah inframerah. Perbandingan nilai absorbansi dari kedua perlakuan tersebut dapat dilihat pada Gambar 20.
Gambar 20. Spektrum absorbansi larutan klorofil pada fase logaritmik
dan fase stasioner
Berdasarkan Gambar 20 dapat diketahui bahwa spektrum absorbansi larutan klorofil dari fase logaritmik memiliki lima pita serapan, sedangkan fase stasioner hanya memiliki dua pita serapan. Perbedaan banyaknya puncak absorbansi ini menunjukkan kandungan pigmen yang terdapat pada kedua fase pertumbuhan. Nilai absorbansi yang lebih tinggi dari kedua fase yaitu pada selang panjang gelombang 400-460 nm daripada selang panjang gelombang 625-675 nm. Hal ini sesuai dengan pernyataan Campbell (2000) yang menyatakan bahwa klorofil-a menyerap daerah dengan panjang gelombang 430 nm dan 660 nm, sedangkan klorofil-b menyerap daerah dengan panjang gelombang 460 nm dan 650 nm. Klorofil merupakan pigmen yang spesifik dan dapat diekstraksi menggunakan aseton (Kusnawijaya diacu dalam Sediadi & Edward 1993).
Kedua kurva tersebut memperlihatkan adanya energi transisi yang dapat diamati melalui pita absorbansinya. Energi transisi ini terjadi karena elektron-elektron mengalami eksitasi dari keadaan dasar ke keadaan tereksitasi akibat absorpsi cahaya.
Untuk menerangkan peristiwa absorpsi energi radiasi oleh molekul, maka radiasi elektromagnetik dipandang sebagai partikel-partikel yang disebut foton. Oleh Max Planck dinyatakan bahwa energi setiap foton berbanding lurus dengan frekuensi radiasi. Energi eksitasi diberikan oleh persamaan:
𝐸𝑒𝑘𝑠𝑖𝑡𝑎𝑠𝑖 = 𝑣 =𝜆 𝑐
𝑒𝑘𝑠𝑖𝑡𝑎𝑠𝑖 ……….. (11)
Besar energi eksitasi pada fase logaritmik untuk panjang gelombang 429,87 nm yaitu 2,892 eV dan untuk panjang gelombang 661,89 nm yaitu 1,878 eV, sedangkan pada fase stasioner untuk panjang gelombang 468,47 nm yaitu 2,654 eV dan untuk panjang gelombang 658,5 nm yaitu 1,888 eV. Dari hasil tersebut dapat diketahui bahwa bahan organik klorofil mengalami proses eksitasi ketika diberikan cahaya dan elektron tereksitasi dari keadaan HOMO ke keadaan LUMO, sehingga menjadi elektron konduksi.
Fluoresensi Klorofil
Fluoresensi merupakan luminesensi yang banyak ditemukan sebagai fenomena optik, dimana penyerapan foton oleh molekul menjadi pemicu emisi foton dengan panjang gelombang yang lebih panjang. Selisih antara 0 0.4 0.8 1.2 1.6 2 2.4 400 500 600 700 800 Ab so rb a n si Panjang Gelombang (nm) 0 0.4 0.8 1.2 1.6 2 2.4 400 500 600 700 800 A b so rb a n si Panjang Gelombang (nm) Logaritmik Stasioner
energi absorbsi dan emisi digunakan untuk vibrasi dan rotasi molekul.
Larutan klorofil Spirulina fusiformis yang merupakan hasil ekstraksi menghasilkan spektrum fluoresensi. Puncak fluoresensi tertinggi (intensitas relatif) yang dihasilkan pada fase logaritmik berada pada panjang gelombang 675,49 nm, sedangkan pada fase stasioner puncak tertingginya berada pada panjang gelombang 678,02 nm. Adapun kurva fluoresensi kedua fase tersebut dapat dilihat pada Gambar 21 dan 22.
Gambar 21. Spektrum fluoresensi fase logaritmik
Gambar 22. Spektrum fluoresensi fase stasioner
Kedua kurva fluoresensi di atas memperlihatkan adanya transisi elektron dari keadaan tereksitasi (LUMO) ke keadaan dasar (HOMO). Emisi fluoresensi yang dihasilkan memiliki panjang gelombang lebih besar dari panjang gelombang eksitasi, sebaliknya energi elektromagnetik yang diemisikan lebih kecil
daripada energi absorpsi. Energi emisi diberikan oleh:
𝐸𝑒𝑚𝑖𝑠𝑖 = 𝑣 =𝜆𝑐
𝑒𝑚𝑖𝑠𝑖 ……… (12)
dengan h merupakan konstanta Planck, v merupakan frekuensi foton, c merupakan kecepatan cahaya, dan λ merupakan panjang gelombang foton.
Besar energi emisi pada fase logaritmik untuk panjang gelombang 675,49 nm yaitu 1,840 eV, sedangkan pada fase stasioner, besar energi emisinya untuk panjang gelombang 678,02 nm yaitu 1,833 eV. Hal ini menunjukkan bahwa besar energi emisi untuk kedua fase tidak jauh berbeda, yaitu berkisar antara 1,8 eV karena bahan yang digunakan berasal dari sumber yang sama, yaitu klorofil
Spirulina fusiformis.
Dari hasil fluoresensi yang diperoleh dapat dikatakan bahwa klorofil merupakan bahan organik yang mengalami proses fluoresensi. Proses emisi yang terjadi pada penelitian ini yaitu emisi fotolistrik (photovoltaic emission) karena energi yang diberikan pada elektron melalui foton adalah energi cahaya yang oleh elektron kemudian diubah menjadi energi mekanik, sehingga elektron tersebut dapat terlepas dari keadaan tereksitasi (LUMO) kembali ke keadaan dasar (HOMO).
Jika dibandingkan hasil absorbansi (eksitasi) maupun fluoresensi (emisi), diperoleh hasil bahwa panjang gelombang eksitasi lebih kecil daripada emisi, sehingga energi transisi eksitasi yang dibutuhkan lebih besar daripada energi transisi emisi. Hal ini disebabkan karena ketika elektron tereksitasi, energi yang dimilikinya lebih tinggi dari keadaan dasarnya. Pada saat foton tersebut teremisi, energi yang dimilikinya lebih kecil daripada energi eksitasi.
Uji Fotokonduktivitas Kurva Arus-Tegangan (I-V)
Arus listrik merupakan banyaknya muatan listrik yang mengalir tiap satuan waktu dimana muatan listrik tersebut bisa mengalir melalui kabel atau penghantar listrik lainnya. Tegangan listrik (Voltase) merupakan perbedaan potensial listrik antara dua titik dalam rangkaian listrik.
Karakterisasi arus-tegangan (I-V) dari klorofil yang diekstrak dari mikroalga Spirulina fusiformis dilakukan dalam kondisi gelap (0 W/m2) dan terang (berbagai intensitas cahaya). Intensitas cahaya yang diberikan 0 10000 20000 30000 40000 50000 60000 400 600 800 1000 Flu o re se n si Panjang Gelombang (nm) 0 5000 10000 15000 20000 25000 400 600 800 1000 Flu o re se n si Panjang Gelombang (nm)
adalah 0,449 W/m2, 1,047 W/m2, 1,496 W/m2, 2,992 W/m2, dan 4,488 W/m2. Kurva I-V tersebut dapat dilihat pada Gambar 23 dan 24.
Gambar 23. Kurva I-V klorofil pada fase logaritmik
Gambar 24. Kurva I-V klorofil pada fase stasioner
Berdasarkan Gambar 23 dan 24 dapat diketahui nilai resistansi dan konduktivitas klorofil pada setiap intensitas cahaya yang berbeda. Pada fase logaritmik dan fase stationer dapat dilihat bahwa kurva I-V berbentuk linier (ohmik). Kemiringan kurva I-V meningkat terhadap kenaikan intensitas cahaya yang diberikan. Kemiringan kurva (slope) pada kedua fase adalah berbeda. Kemiringan (slope) ini menunjukkan besarnya resistansi pada klorofil.
Resistansi
Berdasarkan kurva-kurva pada Gambar 23 dan 24, maka dapat ditentukan resistansi (hambatan) klorofil pada setiap intensitas cahaya, yaitu dengan menentukan kemiringan kurva I-V. Nilai resistansi merupakan satu per kemiringan kurva. Pada fase logaritmik dan stasioner diperoleh nilai resitansi yang berbeda pada setiap intensitas cahaya. Kurva resistansi pada kedua fase dapat dilihat melalui Gambar 25.
Gambar 25. Kurva resistansi klorofil pada fase logaritmik dan fase stasioner
Pada fase logaritmik, dalam kondisi gelap diperoleh nilai resistansi sebagai slope sekitar 135,389 Ω, kondisi terang dengan intensitas 0,449 W/m2 diperoleh nilai resistansi sekitar 131,384 Ω, intensitas 1,047 W/m2 diperoleh nilai resistansi sekitar 129,039 Ω, intensitas 1,496 W/m2 diperoleh nilai resistansi sekitar 127,372 Ω, intensitas 2,992 W/m2 diperoleh nilai resistansi sekitar 126,436 Ω, dan intensitas 4,488 W/m2 diperoleh nilai resistansi sekitar 124,429Ω.
Pada fase stasioner, dalam kondisi gelap diperoleh nilai resistansi sebagai slope sekitar 127,148 Ω, kondisi terang dengan intensitas 0,449 W/m2 diperoleh nilai resistansi sekitar 121,657 Ω, intensitas 1,047 W/m2 diperoleh nilai resistansi sekitar 120,089 Ω, intensitas 1,496 W/m2 diperoleh nilai resistansi sekitar 118,298 Ω, intensitas 2,992 W/m2 diperoleh nilai resistansi sekitar 115,285 Ω, dan intensitas 4,488 W/m2 diperoleh nilai resistansi sekitar 114,165 Ω. 0 0.001 0.002 0.003 0.004 0.005 0.006 0 0.2 0.4 0.6 0.8 1 K u a t A ru s Lis tr ik (A ) Tegangan (V) 0 W/m2 0,449 W/m2 1,047 W/m2 1,496 W/m2 2,992 W/m2 4,488 W/m2 0 0.001 0.002 0.003 0.004 0.005 0.006 0 0.2 0.4 0.6 0.8 1 K u a t A ru s Lis tr ik (A ) Tegangan (V) 0 W/m2 0,449 W/m2 1,047 W/m2 1,496 W/m2 2,992 W/m2 4,488 W/m2 110 115 120 125 130 135 140 0 1 2 3 4 5 Resi st a n si ( Ω) Intensitas Cahaya (W/m2) Logaritmik Stasioner
Jika dilihat hasil dari kedua perlakuan di atas, nilai resistansi menurun seiring dengan kenaikan intensitas cahaya. Hal ini disebabkan karena adanya tambahan pembawa muatan bebas (elektron) yang tereksitasi ketika diberikan cahaya. Elektron ini semakin bertambah seiring dengan meningkatnya intensitas cahaya yang diberikan dan menyebabkan resistansi semakin menurun. Resistansi yang semakin rendah inilah yang menyebabkan arusnya semakin tinggi. Berdasarkan kedua sampel, nilai resistansi yang paling besar terdapat pada sampel fase logaritmik.
Resistivitas
Resistivitas merupakan salah satu faktor yang mempengaruhi resistansi. Kurva resistivitas yang diperoleh pada fase logaritmik dan stasioner dapat dilihat pada Gambar 26.
Gambar 26. Kurva resistivitas klorofil pada fase logaritmik dan fase stasioner
Pada fase logaritmik, dalam kondisi gelap diperoleh nilai resistivitas sekitar 194 Ωm, kondisi terang dengan intensitas 0,449 W/m2 diperoleh nilai resistivitas sekitar 188 Ωm, intensitas 1,047 W/m2 diperoleh nilai resistivitas sekitar 185 Ωm, intensitas 1,496 W/m2 diperoleh nilai resistivitas sekitar 182 Ωm, intensitas 2,992 W/m2 diperoleh nilai resistivitas sekitar 181 Ωm, dan intensitas 4,488 W/m2 diperoleh nilai resistivitas sekitar 178 Ωm.
Pada fase stasioner, dalam kondisi gelap diperoleh nilai resistivitas sekitar 242 Ωm, kondisi terang dengan intensitas 0,449 W/m2 diperoleh nilai resistivitas sekitar 231 Ωm, intensitas 1,047 W/m2 diperoleh nilai resistivitas sekitar 228 Ωm, intensitas 1,496 W/m2 diperoleh nilai resistivitas sekitar 225 Ωm, intensitas 2,992 W/m2 diperoleh
nilai resistivitas sekitar 219 Ωm, dan intensitas 4,488 W/m2 diperoleh nilai resistivitas sekitar 217 Ωm.
Jika dilihat dari hasil yang diperoleh pada kedua fase, diperoleh bahwa resistivitas semakin menurun seiring dengan kenaikan intensitas cahaya. Data resistivitas yang diperoleh menunjukkan bahwa klorofil bersifat sebagai semikonduktor karena resistivitas bahan semikonduktor berada pada selang sekitar 10-5 sampai 106 Ωm (Tyagi 1934).
Konduktivitas
Besar konduktivitas bahan semikonduktor dapat ditentukan dari resistivitas yang diperoleh, dimana hubungan antara konduktivitas dan resistivitas berbanding terbalik. Adapun kurva konduktivitas pada fase logaritmik dan stasioner dapat dilihat pada Gambar 27.
Gambar 27. Kurva konduktivitas klorofil pada fase logaritmik dan fase stasioner
Pada fase logaritmik, dalam kondisi gelap diperoleh nilai konduktivitas sekitar 0,00517 S/m, kondisi terang dengan intensitas 0,449 W/m2 diperoleh nilai konduktivitas sekitar 0,00532 S/m, intensitas 1,047 W/m2 diperoleh nilai konduktivitas sekitar 0,00542 S/m, intensitas 1,496 W/m2 diperoleh nilai konduktivitas sekitar 0,00549 S/m, intensitas 2,992 W/m2 diperoleh nilai konduktivitas sekitar 0,00553 S/m, dan intensitas 4,488 W/m2 diperoleh nilai konduktivitas sekitar 0,00562 S/m.
Pada fase stasioner, dalam kondisi gelap diperoleh nilai konduktivitas sekitar 0,00414 S/m, kondisi terang dengan intensitas 0,449 W/m2 diperoleh nilai konduktivitas sekitar 0,00433 S/m, intensitas 1,047 W/m2 170 180 190 200 210 220 230 240 250 0 1 2 3 4 5 R es istiv ita s ( Ω m) Intensitas Cahaya (W/m2) Logaritmik Stasioner 0.0040 0.0042 0.0044 0.0046 0.0048 0.0050 0.0052 0.0054 0.0056 0.0058 0 1 2 3 4 5 K o n d u k tiv ita s (S /m ) Intensitas Cahaya (W/m2) Logaritmik Stasioner
diperoleh nilai konduktivitas sekitar 0,00438 S/m, intensitas 1,496 W/m2 diperoleh nilai konduktivitas sekitar 0,00445 S/m, intensitas 2,992 W/m2 diperoleh nilai konduktivitas sekitar 0,00457 S/m, dan intensitas 4,488 W/m2 diperoleh nilai konduktivitas sekitar 0,00461 S/m.
Berdasarkan kedua perlakuan di atas, konduktivitas listrik meningkat seiring dengan kenaikan intensitas cahaya yang diberikan. Kenaikan konduktivitas ini disebabkan karena bertambahnya jumlah pembawa muatan bebas akibat diberikan cahaya dengan intensitas yang meningkat. Bertambahnya muatan bebas ini mengakibatkan resistansi dan resistivitas semakin menurun. Oleh karena konduktivitas berbanding terbalik dengan resistivitas, maka kurva hubungan konduktivitas terhadap kenaikan intensitas cahaya semakin naik. Hal ini menunjukkan bahwa klorofil mempunyai respon terhadap cahaya dan dapat dimanfaatkan sebagai dye sensitizer, fotokonduktor, dan fotosel.
Jika diurutkan dari kedua sampel di atas, nilai konduktivitas yang terbesar hingga yang terkecil adalah sampel pada fase logaritmik dan kemudian fase stasioner. Dalam hal ini dapat dikatakan bahwa sampel klorofil pada fase logaritmik merupakan bahan yang lebih sensitif terhadap cahaya dan memiliki sifat fotokonduktif yang lebih baik. Hal ini diduga karena pada fase logaritmik kadar klorofil yang dihasilkan lebih banyak. Klorofil merupakan bahan yang sangat peka terhadap cahaya dan bersifat konduktif (Lipsova et al 2007). Bersadarkan penelitian yang telah dilakukan, diperoleh suatu hasil bahwa klorofil Spirulina fusiformis baik untuk digunakan dalam aplikasi sel surya maupun fotosensitizer.
Proses terjadinya fotokonduktif tersebut disebabkan elektron menyerap energi cahaya yang datang dari lampu. Semakin banyak cahaya (foton) yang diserap oleh elektron pada keadaan HOMO, maka semakin banyak elektron yang tereksitasi ke keadaan LUMO, sehingga lebih banyak menghasilkan arus listrik.
KESIMPULAN DAN SARAN Kesimpulan
Pertumbuhan Spirulina berlangsung selama 86 hari yang terdiri dari lima fase, yaitu fase lag (hari ke-1 sampai 7), fase logaritmik (hari ke-8 sampai 25), fase penurunan laju (hari ke-26 sampai 41), fase stasioner (hari ke-42 sampai 78), dan fase kematian (mulai hari ke-79)
Hasil pemanenan menunjukkan bahwa biomassa sel yang dihasilkan pada fase logaritmik lebih sedikit dibandingkan fase stasioner, namun kadar klorofil yang diperoleh pada fase logaritmik lebih tinggi dibandingkan fase stasioner.
Nilai absorbansi dan fluoresensi menunjukkan bahwa klorofil merupakan bahan organik yang mengalami proses eksitasi dan emisi. Panjang gelombang yang diperoleh saat eksitasi lebih kecil daripada emisi, sedangkan energi transisi eksitasi lebih besar daripada emisi.
Besar konduktivitas listrik semakin besar seiring dengan kenaikan intensitas cahaya, sedangkan resistansi dan resistivitasnya semakin kecil, sehingga klorofil Spirilina fusiformis merupakan bahan semikonduktor yang fotokonduktif dan baik untuk digunakan dalam aplikasi sel surya maupun fotosensitizer. Sampel pada fase logaritmik memiliki nilai konduktivitas yang lebih besar daripada fase stasioner, sehingga sampel pada fase logaritmik lebih konduktif dan lebih baik digunakan dalam aplikasi sel surya maupun fotosensitizer.
Saran
Penelitian ini dapat dilanjutkan hingga ke aplikasinya dan mencari rendemen antara banyaknya kultur yang diperlukan terhadap aplikasinya. Hasilnya dapat dibandingkan juga dengan menggunakan media dan proses kultivasi yang berbeda, misalnya media NPK dan cahaya matahari.
Pengukuran fotokonduktivitas juga dapat dilakukan dengan metode dan sumber cahaya yang berbeda-beda.
Penelitian ini dapat dikembangkan dengan mengisolasi senyawa porphyrin dari klorofil menggunakan metode kromatografi.