ADSORPSI ION LOGAM CADMIUM DENGAN SILIKA MODIFIKASI
Fransiska Sri Herwahyu Krismastuti1*, Harry Budiman1, Achmad Hanafi Setiawan1 1
Pusat Penelitian Kimia – Lembaga Ilmu Pengetahuan Indonesia Kawasan PUSPIPTEK, Serpong, Tangerang 15314
Telp. (021)7560929, Fax. (021)7560549 *
email: [email protected]
ABSTRAK
Upaya penangan limbah yang mengandung logam berat terus dilakukan, salah satunya adalah dengan metoda adsorpsi. Pada penelitian ini telah dilakukan modifikasi silika gel dengan menggunakan ligan 2-mercaptoimidazole dan aplikasinya untuk penyerapan logam berat Cadmium (Cd) dari sampel air. Silika gel, dalam hal ini berfungsi sebagai material pendukung dan 2-mercaptoimidazole sebagai ligan yang akan diimobilisasikan ke permukaan silika gel sehingga kemampuan adsorpsi dari silika gel akan meningkat. Karakterisasi silika gel dilakukan dengan menggunakan spektroskopi FTIR untuk memastikan 2-mercaptoimidazole telah terimobilisasi pada silika gel. Hasil karakterisasi menunjukkan bahwa 2-mercaptoimidazole telah terimobilisasi pada permukaan silika gel dengan munculnya bilangan gelombang pada 2630 cm-1 yang karakteristik dengan S-H stretch, N-H bend pada 1585 cm-1, C-S stretch pada 673.16 cm-1, dan C=C stretch pada 3128.54 cm-1. Kondisi optimum adsorpsi yang meliputi pengaruh pH, konsentrasi awal ion logam, dan waktu interaksi ditentukan dengan menggunakan model batch adsorption
untuk mengetahui jumlah ion logam Cd yang teradsorp. Hasil yang diperoleh menunjukkan bahwa adsorpsi paling optimum terjadi pada kondisi pH 9, konsentrasi 10 ppm, dan waktu interaksi 3 jam.
Kata kunci: adsorpsi, cadmium, logam berat, silika, 2-mercaptoimidazole
PENDAHULUAN
Keberadaan logam berat sebagai polutan bagi lingkungan hidup diawali dengan evolusi umat manusia dan meningkat seiring dengan berkembangnya populasi dan industrialisasi dari proses modernisasi manusia itu sendiri. Logam berat adalah senyawa kimia yang berupa logam dengan berat molekul yang tinggi dan memiliki sifat beracun. Keberadaannya di air atau air limbah dengan konsentrasi melebihi ambang batas dapat memberikan dampak negatif bagi siklus biologi yang normal di lingkungan1. Dampak negatif yang langsung dirasakan oleh manusia antara lain gangguan kesehatan dan keracunan seperti gangguan fungsi syaraf,
perubahan komposisi darah, kelainan pada jantung, paru-paru dan sebagainya1. Logam berbeda dengan polutan berbahaya lainnya karena logam bersifat tidak terdegradasi, dapat terakumulasi pada jaringan hidup, dan terkonsentrasi pada rantai makanan2. Diantara ion logam pencemar lingkungan yang berbahaya adalah Cadmium, Timbal, Seng, Merkuri, Tembaga, dan Besi2.
Berbagai teknik pengambilan logam berat dari air telah dikembangkan, misalnya filtrasi, pengendapan secara kimia, adsorpsi pertukaran ion, electro-deposition, dan sistem membran4. Salah satu teknik yang banyak dikembangkan adalah prinsip ekstraksi fasa padat
(solid phase extraction) dengan menggunakan adsorben tertentu karena tidak membutuhkan pelarut yang berbahaya. Metode ini berdasarkan pada interaksi logam dengan gugus fungsional yang ada dipermukaan adsorben, umumnya yang mengandung gugus fungsional -OH, -NH, -SH, dan –COOH5. Sorben yang paling sering digunakan dalam prekonsentrasi logam-logam dalam sampel lingkungan adalah resin polimer, silika gelas berpori, silika yang dimodifikasi dengan proses grafting, atau metode sol gel6.
Silika sering kali dimodifikasi dengan gugus organik tertentu untuk meningkatkan kemampuan adsorpsinya. Hal ini dikarenakan silika memiliki beberapa sifat unik yang tidak dimiliki oleh senyawa anorganik lainnya, seperti inert, sifat adsorpsi dan pertukaran ion yang baik, mudah dimodifikasi dengan senyawa kimia tertentu untuk meningkatkan kinerjanya7, kestabilan mekanik dan termal tinggi, serta dapat digunakan untuk prekonsentrasi atau pemisahan analit karena proses pengikatan analit pada permukaan silika yang bersifat reversible8.
Permukaan silika yang dikarakterisasi dengan hadirnya gugus silanol (-SiOH) dan siloksan (Si-O-Si) memungkinkan silika dimodifikasi dengan gugus organik tertantu yang dapat berikatan dengan silika dan juga secara selektif dapat mengikat ion logam dengan mekanisme tertentu9. Gugus organik tersebut umumnya adalah senyawa yang mempunyai atom donor seperti S, N, O, P yang sering disebut sebagai ligan. Proses modifikasi silika dengan ligan tertentu dapat terjadi melalui 2 proses, yaitu secara kimia jika terbentuk ikatan kimia antara ligan organik dengan silika yang telah mengandung gugus amin atau klor dan secara
fisik jika terjadi adsorpsi secara fisik dari ligan ke permukaan silika7.
Artikel ini akan memaparkan tentang modifikasi silika dengan ligan organik, 2-mercaptoimidazole dengan menggunakan senyawa perantara 3-chloropropyltrimethoxysilane sehingga adsorben modifikasi ini dapat digunakan untuk mengikat ion logam Cadmium yang merupakan golongan asam lemah (soft acid) dalam pengelompokkan HSAB (Hard Soft Acid-Base). Adsorben hasil modifikasi dianalisis dengan menggunakan
Fourier Tranform Infrared Spectrophotometer.
Sedangkan parameter yang dikaji adalah variable yang mempengaruhi kemampuan penyerapan silika gel, seperti pH, konsentrasi, dan waktu kontak dengan logam.
PERCOBAAN Bahan Kimia
Bahan kimia yang digunakan merupakan bahan kimia grade pro analysis (p.a), yang terdiri atas silika gel, 3-chloropropyltrimethoxysilane, 2-mercaptoimidazole, logam Cadmium, etanol, toluen, natrium sulfat anhydrous, natrium hidrogenposfat, asam sitrat, kalium klorida, natrium hidroksida, asam borat, asam nitrat, air demineralisasi, gas nitrogen.
Larutan stok Cadmium(II) 1000 ppm dibuat dengan melarutkan 0.1 gram logam Cd dalam 3 mL asam nitrat 1:1 lalu diencerkan sampai 100 mL dengan menggunakan air demineralisasi.
Alat yang digunakan meliputi: peralatan refluks untuk pembuatan silika termodifikasi, hotplate IKA®C-MAG HS 7,
Shaker Micromat, Vacuum Oven, dan furnace
Sibata . Silika modifikasi dikarakterisasi oleh
Fourier Transform Infra Red Spectrometer
(FT-IR) Shimadzu. Sedangkan konsentrasi Cadmium(II) sisa di larutan diukur dengan
Graphite Furnace Atomic Absorption
Spectrometer SpectrAA-880 Zeeman Varian.
Metoda
Preparasi silika termodifikasi oleh 2-mercaptoimidazole
Aktivasi silika. Sebanyak 10 g silika gel direndam dengan 50 mL asam klorida 4 M dan direfluks disertai pengadukan selama 4 jam. Kemudian, campuran disaring dan silika gel dicuci dengan air demineralisasi sampai bebas asam. Selanjutnya silika dikeringkan di furnace
pada suhu 150oC selama 5 jam.
Silika dimodifikasi dengan
3-chloropropyltrimethoxysilane (Si-CTS). Sebanyak 1 g silika aktif dicampur dengan 20 mL
toluen kering dan 2,5 mL 3-chloropropyltrimethoxysilane. Campuran diaduk dan direfluks pada suhu 70-80oC selam 8 jam. Kemudian, campuran disaring dan silika dicuci dengan toluen dan aseton kering. Si-CTS dikeringkan dalam vacum oven pada suhu 70 oC selama 3 jam.
Si-CTS dimodifikasi dengan 2-mercaptoimidazole (Si-CTS-MCP). Sebanyak 40 ml toluen kering dan 5 mL 4% (b/v) 2-mercaptoimidazole dalam metanol ditambahkan ke dalam 1 g Si-CTS. Kemudian campuran tersebut direfluks sambil diaduk pada suhu
70-80oC dalam lingkungan gas nitrogen selama 8 jam. Silika termodifikasi disaring dan dicuci dengan toluen. Selanjutnya, silika termodifikasi dikeringkan dalam oven vakum pada suhu 50oC selama 3 jam. Si-CTS-MCP dikarakterisasi dengan Fourier Tranform Infrared Spectrometer. Adsorpsi ion logam Cadmium pada silika termodifikasi
Sebanyak 100 mg adsorbent Si-CTS-MCP dikontakkan dengan 10 mL larutan Cadmium(II) 10 ppm disertai dengan pengocokan selama 3 jam pada pH larutan 2, 3, 4, 6, 7, 8, 9, dan 10. Setelah kondisi pH optimum penyerapan Cadmium(II) pada silika termodifikasi ditemukan, sebanyak 100 mg Si-CTS-MCP dikontakkan dan dikocok selama 3 jam dalam 10 mL larutan Cadmium(II) berbagai konsentrasi (1, 3, 5, 6, 8, 10, 12, 14, dan 16 ppm). Selanjutnya pengaruh waktu pengocokan terhadap adsorpsi Cadmium(II) diperiksa, sebanyak 100 mg Si-CTS-MCP dikontakkan dengan larutan Cadmium 10 ppm pada pH optimum dan dikocok dengan berbagai variasi waktu (0, 15, 30, 45, 60, 120, dan 240 menit). Konsentrasi Cadmium(II) di larutan supernatan diukur dengan menggunakan Spektroskopi Serapan Atom.
HASIL DAN PEMBAHASAN
Pembuatan dan Karakterisasi Silika Modifikasi
Modifikasi silika diawali dengan mengaktivasi silika yang akan dimodifikasi dengan tujuan menguapkan dan menghilangkan molekul-molekul air yang berikatan dengan gugus silanol (Si-OH) melalui ikatan hidrogen sehingga gugus silanol pada silika siap untuk
berikatan secara kovalen dengan gugus fungsi organik pada suatu senyawa10. Karakterisasi dengan FTIR menunjukkan adanya –OH stretch
pada bilangan gelombang 3207.63 cm-1 dan 3479.62 cm-1 yang karakteristik dengan gugus silanol pada silika. Sedangkan pada bilangan gelombang 1107.14 cm-1 karakteristik dengan gugus siloksan pada silika. Kedua gugus inilah yang memungkinkan silika untuk dimodifikasi dan mempunyai kemampuan adsorpsi terhadap ion logam berat.
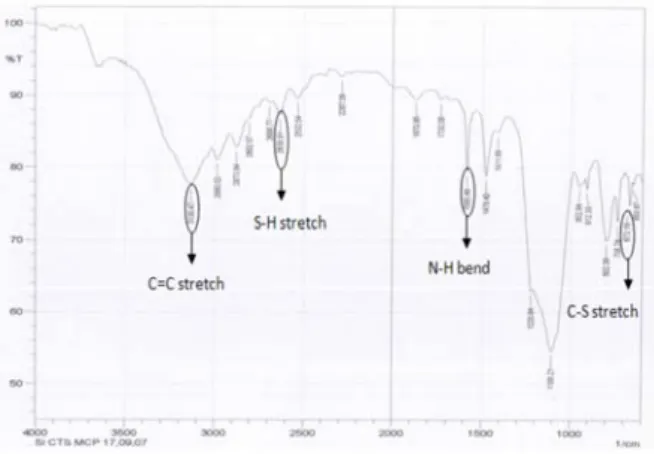
Gambar 1. Spektra FTIR Silika Aktif Silika yang telah diaktivasi, direaksikan dengan senyawa penghubung 3-chloropropyltrimethoxysilane untuk memasukkan gugus klor sebelum silika diimobilisasi dengan 2-mercaptoimidazole11,12. Senyawa penghubung akan bereaksi dengan ligan organik sehingga memungkinkan silika dimodifikasi secara kimia. Karakterisasi dengan FTIR terlihat adanya regangan C-H pada daerah 2958.80 cm-1 dan lentur C-H pada 1442.75 cm-1 dan 1408.04 cm-1 yang menunjukkan bahwa silika telah terikat dengan senyawa perantara yang akan menyempurnakan proses imobilisasi ligan pada silika.
Gambar 2. Spektra FTIR Si-CTS
Silika yang telah berikatan dengan senyawa penghubung siap untuk dimodifikasi dengan ligan 2-mercaptoimidazole. Bilangan gelombang pada regang S-H: 2630 cm-1, lentur N-H: 1585 cm-1, regang C-S: 673,16, dan regang C=C: 3128,54 cm-1 menunjukkan bahwa 2-mercaptoimidazole telah terimobilisasi pada silika.
Gambar 3. Spektra FTIR Si-CTS-MCP SiO2 O Si O CH3 O C H2 H2 C H2 C N N H S
Gambar 4. Silika Modifikasi (Si-CTS-MCP)
Adsorpsi Ion Logam Cadmium dengan Silika Modifikasi
Adsorpsi ion logam dengan menggunakan adsorben silika modifikasi terjadi melalui pembentukan senyawa kompleks antara ion logam dengan atom donor pada ligan organik. Menurut teori HSAB (Hard Soft Acid-Base), Cadmium dikategorikan sebagai asam lunak, gugus aktif pada silika (silanol dan siloksan) termasuk dalam golongan basa keras, sedangkan ligan 2-mercaptoimidazole digolongkan dalam basa lunak. Interaksi antara asam dan basa lunak ini sangat menguntungkan dalam proses adsorpsi karena asam lunak cenderung lebih suka berikatan dengan basa lunak13. Oleh karena itu, gugus aktif pada ligan 2-mercaptoimidazole lebih berperan dalam pengikatan ion logam pada proses adsorpsi.
Pengaruh pHlarutan ion logam
Kondisi keasaman larutan ion logam memberikan pengaruh terhadap kapasitas adsorpsi dengan menggunakan silika modifikasi sehingga perlu ditentukan pH optimum proses adsorpsi.
Grafik 1. Penentuan pH optimum pada adsorpsi ion logam Cadmium
Berdasarkan grafik di atas, semakin tinggi pH (semakin basa suatu larutan) ion logam yang terserap semakin banyak dan mencapai puncaknya pada pH 9. Pada pH optimum (pH 9), kapasitas adsorpsi silika adalah 0,2731 mg ion
logam cadmium per g adsorben atau sekitar 99,901% ion logam dapat terserap oleh silika modifikasi.
Pada kondisi asam (pH rendah), atom nitrogen pada ligan organik dalam keadaan terprotonasi sehingga bermuatan parsial positif. Keadaan ini akan menurunkan kemampuan mengadsorpsi ion logam Cadmium(II)12 karena hanya atom sulfur yang berperan dalam proses adsorpsi dan juga dimungkinkan terjadinya tolakan antara muatan positif ion logam dan nitrogen yang terprotonasi. Pada pH netral terjadi peningkatan jumlah ion logam yang teradsorpsi. Hal ini disebabkan karena pada pH netral, ikatan koordinasi antara logam dan adsorben terjadi melalui atom nitrogen dan sulfur. Kondisi larutan basa (pH tinggi) menyebabkan atom nitrogen mulai terdeprotonasi sehingga bermuatan parsial negatif. Akibatnya interaksi ion logam dan adsorben makin kuat sehingga jumlah ion logam yang terserap semakin banyak dan mencapai puncaknya pada larutan logam dengan pH 9. Setelah pH 9 adsorpsi mulai menurun. Hal ini kemungkinan disebabkan karena mulai terbentuk endapan Cd(OH)2 akibat terlampauinya harga Ksp Cd(OH)2 dalam larutan sehingga sebagian logam tidak dapat teradsorp. Harga Ksp Cd(OH)2 pada suhu 25°C adalah 7,2 x 10-15 (14) sehingga secara teoritis logam Cadmium akan mengendap sebagai Cd(OH)2 pada pH 9,28. Fakta ini men-dukung hasil penelitian yang menunjukkan penu-runan ion logam yang teradsorp setelah pH 9.
Pengaruh konsentrasi ion logam
Penentuan konsentrasi optimum adsorpsi dilakukan dengan menginteraksikan
silika modifikasi dengan ion logam Cadmium pada pH optimum.
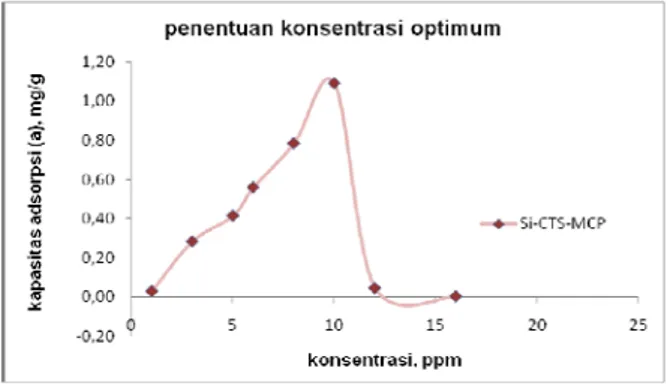
Grafik 2. Penentuan konsentrasi optimum pada adsorpsi ion logam Cadmium
Grafik konsentrasi optimum menunjukkan bahwa jumlah ion logam yang teradsorp meningkat seiring dengan meningkatnya konsentrasi ion logam dan mencapai puncaknya pada konsentrasi 10 ppm kemudian menurun secara signifikan.
Pada konsentrasi rendah (di bawah 10 ppm), jumlah ion logam dalam larutan juga sedikit sehingga hanya sedikit ion logam yang membentuk ikatan koordinasi dengan adsorben silika modifikasi. Semakin banyak jumlah ion logam, semakin ion logam yang terikat pada silika modifikasi dan mencapai optimum pada konsentrasi 10 ppm. Pada konsentrasi tersebut semua ion logam telah membentuk ikatan koordinasi dengan adsorben. Penambahan konsentrasi ion logam yang berarti menambah jumlah ion logam dalam larutan ternyata menurunkan kapasitas adsorpsi dari adsorben. Hal ini mungkin terjadi karena ion-ion logam bersaing untuk berikatan dengan adsorben sehingga menyebabkan ion-ion logam yang telah terikat terlepas kembali.
Pengaruh waktu pengocokan
Waktu pengocokan atau waktu interaksi ion logam dan adsorben merupakan parameter penting untuk mengetahui kecepatan reaksi adsorpsi. Semakin sedikit waktu interaksi, laju reaksi makin cepat yang berarti juga laju adsorpsi makin tinggi.
Grafik 3. Penentuan waktu interaksi optimum pada adsorpsi ion logam Cadmium
Berdasarkan data di atas terlihat bahwa secara umum adsorpsi ion logam Cadmium berlangsung cepat sebelum menit ke-15, selanjutnya adsorpsi berlangsung lambat bahkan cenderung konstan sampai menit ke-180 (3 jam) kemudian mulai turun pada menit ke-240 (4 jam). Hal ini menunjukkan bahwa waktu interaksi antara ion logam dan adsorben akan mempengaruhi jumlah ion logam yang terikat pada adsorben, dimana semakin lama waktu interaksi jumlah ion logam yang teradsorpsi juga semakin banyak dan mencapai puncaknya pada 3 jam interaksi. Akan tetapi setelah lebih dari 3 jam, adsorben mulai mencapai titik jenuh (menit ke-240 atau 4 jam) sehingga kondisi tersebut menyebabkan ion logam yang telah terikat menjadi terlepas kembali.
KESIMPULAN
Silika dapat dimodifikasi dengan ligan organic, 2-mercaptoimidazole, melalui proses
imobilisasi dengan menggunakan senyawa perantara 3-chloropropyltrimethoxysilane. Silika yang sudah dimodifikasi dapat mengadsorpsi optimum ion logam Cadmium pada kondisi pH 9 dan waktu pengocokan selama 180 menit, juga dapat dikontakkan sampai konsentrasi Cadmium(II) 10 ppm.
UCAPAN TERIMAKASIH
Penulis mengucapkan terima kasih pada Proyek DIPA 2008 Pusat Penelitian Kimia-LIPI yang telah membiayai penelitian ini. Selain itu, penulis juga mengucapkan terimakasih pada Eli Susilawati dan Yulianti Sampora yang turut mendukung secara teknis pelaksanaan penelitian ini.
DAFTAR PUSTAKA
1. Dantas, T.N.C., et.al., 2003, Heavy Metal Extraction by Microemulsion, Water Research 37 (2003) 2709-2717
2. Connel, D. W., dan Miller, G.J.,
penerjemah: Yanti Koestoer, 1995, Kimia dan Ekotoksikologi
Pencemaran, UI-Press, Jakarta 3. An, H.K., Park, B.Y., Kim, D.S., 2001, Crab
Shell for The Removal of Heavy Metals from Aqueous Solution, Water Research Vol. 35, No. 15, pp. 3551-3556
4. Pradhan, S., Shukla, S.S., Dorris, K.L., 2005, Removal of Nickel from Aqueous Solution using Crab Shell, Journal of Hazardous Material B125 (2005) 201-204 5. Stum, W., dan Morgan, J.J., 1996, Aquatic
Chemistry, John Wiley and Sons Inc., New York
6. De Moraes, S.V.M, Tisott, M.M., Milcharek, C.D., Brasil, J.L., Costa, T.M.H., Gallas, M.R., Benvenutti, E.V., Lima, E.C., 2005, Analytical Sciences, 21, 573-577.
7. Osman, M.M, Kholeif, S.A., Abou-Almaaty, N.A., Mahmoud, M.E., 2004, Analytical Sciences, 20, 847-852. 8. Pyrzynska, K. and Wierzbicki, T., 2005,
Analytical Sciences, 21, 951-954 9. Mahmoud, M.E., Osman, M.M., Amer,
M.E., 2000, Selective Preconcentration and Solid Phase Extraction of Mercury(II) from Natural Water by Silica Gel-Loaded Dithizone Phases, Anal. Chim. Acta., 415, 33-40
10. Misra, B.K., Jal. P.K., Patel, S., Talanta, 2004, 62, 1005-1028.
11. Fujiwara, S.T., and Gushikem, Y., 1999, J. Braz. Chem. Soc, 10 no 5, 389-393.
12. Dias Filho, N.L, do Carmo, D.R.,Caetano, L., Rosa, A.H., 2005, Analytical Sciences, 21, 1359-1363.
13. Bowser, J.R., 1993, Inorganic Chemistry, Brooks/Cole Publishing Company A Div. of Wadsworth, Inc., Beltmont, California
14. Solubility Product Constant, http://www.ktf-split.hr/periodni/en/abc/kpt.html