Rangkuman kelebihan dan kekurangan proses elektrokoagulasi dapat dirangkum di bawah ini (Syam Babu et al., 2020). Elektrokoagulasi memberikan rentang pH yang lebih efisien dan menghasilkan netralisasi pH serta dapat digunakan secara tepat untuk sumber energi terbarukan (Syam Babu et al., 2020). Efisiensi unit elektrokoagulasi berkurang karena terbentuknya lapisan oksida resisten pada katoda (Syam Babu et al., 2020).
Pemilihan logam sebagai elektroda erat kaitannya dengan kemudahannya dalam menghantarkan arus listrik (Moussa et al., 2017, Syam Babu et al., 2020).
Elektrokoagulasi untuk Penyisihan Metformin, Aspirin dan Paracetamol
Diagram Pourbaix Anoda yang Dipergunakan
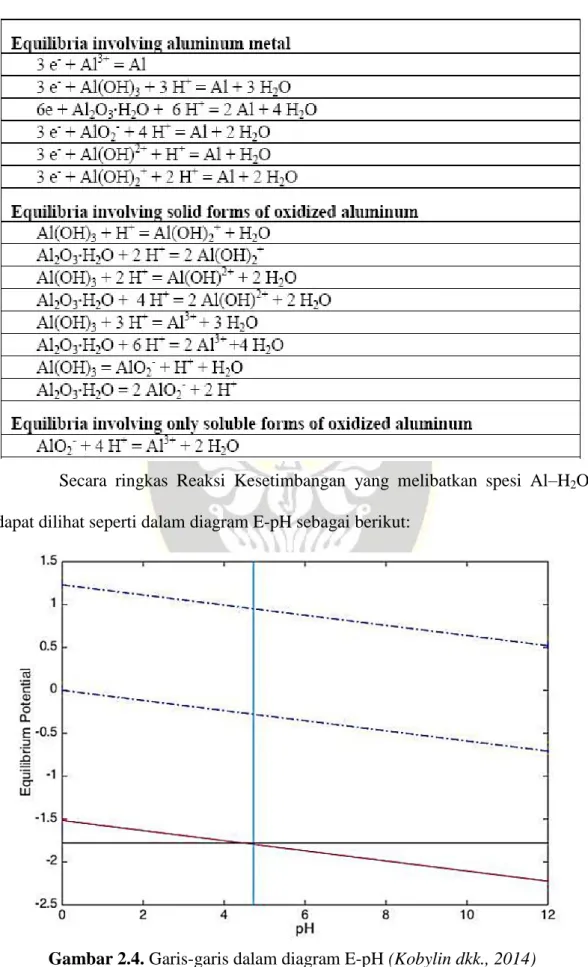
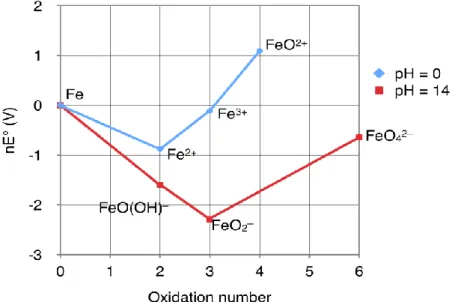
Spesies yang ditunjukkan pada diagram Pourbaix adalah keberadaan semua spesies besi, baik dalam fase larutan maupun dalam fase pengendapan. Untuk jenis aplikasi korosi yang diprediksi Pourbaix, konsentrasi ini biasanya cukup rendah sehingga wilayah yang digambarkan di sebagian besar diagram Pourbaix sesuai dengan konsentrasi yang sangat kecil (total 1 mM) (Perry et al., 2019). Reaksi yang dapat terjadi dalam sistem Fe-H2O termasuk spesies yang paling stabil dalam kondisi basah.
Jika diperhatikan, diagram Pourbaix untuk Fe juga menunjukkan garis kesetimbangan reduksi ion H+ menjadi hidrogen (Persamaan 2.6) dan reduksi ion H+ menjadi air (Persamaan 2.7). O2 + 4H+ + 4e- ⇌ 2H2O (2.7) Garis kesetimbangan untuk reduksi dan oksidasi air berguna karena beberapa alasan. Pertama, dalam kasus di mana oksidasi dan reduksi air relatif cepat dibandingkan dengan fenomena elektrokimia, potensial oksidasi dan reduksi air membatasi potensial yang dapat dialami oleh unsur tersebut – yaitu, jika larutan mempunyai potensial yang lebih ekstrim dalam bentuk dari elektroda atau oksidan atau reduktor, maka zat tersebut. Dalam lingkungan ini, potensi reduksi oksigen standar yang bergantung pada pH, ditunjukkan oleh garis biru atas pada Gambar 2.1, menentukan potensi sistem.
Seperti terlihat pada gambar 2.1, potensi kesetimbangan air berada di atas potensi daerah kestabilan logam besi. Garis-garis pada diagram mewakili kondisi E-pH di mana spesies yang berdekatan memiliki keseimbangan yang sama. Garis-garis ini menunjukkan reaksi yang melibatkan ion H+ atau OH-, namun tidak bergantung pada E.
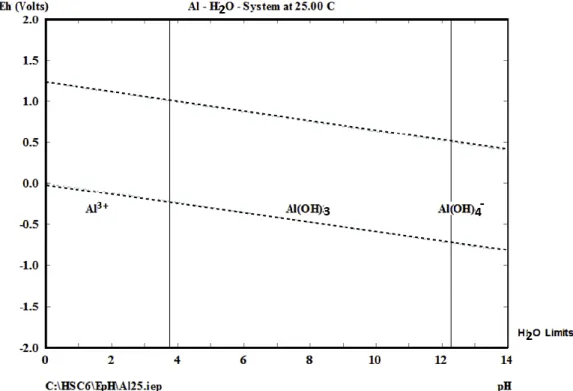
Kepasifan adalah keadaan logam di mana korosi dapat dicegah pada lingkungan tertentu melalui modifikasi permukaan, misalnya dengan pembentukan lapisan oksida pelindung tipis (Pourbaix mempelajari spesies aluminium dominan dalam larutan pada nilai pH berbeda, di mana mereka menemukan bahwa pada pH 3 5 terbentuk spesies utama, untuk nilai pH (antara 4 dan 9,5) spesies mendominasi dan pada pH 10 spesies yang terbentuk adalah Hasil serupa dapat ditemukan dengan memplot diagram pourbaix untuk aluminium yang digunakan (ditunjukkan pada Gambar 2.3), karena memberikan spesies aluminium yang stabil secara termodinamika pada pH dan potensial sel tertentu.(2017), juga menyelidiki pengaruh pH awal terhadap pengurangan COD dan menemukan bahwa efisiensi penyisihan terbaik dicapai pada kisaran pH 6–8 dan efisiensi penghilangan paling kecil terjadi pada pH sangat basa yaitu 12. Sebaliknya, koagulan lain dikenal sebagai koagulan lemah yang sangat larut karena membawa muatan negatif dan tidak akan mampu mengganggu koloid (Moussa et al. . ., 2017).
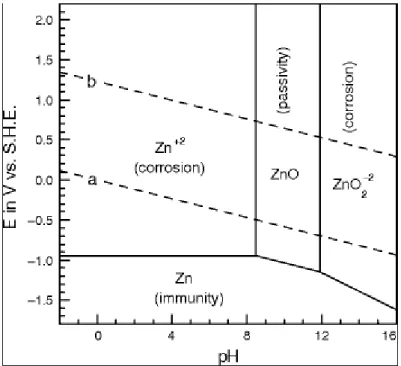
Beberapa penulis sampai pada kesimpulan yang sama bahwa kinerja EC maksimum ketika menggunakan anoda aluminium adalah sekitar pH netral (Diagram Moussa et al. Pourbaix Zinc menunjukkan spesies atau fase paling stabil dari suatu unsur Seng sebagai fungsi potensial dan pH.
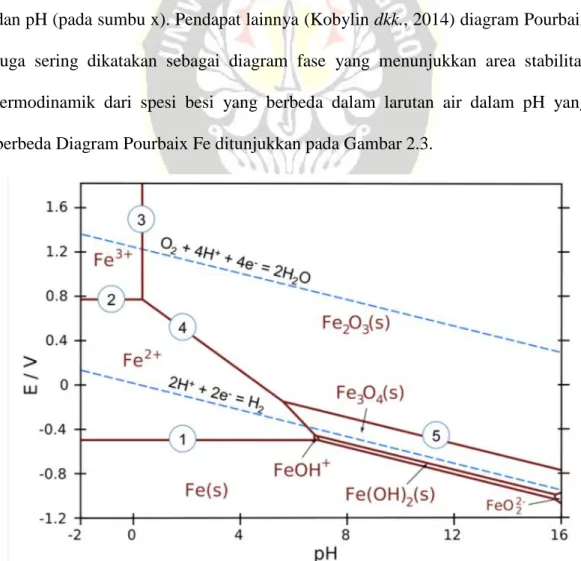
Diagram Latimer Anoda yang Dipergunakan
Jumlah antara masing-masing pasangan adalah potensi reduksi standar untuk reaksi setengah reduksi yang melibatkan spesies tersebut. Untuk logam aluminium dan logam seng, karena hanya mempunyai satu jenis bilangan oksidasi, maka kedua logam tersebut tidak dapat memprediksi sifat redoks spesiesnya.
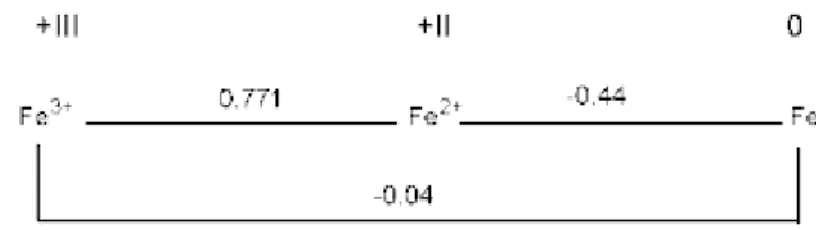
Diagram Frost Anoda yang dipergunakan
Dengan memasukkan komponen-komponen di atas (jumlah mol zat yang terlibat dalam reaksi, bilangan Faraday yang digunakan, dan tegangan yang diberikan), diagram Frost-Ebsworth untuk logam aluminium dan logam seng dapat diprediksi.
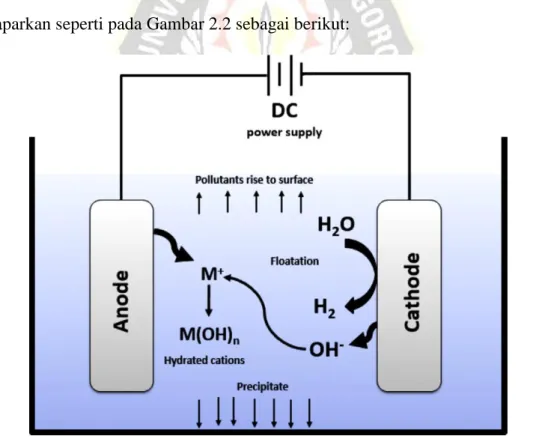
Mekanisme Proses Elektrokoagulasi
Fe (s) + 8 H2O –→ Fe(OH)2 (s) + O2 (g) + 3 H2 (aq) E° = -0,39 Volt (2,19) Reaksi yang terjadi pada proses elektrokoagulasi adalah reaksi dan reaksi reduksi . Pada proses oksidasi, logam yang berperan sebagai anoda (logam Al, Fe dan Zn) akan mengalami oksidasi sedangkan air akan mengalami reduksi sehingga terjadi pelepasan gas hidrogen (H2) yang akan membentuk gelembung-gelembung udara yang naik ke permukaan reaktor. Kehadiran oksigen terlarut dalam air menyebabkan endapan besi hidroksida teroksidasi menjadi besi hidroksida, yang juga mengendap dalam larutan. Kation logam yang diproduksi secara elektrokimia (menjadi Fe3+ atau Al3+) akan bereaksi secara spontan dan menghasilkan/menghasilkan hidroksida dan/atau polihidroksida yang sesuai menurut kinetika pengendapan kompleks.
Secara ringkas proses-proses yang terjadi pada proses elektrokoagulasi dan mekanisme pengendapan pencemaran organik dapat diuraikan secara singkat sebagai berikut. Beberapa bahan pencemar organik yang mempunyai kekentalan rendah akan terangkat ke permukaan air, sedangkan bahan pencemar organik yang mempunyai kekentalan tinggi bersama-sama dengan monomer/polimer Al(OH)2+, Al(OH)2+ dan Al(OH) akan terangkat ke permukaan air. mengendapkan. )4 dan spesies polimer, seperti Al6(OH)153+. Dari Gambar 2.12 terlihat adanya muatan positif dan negatif, sehingga dapat terjadi interaksi dalam larutan yang sangat dipengaruhi oleh konsentrasi hidroksida.
Konsentrasi hidroksida dapat menentukan jenis pengendapan hidroksida yang terjadi, hal ini sesuai dengan yang dilaporkan (Vepsäläinen et al., 2012) seperti terlihat pada Gambar 2.13. Efektivitas penghilangan bahan organik terlarut diukur dengan menurunkan nilai COD sampel, antara sebelum dan sesudah proses elektrokoagulasi (Kuokkanen dan Kuokkanen, 2013).
Tipe Pengendapan Proses Elektrokoagulasi
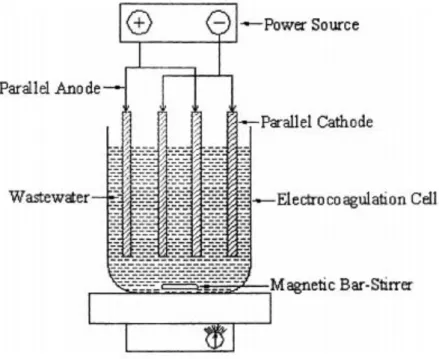
Jenis pengendapan proses elektrokoagulasi (Naje et al., 2017) Untuk mengoptimalkan hasil proses elektrokoagulasi, sering dilakukan beberapa variasi kondisi operasi proses elektrokoagulasi, seperti: rapat arus, jenis elektroda (keduanya anoda dan anoda), jarak elektroda, keasaman (pH), penambahan larutan elektrolit dan waktu elektrolisis. Indikator keberhasilan proses elektrokoagulasi dilakukan dengan mengukur penurunan nilai Chemical Oxygen Demand (COD), Biological Oxygen Demand (BOD), Total Suspended Solid (TSS), Turbidity (kekeruhan), Color (warna), derajat kekeruhan. keasaman (pH ) dan Salinitas (salinitas) yang terjadi setelah proses elektrolisis berlangsung (Naje et al., 2017, Sen et al., 2019).
Energi Dalam Elektrolisis (tinjauan secara thermodinamika)
Semakin negatif nilai ∆G maka reaksi akan semakin spontan, dan sebaliknya semakin positif nilai ∆G maka reaksi akan semakin tidak spontan. Ecell = ERight-Eleft = EReduction-EOxidation (2.34) Dimana ∆G = Energi bebas Gibbs, merupakan ukuran spontanitas suatu reaksi. Faktor lainnya adalah n, dimana n adalah jumlah mol zat yang terlibat dalam reaksi, F adalah jumlah faraday yang terlibat dalam reaksi, dan E adalah potensial sel elektroda (Volt) yang terlibat dalam suatu reaksi (F = 23,060 kal/ setara volt). .
Jika nilai energi bebas Gibbs (∆G) menjadi 0, hal ini menunjukkan bahwa reaksi berada dalam keadaan setimbang (Adamson, 1979).
Potensial Reduksi dan Energi Gibbs
Nilai E°sel dapat diperoleh secara eksperimental untuk sel, tetapi biasanya nilai tersebut jarang digunakan di laboratorium dalam kondisi standar dan dengan. Nilai E°sel juga dapat dihitung (sesuai dengan nilai ΔG°) menggunakan nilai potensial reduksi standar untuk setengah sel. Metode ini lebih umum digunakan untuk mengevaluasi kelayakan termodinamika reaksi redoks (Šima, 2013).
Elektrolisis dan Hukum Faraday
Faktor yang Mempengaruhi Efisiensi Proses Elektrolisis
Reaktor Elektrolisis
Reaktor dioperasikan dalam kondisi transportasi massal yang terkendali untuk mencapai efisiensi maksimum, oleh karena itu kondisi aliran dalam pengoperasian reaktor sangat penting. Dalam reaksi elektrokimia ini melibatkan perubahan/konversi tahapan kimia seperti adsorpsi, reaksi elektroda, reaksi kimia dan tahapan fisika seperti proses transpor massa dan perpindahan massa.
Analisis dengan spektroskopi UV-visibel bertujuan untuk menganalisis representasi gugus kovalen tak jenuh yang terdapat pada bahan analit, yang menyebabkan bahan tersebut menyerap energi dalam gelombang UV-visibel. Metode spektrofotometri ultraviolet dan sinar tampak telah banyak digunakan untuk penentuan senyawa organik, yang biasanya digunakan untuk penentuan senyawa dalam jumlah yang sangat kecil (Hu et al., 2002, Silverstein et al., 2014, Triyati, 1985). Molekul yang mengandung dua atau lebih gugus kromofor akan menyerap cahaya pada panjang gelombang yang hampir sama dengan molekul yang hanya mempunyai satu gugus kromofor tertentu, namun intensitas serapan sebanding dengan jumlah kromofor yang ada.
Dalam analisis kimia analitik secara kualitatif dan kuantitatif sering ditambahkan pereaksi organik yang dapat membentuk kompleks berwarna stabil, misalnya o-fenantrolin untuk besi, dimetil glioksim untuk nikel, dietil tiokarbamat untuk tembaga, dan sebagainya (Hu et al., 2002 , Silverstein dkk., 2014, Triyati, 1985). Spektroskopi UV-Vis umumnya digunakan untuk molekul dan ion anorganik atau kompleks dalam larutan. Sinar ultraviolet memiliki panjang gelombang 200-400 nm, dan cahaya tampak memiliki panjang gelombang 400-800 nm (Bigio dan Mourant, 1997).
Hubungan antara serapan dan konsentrasi akan linier (A≈C) jika nilai serapan larutan berada di antara A < 0,8) atau sering disebut ruang lingkup hukum Lambert-Beer dengan lebar sel 1 cm. Konsentrasi sampel dalam larutan dapat ditentukan dengan mengukur serapan pada panjang gelombang tertentu menggunakan hukum Lambert-Beer. Keberhasilan proses elektrolisis tidak hanya ditentukan oleh rendemen dalam proses elektrolisis, tetapi juga oleh karakterisasi kromofor dan gugus fungsi.
Karakterisasi gugus kromoforik dilakukan dengan spektroskopi UV-visibel, dan karakterisasi gugus fungsi dilakukan dengan spektroskopi FTIR (Faix, 1992). Secara umum, dasar untuk mendeskripsikan interaksi gugus fungsi adalah model osilator harmonik sederhana dan modifikasinya untuk memperhitungkan frekuensi karakteristik yang dapat dideteksi untuk kombinasi atom tertentu dalam suatu molekul.
Analisis Multivarian
Dari pernyataan sederhana hukum Hooke, kita dapat menyatakan frekuensi getaran dasar suatu molekul berdasarkan Persamaan. 2.45) Dimana v adalah frekuensi dasar getaran, k adalah gaya elektrostatis yang konstan, µ adalah massa tereduksi atau massa tereduksi, mis. m1m2/(m1+ m2), dimana m1 dan m2 adalah massa atom penyusunnya (Bigio dan Mourant, 1997).
Analisis Response Surface Methodology (RSM)
Model yang menghasilkan signifikansi ANOVA dan nonsignifikansi ketidaksesuaian dipilih untuk analisis variabel. Salah satu fitur DX 7.0® adalah ia juga menyediakan plot residu normal, yang menunjukkan apakah residu (perbedaan antara respons aktual dan nilai respons yang diprediksi) mengikuti garis normal (garis lurus). Titik data yang mendekati garis normal menunjukkan data berdistribusi normal, artinya hasil sebenarnya akan mendekati hasil prediksi program DX 7.0® (Raissi dan Farsani, 2009).
Nilai desirability yang mendekati 1,0 menunjukkan bahwa kemampuan program dalam menghasilkan produk yang diinginkan semakin sempurna. Tujuan optimasi bukan untuk memperoleh nilai desirability sebesar 1,0, melainkan mencari kondisi terbaik yang menyatukan seluruh fungsi tujuan (Raissi dan Farsani, 2009). Apabila kondisi proses yang optimal telah diperoleh maka diakhiri dengan tahap verifikasi yaitu pengolahan dan analisa ATC sesuai dengan formulasi terbaik hasil optimasi RSM.
Hasil yang diperoleh kemudian dibandingkan dengan nilai prediksi variabel respon RSM, ditambah dengan nilai prediksi masing-masing respon, sehingga terlihat sesuai pada tahap verifikasi (Paudyal et al., 2017). Kondisi operasi optimal untuk penghilangan aspirin dapat ditulis sebagai berikut: 2.46) Dimana Y adalah variabel respon, i, j, dan konstanta regresi linier, orde kedua, dan sekuensial, e adalah kesalahan acak, dan k adalah jumlah parameter.
Studi Kinetika Elektrokoagulasi