Alhamdulillah, penulisan buku dasar-dasar spektrofotometri UV-Vis dan spektrometri massa untuk penentuan struktur senyawa organik akhirnya selesai. Dalam spektrofotometri UV-Vis digunakan beberapa istilah yang berkaitan dengan molekul, yaitu kromofor, auksokrom, efek batokrom atau pergeseran merah, efek hipokromik atau pergeseran biru, hipsokrom dan hipokrom.
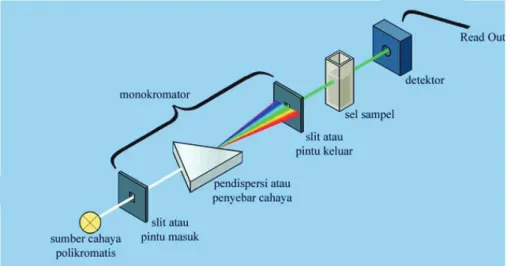
Syarat pengukuran
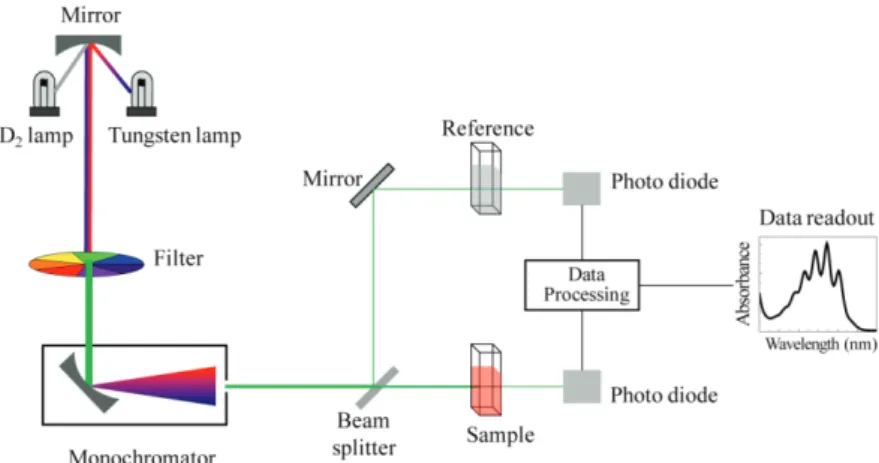
Detektor berupa fotodetektor atau detektor panas atau detektor fotodioda berfungsi untuk menangkap cahaya yang dipancarkan sampel dan mengubahnya menjadi arus listrik.
Interaksi sinar UV-Vis dengan senyawa
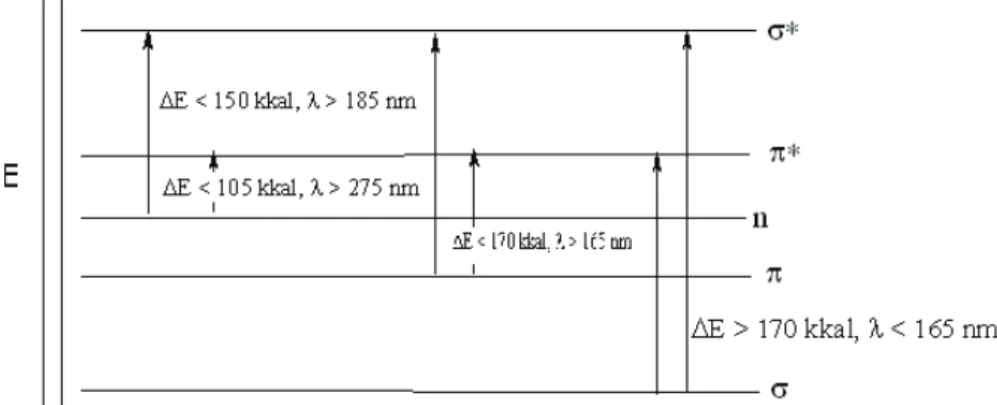
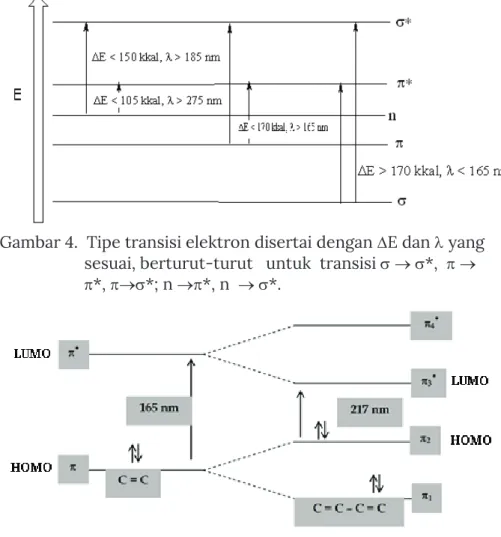
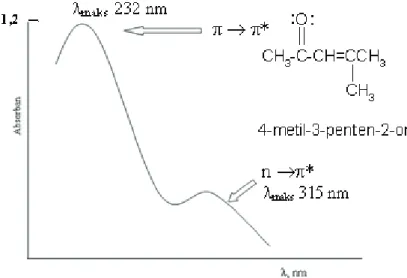
Dari Gambar 3 terlihat bahwa transisi elektron * pada molekul organik memerlukan E yang paling besar, sedangkan transisi elektron n * memerlukan E yang paling kecil. Transisi elektron n * memerlukan energi yang lebih kecil dibandingkan transisi *, namun karena orbital non-ikatan berada pada ruang yang berbeda dengan orbital anti-ikatan *, maka banyaknya n elektron yang bertransisi ke * adalah lebih kecil dari jumlah elektron transisi *, sehingga pada spektrum UV penyerapan eksitasi n * jauh lebih rendah.
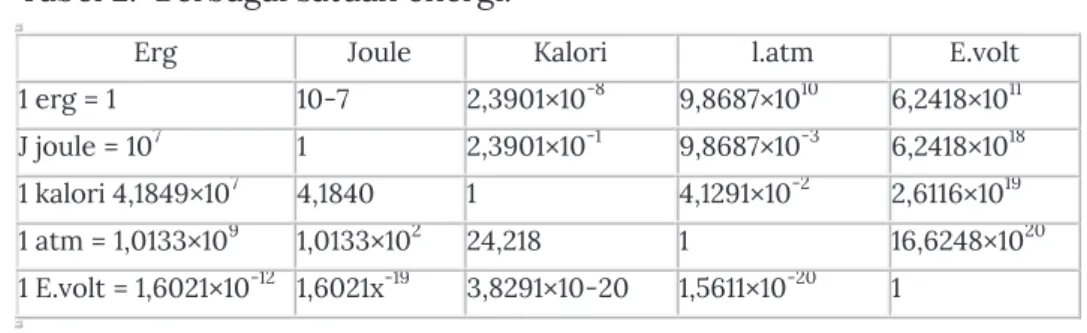
Spektrum UV-Vis
Berlangsung antara orbital-orbital dalam bidang yang sama
Selama transisi orientasi spin harus tetap
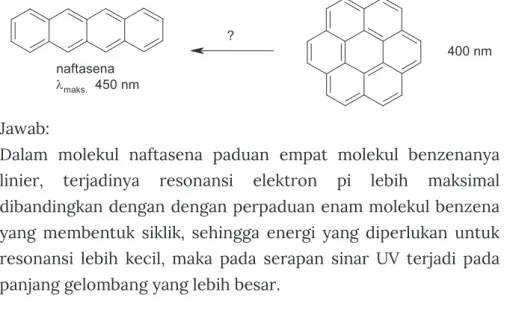
Pita pada panjang gelombang 254 nm dari benzena disebabkan oleh hilangnya simetri benzena akibat getaran ikatan pada molekul benzena, dimana keadaan elektron berpindah ke tingkat energi getaran. Naftasen merupakan molekul aromatik yang memiliki empat molekul benzena tertanam dan menyerap pada panjang gelombang maksimum 450 nm.
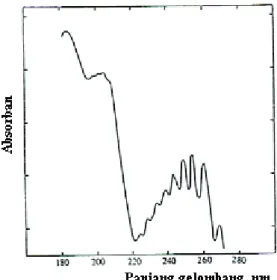
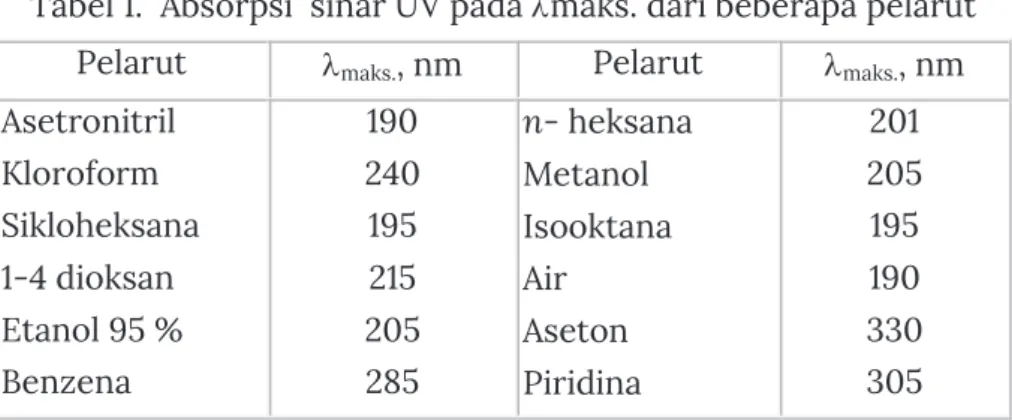
Pergeseran panjang gelombang dan absorban (ε) pada Spektrum UV-Vis
Semakin banyak cincin benzena yang terintegrasi dalam satu molekul, semakin besar panjang gelombang maksimumnya, karena peningkatan konjugasi dan peningkatan stabilisasi resonansi. Pada molekul naftasen kombinasi empat molekul benzena bersifat linier, resonansi elektron pi berlangsung optimal dibandingkan dengan kombinasi enam molekul benzena membentuk molekul siklik, sehingga energi yang diperlukan untuk resonansi lebih sedikit, sehingga penyerapan sinar UV berlangsung pada panjang gelombang yang lebih panjang.
Perhitungan panjang gelombang Alkena
Begitu pula pada senyawa yang mengandung gugus nitro, serapan maksimum terjadi pada panjang gelombang 275 – 295 nm. Untuk , senyawa β-amida tak jenuh, panjang gelombang maksimum yang diserap akan lebih kecil dibandingkan asam karboksilat, yaitu sekitar 200 nm dengan kepunahan molar sekitar 8000; laktam.

CH=CH) 2 CHO (CH=CH) 3 CHO
Setiap gugus yang terikat pada benzena akan menghasilkan efek batokromik dibandingkan dengan panjang gelombang serapan maksimum benzena; Selain itu, semakin lama konjugasi ikatan rangkap, semakin besar efek batokromik pada panjang gelombang maksimum, terutama untuk pita K (204 nm) benzena. Misalnya, disubstituen gugus amina dan nitro yang terletak pada posisi para akan menyerap pada panjang gelombang 375 nm.
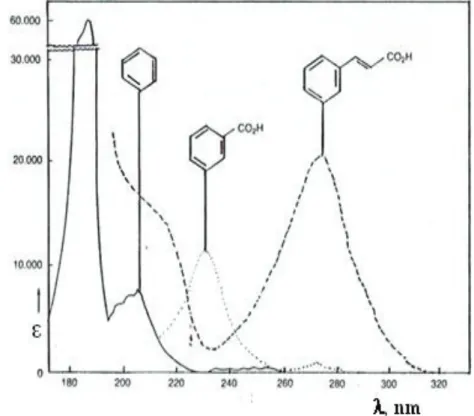
Beberapa contoh spektrum UV-Vis
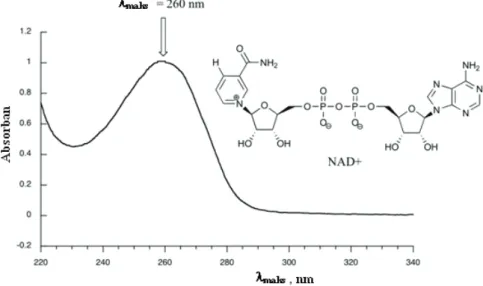
Walaupun kedua molekul tersebut berbeda, namun karena kromofornya sama, bentuk spektrumnya setara dengan max yang hampir sama. Nama asam ini berasal dari benzoin gum (dupa resin) yang dulunya merupakan satu-satunya sumber asam benzoat. NAD+ dan NADH keduanya menyerap pada 260 nm (Gambar 15), tetapi NADH memiliki pita serapan kedua pada λmaks.
NAD+ dan NADH sama-sama menyerap pada 260 nm, Gambar 15), namun NADH mempunyai pita serapan yang berbeda dengan λmax.
Soal Latihan
- Pasangan mana berikut iniyang mungkin dibedakan satu sama lain oleh spektra UV ? Jelaskan !
- CH=CHCH 2 C CH 2 CH=CHCOO
- Transisi elektronik tipe apa yang menyebabkan absorpsi UV dalam tiap senyawa berikut ? (a) 2,4-oktadiena (b)
- Urutkan senyawa berikut menurut meningkatnya maks : (a) benzena (b) bifenil (C 6 H 5 -C 6 H 5 ) (c) stirena (C 6 H 5 CH=CH 2 )
- Jelaskan mengapa maks untuk trans stilbena (C 6 H 5 CH=CHC 6 H 5 ) adalah 295 nm, sedangkan cis-stilbena 280
- CH=CHCH=CH 2 CH=CHCH=CH
- CCH=CHCH 3 CH 3
- Dari jawaban untuk soal no 6, ramalkan maks untuk poliena berikut
- Ramalkan nilai maks pada senyawa-senyawa berikut berdasarkan maks yang diketahui
- Hitunglah maks menggunakan aturan Wood-Ward untuk setiap senyawa-senyawa berikut
- C-CH=CHN( ) 2
- CH CCH 3O
- CCH=CHCH 3C
- O 2 CCH=C( ) 2 O
- Jelaskan molekul mana berikut ini yang mengabsorpsi pada yang lebih panjang pada daerah spektrum UV ?
- Spektrum UV dari suatu senyawa organik mempunyai spektrum sbb
- Sarankan struktur untuk setiap senyawa yang sesuai dengan data spektra (semua dalam pelarut etanol)
- Hitunglah panjang gelombang maks dan ekstinsi molar maks dari -karoten !
Dalam biokimia sering terjadi oksidasi-reduksi molekul organik, misalnya reduksi NAD+ menjadi NADH. NAD+ dan NADH keduanya menyerap pada 260 nm (Gambar 15), namun NADH memiliki pita serapan kedua dengan λmax. Jelaskan manakah molekul berikut yang menyerap pada yang lebih panjang pada daerah spektrum UV. Sarankan struktur setiap senyawa berdasarkan data spektrum (semua dalam pelarut etanol): data spektrum (semua dalam pelarut etanol):
DAFTAR PUSTAKA
AOAC, 1970. Official Methods Of Analysis Of The Association Official Analytical Chemists Association Of Official Analytical
Miller, 1992, Experiment and Techniques in Organic Chemistry, Prentice Hall, Englewood Techniques in Organic Chemistry, Prentice Hall, Englewood Cliffs. Official Methods of Analysis Of Association Official Analytical Chemists Association Of Official Analytical Official Analytical Chemists Association of Official Analytical Chemist, Washington, D.C. Holler, Fundamentals of Analytical Chemistry, 7. udgave, Saunders College Analytical Chemistry, 7. udgave, Saunders College Publishing, Philadelphia, 1996.
SPEKTROSKOPI MASSA
Setelah mempelajari bab ini, mahasiswa diharapkan dapat
PENDAHULUAN
Prinsip Spektroskopi Massa
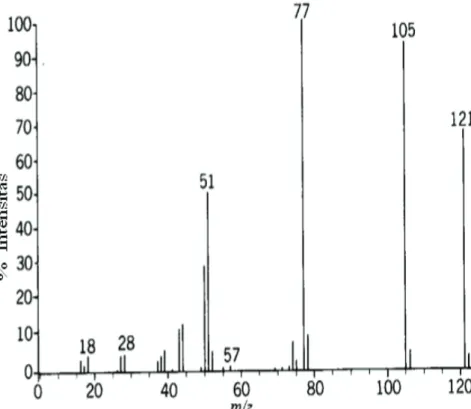
Analisis spektrum massa suatu senyawa organik, yang tidak hanya memperhatikan massa ion molekul (Mr) M+ dan massa fragmen yang muncul pada spektrum tersebut, tetapi juga massa fragmen yang hilang. Dengan menyusun beberapa kemungkinan struktur fragmen dengan bantuan teka-teki, struktur molekul suatu senyawa organik dapat ditentukan. Spektrometer massa dapat mendeteksi hasil pemecahan ion-ion molekul tersebut dan dapat dibaca dalam bentuk spektrum massa yang merupakan plot antara massa fragmen dalam m/e atau m/z (z dan e adalah besarnya muatan = 1, m = massa fragmen) dan kelimpahan atau intensitasnya, Akibatnya setiap fragmen akan tampak sebagai garis sesuai massanya dan tinggi garis menunjukkan kelimpahannya (contoh spektrum massa dapat dilihat pada Gambar 1).
Dari massa fragmen, struktur fragmen dapat ditentukan, dan dengan menggabungkan struktur fragmen yang berbeda dalam spektrum massa dan fragmen yang hilang, struktur molekul induk dapat ditentukan.
Isotop Spektra Massa
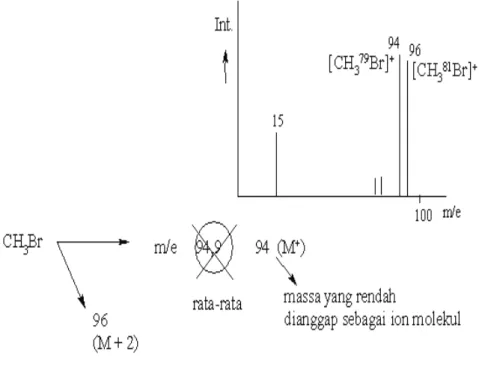
Fragmen ion terlebih dahulu masuk ke alat analisa elektrostatik, alat analisa ini mempengaruhi kecepatan pemfokusan ion-ion di celah A, sehingga ion-ion dengan m/e tertentu dan energi ion tunggal akan fokus di celah B di alat analisa magnetik; Dengan cara ini, pemisahan massa ion menjadi lebih sempurna. Dengan menggunakan spektrometer resolusi rendah, ion-ion fragmen dengan rumus molekul yang sama tetapi dengan komposisi isotop berbeda dapat dideteksi dengan adanya puncak pada nilai massa nominal yang berbeda, misalnya pada contoh CH3+ mengandung fragmen dengan satu nominal massa 15 (fragmen 12C1H3+) sampai 19 (fragmen 13C2H3+) . Di bawah ini adalah cara menghitung intensitas relatif massa maksimum ion fragmen CH2Cl+ (tanpa perkiraan), dengan mempertimbangkan kelimpahan isotop tersebut di alam.
Puncak terkuat disebut puncak dasar dan puncak lainnya adalah intensitas relatif yang dilaporkan sebagai % dari puncak dasar.
Faktor-faktor yang menentukan cara fragmentasi
Ionisasi dan Fragmentasi
Puncak metanol yang berasal dari hilangnya satu elektron, merupakan puncak ion molekul dimana nilai m/e adalah massa molekul (MW). Frekuensi reaksi A juga lebih besar dari frekuensi reaksi C; Energi aktivasi A lebih besar daripada energi aktivasi terminasi C, baik reaksi A maupun C bersifat kompetitif. Setelah terionisasi oleh elektron dalam ruang pengion, molekul organik menjadi ion molekul.
Sebagian kecil ion molekul mengalami fragmentasi di luar ruang ionisasi (setelah daerah percepatan). A+ hasil fragmentasi mempunyai energi translasi yang lebih rendah dibandingkan energi translasi A+ yang terfragmentasi normal.
Penjelasan Spektrum massa
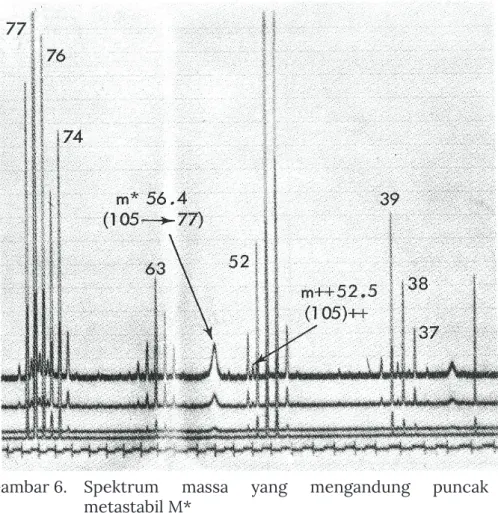
Pada spektrum massa akan ditemukan M+ dengan intensitas tinggi, hal ini dikarenakan pemisahan ion yang paling mudah adalah proses berenergi tinggi. Pemutusan ikatan M+ bergantung pada struktur dan gugus fungsi dalam molekul organik, sehingga menentukan seberapa besar intensitas yang dihasilkan fragmen akibat pemutusan tersebut (Tabel 2). Jika fragmentasi melibatkan dua atau lebih reaksi yang bersaing, hanya proses fragmentasi dengan energi aktivasi terminasi terendah yang akan menghasilkan m* (puncak metastabil).
Jika dalam ion radikal molekul fragmentasi melibatkan dua atau lebih mode peluruhan, spektrum akan menunjukkan m/e fragmen yang dihasilkan dari pemutusan ikatan dengan energi paling rendah, dan mungkin satu-satunya proses primer jika faktor frekuensinya tinggi.
Puncak ion molekul (M + )
Namun jika terdapat ikatan lemah (Eo = 3 – 5 eV), ion M+ akan sedikit atau tidak ada sama sekali. Intensitas kuat menunjukkan tinggi puncak ion fragmen lebih dari 30% puncak basa, intensitas lemah menunjukkan tinggi puncak hanya beberapa % (Gambar 8). Namun penting juga untuk dicatat bahwa jika ion molekul mengalami fragmentasi gugus metil membentuk m/e A, dan fragmentasi air menghasilkan m/e B, maka A bukanlah ion molekul, meskipun perbedaan antara A dan puncak B adalah 3 satuan massa.
Aturan elektron genap menyatakan bahwa ion dengan elektron ganjil akan melepaskan radikal dan/atau molekul dengan elektron genap;
Penentuan rumus molekul
Aturan nitrogen menyatakan bahwa jika suatu senyawa terdiri dari atom C, H, dan O maka Mrnya genap, dan jika ada N maka jumlah nitrogennya juga harus genap, sedangkan jika Mr ganjil maka jumlahnya harus N. menjadi aneh juga; Untuk menentukan rumus molekul dari tabel di atas perlu memperhatikan aturan nitrogen yaitu M+ = 150 (genap), artinya jika dalam molekul terdapat nitrogen maka jumlah nitrogen dalam molekul harus genap. Dari dua pilihan ini, dipilih % intensitas (M+2) yang paling mendekati 0,8; Berdasarkan data tersebut, rumus molekul yang sesuai dengan data spektrum massa adalah C9H10O2.
Apabila senyawa organik yang dianalisis mengandung unsur/atom selain C, H, O, N, tentukan terlebih dahulu jenis dan jumlah unsurnya, kemudian kurangi Mr, kemudian tentukan komposisi sisa molekulnya seperti di atas.
Penggunaan rumus molekul
Reaksi-reaksi ion dalam fasa gas
Pada senyawa aromatik tersubstitusi, terdapat beberapa reaksi fragmentasi yang dapat terjadi tergantung pada jenis dan posisi substituen. Fragmentasi senyawa alifatik terjadi melalui pemutusan ikatan kovalen primer tunggal, melalui homolisis dan pemutusan. Terjadinya reaksi penataan ulang jika energi putusnya besar sering terjadi pada senyawa yang mengandung gugus karbonil dan hidrogen, yang dikenal dengan reaksi penataan ulang McLacfferty.
Terjadinya reaksi penataan ulang jika energi putusnya besar sering terjadi pada senyawa yang mengandung gugus karbonil dan hidrogen, yang dikenal dengan reaksi penataan ulang McLacfferty.
Spektra hidrokarbon dan beberapa senyawa gugus fungsi tunggal
Setelah mengalami reaksi penataan ulang, ikatan terputus, menghasilkan fragmen radikal ion enol dan olefin. Selain radikal, ion, atau ion radikal yang dihasilkan selama fragmentasi, molekul kecil, seperti air, karbon dioksida, karbon monoksida, atau alkena, juga dilepaskan dari ion molekul. Satu molekul air biasanya berasal dari ion radikal molekul senyawa alkohol; karbon dioksida dan karbon monoksida berasal dari ion radikal molekul anhidrida; sedangkan alkena merupakan hasil penataan ulang McLafferty molekul ion radikal dari senyawa yang mengandung gugus karbonil dan mengandung hidrogen.
Penghapusan air ini sangat mudah sehingga puncak ion molekul bahkan tidak ditemukan dalam spektrum.
Ion molekul alkohol mudah kehilangan H2O dan menunjukkan puncak 18 satuan massa lebih kecil dari puncak ion molekul. Misalnya senyawa aromatik yang mempunyai gugus metil orto terhadap gugus nitro akan melepaskan gugus OH, sedangkan senyawa aromatik yang mempunyai gugus ester orto terhadap OH, NH, SH, atau CH3 akan melepaskan alkohol. Penentuan struktur molekul senyawa organik hanya dengan mengandalkan spektroskopi massa tidak cukup meyakinkan jika senyawa organik tersebut merupakan senyawa baru dan/atau mempunyai struktur kompleks.
Aturan Stephenson
Aturan Stephenson menyatakan bahwa bagian suatu fragmen yang bermuatan jika terjadi jenis fragmentasi tertentu dan fragmen tersebut merupakan perpanjangan dari sistem konjugasi akan menurunkan potensial ionisasi (PI). Hal serupa juga terjadi pada reaksi pemutusan ikatan tunggal yang didahului dengan penataan ulang, ion radikal yang terbentuk adalah ion radikal yang PI-nya lebih kecil. Selain dilaporkan dalam bentuk spektral atau tabel, hasil analisis MS juga dapat dilaporkan dalam bentuk urutan m/e, dimulai dari massa tertinggi (M+), serta % intensitas; karena jika.
Jenis spektrometri massa
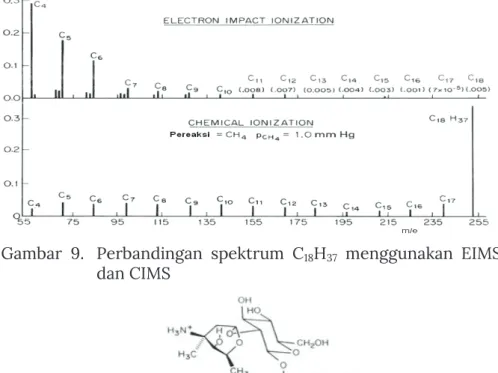
Dalam CIMS, sampel gas bereaksi dengan lebih dari 103 x sampel gas reagen untuk memperoleh ion kuasi-molekul (M+H)+. Sampel yang dianalisis berada dalam fase padat atau cair yang terkondensasi dan kemudian dibombardir oleh partikel atau cahaya. Contoh spektrum MS C18H37 hasil analisis menggunakan CIMS dibandingkan EIMS dapat dilihat pada Gambar 9 dan Gambar 10.
Spektrometer massa juga dapat digabungkan dengan kromatografi gas untuk membentuk GC-MS atau dengan kromatografi cair untuk membentuk LC-MS.
Soal latihan
- Apakah ion molekul dan fragmen-fragmen utama yang bermuatan positif yang dihasilkan dari ionisasai: (a) 2-
- Sarankan struktur dan pola fragmentasi yang dapat menerangkan peak-peak yang dijumpai dalam spektrum
- Suatu keton (C 6 H 12 O) memberikan suatu uji positif iodoform dan menunjukkan puncak-puncak dalam spektrum massa
- Jelaskan bagaimana saudara dapat memperkirakan struktur molekul dari data MS berikut
- Gambarkan corak spektrum massa ion molekul dari 1-bromo- 2,2-dikloroetana !
- Suatu senyawa menunjukkan pita serapan inframerah yang kuat pada 1715 cm cm . Senyawa ini bereaksi dengan
- Spektrum inframerah senyawa ini mengandung pita karbonil pada 1830 cm 1 . Spektrum NMR mengandung singlet pada
- Jelaskan bagaimana struktur molekul dari senyawa ini ditentukan berdasarkan spektrum massa berikut, lengkapi
- Jelaskan bagaimana struktur molekul dari senyawa ini ditentukan berdasarkan spektrum massa berikut, lengkapi
- Jelaskan bagaimana struktur molekul dari senyawa ditentukan berdasarkan spektrum IR, 1 H-NMR berikut, dan
- Jelaskan bagaimana struktur molekul dari senyawa ditentukan berdasarkan spektrum IR, 1 H-NMR, dan spektrum
- Jelaskan bagaimana struktur molekul dari senyawa-senyawa berikut ditentukan berdasarkan spektrum IR, 1 H-NMR, dan
Ion dan fragmen molekul bermuatan positif terpenting yang dihasilkan dari ionisasi adalah: (a) 2- yang bermuatan positif akibat ionisasi: (a) 2-metilpentana, (b) 2,2-dimetilpropana, (c) 1-pentena . Prediksikan nilai m/e produk penataan ulang McLafferty dari senyawa berikut: (a) 2-pentanon, (b) 3- McLafferty dari senyawa berikut: (a) 2-pentanon, (b) 3- metilbutanal, ( c) propil asetat, (d) etil 3-metilbutanoat. Suatu keton (C6H12O) memberikan uji iodoform positif dan menunjukkan puncak spektrum massa dan menunjukkan puncak spektrum massa pada nilai m/e dan 43.
NMR mengandung sinyal, termasuk yang ditemukan pada kisaran 100-200 ppm. Puncak penting senyawa ini adalah sebagai berikut. dan terdapat puncak metastabil di 44,5 dan 62,6.
DAFTAR PUSTAKA
Silverstein et al., 1981, Spectrometric Identification of Organic Compounds, John Willey