LAPORAN PRAKTIKUM TERMODINAMIKA SEMESTER GENAP 2021/2022
KALORIMETRI – KALORIMETRI EQUIVALEN AIR
NAMA : Fadhilah Amelia NIM : 2010208002
Dosen : Ravensky Yurianty,Pratiwi S.Pd M,Si
LABORATORIUM IPA
FAKULTAS ILMU TARBIYAH DAN KEGURUAN UNIVERSITAS ISLAM NEGERI RADEN FATAH
2022
KALORIMETRI – KALORIMETRI EQUIVALEN AIR
I. TUJUAN
Untuk menentukan equivalen air kalorimeter II. DASAR TEORI
Termodinamika kimia dapat didefinisikan sebagai cabang kimia yang menangani hubungan kalor, kerja, dan bentuk energi lain, dengan kesetimbangan dalam reaksi kimia dan dalam perubahan keadaan. Erat berkaitan dengan termodinamika kimia adalah termokimia, yang menangani pengukuran dan penafsiran perubahan kalor yang menyertai reaksi kimia, perubahan keadaan dan pembentukan larutan (Keenan, 1980)
Menurut Raymond Chang (2004), termokimia adalah ilmu kimia yang mempelajari perubahan kalor yang menyertai suatu reaksi kimia.
Kalor adalah berbentuk energi yang menyebabkan suatu zat memiliki suhu. Jika zat menerima kalor, maka zat itu akan mengalami perubahan wujud, seperti perubahan wujud dari padat menjadi cair. Sebaliknya jika suatu zat mengalami perubahan wujud dari cair menjadi padat maka zat tersebut akan melepaskan sejumlah kalor.
Hampir semua reaksi kimia menyerap atau menghasilkan energi, umumnya dalam bentuk kalor. Penting bagi kita untuk memahami perbedaan energi termal dan kalor. Kalor adalah perpindahahan energi termal antara dua benda yang suhunya berbeda walaupun kalor diserap atau kalor dibebaskan. Ketika menggambarkan perubahan energi termal yang terjadi selama proses tersebut. Ilmu kimia yang mempelajari kalor yang menyertai reaksi kimia disebut termokimia
Berdasarkan prinsip perpindahan kalor,banyak sekali manfaat didalam bidang pangan diaplikasin sebagai pengering suatu bahan makanan karna dengan pengeringan mikroba pada makanan akan mati dan tidak tumbuh dan sebagai penggoreng bahan makanan. Oleh karena banyaknya kejadian dalam kehidupan sehari – hari yang melibatkan perpindahan kalor maka kalorimetri perlu dipelajari.
Kalorimeter adalah alat yang digunakan untuk menentukan kapasitas kalor, kapasitas kalor jenis, dan kapasitas kalor laten dari suatu benda atau bahan. Alat kalorimeter yang sering digunakan dalam percobaan di laboratorium adalah kalorimeter gelas atau kalorimeter termos. Wadah kalorimeter ini terbuat dari logam dan dilapisi oleh bahan isolator untuk mencegah hilangnya kalor dari wadah logam ke lingkungan. Prinsip kerja alat ini adalah mengukur perubahan suhu dan perkiraan kapasitas kalor, umumnya kapasitas kalor wadah dapat diabaikan karena relatif sangat kecil.
Kalorimeter terdiri dari dua wadah, wadah luar dan dalam. Ruang antara wadah ini bertindak sebagai isolator kalor dan karenanya ada pertukaran kalor yang sangat sedikit di antara kedua wadah sisi.
Termometer mengukur suhu cairan di wadah dalam. Fungsi pengaduk untuk mengaduk cairan dalam mendistribusikan kalor di seluruh wadah.
Cincin serat dalam kalorimeter membantu menahan bejana dalam yang menggantung di tengah bejana luar. Kalorimeter juga memiliki penutup isolasi atau tutup dengan lubang untuk memasang batang pengaduk dan termometer.
Sebuah kalorimeter yang mengandung air atau zat lainya dengan kapasitas kalor yang sudah diketahui. Kalor (Q) dilepaskan dengan reaksi atau proses penyerapan di kalorimeter dan zat apapun pada kalorimeter.
Jika terdapat zat lain dalam kalorimeter, maka kestimbangan energi adalah:
Q = Qcal + QW
Qcal= aliran kalor pada kalorimeter Qcal = Ccal ΔT
Qw = aliran kalor pada air Qw = Cw ΔT
Ccal = kapasitas kalor kalorimeter Cw = Kapasitas Kalor air
Karena air dan kalorimeter berada dalam kesetimbangan suhu sehingga nilai ΔT sama. Perubahan energi dari reaksi yang terjadi pada tekanan tetap disebut sebagai perubahan entalpi atau kalor reaksi.
Kapasitas kalor, yang didefinisikan sebagai jumlah kalor yang dibutuhkan untuk menaikkan suhu jumlah tertentu suatu zat sebesar satu derajat Celcius, (J/oC) dengan lambang C yang direpresentasikan sebagai jumlah kapasitas kalor untuk masing-masing komponen yang terlibat dalam proses reaksi.
C = Ccal + Cw
Kalorimeter merupakan sistem terisolasi, sehingga tidak ada pertukaran kalor, sehingga
Qreaksi = Qkalorimeter
Berdasarkan sifat reaksi, terdapat beberapa macam reaksi termokimia diantaranya kalor pembentukan, kalor pelarutan, kalor pelarutan, kalor pembakaran, kalor penetralan. Untuk mengukur kalor dalam bentuk kalor pada suatu zat dapat menggunakan alat kalorimeter.
Kalorimeter ada dua jenis yaitu kalorimeter sederhana dan kalorimeter bom.
Dalam suatu reaksi jumlah kalor yang menaikkan suhu suatu zat dengan jumlah tertetnu, jumlah kalor yang sama dapat secara bersamaan menikkan suhu yang sama dari massa air tertentu. Massa air kemudian diistilahkan dengan ekuivalen air
Perubahan kalor yang terkait dengan reaksi kimia dapat dipelajari dengan bantuan teknik kalorimetri. Dalam reaksi spesifik kuantitas kalor yang menaikkan suhu suatu zat dengan jumlah tertentu, kuantitas kalor yang sama dapat secara bersamaan menaikkan suhu yang sama dari massa air tertentu dengan menganggap kalor spesifik air menjadi 1 kalori per gram. Massa air kemudian diistilahkan dengan ekuivalen air
III. ALAT DAN BAHAN 1. Alat
a. Kalorimeter b. Termometer c. Stirer 2. Bahan
a. Air dingin b. Air panas
IV. PROSEDUR KERJA
Silahkan pilih menu calorimetry – water equivalent, kemudian simulator.
Catatan : Penting untuk dicatat bahwa, yang pertama harus memilih sampel "air dingin" untuk melanjutkan dengan simulasi. Setiap kali pembacaan pada stopwatch 4 menit 30 detik, yang kemudian dapat memilih sampel berikutnya "air panas". Setiap kali pembacaan sampel air panas 4 menit 30 detik, kemudian dapat memilih sampel air panas + air dingin.
Adapun prosedur percobaan sebagai berikut :
1. Anda dapat menconteng cross section terlebih dahulu 2. Pilih air dingin (cold water)
3. Mulai reaksi dengan mengklik tombol "Mulai".
4. Catat waktu dan suhu hingga 4 menit 30 detik.
5. Masukkan nilai dalam lembar kerja.
6. Cari tahu suhu konstan (T2).
7. Masukkan nilai di lembar kerja.
8. Pilih air panas (hot water). (Ini akan aktif hanya setelah prosedur di atas)
9. Ulangi langkah 3, 4, 5 dan 6 (T1).
10. Pilih campuran "Air panas + Air dingin".
11. Ulangi langkah 3, 4, 5 dan 6 (T3). 12. Hitung equivalen air dengan kalorimeter.
Catatan: Diasumsikan bahwa pada 4 menit 30 detik suhu kalorimeter menjadi nilai konstan.
V. HASIL DAN PEMBAHASAN 1. Hasil
a. Penentuan Ekuivalen Air Kalorimeter
No Waktu ( s)
Suhu Air Dingin
(◦C)
Air Panas (◦C)
Campuran (◦C)
1 0 27.1 50.1
2 30 27.1 49.7
3 60 27.1 49.3
4 90 27.1 49
5 120 27.1 48.6
6 150 27.1 48.2
7 180 27.1 47.8
8 210 27.1 47.8
9 240 27.1 47.8
10 270 27.1 47.8
11 300 40.7
12 330 40.3
13 360 39.9
14 390 39.5
15 420 39.1
16 450 38.7
17 480 38.7
18 510 38.7
19 540 38.7
20 570 38.7
Suhu air dan kalorimeter T1 =
50,1+49,7+49,3+49+48,6+48,2+47,8+47,8+47,8+47,8 10
T1 = 486,1 10 T1 = 48,61 ◦C
Suhu air dingin
Karena suhu air dingin konstan, maka T2 = 27, 1 ◦C
Suhu Campuran T3 =
40,7+40,3+39,9+39,5+39,1+38,7+38,7+38,7+38,7+38,7 10
T3 = 393 10 T3 = 39, 3 ◦C
Kalor yang didapatkan dari air panas = 50 ( T3 – T2)
= 50 (39,3 – 27,1 )
= 50 ( 12,2 )
= 610 cal Ekuivalen air kalorimeter = W
W =
(
50(T(T1−T3−T32))) – 50
W =
(
50(39,3−27,1)(48,61−39,3)
) – 50
W =
(
50(12,2)(9,31)) – 50
W =
(
9,31610) – 50
W = 65,5209
– 50
W = 15, 52 Cal
2.
PembahasanPraktikum ini dilakukan menggunakan media berupa Virtual Lab Amrita dengan judul percobaan Kalorimetri – Kalorimetri Equivalen Air. Yang bertujuan untuk menentukan ekuivalen air kalorimeter. Kalorimeter adalah alat untuk yang digunakan untuk menentukan kapasitas kalor, kapasitas kalor jenism dan kapasitas kalor laten dari suatu benda atau bahan.
Untuk memulai praktikum ini, pertama – tama praktikan login terlebhin dahulu di Virtual Lab Amrita. Kemudian praktikan memilih Chemical Sciences , lalu memilih Physical Chemistry Virtual Lab, selanjutnya pilih praktikum yang akan kita lakukan yaitu Calorimetry – Water Ewuivalent Calorimeter. Setelah itu pilih simulator untuk melakukan percobaan.
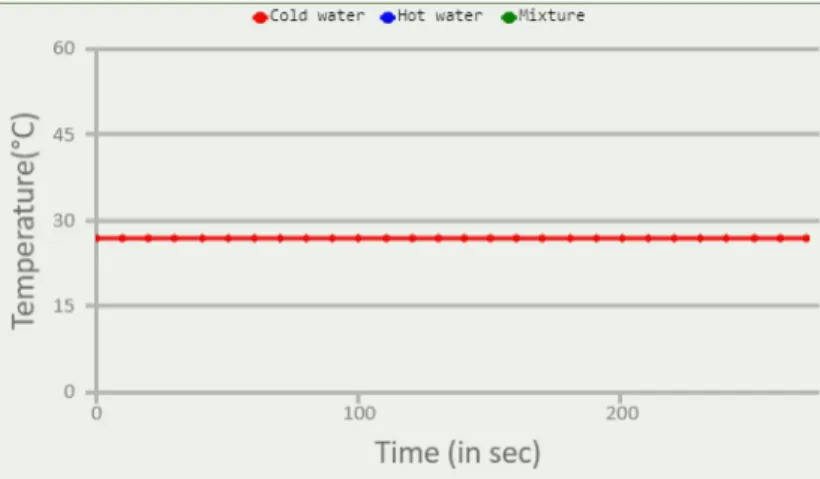
Langakah Pertama yang dilakukan yaitu memilih sampel dibagian select sample. Sampel Pertama yang digunakan adalah air dingin (cold water). Kemudian mencentang kolom cross section, setelah itu klik start, kemudian ditunggu selama 270 detik atau sekitar 4 menit 30 detik. Setelah diamati dari grafik ternyata suhu dari sampel pertama ( air dingin) di dapat lah data tidak ada perubahan suhu yang terjadi ( suhu konstan) yaitu berkisar pada angka 27,1 ºC peristiwa ini disebut dengan isotermal. Proses isotermal adalah proses prubahan keadaan termodinamika yang terjadi pada suhu konstan atau tetap.
Gambar 1. Grafik suhu sampel 1 (air dingin)
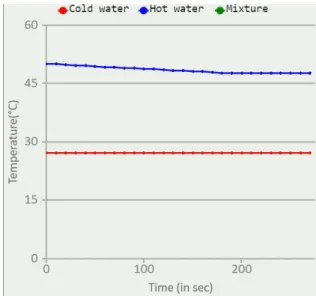
Selanjutnya untuk sampel yang kedua praktikan memilih air panas ( Hot water). Kemudian mecentang kembali kolom cross section, klik start, dan tunggu selama 270 detik atau sama dengan 4 menit 30 detik. Setelah diamati dari grafik suhu mengalami penurunan, pada saat 0 detik air ppanas besuhu 50,1 ºC hingga pada detik terakhir atau detik ke 270 suhu menjadi 47,8 ºC. Peristiwa ini terjadi karena air panas melepaskan sebagian kalor ke zat yang bersuhu rendah agar kalor tersebar merata
Gambar 2. Grafik suhu sampel 2 ( air panas)
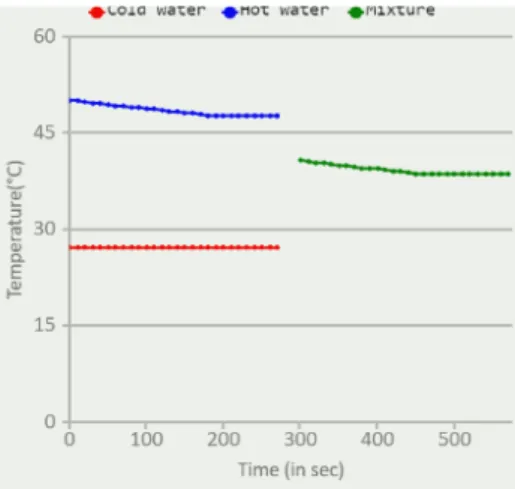
Selanjutnya untuk sampel terakhir yaitu adalah sampel campuran, air dingin dicampur dengan air panas. Praktikan kembalik mencentang kolom cross section dan mengklik start, kemudian tunggu selama 270 detik atau 4 menit 30 detik lagi. Setelah diamati pada sampel ketiga terjadi perubahan suhu karena campuran tidak konstan pada detik awal sampel bersuhu 40,7 ºC kemudian pada detik terakhir suhu berubah menurun menjadi 38,1 ºC. Perubahan suhu terjadi karena adanya pelepasan dan penyerapan kalor. Air panas melepaskan sebagain kalornya ( Qlepas ) dan air dingin menyerap kalor (Qterima) oleh karena itu suhunya menjadi turun sesuai dengan azaz black
Gambar 3. Grafik Perubahan suhu sampel 3 ( air dingin + air panas)
Dari percobaan ini praktikan menghasilkan data didapat rata – rata T1 = 48,61 ºC , T2 = 27,1 ºC dan rata rat T3 = 39,3ºC. Setelah itu praktikan melakukan perhitungan kalor yang didapatkan dari air panas yaitu sebesar 610 cal dan ekuivalen air kalorimeter yaitu sebesar 15,52 cal.
VI. KESIMPULAN
a. Kalor adalah berbentuk energi yang menyebabkan suatu zat memiliki suhu
b. Kalorimeter adalah alat yang digunakan untuk menentukan
kapasitas kalor, kapasitas kalor jenis, dan kapasitas kalor laten dari suatu benda atau bahan
c. Dari percobaan ini praktikan menghasilkan data didapat rata – rata T1 = 48,61 ºC , T2 = 27,1 ºC dan rata rat T3 = 39,3ºC. Setelah itu praktikan melakukan perhitungan kalor yang didapatkan dari air panas yaitu sebesar 610 cal dan ekuivalen air kalorimeter yaitu sebesar 15,52 cal.
VII. PERTANYAAN DAN JAWABAN
a. Hitung kapasitas kalorimeter. Suhu air panas 50 mL adalah 37,9◦C suhu air dingin 50 mL adalah 20.9◦C, Suhu setelah pencampuran adalah 29,1◦C, Panas jenis air adalah 4,184 J/ g C, massa jenis air 1 g/mL . H
b. Hitung kapasitas kalor (kJ/K) kalorimeter ketika suhunya dinaikkan menjadi 0,3 K dengan menyerap energi 30,0 J
c. Diskusikan perbedaan antara kalorimetri volume konstan dan tekanan konstan
d. Bagaimana Anda menentukan ekuivalen air dari kalorimeter Jawab :
a. Dik :
ρ air = 1gr/mL Cair = 4,184 J/g°C
Tair dingin = 20,9 °C Tair panas = 37,9 °C Vair dingin = 50 mL Vair panas = 50 mL m = ρ x V
m = 1 gr/mL x 50 mL m = 50gr
Tcampuran = 29,1 °C
Dit : Kapasitas kalorimeter?
Jawab :
Q lepas air panas Qair panas = m C ∆T
= m C ( Tair panas – Tcampuran)
= 50g x 4,184 J/g°C ( 37,9 – 29,1) °C = 1840,96 Joule
Q yang diserap air Qair dingin = m C ∆T
= m C ( Tcampuran – Tair dingin )
= 50g x 4,184 J/g°C ( 29,1– 20,9) °C = 1715, 44 Joule
Q serap dari kalorimeter Q = Qair panas – Qair dingin
= (1840,96 – 1715,44) Joule = 125,52 Joule
Kapasitas kalorimeter (C) C= Qkal
Tcampran−Tairdingin
C= 125,52Joule (29,1−20,9)°C C=15,30J/° C
b. Diketahui :
Suhu ditambahkan = 0.3 K Q = 30 Joule
Ditanya : Kapasitas air Kalorimetri?
Jawab : C= Q
∆ T
C=30Joule 0,3K C=100J/K C = 0,1 Kj/K
c. Kalorimetri bom volume konstan adalah kalor pembakaran biasanya diukur dengan menempatkan senyawa yang massanya diketahui dalam wadah baja yang di isi dengan oksigen pada tekanan 30 atm.
Bom tertutup dicelupkan kedalam air, sampel dihubungkan ke listrik, dan kalor yang dihasilkan oleh reaksi pembakaran dapat dihitung secara tepat dengan mencatat kenaikan suhu air. Kalor yang dilepas oleh sampel diserap oleh air dan bom. Kalorimeter yang dirancang secara khusus itu memungkinkan kita untuk mengasumsikan bahwa tidak ada kalor ( atau massa) yang hilang ke lingkungan selama waktu pengukuran. Dengan demikian kita dapat mengetahui kalor pembakaran pada bom tersebut
Sedangkan, Kalorimetri tekanan konstan adalah peralatan yang lebih sederhana dibanding kalorimeter volume – konstan, yang digunakan untuk menentukan perubahan kalor untuk reaksi selain pembakaran.
Secara kasar, kalorimeter tekanan-kanstan dapat dibuat dari dua cangkir kopi styrofoam. Hal tersebut merupakan cara sederhana dari kalorimetri tekanan-konstan. Peralatan ini mengukur pengaruh kalor pada berbagai reaksi, seperti penetralan asam basa, kalor pelarut, dan kalor pengenceran. Karena tekanannya konstan, perubahan kalor yang terjadi
untuk proses (qreaksi) sama dengan perubahan entalpi. Dari dua cangkir kopi styrofoam dapat diketahui perubahan-perubahan kalor yang terjadi serta cara sederhana yang dapat dilakukan untuk mengetahui perubahan kalor.
d. Untuk menentukan ekuivalen air dari kalorimeter adalah dengan cara menghitung Qlepas = Qterima . Harga air kalorimeter adalah banyaknya panas yang diperlukan untuk menaikkan satu satuan derajan suhu kalorimeter tersebut. Jika bahan dari kalorimeter diketahui yang dimaksudkan dengan harga air tersebut sama dengan kapasitas kalor dari kalorimeter tersebut. Karena bahan kalorimeter biasanya sering tidak diketahui, harga air kalorimeter sering ditentukan dengan menggunakan azaz black
Kalor yang dilepas = Kalor yang diterima Qlepas = Qterima
m1 . c1 ( T1 – Ta ) = m2 . c2 (Ta – T2) Sehingga besarnya kapasitas kalor kalorimeter adalah :
C=m2ca
(
T2−Ta)
−m1ca(Ta−T1) (Ta−T1)VIII. LAMPIRAN
DAFTAR PUSTAKA
Chang R. 2004. Kimia Dasar: Konsep-Konsep Inti Edisi 3 Jilid II Erlangga: Jakarta
Fadiawati, Noor et. 2016. alat Penentuan Kalor Reaksi Pada Tekanan Tetap. Jurnal Pendidikan dan Pembelajaran Kimia.
Jurnal Pendidikan dan Pembelajaran Kimia. Volume 5.
Nomor 1.
Noviyanti, Mardiyah dan Hufry. 2020. Rancangan bangun set eksperimen kalorimeter digital dengan pengindera sensor termokopel dan sensor load cell berbasis arduino Uno. Jurnal Pillar of Physics, Volume 13. Halaman 34-41
LAPORAN PRAKTIKUM TERMODINAMIKA SEMESTER GENAP 2021/2022
KALORIMETRI – PANAS PENETRALAN
NAMA : Fadhilah Amelia NIM : 2010208002
Dosen : Ravensky Yurianty Pratiwi, S.Pd M,Si
LABORATORIUM IPA
FAKULTAS ILMU TARBIYAH DAN KEGURUAN UNIVERSITAS ISLAM NEGERI RADEN FATAH
2022
KALORIMETRI – PANAS PENETRALAN I. TUJUAN
Untuk menentukan kalor penetralan asam kuat dengan basa kuat II. DASAR TEORI
Termodinamika kimia dapat didefinisikan sebagai cabang kimia yang menangani hubungan kalor, kerja dan bentuk lain energi, dengan kesetimbangan dalam reaksi kimia dan dalam perubahan keadaan. Erat berkaitan dengan termodinamika kimia adalah termokimia, yang menangani pengukuran dan penafsiran perubahan kalor yang menyertai reaksi kimia, perubahan keadaan dan pembentukan larutan (Keenan, 1980). Termokimia merupakan penerapan hukum pertama termodinamika terhadap peristiwa kimia yang membahas tentang kalor yang menyertai reaksi kimia. Dalam termokimi ada dua hal yang perlu diperhatikan yang menyangkut perpindahan energi, yaitu sistem dan lingkungan (Atkins, 1999).
Termokimia merupakan penerapan hukum pertama termodinamika terhadap peristiwa kimia yang membahas tentang kalor yang menyertai reaksi kimia. Dalam termokimia ada dua hal yang perlu diperhatikan yang menyangkut perpindahan energi yaitu sistem dan lingkungan.
Sistem adalah segala sesuatu yang menjadi pusat perhatian dalam mempelajari perubahan energi. Lingkungan adalah hal – hal diluar sistem yang membatasi sistem ( mengelilingi sistem) dan dapat mempengaruhi sistem, dalam hal ini, tabung reaksi, tempat berlangsungnya reaksi kimia, merupakan lingkungan
Rekasi endoterm adalah reaksi yang disertai dengan perpindahan kalor dari lingkungan ke sistem ( kalor diserap oleh sistem dari lingkungannya) ditandai dengan adanya penurunan suhu lingkungan disekitar sistem. Reaksi eksoterm adlah reaksi yang disertai dengan perpindahan kalor dari sistem ke lingkungan (kalor dibebaskan oleh
sistem ke lingkungannya) ditandai dengan adanya kenaikan suhu lingkungan di sekitar sistem.
Kalor adalah berbentuk energi yang menyebabkan suatu zat memiliki suhu. Jika zat menerima kalor, maka zat itu akan mengalami perubahan wujud, seperti perubahan wujud dari padat menjadi cair.
Sebaliknya jika suatu zat mengalami perubahan wujud dari cair menjadi padat maka zat tersebut akan melepaskan sejumlah kalor. Kalor reaksi pada tekanan tetap berbeda dengan kalor reaksi volume tetap, kalor reaksi pada tekanan tetap memperhitungkan kerja tekanan volume, sedangkan kalor reaksi pada volume tetap tidak memperhitungkannya.
Kalor reaksi pada tekanan tetap disebut entalpi (H)
Kalorimetri adalah ilmu pengetahuan yang menjelaskan mengenai perubahan energi sebuah sistem dengan menghitung perubahan energi sebuah sitem dan menghitung perubahan temperatur di sekelilingnya.
Eksperimen kalorimetri sering digunakan untuk menentukan entalpi sebuah reaksi, fusi panas reaksi kimia, atau untuk menghitung kapasitas panas sebuah elemen yang tidak diketahui. Beberapa eksperimen dilakukan pada sebuah kalorimeter. Kalorimeter adalah alat yang digunakan untuk menentukan kapasitas kalor, kapasitas kalor jenis dan kapasitas kalor laten dari suatu benda atau bahan (Mardiyah Noviyanti et al 2020)
Panas netralisasi terjadi dalam larutan asam kuat dan basa kuat dengan sedikit air ternyata berharga konstan. Hal ini disebabkan karena asam kuat dan basa kuat akan mudah terionisasi sempurna dalam bentuk ion di dalam larutan. Panas penetralan merupakan jumlah panas yang dilepaskan ketika 1 mol air terbentuk akibat reaksi dengan asam dan basa kuat atau sebaliknya (Ari Harnanto et al , 2009)
Pada reaksi asam dan basa konsentrasinya tidak selamanya menghasilkan larutan netral, karena tergantung dari kekuatan asam dan basa tersebut. Reaksi penetralan asam basa dapat digunakan untuk menentukan kadar/konsenrasi berbagai jenis larutan. Kadar larutan asam
ditentukan dengan menggunakan larutan basa yang telahh diketahui kadarnya, atau sebaliknya (Ari Harnanto et al , 2009)
Asam menurut arhenius didefinisikan sebagai zat – zat yang dapat memberikan ion hidrogen (H+) atau ion hidronium (H3O+) bila dilarutkan dalam air, Basa menurut Arhenius didefinisikan sebagai zat – zat yanfg dalam air menghasilkan ion hidroksida ( OH-) .Johanes N Bronsted dan Thomas Lowry mengemukakan teori asam dan basa sebagai “Asam adalah senyawa yang dapat memberikan proton (H+) kepada senyawa lain disebut juga donor proton. Basa ialah senyawa yang menerima proton (H+) dari senyawa lain. Disebut juga akseptor proton” Lewis menyatakan bahwa asam adalah suatu molekul atau ion yang dapat menerima pasangan elektron, sedangkan basa adalah suatu molekul atau ion yang dapat memberikan pasangan elektronnya (Ari Harnanto et al , 2009)
Panas pelarutan adalah panas yang diserap jika 1 mol padatan dilarutkan dalam larutan yang sudah dalam keadaan jenuh. Halini berbeda dengan panas pelarutan untuk larutan encer yang terdapat dala tabel panas pelarutan. Panas pelarutan biasanya terdapa tabel merupakan panas. Pengenceran dari keadaan jenuh menjadi encer.
III. ALAT DAN BAHAN 1. Alat
d. Kalorimeter e. Termometer f. Stirer 2. Bahan
c. Air dingin d. Air panas e. HCl f. NaOH
IV. PROSEDUR KERJA
Silahkan pilih menu calorimetry– heat of Neutralization, kemudian simulator. Catatan : Penting untuk dicatat bahwa, yang pertama harus memilih sampel "HCl" untuk melanjutkan dengan simulasi. Setiap kali pembacaan pada stopwatch 4 menit 30 detik, kemudian dapat memilih sampel "NaOH". Setiap kali pembacaan sampel NaOH 4 menit 30 detik,
selanjutnya dapat memilih Sampel HCl + NaOH. Adapun langkah pengerjaan sebagai berikut :
1. Anda dapat menconteng cross section terlebih dahulu 2. Pilih HCl.
3. Mulai reaksi dengan mengklik tombol "Mulai".
4. Catat waktu dan suhu hingga 4 menit 30 detik.
5. Masukkan nilai dalam lembar kerja.
6. Cari tahu suhu konstan (T2).
7. Masukkan nilai di lembar kerja.
8. Pilih NaOH. (Ini akan aktif hanya setelah prosedur di atas) 9. Ulangi langkah 3, 4, 5 dan 6 (T1).
10. Pilih campuran "HCl + NaOH".
11. Ulangi langkah 3, 4, 5 dan 6 (T3).
12. Hitung Kalor Netralisasi.
V. HASIL DAN PEMBAHASAN 1. Hasil
a. Penentuan Ekuivalen Air Kalorimeter
No Waktu
Suhu
HCl (oC) NaOH (oC) Campuran (oC)
1 0 29 30.1
2 30 29 29.8
3 60 29 29.4
4 90 29 29.1
5 120 29 28.8
6 150 29 28.4
7 180 29 28.1
8 210 29 28.1
9 240 29 28.1
10 270 29 28.1
11 300 36.1
12 330 35.7
13 360 35
14 390 35.3
15 420 34.9
16 450 34
17 480 33.6
18 510 33.6
19 540 33.6
20 570 33.6
Suhu alkali dan kalorimeter
T1 =
30,1+29,8+29,4+29,1+28,8+28,4+28,1+28,1+28,1+28,1 10
T1 = 288 10 T1 = 28,8 oC
Suhu Asam,
Karena suhu asam konstan, T2 = 29 oC
Suhu Campuran,
T3 =
36,1+35,7+35,3+34,9+34,4+34+33,6+33,6+33,6+33,6 10
T3 = 344,8 10 T3 = 34,48 oC
Ekuvalen air kalorimeter, W = 15,52 cal ( di dapat dari percobaan 1)
Kalor Yang diserap
Q = ( 50 + W ) ( T3 – T1 ) + 50 (T3 – T2 ) = = ( 50 + 15,52) ( 34,48 – 28,8 ) + 50 ( 34,48 – 29) = (65,52) (5,68) + 50 ( 5,48 )
= 372,1536 + 274 = 646,1536 cal
Kalor penetralan =(
(Q x(V x C1000) ))
= (
(646,15(50xx1)1000))
= (
(646,150)(50))
= 12.923 cal
Kalor penetralan HCl dan NaOh = 12.923 cal x 0.0042
= 54,27 kJ
2. Pembahasan
Praktikum ini dilakukan menggunakan media berupa Virtual Lab Amrita dengan judul percobaan Kalorimetri – Panas Penetralan.
Yang bertujuan untuk menentukan kalor penetralan asam kuat dengan basa kuay
Untuk memulai praktikum ini, pertama – tama praktikan login terlebih dahulu di Virtual Lab Amrita. Kemudian praktikan memilih Chemical Sciences , lalu memilih Physical Chemistry Virtual Lab, selanjutnya pilih praktikum yang akan kita lakukan yaitu Heat of Neutralization Setelah itu pilih simulator untuk melakukan percobaan.
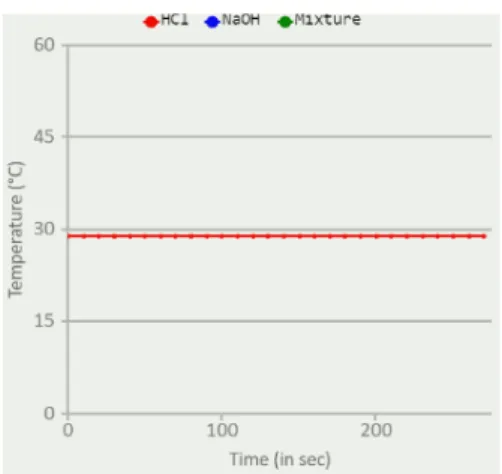
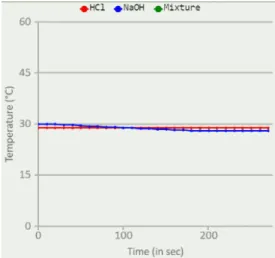
Langakah Pertama yang dilakukan yaitu memilih sampel dibagian select sample. Sampel Pertama yang digunakan adalah HCl (Asam Klorida). Asam klorida merupakan asam kuat. Kemudian mencentang kolom cross section, setelah itu klik start, kemudian ditunggu selama 270 detik atau sekitar 4 menit 30 detik. Setelah diamati dari grafik ternyata suhu dari sampel pertama (HCl) di dapat lah data tidak ada perubahan suhu yang terjadi (suhu konstan) yaitu berkisar pada angka 29ºC peristiwa ini disebut dengan isotermal.
Proses isotermal adalah proses perubahan keadaan termodinamika yang terjadi pada suhu konstan atau tetap.
Gammbar 1. Grafik suhu sampel 1 (HCl)
Selanjutnya untuk sampel yang kedua praktikan memilih NaOH (Natrium Hidrokisda) Natrium Hidroksida merupakan basa kuat. Kemudian mecentang kembali kolom cross section, klik start, dan tunggu selama 270 detik atau sama dengan 4 menit 30 detik.
Setelah diamati dari grafik suhu mengalami penurunan, pada saat 0 detik besuhu 30,1 ºC hingga pada detik terakhir atau detik ke 270 suhu menjadi 28,1 ºC. Peristiwa ini terjadi karena larutan NaOH melepaskan sebagian kalornya, jadi zat yang bersuhu tinggi akan melepaskan kalor ke zat yang bersuhu rendah agar kalor tersebar merata
Gambar 2. Grafik suhu sampel 2 (NaOH)
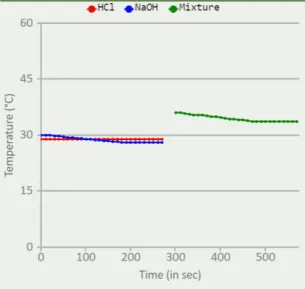
Selanjutnya untuk sampel terakhir yaitu adalah sampel campuran, HCl dicampur dengan NaOH. Praktikan kembali
mencentang kolom cross section dan mengklik start, kemudian tunggu selama 270 detik atau 4 menit 30 detik lagi. Setelah diamati pada sampel ketiga terjadi perubahan suhu karena campuran tidak konstan pada detik awal sampel bersuhu 36,1 ºC kemudian pada detik terakhir suhu berubah menurun menjadi 33,6 ºC. Perubahan suhu terjadi karena adanya pelepasan dan penyerapan kalor. NaOH melepaskan sebagian kalornya (Qlepas) dan HCl menyerap kalor (Qterima). Oleh karen itu suhunya menjadi turun. Kalor di dalam reaksi ini selalu terjaga kedalam sistem, karena sifat dari reaksi ini adalah netral. Reaksi ini disebut penetralan karena pencampuran basa kuat ke dalam asam kuat yang dapat mengakibatkan panas netralisasi oleh asam kuat dan basa kuat
Gambar 3. Grafik suhu sampel 3 ( HCl + NaOH)
Dari percobaan ini praktikan menghasilkan data didapat rata – rata T1 = 28,8 ºC , T2 = 29 ºC dan rata rat T3 = 34,48ºC . HCl asam kuat dan NaOH basa kuat, sehingga ketika kedua senyawa direaksikan akan terjadi penetralan. Hal ini dapat dilihat dari pengukuran suhunya.
Nantinya reaksi ini menghasilkan perubahan entalpi sama dengan perubahan energi dalam, sehingga didapalah hasi dari kalor penetralan HCl dan NaOH adalah 54276,6 Kj.
Pada pencampuran HCl dan NaOH terjadinya suatu reaksi eksoterm. Reaksi eksoterm adalah pelepasan kalor dari sistem ke lingkungannya sehingga suhu lingkungan bertambah atau mengalami kenaikan T2 > T1 . Pada reaksi eksoterm sistem yang melepaskan kalor akan mengalami penurunan energi sehingga nenergi sebelum reaksi akan lebih besar daripada energi setelah reaksi. Jadi pada percobaan diatas sudah terbukti bahwa pencampuran HCl dan NaOH akan mengalami reaksi eksoterm dengan nilai energi, T2 > T1 atau 29 oC >
28,8 oC
VI. KESIMPULAN DAN SARAN
1. Reaksi eksoterm adalah reaksi kimia dengan sistem melepaskan kalor sedangkan reaksi endoterm adalah reaksi kimia dengan sitem menyerap kalor dari lingkungan
2. Panas penetralan merupakan jumlah panas yang dilepaskan ketika 1 mol air terbentuk akibat reaksi dengan asam dan basa kuat atau sebaliknya
3. Dari percobaan diatas didapatkan hasil rata – rata T1 = 28,8 oC, T2 = 29 oC, dan T3 = 34,48 oC
4. HCl dan NaOH merupakan asam kuat dan basa kuat jadi ketika kedua senyawa direaksikan terjadi reaksi penetralan
5. Dari percobaan ini didapat hasil dari kalor penetralan HCl dan NaOH adalah 54276,6 Kj
VII. PERTANYAAN DAN JAWABAN
a. Jelaskan macam macam jenis kalor dan berikan masing masing contoh b. Apa perbedaan antara kapasitas kalor dan kalor jenis
c. Anda membahkan hidrogen klorida dan natrium hidroksida bersama sama dalam gelas kimia. Sebagai seorang ahli kimia jelaskan reaksi yang terjadi dalam sistem itu
d. Bagaimana Anda menentukan kalor netralisasi kalorimeter
Jawab :
a. 1. Kalor Pembentukan
Kalor pembentukan adalah kalor yang mengahasilkan atau diperlukan untuk pembuatan 1 mol senyawa dari unsur – unsurnya.
2. Kalor Penguraian
Kalor penguraian adalah kalor yang dihasilkan atau diperlukan untuk menguraikan 1 mol senyawa menjadi unsur – unsurnya
3. Kalor Pembakaran
Kalor yang dihasilkan untuk membakr 1 mol zat 4. Kalor netralisasi
Kalor netralisasi adalah kalor yang dihasilkan atau diperlukan untuk membentuk 1 mol H2O dari reaksi antara asam dan basa.
5. Kalor pelarutan
Kalor pelarutan adalah kalor yang dihasilkan atau diperlukan untuk melarutkan 1 mol zat padat menjadi larutan
b. Perbedaan antara kapasitas kalor dan kalor jenis
Kapasitas kalor adalah jumlah kalor yang diserap oleh benda bermassa tertentu untuk menaikkan suhu sebesar 1 oC satuan kapasitas kalor dalam sistem interantional adalah J/K
Sedangkan, kalor jenis adalah banyaknya kalor yang diserap atau diperlukan oleh 1 gram zat untuk menaikkan suhu sebesar 1 oC.
c. Reaksi yang terbentuk adalah reaksi penetralan. Hal ini karena reaksi penetralan merupakan reaksi yang melibatkan hidrogen dan hidroksida.
HCl bersifat asam kuat dan NaOH bersifat basa kuat. Larutan garam dari asam kuat dan basa kuat umumnya tidak mengubah perbandingan konsentrasi H+ dan OH- dalam air. Oleh karena itu larutannya bersifat netral. Garam NaCl terbentuk dari basa kuat (NaOH) dan asam kuat (HCl) tidak dapat terhidrolisis sehingga larutannya bersifat netral. Anion Cl- merupakan basa konjugasi yang sangat lemah karena berasal dari asam kuat sehingga cenderung tidak dapat menarik proton. Kation Na+ tidak terhidrolisis, sebagaimana dalam air Na+ hannya akan terhidrasi.
Oleh karena densitas muatannya yang rendah, kemampuan kation Na+
mempolarisasi molekul – molekul H2O di sekitarnya untuk melepas proton dapat diabaikan. Akibatnya kation Na+ cenderung tidak mempnegaruhi keasaman larutan
d. Untuk menentukan kalor netralisasi kalorimeter dapat dilihat dari entalpi yang terjadi pada penetralan asam oleh basa atu sebaliknya pada
keadaan standar. Perubahan kalor penetralan HCl – NaOH sepertyi halnya pada percobaan ini, penentuan kalor penetralan HCl dan NaOH dengan cara mengukur suhu HCl dan NaOH setelah suhu antara HCl dan NaOH sama, dimasukkan dalam kalorimeter dan ukur suhu
campurannya, selama beberapa menit dengan selang waktu tertentu.
Pada pencampuran HCl dan NaOH terjadi reaksi eksoterm. Reaksi eksoterm adalah pelepasan kalor dari sistem ke lingkungan sehingga suatu lingkungan bertambah atau mengalami kenaikan, T2 > T1
VIII. LAMPIRAN
DAFTAR PUSTAKA
Altkins, P.W. 1999. Kimia Fisika 4 Jilid I. Erlangga:Jakarta
Chang R. 2004. Kimia Dasar: Konsep-Konsep Inti Edisi 3 Jilid II.
Erlangga: Jakarta
Fadiawati, Noor et al. 2016. Alat Penentuan Kalor Reaksi Pada Tekanan Tetap. Jurnal Pendidikan dan Pembelajaran Kimia.
Jurnal Pendidikan dan Pembelajaran Kimia. Volume 5.
Nomor 1.
Harnanto, Ari dan Ruminten. 2009. Kimia untuk kelas XI. Jakarta:
Pusat Perbukuan Departemen Pendidikan Nasional
Keenan, C. W. 1980. Kimia untuk Universitas. Jakarta: Erlangga.
Noviyanti, Mardiyah dan Hufry. 2020. Rancangan bangun set eksperimen kalorimeter digital dengan pengindera sensor termokopel dan sensor load cell berbasis arduino Uno. Jurnal Pillar of Physics, Volume 13. Halaman 34-41
Sukardjo. 2003. Kimia Fisika .Rineka Cipta: Jakarta
LAPORAN PRAKTIKUM TERMODINAMIKA SEMESTER GENAP 2021/2022
PENGUKURAN EMF
NAMA : Fadhilah Amelia NIM : 2010208002
Dosen : Ravensky Yurianty Pratiwi, S.Pd M,Si
LABORATORIUM IPA
FAKULTAS ILMU TARBIYAH DAN KEGURUAN UNIVERSITAS ISLAM NEGERI RADEN FATAH
2022
PENGKURUAN EMF I. TUJUAN
1. Untuk menemukan EMF sel
2. Untuk menghitung perubahan energi bebas Gibbs dari reaksi sel 3. Untuk menghitung konstanta kesetimbangan
4. Untuk memprediksi spontanitas reaksi sel II. DASAR TEORI
Elektrokimia adalah bagian dari ilmu kimia yang mempelajari hubungan antara reaksi kimia dana aliran listrik merupakan aliran sesuatu yang bermuatan seperti elektron. Reaksi yang berhubungan dengan adanya aliran elektron adalah reaksi yang melibatkan pelepasan dan penerimaan elektron atau yang kita kenal dengan reaksi oksidasi dan reduksi atau rekasi redoks (Mulyani,2003)
Elektrokimia adalah cabang ilmu kimia yang berkenaan dengan interkonvensi energi listrik dan energi kimia. Proses elektrokimia adalah reaksi reaksi (oksidasi – reduksi) dimana dalam reaksi ini energi yang dilepas oleh reaksi spontan diubah menjadi listrik atau dimana energi listrik yang di lepas oleh reaksi non spontan bisa terjadi. Dilepasnya elektron oleh suatu unsur tersebut dalam reduksi, terjadi penurunan biloks karena diperolehnya oleh unsur tersebut (Chang, 2004)
Reaksi elektrokimia melibatkan perpindahan elektron – elektron bebas dari suatu logam kepada komponen di dalam larutan.
Kesetimbangan reaksi elektrokimia penting dalam sel galvani dan sel elektrolisis. Pengukuran daya gerak listrik suatu sel elektrokimia dalam jangkauan suhu terterntu dapat digunakan untuk menentukan nilai – nilai termodinamika reaksi yang berlangsung serta kerfisien aktivitas dari elektrolit yang terlibat (Burhanudin, 2014)
Sel elektrolisis adalah di mana energi listrik yang digunakan untuk berlangsungnya suatu reaksi kimia. Sel ini merupakan kebalikan dari sel galvani emf yang diperlukan untuk berlangsungnya proses ini akan sedikit lebih tinggi daripada emf yang dihasilkan oleh reaksi kimia, dan ini
didapat dari lingkungannya. Reaksi kimia spontan menghendaki ΔG menjadi negative. Apabila emf sel adalah positif, maka ini adalah sel galvani. Kesetimbangan akan terjadi apabila ΔG dan E sama dengan nol.
Reaksi dengsn nilai E yang lebih positif akan terjadi lebih dahulu daripaada reaksi – reaksi dengan emf yang kepositifannya lebih rendah (Dogra,2009)
Harga Electromotive force (EMF) atau daya elektromotif suatu sel elektrokimia dapat diukur dengan kecepatan yang tinggi apabila penentuannya dilakukan dengan cara tertentu. Perbedaan potensial yang diukur antara anode dan katode tergantung pada kuantitas muatan listrik yang mengalir di antara keduanya, dengan demikian tergantung arus listrik yang berasal dari sel. Sejumlah emf sel digunakan untuk mengatasi tahanan listrik intern sel, dan karena arus berasal dari sel maka terjadilah perubahan konsentrasi spesies dalam bagian setengah sel. Perubahan konsentrasi ini menyebabkan potensial elektroda berubah, yang berkaitan dengan menurunnya perbedaan potensial. Sel seperti sel daniell dapat dibuat reversibel dengan cara mengimbangi potensialnya dengan suatu potensial eksternal sehingga tidak ada aliran arus. Saat potensial listrik bener berimbang, sel tersebut bereaksi reversibel dan potensialnya dirujuk sebagai elektrokimia force (EMF). Hal ini bisa dilakukan dengan menggunakan potensiometer, karena EMF meruoakan beda potensial saat sel tersebut bereaksi reversibel dan reaksi reversibel dapat dicapai saat arus yang lewat sama dengan nol, maka arus listrik yang keluar dari sel harus diimbangi oleh arus hasil dari kerja yang mempunya emf yang lebih besar dari emf sel yang akan diukur, jadi kutub harus dipasang berlawanan dengan kutub – kutub listrik dari luar seperti yang terlihat pada gambar.
Pengukuran emf dalam sel galvanic adalah perbedaan potensial listrik antara dua elektrode. Ketika aliran listrik dibuat diantara dua batang logam yang berbeda dan elektron akan mengalir secara spontan sampai kecenderungan elektron bergerak diantara kedua batang tersebut sama.
Sebuah sel elektrokimia yang beroperasi secara spontan disebur dengan sel galvani (sel volta) mengubah energi kimia menjadi energi
listrik yang dapat digunakan untuk melakukan kerja. Elektrolisis adalah peristiwa elektrolit dalam sel elektrolisis oleh arus listrik, arus listrik berasal dari suber arus baterai/aki yang menghasilkan arus searah. Pada anoda terjadi reaksi oksidasi, yang merupakan anion ( ion negatif) ditarik oleh anoda dan jumlah elektronnya berkurang sehingga bilangan oksidasinya bertambah. Pada katoda terjadi reaks reduksi yaitu kation ditarik oleh katoda dan menerima tambahan elektron sehinggan biloksnya berkurang (Oxtoby, 1999)
Sel galvanik terdiri dari kombinasi setengah sel yang berbeda yang dihubungkan oleh jembatan garam. Setiap sel terdiri dari logam yang dicelupkan kedalam elektrolit. Logam dengan potensial reduksi yang lebih tinggi bertindak sebagai katoda dan yang lainnya akan bertindak sebagai anoda. Potensial sel ( EoSel) adalah penjumlahan dari potensial anoda dengan potensial katoda
E°Sel = E°Katoda - E°Anoda
Elektroda merupakan tempat terjadinya rekasi oksidasi-reduksi, pada elektroda anoda terjadi reaksi oksidasi dan katoda terjadi reaksi reduksi.
Ketika sebuah logam bersentuham demgan ion dari larutannya sendiri, maka akan menghasilkan potensial elektrolit. Untuk menentukan interaksi antara elektroda dapat menggunakan metode percobaan langsung yang memberikan hasil yang sangat cermat, yaitu berdasarkan penentuan percobaan potensial antara dua elektroda. Nila dibuat suatu hubungan listrik antara dua daerah yang mempunyai rapatan muatan yang lebih tinggi atau potensial listrik lebih tinggi menuju daerah dengan muatan rapatan potensial listrik lebih rendah. Aliran muatan ini disebut aliran listrik, bila antara dua titik perbedaan potensialnya makin besar, maka makin besar pula alirannya. Perbedaan potensial listrik kecil cukup untuk menghasilkan aliran listrik (Alhidayatuddiniyah, 2001)
Dlam menyetarakan reaksi redoks, kita dapat memecahkan reaksi itu menjadi dua bagian yaitu setengah reaksi oksidasi dan setengah rekasi redukis, pada reaksi reduksi, zat – zat yang direaksikan dicampur dalam
satu wadah sehingga terjadi reaksi yang disetai pelepasan dan penyerapan kalor. Dan sel volta merupakan penaraan bahan kimia dan penghantar listrik yang memberikan aliran elektron lewat rangkaian lur dari suatu zat kimia yang teroksidasi ke zat kimia yang direduksi.
III.ALAT DAN BAHAN Alat :
a. Beaker gelas b. Voltmeter c. Jembatan Garam Bahan
a. Elektrode yang digunakan
Li, K, Ba, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Ti, Co, Ini, Sn, Pb, Cu, Ag, Au, 2H
b. Elektrolit yang digunakan -LiCl, KCl, BaCl2, CaCl2, NaCl, MgSO4 , Al(NO3)3, MnSO4 , ZnSO4, Cr(NO3)3 , FeSO4 , CdSO4 , TiNO3 CoSO4 , NiSO4 , SnSO4, PbNO3, CuSO4, AgNO3 , AuNO3 , HCl
IV.PROSEDUR KERJA
1. Pilihlah simulator pada EMF measurement 2. Atur suhunya.
3. Pilih katoda dari daftar.
4. Pilih anoda dari daftar.
5. Pilih konsentrasi elektrolit.
6. Catat tegangan sel.
7. Hitung energi bebas Gibbs dari tegangan yang diperoleh dari percobaan.
8. Hitung konstanta kesetimbangan 9. Prediksi spontanitas reaksi sel V. HASIL DAN PEMBAHASAN
1. Hasil Suhu = 25°C
Katode yang digunakan = Copper / tembaga (Cu) Konsentrasi elektrolit = 0,01 M
Anoda yang digunakan = Zinc (Zn)
Konsentrasi elektrolit yang digunakan = 0,01 M Sehingga, EMF sell = 1.1 V
E°sel Zn Zn2+ + 2e = -0,76 E°sel Cu2+ + 2e Cu = + 0,34
Zn Zn2+ + 2e 0,76
Cu2+ + 2e Cu 0,34
Zn + Cu2+ Zn2+ 1,1 V Perubahan energi bebas gibs pada reaksi sel, =
ΔG° = -n . F . E°sel
= - (2) x 96.500 x 1.1 V = -212.300 j/mol
Konstanta kesetimbangan dari reaksi sel, K = ln K = n. F . E ° sel
R . T
ln K = 212,300j/mol 8,314j/k mol x298k = 212.300
2477,572 ln K = 85,68 K = 1,623
Spontanitas reaksi sel = reaksi bersifat spontan, karena E°sel > 0, ΔG°
negatif dan K > 1 maka arah reaksi mengarah ke produk dan reaksi 2. Pembahasan
Praktikum ini dilakukan menggunakan media berupa Virtual Lab Amrita dengan judul percobaan pengukuran EMF. Yang bertujuan untuk menentukan EMF sel, menghitung perubahan energi bebas gibbs dari reaksi sel dan memprediksi spontanitas reaksi sel
Untuk memulai praktikum ini, pertama – tama praktikan login terlebih dahulu di Virtual Lab Amrita. Kemudian praktikan memilih Chemical
Sciences , lalu memilih Physical Chemistry Virtual Lab, selanjutnya pilih praktikum yang akan kita lakukan yaitu EMF measurement.
Setelah itu pilih simulator untuk melakukan percobaan. Pada percobaan ini praktikan diharuskan untuk mengatur suhu, memilih katode dan anode yang digunakan pada saat melakukan percobaan, serta mengatur setiap konsentrasi elektrolitnya.
Pada percobaan ini praktikan memakai suhu 25°C, katoda yang digunakan yaitu Cu, anoda yang digunakan yaitu Zn, dan konsentrasi masing – masing elektrolit yang digunakan yaitu 0,01 M , sehingga didapatkan nilai EMF sell sebesar 1,1 V
Zn Zn2+ + 2e 0,76
Cu2+ + 2e Cu 0,34
Zn + Cu2+ Zn2+ 1,1 V
Pada proses percobaan ini CusSO4 mengalami reaksi reduksi karena terjadi pada katoda, yanfg artinya CuSO4 mengalami penurunan bilangan oksidas (Biloks) sedangkan ZnSO4 mengalami reaksi reduksi karena terjadi pada anoda yang artinya ZnSO4 mengalami kenaikan bilangan oksidasi (Biloks)
Beberapa potensial listrik dari suatu reaksi redoks dalam sel volt merupakan total dari potensial elektrode usnur – unsur sesuai dengan reaksinya. Dalam hal ini, hasil perhitungan potensial sel bisa positid atay bisa negatif. Perhatikan pernyataan berikut :
ΔE° sel > 0, ΔG negatif dan K > 1, spontan
Artinya, jika potensial bertanda positif atau ΔE° sel lebih besar dari 0, dan K nya juga lebih besar dari 1 serta energi bebas gibsnya negatif berarti reaksi dapat berlangsung spontan.
ΔE° sel > 0, ΔG negatif dan K < 1, tidak spontan
Jika potensial bertanda negatif atau ΔE° sel lebih kecil dari 0 dan K nya juga lebih kecil dari 1, serta energi bebas gibsnya positif, berarti reaksi tidak berlangsung spontan.
E° sel = 0 , ΔG = 0 dan K =1 tidak ada reaksi yang terjadi
Jika potensialnya sam dengan 0, dan K nya bernilai 1 serta energi bebas gibsnya 0, berarti tidak ada reaksi yang terjadi.
Pada reaksi percobaan ini yaitu reaksi Cu dan Zn, elektroktron akan mengalir dari anoda Zn ke katoda Cu. Hal tersebut akan menimbulkan perbedaan potensial antara kedua elektroda. Ketika tidak ada lagi arus listrik mengalir maka akan terjadi perbedaan potensial maksimum yang dinamakan GGL sel atau E° sel. Langkah selanjutnya, praktikan melakukan perhitungan untuk menentukan energi bebas gibbs, adapun rumus untuk menghitung energi bebas gibs adalah :
ΔG = -n . F . E°
Maka didapatlah energi bebas dari reaksi sel sebesar ΔG = -212.300 j/mol. Setelah itu praktikan melakukan perhitungan kembali untuk menentukan kestimbangan, adapun rumusnya adalah sebagai berikut :
ΔG = -RT . ln K ln K = ΔG
RT Maka didapatlah nilai konstanta =
Percobaan ini menghasilkan data bahwa reaksi dalam percobaan ini terjadi bersifat spontan, hal ini dapat dilihat pada hasil perhitungan disesuaikan denganΔE° sel > 0 , ΔG negatif dan K > 1
VI. KESIMPULAN DAN SARAN
1. Elektrokimia adalah bagian dari ilmu kimia yang mempelajari hubungan antara reaksi kimia dan aliran listrik
2. Pada percobaan ini didapatkan hasil perubahan energi bebas gibs pada reaksi sel, ΔG = -212.300 J/mol
3. Pada percobaan ini didapatkan hasil konstanta kesetimbangan dari reaksi sel, K = 1,623
4. Pada percobaan ini reaksi terjadi secara spontan karena nilai ΔE° sel >
0 , ΔG negatif dan K 1,623.
VII.PERTANYAAN DAN JAWABAN
1. Jelaskan tentang sel elektrokimia dan pembagiannya sebagai sel volta dan sel elektrolisis
2. Jelaskan hubungan antara potensial sel, energi bebas dan kesetimbangan
Jawab : 1. Sel elektrokimia juga disebut sel volta atau sel galvani adalah suatu alat tempat reaksi kimia terjadi dengan produksi suatu perbedaan potensial lirik antara dua elektroda. Jika kedua elektroda dihubungkan terhadap suatu tangkaian luar, dihasilkan aliran arus yang dapat mengakibatkan terjadinya kerja mekanik sehingga sel elektrokimia mengubah energi kimia ke dalam kerja yang berupa energi listrik. Sel elektrolisis dan sel volta merupakan hasil terapan dari sel elektrokimia yang menggunakan media elektroda dan larutan elektrolit. Sampai saat ini, sel elektrokimia masih memeiliki peranan penting di dalam kemajuan teknologi modern mulai industri otomotif maupun rumah tangga. Sel volta merupakan sel elektrokimia yang dapat menghasilkan energi listrik secara spontan dari reaksi kimia yang terjadi di dalam larutan. Contoh sel volta adalah baterai listrik. Sementara itu, sel elektrolisis adalah sel yang mengalami reaksi kimia ketika arus listrik dialirkan ke sel tersebut. Contoh sel elektrolisis adalah penguraian garam menjadi unsur pembentuknya, yaitu natrium dan klorin
2. Hubungan antara potensial sel, energi bebas dan konstanta kesetimbangan secara langsung berhubungan dalam suatu persamaan yaitu :
ΔG° = -R . T ln Keq = -n . F. E°Sel dimana :
R = 8,314 J/mom KT = suhu ( kelvin)
n = mol dari jumlah elektron dalam reaksi redoks F = 96.500 C/mok
ΔG° merupakan perbedaan energi bebas gibss antara produk dan reaktan. Sedangkan E°Sel adalah perbedaan gaya gerak listrik antara 2
setengah sel. Semakin besar E°Sel maka semakin besar pula kekuatan pendorong elektron melalui sistem maka akan semakin spontan pula reaksi yang terjadi. E°Sel diukur dalam satuan volt. Keselurahan tegangan sel diukur dari potensial setengah sel reduksi + potensial setengah sel oksidasi. Jadi hubungan antara potensial sel, energi bebas dan konstanta kesetimbangan secara langsung berhubungan dalm suatu persamaan yang di atas
VIII. LAMPIRAN
DAFTAR PUSTAKA
Alhidayatuddiniyah. 2017. Aplikasi Kalkulator Fisika untuk Sekolah Menengah Pertama (SMP) Berbasis Adobe Flash Pro CS6 Sebagai Pengembangan Media Pembelajaran. Artikel Prosiding SNFA
Chang, Raymond. 2004. Kimia Dasar Jilid 2. Jakarta: Erlangga Dogra, S.K & S. Dogra. 2009. KIMIA FISIK DAN SOAL-SOAL.
Jakarta: UI-Press Milama, Burhanudin. 2014. Panduan praktikum kimia fisika 2. Jakarta : UIN
Press
Mulyani, Sri dan Hendrawan. 2003. Common Textbook KIMIA FISIKA II. Bandung : UPI
Oxtoby, D. W. 1999. Kimia Modern Edisi 4 Jilid 1.Jakarta: Erlangga
LAPORAN PRAKTIKUM TERMODINAMIKA SEMESTER GENAP 2021/2022
VOLUME MOLAR PARSIAL
NAMA : Fadhilah Amelia NIM : 2010208002
Dosen : Ravensky Yurianty Pratiwi, S.Pd M,Si
LABORATORIUM IPA
FAKULTAS ILMU TARBIYAH DAN KEGURUAN UNIVERSITAS ISLAM NEGERI RADEN FATAH
2022
VOLUM MOLAR PARSIAL I. TUJUAN
Menentukan volum molal parsial dari komponen penyusun larutan II. DASAR TEORI
Akuades atau air mempunyai rumus kimia H2O. Air tidak bersifat korosif, iritasi, permeator ataupun sensitif untuk mata, kulit, atau menelan. Akuades juga tidak berbahaya jika terhirup. Akuades tidak memiliki efek karsinogenik dan mutagenic. Bahan ini tidak mudah terbakar ataupun meldak. Akuades merupakan senyawa netral yang memiliki pH 7, tidak berbau dan tidak berwarna serta tidak berasa. Air mempunyai titik didih 100 C dan merupakan senyawa yang stabil (Anonim, 2015)
Natrium klorida, juga dikenal dengan garam dapur atau halit, adalah senyawa kimia dengan rumus kimia NaCl. Senyawa ini adalah garam yang paling mempengaruhi salinitas laut dan cairan eksraseluler pada banyak organisme multiseluler. Massa molar 58,44 g/mol, tidak berwarna/berbentuk kristal putih, densitas 2,16 g/cm3, titik leleh 801 C ( 1074 K) titik didih 1465 C (1738 K), kelarutan dalam air 35,9 g/100mL (25 C). Larutan ini berbahaya pada kontak mata dan kulit. Kontak
langsung dengan mat dapaty ditangani dengan membasuh mata dengan air mengalir dan mata terbula terus menerus dalam waktu 15 menit. Pada kontak kulit dapat segera dibasuh dengan air dingin sekurang – kurangnya 15 menit. Pakain atau sepatu yang terkena harus dikeluarkan dan dibersihkan sebelum digunakan kembali.
Ammonium klorida susunannya terdiri atas butir – butir cair / pada di dalam suatu gas. Ammonium klorida ini dapat digunakan sebagai obat pembunuh serangga dalam pertanian dan perkebunan. Ammonium klorida dapat menyebabkan iritasi pada saluran pernafasan, dan iritasi pada saluran pencernaan sehingga menyebabkan diare. Kontak langsung dengan mata dapat ditangani dengan membasuh mata dengan air mengalir dan mata terbuka terus menerus dalam waktu 15 menit. Pada kontak kulit dapat segera dibasuh dengan air dingin sekurang – kurangnya 15 menit. Pakaian atay sepatu yang terkena harus dikeluarkan dan dibersihkan sebelum digunakan kembali. Terkena kulit segera basuh dengan air selama 15 menit
Campuran merupakan kmpulan dua materi atau lebih yang dapat dipisahkan dengan proses fisika. Campuran memiliki komposisi yang beragam dan perbandingan yang tidak tetap, terbentuk melalui proses fisika, dapat dipisahkan dengan proses fisika ( seperti filtrasi, evaporasi, dan distilasi) setiap komponen pada campuran homogen tidak memiliki batas sehingga tidak dapat dibedakan senyawa penyusunnya. Zat penyusun pada campuran homogen memiliki sifat yang sama dan merata dalam segala hal, seperti kesamaan rasa, massa jenis, warna dan bau.
Campuran homogen disebut juga larutan, yang terdiri dari zat terlarut dan pelarut. Jumlah zat pelarut lebih banyak dari pada zat terlarut.
Apabila suatu volume yang besar dari air murni ditambhkan 1 mol H2O maka volumenya bertambah 18 cm3 dan kita dapat mengatakan bahwa 18cm3 mol-1 adalah volume molar air murni. Walaupun mengatakan demikian, jika kita menambahkan 1 mol H2O ke dalam etanol murni yang volumenya besarr maka pertambahan volume hanya 14 cm3. Alasan dari perbedaan kenaikan volume ini adalah volume yang
ditempati oleh sejumlah tertentu molekul air bergantung pada molekul – molekul yang mengelilinginya. Begitu banyak etanol yang ada sehingga setiap molekil H2O dikelilingi oleh etanol murni, kumpulan molekul – molekul ini menyebabkan etanol hanya menempati ruang sebesar, 14 cm3, kuantitas 14 cm3 mol-1 adalah volume molar parsial air dalam etanol murni, yaitu volume campuran yang dapat dianggap berasal dari suatu komponen
Volume molar parsial komponen suatu campuran berubah-ubah bergantung pada komposisi, karena lingkungan setiap jenis molekul berubah jika komposisinya berubah dari A murni ke B murni. Perubahan lingkungan molecular dan perubahan gaya-gaya yang bekerja antar molekul inilah yang menghasilkan variasi sifat termodinamika campuran jika komposisinya berubah. Volume molar parsial VJ dari suatu zat J pada beberapa komponen umum didefinisikan secara formal sebagai berikut.
C. Vj = P, t, n¢ ……….( 1 )
Dengan nJ sebagai jumlah (jumlah mol) J dan subskrip n’
menunjukkan bahwa jumlah zat lain tetap. Volume molar parsial adalah kemiringan grafik volume total, ketika jumlah J berubah, sedangkan tekanan, temperature, dan jumlah komponen lain tetap. Nilainya bergantung pada komposisi, seperti yang kita lihat untuk air dan etanol.
Definisi ini menunjukkan bahwa ketika komposisi campuran berubah sebesar penambahan dnA zat A dan dnB zat B, maka volume total campuran berubah sebesar
D. dV = p,T, nB dnA p,T, nA
dnB = VA dnA + VB dnB ……..(2)
(Atkins, 1994)
Faktor – Faktor yang mempengaruhi perubahan volume molar parsial adalah adanya perbedaan antara gaya intermolekular pada larutan dan pada komponen murni penyusun larutan tersebut, dan adanya perbedaan antara bentuk dan ukuran molekul suatu larutan dan pada komponen murni penyusun larutan tersebut. Ada tiga sifat termodinamik
molal parsial utama, yakni: (i) volume molal parsial dari komponen- komponen dalam larutan (juga disebut sebagai panas differensial larutan), (ii) entalpi molal parsial, dan (iii) energi bebas molal parsial (potensial kimia). Sifat-sifat ini dapat ditentukan dengan bantuan (i) metode grafik, (ii) menggunakan hubungan analitik yang menunjukkan V dan ni, dan (iii) menggunakan suatu fungsi yang disebut besaran molal nyata (Rao dan Fasad, 2003)
III. ALAT DAN BAHAN 1. Alat
a. Piknometer
b. Labu takar 100 mL c. Erlenmeyer 250 mL
d. Gelas Piala 200 mL dan 100 mL e. Pipet Ukur 100 mL
f. Pengaduk Kaca 2. Bahan
a. NaCl b. NH4Cl c. Aquades
IV. PROSEDUR KERJA 1. NaCl
a. Mengencerkan NaCl 3 M dengan pelarut air pada labu ukur 50 mL dengan variasi konsentrasi 1,5 M ; 0,750 M ; 0,500 M ; 0,375 M
b. Menimbang piknometer kosong
c. Menimbang piknometer yang diisi penuh dengan aquades, dicatat massa dan suhunya
d. Menimbang piknometer yang diisi penuh dengan NaCl berbagai konsentrasi dimulai dari konsentrasi terendah, dicatat massanya
e. Mencatat temperatur didalam piknometer setiap penimbangan f. Melakukan duplo pengukuran
2. NH4Cl
a. Mengencerkan NH4Cl 3 M dengan pelarut air pada labu ukur 100 mL denganvariasi konsentrasi 0,5 M ; 0,25 M ; 0,16 M ; 0,125 M.
b. Menimbang piknometer kosong
c. Menimbang piknometer yang diisi penuh dengan aquades, dicatat massa dan suhunya
d. Menimbang piknometer yang diisi penuh dengan NaCl berbagai konsentrasi dimulai dari konsentrasi terendah, dicatat massanya
e. Mencatat temperatur didalam piknometer setiap penimbangan
f. Melakukan duplo
V. HASIL DAN PEMBAHASAN 1. Hasil
1. NaCl
a. Pengenceran 1,5 M NaCl M1 . V1 = M2 . V2
3 . V1 = 1, 5 . 150 V1 = 225
3 V1 = 75
b. Pengenceran 0,750 M NaCl M1 . V1 = M2 . V2
3 . V1 = 0,750. 150 V1 = 112,5
3 V1 = 37,5
c. Pengenceran 0,500 M NaCl M1 . V1 = M2 . V2
3 . V1 = 0,500 . 150 V1 = 75
3 V1 = 25
d. Pengencean 0,375 M NaCl M1 . V1 = M2 . V2
3 . V1 = 0, 375 . 150 V1 = 56,25
3 V1 = 18,75
e. Berat Jenis larutan 1,5M d = d0(W−We)
(W0−We)
d = 0,99(81,395−22,34) (77,84−22,34) d = 1,0528
f. Berat Jenis larutan 0,75 M d = d0
(
W−We)
(
W0−We)
d = 0,99(79,76−22,34) (77,84−22,34) d = 1,0242
g. Berat jenis larutan 0,5 M d = d0
(
W−We)
(
W0−We)
d = 0,99(78,845−22,34) (77,84−22,34) d = 1,0079
h. Berat jenis larutan 0,375 M d = d0
(
W−We)
(
W0−We)
d = 0,99(78,715−22,34) (77,84−22,34) d = 1,0056
i. Molalitas larutan 1,5 M m =
1 d
M− M2 1000 m =
1 1,0582
1,5 −58,5 1000 m = 1,5544
j. Molalitas larutan 0,75 M m =
1 d
M− M2 1000 m =
1 1,0242
0,75 −58,5 1000 m = 0,7650
k. Molalitas larutan 0,5 M m =
1 d
M− M2 1000 m =
1 1,0079
0,5 −58,5 1000 m = 0,6989
l. Molalitas larutan 0,375 M m =
1 d
M− M2 1000 m =
1 1,0056
0,375 − 58,5 1000
m = 0,3812
m. Volume molal semu zat terlarut 1,5 M
Ø = M2−
(
M2−1000m) (
WW0−W−W0e)
d
Ø = 58,5−
(
58,5−1,55441000)(
81,39577,84−22,34−77,84)
1,0528 Ø = 91,1183
n. Volume molal semu zat terlarut 0,75 M Ø = M2−
(
M2−1000m) (
WW0−W−W0e)
d
Ø = 58,5−
(
58,5−0,76501000)(
79,7677,84−77,84−22,34)
1,0242
Ø = 99,1795
o. Volume molal semu zat terlarut 0,5 M Ø = M2−
(
M2−1000m) (
WW0−W−W0e)
d
Ø = 58,5−
(
58,5−0,69891000)(
78,845−77,84 77,84−22,34)
1,0079 Ø = 82,6856
p. Volume Molal semu zat terlarut 0,375 Ø = M2−
(
M2−1000m) (
WW0−W−W0e)
d
Ø = 58,5−
(
58,5−0,38121000)(
78,715−77,84 77,84−22,34)
1,0056 Ø = 98,2171
q. Massa piknometer kosong = 22,34 gr
r. Massa piknometer yang diisi penuh aquades = 77, 84 gr s. Suhu = 29 ( diisi dengan aquades)
t. Tabel Pengamatan
Konsentrasi Massa rata rata
d ( g/Ml)
m (molal)
Ø (mL/mol)
V1
mL/mol
V2
mL/mol
0,375 M 78,715 1,0056 0,3812 98,2171 18,75 150
0, 500 M 78,845 1,0079 0,6989 82,6856 25 150
0, 750 M 79,76 1,0242 0,7650 99,1795 37,5 150
1,500 M 81,395 1,0528 1,5544 91,1183 75 150
2. NH4Cl
a. Pengenceran 0,5 M NH4Cl M1 . V1 = M2 . V2
3 . V1 = 0,5 . 250 V1 = 125
3 V1 = 41,6
b. Pengenceran 0, 25 M NH4Cl M1 . V1 = M2 . V2
3 . V1 = 0,25 . 250 V1 = 62,5
3 V1 = 20,83
c. Pengenceran 0,16 M NH4Cl M1 . V1 = M2 . V2
3 . V1 = 0,16 . 250 V1 = 40
3 V1 = 13,33
d. Pengenceran 0,125 M NH4Cl M1 . V1 = M2 . V2
3 . V1 = 0,125 . 250 V1 = 31,25
3
V1 = 10,41
e. Berat Jenis larutan 0,5 M d = d0(W−We)
(W0−We)
d = 0,99(129,72915−31,59) (129,5807−31,59) d = 0,99
f. Berat Jenis larutan 0,25 M d = d0(W−We)
(W0−We)
d = 0,99(130,282−31,59) (129,5807−31,59) d = 1,01
g. Berat Jenis larutan 0,16M d = d0(W−We)
(W0−We)
d = 0,99(130, 44715−31,59) (129,5807−31,59) d = 1,012
h. Berat Jenis larutan 0,125 M d = d0(W−We)
(W0−We)
d = 0,99(131,10175−31,59) (129,5807−31,59) d = 1,00
i. Molalitas larutan 0,5 M m =
1 d
M− M2 1000 m =
1 0,99
0,5 −53,5 1000 m = 0,52
j. Molalitas larutan 0,25 M
m =
1 d
M− M2 1000 m =
1 1,01
0,25−53,5 1000 m = 0,25
k. Molalitas larutan 0,160 M m =
1 d
M− M2 1000 m =
1 1,012
0,16 −53,5 1000 m = 0,16
l. Molalitas larutan 0,125 m =
1 d
M− M2 1000 m =
1 1,00
0,125−53,5 1000 m = 0,126
m. Volume molal semu zat terlarut 0,5 M
Ø = M2−
(
M2−1000m) (
WW0−W−W0e)
d
Ø = 53,5−
(
53,5−10000,52)(
129,72915−129,5807 129,5807−31,59)
0,99 Ø = 56,9896
n. Volume molal semu zat terlarut 0,25 M
Ø = M2−
(
M2−1000m) (
WW0−W−W0e)
d
Ø = 53,5−
(
53,5−10000,25)(
130,282−129,5807 129,5807−31,59)
1,01 Ø = 80,713
o. Volume molal semu zat terlarut 0,16 M
Ø = M2−
(
M2−1000m) (
WW0−W−W0e)
d
Ø = 53,5−
(
53,5−10000,16)(
130,44715−129,5807 129,5807−31,59)
1,012 Ø = 106,7482
p. Volume molal nsemu zat terlarut 0,125
Ø = M2−
(
M<