SINTESIS DAN KARAKTERISASI MEMBRAN SELULOSA ASETAT DENGAN AGEN PEMBENTUK PORI NONILFENOL ETOKSILAT
TERMODIFIKASI SILIKA
(Skripsi)
Oleh
Ramy Zahra Mahdiyah 1717011065
JURUSAN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
2022
ABSTRAK
SINTESIS DAN KARAKTERISASI MEMBRAN SELULOSA ASETAT DENGAN AGEN PEMBENTUK PORI NONILFENOL ETOKSILAT
TERMODIFIKASI SILIKA
Oleh
Ramy Zahra Mahdiyah
Selulosa merupakan suatu polimer alam yang terdapat dalam tumbuhan, salah satunya dalam tumbuhan nanas. Selulosa banyak dimanfaatkan sebagai membran selulosa asetat karena bahan baku pembuatannya mudah didapat, biaya produksi rendah dan ramah lingkungan. Selulosa diperoleh dengan mengisolasi limbah nanas yang berasal dari PT Great Giant Pineapple dengan NaOH 10%, diperoleh kadar selulosa sebesar 59,8%, dan kadar lignin sebesar 6,9%. Sintesis selulosa asetat menggunakan anhidrida asetat sebagai pereaksi dengan katalis asam sulfat pekat, diperoleh selulosa monoasetat dengan kadar asetil sebesar 20,23% dan derajat subtitusi sebesar 0,95. Perbandingan FT–IR selulosa asetat standar dengan selulosa asetat hasil sintesis pada puncak bilangan gelombang 3444 cm-1 (gugus OH) dan puncak spektrum ciri khas dari selulosa asetat: 1729 cm-1 (gugus C=O), 1371 cm-1 (gugus C-H pada CH3) dan 1222 cm-1 (gugus C-O) yang menunjukkan bahwa subtitusi gugus asetil pada selulosa yang kurang baik, sehingga digunakan selulosa asetat standar pada pembuatan membran SA/NPE/Si. Membran SA/NPE/Si dengan variasi kadar Si sebesar 0% (Octaviani, 2011), 5%, 10%, dan 15% masing-masing memiliki diameter rata – rata pori sebesar 0,708 µm; 0,370 µm; 1,065 µm dan 0,508 µm. Hasil EDX menunjukkan kadar Si membran SA/NPE/Si 5%, 10%, dan 15% adalah 1,18 (%wt), 0,89 (%wt) dan 0 (%wt).
Berdasarkan hasil SEM tersebut, membran SA/NPE/Si 10% memiliki pori yang lebih besar, dan silika yang lebih merata sehingga membran SA/NPE/Si 10%
lebih optimal dalam mengurangi fouling.
Kata Kunci : Membran, Selulosa asetat, NPE, Silika, Pori – pori.
ABSTRACT
SYNTHESIS AND CHARACTERIZATION OF CELLULOSE ACETATE MEMBRANES WITH PORE-FORMING AGENT NONYLPHENOL
ETHOXYLATE MODIFIED SILICA
By
Ramy Zahra Mahdiyah
Cellulose is a natural polymer found in plants, one of which is in pineapple plants.
Cellulose is widely used as cellulose acetate membrane because the raw material for making it is easy to obtain, low production costs and environmentally friendly.
Cellulose was obtained by isolating pineapple waste from PT Great Giant Pineapple, with 10% NaOH, cellulose content was 59.8%, and lignin content was 6.9%. The synthesis of cellulose acetate using acetic anhydride as a reagent with concentrated sulfuric acid catalyst, obtained cellulose monoacetate with an acetyl content of 20.23% and a substitution degree of 0.95. FT–IR comparison of standard cellulose acetate with synthesized cellulose acetate at the peak of the wave number 3444 cm-1 (OH group) and the characteristic peak spectrum of cellulose acetate: 1729 (C=O group), 1371 cm-1 (C-H group on CH3) and 1222 cm-1 (C-O group) indicating that the substitution of acetyl groups in cellulose is not good, so standard cellulose acetate is used in the manufacture of SA/NPE/Si membranes. SA/NPE/Si membranes with variations in Si content of 0%
(Octaviani, 2011), 5%, 10%, and 15% each have an average pore diameter of 0.708 µm; 0.370 µm; 1.065 µm and 0.508 µm. The results EDX showed the levels of Si membrane SA/NPE/Si 5%, 10%, and 15% were 1.18 (%wt), 0.89 (%wt) and 0 (%wt). Based on the SEM results, the 10% SA/NPE/Si membrane has larger pores and more even silica, so that the 10% SA/NPE/Si membrane is more optimal in reducing fouling.
Keywords : Membrane, Cellulose acetate, NPE, Silica, Pores.
SINTESIS DAN KARAKTERISASI MEMBRAN SELULOSA ASETAT DENGAN AGEN PEMBENTUK PORI NONILFENOL ETOKSILAT
TERMODIFIKASI SILIKA
Oleh
Ramy Zahra Mahdiyah
Skripsi
Sebagai Salah Satu Syarat untuk Mencapai Gelar SARJANA SAINS.
Pada Jurusan Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung
JURUSAN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
2022
Judul Penelitian : SINTESIS DAN KARAKTERISASI MEMBRAN SELULOSA ASETAT DENGAN AGEN
PEMBENTUK PORI NONILFENOL ETOKSILAT TERMODIFIKASI SILIKA
Nama Mahasiswa : Ramy Zahra Mahdiyah Nomor Pokok Mahasiswa : 1717011065
Jurusan : Kimia
Fakultas : Matematika dan Ilmu Pengetahuan Alam
MENYETUJUI 1. Komisi Pembimbing
Dr. Eng. Suripto Dwi Yuwono, S.Si., M.T.
NIP. 197407052000031001
Dr. Oman Zuas, S.Si., M.Sc.
NIP. 197302111999031004
2. Ketua Jurusan Kimia FMIPA Universitas Lampung
Mulyono, Ph.D.
NIP. 197406112000031002
MENGESAHKAN
1. Tim Penguji
Ketua : Dr. Eng. Suripto Dwi Yuwono, M.T. ...
Sekretaris : Dr. Oman Zuas, S.Si., M.Sc. ...
Anggota : Dr. Sonny Widiarto, M.Sc. ...
2. Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Dr. Eng. Suripto Dwi Yuwono, S.Si., M.T.
NIP. 197407052000031001
Tanggal Lulus Ujian Skripsi : 5 Oktober 2022
SURAT PERNYATAAN KEASLIAN SKRIPSI
Yang bertanda tangan dibawah ini : Nama : Ramy Zahra Mahdiyah NPM : 1717011065
Jurusan : Kimia
Fakultas : Matematika dan Ilmu Pengetahuan Alam
Dengan ini menyatakan bahwa skripsi saya yang berjudul “Sintesis dan Karakterisasi Membran Selulosa Asetat dengan Agen Pembentuk Pori Nonilfenol Etoksilat Termodifikasi Silika” adalah benar karya dan hasil penelitiaan saya sendiri, dan tidak terdapat karya atau pendapat yang ditulis atau diterbitkan oleh orang lain, kecuali yang secara tertulis diacu dalam naskah ini sebagaimana disebutkan dalam daftar pustaka.
Apabila ada pernyataan yang tidak benar, maka saya bersedia dikenai sanksi sesuai dengan hukum yang berlaku.
Bandar Lampung, 1 November 2022 Yang Menyatakan
Ramy Zahra Mahdiyah NPM. 1717011065
RIWAYAT HIDUP
Penulis Bernama Ramy Zahra Mahdiyah, lahir di Pulung Kencana pada tahun 1999, yang merupakan anak ketiga dari empat bersaudara dari pasangan Bapak Suharno (Alm) dan Ibu Nurhartati.
Jenjang pendidikan formal dimulai dari SD N 2 Pulung Kencana, diselesaikan pada tahun 2011, kemudian melanjutkan sekolah di SMP N 4 Tulang Bawang Tengah dari tahun 2011 – 2014 dan SMA N 1 Tumijajar dari tahun 2014 – 2017.
Pada tahun 2017, penulis terdaftar sebagai mahasiswa di Jurusan Kimia, Fakultas MIPA, Universitas Lampung melalui jalur Seleksi Bersama Masuk Perguruan Tinggi Negeri (SBMPTN).
Sejak menumpuh pendidikan di jenjang SD – SMA, penulis aktif dalam ekstrakulikuler Pramuka. Selama menjadi mahasiswa, penulis aktif dalam Himpunan Mahasiswa Kimia (Himaki) jurusan Kimia FMIPA Unila dari tahun 2018 – 2019 sebagai anggota biro penerbitan Himaki FMIPA Unila dan Koperasi Mahasiswa Universitas Lampung (Kopma Unila) dari tahun 2018 – 2020 sebagai anggota dan pengurus divisi minat dan bakat pada kepungurusan tahun 2020.
KATA INSPIRASI
“Barang siapa yang menempuh jalan menuntut ilmu, maka Allah mudahkan baginya jalan menuju surga”
(HR. Muslim)
“...Boleh jadi kamu tidak menyenangi sesuatu, padahal itu baik bagimu, dan boleh jadi kamu menyukai sesuatu, padahal itu tidak baik bagimu. Allah mengetahui, sedang kamu tidak mengetahui.”
(Q.S. Al – Baqarah (2) : 216)
“Sesungguhnya, Allah ta’ala malu bila seorang hamba membentangkan kedua tangannya untuk memohon kebaikan kepada-Nya, lalu Ia mengembalikan kedua tangan hamba itu dalam keadaan hampa”
(H.R. Ahmad , dishaihkan Asy-Syeikh Al-Albani dalam Shahihul Jami’ no. 1757)
“...Dan aku menyerahkan urusanku kepada Allah. Sungguh, Allah Maha Melihat akan hamba-hamba-Nya”
(Q.S. Ghafir (40) : 44)
PERSEMBAHAN
Puji syukur kehadirat Allah SWT atas segala limpahan rahmat dan hidayah-Nya. Dengan penuh rasa syukur dan dengan segala kerendahan hati penulis persembahkan skripsi ini kepada:
Orangtua dan Saudara Tercinta
Terimakasih atas segala cinta, kasih sayang, perhatian, dan do’a yang tak pernah putus mengiringi setiap langkah perjalanan panjang ini.
Dosen Jurusan Kimia
Atas segala ilmu dan pelajaran berharga yang diberikan selama menempuh pendidikan di kampus
Sahabat-sahabat Terbaik
Selalu menjadi pendengar terbaik dan pengingat agar selalu dalam kebaikan, do’a dan semangatnya untuk terus berjuang dalam kebaikan, fokus dengan tujuan dan menjadikan hari –
hari lebih ringan.
Almamater Tercinta, Universitas Lampung
SANWACANA
Puji syukur kehadirat Allah SWT atas Limpahan rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan penelitian dan penulisan skripsi yang berjudul “Sintesis dan Karakterisasi Membran Selulosa Asetat dengan Agen Pembentuk Pori Nonilfenol Etoksilat Termodifikasi Silika” sebagai salah satu syarat untuk memperoleh gelar sarjana sains di Universitas Lampung.
Penulis menyadari bahwa bisa berada di tahap ini tidak lepas dari bantuan,
bimbingan, kritik, dan saran dari berbagai pihak, oleh karena itu pada kesempatan ini penulis mengucapkan terima kasih kepada :
1. Bapak Dr. Eng. Suripto Dwi Yuwono, S.Si., M.T. selaku pembimbing 1 atas segala motivasi, waktu, materi, bimbingan, serta kesabaran tanpa batas selama membersamai penulis menyelesaikan skripsi.
2. Bapak Dr. Oman Zuas, S.Si., M.Sc. selaku pembimbing 2 atas segala motivasi, ilmu, bimbingan, kritik,dan saran sehingga skripsi ini dapat terselesaikan.
3. Bapak Dr. Sonny Widiarto, M.Sc. selaku penguji atas kritik dan saran penelitian dan penulisan dalam penyusunan skripsi.
4. Ibu Dr. Ilim, M.S. selaku pembimbing akademik atas kesediaannya
membimbing dan memberikan motivasi dan sarannya dalam segala hal terkait dengan perkuliahan.
5. Bapak Mulyono, Ph.D. selaku ketua Jurusan Kimia FMIPA Universitas Lampung.
6. Ibu Dr. Mita Rilyanti, S.Si., M.Si. selaku sekretaris Jurusan Kimia FMIPA Unila.
7. Bapak Ibu Dosen Jurusan Kimia FMIPA Unila atas segala ilmu , nasihat, waktu yang diberikan selama perkuliahan.
8. Bapak Dr. Eng. Suripto Dwi Yuwono, M.T. selaku Dekan FMIPA Universitas Lampung
9. Ibu tersayang, Kakak laki – laki dan perempuan, adik perempuan dan keluarga besar yang tiada hentinya memberikan do’a, semangat, dan dukungan materi sehingga penulis bisa menyelesaikan skripsi ini.
10. Ustadzah RQM atas segala bimbingan dan motivasi yang diberikan selama membersamai di Rumah Qur’an.
11. Teman-teman Aura Dhayang F, S.Si, Azizah Malik, Nia Kurniasih, Rana Aprilia R, Meriezka Ismaini, Agustina Ayu P, Rosalinda Y, S.Si., Rosyie Liana B, S.I.Kom., teman – teman RI – CND ’17, teman – teman RQM 2, dan Teman – teman Kopma ’17 atas segala kesempatan, ilmu, pengalaman berharga, motivasi dan bantuannya tanpa pamrih serta do’a – doa’a yang tak pernah luput.
12. Teman “seperbimbingan” Kadek Suprajaya, S.Si dan Jeremia Christian atas bantuannya dalam menyelesaikan penelitian.
13. Keluarga Kimia 2017 atas segala bantuan selama menjadi mahasiswa di jurusan Kimia.
Terimakasih atas segala bantuan dan dukungan seluruh pihak yang tidak dapat disebutkan satu persatu. Penulis menyadari bahwa skripsi ini masih jauh dari kata sempurna, terlepas dari itu semua semoga masih ada manfaat yang bisa diambil oleh pembaca.
Bandar Lampung, 01 Novemeber 2022 Penulis,
Ramy Zahra Mahdiyah
DAFTAR ISI
Halaman
DAFTAR TABEL ... vi
DAFTAR GAMBAR ... vii
I. PENDAHULUAN ... 1
1.1. Latar Belakang ... 1
1.2. Tujuan ... 4
1.3. Manfaat ... 4
II. TINJAUAN PUSTAKA ... 5
2.1. Nanas ... 5
2.2. Limbah Nanas ... 5
2.3. Lignoselulosa ... 7
2.3.1. Selulosa ... 7
2.3.2. Hemiselulosa ... 9
2.3.3. Lignin ... 9
2.4. Isolasi Selulosa ... 11
2.5. Bahan Baku Pembuatan Membran ... 12
2.5.1. Selulosa asetat ... 12
2.5.2. Nonilfenol Etoksilat (NPE) ... 14
2.5.3. Silika ... 15
2.5.4. Aseton ... 16
2.6. Membran ... 18
2.6.1. Klasifikasi Membran... 18
2.6.2. Metode pembuatan Membran ... 19
2.7. Karakterisasi Membran ... 21
2.7.1. Fourier Transform Infra Red (FT – IR) ... 21
2.7.2. Scnning Elctrone microscape (SEM) ... 22
III. METODE PENELITIAN ... 24
3.1. Waktu dan Tempat ... 24
3.2. Alat dan Bahan ... 24
3.3. Prosedur ... 25
3.3.1. Isolasi α – Selulosa ... 25
3.3.2. Sintesis Selulosa Asetat ... 27
3.3.3. Analisis Kadar Selulosa Asetat ... 27
3.3.4. Pembuatan Membran Selulosa Asetat ... 29
3.3.5. Karakterisasi dan Uji Membran ... 30
IV. HASIL DAN PEMBAHASAN ... 31
4.1. Isolasi Selulosa ... 31
4.2. Sintesis Selulosa Asetat ... 34
4.3. Sintesis Membran SA/NPE/Si ... 39
4.4 Hasil Analisis FT – IR Membran SA/NPE/Si ... 40
4.5 Hasil Analisis SEM Membran SA/NPE/Si ... 42
V. KESIMPULAN DAN SARAN ... 45
5.1. Kesimpulan ... 45
5.2. Saran ... 45
DAFTAR PUSTAKA ... 47
LAMPIRAN ... 54
DAFTAR TABEL
Tabel Halaman
1. Perbedaan komponen limbah daun nanas dan mahkota nanas ... 6
2. Kandungan limbah mahkota nanas pada konsentrasi NaOH 15% ... 6
3. Kandungan lignoselulosa serat daun nanas ... 7
4. Parameter kelarutan beberapa pelarut organik ... 17
5. Perbedaan sifat beberapa pelarut organik ... 17
6. Kadar selulosa dalam berbagai variasi NaOH ... 32
7. Puncak FT - IR Selulosa Standar dan Seluosa Isolasi ... 34
8. Puncak FT - IR SA hasil sintesis, SA Isolasi dan Selulosa Isolasi ... 36
9. Kelarutan selulosa berdasarkan derajat subtitusi dan kadar asetil ... 38
10. Tabel Perbandingan Puncak FT – IR Membran SA/NPE/Si ... 62
11. Membran SA/NPE/Si 5% ... 63
12. Membran SA/NPE/Si 10% ... 63
13. Membran SA/NPE/Si 15% ... 63
14. Analisis kadar selulosa ... 68
DAFTAR GAMBAR
Gambar Halaman
1. Struktur selulosa ... 8
2. Struktur hemiselulosa ... 9
3. Model lignin ... 10
4. Satuan penyusun lignin ... 10
5. Skema penguraian lignoselulosa ... 11
6. Reaksi degradasi lignoselulosa ... 11
7. Selulosa asetat ... 13
8. Struktur molekul NPE ... 15
9. Skema ikatan yang terjadi pada silika ... 16
10. Skema teknik inversi fasa... 20
11. Spektrum FT - IR (a) senyawa NPE (b) SA-NPE ... 22
12. Hasil SEM Membran SA ... 23
13. Penampakan (a) Silika dan (b) Agregat Silika, Pada Membran SA/PEG/Si ... 23
14. Perbedaan proses pretreatment isolasi dengan variasi NaOH (a) 2% (sampel A), (b) 6% (Sampel B), dan (c) 10% (Sampel C). ... 31
15. Hasil isolasi selulosa dengan konsentrasi NaOH 10%. ... 33
16. Spektrum FT – IR (a) selulosa isolasi, (b) selulosa standar. ... 33
17. Reaksi asetilasi selulosa ... 35
18. Perbandingan SA (a) hasil sintesis, (b) standar, ... 35
19. Perbandingan spektrum FT - IR (a) SA hasil sintesis, (b) SA standar, dan (c)
Selulosa hasil isolasi. ... 35
20. Perbedaan kelarutan (a) SA standar dalam etanol (b) SA hasil sintesis dalam etanol (c) SA standar dalam akuades (d) SA hasil sintesis dalam akuades ... 38
21. Perbedaan kelarutan dalam aseton (a) SA standar (b) SA hasil sintesis ... 38
22. Permukaan bagian atas Membran SA/NPE/Si dengan variasi Si (a) 0%, (b) 5%, (c) 10% dan (d) 15% ... 39
23. Permukaan bagian bawah Membran SA/NPE/Si dengan variasi Si (a) 0%, (b) 5%, (c) 10% dan (d) 15% ... 39
24. Perbedaan Spektrum FT - IR Membran SA/NPE/Si, dengan variasi kadar Si (a) Si 0%, (b) Si 5%, (c) Si 10%, (d) Si 15%. ... 40
25. Hasil SEM membran SA/NPE/Si 5%, a) perbesaran 2000x dan b) perbesaran 5000x ... 42
26. Hasil SEM membran SA/NPE/Si 10%, a) perbesaran 2000x dan b) perbesaran 5000x ... 42
27. Hasil SEM Membran SA/NPE/Si 15%, a) perbesaran 2000x dan b) perbesaran 5000x ... 42
28. EDX Membran SA/NPE/Si (a) 5%, (b) 10, dan (c) 15%. ... 43
29. Diagram Alir Sintesis Membran SA/NPE/Si ... 56
30. Diagram Alir Analisis Kadar selulosa... 58
31. Diagram Alir Analisis Kadar Selulosa Asetat ... 59
32. Histogram Diameter Pori Membran SA/NPE/Si 0% ... 59
33. Histogram Pori Membran SA/NPE/Si 5%, 10% dan 15% ... 60
34. Sketsa Struktur Membran SA/NPE/Si ... 61
I. PENDAHULUAN
1.1. Latar Belakang
Nanas merupakan tanaman yang hidup di dataran rendah hingga dataran tinggi dan tersebar luas di seluruh Indonesia, terutama di daerah Lampung. Berdasarkan Badan Pusat Statistika (2021), Lampung menjadi daerah dengan pusat produksi nanas tertinggi di Indonesia dengan persentase sebesar 24,45 %, lebih tinggi dibandingkan Sumatra Selatan 16,50%, Riau 12,30%, Jawa Tengah 11,95%, Jawa Barat 9,57%, Jawa Timur 6,89% dan provinsi lainnya sebesar 18,34%. Tingginya produksi nanas tersebut tidak lepas dari pengaruh pabrik nanas terbesar di
Indonesia yang berada di wilayah Lampung, yaitu PT Great Giant Pineapple (Suwandi, 2016). Badan Pusat Statistik (2021) mencatat total produksi nanas di Lampung sebesar 705883 ton pertahun. Besarnya produksi buah nanas tersebut, akan meningkatkan jumlah limbah nanas di Lampung. Pada produksi pengalengan buah nanas, limbah nanas dapat mencapai 45 - 65 % dari total produksi buah nanas (Difonzo et al., 2018). Berdasarkan hal tersebut, apabila jumlah limbah nanas mencapai 45% dari total produksi nanas, maka total limbah nanas di Lampung dapat mencapai ± 870 ton perharinya, yang terdiri dari 56% kulit, 17%
mahkota, 15% pucuk, 7% hati, dan 5% ampas nanas (Oktaviani, 2016).
Berdasarkan data yang pernah dilaporkan sebelumnya, diketahui bahwa limbah nanas merupakan salah satu biomassa yang mengandung kadar selulosa yang sangat tinggi. Limbah mahkota nanas dapat menghasilkan 95% kadar selulosa dari total rendemen (Susana, 2011), sedangkan limbah serat nanas dapat menghasilkan kadar selulosa sekitar 59,12% dari total rendemen (Mayangsari dkk., 2019).
Selulosa merupakan polimer rantai lurus yang tersusun dari unit – unit D-glukosa yang berjumlah ratusan hingga ribuan dan dihubungkan dengan ikatan glikosidik
(ikatan glikosida β-(1,4)). Selulosa merupakan komponen dasar dinding sel.
Selulosa selalu berasosiasi dengan poli sakarida lain seperti lignin, pektin, hemiselulosa dan xilan yang menyebabkan molekul – molekul selulosa
membentuk rantai yang saling bersisian, kokoh dan lurus sehingga sulit diuraikan (Fessenden dan Fessenden, 1999 ; Monariqsa dkk., 2012). Berdasarkan sifatnya tersebut, selulosa banyak dimanfaatkan sebagai bioplastik (Tamiogy dkk., 2018);
Carboxymethyl Cellulose ( banyak digunakan dalam industri tekstil, kertas, detergen, cat dan keramik) (Wijayani, 2005) dan sebagai membran selulosa asetat (Ernawati dkk., 2013).
Membran selulosa asetat merupakan membran filtrasi yang banyak dikembangkan saat ini karena memiliki keunggulan, antara lain memiliki karakteristik fisik dan optik yang baik, daya tarik yang tinggi karena sifatnya yang biodegradable sehingga ramah lingkungan, pemisahan (rejeksi) garam yang tinggi, mudah untuk diproduksi (Shofa dkk., 2012), dalam aplikasinya, kemampuan pemisahan suatu membran sangat dipengaruhi oleh kualitasnya. Beberapa parameter kualitas membran tersebut antara lain mempunyai permeabilitas dan selektifitas yang tinggi, stabil pada suhu yang tinggi, kestabilan mekanik dan tahan terhadap zat kimia yang akan dipisahkan (Mulder, 1996). Membran selulosa asetat memiliki selektivitas yang tinggi karena tingkat rejeksi garam yang tinggi, namun hal tersebut dapat mengakibatkan fouling, karena penumpukkan zat-zat kontaminan dalam air baku misalnya kerak, pengendapan koloid, oksida logam, organik dan lainnya, maka dari itu penambahan suatu porogen dalam membran selulosa asetat diperlukan untuk mengatasi fouling yang terjadi.
Penggunaan surfaktan sebagai agen pembentuk pori (porogen) membran selulosa asetat telah banyak dilakukan. Buana dkk (2014), menggunakan Sodium Dodesil Sulfat (SDS) sebagai porogen pada membran selulosa asetat, menghasilkan densitas dan derajat swelling membran yang semakin kecil seiring dengan bertambahnya SDS, hal tersebut menunjukkan bahwa semakin besar pori-pori yang terbentuk. Lestari (2009) melaporkan, penambahan SDS pada suhu 60⁰C menghasilkan pori sebesar 250 nm, sedangkan pada suhu 40⁰C menghasilkan pori
sebesar 500 nm. Selain surfaktan anionik (SDS), surfaktan non ionik juga dapat digunakan sebagai porogen seperti penelitian yang dilakukan oleh Pranawati (2011) dan Ikrammurti (2011) yang menggunakan surfaktan (pluronik F127) pada membran selulosa asetat yang mengahasilkan pori sebesar ± 20 µm. Selain itu, Nonylphenol Ethoxylate (NPE) termasuk kedalam surfaktan non ionik, pada penelitian yang dilaporkan oleh Octaviani (2011). Membran selulosa asetat dengan penambahan NPE sebagai porogen, menghasilkan pori pada membran sebesar 190 – 291 nm namun membran tersebut masih mengalami penumpukkan umpan hingga membentuk gumpalan – gumpalan pada lapisan bawah membran yang dapat menutupi pori – pori membran (terjadi fouling), maka dari itu perbesaran ukuran pori diperlukan untuk mengurangi fouling yang terjadi pada membran tanpa mengurangi secara drastis selektivitas atau nilai rejeksi membran.
Ukuran pori dapat diperbesar dengan penambahan senyawa lain. Merta (2015), melaporkan bahwa penggunaan silika dengan konsentrasi silika yang lebih besar (5%) mampu menghasilkan pori yang lebih rapat dan lebih besar. Penambahan silika pada membran akan membentuk struktur membran yang bercabang sehingga membentuk pori. Silika memiliki sisi aktif berupa gugus silanol (≡Si- OH) dan siloksan (≡Si-O-Si≡). Gugus silanol dan siloksan mengakibatkan silika mudah dimodifikasi terutama dalam bentuk silika gel (Sulastri, 2010). Silika memiliki sifat yang sangat inert, hidrofilik, mempunyai kestabilan termal dan mekanik yang tinggi serta relatif tidak mengembang dalam pelarut organik jika dibandingkan dengan padatan resin polimer organik. Penambahan zat aditif berupa silika pada membran selulosa asetat–NPE (Membran SA-NPE) diharapkan dapat meningkatan pori pada membran bila dibandingkan dengan membran SA–
NPE tanpa silika sehingga fouling dapat berkurang. Maka dari itu, dilakukan penelitian mengenai Sintesis dan karakterisasi Membran Selulosa Asetat-NPE termodifikasi silika.
1.2. Tujuan
Tujuan dari penelitian ini adalah sebagai berikut:
1. Mengisolasi selulosa dari limbah nanas dan menganalisis kadar selulosa 2. Mengetahui pengaruh penambahan NaOH terhadap lignin pada selulosa hasil
isolasi.
3. Mensintesis selulosa asetat dari selulosa hasil isolasi.
4. Mensintesis membran selulosa asetat dengan agen pembentuk pori NPE termodifikasi silika.
5. Mengetahui pengaruh penambahan silika terhadap pori – pori membran SA- NPE.
1.3. Manfaat
Manfaat dari penelitian ini adalah sebagai berikut:
1. Memanfaat limbah nanas sebagai bahan baku selulosa dalam mensintesis membran selulosa asetat-NPE-silika (Membran SA/NPE/Si).
2. Mengetahui kadar selulosa hasil isolasi dan lignin serta pengaruh penambahan NaOH terhadap lignin pada selulosa hasil isolasi.
3. Mengembangkan metoda sintsesis membran selulosa asetat berpori.
4. Mengetahui pengaruh pemanambahan silika terhadap pori – pori membran SA/NPE/Si.
II. TINJAUAN PUSTAKA
2.1. Nanas
Tanaman nanas berbentuk semak atau rerumputan yang termasuk ke dalam tanaman tahunan. Tanaman nanas umumnya dikembang biakan secara vegetatif melalui tunas. Secara umum struktur morfologi tanaman nanas terdiri dari mahkota, tangkai, gagang bunga, bunga dan buah, daun, tunas dan akar (Bartholomew et al., 2003).
Tanaman nanas diklasifikasikan sebagai berikut:
Fillum : Plantae (tumbuh-tumbuhan) Divisi : Spermatophyta (tumbuhan berbiji) Kelas : Angiospermae (berbiji tertutup) Ordo : Farinosae (Bromeliales)
Famili : Bromeliaceae Genus : Ananas
Spesies : Ananas comosus (L.) Merr. (Bartholomew et al., 2003).
2.2. Limbah Nanas
Berdasarkan komposisi limbah, limbah nanas terdiri dari 2 macam yaitu 1) limbah nanas yang terdiri dari daun, tangkai, dan batang. 2) limbah nanas pengalengan yang terdiri dari kulit, mahkota, pucuk, untu buat dan ampas nanas (Murni dkk., 2008). Limbah nanas yang dikeringkan dan digiling akan menjadi limbah nanas padat yang umumya dikenal dengan istilah dedak nanas. (Murni dkk., 2008).
Kandungan dalam limbah nanas disajikan dalam Tabel 1. Berdasarkan penelitian yang dilaporkan oleh Nurnasari dan Nurindah, 2017. Serat kasar mengandung selulosa dan hemiselulosa yang bergabung membentuk mikrofibril yang dilapisi oleh lignin. Lignin pada mikrofibril berfungsi untuk mencegah lipatan mikrofibril dan menambah ketahanan terhadap tekanan pada dinding sel. Semakin besar kandungan serat pada limbah nanas, maka kadar selulosa akan semakin tinggi. Hal tersebut dapat dilihat dengan membandingkan serat kasar pada Tabel 1 dengan kadar selulosa pada Tabel 2 dan 3. Kandungan serat dan kadar selulosa pada mahkota nanas lebih besar dibandingkan pada serat daun nanas.
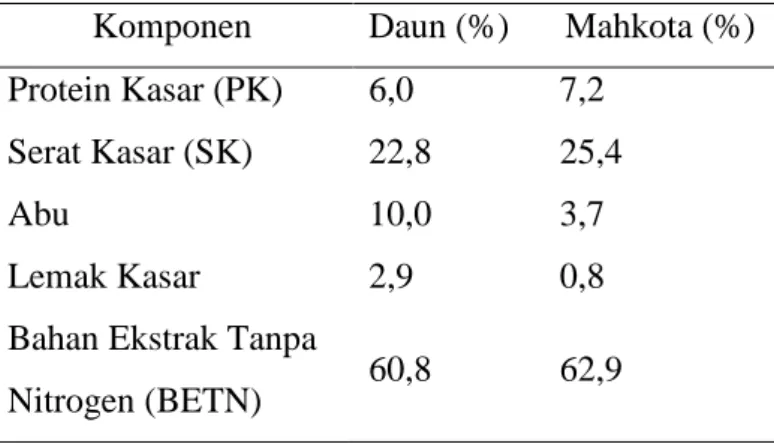
Tabel 1. Perbedaan komponen limbah daun nanas dan mahkota nanas Komponen Daun (%) Mahkota (%)
Protein Kasar (PK) 6,0 7,2 Serat Kasar (SK) 22,8 25,4
Abu 10,0 3,7
Lemak Kasar 2,9 0,8
Bahan Ekstrak Tanpa
Nitrogen (BETN) 60,8 62,9
(Murni dkk., 2008)
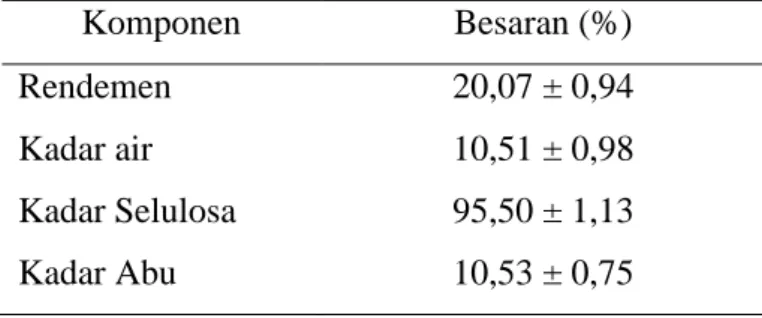
Tabel 2. Kandungan limbah mahkota nanas pada konsentrasi NaOH 15%
Komponen Besaran (%)
Rendemen 20,07 ± 0,94
Kadar air 10,51 ± 0,98
Kadar Selulosa 95,50 ± 1,13
Kadar Abu 10,53 ± 0,75
(Susana, 2011).
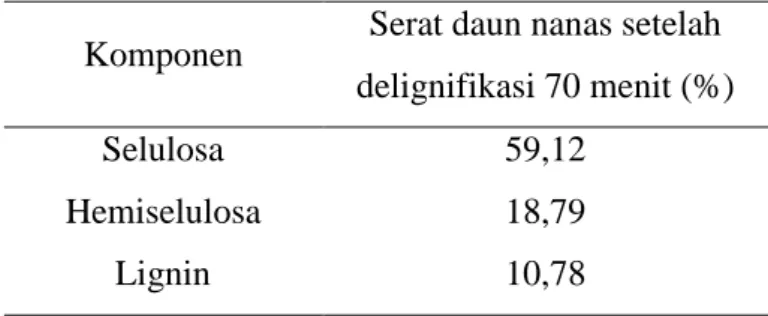
Tabel 3. Kandungan lignoselulosa serat daun nanas Komponen Serat daun nanas setelah
delignifikasi 70 menit (%)
Selulosa 59,12
Hemiselulosa 18,79
Lignin 10,78
(Mayangsari dkk., 2019).
2.3. Lignoselulosa
Lignoselulosa merupakan gabungan beberapa polimer yaitu selulosa,
hemiselulosa, dan lignin yang terikat dengan kuat secara kimia oleh ikatan silang kovalen dan gaya non kovalen antar polimer tersebut (Pérez et al., 2002).
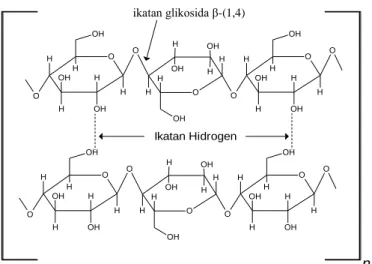
2.3.1. Selulosa
Selulosa merupakan polimer rantai lurus yang terdiri dari sub unit D-glukosa (Gambar 1) yang dihubungkan dengan ikatan glikosida β-(1,4) yang membentuk molekul selobiosa (Pérez et al., 2002). Ikatan tersebut menyebabkan molekul- molekul selulosa membentuk rantai yang saling bersisian, kokoh, dan lurus (Fessenden dan Fessenden, 1999). Selulosa tidak pernah ditemukan dalam keadaan murni di alam, tetapi selalu berasosiasi dengan polisakarida lain seperti lignin, pektin, hemiselulosa, dan xilan. Di dalam tumbuhan molekul selulosa tersusun dalam bentuk rantai panjang (fibril) yang terdiri atas beberapa molekul paralel (Monariqsa dkk., 2012) yang dihubungkan oleh ikatan hidrogen dan gaya van der waals sehingga memebentuk serat selulosa yang sulit diuraikan dan tidak larut dalam air meskipun selulosa memiliki gugus hidroksil yang banyak (Pérez et al., 2002, dan Suyati, 2008).
O
H H H H
OH
H OH
O OH O
H H H H
OH
H OH
O OH
O O
OH H
H
H
O
OH H H
OH
Ikatan Hidrogen
O
H H H H
OH
H OH
O OH O
H H H H
OH
H OH
O OH
O O
OH H
H
H
O
OH H H
OH
n
Gambar 1. Struktur selulosa (Sutini dkk., 2019)
Berdasarkan derajat polimerisasi (DP) dan kelarutan dalam senyawa natrium hidroksida (NaOH) 17,5%, selulosa dapat dibagi atas tiga jenis, yaitu :
a. α - Selulosa (Alpha Cellulose) adalah selulosa yang memiliki rantai panjang, tidak larut dalam NaOH 17,5% atau larutan basa kuat dengan derajat
polimerisasi sebesar 600 – 15000. α selulosa umumnya dipakai sebagai indikator tingkat kemurnian selulosa. Selulosa dengan derajat kemurnian α >
92 % memenuhi syarat untuk bahan baku utama pembuatan propelan atau bahan peledak. Sedangkan selulosa kualitas dibawahnya digunakan sebagai bahan baku pada industri kertas dan industri kain (serat rayon). Semakin tinggi kadar alfa selulosa, maka semakin baik mutu bahannya (Julika dkk., 2010).
b. Selulosa β (Betha Cellulose) adalah selulosa yang memiliki rantai yang pendek, larut dalam NaOH 17,5% atau basa kuat dengan derajat polimerisasi sebesar 15 – 90, dan dapat mengendap apabila dinetralkan (Sumada dkk., 2011).
c. Selulosa γ (Gamma Cellulose) adalah selulosa yang memiliki rantai pendek, larut dalam NaOH 17,5% atau basa kuat dan memiliki derajat polimerisasi kurang dari 15. Kandungan utama dari selulosa γ adalah hemiselulosa (Sumada dkk., 2011).
ikatan glikosida β-(1,4)
2.3.2. Hemiselulosa
Hemiselulosa merupakan polimer karbohidrat kompleks namun memiliki berat molekul yang lebih rendah dari selulosa. Hemiselulosa terdiri dari D-xilosa, D- manosa, D-galaktosa, D-glukosa, L-arabinosa, 4-O-metil-glukuronat, D- galakturonat, dan D-glukuronat yang dihubungkan dengan ikatan β-(1,4)- glikosidik dan kadang – kadang ikatan β-(1,3)-glikosidik (Pérez et al., 2002).
Hemiselulosa memiliki struktur amorf, ikatannya lemah sehingga mudah
dihdrolisis dan tidak tahan terhadap perlakuan panas (Fengel and Wagener, 1989).
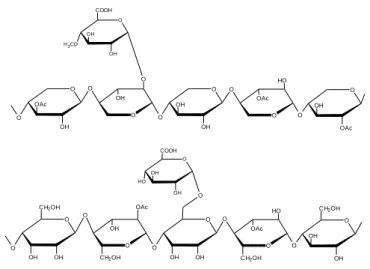
Hemiselulosa memiliki cabang dengan rantai lateral pendek yang terdiri dari gula yang berbeda (Gambar 2), hemiselulosa tidak membentuk agregat bahkan ketika dikristalisasi bersama dengan rantai selulosa (Pérez et al., 2002).
O
H3CO OH
OH COOH
O OH
OH O O
OAc
OH O
O O
OH
O
O
O OAc
O OH
OAc O O H
O
O H
OH
OH COOH
O
O
OH OH O O
OH OH O CH2OH
O O
OH
CH2OH
O O
OAc
CH2OH
O OH
OH CH2OH
O O OAc H
Gambar 2. Struktur hemiselulosa (Tezara et al., 2016)
2.3.3. Lignin
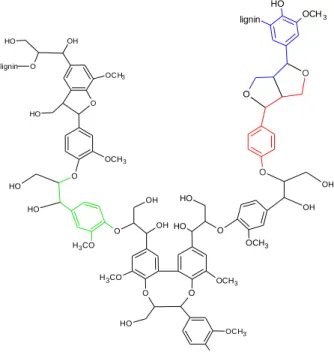
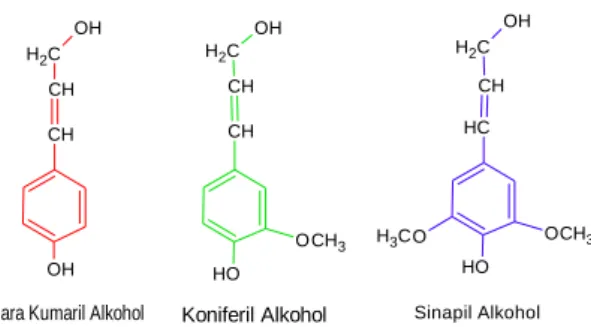
Lignin yang berikatan dengan selulosa merupakan polimer yang paling melimpah di alam. Secara struktural, lignin adalah heteropolimer amorf, yang terdiri dari unit fenilpropana (Gambar 3) yang tidak larut dalam air, dan tidak aktif secara optik. Polimer disintesis oleh turunan radikal bebas, di mana pelepasan peroksida melalui dehidrogenasi pada tiga fenil-propionik-alkohol. Ketiga fenil propionik alkohol tersebut dapat dilihat pada Gambar 4, yaitu konoferil alkohol (guaiasil
popranol), kumaril alkohol (p-hidroksifenilpropanol), dan sinapil alkohol (siringil propanol). Koniferil alkohol merupakan komponen utama lignin kayu lunak, sedangkan kumaril dan siringil merupakan komponen utama penyusun lignin kayu keras. Polimerisasi ini menghasilkan struktur yang heterogen yang struktur dasarnya dihubungkan oleh C-C dan ikatan aril-eter dengan aril gliserol, β-aril- eter sebagai struktur dominan pada lignin. Lebih dari 30 persen tanaman tersusun atas lignin yang memberikan bentuk kokoh dan memberikan proteksi terhadap serangga dan patogen (Orth et al., 1993).
O O
H
OCH3 O
OH
lignin
O H
OCH3 O O
H O H
O H3CO
OH OH
O H3CO
O OCH3
O H
OCH3
OH O
OH OH O
OCH3 O
H O H
O
O O H
OCH3 lignin
Gambar 3. Model lignin (Sutini dkk., 2019)
CH CH
OH C H2
OH
C H
CH
O H
C H2
OH
O OCH3
C H3 CH
CH
O H
C H2
OH
OCH3
Para Kumaril Alkohol Koniferil Alkohol Sinapil Alkohol
Gambar 4. Satuan penyusun lignin (Steffen, 2003)
2.4. Isolasi Selulosa
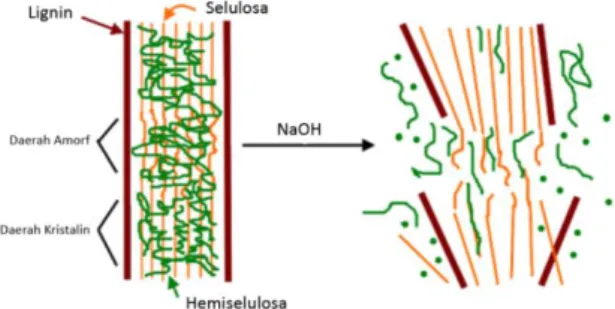
Pemisahan selulosa dari hemiselulosa dan lignin pada lignoselulosa dapat dilakukan melalui proses pretreatment seperti pada Gambar 5, delignifikasi dan bleaching atau pemutihan. Proses pretreatment dilakukan untuk menghilangkan lignin dari selulosa.
Gambar 5. Skema penguraian lignoselulosa (Mosier et al., 2005)
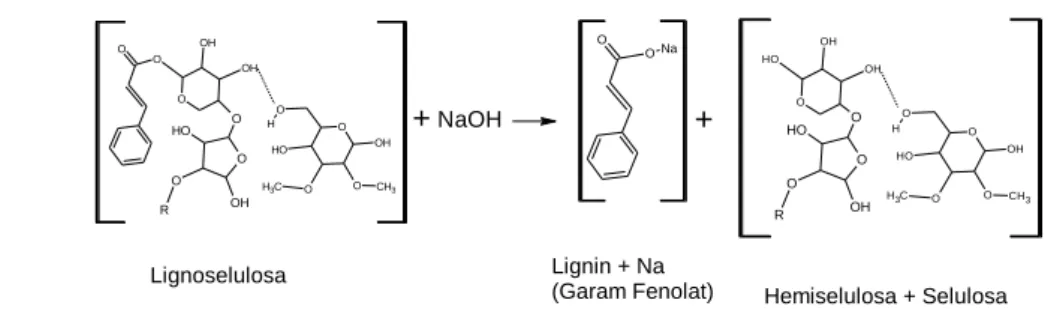
Pretreatment dapat memecah beberapa molekul selulosa terutama di daerah- daerah amorf. Penghilangan lignin dan hemiselulosa memungkinkan reagen hidrolitik lebih mudah untuk memutus molekul selulosa atau mereaksikan selulosa pada langkah berikutnya (Rehman et al., 2012). Pada reaksi penguraian lignoselulosa (Gambar 6), Ion hidroksida dari NaOH akan memutuskan ikatan dari monomer lignin, lignin yang telah terputus ikatannya akan mengikat (Na+) sehingga terbentuk natrium fenolat (garam fenolat) yang mudah larut dalam akuades, sedangkan hemiselulosa yang terbebas dari lignin, sebagian besar akan larut dalam NaOH (Lestari dkk., 2018). Proses delignifikasi lebih lanjut,
dilakukan untuk mendegradasi ikatan lignin agar mempermudah pemisahan lignin dengan kandungan senyawa lainnya dalam lignoselulosa (Sun and Cheng, 2002)
.
O
O O
O
H OH
O
CH3 C
H3 H O
O
O OH OH
O
O O H
O R OH
+NaOH
O O Na
+ O
O O
O
H OH
O
CH3 C
H3 H O
H
O OH OH
O
O O H
O R OH
Lignoselulosa Lignin + Na
(Garam Fenolat) Hemiselulosa + Selulosa
Gambar 6. Reaksi degradasi lignoselulosa (Muslimah, 2017)
Lignin akan menurunkan tingkat kecerahan dan menurunkan kadar selulosa, sedangkan hemiselulosa pada kandungan tinggi dapat menurunkan sifat mekanik selulosa karena adanya penurunan resistensi individu seratnya (Septevani dkk., 2018), maka dari itu lignin dan hemiselulosa perlu dihilangkan secara maksimal agar kadar selulosa yang diperoleh juga semakin tinggi dan semakin baik kualitasnya. Kadar selulosa yang tinggi (lebih dari 80%) hanya dapat diperoleh melalui proses pemutihan (Septevani dkk., 2018). Pemutihan merupakan pendegradasian lignin lebih lanjut yang sebelumnya belum terdegradasi secara sempurna (Fengel and Wagener, 1989).
Pada proses pemutihan,tingkat kecerahan (brigthness) dapat mengindikasikan kadar selulosa. Berdasarkan penelitian yang dilakukan oleh Septevani (2018), brightness yang semakin tinggi berbanding lurus dengan kadar selulosa. Sebelum dilakukan pemutihan, selulosa memiliki warna sedikit kecoklatan dengan kadar selulosa sebesar 73%, sedangkan pada selulosa dengan penambahan pemutih (NaOCl) dapat menaikkan kadar yang lebih tinggi, yaitu 81.5 % ± 2,1. Perlakuan dengan pemutihan 2 hingga 3 kali menghasilkan brightness yang semakin tinggi (semakin putih) dan kadar selulosa semakin besar yaitu 84%.
2.5. Bahan Baku Pembuatan Membran 2.5.1. Selulosa asetat
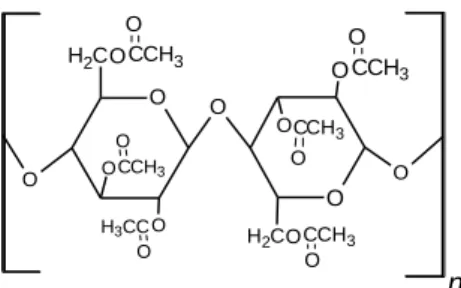
Selulosa asetat adalah selulosa yang gugus hidroksilnya digantikan oleh gugus asetil dari asetat anhidrida, struktur selulosa asetat dapat dilihat pada Gambar 7.
Salah satu sifat yang penting dari selulosa asetat adalah kadar asetil dan derajat subtitusi (DS), kedua sifat tersebut dapat menunjukkan kemampuan larut selulosa asetat dalam suatu pelarut sehingga dapat diaplikasikan dengan baik. Beberapa aplikasi selulosa asetat umumnya digunakan dalam berbagai jenis film, bahan pelapis, pembuatan plastik, pernis, dan serat lembaran. Selulosa asetat juga dimanfaatkan dalam aplikasi kedokteran, farmakologi, kromatografi, dan tekstil tiruan (Fengel and Wegener, 1989 dan Wang et al., 2009).
Menurut penelitian yang dilaporkan oleh Gaol dkk (2013), Sintesis selulosa asetat secara sederhana dapat dilakukan dengan beberapa tahap, yaitu aktivasi selulosa, asetilasi selulosa dan reaksi hidrolisis sisa reaktan asetat anhidrida. Tahap aktivasi selulosa dilakukan untuk meningkatkan reaktifitas selulosa, pengembangan serat – serat dan penurunan derajat polimerisasi. Tahap asetilasi adalah reaksi antara selulosa dengan asetat anhidrida dengan katalis asam sulfat, selanjutnya, sisa reaktan asetat anhidrida dihidrolisis.
O C H2
O O
O
O C H2
O O
O OC
O CH3
OC O
CH3 C O
CH3
CO O C H3
C O
CH3
C O
CH3
n
Gambar 7. Selulosa asetat
a) Asetilasi
Asetilasi yang bertujuan untuk memproduksi selulosa asetat. Larutan untuk asetilasi ini diperoleh dari pemanasan dan pengadukan selulosa dalam reaktor, dengan menambahkan campuran asam asetat glasial, asam sulfat 98
% (katalis) dan asetat anhidrid yang berlebih. Reaksi asetilasi selulosa bersifat endotermis sehingga suhu tidak boleh melampaui suhu maksimum (50˚C) (Mc. Ketta,1982).
Berdasarkan penelitian yang dilaporkan oleh Savitri (2003), Berikut faktor – faktor yang mempengaruhi proses asetilasi :
1) Suhu: Suhu tinggi dapat menyebabkan selulosa dan selulosa asetat teregradasi sehingga mengakibatkan jumlah produk menurun.
2) Waktu asetilasi: Waktu asetilasi yang panjang dapat menyebabkan
selulosa dan selulosa asetat terdegradasi sehingga jumlah produk menjadi kecil.
3) Kecepatan pengadukan: Kecepatan pengadukan yang tinggi dapat memperbesar perpindahan massa sehingga semakin besar kecepatan reaksi, produk yang dihasilkan akan semakin meningkat.
4) Jumlah asam asetat: Jumlah reaktan yang besar akan memperbesar kemungkinan tumbukan antar reaktan sehingga mempengaruhi kecepatan reaksi asetilasi.
5) Jumlah pelarut: Jumlah pelarut akan mempengaruhi homogenitas dari larutan tetapi jika jumlahnya terlalu besar akan mengurangi kemungkinan tumbukan antar reaktan (memperkecil konsentrasi reaktan) sehingga akan memperkecil produk yang dihasilkan.
b) Hidrolisis
Sisa reaktan asetat anhidrid dihidrolisis menjadi asam asetat. Reaksi asetilasi dihentikan dengan menambahkan air yang dimasukkan sebagai larutan asam asetat dengan kandungan air 5–30 % (Kirk-Othmer, 1994). Jumlah gugus asetil saat akhir proses asetilasi berkurang menjadi 3,0 dan turun hingga sekitar 2,4, jumlah gugus asetil dan gugus sulfat berkurang oleh hidrolisis asam yang dipengaruhi oleh waktu, suhu, dan keasaman. Gugus sulfat terhidrolisis lebih mudah daripada gugus asetil. Asam sulfat yang terbentuk meningkatkan sifat keasaman larutan reaksi (Ott et al., 1954).
2.5.2. Nonilfenol Etoksilat (NPE)
NPE memiliki rumus C9H19C6H4(OCH2CH2)nOH, n = 9. Surfaktan atau zat aktif permukaan merupakan senyawa kimia yang dapat menurunkan tegangan
permukaan yang bersifat ampifilik (memiliki 2 ujung berbeda sifat interaksinya dalam satu struktur senyawa) di mana bagian kepala adalah penyuka air
sedangkan bagian ekor merupakan bagian yang tidak menyukai air. Bagian kepala merupakan gugus polar yang berupa etoksi (dari etilen oksida) dan gugus
nonpolar berupa rantai hidrokarbon. Surfaktan diklasifikasikan menjadi 4 yaitu surfaktan anionik, kationik, non ionik dan amfoterik. NPE termasuk ke dalam surfaktan non ionik. Salah satu keuntungan surfaktan non ionik adalah sifatnya yang tidak beracun karena tidak terionisasi dalam larutan. Penambahan NPE pada
membran selulosa asetat untuk memberikan pori pada membran (porogen) (Octaviani, 2011). Struktur molekul NPE dapat dilihat pada Gambar 8.
O
OH
C H3
n
Gambar 8. Struktur molekul NPE (Octaviani, 2011)
2.5.3. Silika
Silika umumnya terdapat dalam beberapa bahan alam seperti pasir, kuarsa, gelas, dan lainnya. Silika memiliki bentuk struktur kristalin dan amorf, silika dengan struktur kristalin umumnya terdapat di alam, sedangkan struktur amorf diperoleh dari sintesis senyawa silika. Silika gel merupakan salah satu bentuk silika yang berstruktur amorf dan berbentuk padatan yang banyak dimanfaatkan sebagi
adsorben. Silika memiliki beberapa kelebihan, yaitu sifatnya yang hidrofilik, inert, memiliki kestabilan termal dan mekanik yang tinggi serta relatif tidak
mengembang dalam pelarut organik (Sulastri dan Susila., 2010). Sifat hidrofilik silika yang tinggi disebabkan adanya gugus silanol dan siloksan. Air dapat
teradorpsi melalui ikatan hidrogen antara molekul air dan gugus silanol. Kadar air dan permeabilitas membran meningkat seiring dengan meningkatnya jumlah silika, kadar air yang meningkat dapat disebabkan oleh hidrofilitas membran yang menigkat. Hidrofilitas yang tinggi, mengakibatkan air dapat berdifusi dalam membran (Merta dkk.,2015).
Gugus siloksan terdiri dari 2 macam, yaitu Si-O-Si ranti lurus, gugus siloksan ini umumnya tidak reaktif dengan pereaksi pada umumnya tetapi sangat reaktif terhadap senyawa logam alkali, dan gugus siloksan yang membentuk struktur yang melingkar dengan empat anggota (Gambar 9). Gugus siloksan ini memiliki reaktivitas yang tinggi, dapat mengadakan kemisorpsi air, amoniak, dan metanol.
Reaksi siloksan ini dengan air akan menghasilkan dua gugus Si-OH, sedangkan reaksi dengan amoniak akan menghasilkan gugus Si-NH2 dan silanol sedangkan reaksi dengan metanol akan menghasilkan gugus Si-O-CH3. (Sulastri dan Susila, 2010).
O OH H
O
Si O Si
O Si O Si
O
Si OH
O H
Si O O
O Si
O Si O O Si O
O
O O
O OH H
Gambar 9. Skema ikatan yang terjadi pada silika (Merta dkk., 2015)
2.5.4. Aseton
Aseton merupakan senyawa organik yang tidak berwarna. Umumnya aseton digunakan sebagai pelarut organik. Penggunaan pelarut aseton pada polimer membran dipengaruhi oleh parameter kelarutan suatu pelarut dan sifat pelarut itu sendiri. Selain aseton, pelarut yang umumnya digunakan pada pembuatan
membran adalah dimetilformamida (DMF), dimetilsulfoksida (DMSO),
Tetrahidrofuran (THF) dan 1,4-dioksan. Kelarutan senyawa dalam suatu pelarut dapat dilihat dari parameter kelarutan (δ) suatu pelarut. Parameter kelarutan terdiri dari 3 komponen, yaitu dispersi gaya london, gaya polar, dan gaya ikatan
hidrogen. Suatu polimer akan semakin mudah larut, apabila selisih parameter kelarutan (∆δ) antara polimer dan pelarut semakin kecil (harga parameter kelarutan palarut semakin medekati harga parameter kelarutan polimer).
Parameter kelarutan selulosa diasetat adalah 22,6995 (Mpa)1/2 (Whim and Johnson, 1996). Parameter kelarutan dan selisih parameter kelarutan selulosa asetat dengan beberapa pelarut dapat dilihat pada Tabel 4, sedangkan perbedaan sifat pelarut pada tabel 4, dapat dilihat pada Tabel 5.
Tabel 4. Parameter kelarutan beberapa pelarut organik
Pelarut Parameter
Kelarutan
Selisih Parameter Kelarutan
Aseton 20,45 2,25
1,4-dioksan 20,45 2,25
Dimetilformamida (DMF) 24,75 2,05 Tetrahidrofuran (THF) 25,15 2,45 Dimetilsulfoksida (DMSO 26,58 3,88
(Whim and Johnson, 1996)
Tabel 5. Perbedaan sifat beberapa pelarut organik
Pelarut Rumus
Kimia
Berat Molekul (g/mol)
Titik didih (⁰C)
Titik beku (⁰C)
Aseton (CH3)2CO 58,8 56 -94
1,4-dioksan C4H8O2 88,11 102 11,8
Dimetilformamida (DMF) HCON(CH3) 73,11 153 -61
Tetrahidrofuran (THF) C4H8O 72,11 65 -108
Dimetilsulfoksida (DMSO C2H6OS 78,13 189 18,5 (Sigmaaldrich, 2021)
Berdasarkan Tabel 4, parameter kelarutan yang mendekati parameter kelarutan selulosa diasetat adalah DMF, aseton, dan 1,4-dioksan, selain parameter kelarutan suatu pelarut, sifat – sifat pelarut itu sendiri juga memengaruhi kinerja pelarut.
Pada Tabel 5, terlihat perbedaan beberapa sifat pelarut-pelarut organik. Aseton memiliki titik didih yang lebih rendah dibandingkan dengan DMF, THF, 1,4- dioksan maupun DMSO. Semakin rendahnya titik didih, volatilitas bahan akan semakin besar dan rantai ikatan cenderung kurang stabil dibandingkan pelarut yang memiliki titik didih lebih tinggi, namun demikian, dengan rendahnya titik didih pelarut, akan memudahkan pengupan pelarut pada saat penyetakkan
membran sehingga membran yang dihasilkan akan memiliki pori yang lebih besar (Abdulreza et al., 2001).
2.6. Membran
Membran dapat didefinisikan sebagai suatu lapisan semipermiabel yang memisahkan suatu komponen atau senyawa dalam suatu campuran berdasarkan sifat fisik dan atau sifat kimianya, selain itu, membran juga dapat didefinisikan sebagai penghalang selektif antara dua fasa, yaitu fasa umpan dan fasa permeat.
Beberapa keunggulan teknologi membran adalah pemisahan dapat dilakukan secara kuntinyu, konsumsi energi cenderung rendah, dapat dikombinasi dengan proses pemisahan lainnya, up-scalling mudah. Sifat–sifat dan variabel membran dapat disesusaikan, dan zat aditif yang digunakan tidak terlalu banyak. Kelemahan dari teknologi membran adalah dapat terjadi polarisasi konsentrasi (fouling
membran), umur membran yang relatif rendah (Suseno dkk., 2003).
2.6.1. Klasifikasi Membran
Membran dengan gaya dorong tekanan umumnya menggunakan membran berpori untuk memisahkan partikel. Berdasarkan perbedaan ukuran pori membran,
terdapat 4 jenis membran sebagai berikut:
a) Mikrofiltrasi
Membran mikrofiltrasi merupakan membran yang memiliki diameter pori antara 0,1-10 µm dengan tekanan di bawah 2 bar (Mulder, 1996). Membran mikrofiltrasi umumnya digunakan untuk mengolah mikroorganisme dalam air minum, saat ini membran mikrofiltrasi berkembang menjadi aplikasi
kontaktor membran untuk penghilang gas asam (Wanten dkk., 2010).
b) Ultrafiltrasi
Membran ultrafiltrasi adalah varian membran di mana tekanan hidrostatik memaksa cairan menembus membran semipermeabel. Padatan tersuspensi dan pelarut yang memiliki berat molekul tinggi akan tertahan, sedangkan air dan pelarut dengan berat molekul yang lebih rendah akan melewati membran.
Membran ultrafiltrasi memiliki bentuk pori asimetris dengan ukuran pori
antara 1 – 100 nm dengan tekanan 1 – 10 bar. Pemisahan menggunakan membran ultrafiltrasi ini umumnya digunakan pada industri dan penelitian untuk purifikasi dan pemekatan larutan terutama larutan protein. (Wanten dkk., 2010).
c) Nanofiltrasi
Membran nanofiltrasi umumnya digunakan untuk pemisahan air dengan jumlah padatan terlarut yang sedikit, misalnya air tanah, selain itu membran ini juga digunakan untuk penyisihan produk samping desinfektan seperti zat organik alam dan sintetik (Mulder, 1996). Membran nanofiltrasi memiliki ukuran pori kurang dari 2 nm, kekuatan tekanan sebesar 10 – 25 bar (Wanten dkk., 2010).
d) Reverse Osmosis
Reverse osmosis adalah salah satu metode filtrasi yang dapat menyisihkan banyak jenis molekul dan ion besar dari larutan sehingga diperoleh permeat yang lebih murni. Pemisahan larutan dengan membran reverse osmosis dilakukan dengan memberikan tekanan pada larutan yang berada pada salah satu sisi membran selektif, tekanan eksternal tersebut digunakan agar larutan dapat melawan tekanan osmotiknya sehingga dapat terjadi perpindahan air dari larutan hipertonik ke larutan hipotonik. Membran reverse osmosis (Mulder, 1996; dan Wanten dkk., 2010). Membran reverse osmosis (RO) memiliki ukuran pori kurang dari 2 nm, kekuatan tekanan pada air payau sebesar 15 – 25 bar sedangkan pada air laut sebesar 40 – 80 bar (Wanten dkk., 2010).
2.6.2. Metode pembuatan Membran
Pembuatan membran memiliki beberapa teknik, yaitu phase inversion (inversi fasa), interfacial polymeratization, streching, tracking dan electrospinning (Merta dkk., 2015). Teknik ini adalah teknik yang paling umum digunakan
dalam industri pembuatan membran berpori. Teknik inversi fasa merupakan teknik pembuatan membran dengan mengubah larutan polimer homogen dari fasa liquid menjadi fase solid. Inversi fasa memiliki kelebihan dibandingkan teknik pembuatan membran lainnya yaitu fabrikasi yang cepat, biaya yang relatif rendah, pengerjaan yang mudah dan sederhana (Sampurna, 2015). Morfologi membran yang dihasilkan sangat bervariasi tergantung dari sifat bahan dasar dan kondisi pada proses pembuatan membran (Merta dkk., 2015). Proses pembuatan membran dengan teknik inversi fasa dapat dilakukan dengan menuangkan larutan polimer homogen ke dalam bak yang berisi larutan non pelarut. Pemisahan dan pengendapan terjadi karena adanya pertukaran antara pelarut dari larutan polimer dan non pelarut (Gambar 10). Pertukaran tersebut terjadi karena adanya
perbedaan kelarutan polimer dalam pelarut dan non pelarut yang mengakibatkan adanya aliran difusi antar pelarut dan non pelarut. (Han et al., 2013).
Gambar 10. Skema teknik inversi fasa (Sampurna, 2015)
Proses pemadatan membran terjadi pada lapisan atas kemudian perlahan terjadi pada lapisan bawahnya. Afinitas yang rendah antara rantai selulosa asetat dengan molekul air pada saat molekul air berdifusi ke dalam larutan polimer yang
menghasilkan inti fasa polimer. Proses difusi yang terus berlanjut menyebabkan inti polimer terbentuk hingga konsentrasinya sangat tinggi dan terjadi pemadatan pada membran (Saljoughi dan Mohammadi, 2009). Proses pembentukkan
membran yang cepat cenderung menghasilkan makrovoid (ruang kosong yang besar sehingga membran menjadi kurang padat) sedangkan membran yang lebih lambat akan menghasilkan pembentukkan inti membran yang lebih terkendali sehingga pembentukkan makrovoid dapat dihindari (Saljoughi et al., 2009).
2.7. Karakterisasi Membran
2.7.1. Fourier Transform Infra Red (FT – IR)
Analisis FT – IR memberikan informasi mengenai gugus fungsi yang terikat pada rantai karbon. Spektrum IR memberikan penentuan frekuensi getaran (vibrasi) dan intensitas dari gugus fungsi dan molekul lainnya kecuali molekul diatomik (Merta dkk.,2015). Spektrometer IR memiliki komponen dasar yang sama dengan Spektrometer UV tampak, namun sedikit berbeda pada sumber, komponen optik dan detektornya (Khopkar, S.M., 1990). Sumber radiasi yang umumnya
digunakan adalah Nernest atau lampu glower yang dibuat dari oksida – oksida zirkonium dan natrium. Celah pada komponen optik atau monokromator yang digunakan dalam alat IR terbuat dari gelas, lelehan silika, LiF, CaF2, BaF2, NaCl, AgCl, KBr,dan CsI (Khopkar, S.M., 1990).
Dua teknik pengukuran sampel yang paling banyak digunakan adalah transmisi dan reflektansi. Pada transmisi, sinar radiasi IR dikenai langsung pada sampel untuk mengetahui besar penyerapan radiasi IR pada sampel sehingga
menghasilkan pola vibrasi, sedangkan pada reflektansi (ATR) Sampel tidak dikenai langsung dengan sinar radisi IR melainkan di pantulkan atau di refleksikan untuk mengethaui pola vibrasi molekul, pantulan tersebut
mengakibatkan tidak semua gugus fungsi pada sampel mengalami vibrasi, hanya gugus fungsi yang memilki intensitas yang besar saja yang dapat terlihat pada puncak spektrum, sehingga spektrum yang dihasilkan (Sulistyani dan huda, 2018).
Salah satu contoh hasil analisis FT – IR pada membran SA – NPE dapat dilihat pada Gambar 11. Pita serapan ciri khas dari gugus asetil berada pada puncak bilangan gelombang : 1053 cm-1 dan 1243 cm-1 menunjukkan gugus C-O serta 1751 cm-1 menunjukkan gugus C=O (Gambar 11b). Pita serapan khas NPE terdapat pada bilangan gelombang 834 cm-1 , 951 cm-1 , dan 3420 cm-1 (Gambar 11a). Jika dibandingkan Gambar 11a dan 11b, pada Gambar 11b tidak terdapat pada pita serapan khas NPE karena NPE telah terlepas dari membran ketika perendaman dan membentuk pori pada membran (Octaviani dkk., 2015).
a b
Gambar 11. Spektrum FT - IR (a) senyawa NPE (b) SA-NPE (Octaviani, 2011)
2.7.2. Scanning Elctrone microscape (SEM)
SEM merupakan alat yang digunkan untuk menganalisis kualitatif dan semi kualitatif. SEM dapat melakukan perbesaran antara 300.000 – 1.000.000 kali (dengan menggunakan SEM yang lebih modern), perbesaran tersebut jauh lebih besar dibanding optical microscope (Mohammed dan Abdullah, 2018).
Permukaan materi yang disinari atau terkena berkas elektron, dipantulkan kembali (refleksi) berkas eltrone (elektron sekunder kesegala arah). Semua berkas elektron yang dipantulkan, detektor SEM akan mendeteksi berkas elektron berintensitas tinggi, yang dipantulkan dari material yang dianalisis. SEM dapat menunjukkan permukaan membran.
Pada membran SA-NPE terlihat pori membran berukuran 190 – 291 nm. Ukuran pori dan morfologi membran tersebut (Gambar 12) menunjukkan bahwa pori – pori membran SA-NPE memiliki bentuk yang tidak seragam, sehingga termasuk ke dalam membran asimetrik (Octaviani, 2011). Penambahan silika pada
membran dapat memperbesar pori, adanya silika dalam suatu membran dapat dilihat pada Gambar 13.
Gambar 12. Hasil SEM Membran SA (Octaviani, 2011).
Gambar 13. Penampakan (a) Silika dan (b) Agregat Silika, Pada Membran SA/PEG/Si (Ahmad, 2015)
a b
III. METODE PENELITIAN
3.1. Waktu dan Tempat
Penelitian dilakukan dari bulan September 2021 – Februari 2022 di laboratorium Kimia Organik, Fakultas MIPA, Universitas Lampung. Analisis FT – IR selulosa dan selulosa asetat dilakukan di Laboratorium Terpadu Sentral Inovasi Terpadu (LTSIT) Universitas Lampung, sedangkan analisis FT – IR membran SA/NPE/Si dilakukan di Laboratorium Terpadu Universitas Sebelas Maret, serta SEM dilakukan di LTSIT, Universitas Lampung.
3.2. Alat dan Bahan
Alat – alat yang digunakan dalam penelitian ini adalah alat – alat gelas (pyrex), termometer air raksa, neraca analitik (metler ae 200), magnetic stirrer (stuart), saringan 325 mesh, oven (heraeus), sendok plastik, set alat refluks, pelat kaca, Zeiss/SEM-EDX EVO MA10, FT – IR Cary 630, dan Spektrometer FT – IR Shimadzu.
Sedangkan bahan – bahan yang digunakan adalah limbah nanas padat, NaOH padat, Na2SO3 padat, H2O2 50%, etanol 96%, HCl 32%, asam asetat glasial, asetat anhidrida, H2SO4 96%, dan akuades, aseton, natrium silikat, selulosa asetat standar dan kertas saring.
3.3. Prosedur
3.3.1. Isolasi α – Selulosa
Proses Isolasi selulosa dilakukan melalui 3 proses, yaitu:
a. Pretreatment Alkali
Pretreatment alkali merupakan proses pretreatment dengan menggunakan larutan alkali (NaOH) untuk meregangkan ikatan antar lignoselulosa, sehingga lignin dan hemiselulosa akan lebih mudah larut pada tahapan selanjutnya (Sun dan Cheng, 2002). Proses pretreatment alkali pada limbah nanas dilakukan dengan memasukan sedikit demi sedikit limbah nanas, yaitu:
1. 100g yang telah dibersihkan, dimasukkan ke dalam NaOH 10%, dengan perbandingan sampel dan NaOH 1:10 (w/v).
2. Dipanaskan pada suhu 80-100 ⁰C selama 60 menit.
3. Campuran dipisahkan dari pelarut, disaring, dan dicuci dengan akuades sampai pH netral, dikeringkan pada suhu 60⁰C (Susana, 2011).
b. Delignifikasi
Delignifikasi adalah suatu proses pendegradasian ikatan lignin dan
mempermudah pemisahan lignin dari kandungan lignoselulosa lainnya (Sun dan Cheng, 2002). Berikut proses delignifikasi pada selulosa :
1. Sampel dari hasil pretreatment (residu) ditambahkan Na2SO3 2%, dengan rasio berat bahan dan volume larutan 1:10.
2. Dipanaskan selama 2 jam pada suhu ±100°C, kemudian dipisahkan dari pelarut basa dan dicuci dengan akuades hingga bersih.
3. Selulosa basah dikeringkan pada suhu 60°C (Lismeri, 2019).
c. Bleaching (Pemutihan)
Proses bleaching atau pemutihan merupakan proses mendegradasi lignin yang tersisa dengan cara memutuskan rantai-rantai pendek lignin sehingga lignin mudah larut saat pencucian. Pemutihan dapat dilakukan dengan satu tahap menggunakan peroksida konsentrasi tinggi atau dengan dua tahap menggunakan
peroksida dan dilanjutkan dengan reduksi dithionit. Pemutihan dengan satu tahap umumnya sering digunakan karena lebih ekonomis dan lebih mudah diperoleh (Fengel and Wegener, 1989). Pada tahap ini, pemutihan menggunakan H2O2 3% dengan rasio berat bahan dan volume larutan 1:10. proses pemutihan dilakukan dengan tahap sebagai berikut:
1. Sampel hasil delignifikasi yang telah ditambahkan H2O2 dipanaskan selama 30 menit pada suhu 60ºC.
2. Dipisahkan dari pelarut peroksida dan dicuci dengan akuades hingga bersih, 3. Dikeringkan pada suhu 60°C.
4. Dilakukan uji FT – IR dan kadar selulosa (Irfanto dkk., 2013).
3.3.2. Analisis Kadar Lignin dan Selulosa
Analisis lignin dan selulosa dilakukan menggunakan metode Chesson – Datta (Lismeri dkk., 2016), yaitu sebagai berikut:
a. Memasukkan 1 gram selulosa (a), ke dalam gelas beaker lalu ditambah akuades 150 mL. Direfluks selama 2 jam pada hotplate dengan suhu ± 100°C.
b. Saring dan cuci dengan akuades hingga volume filtrat 300 mL.
c. Residu dikeringkan dengan oven, lalu ditimbang hingga beratnya konstan (b).
d. Residu (b) kemudian ditambah 150 ml H2SO4 1N e. Direfluks dengan suhu ± 100°C selama 2 jam.
f. Saring dan cuci residu dengan akuades hingga volume filtrat 300 mL.
g. Residu dikeringkan hingga beratnya konstan dan ditimbang (c).
h. Selanjutnya, residu (c) direndam dengan 10 mL H2SO4 72% selama 4 jam pada suhu kamar kemudian ditambahkan 150 ml H2SO4 1N (untuk
pengenceran),
i. Direfluks kembali dengan suhu ± 100°C selama 2 jam.
j. Saring dan cuci residu dengan aquadest hingga volume filtrat 400 ml.
k. Residu dikeringkan hingga beratnya konstan dan ditimbang (d).
Perhitungan:
Kadar Air (%) = x 100%
Hemiselulosa (%) = x 100%
3.3.3. Sintesis Selulosa Asetat
Sinetesis selulosa asetat dilakukan sebagai berikut:
a. Sebanyak 5 g selulosa ditambahkan 125 mL asam asetat glasial,
b. diaduk menggunakan magnetic stirrer dengan kecepatan skala 3 selama 30 menit pada suhu 50°C.
c. Larutan ditambahkan 8 tetes H2SO4 dan 25 mL asam asetat glasial lalu diaduk dengan kecepatan skala 3 selama 25 menit.
d. Asam asetat anhidrida ditambahkan pada campuran dengan perbandingan selulosa terhadap asetat anhidrida sebesar 1:10 (b/v).
e. Diaduk dengan magnetic stirrer dengan skala, waktu dan suhu yang sama.
f. Campuran didiamkan selama 14 jam pada suhu ruang, lalu dicuci dengan akuades hingga pH netral dan dikeringkan (suhu 40⁰C).
g. Selulosa asetat yang diperoleh kemudian dilakukan uji FTIR dan analisis kadar asetil untuk mengetahui jenis selulosa asetat yang dihasilkan (Lismeri dkk., 2016).
3.3.4. Analisis Kadar Selulosa Asetat
Analisis kadar selulosa asetat dilakukan dengan reaksi saponifikasi yang dilanjutkan dengan titrasi asam basa sesuai prosedur ASTM D-678 – 91 (Lismeri dkk., 2016):
a. Ditambahkan 4 mL etanol 75% (v/v) ke dalam labu yang berisikan untuk ± 0,1 gram selulosa asetat, lalu dipanaskan di penangas air bersuhu 55°C, ±30 menit.
b. Selanjutnya, labu dikeluarkan dari penangas, kemudian dimasukkan 4 mL Selulosa (%) = 𝑐 𝑑
𝑎 x 100%
Lignin (%) = 𝑑 𝑒
𝑎 x 100%
NaOH 0.5 N ke dalamnya, dengan buret dan dipanaskan kembali selama 15 menit pada suhu yang sama. Selanjutnya, labu ditutup rapat dengan lembaran aluminium dan dibiarkan selama 72 jam pada suhu ruang.
c. Sisa NaOH dititrasi dengan HC1 0.5 N standar menggunakan indikator fenolftalein (pp) sampai lenyapnya warna merah muda.
d. Sebanyak 1 mL titran dilebihkan dari titik akhir itu, lalu labu ditutup rapat kembali, dan dibiarkan selama 24 jam pada suhu kamar untuk menarik NaOH yang berdifusi ke dalam selulosa teregenerasi.
e. Sisa HC1 dititrasi dengan NaOH 0.5 N standar sampai muncul warna merah muda permanen pertama kali (titik akhir).
f. Blangko, diperlakukan serupa dengan penetapan kadar asetil contoh, tetapi tanpa menggunakan contoh.
Perhitungan asetil selulosa asetat dan derajat subtitusi :
Keterangan :
A = Volume NaOH untuk titrasi sampel B = Volume NaOH untuk titrasi blanko C = Volume HCl untuk titrasi sampel D = Volume HCl untuk titrasi blanko Na = Konsentrasi HCl
Nb = Konsentrasi NaOH
W = Bobot selulosa asetat(Lismeri dkk., 2016).
Derajat Subtitusi (
)
( )
Keterangan :
o 162 adalah berat molekul unit anhidroglukosa, o 43 adalah mr asetil,
o 42 adalah Mr asetil – massa atom hidrogen (43-1) (Lismeri dkk., 2016).
Kadar Asetil (%) = [ D C Na+ A B Nb]
W 4,305
3.3.5. Pembuatan Membran Selulosa Asetat
Sintesis membran SA/NPE dan membran SA/NPE/Si sebagai berikut:
a. Pembuatan Membran SA/NPE
Campuran yang terdiri atas SA dan NPE dalam pelarut aseton sebanyak 3,8 mL, dengan komposisi SA sebesar 15% (b/v) atau sebanyak 0,6 gram, dan NPE 5% (v/v) atau sebanyak 0,2 mL.
Larutan yang homogen (larutan dope) dicetak di atas pelat kaca yang sudah diberi selotip pada bagian tepinya dengan ketebalan yang sama.
Didiamkan selama 15 menit untuk menguapkan pelarut.
Pelat kaca beserta membran yang menempel dimasukkan ke dalam air dengan suhu 60˚C selama 45 menit kemudian membran dilepaskan dari pelat kaca. Membran direndam dalam air suling sebelum digunakan (Octaviani, 2011).
b. Sintesis membran SA/NPE/Si
Mencampurkan larutan silika ( Si 5% atau Si 10% atau Si 15%) sebanyak 0,2 mL ke dalam campuran yang terdiri atas SA dan NPE dalam pelarut aseton, dengan komposisi SA dan NPE yang sama dengan membran SA/NPE.
Larutan telah dihomogenkan (larutan dope), dicetak di atas pelat kaca yang sudah diberi selotip pada bagian tepinya dengan ketebalan yang sama.
Didiamkan selama ±15 menit untuk menguapkan pelarut.
Pelat kaca beserta membran yang menempel dimasukkan ke dalam akuades dengan suhu 60˚C selama ±45 menit, kemudian membran dilepaskan dari pelat kaca (Membran direndam dalam akuades ketika belum digunakan). (Merta dkk., 2015 dan Octaviani, 2011).
3.3.6. Karakterisasi Selulosa, Selulosa Asetat dan Membran a. Analisa gugus fungsi
Analisa gugus fungsi selulosa dan selulosa asetat menggunakan FT – IR Cary 630 dengan range bilangan gelombang 4000 – 600 cm-1 sedangkan pada membran, analisa gugus fungsi menggunakan Spektrometer FT – IR Shimadzu dengan range bilangan gelombang 4000 – 400 cm-1. Pada FT – IR Cary 630
menggunakan aksesoris berupa ATR (Attenuated Total Reflectance) sehingga Analisa dilakukan dengan menempatkan sampel langsung pada pelat sampling dengan kristal ZnSe (tanpa dicampur dengan KBr) dari atas jendela optik, kemudian ditahan oleh penjepit kompresi micrometer controlled untuk memastikan sampel dan kristal terpasang dengan baik (Sulistyani dan Huda, 2018).
Pada analisa membran, menggunakan Spektrometer FT – IR Shimadzu, dengan aksesoris yang digunakan berupa transmisi sehingga diperlukan preparasi sampel dengan baik. Preparasi pada spektrometer FT – IR Shimadzu dilakukan dengan mengehilangkan air pada sampel (membran) menggunakan oven pada suhu 80⁰C selama ±15 menit, kemudian menghaluskan sampel dan mencampurkan sampel dengan KBr pada pelat KBr sampai homogen, selanjutnya campuran ditekan dengan alat penekan hidrolik atau sejenisnya hingga pelatt transparan lalu sampel dianalisis (Khopkar, S.M., 1990).
b. Analisa struktur morfologi
Analisa struktur morfologi membran dilakukan dengan analisis SEM. Analisis SEM merupakan analisis kualitat