ABSTRAK
KINETIKA DAN ISOTERM ADSORPSI ION-ION LOGAM DIVALEN Ca2+, Cu2+, DAN Cd2+ DALAM LARUTAN OLEH
BIOMASSA ALGA Spirulina sp
Oleh
SEVINA SILVI
Pada penelitian ini telah dilakukan proses adsorpsi ion Ca2+, Cu2+, dan Cd2+ terhadap adsorben biomassa alga Spirulina sp. Identifikasi gugus fungsi biomassa alga Spirulina sp dilakukan dengan menggunakan spektrofotometer inframerah (IR) dan kadar ion logam dianalisis dengan spektrofotometer serapan atom (SSA). Proses adsorpsi ion Ca2+, Cu2+, dan Cd2+ pada biomassa alga dilakukan dengan metode batch untuk mengkaji jumlah (dosis) biomassa alga sebagai adsorben, pH, dan waktu kontak optimum serta konsentrasi ion logam optimum. Jumlah dosis biomassa alga sebagai adsorben ion Ca2+, Cu2+, dan Cd2+ optimum pada 0,1 g dan proses adsorpsi optimum pada pH 5. Kinetika adsorpsi ion Ca2+, Cu2+, dan Cd2+ cenderung mengikuti model kinetika pseudo orde dua dengan konstanta laju untuk ion Ca2+, Cu2+, dan Cd2+ masing-masing adalah 0,300; 0,090; dan 0,015 g mg-1 menit-1. Isoterm adsorpsi ion Ca2+, Cu2+, dan Cd2+ cenderung mengikuti model isoterm Langmuir dengan kapasitas adsorpsi untuk ion Ca2+, Cu2+, dan Cd2+ masing-masing adalah 22,52; 22,21; dan 21,25 mg g-1.
ABSTRACT
ADSORPTION KINETICS AND ISOTHERM OF DIVALENT IONS OF Ca2+, Cu2+, AND Cd2+ IN SOLUTION USING
Spirulina sp ALGAE BIOMASS
By
SEVINA SILVI
In this research, it has been carried out adsorption process of Ca2+, Cu2+, and Cd2+ ions towards adsorbent of Spirulina sp. The identification of the functional groups of Spirulina sp algae biomass was performed using FTIR spectroscopy method and the amount of ions was analyzed using Atomic Absorption Spectrophotometer (AAS). Batch process was used in the adsorption of Ca2+, Cu2+, and Cd2+ ions by algae biomass to determine the algae biomass dosage as adsorbent, pH, interaction time, and initial metal ion concentration. The optimum algae biomass dosage was 0.1 g and the optimum adsorption was at pH 5. The kinetics adsorptions of Ca2+, Cu2+, and Cd2+ ions tend to follow the pseudo second order kinetics with rate constant values of 0.300, 0.090, and 0.015 g mg-1 min-1, respectively. The adsorption isotherms of Ca2+, Cu2+, and Cd2+ ions tend to follow the Langmuir isotherm models, with the values of adsorption capacity of 22.52, 22.21, and 21.25 mg g-1, respectively.
KINETIKA DAN ISOTERM ADSORPSI ION-ION LOGAM DIVALEN Ca2+, Cu2+, DAN Cd2+ DALAM LARUTAN OLEH
BIOMASSA ALGA Spirulina sp
Oleh
SEVINA SILVI
Skripsi
Sebagai Salah Satu Syarat Untuk Mencapai Gelar SARJANA SAINS
Pada
Jurusan Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
RIWAYAT HIDUP
Penulis dilahirkan di Bandar Lampung, pada tanggal 18 Januari
1993, sebagai anak tunggal dari Imron Hakim dan Mila.
Jenjang pendidikan diawali dari Taman Kanak-kanak (TK) di
TK Pertiwi Bandar Lampung diselesaikan pada tahun 1998.
Sekolah Dasar (SD) di SDN 1 Rawalaut Bandar Lampung diselesaikan pada tahun
2004. Sekolah Menengah Pertama (SMP) di SMPK BPK Penabur Bandar
Lampung diselesaikan pada tahun 2007, dan Sekolah Menengah Atas (SMA) di
SMAK BPK Penabur Bandar Lampung diselesaikan pada tahun 2010. Tahun
2010, penulis terdaftar sebagai Mahasiswa Jurusan Kimia FMIPA Unila melalui
jalur SNMPTN (Seleksi Nasional Masuk Perguruan Tinggi Negri).
Pada tahun 2013 Penulis melakukan Praktek Kerja Lapangan di Laboratorium
Kimia Anorganik Jurusan Kimia FMIPA Unila di Bandar Lampung. Selama
menjadi mahasiswa penulis pernah menjadi asisten praktikum Sains Dasar
Biologi, Sains Dasar Ilmu Komputer, dan Kimia Dasar I. Penulis juga aktif di
Himpunan Mahasiswa Kimia (HIMAKI) FMIPA Unila sebagai anggota Biro
Kupersembahkan karya sederhana ini kepada :
ALLAH S.W.T
]
Kedua orang tuaku,
Mama dan Papa yang telah memberikan rasa kasih sayang
serta cinta kalian dalam semangat dan doa indah untukku
Keluarga besar yang telah mendukungku.
Seluruh sahabat terbaikku
Seseorang yang akan mendampingiku kelak
MOTO
“Maka nikmat Tuhanmu yang manakah yang kamu dustakan?
Maha suci nama Tuhanmu yang mempunyai kebesaran dan
kemurahan”
(Ar-Rahman 77-78)
“
Ses
ungguhnya sesudah kesulitan itu ada kemudahan”
(QS. Al-Insyirah:6)
“Tiap kali kamu merasa
beruntung, percayalah doa ibumu telah
didengar”
(Anonim)
“Tuhanmu lebih tau batas rasa sakit yang bisa kau tampung.
Jangan sampai engkau menyerah disaat selangkah lagi Tuhanmu
menggantikan kesakitan dengan sejuta keindahan”
(Anonim)
SANWACANA
Assalamu’alaikum Wr. Wb.
Alhamdulillah Puji dan syukur Penulis ucapkan atas kehadirat Allah SWT, karena atas segala rahmat dan karunia-Nya skripsi ini dapat diselesaikan.
Skripsi dengan judul "KINETIKA DAN ISOTERM ADSORPSI ION-ION LOGAM DIVALEN Ca2+, Cu2+, DAN Cd2+ DALAM LARUTAN OLEH BIOMASSA ALGA Spirulina sp" adalah salah satu syarat untuk memperoleh gelar Sarjana Sains pada Jurusan Kimia, Fakultas Matematika dan Ilmu
Pengetahuan Alam, Universitas Lampung.
Dalam pelaksanaan dan penulisan skripsi ini tidak lepas dari kesulitan dan rintangan, namun itu semua dapat penulis lalui berkat rahmat dan ridha Allah SWT serta bantuan dan dorongan semangat dari orang-orang yang hadir di kehidupan penulis. Dalam kesempatan ini, penulis menyampaikan terima kasih setulus-tulusnya kepada :
2. Bapak Prof. Suharso, Ph.D., selaku pembimbing II penelitian dan selaku Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam yang telah memberikan ilmu, kritik, saran dan arahan yang diberikan kepada penulis sehingga skripsi ini terselesaikan dengan baik.
3. Bapak Rudy T. M. Situmeang, M. Sc., selaku penguji penelitian dan pembimbing akademik yang telah memberikan ilmu, perhatian, motivasi, nasehat, kritik, serta saran kepada penulis sehingga skripsi ini terselesaikan dengan baik.
4. Bapak Dr. Eng. Suripto Dwi Yuwono, selaku ketua Jurusan Kimia FMIPA Unila.
5. Seluruh dosen FMIPA Unila yang telah mendidik dan memberikan ilmu pengetahuan yang sangat berguna kepada penulis selama kuliah.
6. Kedua orang tuaku yang sangat aku sayangi. Papaku Imron Hakim, yang selalu menjadi inspirasi dan teladan bagiku dalam segala hal. Selalu
memberikan semangat dan motivasi bagiku. Terima kasih papa atas doamu yang tak putus dan segala bentuk pengorbananmu. Mamaku Mila sekaligus menjadi sahabatku. Mama yang selalu memberikan kasih sayang, cinta yang begitu besar, sabar dalam menghadapi sikap burukku, senyum yang selalu menyemangatkanku, dan selalu mendoakanku setiap waktu. Sekali lagi terima kasih papa dan mama tersayang dengan tulus dan ikhlas kuucapkan atas segala hal terbaik dan semua yang telah diberikan kepadaku serta bentuk pengorbanan kalian sampai saat ini. Kalian berdua kesayangan sevin.
8. Sahabat-sahabat terbaikku, Chyntia Gustiyanda Patraini, Martha Selvina Gultom, dan Putri Rahmatika. Terima kasih atas dukungan, kebersamaan selama ini, tempat berbagi suka dan duka, semoga Allah selalu melindungi kalian dimanapun kalian berada. Tetap semangat untuk kalian ya til dan sukses untuk kita semua. Sekali lagi thanks my beloved.
9. Teman seperjuangan penelitianku Widya Afriliani Wijaya dan Agung
Supriyanto, terima kasih atas segala bantuan dan dukungannya. Sukses untuk kita dan semoga Allah membalas segala bentuk kebaikan kalian.
10. Sahabat terbaik, Tika Christy Novianty, terima kasih atas segala bantuan dan dukungan. Tetap semangat dan sukses selalu untuk kita.
11. Ryanda Masri Kurniawan, terima kasih banyak atas segala bentuk bantuan, doa, semangat, serta dukungannya selama ini. Tidak lupa kusampaikan terima kasih kepada Rizka Shafira Triana dan Rahmanita Sophia Jauhara, terima kasih atas doa, semangat, dan dukungannya.
12. Teman-teman seperjuangan Lab Anorganik, Silvana Maya Pratiwi, Fauziyyah
Mu’min Shiddiq, Wynda Dwi Anggraini, S. Si., Hapin Afriyani, S. Si., Rini
Handayani Rotua P, terima kasih untuk kebersamaan dan keceriaan kalian selama menjalankan penelitian dan perkuliahan. Tetap semangat kawan, sukses selalu untuk kita semua.
Arina, M. Prasetio Ersa, Indah Aprianti, Nur Robiah, Chintia Yolanda, Rully Prayetno, Maria Anggraini, terima kasih untuk bantuan, kebersamaan, dan keceriaan selama menjalankan perkuliahan, tetap semangat dan jangan menyerah, perjuangan kita masih panjang, sukses selalu untuk kita semua. 14. Keluarga Besar Kimia FMIPA Unila 2008-2013, terima kasih atas segala
dukungannya.
15. Mba Liza Apriliya S, S.Si selaku Laboran Laboratorium Kimia Anorganik Fisik yang telah banyak membantu penulis untuk mendapatkan zat dan bahan kimia, serta terima kasih juga kepada Mba Nora dan Pak Ghani, terimakasih atas segala bantuannya.
16. Semua pihak yang telah membantu dan mendukung penulis dalam penyusunan skripsi ini.
Akhir kata, Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan. Penulis berharap semoga skripsi yang sederhana ini dapat berguna dan bermanfaat bagi kita semua. Amin.
Bandar Lampung, 20 Agustus 2014 Penulis
DAFTAR ISI
Halaman
DAFTAR TABEL ...xvi
DAFTAR GAMBAR ... .xviii
I. PENDAHULUAN A. Latar Belakang ... 1
B. Tujuan Penelitian ... 4
C. Manfaat Penelitian ... 4
II. TINJAUAN PUSTAKA A. Biomassa Alga ... 5
B. Logam ... 7
1. Kalsium (Ca) ... 10
2. Tembaga (Cu) ... 11
3. Kadmium (Cd) ... 11
C. Adsorpsi ... 12
1. Faktor-faktor yang Mempengaruhi Proses Adsorpsi ... 14
1.1.Sifat adsorbat ... 14
1.2.Sifat adsorben ... 14
1.3.pH larutan ... 14
1.4.Konsentrasi adsorbat ... 15
1.5.Temperatur ... 15
1.6. Waktu kontak dan pengocokan ... 15
2. Parameter Adsorpsi ... 15
2.2.Isoterm Adsorpsi ... 17
a. Isoterm adsorpsi Langmuir ... 18
b. Isoterm adsorpsi Freundlich ... 19
D. Karakterisasi Material ... 21
1. Spektrofotometer Infrared (IR) ... 21
2. Atomic Adsorption Spectrophotometer (AAS) ... 22
III. METODOLOGI PENELITIAN A. Waktu dan Tempat ... 24
B. Alat dan Bahan ... 24
C. Prosedur Penelitian ... 25
1. Penyiapan Biomassa Alga Spirulina sp ... 25
2. Karakterisasi Material ... 25
3. Uji Adsorpsi ... 25
a. Penentuan Dosis Alga Spirulina sp Optimum ... 25
b. Penentuan pH Optimum ... 26
c. Penentuan Waktu Kontak Optimum ... 26
d. Penentuan Konsentrasi Logam Optimum ... 27
IV. HASIL DAN PEMBAHASAN A. Karakterisasi Material ... 28
B. Uji Adsorpsi ... 29
1. Penentuan Dosis Biomassa Alga Spirulina sp Optimum ... 29
2. Penentuan pH Optimum ... 31
3. Penentuan Waktu Kontak Optimum ... 33
4. Penentuan Konsentrasi Logam Optimum ... 34
C. Penentuan Laju Adsorpsi ... 36
D. Penentuan Kapasitas dan Energi Adsorpsi ... 39
V. KESIMPULAN DAN SARAN A.Kesimpulan ... 45
VI. DAFTAR PUSTAKA ... 47
DAFTAR TABEL
Tabel Halaman
1. Parameter kinetika adsorpsi ion Ca2+, Cu2+, dan Cd2+ terhadap biomassa alga Spirulina sp pada pH 5; konsentrasi
ion logam 100 ppm; T=27oC ... 36 2. Parameter isoterm adsorpsi Langmuir dan Freundlich
ion Ca2+, Cu2+, dan Cd2+ terhadap biomassa alga Spirulina sp
pada pH 5; waktu kontak 45 menit; T=27oC ... 39 3. Adsorpsi ion Ca2+, Cu2+ dan Cd2+ oleh biomassa alga
Spirulina sp dengan variasi dosis biomassa alga Spirulina sp ... 53 4. Adsorpsi ion Ca2+, Cu2+, dan Cd2+ oleh biomassa alga
Spirulina sp dengan variasi pH ... 53 5. Adsorpsi ion Ca2+, Cu2+, dan Cd2+ oleh biomassa alga
Spirulina sp dengan variasi waktu kontak ... 53 6. Adsorpsi ion Ca2+, Cu2+, dan Cd2+ oleh biomassa alga
Spirulina sp dengan variasi konsentrasi logam ... 54 7. Data perhitungan hasil kinetika pseudo orde satu
pada adsorpsi ion Ca2+ terhadap biomassa alga Spirulina sp ... 54 8. Data perhitungan hasil kinetika pseudo orde satu
pada adsorpsi ion Cu2+ terhadap biomassa alga Spirulina sp ... 55 9. Data perhitungan hasil kinetika pseudo orde satu
pada adsorpsi ion Cd2+ terhadap biomassa alga Spirulina sp ... 56 10. Data perhitungan hasil kinetika pseudo orde dua
pada adsorpsi ion Ca2+ terhadap biomassa alga Spirulina sp ... 56 11. Data perhitungan hasil kinetika pseudo orde dua
12. Data perhitungan hasil kinetika pseudo orde dua
pada adsorpsi ion Cd2+ terhadap biomassa alga Spirulina sp ... 58 13. Data perhitungan menggunakan model isoterm Langmuir
pada biomassa alga Spirulina sp terhadap ion Ca2+ ... 59 14. Data perhitungan menggunakan model isoterm Langmuir
pada biomassa alga Spirulina sp terhadap ion Cu2+ ... 60 15. Data perhitungan menggunakan model isoterm Langmuir
pada biomassa alga Spirulina sp terhadap ion Cd2+ ... 62 16. Data perhitungan menggunakan model isoterm Freundlich
pada biomassa alga Spirulina sp terhadap ion Ca2+ ... 63 17. Data perhitungan menggunakan model isoterm Freundlich
pada biomassa alga Spirulina sp terhadap ion Cu2+ ... 64 18. Data perhitungan menggunakan model isoterm Freundlich
DAFTAR GAMBAR
Gambar Halaman
1. Kurva Isoterm Adsorpsi Langmuir ... 19 2. Kurva Isoterm Adsorpsi Freundlich ... 20 3. Spektrum biomassa alga Spirulina sp ... 28 4. Adsorpsi ion Ca2+, Cu2+, dan Cd2+ dengan variasi dosis
biomassa alga Spirulina sp ... 30 5. Adsorpsi ion Ca2+, Cu2+, dan Cd2+ oleh biomassa alga
Spirulina sp pada rentang pH 3 – 7 ... 31 6. Adsorpsi ion Ca2+, Cu2+, dan Cd2+ oleh biomassa alga
Spirulina sp dengan variasi waktu kontak ... 33 7. Adsorpsi ion Ca2+, Cu2+, dan Cd2+ oleh biomassa alga
Spirulina sp dengan variasi konsentrasi logam ... 35 8. Kurva kinetika pseudo orde satu pada adsorpsi ion Ca2+
terhadap biomassa alga Spirulina sp ... 37 9. Kurva kinetika pseudo orde dua pada biomassa alga Spirulina sp
dengan ion (a) Ca2+, (b) Cu2+, dan (c) Cd2+ ... 38 10. Kurva menggunakan model isoterm Langmuir pada
biomassa alga Spirulina sp dengan ion (a) Ca2+, (b) Cu2+,
dan (c) Cd2+ ... 41 11. Kurva menggunakan model isoterm Freundlich pada
biomassa alga Spirulina sp dengan ion (a) Ca2+, (b) Cu2+,
I.PENDAHULUAN
A.Latar Belakang Masalah
Seiring dengan semakin majunya perkembangan di bidang industri, semakin besar pula dampak yang ditimbulkan, terutama terjadinya peningkatan dalam masalah pencemaran lingkungan. Salah satu pencemaran yang terjadi melalui media air adalah pencemaran logam berat. Logam berat banyak digunakan karena sifatnya yang dapat menghantarkan listrik dan panas serta dapat membentuk logam paduan dengan logam lain (Raya, 1998). Beberapa ion logam pencemar air yang cukup berbahaya adalah Cd, Pb, Zn, Hg, Cu, dan Fe. Logam berat merupakan unsur logam yang memiliki berat molekul tinggi. Dalam kadar rendah, logam berat pada umumnya sudah cukup beracun bagi tumbuhan dan hewan, termasuk manusia (Krauskopf, 1979). Selain logam berat, di perairan juga terkandung logam alkali tanah. Contoh dari logam alkali tanah yaitu Be, Mg, dan Ca. Logam Ca tidak berbahaya tetapi apabila logam ini masuk ke dalam tubuh dalam jumlah yang berlebihan maka akan menimbulkan dampak yang buruk bagi tubuh.
Oleh karena itu perlu dilakukan upaya penurunan konsentrasi logam di
air buangan, seperti pengendapan secara kimia, koagulasi, kompleksasi, ekstraksi pelarut, separasi dengan membran, pertukaran ion dan adsorpsi. Dari berbagai teknik tersebut adsorpsi sering digunakan karena prosesnya yang relatif sederhana dan biaya yang diperlukan relatif murah (Patel and Suresh, 2008; Gupta and Rastogi, 2008).
Metode adsorpsi umumnya berdasarkan interaksi ion logam dengan gugus fungsional yang ada pada permukaan adsorben melalui interaksi pembentukan kompleks dan biasanya terjadi pada permukaan padatan yang kaya gugus fungsional seperti –OH, -NH, -SH, dan –COOH (Stum and Morgan, 1996). Keberhasilan proses adsorpsi ion logam sangat ditentukan oleh kuat lemahnya interaksi yang terjadi antara ion logam sebagai adsorbat dengan situs aktif (gugus fungsional) pada adsorben, karena gugus fungsi yang dimiliki oleh adsorben dan sifat dari spesies ion logam yang terikat merupakan faktor penting untuk dapat terjadinya adsorpsi (Buhani et al., 2010). Material yang sering digunakan sebagai adsorben logam berat yaitu kitosan (Veera et al., 2003), rumput laut (Seki and Suzuki, 1998), dan mikroalga (Cerventes et al., 2001).
biomassa alga Spirulina sp sebagai adsorben logam berat telah diketahui dari hasil penelitian terdahulu, seperti biomassa alga Spirulina sp sangat efisien dalam mengurangi ion Cu(II) dari air buangan (Al-Homaidan et al., 2013).
Spirulina sp merupakan salah satu jenis alga hijau yang banyak ditemukan di perairan laut Indonesia, namun belum banyak digunakan sebagai adsorben. Biomassa alga merupakan salah satu material alam yang memiliki gugus aktif yang berperan dalam mengikat ion logam dan memiliki kelimpahan yang cukup banyak di wilayah perairan Indonesia. Biomassa dari beberapa spesies alga efektif untuk mengikat ion logam dari lingkungan perairan (Harris and Ramelow, 1990), karena biomassa alga mengandung beberapa gugus fungsi yang dapat berperan sebagai ligan terhadap ion logam (Buhani and Suharso, 2009; Gupta and Rastogi, 2008). Gugus fungsi tersebut terutama adalah gugus karboksil, hidroksil, sulfudril, amino, imidazol, sulfat, dan sulfonat yang terdapat didalam dinding sel dalam sitoplasma (Putra, 2006).
B.Tujuan Penelitian
Berdasarkan latar belakang masalah yang telah diuraikan sebelumnya, maka penelitian ini dilakukan dengan tujuan:
1. mengetahui dosis biomassa alga optimum, pH optimum, waktu adsorpsi optimum, dan konsentrasi logam optimum untuk proses penyerapan ion-ion Ca2+, Cu2+, dan Cd2+ oleh biomassa alga Spirulina sp;
2. mempelajari kinetika dan isoterm adsorpsi ion-ion Ca2+, Cu2+, dan Cd2+ oleh biomassa alga Spirulina sp.
C.Manfaat Penelitian
II. TINJAUAN PUSTAKA
A.Biomassa Alga
Mikroalga merupakan kelompok tumbuhan berukuran renik yang termasuk
dalam kelas alga, diameternya antara 3-30 m, baik sel tunggal maupun koloni yang hidup di seluruh wilayah perairan tawar maupun laut, yang lazim disebut
fitoplankton. Di dunia mikrobia, mikroalga termasuk eukariotik, umumnya
bersifat fotosintetik dengan pigmen fotosintetik hijau (klorofil), coklat
(fikosantin), biru kehijauan (fikobilin), dan merah (fikoeritrin). Morfologi
mikroalga berbentuk uniseluler atau multiseluler tetapi belum ada pembagian
tugas yang jelas pada sel-sel komponennya. Hal itulah yang membedakan
mikroalga dari tumbuhan tingkat tinggi (Romimohtarto, 2004). Dalam biomassa
mikroalga terkandung bahan-bahan penting yang sangat bermanfaat, misalnya
protein, karbohidrat, lemak, dan asam nukleat. Persentase keempat komponen
beraturan) yang merupakan rantai, berwarna hijau kebiruan. Filamen mikroalga ini merupakan rangkaian sel yang disebut trichome. Umumnya bentuk sel
Spirulina sp dapat terdiri dari salah satu bentuk berikut yaitu diskus, isodiametris, atau silindris (Herianti and Pratiwi, 1987). Spirulinasp memiliki kandungan protein sebesar 46 – 43, karbohidrat 8 – 14, lemak 4 – 9, dan asam nukleat 2 – 5% (Becker, 1994).
Menurut Herianti and Pratiwi (1987) mengklasifikasikan Spirulina sp sebagai berikut:
Divisi : Cyanophyta Ordo : Oscillatoriales Sub Ordo : Oscillatorineae Famili : Oscillatoriceae Genus : Spirulina Spesies : Spirulina sp
Secara umum, keuntungan pemanfaatan alga sebagai bioindikator dan biosorben adalah:
1. alga mempunyai kemampuan yang cukup tinggi dalam mengadsorpsi logam berat karena di dalam alga terdapat gugus fungsi yang dapat melakukan pengikatan dengan ion logam. Gugus fungsi tersebut terutama gugus karboksil, hidroksil, amina, sulfudril, imadazol, sulfat, dan sulfonat yang terdapat dalam dinding sel dalam sitoplasma;
4. tidak perlu nutrisi tambahan.
Alga dapat dijadikan alternatif adsorben yang cukup potensial dalam rangka meminimalisasi pencemaran air yang disebabkan oleh logam berat. Selain itu, berkaitan dengan adsorpsi, alga memiliki dua karakteristik yang penting, yaitu secara struktural, alga memiliki sejumlah situs aktif pada dinding selnya (polisakarida dan protein, beberapa diantaranya mengandung gugus karboksil, sulfat, amino) yang dapat menjadi binding sites ion-ion logam. Selain itu, pada permukaan alga terdapat pori-pori yang memberikan peluang untuk terjadinya proses adsorpsi secara fisik (Susilawati, 2009). Suatu lingkungan yang memiliki tingkat kandungan logam berat yang melebihi jumlah yang diperlukan, dapat mengakibatkan pertumbuhan alga terhambat, sehingga dalam keadaan ini
eksistensi logam dalam lingkungan adalah polutan bagi alga. Adapun syarat utama suatu alga sebagai bioindikator adalah harus memiliki daya tahan tinggi terhadap toksisitas akut maupun toksisitas kronis (Harris and Ramelow, 1990).
B. Logam
berlangsung sangat cepat sejak dimulainya revolusi industri (Nriagu, 1979). Menurut Darmono (1995), faktor yang menyebabkan logam berat termasuk dalam kelompok zat pencemar adalah karena adanya sifat-sifat logam berat yang tidak dapat terurai (non degradable) dan mudah diabsorbsi. Sumber utama pencemaran oleh logam berat disebabkan oleh pembakaran bahan bakar fossil, pertambangan dan peleburan bijih logam , limbah domestik, pupuk, pestisida dan lain-lain. Umumnya, logam berat yang menyebabkan pencemaran adalah Cd, Cr, Cu, Hg, Pb dan Zn (Kabata-Pendias and Pendias, 1989).
Logam berat digolongkan menjadi dua jenis yaitu logam berat esensial dan non esensial. Logam berat esensial adalah logam yang keberadaannya dalam jumlah tertentu sangat dibutuhkan oleh organisme hidup, namun dalam jumlah yang berlebihan dapat menimbulkan efek racun. Contoh logam berat ini adalah Zn, Cu, Fe, Co, Mn, sedangkan logam berat non esensial yaitu logam yang keberadaannya dalam tubuh belum diketahui manfaatnya atau bahkan dapat bersifat racun, seperti Hg, Cd, Pb, Cr. Logam ini dapat menimbulkan efek kesehatan bagi manusia tergantung pada bagaimana logam berat tersebut terikat dalam tubuh. Daya racun yang dimiliki akan bekerja sebagai penghalang kerja enzim, selain itu logam berat ini akan bertindak sebagai penyebab alergi, mutagen atau karsinogen bagi
manusia (Putra, 2006).
Lewis yang menjadi donor pasangan elektron. Dengan demikian, prinsip-prinsip yang berlaku dalam interaksi asam-basa Lewis dapat digunakan dalam adsorpsi ion logam (Keenan and Kleinfelter, 1984).
Pearson (1963) mengklasifikasikan asam-basa Lewis menurut sifat keras dan lemahnya. Menurut Pearson, situs aktif pada permukaan padatan dapat dianggap sebagai ligan yang dapat mengikat logam secara selektif. Logam dan ligan
dikelompokkan menurut sifat keras dan lemahnya berdasarkan pada polarisabilitas unsur. Pearson (1963) mengemukakan suatu prinsip yang disebut Hard and Soft Acid Base (HSAB). Ligan-ligan dengan atom yang sangat elektronegatif dan berukuran kecil merupakan basa keras, sedangkan ligan-ligan dengan atom yang elektron terluarnya mudah terpolarisasi akibat pengaruh ion dari luar merupakan basa lemah. Sedangkan ion-ion logam yang berukuran kecil namun bermuatan positif besar, elektron terluarnya tidak mudah dipengaruhi oleh ion dari luar, ini dikelompokkan ke dalam asam keras, sedangkan ion-ion logam yang berukuran besar dan bermuatan kecil atau nol, elektron terluarnya mudah dipengaruhi oleh ion lain, dikelompokkan ke dalam asam lemah.
Menurut prinsip HSAB, asam keras akan berinteraksi dengan basa keras untuk membentuk kompleks, begitu juga asam lemah dengan basa lemah. Interaksi asam keras dengan basa keras merupakan interaksi ionik, sedangkan interaksi asam lemah dengan basa lemah, interaksinya lebih bersifat kovalen.
dalam tubuh dalam jumlah yang berlebihan maka akan menimbulkan dampak yang buruk bagi tubuh.
Dalam penelitian ini digunakan tiga macam logam diantaranya yaitu:
1. Kalsium (Ca)
gangguan ginjal yang menimbulkan batu ginjal, maka tidak boleh mengkonsumsi sekitar 2500 mg (Almatsier, 2002).
2. Tembaga (Cu)
Tembaga adalah suatu unsur kimia dalam tabel periodik yang memiliki lambang Cu dan nomor atom 29. Tembaga murni sifatnya halus dan lunak, dengan permukaan berwarna jingga kemerahan. Tembaga dicampurkan dengan timah untuk membuat perunggu (Cotton and Wilkinson, 1989). Di dalam penelitian ini digunakan senyawa CuSO4•5H2O dimana nilai kelarutannya dalam air yaitu 320 g/L. Unsur tembaga dialam ditemukan dalam bentuk logam bebas atau
persenyawaan. Logam tembaga dikelompokkan ke dalam logam penghantar listrik yang baik. Dalam bidang industri senyawa tembaga banyak digunakan seperti industri cat sebagai antifouling, industri peptisida dan fungisida. Logam Cu termasuk logam berat essensial, jadi meskipun beracun tetapi sangat dibutuhkan manusia dalam jumlah yang kecil. Toksisitas yang dimiliki Cu baru akan bekerja bila telah masuk ke dalam tubuh organisme dalam jumlah yang besar atau melebihi nilai toleransi organisme terkait (Palar, 1994).
3. Kadmium (Cd)
mempunyai titik lebur 321oC (Susilawati, 2009). Cd adalah logam berat yang termasuk dalam golongan II B dalam sistem periodik. Logam ini akan mudah bereaksi dengan ligan-ligan yang mengandung unsur-unsur O, S dan N. Di dalam penelitian ini digunakan senyawa CdSO4•8H2O dimana nilai kelarutannya dalam air yaitu 76.4 g/100 mL. Dalam tubuh logam ini bersifat toksik, karena bereaksi dengan ligan-ligan yang penting untuk fungsi normal tubuh (Alfian, 2005). Kadmium juga berbahaya karena elemen ini beresiko tinggi terhadap pembuluh darah. Kadmium berpengaruh terhadap manusia dalam jangka waktu panjang dan dapat terakumulasi pada tubuh khususnya hti dan ginjal. Menurut teori, pada konsentrasi rendah berefek terhadap gangguan pada paru-paru, emphysema dan
renal turbular disease acidosis yang kronis (Susilawati, 2009).
C.Adsorpsi
akumulasi sejumlah molekul, ion atau atom yang terjadi pada batas antara dua fasa. Adsorpsi menyangkut akumulasi atau pemusatan substansi adsorbat pada adsorben dan dalam hal ini dapat terjadi pada antar muka dua fasa. Fasa yang menyerap disebut adsorben dan fasa yang terserap disebut adsorbat. Kebanyakan adsorben adalah bahan-bahan yang memiliki pori karena berlangsung terutama pada dinding-dinding pori atau letak-letak tertentu didalam adsorben.
Gaya tarik-menarik dari suatu padatan dibedakan menjadi dua jenis yaitu gaya fisika dan gaya kimia yang masing-masing menghasilkan adsorpsi fisika
(physisorption) dan adsorpsi kimia (chemisorption). Adsorpsi fisika adalah proses interaksi antara adsorben dengan adsorbat yang melibatkan gaya-gaya antar molekul seperti gaya van der Waals. Molekul terikat sangat lemah dan energi yang dilepaskan pada adsorpsi fisika relatif rendah sekitar 20 kJ/mol (Castellan, 1982). Sedangkan pada adsorpsi kimia, interaksi adsorben dan adsorbat
1. Faktor-faktor yang Mempengaruhi Proses Adsorpsi
Secara umum, proses adsorpsi dipengaruhi oleh beberapa faktor antara lain (Oscik, 1982):
1.1.Sifat adsorbat
Besarnya adsorpsi zat terlarut tergantung pada kelarutannya dalam pelarut. Kenaikan kelarutan menunjukkan ikatan yang kuat antara zat terlarut dan pelarut dan aksi sebaliknya terhadap adsorpsi oleh adsorben. Makin besar kelarutannya, ikatan antara zat terlarut dengan pelarut makin kuat sehingga adsorpsi akan semakin kecil karena sebelum adsorpsi terjadi diperlukan energi yang besar untuk memecah ikatan zat terlarut dengan pelarut.
1.2.Sifat adsorben
Luas permukaan adsorben sangat berpengaruh terutama untuk tersedianya tempat adsorpsi. Adsorpsi merupakan suatu kejadian permukaan sehingga besarnya adsorpsi sebanding dengan luas permukaan spesifik. Makin besar luas permukaan makin besar pula adsorpsi yang terjadi.
1.3.pH larutan
1.4.Konsentrasi adsorbat
Pada umumnya adsorpsi akan meningkat dengan kenaikan konsentrasi adsorbat tetapi tidak berbanding lurus. Adsorpsi akan konstan jika terjadi kesetimbangan antara konsentrasi adsorbat yang diserap dengan konsentrasi yang tersisa dalam larutan.
1.5.Temperatur
Reaksi yang terjadi pada adsorpsi biasanya eksotermis, oleh sebab itu adsorpsi akan besar jika temperatur rendah.
1.6.Waktu kontak dan pengocokan
Waktu kontak yang cukup diperlukan untuk mencapai kesetimbangan adsorpsi. Jika fase cairan yang berisi adsorben diam, maka difusi adsorbat melalui
permukaan adsorben akan lambat. Oleh karena itu diperlukan pengocokan untuk mempercepat proses adsorpsi.
2. Parameter Adsorpsi
2.1.Kinetika Adsorpsi
tidak berkaitan dengan stoikiometri reaksi. Sebaliknya, kinetika diatur oleh proses mekanisme, yaitu dengan jumlah spesies yang bertabrakan untuk terjadinya reaksi. Selain itu, kinetika juga dapat digunakan untuk menentukan kecepatan adsorpsi yang berlangsung dan menentukan kapasitas keseimbangan yang dapat dimanfaatkan dalam situasi yang dinamis dan praktis. Tingkat adsorpsi
keseluruhan dipengaruhi oleh perubahan sifat dan komponen pelarut, serta ukuran partikel dan suhu. Kinetika reaksi adsorpsi juga tergantung pada gugus fungsional dan konsentrasi. Tingginya tingkat substitusi gugus fungsional pada polimer inert dapat meningkatkan laju reaksi keseluruhan (Allen et al., 2004).
Analisis kinetika didasarkan pada kinetika reaksi terutama pseudo orde pertama atau mekanisme pseudo pertama bertingkat. Untuk meneliti mekanisme adsorpsi, konstanta kecepatan reaksi sorpsi kimia untuk ion-ion logam,digunakan
persamaan sistem pseudo order pertama oleh Lagergren dan mekanisme pseudo order kedua (Buhani et al., 2010). Persamaan ini digunakan untuk menguji data percobaan dari konsentrasi awal, suhu dan berat ion-ion logam dalam larutan (Zhang et al., 2003). Model kinetika (pseudo urutan pertama dan persamaan orde dua) dapat digunakan dengan asumsi bahwa konsentrasi diukur sama dengan konsentrasi permukaan adsorben. Tingkat persamaan urutan pertama Lagergren adalah salah satu yang paling banyak digunakan untuk adsorpsi zat terlarut dari larutan cair (Liu et al., 2004).
Untuk konstanta laju kinetika pseudo orde satu:
Dengan qeadalah jumlah ion logam divalen yang teradsorpsi (mg/g) pada waktu
keseimbangan, qt adalah jumlah ion logam divalen yang teradsorpsi pada waktu t
(menit), k1 adalah konstanta kecepatan adsorpsi (jam-1). Integrasi persamaan ini
dengan kondisi batas t =0 sampai t=t dan qt = qt, memberikan: Dengan menggunakan regreasi linear dan mengalurkan ln(qe– qt ) terhadap t
diperoleh konstanta k1. Untuk konstanta kecepatan reaksi pseudo orde kedua
proses kemisorpsi:
Dengan k2konstanta keseimbangan order kedua kemisorpsi (g/mg.jam). Model
kinetika pseudo order kedua dapat disusun untuk mendapatkan bentuk linear :
e
a. Isoterm adsorpsi Langmuir
Menurut Oscik (1982), teori Langmuir menjelaskan bahwa pada permukaan adsorben terdapat sejumlah tertentu situs aktif yang sebanding dengan luas permukaan. Setiap situs aktif hanya satu molekul yang dapat diadsorpsi. Ikatan antara zat yang teradsorpsi dengan adsorben dapat terjadi secara fisika atau secara kimia. Ikatan tersebut harus cukup kuat untuk mencegah perpindahan molekul yang telah teradsorpsi sepanjang permukaan adsorben.
Model adsorpsi isoterm Langmuir dapat dinyatakan dalam persamaan: (6)
dimana C adalah konsentrasi kesetimbangan, m adalah jumlah zat yang
teradsorpsi per gram adsorben, b adalah kapasitas adsorpsi dan K adalah tetapan kesetimbangan adsorpsi. Dengan kurva linier hubungan antara C/m versus C, maka dapat ditentukan nilai b dari kemiringan (slop) dan K dari intersep kurva. Energi adsorpsi (Eads) yang didefinisikan sebagai energi yang dihasilkan apabila satu mol ion logam teradsorpsi dalam adsorben dan nilainya ekuivalen dengan nilai negatif dari perubahan energi bebas Gibbs standar, ∆G0, dapat dihitung menggunakan persamaan:
(7) Dengan R adalah tetapan gas umum (8,314 J/mol K), T temperatur (K) dan K
adalah tetapan kesetimbangan adsorpsi yang diperoleh dari persamaan Langmuir dan energi total adsorpsi adalah sama dengan energi bebas Gibbs (Oscik, 1982).
Kurva isoterm adsorpsi Langmuir dapat disajikan seperti pada Gambar 1.
Gambar 1. Kurva isoterm adsorpsi Langmuir (Oscik and Cooper, 1994).
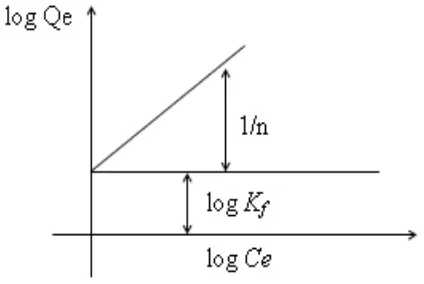
b. Isoterm adsorpsi Freundlich
Model isoterm Freundlich menjelaskan bahwa proses adsorpsi pada bagian permukaan adalah heterogen dimana tidak semua permukaan adsorben mempunyai daya adsorpsi. Model isoterm Freundlich menunjukkan lapisan adsorbat yang terbentuk pada permukaan adsorben adalah multilayer. Hal tersebut berkaitan dengan ciri-ciri dari adsorpsi secara fisika dimana adsorpsi dapat terjadi pada banyak lapisan (multilayer) (Husin and Rosnelly, 2005). Asumsi yang digunakan :
i) Tidak ada asosiasi dan disosiasi molekul-molekul adsorbat setelah teradsorpsi pada permukaan padatan.
ii) Hanya berlangsung mekanisme adsorpsi secara fisis tanpa adanya adsorpsi kimia.
iii)Permukaan padat bersifat heterogen (Noll et al., 1992).
Bentuk persamaan Freundlich adalah sebagai berikut:
Dimana:
Qe = Banyaknya zat yang terserap per satuan berat adsorben (mol/g)
Ce = Konsentrasi adsorbat pada saat kesetimbangan (mol/L) n = Kapasitas adsorpsi maksimum (mol/g)
Kf= Konstanta Feundlich (L/mol)
Persamaan di atas dapat diubah kedalam bentuk linier dengan mengambil bentuk logaritmanya:
(9)
Sehingga kurva isoterm adsorpsinya disajikan pada Gambar 2.
Gambar 2. Kurva isoterm adsorpsi Freundlich (Rousseau, 1987).
Bentuk linear dapat digunakan untuk menentukan kelinearan data percobaan dengan cara mengeplotkan C/Q terhadap Ce. Konstanta Freundlich Kfdapat
diperoleh dari kemiringan garis lurusnya dan 1/n merupakan harga slop. Bila n diketahui Kf dapat dicari, semakin besar harga Kfmaka daya adsorpsi akan
semakin baik dan dari harga Kfyang diperoleh, maka energi adsorpsi akan dapat
Selain itu, untuk menentukan jumlah logam teradsorpsi, rasio distribusi dan koefisien selektivitas pada proses adsorpsi ion logam terhadap adsorben alga
Spirulina sp dapat digunakan persamaan berikut:
Q = (Co-Ca)V/W (10)
Dimana Q menyatakan jumlah logam teradsorpsi (mg/g), Co dan Ca menyatakan konsentrasi awal dan kesetimbangan dari ion logam (mmol/L), W adalah massa adsorben (g), V adalah volume larutan ion logam (L) (Buhani et al., 2009).
D.Karakterisasi Material
1. Spektrofotometer Infrared (IR)
Spektrofotometer IR adalah spektrofotometer yang memanfaatkan sinar IR dekat, yakni sinar yang berada pada jangkauan panjang gelombang 2,5 - 25 m atau jangkauan frekuensi 400 - 4000 cm-1. Sinar ini muncul akibat vibrasi atom-atom pada posisi kesetimbangan dalam molekul dan kombinasi vibrasi dengan rotasi menghasilkan spektrum vibrasi-rotasi (Khopkar, 2001).
Spektrum inframerah suatu molekul adalah hasil transisi antara tingkat energi getaran (vibrasi) atau osilasi (oscillation). Bila molekul menyerap radiasi
inframerah, energi yang diserap menyebabkan kenaikan dalam amplitudo getaran atom-atom yang terikat itu. Jadi molekul ini berada pada keadaan vibrasi
eksak dari absorpsi oleh suatu tipe ikatan, bergantung pada macam getaran dari ikatan tersebut. Oleh karena itu, tipe ikatan yang berlainan menyerap radiasi inframerah pada panjang gelombang yang berlainan. Dengan demikian spektrofotometer inframerah dapat digunakan untuk mengidentifikasi adanya gugus fungsi dalam suatu molekul (Supratman, 2010).
2. Spektrofotometer Serapan Atom (SSA)
Metode analisis SSA didasarkan pada penyerapan energi radiasi pada panjang gelombang tertentu oleh atom-atom netral pada keadaan dasarnya (ground state) dalam bentuk gas. Penyerapan energi radiasi dengan panjang gelombang ( ) tertentu mengakibatkan terjadinya transisi elektronik dari tingkat energi dasar yang merupakan konfigurasi elektron yang paling stabil ke tingkat energi yang lebih tinggi (excited state).
SSA merupakan salah satu metode analisis logam yang sangat selektif dan sensitif, karena setiap atom memiliki garis resonansi yang spesifik. SSA digunakan untuk menentukan kadar unsur-unsur logam dan semi logam yang konsentrasinya relatif rendah di dalam sebuah sampel. Kebanyakan analisis SSA menggunakan nyala untuk atomisasi unsur yang dianalisis. Intensitas radiasi yang diserap sebanding dengan jumlah atom yang ada.
menyatakan bahwa banyaknya sinar yang diserap sebanding dengan banyaknya atom yang ada dalam nyala atomisasi. Pengamatan banyaknya sinar yang diserap ini dilakukan dengan membandingkan intensitas radiasi sebelum diserap dengan intensitas radiasi setelah diserap oleh atom-atom pada tingkat energi dasar.
Suatu sampel pertama-tama harus dilarutkan (dekstruksi) yang bertujuan untuk membuat unsur logam menjadi ion logam yang bebas. Kemudian larutan sampel dimasukkan ke dalam nyala dalam bentuk aerosol yang selanjutnya akan
membentuk atom-atomnya. Pada suhu nyala udara-asetilen (2300oC), atom dari sejumlah banyak unsur berada dalam keadaan dasar. Sumber emisi sinar yang digunakan adalah lampu katoda berongga yang mempunyai garis spektra yang tajam.
Lima komponen dasar instrumen SSA adalah sebagai berikut:
a. Sumber sinar, berfungsi untuk mengemisikan spektrum spesifik untuk analit yang akan diukur;
b. Sel sampel, sebagai wadah analit yang akan diukur dengan emisi dari sumber sinar;
c. Monokromator, untuk memonokromatiskan cahaya dari nyala pembakar; d. Detektor, biasanya digunakan photomultiplier tube yang berfungsi untuk
mengubah energi sinar menjadi energi listrik;
e. Rekorder, merupakan sistem pembacaan data dari instrumen elektronik (Skoog
III. METODOLOGI PENELITIAN
A.Waktu dan Tempat
Penelitian ini telah dilaksanakan pada bulan Maret sampai Mei 2014 di
Laboratorium Kimia Anorganik FMIPA Universitas Lampung. Penyiapan alga
Spirulina sp di Balai Besar Pengembangan Budidaya Laut Lampung (BBPBL).
B.Alat dan Bahan
Peralatan yang digunakan pada penelitian ini antara lain alat-alat gelas yang biasa
digunakan di laboratorium, yaitu labu erlenmeyer, spatula, pengaduk, gelas
kimia, gelas ukur, pipet tetes, corong, neraca analitis, oven, labu ukur, pH
indikator universal, spektrofotometer IR dan SSA.
Bahan-bahan yang digunakan pada penelitian ini adalah, biomassa alga Spirulina
sp, akuades, larutan CaCl2•2H2O, larutan CuSO4•5H2O, larutan CdSO4•8H2O,
C.Prosedur Penelitian
1. Penyiapan Biomassa Alga Spirulina sp
Biomassa alga Spirulina sp dipreparasi di Balai Besar Pengembangan Budidaya Laut ( BBPBL) dan didapatkan alga berbentuk nata. Alga yang diperoleh kemudian dikeringkan tanpa terkena sinar matahari selama 3 hari, kemudian dioven pada suhu 40oC selama 2-3 jam. Setelah dioven alga digerus hingga berukuran 200 mesh.
2. Karakterisasi Material
Biomassa alga Spirulina sp dikarakterisasi menggunakan spektrofotometer IR untuk mengetahui gugus-gugus fungsionalnya.
3. Uji Adsorpsi
a. Penentuan Dosis Biomassa Alga Spirulina sp Optimum
Biomassa alga Spirulina sp sebanyak 0,1; 0,2; 0,3; 0,4; dan 0,5 gram masing-masing dimasukkan ke dalam labu erlenmeyer dan ditambahkan 25 mL larutan
larutan dengan SSA. Prosedur ini diterapkan untuk larutan ion Cu2+ dan Cd2+ 100 ppm.
b. Penentuan pH Optimum
Dosis biomassa alga Spirulina sp optimum (percobaan a) dimasukkan ke dalam 6 labu erlenmeyer. Kemudian sebanyak 25 mL larutan ion Ca2+ 100 ppmyang telah diatur pHnya ditambahkan ke dalam masing-masing labu erlenmeyer. pH yang digunakan, yaitu 3, 4, 5, 6, dan 7. Lalu diaduk dengan pengaduk selama 1 jam. Kemudian larutan disentrifus dan filtratnya diambil untuk dianalisis kadar logam yang tersisa dalam larutan dengan SSA. Prosedur ini diterapkan juga untuk larutan
ion Cu2+ dan Cd2+ 100 ppm (Buhani et al., 2010).
c. Penentuan Waktu Kontak Optimum
d. Penentuan Konsentrasi Logam Optimum
Dosis biomassa alga Spirulina sp optimum (percobaan a) dimasukkan ke dalam 6 labu erlenmeyer. Kemudian sebanyak 25 mL larutan ion Ca2+ 0, 25, 50, 100, 200 dan 300 ppm dengan pH optimum (percobaan b) ditambahkan ke dalam masing-masing labu erlenmeyer. Lalu diaduk dengan pengaduk selama waktu optimum (percobaan c). Kemudian larutan disentrifus dan filtratnya diambil untuk
V. KESIMPULAN DAN SARAN
A.Kesimpulan
Berdasarkan hasil yang diperoleh dari penelitian yang telah dilakukan maka dapat ditarik kesimpulan sebagai berikut:
1. Dosis biomassa alga Spirulina sp sebagai adsorben ion Ca2+, Cu2+, dan Cd2+ optimum pada 0,1 g, proses adsorpsi optimum pada pH 5, waktu kontak optimum pada menit ke-45, dan konsentrasi logam optimum pada 300 mg L-1.
2. Laju adsorpsi ion Ca2+, Cu2+, dan Cd2+ cenderung mengikuti kinetika pseudo orde dua dengan nilai k2 masing-masing sebesar 0,300; 0,090; dan 0,015 g mg-1 menit-1.
3. Isoterm adsorpsi ion Ca2+, Cu2+, dan Cd2+ cenderung mengikuti model isoterm adsoprsi Langmuir yang menghasilkan kapasitas adsorpsi masing-masing sebesar 22,52; 22,21; dan 21,25 mg g-1.
B.Saran
DAFTAR PUSTAKA
Adamson, A.W. and A.P. Gast. 1990. Physical Chemistry of Surface. 6th edition. John Wiley & Sons.Inc. New York.
Alberty, R.A., and F. Daniel. 1987. Physical Chemistry, 5th ed, SI Version. John Wiley and Sons Inc. New York.
Alfian, Z. 2005. Analisis kadar logam kadmium (Cd2+) dari kerang yang diperoleh dari daerah Belawan secara spektrofotometer serapan atom. J. Sains Kimia. 9(2): 73-76.
Al-Homaidan A. A., H. J. Al-Houri, A. A. Al-Hazzani, G. Elgaaly, and N. M. S. Moubayed. 2013. Biosorption of copper ions from aqueous solutions by
Spirulina plantesis biomass. Arabian J. of Chem. 7(1): 57–62.
Allen, S.J., G. Mckay, and J.F. Porter. 2004. Adsorption isotherm models for basic dye adsorption by peat in single and binary component systems. J. of Colloid and Interface Sci. 280: 322-333.
Almatsier, S. 2002. Prinsip Dasar Ilmu Gizi. Gramedia Pustaka Utama. Jakarta.
Amaria. 2005. Immobilisasi Saccharomyces cerevisiae Limbah Fermentasi Industri Bir melalui Pembentukan Sol-Gel Silika dan Aplikasinya untuk Adsorpsi Kation-kation Logam Berat. USU. Surabaya.
Atkins, P. W. 1999. Kimia Fisika Edisi Ke-2. Penerjemah Indarto Purnomo Wahyu. Erlangga. Jakarta.
Blais, J. F., B. Dufresne, and G. Mercier. 2000. State of the art of technologies for metal removal from industrial effluents. Rev. Sci. Eau. 12(4): 687-711.
Buhani, Narsito, Nuryono, and E.S. Kunarti. 2010. Production of metal ion
imprinted polymer from mercapto-silica through sol-gel process as selective adsorbent of cadmium. Desalination. 251: 83-89.
Buhani, Narsito, Nuryono, and E.S. Kunarti. 2009. Amino and mercapto-silica hybrid for Cd(II) adsorption in aqueous solution. Indo. J. Chem. 9(2): 170-176
Buhani and Suharso. 2009. Immobilization of Nannochloropsis sp biomass by sol-gel technique as adsorbent of metal ion Cu(II) from aqueous solution.
Asian J. Chem. 21(5): 3799-3808.
Buhani, Suharso and Sumadi. 2010. Adsorption kinetics and isotherm of Cd (II) ion on Nannochloropsis sp biomass imprinted ionic polymer. Desalination. 259: 140-146.
Buhani, Suharso, and Z. Sembiring. 2006. Biosorption of metal ions Pb(II), Cu(II), and Cd(II) on Sargassum duplicatum immobilized silica gel matrix. Indo. J. Chem. 6 (3): 245–250.
Castellan, G. W. 1982. Physical Chemistry Third Edition. General Graphic Services. New York.
Cerventes, C., J. Compos-Garcia, D. Silvia, F.G. Corona, H.L. Tavera, J. Gusman, and R.M. Sanchez. 2001. Interaction of chromium with microorganisms and plant. FEMS Microbiology Reviews, 25 : 335- 347.
Cotton, F.A. and G. Wilkinson. 1989. Kimia Anorganik Dasar. Terjemahan Sahati Suharto. Penerbit Universitas Indonesia (UI Press). Jakarta.
Gupta, V.K. and A. Rastogi, 2008. Biosorption of lead from aqueous solution by green algae Spyrogyra Species: kinetics and equilibrium studies. J. Hazard Mater. 152:407-414.
Harris, O. P., and J. G. Ramelow. 1990. Binding of metal ions by particulate quadricauda.Environt Science and Technology. 24 : 220-227.
Herianti dan E. Pratiwi. 1987. Kultur laboratoris Spirulina sp. J. Perikanan Laut No 44/1987. Balai Penenlitian Laut. Jakarta.
Huheey, J. E., E. A. Keiter and R. L. Keiter. 1993. Inorganic Chemistry: Principles of Structure and Reactivity. 4th edition. Harpelcolling College Publisher. New York.
Husin, G. dan C. M. Rosnelly. 2005. Studi Kinetika Adsorpsi Larutan Logam Timbal Menggunakan Karbon Aktif dari Batang Pisang. (Tesis).Fakultas Teknik Universitas Syiah Kuala Darrusalam. Banda Aceh.
Jin, X., G. W. Bailey, Y. S. Yu, and A. T. Lynch. 1996. Kinetics of single and multiple metal ion sorption processes on humic substances. Soil Science. 161:509-519.
Kabata-Pendias A. and H. Pendias. 1989. Trace Elements in the Soil and Plants. CRC Press. Boca Raton, FL.
Keenan, C.W. dan W. Kleinfelter. 1984. Ilmu Kimia untuk Universitas Edisi ke-6. Terjemahan Aloysius Hadyana Pudjaatmaka. Erlangga. Jakarta. Hal. 512-543.
Khasanah, E. N. 2006. Termodinamika Adsorpsi Ag(I) dan Ni(II) pada Hibrida Amino-Silika dari Abu Sekam Padi. (Skripsi). FMIPA-UGM. Yogyakarta.
Khopkar, S.M. 2001. Konsep Dasar Kimia Analitik. UI Press. Jakarta.
Liu, Y., X. Chang, S. Wang, Y. Guo, B. Din. and S. Meng. 2004. Solid-phase extraction and preconcentration of cadmium(II) in aqueous solution with Cd(II)-imprinted resin (poly-Cd(II)-DAAB-VP) packed columns. Analytica Chimica Acta. 519: 173-179.
Matsuoka. 2002. Mode of Occurance of Calcium in Various Coals. Fuel 81. Elsier Science Publishing. New York.
Mehta, S. K. and J. P. Gaurr. 2001. Removal of Ni and Cu from single and binary metal solutions by biosorption on the cone biomass of Thuja orientalis.
Process Biochem. 38: 1627-1631.
Noll, K.E., V. Gournaris. and W.S. Hou. 1992. Adsorption Technology for Air and Water Polution Control. pp.1-8. LewishPublisher Inc. Michigan.
Nriagu, J. O. 1979. Global inventory of natural and anthropogenic emissions of trace metals to the atmosphere. Nature. 279: 409-411.
Oscik, J. and I. L. Cooper. 1994. Adsorption. Ellis Horwood Publisher, Ltd. Chichester.
Oscik, J. 1982. Adsorption. John Willey & Sons, Inc. New York.
Palar, H . 1994. Pencemaran dan Toksikologi Logam Berat. Rineka Cipta. Bandung
Patel, R. and S. Suresh. 2008. Kinetic and equilibrium studies on the biosorption of reactive black 5 dye by Aspergillus foetidus. J. Bioresour. Technol. 99 (1): 51-58.
Pearson, R. G. 1963. Hard and Soft Acids and Bases. J. Am. Soc. 85: 3533-3539.
Rahmawati, A. and S. J. Santoso. 2012. Studi adsorpsi logam Pb(II) dan Cd(II) pada asam humat dalam medium air. Alchemy. 2(1): 46-57.
Raya, I. 1998. Studi Kinetika Adsorpsi Ion Logam Al(III) dan Cr(III) pada Adsorben Chaetoceros calcitrans yang Terimmobilisasi pada Silika Gel. (Tesis). FMIPA UGM. Yogyakarta.
Rezaei, H. 2013. Biosorption of chromium by using Spirulina sp. Arabian J. of Chem.
Rios, J. P., L. Bess-Oberto, K. J. Tiemann and Gardea-Torresdey. 1999.
Investigation of Metal Ion Binding by Agricultural by Product. Proceedings of the 1999 Conference on Hazardous Waste Research.
Rome, L. and G. M. Gadd. 1987. Copper adsorption by Rhizopus arrhizus,
Cladosarium resinae and Penicillium italicum. Appl. Microbiol. Biotech. 26: 84-90.
Romimohtarto, K. 2004. Meroplankton Laut. Penerbit Djambatan. Jakarta.
Rousseau, R. W. 1987. Handbook Of Separation Process Technology. John Wiley and Sons Inc. United States. pp.67.
Seki, I.H., and A. Suzuki. 1998. Biosorption of heavy metal ions to brown algae,
Macrocystis pyrifera, Kjellmamiella crassiforia, and Undaria pinnatifida. J. Colloid Interface. Sci. 206: 297-301.
Skoog., A. Douglas, F. James Holler, A. Timothy, and Nieman. 2000. Principles of Instrumental Analysis Fifth ed. Saunders College Publishing. London.
Stum W, and J.J. Morgan. 1996. Aquatic Chemistry. John Wiley and Sons. New York.
Susilawati. 2009. Studi Adsorpsi Ion Logam Cd(II) oleh Biomassa Alga Hijau yang Diimobilisasi pada Silika Gel. (Skripsi). Universitas Indonesia. Depok.
Svehla, G. 1990. Buku Teks Analisis Anorganik Kualitatif Makro dan Semimikro. Alih Bahasa Oleh L. Setiono dan A. H pudjaatmaka. PT. Kalman Media Pustaka. Jakarta.
Veera, M.B., A. Krishnala, L.T. Jonathan, and D.S. Edger. 2003. Removal of hexavalent chromium from wastewater using a new composite chitosan biosorben, J.Technol. Sci, 37 : 4449-4456.
Winarno, F. G. 1991. Kimia Pangan dan Gizi. Gramedia Pustaka Utama. Jakarta.
Zhang, L.Y., G.X. Chend, and C. Fu. 2003. Synthesis and characteristic of tyrosinase imprinted beads via suspension polymerization. Reaction FunctionalPolymer. 56: 167-173.
Lampiran 1. Penentuan Uji Adsorpsi
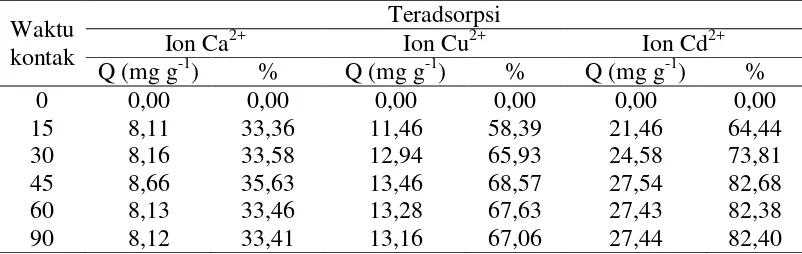
Tabel 3. Adsorpsi ion Ca2+, Cu2+, dan Cd2+ oleh biomassa alga Spirulina sp dengan variasi dosis biomassa alga Spirulina sp
Massa dengan variasi waktu kontak
Tabel 6. Adsorpsi ion Ca2+, Cu2+, dan Cd2+ oleh biomassa alga Spirulina sp dengan variasi konsentrasi logam
Konsentrasi
Lampiran 2. Penentuan Laju Adsorpsi
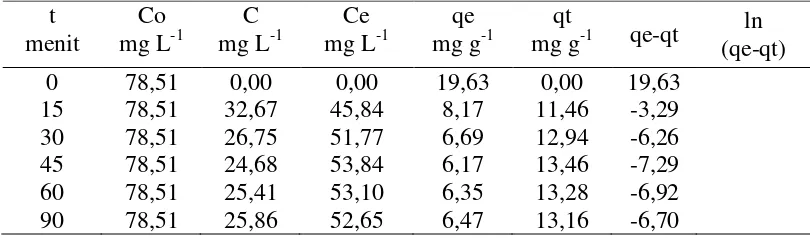
Tabel 7. Data perhitungan hasil kinetika pseudo orde satu pada adsorpsi ion Ca2+ terhadap biomassa alga Spirulina sp.
t
C : konsentrai ion logam pada keadaan setimbang (mg L-1)
Dari hasil data pada Tabel 7, didapat grafik sebagai berikut:
Gambar 12. Kurva kinetika pseudo orde satu pada adsorpsi ion Ca2+ terhadap biomassa alga Spirulina sp.
Hasil perhitungan kurva pada biomassa alga Spirulina sp terhadap ion Ca2+
Tabel 8. Data perhitungan hasil kinetika pseudo orde satu pada adsorpsi ion Cu2+ terhadap biomassa alga Spirulina sp.
Tabel 9. Data perhitungan hasil kinetika pseudo orde satu pada adsorpsi ion Cd2+ terhadap biomassa alga Spirulina sp.
t
Tabel 10. Data perhitungan hasil kinetika pseudo orde dua pada adsorpsi ion Ca2+ terhadap biomassa alga Spirulina sp.
t
Dari hasil data pada Tabel 10, didapat grafik sebagai berikut:
Hasil perhitungan kurva pada biomassa alga Spirulina sp terhadap ion Ca2+
Tabel 11. Data perhitungan hasil kinetika pseudo orde dua pada adsorpsi ion Cu2+ terhadap biomassa alga Spirulina sp.
t
Dari hasil data pada Tabel 11, didapat grafik sebagai berikut:
Hasil perhitungan kurva pada biomassa alga Spirulina sp terhadap ion Cu2+
Tabel 12. Data perhitungan hasil kinetika pseudo orde dua pada adsorpsi ion Cd2+ terhadap biomassa alga Spirulina sp.
t
Dari hasil data pada Tabel 12, didapat grafik sebagai berikut:
Hasil perhitungan kurva pada biomassa alga Spirulina sp terhadap ion Cd2+ sebagai berikut:
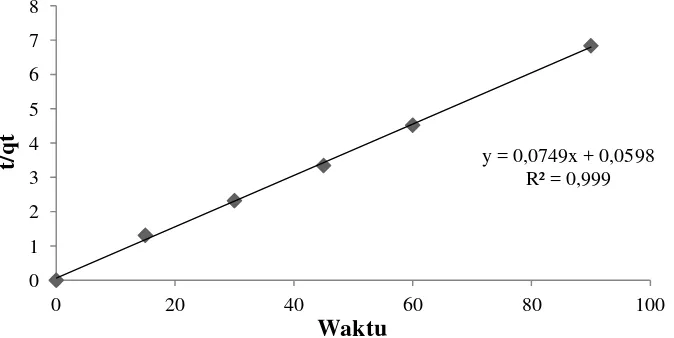
t/qt = 1/k2qe2 + t/qe
y = ax + b, Slop (a) = 1/qe dan Intersep (b) = 1/k2qe2 y = 0,0355x - 0,0846 a = 0,0355 dan b = 0,0846
h = 1/b = 1/0,0846 = 11,82 dan qe2 = 1/a = 1/0,0355 = (28,17)2 = 793,55 k2 = h/qe2 = 11,82/793,55 = 0,015 g mg-1 menit-1
Lampiran 3. Penentuan Kapasitas dan Energi Adsorpsi
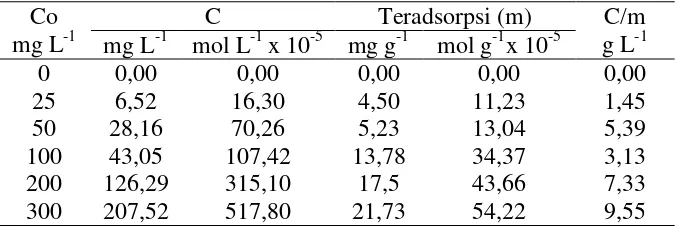
Tabel 13. Data perhitungan menggunakan model isoterm Langmuir pada biomassa alga Spirulina sp terhadap ion Ca2+
Co mg L-1
C Teradsorpsi (m) C/m
g L-1 mg L-1 mol L-1 x 10-5 mg g-1 mol g-1x 10-5
0 0,00 0,00 0,00 0,00 0,00
25 6,52 16,30 4,50 11,23 1,45
50 28,16 70,26 5,23 13,04 5,39
100 43,05 107,42 13,78 34,37 3,13
200 126,29 315,10 17,5 43,66 7,33
300 207,52 517,80 21,73 54,22 9,55
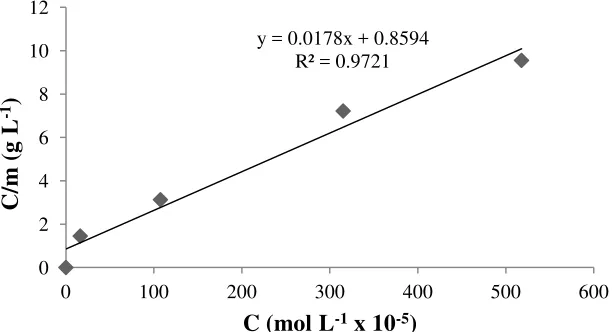
Gambar 16. Kurva isoterm adsorpsi Langmuir pada biomassa alga Spirulina sp terhadap ion Ca2+
Hasil perhitungan kurva pada Gambar 16 adalah sebagai berikut: y = 0,0178x + 0,8594
Tabel 14. Data perhitungan menggunakan model isoterm Langmuir pada biomassa alga Spirulina sp terhadap ion Cu2+
Dari hasil data pada Tabel 14, didapat grafik sebagai berikut:
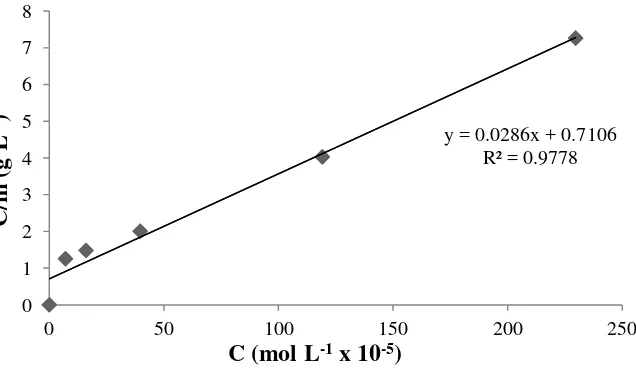
Gambar 17. Kurva isoterm adsorpsi Langmuir pada biomassa alga Spirulina sp terhadap ion Cu2+
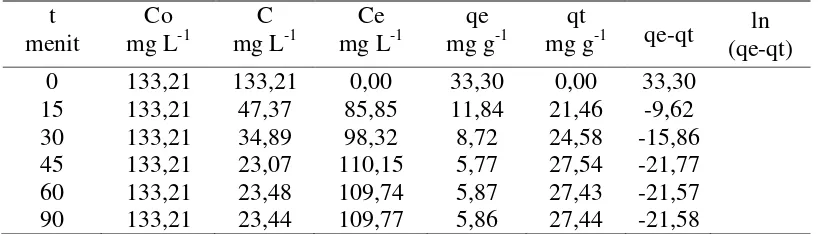
Tabel 15. Data perhitungan menggunakan model isoterm Langmuir pada biomassa alga Spirulina sp terhadap ion Cd2+
Co
Dari hasil data pada Tabel 15, didapat grafik sebagai berikut:
Gambar 18. Kurva isoterm adsorpsi Langmuir pada biomassa alga Spirulina sp terhadap ion Cd2+
E = -RT ln K
E = -(8,314 J mol-1 K x 300 K x ln 14,75 x 103) E = -23941 J mol-1 = -23,94 kJ mol-1
Tabel 16. Data perhitungan menggunakan model isoterm Freundlich pada biomassa alga Spirulina sp terhadap ion Ca2+
Co
Dari hasil data pada Tabel 16, didapat grafik sebagai berikut:
Hasil perhitungan kurva pada Gambar 19, sebagai berikut: y = 0,5691x + 0,093
a = 0,5691 (slop), b = 0,093 (intersep) n = 1/a, jadi n = 1/0,5691 = 1,76 kf = 10b = 100,093 = 1,24 mg g-1
Tabel 17. Data perhitungan menggunakan model isoterm Freundlich pada pada biomassa alga Spirulina sp terhadap ion Cu2+
Co
Dari hasil data pada Tabel 17, didapat grafik sebagai berikut:
Hasil perhitungan kurva pada Gambar 20, sebagai berikut: y = 0,6108x + 0,1214
a = 0,6108 (slop), b = 0,1214 (intersep) n = 1/a, jadi n = 1/0,6108 = 1,637 kf = 10b = 100,1214 = 1,32 mg g-1
Tabel 18. Data perhitungan menggunakan model isoterm Freundlich pada biomassa alga Spirulina sp terhadap ion Cd2+
Co
Dari hasil data Tabel 18, didapat grafik sebagai berikut:
Hasil perhitungan kurva pada Gambar 21, sebagai berikut: y = 0,4908x + 0,3404
a = 0,4908 (slop), b = 0,3404 (intersep) n = 1/a, jadi n = 1/0,4908 = 2,04