TERMOKIMIA
I. TUJUAN PERCOBAAN
1. Mengenal alat kalorimeter tekanan tetap dan memahami cara kerja alat tersebut.
2. Mampu menggunakan alat tersebut untuk mengukur kalor reaksi suatu larutan. 3. Mengetahui kapasitas kalor kalorimeter, kalor reaksi dan kalor pengenceran
larutan.
4. Menentukan syarat termometer ideal
5. Menentukan faktor-faktor yang mempengaruhi besar kecilnya panas yang diterima atau yang dilepaskan suatu zat.
II. DASAR TEORI
Kalor didefinisikan sebagai energi panas yang dimiliki oleh suatu benda atau zat. Secara umum untuk mendeteksi adanya kalor yang dimiliki oleh suatu benda yaitu dengan mengukur suhu benda tersebut. Jika suhunya tinggi maka kalor yang dikandung oleh benda sangat besar, begitu juga sebaliknya jika suhunya rendah maka kalor yang dikandung sedikit.
Besar kecilnya kalor yang dibutuhkan oleh suatu benda dipengaruhi oleh tiga faktor yaitu :
a. Massa zat
b. Kalor jenis
c. Suhu
Sehingga secara matematis dapat dirumuskan : Q = m x c x ∆T Dimana
‒ Q = kalor yang diterima atau dilepaskan (J)
‒ m = massa (kg)
‒ c = kalor jenis (J/kgC)
‒ ∆T = perubahan suhu (˚C)
Kalor dapat dibagi menjadi 2 jenis yaitu :
a. Kalor yang digunakan untuk menaikkan suhu
b. Kalor yang digunakan untuk mengubah wujud zat (kalor laten).
Dimana
‒ U = kalor uap (J/kg)
Kalor uap adalah banyaknya kalor yang diperlukan oleh 1 kg zat cair pada titik didihnya agar wujud zat cair tersebut berubah menjadi gas.
‒ L = kalor lebur (J/kg)
Air membeku pada suhu 0 °C sedang es mencair pada suhu 0 °C. Jadi titik beku sama dengan titik lebur. Kalor yang dilepas untuk pembekuan suatu zat suhunya tetap dan dinamakan kalor beku. Kalor yang diperlukan untuk peleburan suatu zat suhunya tetap dan dinamakan kalor lebur. Kalor beku = kalor lebur.
Persaaman kalor yg diperlukan untuk meleburkan zat yaitu : Q = m L
Keterangan
Q = banyaknya kalor yang digunakan (joule) m = massa zat (kg)
L = kalor lebur zat (J/kg)
Faktor yang mempengaruhi titik lebur zat antara lain tekanan udara di atas permukaan dan ketidakmurnian zat. Regelasi adalah gejala meleburnya bagian balok es yang diberi beban (tekanan luar) dan membeku kembali sesaat beban dihilangkan.
Dalam pembahasan kalor ada dua kosep yang hampir sama tetapi berbeda yaitu kapasitas kalor (C) dan kalor jenis (c).
Kapasitas kalor didefinisikan sebagai suhu yang diperlukan untuk menaikkan suhu keseluruhan zat atau bahan sebesar 1 ˚C pada keadaan normalnya.
Secara matematis kapasitas kalor dapat dituliskan sebagai berikut :
Kalor jenis (c) adalah banyaknya kalor (Q) yang dibutuhkan untuk menaikkan suhu (T) satu satuan massa (m) benda sebesar satu derajat.
Kalor jenis suatu benda menyatakan kemampuan suatu benda untuk menyerap kalor atau melepaskan kalor. Semakin besar kalor jenis suatu benda, semakin kecil kemampuan benda tersebut menyerap atau melepaskan kalor. Semakin kecil kalor jenis benda, semakin baik kemampuan benda tersebut menyerap atau melepaskan kalor.
Apabila benda-benda yang memiliki perbedaan suhu saling bersentuhan, akan ada perpindahan panas atau sering disebut kalor, dari benda yang bersuhu tinggi menuju benda yang bersuhu rendah. Perpindahan kalor terhenti setelah benda-benda yang bersentuhan mencapai suhu yang sama. Secara alami, kalor dengan sendirinya berpindah dari benda yang bersuhu tinggi menuju benda yang bersuhu rendah. Perpindahan kalor cenderung menyamakan suhu benda yang saling bersentuhan.
Pada abad ke-19, seorang fisikawan Inggris bernama James Prescott Joule (1818-1889) mempelajari cara memanaskan air dalam sebuah wadah menggunakan roda pengaduk. Berdasarkan hasil percobaannya, Joule membuat perbandingan dengan air yang dipanaskan menggunakan api. Ketika nyala api dan wadah yang berisi air bersentuhan, kalor berpindah dari api (suhu tinggi) menuju air (suhu rendah). Setelah membuat perbandingan antara meningkatnya suhu air karena bersentuhan dengan api dan meningkatnya suhu air akibat adanya usaha yang dilakukan oleh pengaduk, Joule menyimpulkan bahwa kalor merupakan energi
yang berpindah dari benda bersuhu tinggi menuju benda bersuhu rendah. Kalor
adalah energi yang berpindah akibat perbedaan suhu. Jadi ketika kalor mengalir dari benda yang bersuhu tinggi menuju benda yang bersuhu rendah, sebenarnya energi yang berpindah dari benda yang bersuhu tinggi menuju benda yang bersuhu rendah. Perpindahan energi terhenti setelah benda-benda yang bersentuhan mencapai suhu yang sama atau kesetimbangan termal.
Berdasarkan uraian di atas, dapat disimpulkan bahwa ketetimbangan termal adalah suatu proses dimana terjadinya kesetimbangan temperatur disebabkan oleh kandungan energi yang telah mencapai saturasi.
oleh suatu zat dapat dijelaskan secara real berdasarkan hukum-hukum dasar termodinamika.
Hukum-Hukum Termodinamika
Terdapat empat hukum dasar yang berlaku dalam sistem termodinamika yaitu :
1. Hukum ke 0 Termodinamika (Zeroth Law)
Hukum ini menyatakan bahwa dua sistem dalam keadaan setimbang dengan sistem ketiga, maka ketiganya dalam saling setimbang satu dengan lainnya.
2. Hukum Pertama Termodinamika
Hukum ini terkait dengan kekekalan energi. Hukum ini menyatakan perubahan energi dalam dari suatu sistem termodinamika tertutup sama dengan total dari jumlah energi kalor yang disuplai ke dalam sistem dan kerja yang dilakukan terhadap sistem.
3. Hukum Kedua Termodinamika
Hukum kedua termodinamika terkait dengan entropi. Hukum ini menyatakan bahwa total entropi dari suatu sistem termodinamika terisolasi cenderung untuk meningkat seiring dengan meningkatnya waktu, mendekati nilai maksimumnya.
4. Hukum Ketiga Termodinamika
Hukum ketiga termodinamika terkait dengan temperatur nol absolut. Hukum ini menyatakan bahwa pada saat suatu sistem mencapai temperatur nol absolut, semua proses akan berhenti dan entropi sistem akan mendekati nilai minimum. Hukum ini juga menyatakan bahwa entropi benda berstruktur kristal sempurna pada temperatur nol absolut bernilai nol.
Hukum ke nol termodinamika berhubungan dengan kesetimbangan termal antara benda benda yang saling bersentuhan, karena panas yang diterima dengan panas yang dilepaskan oleh benda-benda atau zat-zat yang saling bersentuhan memiliki besar yang sama sehingga hal tersebut di atas dapat dijelaskan dengan teori Asas Black.
Menurut asas Black apabila ada dua benda yang suhunya berbeda kemudian disatukan atau dicampur maka akan terjadi aliran kalor dari benda yang bersuhu tinggi menuju benda yang bersuhu rendah. Aliran ini akan berhenti sampai terjadi keseimbangantermal (suhu kedua benda sama).
Secara matematis dapat dirumuskan :
Yang melepas kalor adalah benda yang suhunya tinggi dan yang menerimakalor adalah benda yang bersuhu rendah.
Bila persamaan tersebut dijabarkan maka akan diperoleh : Qlepas = Qterima
m x c x ∆T = m x c x ∆T
Asas Black berhubungan erat dengan hukum kekekalan energi yang berbunyi “ Energi tidak dapat diciptakan, energi tidak dapat dimusnahkan, tetapi energi dapat diubah bentuknya dari energi yang satu ke energi yang lain”.
Perpindahan panas yang terjadi pada benda dapat dihitung dengan menggunakan kalorimeter karena kalorimeter merupakan alat yang digunakan untuk mengukur laju penyerapan kalor dalam suatu bahan, menentukan panas jenis suatu bahan, dan juga bisa untuk menentukan koefisien laju konveksi suatu fluida. Kalorimeter bekerja dengan prinsip adiabatik, yang berarti tidak ada kalor yang masuk ataupun keluar dari sistem sehingga kondisinya ideal.
Kalorimeter ideal adalah kalorimeter yang memiliki kapasitas kalor yang sangat kecil agar hanya ada sedikit kalor yang dapat diserap oleh kalorimeter.
Faktor-faktor yang mempengaruhi kecepatan hantaran kalor (banyaknya kalor
yang dihantarkan persatuan waktu) adalah : a. Luas penampang
b. Perbedaan suhu c. Panjang benda
[image:5.595.84.579.512.759.2]d. Konduktivitas termal benda
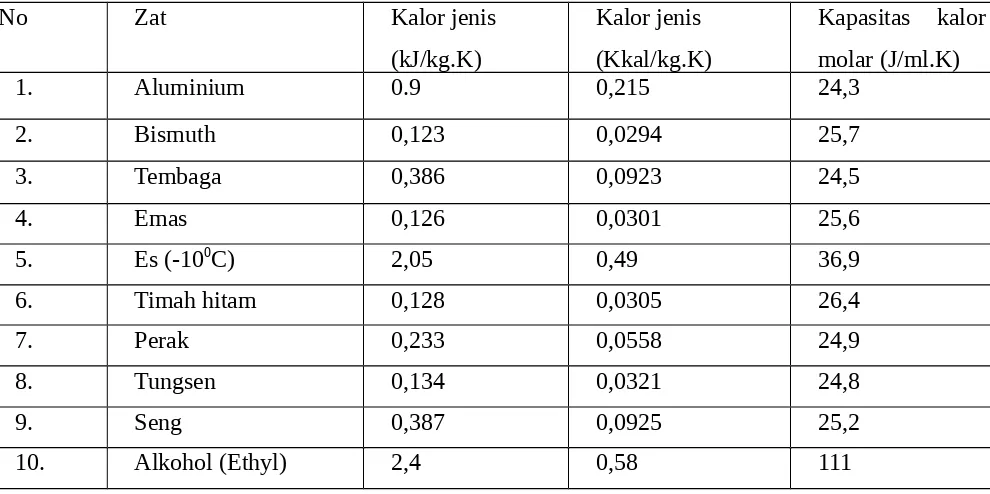
Tabel 1.1 Kalor Jenis dan Kapasitas Kalor Molar untuk Berbagai Padatan dan Cairan pada 20˚C
No Zat Kalor jenis
(kJ/kg.K)
Kalor jenis (Kkal/kg.K)
Kapasitas kalor molar (J/ml.K)
1. Aluminium 0.9 0,215 24,3
2. Bismuth 0,123 0,0294 25,7
3. Tembaga 0,386 0,0923 24,5
4. Emas 0,126 0,0301 25,6
5. Es (-100C) 2,05 0,49 36,9
6. Timah hitam 0,128 0,0305 26,4
7. Perak 0,233 0,0558 24,9
8. Tungsen 0,134 0,0321 24,8
9. Seng 0,387 0,0925 25,2
11. Raksa 0.14 0,033 28,3
12. Air 4,18 1 75,2
Dari tabel diatas dapat dilihat bahwa kalor jenis air jauh lebih besar dari pada kalor jenis zat lain. Karena kapasitas kalornya yang sangat besar, air adalah bahan yang baik sekali untuk menyimpan energi termis. Air juga merupakan pendingin yang baik.
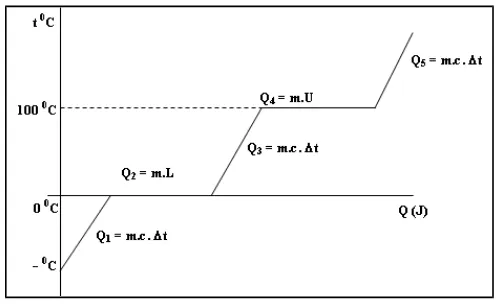
[image:6.595.209.459.269.421.2]Dalam grafik ini dapat dilihat semua persamaan kalor yang digunakan.
Gambar 1. Analisis Grafik Perubahan Wujud pada Es yang Dipanaskan sampai Menjadi Uap
Pada Q1 es mendapat kalor dan digunakan menaikkan suhu es, setelah suhu sampai pada 0 C kalor yang diterima digunakan untuk melebur (Q2), setelah semua menjadi air barulah terjadi kenaikan suhu air (Q3), setelah suhunya mencapai suhu
1000C maka kalor yang diterima digunakan untuk berubah wujud menjadi uap (Q4),
kemudian setelah berubah menjadi uap semua maka akan kembali terjadi kenaikan suhu kembali (Q5).
III.ALAT DAN BAHAN
A. Alat
Gelas plastik bertutup Labu ukur
Gelas ukur Termometer
Gelas kimia Batang pengaduk
B. Bahan
CaCl2 NaOH
IV. CARA KERJA
Percobaan 1: Penentuan Kapasitas Kalor suatu kalorimeter.
Dua buah gelas plastik bertutup, termometer dan batang pengaduk disediakan. alat-alat tersebut dirangkai seperti gambar di bawah ini. 50 mL larutan HCl 1 M dimasukkan ke dalam gelas kimia 100 mL, ukur temperatur larutan ini. Ke dalam gelas kimia yang lain masukkan 50 mL larutan NaOH 1M dan ukur temperatur larutan ini. Jika temperatur kedua larutan telah sama, kedua larutan dimasukkan ke dalam kalorimeter. Temperatur maksimal yang dicapai oleh campuran kedua larutan tersebut dicatat. Diketahui kalor reaksi netralisasi HCl dengan NaOH adalah -56,2 kJ/mol dan anggaplah densitas dan kalor jenis campuran larutan itu sama dengan
densitas dan kalor jenis air (1,00 gr/mL dan 4,184 J/g0C).
Percobaan 2: Penentuan kalor reaksi larutan.
Kalorimeter pada percobaan 1
digunakan kembali. 5 gram serbuk CaCl2
dimasukkan ke dalam kalorimeter. 50 mL
air ditambahkan, namun sebelum penambahan catat temperatur air tersebut. Setelah
diperoleh temperatur yang stabil dari larutan CaCl2, 50 mL air ditambahkan sekali
lagi. Sambil diaduk temperatur larutan tersebut dicatat. 50 mL air
5 gram CaCl2 tambahkan 50 ml
air yang sudah di catat tempera
V. DATA PENGAMATAN
Percobaan 1.
NO Uraian Temperatur Pengamatan
1. 50 mL larutan HCl 1 M 260 C
50 ml larutan NaOH 1 M 260 C
Campuran kedua larutan 310 C
2. 50 mL larutan HCl 1 M 260 C
50 ml larutan NaOH 1 M 260 C
Campuran kedua larutan 320 C
3. 50 mL larutan HCl 1 M 260 C
50 ml larutan NaOH 1 M 260 C
Campuran kedua larutan 300 C
Percobaan 2
NO Uraian Temperatur Pengamatan
1. Air (Aquades) 260 C
Larutan CaCl2* 340 C
Larutan CaCl2** 340 C
Larutan CaCl2 + 50 mL air 290 C
VI. ANALISIS DATA
Perhitungan
Percobaan 1. Penentuan Kapasitas Kalor Kalorimeter
Diketahui :
V1 = Volume HCl = 50 ml = 0,05 liter
V2 = Volume NaOH = 50 ml = 0,05 liter
Volume total = V1 + V2 = 0,05 liter + 0,05 liter = 0,1 liter
M1 = Molaritas HCl = 1M
M2 = Molaritas NaOH = 1M
∆t1 = Perubahan suhu pengamatan 1 = 310C - 260C = 50C
∆t2 = Perubahan suhu pengamatan 2 = 320C – 260C = 60C
∆t3 = Perubahan suhu pengamatan 3 = 300C – 260C = 40C
qreaksi = -56,2 kJ/mol
air =
c= 4,184 J/g0C
Ditanya :
Jawab :
massa total =
M1xV1 + M2xV2 = MtotalxVtotal
1 x 0,05 + 1 x 0,05 = Mtotal x 0,1
0,05 + 0,05 = 0,1 Mtotal
0,1 = 0,1Mtotal
Mtotal =
Jadi, molaritas totalnya adalah 1
` M =
n = M x V n = 1 x 0,1 n = 0,1 mol
= =
Pengamatan 1 :
qreeaksi = - (qlarutan + qkalorimeter)
- J = - (m.c.∆t1 + qkalorimeter)
- J = - (100 x 4,184 x 5 + qkalorimeter)
- J = - (2092 J + qkalorimeter)
- J + 2092 J = - qkalorimeter
qkalorimeter = 3528 J
qkalorimeter = C1.∆t1
3528 J = C1 x 50C
C1 = 3528 J/ 50C = 705,6 J/0C
Pengamatan 2 :
qreeaksi = - (qlarutan + qkalorimeter)
- J = - (m.c.∆t2 + qkalorimeter)
- J = - (100 x 4,184 x 6 + qkalorimeter)
- J = - (2510 J + qkalorimeter)
- J + 2510 J = - qkalorimeter
qkalorimeter = 3110 J
qkalorimeter = C2.∆t2
3110 J = C2 x 60C
C2 = 3110 J / 60C = 518,3 J/0C
qreeaksi = - (qlarutan + qkalorimeter)
- J = - (m.s.∆t3 + qkalorimeter)
- J = - (100 x 4,184 x 4 + qkalorimeter)
- J = - (1674 J + qkalorimeter)
- J + 1674 J = - qkalorimeter
qkalorimeter = 3946 J
qkalorimeter = C3.∆t3
3946 J = C2 x 40C
C3 = 3946 J/ 40C = 986,5 J/0C
Kapasitas Kalorimeter Rata-rata :
Crata-rata = =
= 736,8 J/0C
= 0,7368 kJ/0C
Jadi, kapasitas kalorimeter rata-rata pada percobaan ini sebesar 736,8 J/0C.
Percobaan 2. Penentuan Kalor Reaksi Larutan
Diketahui :
m CaCl2 = 5 gram
m air = 1 gr/mL x 50 mL = 50 gram
massa total = m CaCl2 + m air = 5 gram + 50 gram = 55 gram
Volume total air = 100 mL Ckal = 736,8 J/0C
= 0,7368 kJ/0C
c = 4,184 J/˚C
Ditanya : qreaksi dan qpengenceran = ....?
Jawab :
Pengamatan 1 qlar = m.c.Δt
= 55 gram x 4,184 J/˚C x (29-34)˚C = 55 gram x 4,184 J/˚C x -4˚C = - 920,5 J
= - 0,9205 kJ qkal = Ckal . Δt
= 0,7368 kJ/0C x (29-34)˚C
= 0,7368 kJ/˚C x -4˚C = - 2,95 kJ
qreaksi = -(qlar + qkal)
= - (-0,9205 + -2,95) kJ = - (- 3,87) kJ
= (3,87) kJ
qlar = m.c.Δt
= 920,5 J = 0,9205 kJ qkal = Ckal . Δt
= 0,7368 kJ/0C x (34-29)˚C
= 0,7368 kJ/0C x 4˚C
= 2,95 kJ
qpengenceran = -(qlar + qkal)
= -(0,9205 + 2,95) kJ = - 3,87 kJ
VII. PEMBAHASAN
Pada praktikum termokimia ini, ada beberapa tujuan yang ingin dicapai yaitu mengenal alat kalorimeter tekanan tetap dan memahami cara kerja alat tersebut, mampu menggunakan alat tersebut untuk mengukur kalor reaksi suatu larutan, mengetahui kapasitas kalor kalorimeter, kalor reaksi dan kalor pengenceran larutan, menentukan syarat termometer ideal dan menentukan faktor-faktor yang mempengaruhi besar kecilnya panas yang diterima atau yang dilepaskan suatu zat.
Percobaan ini dilakukan sebanyak dua kali pertama yaitu untuk mengetahui kapasitas kalor suatu kalorimeter dan percobaan kedua yaitu untuk menentukan kalor reaksi dari beberapa larutan.
Percobaan pertama dilakukan sebanyak tiga kali dengan menghitung suhu 50 ml larutan HCl 1 M, 50 ml larutan NaOH 1 M dan campuran kedua larutan tersebut. Sehingga diperoleh hasil suhu awal 50 ml larutan HCl 1 M dan 50 ml larutan NaOH 1 M sebesar 26 ˚C pada masing-masing pengamatan sedangkan diperoleh suhu campuran kedua larutan tersebut sebesar 31˚C pada pengamatan pertama, 32˚C pada pengamatan kedua dan 30˚C pada pengamatan ketiga. Terjadi perbedaan suhu antara 50 ml larutan HCl murni dan 50 ml larutan NaOH murni dengan campuran kedua larutan tersebut. Melalui hasil tersebut dapat diketahui bahwa terjadi peningkatan suhu akibat perpindahan kalor atau panas dari lingkungan menuju sistem sehingga terjadi reaksi endoterm.
Reaksi : HCl + NaOH → NaCl + H2O
Setelah diperoleh data-data diatas, maka selanjutnya adalah menghitung nilai kapasitas kalor kalorimeter dan kapasitas kalor rata-rata kalorimeter, Pada
perngamatan pertama diperoleh nilai kapasitas kalor sebesar 705,6 J/0C, pada
pengamatan kedua diperoleh nilai kapasitas kalor sebesar 518,3 J/0C dan pada
diperoleh nilai rata-rata kapasitas kalor kalorimeter pada percobaan pertama
adalah sebesar 736,8 J/0C atau 0,7368 kJ/0C.
Percobaan kedua yang bertujuan untuk menentukan kalor reaksi larutan. Pada percobaan kedua digunakan 50 ml larutan CaCl2. Pertama-tama suhu
larutan CaCl2 dihitung dan didapat sebesar 340C dimana suhu awal 50 ml air
sebesar 260C sehingga diperoleh suhu campuran sebesar 290C. Pada percobaan
kedua ini, dapat diketahui bahwa terjadinya penurunan suhu campuran antara
CaCl2 dan air dimana suhu campuran lebih rendah dibandingkan denan suhu
lrutan CaCl2. Akibatnya terjadi perpindahan panas dari sistem menuju
lingkungan sehingga terjadi reaksi eksoterm.
Reaksi : CaCl2(l) + 2H2O(aq) → Ca(OH)2(l) + 2HCl(l)
Karena perubahan suhu dari kedua pengamatan itu sama jadi kalor reaksi dan kalor pengencerannya juga diperoleh sama yaitu sebesar 3,87 kJ.
VIII. KESIMPULAN
Dari penjelasan percobaan di atas maka dapat disimpulkan bahwa :
1. Suhu atau temperatur merupakan penunjuk panas atau dinginnya suatu benda, untuk mengukur suhu digunakan termometer.
2. Kalor atau panas adalah energi termal yang mengalir atau transfer energi dari dua zat yang suhunya berbeda yang saling bersinggungan.
3. Kalor selalu mengalir dari zat yang suhunya tinggi menuju zat yang suhunya lebih rendah. Akan tetapi kalor tidak selalu mengalir dari zat yang memiliki energi dalam besar ke zat yang memiliki energi dalam kecil. Aliran kalor akan berhenti apabila sudah mencapai titik keseimbangan.
4. Kapasitas kalor adalah besar kalor yang diperlukan untuk menaikkan suhu suatu zat atau benda sebesar 1 ˚C untuk sembarang nilai massa. Benda yang bersuhu lebih tinggi dari lingkungannya akan cenderung melepaskan kalor, demikian juga sebaliknya benda-benda yang bersuhu lebih rendah dari lingkungannya akan cenderung menerima kalor untuk menstabilkan kondisinya dengan lingkungan di sekitarnya.
5. Pada proses perpindahan kalor dari benda satu ke benda lain yang suhunya tidak sama maka berlaku asas Black yang menyatakan bahwa bila suatu benda menerima kalor dari benda lain maka kalor yang diterima sama dengan kalor yang dilepas.
6. Jika temperatur akhir lebih rendah dari temperatur awal maka berlangsung reaksi eksoterm. Sedangkan jika temperatur akhir lebih tinggi dari temperatur awal maka berlangsung reaksi endoterm.
7. Proses perpipindahan panas pada kalorimeter berlangsung secara adiabatik karena tidak ada energi yang lepas atau masuk ke dalam kalorimeter.
8. Kalorimeter adalah alat yang digunakan untuk mengukur kalor jenis suatu zat atau benda. Oleh karena itu kalorimeter ideal harus memiliki kapasitas kalor yang sangat kecil untuk memaksimalkan hasil pengukuran agar hanya ada sedikit panas yang dapat terserap oleh kalorimeter atau kalorimeter mampu mempertahankan suhu awalnya.
DAFTAR PUSTAKA
Tim Kimia Dasar. 2012. Penuntun Praktikum Kimia Dasar II. Jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Udayana.
Fadli.Muhtadin. 2011. Asas Black. http://www.scribd.com/doc/38880537/Asas-Black diakses 26 Maret 2014.
Keenan, Kleinfelter, Wood. 1992. Kimia untuk Universitas Jilid 2 Edisi Keenam. Jakarta : Erlangga.
Petrucci, Ralph H, 1987. Kimia Dasar Prinsip dan Terapan Modern Jilid 3. Penerbit Erlangga.