PENDAHULUAN
Pada Pelita IV, pemerintah mengembangkan produksi ke- delai melalui usaha pokok intensifikasi, ekstensifikasi, diversifikasi, dan rehabilitasi. Usaha pokok ekstensifi- kasi diarahkan kepada perluasan areal, terutama di daerah- daerah baru. Pada tahun anggaran 1983/1984, perluasan per- tanaman kedelai telah diupayakan di lahan-lahan yang bere- aksi masam dengan jalan pengapuran. Daerah Kalimantan Se- latan termasuk dalam kategori tersebut.
Pada tahun 1984, Pemerintah Daerah Tingkat I Kaliman- tan Selatan, melalui Dinas Pertanian Tanaman Pangan, menca- nangkan pengembangan tanaman kedelai di seluruh wilayah propinsi. Sejak itulah tanaman kedelai telah berkembang di tiap kabupaten dengan prospek yang cukup memberi harapan.
2
Suatu organisme pengganggu tanaman dianggap penting kalau ia berpotensi menurunkan hasil. Demikian juga dengan penyebab penyakit daun kedelai yang diteliti. Meskipun, setelah didiagnosis, terbukti bahwa penyakit tersebuttelah diketahui sebelumnya, termasuk pengaruhnya terhadap hasil, kiranya masih perlu diteliti potensi penyakit tersebut di Kalimantan Selatan karena bagaimanapun juga keadaan serang- an suatu patogen tanaman tergantung pada interaksi inang- patogen dan lingkungan setempat.
Pengendalian organisme pengganggu tanaman secara ter- padu memerlukan informasi mengenai macam jasad pengganggu yang ada, termasuk sebaran dan intensitas serangannya, serta hubungannya dengan inang dan lingkungannya. Sehu- bungan dengan itu, sebaran penyakit yang sedang diteliti perlu dipetakan khususnya untuk kawasan Kalimantan Selatan. Untuk menjawab pertanyaan-pertanyaan yang mungkin akan muncul, dalam kaitannya dengan masalah epidemi penyakit tersebut dan pengendaliannya, maka diperlukan penelitian mengenai cara bertahan hidup patogen bersangkutan, sehingga ia dapat menginfeksi tanaman kedelai berikutnya. Dengan mengetahui sifat-sifat tersebut maka diharapkan daur hidup patogen dapat diputus, misalnya dengan perlakuan benih, perlakuan tanah, rotasi tanaman, pemberantasan inang lain, dan.sebagainya.
Tujuan penelitian adalah:
di Kalimantan Selatan, yang mempunyai gejala berupa bercak kecil berwarna coklat dengan "haloft kekuningan. Mengetahui sebaran dan intensitas serangannya di Kali- mantan Selatan.
Mengetahui pengaruh penyakit tersebut terhadap hasil tanaman kedelai, dalam lingkungan Kalimantan Selatan. Mengetahui daya bertahan hidup patogen.
Hipotesis yang dirumuskan dalam penelitian adalah: Berdasarkan pengamatan terhadap gejala dan perendaman spesimen dalam larutan NaCl fisiologis, serta mengingat kondisi lingkungan setempat, kemungkinan penyakit ter- sebut adalah penyakit pustul bakteri kedelai, yang di- sebabkan oleh Xanthomonas c a m p e s t r i s pv. glycines.
Penyakit tersebut terdapat pada tanaman kedelai di se- luruh wilayah Kalimantan Selatan, dengan berbagai in- tensitas serangan.
Berdasarkan pengamatan sepintas terhadap proporsi daun yang bergejala, penyakit ini berpengaruh terhadap hasil kedelai
.
Biji kedelai terinfeksi yang berasal dari areal terse- rang sangat berperan dalam penyebaran penyakit.
Bakteri patogen dapat bertahan hidup di dalam bi ji, ta- nah, dan serasah.
TINJAUAN PUSTAKA
Dalam Compendium of Soybean Diseases (Sinclair, 1982) disebutkan bahwa sejumlah bakteri patogen dapat menyerang tanaman kedelai. Bakteri tersebut adalah: 1) Pseudomonas syringae pv. glycinea (Coerper) Young, Dye & Wilkie, penye- bab penyakit hawar daun; 2) Xanthomonas campestris pv. glycines (Nakano) Dye, penyebab penyakit pustul daun;
3) Pseudomonas syringae pv. tabaci (Wolf & Foster) Young, Dye & Wilkie, penyebab penyakit layu terbakar; 4) Coryne- bacterium flaccumfaciens pv. flaccumfaciens (Hedges) Col- lins & Jones dan Pseudomonas solanacearum (Smith) Smith, penyebab penyakit layu; 5 ) Pseudomonas syringae pv. sy- ringae van Hall, penyebab penyakit bercak daun berkerut; 6) Corynebacterium spp., penyebab penyakit bercak "tan" bakteri; dan 7) Bacillus subtilis (Ehrenberg) perusak biji. Dilaporkan juga bahwa tanaman kedelai rentan terha- dap Xanthomonas campestris pv. phaseoli vignicola dan Xan- thomonas campestris pv. phaseoli fuscans, yang masing-ma- sing biasanya menyerang tanaman ercis (Cicer arietinum) dan kacang buncis (Phaseolus vulgaris).
Penyakit oleh bakteri lebih banyak terdapat di daerah- daerah dengan iklim yang relatif lebih basah (Sinclair,
Hawar Bakteri
Penyakit hawar tersebar di seluruh dunia dan merupakan penyakit bakteri yang paling sering dijumpai pada pertanam- an kedelai terutama pada keadaan iklim yang dingin dan basah (Sinclair, 1982). Di Indonesia, penyakit ini terda- pat di Sumatera, Jawa, Kalimantan, Sulawesi, Bali dan Nusa- tenggara (Puslitbangtan, 1990).
Gejala Penyakit
6 yang terserang menjadi kerdil dan bila titik tumbuh terin-
feksi tanaman akan mati.
Organisme Penyebab
Penyakit hawar bakteri disebabkan oleh Pseudomonas s y r i n g a e pv. g l y c i n e a (Coerper) Young, Dye & Wilkie. Bak- teri ini berbentuk batang, berukuran 1.2-1.5 pm x 2.3-3 pm, dan memiliki satu sampai beberapa flagella "polar". Bak- teri ini menghasilkan pigmen yang berfluoresen pada medium King's B (di bawah sinar ultraviolet, 366 nm)
,
tidak menca- irkan gelatin, dan menghasilkan asam dari sukrosa (Sinclair, 1982). Koloni pada "nutrient agar" bundar, lem- but, berkilat, bertepi rata, berwarna putih, dan tidak lengket. Temperatur optimum untuk perturnbuhan adalah 24-26 C, dengan temperatur maksimum 35 C dan minimum 2 C.Penyakit Pustul Bakteri
7 Kanada, Nikaragua, Bolivia, Kolombia, Brazilia, Argentina, dan Venezuela. Di Indonesia penyakit pustul bakteri terda- pat di Jawa Barat, Jawa Timur, Lampung dan Sulawesi Selatan
(Machmud, 1 9 8 7 ) .
Gejala penyakit
Gejala awal penyakit pustul bakteri kedelai berupa bercak kecil, berwarna hijau pucat, dengan bagian tengah menonjol ke arah kedua permukaan daun. Selanjutnya pada bagian tengah itu akan terbentuk pustul berukuran kecil, menonjol, dan berwarna terang. Tidak seperti pada hawar bakteri, pada awal gejala tidak disertai adanya gejala ke- basahan. Pustul terutama terbentuk pada permukaan bawah daun. Namun dilaporkan juga bahwa tiap bercak tidak selalu disertai adanya pustul (Kennedy dan Tachibana, 1 9 7 3 ) .
Ukuran bercak bervariasi dari suatu titik berukuran kecil sampai cukup besar, berbelang cokelat karena bersatu- nya bercak-bercak kecil. Daun menjadi kasar dan mudah robek karena terpaan angin. Pada varietas-varietas yang sangat rentan, polong juga dapat terserang dengan menirnbul- kan gejala berupa bercak agak menonjol, yang berwarna co- kelat kemerahan (Sinclair, 1 9 8 2 ) .
Organisme Penyebab
Sinonim bakteri tersebut adalah (Bradbury, 1986):
-
Pseudomonas glycines Nakano 1919,-
Bacterium glycines (Nakano) Elliott 1930,-
Phytomonas glycines (Nakano) Magrou in Haudoroy,-
Bacterium phaseoli var. sojensis Hedges 1922,-
Phytomonas phaseoli var. sojensis (Hedges) Burkholder 1930,-
Pseudomonas phaseoli var. sojensis (Hedges) Stapp 1928,-
Xanthomonas phaseoli var. sojensis (Hedges) Starr & Burkholder 1942.Bakteri pustul berukuran 0.5-0.9 pm x 1.4-2.3 pm, ber- bentuk batang, mempunyai satu flagelum polar, dan bersifat gram negatif. Koloni pada medium "Beef Infusion Agar" ber- warna kuning pucat, yang semakin lama akan menjadi kuning tua, berukuran kecil, sirkular, dan dengan tepi yang halus. Bakteri ini dapat mencairkan gelatin, menghasilkan asam dan bukan gas dari sukrosa, dan sangat cepat menghidrolisis pati (Sinclair, 1982). Temperatur optimum untuk pertumbuh- an bakteri pustul adalah 30-33 C, maksimum 38 C, dan mini- mum 10 C. Dengan demikian, bakteri pustul lebih cocok hidup di daerah beriklim panas bila dibandingkan dengan bakteri hawar daun, yang mempunyai temperatur optimum 24
-
26c
(Sinclair, 1982; Kennedy dan Tachibana, 1973).9 Tabel 1 (hal. 14) dan Tabel 2 (hal. 15) berlaku baginya. Juga sebagai anggota dari genus Xanthomonas, bakteri ini tentu bersifat oksidatif, tidak fermentatif, dan sangat aerobik (Bryant et al., 1979).
Lelliott dan Stead (1987) mendeskripsikan bahwa pato- var-patovar X. campestris mempunyai sifat-sifat sebagai be- rikut: 1). Gram negatif, 2). reaksi oksidase: negatif, 3). reaksi katalase: positif, 4). pertumbuhan terhambat oleh TZC 0.1% dan kadang-kadang oleh TZC 0.02%, 5). pertumbuhan dengan warna kuning madu pada medium kentang, 6). oksida- ti£.
[image:174.536.42.482.81.785.2]Interaksi inang
-
patogenSetelah masuk melalui lubang alamiah, biasanya sto- mata, atau luka, bakteri pustul kemudian berkembang secara interseluler. Jones dan Fett ( 1985 ) melaporkan bahwa bakteri pustul dari strain yang virulen dan kompatibel, tumbuh dengan cepat in vivo dan tetap berada dalam ruang antar sel. Di pihak lain, bakteri yang inkompatibel akan segera terhambat perkembangannya, merangsang reaksi hiper- sensitif pada inang, dan diimobilisasikan oleh benda-benda serabut atau amorf di permukaan sel mesofil sehingga tidak leluasa menyebar dan menginfeksi.
Menurut Dickson (1956), setelah bakteri masuk ke da- lam jaringan inang terjadilah pembesaran sel pada jaringan tersebut. Groth dan Braun (1986) mengemukakan bahwa hiper- trofi tersebut terutama terjadi pada sel-sel mesofil dan terjadi juga pada varietas tahan, namun dengan ukuran yang lebih kecil. Pada Gambar 1 dapat dilihat bagian daun yang membesar dan membentuk gejala pustul.
Interaksi inang
-
patogen-
lingkungan11 bakteri juga sangat membantu penyebarannya (Sinclair, 1982; Lelliott dan Stead, 1987).
Keterangan: Sn = sel normal, Sb = sel yang membesar Gambar 1. Pembesaran sel pada pembentukan pustul
(dikutip dari Groth dan Braun, 1986)
Identifikasi Bakteri Patogen
12 oleh faktor yang berlainan. Menurut Sinclair (1982), pe- nyakit pustul kedelai tidak selalu disertai dengan timbul- nya gejala pustul. Dengan demikian, diagnosis penyakit tersebut yang hanya berdasarkan gejala kurang dapat dian- dalkan.
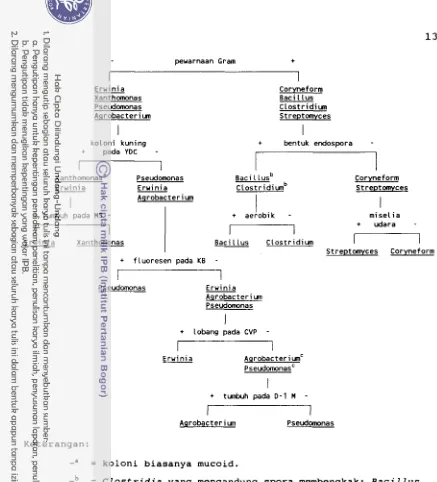
Schaad ( 1988) membagi bakteri patogen tanaman yang su- dah dikenal menjadi dua bagian berdasarkan kemampuannya tumbuh pada medium bakteri baku. Bakteri yang termasuk kelompok pertama relatif mudah diidentifikasi berdasarkan sifat koloni pada medium agar tertentu dan beberapa uji si- fat lainnya, termasuk uji Gram. Bakteri yang tercakup da- lam kelompok kedua hanya dapat tumbuh pada medium yang kom- plek, yaitu yang mengandung serum tertentu. Gambar 2 meru- pakan pemandu bagi determinasi yang cepat sampai pada kate- gori Genus. Setelah melalui tahap pertama, untuk penentuan spesies dari genus Xanthomonas dapat digunakan tabel pengu- jian menurut Dye (1980) dan Moffett dan Croft (1983).
Bakteri dapat juga diidentifikasi berdasarkan teknik serologi, bakteriofag, dan analisis DNA.
peuarnaan Gram +
E r u i n i a Xanthomonas Pseudomonas Agrobacteriun
I
k o l o n i kuning
+ pada YDC -
I I
~anthomonas' Pseudomonas E r u i n i a E r u i n i a
I
Agrobacteriun+ tunbuh pada MS -
m
E r u i n i a XanthomonasI
+ fluoresen pada KB
Corvnef orm Baci 1 lu s C l o s t r i d i u n Streptomyces
+ bentuk endospora -
I
Baci L [usbc l o s t r i d i u n b
I
+ aerobik -
Coryneform Streotomyces
I
m i s e l i a
I + udara -
I I
B a c i l l u s C l o s t r i d i u n
l----'l
Streptomyces Coryneform
I I
Pseudomonas E r w i n i a Agrobacteriun Pseudomonas
I
+ lobang pada CVP -
7
E r u i n i a Agrobacteri unC pseudomonasC
I
+ tunbuh pada D-1 M -
I I
Agrobacteriun Pseudomonas
Keterangan:
-' = koloni biasanya mucoid.
-b = Clostridia yang mengandung spora membengkak; Bacillus
tidak.
-' = beberapa Agrobacteria dan Pseudomonas bisa membentuk lobang yang dangkal.
YDC = medium agar "Yeast extract Dextrose CaC03".
MS = medium agar "Miller-Schroth"
KB = medium agar "King B"
CVP = medium agar "Crystal Violet-Pectate"
[image:178.536.44.481.32.514.2]D-1M = medium agar yang mengandung mannitol, untuk Agrobacterium.
Tabel 1. Uji fisiologis untuk membedakan spesies dari genus Xanthomonas menurut Dye (1980)
X. cam- X. fra- X. albi- X. axo- X. ampe- Uji pestris gariae lineans nopodis lina
Pertumbuhan
pada 36 C
+
-
Hidrolisis
aeculin
+
+
Pertumbuhan
mucoid
+
+
Menguraikan
protein v
+
Urease
+
-
Membentuk asam dari:
Arabinosa
+
-
-
-
+
Glukosa
+
+
+
+
-
Mannosa
+
+
+
-
-
Keterangan:
+
= 90% atau lebih bereaksi positif-
-
-
90% atau lebih bereaksi negatif v = kurang dari 90% positif, selebihnyanegatif
membentuk kompleks yang mudah mengendap. U j i serologi me- liputi aglutinasi, presipitasidan imunofloresensi (Schaad, 1979; Kiraly et al., 1974).
[image:179.540.43.486.56.780.2]Tabel 2. Uji fisiologis untuk membedakan spesies dari genus Xanthomonas menurut Moffett dan Croft (1980)
X. albi- X. ampe- X. axo- X. cam- X. fra-
Uji lineans lina nopodis pestris grariae
Pertumbuhan
pada 36 C
+
-
+
+
-
Pertumbuhan
mucoid
-
-
-
+
+
Proteolisis
susu
-
-
-
+
-
Membentuk asam dari:
Arabinosa
-
+
-
+
-
Cellobiosa
-
-
-
+
-
Trehalosa
-
-
+
+
-
Keterangan:
+
= 90% atau lebih bereaksi positif-
= 90% atau lebih bereaksi negatif [image:180.532.41.479.29.785.2]16 kompatibilitas antara bakteriofag dan bakteribersangkutan. Asosiasi ini dapat digunakan untuk usaha diagnosis bakteri asalkan telah tersedia bakteriofag yang diperlukan. Numic (1971) mencatat beberapa bakteriofag yang berasosiasi de- ngan bakteri Xanthomonas campestris pv. glycines yaitu an- tara lain Xpg 30-3, Xpg 5-5, Xpg 1-6, Xpg 10, Xpg 11 dan Xpg 8-12.
Kehilangan Hasil
17 Penyakit pustul mengurangi bagian daun yang dapat ber- fotosintesis, meskipun beberapa peneliti menyatakan bahwa penyakit tersebut tidak nyata menurunkan hasil kedelai. Namun Weber et al. (dalam Kennedy dan Tachibana, 1973), dalam penelitiannya di Amerika Serikat, melaporkan bahwa penyakit pustul bakteri dapat menurunkan.hasi.1 kedelai se- besar 4.3% melalui penurunan bobot dan jumlah biji. Saxena (1976), dalam kondisi lingkungan di India, mengemukakan adanya penurunan hasil kedelai yang disebabkan oleh penya- kit pustul bakteri, dengan catatan kalau gejala penyakit telah tampak pada waktu tanaman berumur antara 20 sampai 45 hari. Di kawasan tropik, termasuk Indonesia, belum pernah dilaporkan penurunan hasil kedelai yang disebabkan oleh pe- nyakit pustul bakteri tersebut.
Cara Bakteri Patogen Bertahan Hidup
1 8
Bakteri patogen tanaman tidak membentuk spora istira- hat (Bryant et al., 1 9 7 9 ) . Bakteri tersebut hanya dorman selama berasosiasi dengan biji, inang perenial, serangga, serasah, tanah, dan lain-lain, sampai terbuka peluang untuk menginfeksi tanaman inang berikutnya (Schuster dan Coyne,
1 9 7 4 ) .
Karena bakteri mempunyai daur hidup yang pendek, maka sejumlah kecil inokulum primer telah dapat dengan cepat me- nimbulkan suatu epidemi. Namun untuk dapat menimbulkan pe- nyakit, inokulum tersebut harus dapat keluar dari sumbernya dan menjalani transmisi (Schuster dan Coyne, 1 9 7 4 ) . Popu- lasi parasit yang non-obligat, termasuk bakteri pustul, memperlihatkan kualitas bertahan hidup rendah dalam keadaan non-parasitik, sangat tegar dalam fase parasitik (Horsfall dan Cowling, 1 9 7 9 ) .
X. campestris pv. glycines dilaporkan dapat bertahan hidup dalam benih dan serasah kedelai. Di samping itu pa- togen ini juga dapat berperan sebagai epifit pada akar gan- dum dan parasit pada Dolichos biflorus dan Brunnichia cir- rhosa (Sinclair, 1 9 8 2 ; Kennedy dan Tachibana, 1 9 7 3 ) .
Hubungan patogen dengan benih
19 benih, dan peranan benih terinfeksi dalam penularan penya- kit belum diketahui.
Terdapatnya bakteri virulen pada benih menjamin ter- jadinya transmisi bakteri tersebut ke bagian lain, kalau benih telah tumbuh. Ada beberapa ha1 yang harus dilalui- nya. Pemindahan patogen dipengaruhi keadaan lingkungan dan faktor-faktor dari benih itu sendiri (Schuster dan Coyne, 1974). Menurut Neergaard (1979), bakteri dapat berada di dalam embrio, di luar ernbrio atau hanya sebagai kontaminan. Infeksi yang ditimbulkannya dapat berupa sistemik atau lo- kal. Bakteri yang berlokasi di dalam embrio akan menjadi aktif pada saat perkecambahan benih dan kemudian berkembang dalam jaringan kecambah dan mengikuti pertumbuhan tunas. Patogen yang berada di luar embrio, selama perkecambahan benih akan terbawa kotiledon atau kulit benih. Anatomi benih berhubungan erat dengan infeksi dan pemindahan pato- gen. Testa benih legum mengandung unsur pembuluh. Pada buncis (Phaseolus vulgaris), jaringan pembuluh "raphe", yaitu kelanjutan funikulus, merupakan tempat yang baik bagi pemindahan patogen internal. Patogen tetap berada di "ra- phew atau menyerang embrio. Xanthomonas campestris pv. phaseoli dapat juga masuk ke dalam benih buncis melalui
pada mikrofil dan akhirnya mencapai bagian dalam kulit biji.
Banyak patogen dapat bertahan hidup selama benih itu masih dapat tumbuh. Beberapa bakteri patogen ada yang mati sebelum benih kehilangan viabilitasnya, namun banyak yang justeru dapat bertahan hidup sampai masa berkecarnbah. Bak- teri X. campestris pv. phaseoli, penyebab penyakit hawar daun pada Phaseolus vulgaris, masih dapat diisolasi dari biji yang telah disimpan selama 15 tahun (Schuster dan Coyne, 1974).
Tipe perkernbangan kecambah juga mempengaruhi pemindah- an bakteri. Pada benih dengan tipe perkembangan epigeal, termasuk kedelai, juga terbuka peluang pemindahan patogen ke bagian atas kecambah.
Hubungan patogen dengan serasah
X. campestris pv. glycines dapat bertahan hidup dalam serasah (Sinclair, 1982). Namun, berapa lama ha1 itu ber- langsung belumlah diketahui.
2 1 kacang buncis yang terinfeksi. Contoh lain, X. campestris pv. ma1 vacearum, penyebab penyakit hawar bakteri pada tanaman kapas, dapat bertahan hidup bertahun-tahun pada serasah yang telah mengering (Moffett dan Croft, 1983; Schuster dan Coyne, 1974).
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Survei penyebaran penyakit dan intensitasnya dilakukan sejak bulan Agustus 1989 hingga bulan Desember 1990, secara bertahap. Untuk penyebaran penyakit, pengamatan dilakukan pada semua areal pertanaman kedelai di Kalimantan Selatan berdasarkan ada tidaknya penyakit pustul. Untuk intensitas penyakit pengamatan dilakukan pada seluruh kabupaten yang ada di Kalimantan Selatan, 9 kabupaten, dan dari tiap kabu- paten diambil satu lokasi contoh secara acak, kecuali untuk kabupaten yang hanya mempunyai satu lokasi yang mengusaha- kan tanaman kedelai.
Pekerjaan di laboratorium dan percobaan pot dilaksana- kan sejak bulan Agustus 1989 sampai bulan Juli 1990 di Ju- rusan Hama dan Penyakit Tumbuhan, Fakultas Pertanian Uni- versitas Lambung Mangkurat, Banjarbaru, Kalimantan Selatan. Khusus untuk percobaan penularan penyakit melalui polong kedelai dilaksanakan sejak bulan Desember 1991 sampai bulan Februari 1992, di Jurusan Hama dan Penyakit Tumbuhan, Fa- kultas Pertanian IPB.
Isolasi Patogen dan Uji Postulat Koch
23 ragi, 20 g dektrosa, 20 g CaC03, dan 15 g agar. Kalsium karbonat disterilisasi dalam otoklaf secara terpisah.
24 diletakkan dalam ruangan lembab dan mendapatkan setengah naungan. Inokulasi dilakukan dengan semprotan. Dari geja- la khas yang terbentuk, dilakukan isolasi dan inokulasi ulang.
Berdasarkan hasil dari dua tahapan isolasi dan inoku- lasi, isolat yang mampu menimbulkan gejala serupa di la- pangan, kemudian diperbanyak pada medium YDCA dan disimpan dalam suhu 30 C, untuk keperluan selanjutnya.
Survei Penyebaran dan Intensitas Serangan Patogen Pustul Kedelai di Kalimantan Selatan
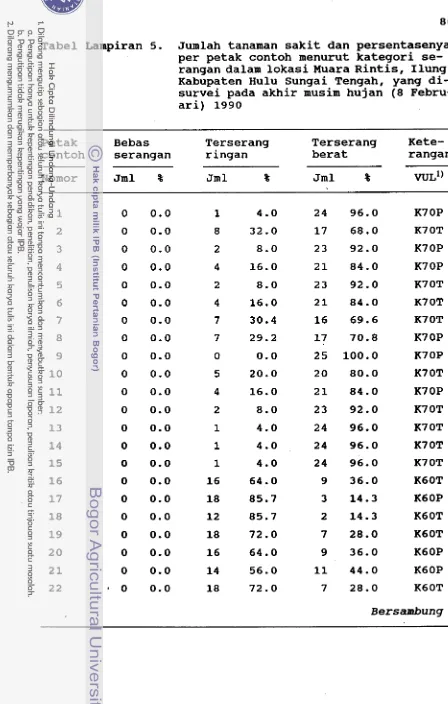
Daerah sebaran penyaki t
Untuk mendapatkan data sebaran penyakit pustul, penga- matan dilakukan diseluruh lokasi yang ada tanaman kedelai- nya di Kalimantan Selatan, yang dilaksanakan sejak Nopember 1989 sampai Oktober 1990. Setiap tanaman yang bergejala mirip pustul diambil daunnya sebagai sampel dan dibawa ke laboratorium untuk diisolasi dan diidentifikasi. Metode yang digunakan sama dengan yang telah diuraikan sebelumnya.
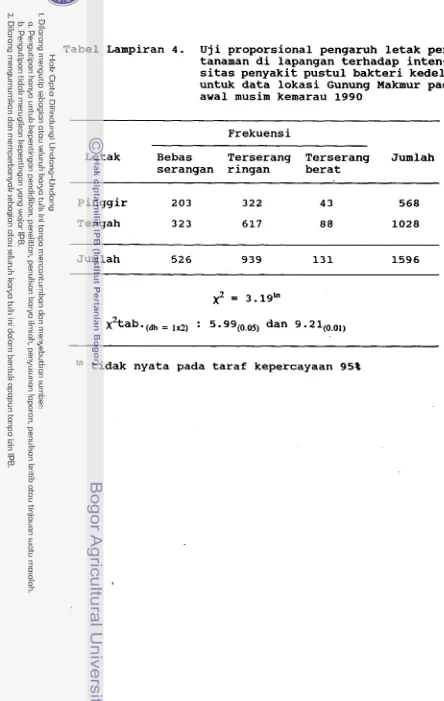
Intensitas penyakit
25 sekitar 25 m. Dengan demikian, jumlah petak contoh tiap lokasi tidak sama banyaknya karena tergantung pada luas dan bentuk areal pertanaman kedelai secara keseluruhan.
Skor penyakit ditentukan berdasarkan penilaian global gejala penyakit pada tiap rumpun tanaman, yaitu sebagai berikut :
Skor 1 = bebas, tidak ada daun yang terserang Skor 2 = terserang ringan, kurang dari 2/3 bagian
tajuk bergejala
Skor 3 = terserang berat, lebih dari 2/3 bagian tajuk berge jala
Identifikasi Patogen
Identifikasibakteri patogen dilakukan berdasarkan uji fisiologis dan biokimia menurut Lelliott dan Stead (1987), yang mengacu langsung pada pernbuktian bahwa isolat yang diuji adalah salah satu spesies Xanthomonas campestris. Diantara karakteristik yang diperlukan adalah uji reaksi Gram, uji katalase, uji oksidase, harnbatan pertumbuhan oleh TZC 1% dan 0.023, perturnbuhan kuning madu pada medium ken- tang, dan uji metabolisme oksidatif-fermentatif.
Uji Reaksi Gram
2 6
Kemudian lup diangkat perlahan dan diperhatikan timbulnya benang lendir yang lengket. Adanya benang lendir menunjuk- kan reaksi Gram negatif (Fahy dan Hayward, 1983).
Uji katalase
Ke atas koloni bakteri yang sedang tumbuh di permukaan medium NA ("nutrient agar") diteteskan 2 tetes larutan H202
3%. Bila dalam waktu singkat terbentuk gelembung udara berarti uji katalase positif.
Uji oksidase
Uji hambatan pertumbuhan oleh TZC
Sebagai larutan dasar, ke dalam 100 ml akuades steril ditambahkan 1.0 g TZC (2,3,5 trifenil tetrazolium khlorida) sehingga didapatkan larutan TZC 1%. Untuk mendapatkan me- dium NA yang mengandung 0.1% TZC, maka ke dalam 9 ml NA yang sedang mencair ( 5 5 O ~ ) ditambahkan 1 ml larutan dasar TZC, dan segera dituangkan ke dalam cawan petri. Medium NA yang mengandung TZC 0.02% didapatkan dari campuran sebanyak
9.8 ml NA yang sedang mencair dan 0.2 ml larutan dasar TZC. Pada masing-masing medium NA yang mengandung 0.1% dan 0.02% TZC di cawan petri, ditanamkan bakteri yang diuji dengan ujung jarum. Selama 3 hari inkubasi, diperhatikan ada atau tidak pertumbuhan koloni yang berawal dari ukuran sebesar titik.
Uji warna pertumbuhan bakteri pada medium sumbat kentang
Uji hambatan pertumbuhan oleh TZC
Sebagai larutan dasar, ke dalam 1 0 0 ml akuades steril ditambahkan 1.0 g TZC (2,3,5 trifenil tetrazolium khlorida) sehingga didapatkan larutan TZC 1%. Untuk mendapatkan me- dium NA yang mengandung 0 . 1 % TZC, maka ke dalam 9 ml NA yang sedang mencair (55OC) ditambahkan 1 ml larutan dasar TZC, dan segera dituangkan ke dalam cawan petri. Medium NA yang mengandung TZC 0 . 0 2 % didapatkan dari campuran sebanyak
9.8 ml NA yang sedang mencair dan 0.2 ml larutan dasar TZC. Pada masing-masing medium NA yang mengandung 0.1% dan 0 . 0 2 % TZC di cawan petri, ditanamkan bakteri yang diuji dengan ujung jarum. Selama 3 hari inkubasi, diperhatikan ada atau tidak pertumbuhan koloni yang berawal dari ukuran sebesar titik.
Uji warna pertumbuhan bakteri pada medium sumbat kentang
28
dicatat adalah berkembangnya koloni bakteri dengan warna kuning madu.
Uji metabolisme oksidatif-fermentatif
Disiapkan satu liter medium dasar yang mengandung 5.0 g NaC1, 2.0 g pepton, 0.3 g K2HP04, 3.0 g agar, 15 ml la- rutan bromothymol biru 0.2% (dalam air)
, dengan pH 7.1.
Sebelum disterilkan, medium dibagi dalam tabung Erlenmeyer ukuran 250 ml, masing-masing 90 ml. Setelah disterilkan dengan otoklaf pada suhu 121 C selama 15 menit, tabung di- letakkan dalam penangas air dengan suhu 50 C dan ke dalam- nya ditambahkan 10 ml larutan glukosa 10% steril (disteril- kan dengan filtrasi). Medium dibagi-bagi ke dalam tabung reaksi masing-masing sebanyak 6 ml. Bakteri diinokulasikan secara tusuk ("stab") masing-masing pada 2 tabung reaksi. Pada salah satu tabung, diatas medium diberi parafin cair. Inkubasi dilakukan selama 3 hari pada suhu kamar kemudian dilihat adanya perubahan warna dari biru menjadi kuning se- bagai pertanda terjadinya asam. Bila asam terjadi pada ta- bung tanpa parafin berarti metabolisme oksidatif (aerobik) positif dan bila terjadi pada tabung dengan parafin maka metabolisme fermentatif (oksidasi anaerobik) positif.29
antara lain: sangat cepat menghidrolisis pati, dapat menca- irkan gelatin, dan menghasilkan asam (bukan gas) dari su-
krosa (Sinclair, 1982).
Hidrolisis pati
Ke dalam medium YNA ("Yeast Extract Nutrient Agar") ditambahkan 0.2% amilum yang mudah larut. Dalam 1 liter YNA mengandung 5.0 g ekstrak ragi, 5.0 g pepton, 5.0 g eks- trak daging, dan 15 g agar, serta pH 6.8. Bakteri ditem- patkan pada medium, dalam cawan petri, dan diinkubasikan pada suhu kamar selama 3 sampai 7 hari. Setelah itu kultur digenangi dengan larutan Lugol sehingga amilum berwarna bi- ru kehitaman. Zona jernih di sekitar kultur bakteri meng- gambarkan terjadinya hidrolisis pati (Fahy & Hayward, 1983)
.
Larutan Lugol dibuat dari 1.0 g I2, 2.0 g
KI, dan 300 ml akuades (Kiraly et al., 1974).Pencairan gelatin
30
Pembentukan asam dari sukrosa
Disediakan medium C-Dye, yang ditambahkan dengan 0.5% sukrosa yang telah disterilkan dengan filtrasi. Satu liter medium C-Dye mengandung 0.5 gNH4H2P04, 0.5 g K2HP04, 0.2 g MgS04.7H20, 5.0 g NaC1, 1.0 g ekstrak ragi, 12.0 g agar, dan 0.7 ml larutan Bromokresol ungu 1.5% (dilarutkan dalam alkohol). Tingkat pH medium 6.8. Bakteri yang diuji ditanamkan secara tusuk dan diamati 2, 4, 7, 21, dan 28 hari setelah tanam. Warna kuning menunjukkan terbentuknya asam.
Kehilangan Hasil
30 Pembentukan asam dari sukrosa
Disediakan medium C-Dye, yang ditambahkan dengan 0.5% sukrosa yang telah disterilkan dengan filtrasi. Satu liter medium C-Dye mengandung 0.5 gNH4H2P04, 0.5 g K2HP04, 0.2 g MgS04. 7H20, 5.0 g NaC1, 1.0 g ekstrak ragi, 12.0 g agar, dan 0.7 ml larutan Bromokresol ungu 1.5% (dilarutkan dalam alkohol). Tingkat pH medium 6.8. Bakteri yang diuji ditanamkan secara tusuk dan diamati 2, 4, 7, 21, dan 28 hari setelah tanam. Warna kuning menunjukkan terbentuknya asam.
Kehilangan Hasil
31
lingkungan yang dipilih adalah Rancangan Acak Lengkap. Tiap pot diisi dengan 10 kg tanah yang telah disterilkan dengan uap panas selama 1 jam. Pot disusun secara acak di atas meja papan yang tingginya 1 m. Tiap pot berjarak 1 m, dan masing-masing pot dipupuk dengan 0.51 g Urea, 0.67 g TSP, dan 0.60 g KC1. Sebelum ditanam, benih terlebih da- hulu diberi inokulan bakteri Rhizobium dengan cara mencam- pur 1.0 g inokulan sedikit air dan dicampur merata dengan
0.1 kg benih.
Inokulasi bakteri patogen dilakukan pada saat tanaman berumur 21 hari, dengan cara menyemprotkan suspensi bakteri pada permukaan bawah daun. Kepadatan inokulum adalah seki- tar 10' sel hiduplml (ditera menggunakan dedar McFarland)
.
Setelah disemprot, tanaman ditutup dengan kantong plastik selama 24 jam. Setelah kantong itu dibuka, pot diletakkan di tempat teduh selama 4 jam untuk penyesuaian, dan kemudi- an diletakkan pada meja papan menurut pengacakan semula.Selama percobaan berlangsung, tanaman disemprot secara berkala, satu kali dalam seminggu, dengan insektisida Decis
2.5 EC (bahan aktifnya deltamethrin) dengan dosis 0.5 ml/l air. Tanaman disiram 1-2 kali sehari.
Hubungan Patogen dengan Benih Kedelai Persentase benih terinfeksi dan lokasi bakteri
Benih berasal dari tanaman kedelai yang terserang. Untuk maksud tersebut, disediakan lahan berukuran 2 m
x
4 m. Pada lahan tersebut dibuat bedengan-bedengan kecil sejajar sisi terpendek, dengan jarak masing-masing 0.5 m. Pada tiap bedengan ditanami kedelai, satu benih satu lo- bang, dengan jarak 25 cm. Sebelum ditanami, lahan dipupuk dengan 81.8 g Urea, 106.7 g TSP, dan 96 g KC1. Karena la- han yang digunakan adalah bekas tanaman kedelai juga, maka tidak diperlukan pemberian Rhizobiurn. Inokulasi dilakukan pada waktu tanaman berumur 3 minggu dengan kepadatan inoku- luml o 8
sel hidup/ml, dengan cara menyemprot pada permukaan bawah daun. Setelah panen, biji dipisahkan dari polong dan diletakkan dalam tampah serta diaduk merata. Dari sejumlah benih yang ada diambil secara acak sebanyak 100 biji untuk keperluan selanjutnya.Tiap benih, setelah dicelup dalam larutan NaOCl 1% 5
33
varietas Galunggung. Perkembangan gejala diamati tiap hari hingga timbul gejala yang khas.
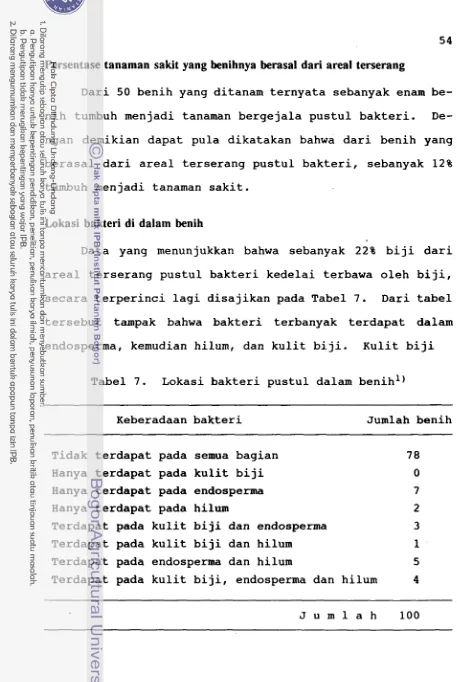
Persentase tanaman sakit yang benihnya berasal dari tanaman terserang
Benih diambil dari karung, hasil panen dari areal ter- serang, dengan alat pengambil contoh sebanyak 50 benih. Untuk itu disediakan 50 buah pot plastik yang berdiameter f 20 cm dan masing-masing diisi dengan 3 kg tanah steril. Pot disusun di atas meja papan yang tingginya 1 m, dengan jarak 1 m. Tanah dipupuk dengan 0.15 g Urea, 0.2 g TSP,
dan 0.18 KC1 per pot. Kurang lebih 1 g Rhizobium diberi
sedikit air dan diaduk dengan benih yang akan ditanam. Ti- ap pot ditanami satu benih kedelai. Pengamatan adanya ge- jala penyakit dilakukan sejak munculnya kotiledon sampai tanaman berbunga. Pot yang tanamannya terserang penyakit dikeluarkan dari meja papan.
Infeksi melalui polong
Untuk maksud ini disediakan 60 buah "polybagM, yang masing-masing diisi 5 kg tanah. Tiap pot dipupuk dengan
0.25 g Urea, 0.33 g TSP, dan 0.30 g KC1. Sekitar 0.2 g