61
EKSTRAKSI DAN UJI STABILITAS ZAT WARNA ALAMI
DARI BUNGA KEMBANG SEPATU (
Hibiscus rosa-sinensis
L.)
DAN BUNGA ROSELLA (
Hibiscus sabdariffa
L.)
NURLELA
PROGRAM STUDI KIMIA
FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH
JAKARTA
EKSTRAKSI DAN UJI STABILITAS ZAT WARNA ALAMI DARI BUNGA KEMBANG SEPATU (Hibiscus rosa-sinensis L.)
DAN BUNGA ROSELLA (Hibiscus sabdariffa L.)
Skripsi
Sebagai Salah Satu Syarat Untuk Memperoleh Gelar Sarjana Sains Program Studi Kimia
Fakultas Sains dan Teknologi
Universitas Islam Negeri Syarif Hidayatullah Jakarta
Oleh: NURLELA 107096002891
PROGRAM STUDI KIMIA FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH JAKARTA
EKSTRAKSI DAN UJI STABILITAS ZAT WARNA ALAMI DARI BUNGA KEMBANG SEPATU (Hibiscus rosa-sinensis L.)
DAN BUNGA ROSELLA (Hibiscus sabdariffa L.)
Skripsi
Sebagai Salah Satu Syarat Untuk Memperoleh Gelar Sarjana Sains Program Studi Kimia
Fakultas Sains dan Teknologi
Universitas Islam Negeri Syarif Hidayatullah Jakarta
Oleh: NURLELA 107096002891
Menyetujui,
Pembimbing I Pembimbing II
Yusraini Dian Inayati Siregar, M.Si Adi Riyadhi, M.Si NIP. 19770512 200112 2 002 NIP. 19780621 200910 1 003
Mengetahui,
Ketua Program Studi Kimia
PENGESAHAN UJIAN
Skripsi yang berjudul “Ekstraksi dan Uji Stabilitas Zat Warna Alami dari Bunga Kembang Sepatu (Hibiscus rosa-sinensis L.) dan Bunga Rosella (Hibiscus sabdariffa L.)” yang ditulis oleh Nurlela, NIM 107096002891 telah diuji dan dinyatakan lulus dalam sidang Munaqosyah Fakultas Sains dan Teknologi, Universitas Islam Negeri Syarif Hidayatullah Jakarta pada tanggal “13 Desember 2011”. skripsi ini telah diterima sebagai salah satu syarat untuk memperoleh gelar Sarjana Strata Satu (S1) Program Studi Kimia.
Menyetujui,
Penguji I Penguji II
Drs. Dede Sukandar, M.Si Hendrawati, M.Si NIP. 19650104 199103 1 004 NIP. 19720815 200312 2 001
Pembimbing I Pembimbing II
Yusraini Dian Inayati Siregar, M.Si Adi Riyadhi, M.Si NIP. 19770512 200112 2 002 NIP. 19780621 200910 1 003
Mengetahui,
Dekan Fakultas Sains dan Teknologi Ketua Program Studi Kimia
Lihat segalanya lebih dekat sehingga bisa menilai lebih bijak, Jadikan hati seluas samudra yang tak bertepi,
Tegar bagai batu karang, tak teriakkan keluh kesah... _hci_
Kupersembahkan skripsi ini untuk kedua oang tua ku, Sebagai perwujudan baktiku pada kalain
Kuberikan untuk kedua adikku, Sebagai bentuk panutan untuk kalian
Kuhadiahkan untukmu, Sebagai ungkapan kasihku padamu
Teruntuk almarhumah nenek ku tercinta, yang tak sempat melihat kelulusan ku...
Terimakasihku untuk segala do’a, cinta, air mata dan ketulusan untuk kedua orang tuaku dan kedua adikku,
untuk dukungan keluarga besarku, untuk ilmu yang telah diberikan guru-guruku,
untuk kebersamaan KIM IA 20 07 (u’r best friend ever, semoga silaturahmi selalu terjaga),
untuk segala nasihat dan kasih sayang sahabatku W idia, untuk canda tawa, suka duka dan tangis bersama, W afa,
untuk semua orang yang mengakui keberadaanku,
dan untuk dirimu yang selalu memberikan do’a, dukungan, sayang, motivasi dan semangat yang tak pernah lelah untuk terus membuatku tegar berdiri walau dalam
tangis,,...
Kita tidak pernah tahu,
Sampai kita berusaha untuk mengerti Kita tidak akan pernah bisa,
Sampai kita mau untuk mencobanya
ABSTRAK
NURLELA. Ekstraksi dan Uji Stabiltas Zat Warna Alami dari Bunga Kembang Sepatu (Hibiscus rosa-sinensis L) dan Bunga Rosella (Hibiscus sabdariffa L). Yusraini DIS, M.Si dan Adi Riyadhi, M.Si.
Ekstraksi dan Uji Stabilitas Zat Warna Alami dari Bunga Kembang Sepatu (Hibiscus rosa-sinensis L) dan Bunga Rosella (Hibiscus sabdariffa L) telah dilakukan. Penelitian bertujuan untuk mengekstraksi bunga kembang sepatu dan bunga rosella dengan mencari temperatur dan konsentrasi yang optimum untuk mendapatkan pigmen dari bunga kembang sepatu dan bunga rosella dengan pelarut air dan etanol, selain itu dilakukan juga uji stabilitas zat warna. Analisa kadar zat warna dilakukan dengan metode spektrofotometri. Hasil ekstrasi optimum menggunakan metode maserasi dengan pelarut air adalah pada temperatur 90 °C dan dengan pelarut etanol pada konsentrasi 96%. Uji stabilitas warna memberikan hasil sebagai berikut: a) Kondisi penyimpanan, sinar matahari dan sinar lampu dapat mempengaruhi stabilitas zat warna ekstrak bunga Kembang Sepatu dan bunga Rosella dengan meningkatnya perentase nilai absorbansi pada kedua ekstrak. b) Penambahan oksidator, H2O2 dapat mempengaruhi stabilitas zat
warna ekstrak bunga Kembang Sepatu dan bunga Rosella dengan penurunan persentase nilai absorbansi ekstrak air dan etanol. c) Nilai pH yang semakin meningkat, dari pH 4 ke pH 5, mempengaruhi stabilitas zat warna ekstrak bunga Kembang Sepatu dan bunga Rosella dengan perubahan persentase nilai absorbansi ekstrak air dan etanol.
ABSTRACT
NURLELA. Ekstraksi dan Uji Stabiltas Zat Warna Alami dari Bunga Kembang Sepatu (Hibiscus rosa-sinensis L) dan Bunga Rosella (Hibiscus sabdariffa L). Yusraini DIS, M.Si dan Adi Riyadhi, M.Si.
Extraction and Stability Tests of Natural Dye Hibiscus Flower (Hibiscus rosa-sinensis L) and Rosella Flower (Hibiscus sabdariffa L) has been done. The research aims to extract Hibiscus flower and Rosella flower by finding the optimum temperature and concentration to get the pigments of flowers with water and ethanol solvent, as well as studying the stability of the dye. Analysis of dye levels is done by spectrophotometric methods. The optimum results of extraction by maceration were at temperature of 90 °C for water solvent and at concentration of 96% for ethanol solvent. The dye stability test gave the following results: a) The storage condition, sunlight and lamp light can affect the stability of the dye extracts of Hibiscus flower and Rosella flower by increasing percentage absorbance level in both extracts, b) The addition of an oxidant, hydrogen peroxide can affect the stability of the dye extracts of Hibiscus flower and Rosella flower through decrease percentage value of absorbance, c) The increasing level of pH, from pH 4 to pH 5, can affect the stability of the dye extracts of Hibiscus flower and Rosella flower through decrease percentage value of absorbance both of water and ethanol solvent.
KATA PENGANTAR
Alhamdulillahi Rabbil’alamin, puji dan syukur penulis panjatkan kepada
Allah S.W.T yang senantiasa melimpahkan rahmat dan hidayah-Nya sehingga
penulis dapat menyelesaikan skripsi yang berjudul ” Ekstraksi dan Uji Stabilitas
Zat Warna Alami dari Bunga Kembang Sepatu (Hibiscus rosa-sinensis L.)
dan Bunga Rosella (Hibiscus sabdariffa L.)” yang disusun berdasarkan
rancangan penelitian dalam rangka Tugas Akhir sebagai salah satu syarat untuk
memperoleh gelar sarjana sains.
Penulis mengucapkan terima kasih kepada berbagai pihak yang
membantu dalam penyelesaian skripsi ini, antara lain :
1. Yusraini, D.I.S, M.Si sebagai Dosen Pembimbing I Penelitian Tugas Akhir
Fakultas Sains dan Teknologi UIN Syarif Hidayatullah Jakarta.
2. Adi Riyadhi, M.Si sebagai Dosen Pembimbing II Penelitian Tugas Akhir
Fakultas Sains dan Teknologi UIN Syarif Hidayatullah Jakarta.
3. Drs. Dede Sukandar, M.Si sebagai Ketua Program Studi Kimia, Fakultas
Sains dan Teknologi UIN Syarif Hidayatullah Jakarta.
4. Dr. Syopiansyah Jaya Putra, M.Sis, selaku Dekan Fakultas Sains dan
Teknologi UIN Syarif Hidayatullah Jakarta.
5. DR. Mirzan T Razzak, M. Eng, APU, sebagai Ketua Pusat Laboratorium
Terpadu UIN Syarif Hidayatullah Jakarta.
6. Seluruh Staf Pusat Laboratorium Terpadu Lab. Kimia yang telah membantu
7. Kedua orang tua yang selalu memberikan do’a dan dukungan yang tiada
henti-hentinya kepada penulis.
8. Teman-teman Kimia Angkatan 2007 yang tidak dapat disebutkan satu per
satu yang telah memberikan saran dan motivasinya.
9. Heru Cahyo Irawan, untuk segala waktu, diskusi dan dukungannya kepada
penulis.
Penulis menyadari skripsi ini jauh dari kesempurnaan, oleh karena itu
kritik dan saran sangat dibutuhkan dari berbagai pihak dan penulis berharap
semoga skripsi ini dapat bermanfaat.
Jakarta, Desember 2011
DAFTAR ISI
1.4 Tujuan Penelitian ... 4
1.5 Manfaat Penelitian ... 4
BAB II TINJAUAN PUSTAKA 2.1 Kembang Sepatu (Hibiscus rosa-sinensis L.) ... 5
2.1.1 Klasifikasi Tanaman ... 6
2.1.2 Kandungan Kimia ... 7
2.2 Rosella (Hibiscus sabdariffa L.) ... 7
2.2.1 Klasifikasi Tanaman ... 9
2.2.2 Kandungan Kimia ... 9
2.3 Flavanoid... 10
2.7.2 Pewarna Identik Alami ... 23
2.7.3 Pewarna Sintetik ... 24
2.7.4 Bahaya Pewarna Sintetik ... 27
2.8.1 Prinsip Dasar Spektrofotometer UV-Vis ... 29
2.8.2 Hukum Beer-Lambert ... 30
2.8.3 Instrumen Spektrofotometer UV-Vis ... 31
BAB III METODE PENELITIAN 3.1 Tempat dan Waktu Penelitian ... 35
3.2 Alat dan Bahan ... 35
3.3 Prosedur Penelitian ... 35
3.4 Uji Stabilitas Warna... 35
3.4.1 Pengaruh Temperatur Penyimpanan ... 36
3.4.2 Pengaruh Lama Penyinaran Matahari ... 36
3.4.3 Pengaruh Lama Penyinaran Lampu ... 37
3.4.4 Pengaruh Waktu Penambahan Oksidator ... 37
3.4.5 Pengaruh Penambahan pH ... 37
BAB IV PEMBAHASAN 4.1 Optimasi Ekstraksi... 38
4.2 Uji Stabiltas Zat Warna... 41
4.2.1 Pengaruh Temperatur Penyimpanan ... 42
4.2.2 Pengaruh Lama Penyinaran Matahari ... 43
4.2.3 Pengaruh Lama Penyinaran Lampu ... 45
4.2.4 Pengaruh Waktu Penambahan Oksidator ... 46
4.2.5 Pengaruh Penambahan pH ... 49
BAB V KESIMPULAN DAN SARAN 5.1 Kesimpulan ... 51
5.2 Saran ... 52
DAFTAR TABEL
Tabel 1. Daftar zat pewarna alami yang diizinkan di Indonesia ... 22
Tabel 2. Daftar zat pewarna sintetik yang diizinkan di Indonesia ... 25
Tabel 3. Daftar zat pewarna yang dilarang di Indonesia ... 28
Tabel 4. Persentase perubahan nilai absorbansi karena pengaruh temperatur penyimpanan. ... 42
Tabel 5. Persentase perubahan nilai absorbansi akibat lama penyinaran
matahari ... 44
Tabel 6. Persentase nilai absorbansi karena lama penyinaran lampu ... 45
DAFTAR GAMBAR
Gambar 1. Kembang Sepatu (Hibiscus rosa-sinensis L.)... 5
Gambar 2. Struktur kandungan senyawa yang ada dalam Kembang Sepatu.7 Gambar 3. Rosella (Hibiscus sabdariffa L) ... 8
Gambar 4. Struktur antosianin dari bunga Rosella. ... 10
Gambar 5. Kerangka dasar dan penomoran flavanoid ... 11
Gambar 6. Beberapa senyawa golongan flavanoid ... 12
Gambar 7. Struktur umum dari antosianin. ... 13
Gambar 8. Transformasi struktur antosianin dalam larutan air. ... 15
Gambar 9. Perubahan struktur akibat pengaruh penambahan buffer pH ... 16
Gambar 10. Struktur senyawa golongan karotenoid ... 23
Gambar 11. Struktur Kimia Carmoisine ... 26
Gambar 12. Diagram spektrofotometri UV-Vis ... 31
Gambar 13. Hubungan absorbansi dengan variasi suhu maserasi bunga Kembang Sepatu dan Rosella ... 39
Gambar 14. Hubungan absorbansi dengan variasi konsentrasi etanol terhadap bunga Kembang Sepatu dan Rosella. ... 40
Gambar 15. Hubungan absorbansi dengan pengaruh oksidator ... 47
Gambar 16. Reaksi yang terjadi karena penambahan hidrogen peroksida ... 48
Gambar 17. Hubungan absorbansi dengan penambahan buffer pH... 49
DAFTAR LAMPIRAN
Lampiran 1... 57
Lampiran 2... 58
BAB I
PENDAHULUAN
1.1Latar Belakang Masalah
Dewasa ini sering ditemukan penggunaan pewarna sintetik dalam berbagai
macam industri seperti tekstil, makanan, dan obat. Penggunaan pewarna sintetik
yang tidak sesuai dapat berdampak buruk terhadap kesehatan dan juga
lingkungan. Khususnya dalam bidang makanan dan obat, pemerintah dalam hal
ini melalui Kementerian Kesehatan mengatur dengan ketat penggunaan pewarna
sintetik pada bahan makanan dan obat, karena bahayanya yang bisa ditimbulkan.
Bahan pewarna dapat digolongkan ke dalam tiga golongan yaitu bahan
pewarna sintesis, bahan pewarna yang dibuat mirip dengan bahan pewarna alami
(identik alami) dan bahan pewarna alami (Depkes, 1988). Bahan pewarna alami
untuk makanan paling banyak dibuat dari ekstrak tumbuhan, tetapi ada juga dari
sumber lain seperti serangga, ganggang, cyanobacteria, dan jamur (Mortensen,
2006).
Penggunaan pewarna sintetis dalam produk pangan dapat digantikan
dengan pewarna alami. Beberapa tanaman telah diteliti sebagai bahan pewarna
alami diantaranya adalah ekstrak bunga Tagetes erecta L sebagai pewarna tekstil
(Jothi, 2008), ekstrak antosianin dari Red cabbage (Xavier, et al. 2008), ekstrak
daun tanaman Indigofera tinctoria Linn. dan ekstrak daun tanaman
Baphicacanthus cusia Brem (Chanayath, et al, 2002).
Bahan pewarna alami dipilih berdasarkan ketersedian di alam, dan
rosa-sinensis L.) dan bunga Rosella (Hibiscus sabdariffa L.) banyak tersedia di sekitar
kita, namun pemanfaatan sebagai pewarna alami belum banyak diteliti. Oleh
sebab itu, perlu dilakukan penelitian ekstrak Bunga Kembang Sepatu dan Rosella
sebagai zat pewarna alami.
Kembang sepatu (Hibiscus rosa-sinensis L.) adalah tanaman semak suku
Malvaceae yang berasal dari Asia Timur dan banyak ditanam sebagai tanaman
hias di daerah tropis dan subtropis. Bunga besar dan berwarna merah.
Pemanfaatan bunga kembang sepatu selain sebagai tanaman hias, bunga kembang
sepatu dipercaya oleh masyarakat sebagai obat demam, batuk dan sariawan,
sedangkan sebagai bahan pewarna belum banyak digunakan.
Bunga Rosella (Hibiscus sabdariffa Linn.) adalah tanaman dari famili
Kembang Sepatu. Tananaman Rosella berasal dari Afrika dan Timur Tengah,
termasuk tanaman perdu yang bisa mencapai 3-5 meter tingginya. Jika sudah
dewasa, tanaman ini akan mengeluarkan bunga berwarna merah. Pemanfaatan
bunga Rosella sebagai tanaman hias, juga dipercaya oleh masyarakat sebagai obat
memperlancar peredaran darah dan mencegah tekanan darah tinggi (Ali, et al,
2005), sedangkan sebagai bahan pewarna belum banyak digunakan.
Zat warna dari tanaman dapat diambil dengan menggunakan teknik
ekstraksi, diantaranya adalah ekstraksi dengan menggunakan pelarut air atau
etanol. Silva, et al (2008) telah melakukan ekstraksi pada biji Bixa orellana L.
dengan menggunakan pelarut super kritis karbon dioksida. Ekstraksi juga dapat
dilakukan dengan bantuan enzim hidrolisis (Kim, et al, 2005). Teknik ekstraksi
dipilih berdasarkan kemudahnnya dan banyaknya zat warna yang berhasil
Penelitian yang dilakukan bertujuan untuk mengekstraksi bunga Kembang
Sepatu dan bunga Rosella dengan mencari temperatur dengan pelarut air dan
konsentrasi etanol yang optimum untuk mendapatkan pigmen dari bunga
Kembang Sepatu dan bunga Rosella, selain itu dilakukan juga uji stabilitas zat
warna. Analisa kadar zat warna dilakukan dengan metode spektrofotometri.
1.2 Rumusan Masalah
1. Pada kondisi bagaimanakah metode maserasi dengan pelarut air dan etanol
dapat mengekstrak bunga Kembang Sepatu dan bunga Rosella secara
optimum?
2. Apakah faktor lingkungan dapat mempengaruhi stabilitas zat warna dari
ekstrak bunga Kembang Sepatu dan ekstrak bunga Rosella?
1.3Hipotesis
1. Pelarut air dan etanol dapat digunakan untuk mengesktrak bunga
Kembang Sepatu dan bunga Rosella pada kondisi optimum.
2. Faktor lingkungan dapat mempengaruhi stabilitas zat warna dari bunga
1.4 Tujuan Penelitian
1. Mengoptimasi metode ekstrak untuk mendapatkan zat warna dari bunga
Kembang Sepatu dan bunga Rosella.
2. Mengetahui pengaruh lingkungan terhadap stabilitas zat warna.
1.5 Manfaat dan Kegunaan Penelitian
Hasil dari penelitian ini dapat menambah inventaris bahan pewarna alami
yang dapat digunakan sebagai pewarna tambahan untuk makanan, kosmetik,
BAB II
TINJAUAN PUSTAKA
2.1 Kembang Sepatu (Hibiscus rossa-sinensis L.)
Bunga Kembang Sepatu atau dalam bahasa latinnya Hibiscus rosa-sinensis
L. merupakan tanaman hias yang banyak dijumpai di Indonesia. Oleh sebab itu,
bunga ini mempunyai beberapa nama yang dikenal di banyak daerah, seperti di
Aceh (Bungong roja), Jawa Barat (Kembang Wera), Bali (Waribang), Nusa
Tenggara (Embuhanga), Sulawesi (Ulange), Maluku (Ubu-ubu) dan Tidore (Bala
bunga). Ada pula nama internasionalnya seperti di Filipina dikenal dengan nama
Gumamela (Plantanamor, 2008).
Gambar 1. Kembang sepatu (Hibiscus rosa-sinensis L.).
Bunga Kembang Sepatu mempunyai kelopak bunga berwarna merah, ada
pula yang berwarna kuning dan merah muda. Merupakan bunga tunggal yang
berbentuk terompet dan terletak di ketiak daun. Kelopak bunga berbentuk
lonceng, berbagi lima dan berwarna hijau kekuningan. Mahkota bunga terdiri dari
15-20 daun mahkota berwarna merah muda, mempunyai benang sari banyak
dengan tangkai sari berwarna merah, kepala sari berwarna kuning dan putik
berbentuk tabung, seperti terlihat pada Gambar 1.
Bunga pada tanaman Kembang Sepatu bergantung pada panjang umur dan
pergantian bunga. Biasanya bunga Kembang Sepatu bertahan hanya satu hari dan
Tanaman Kembang Sepatu banyak ditanam selain karena keindahan warna
yang dihasilkan juga bermanfaat untuk kesehatan. Sudah sejak lama tanaman
Kembang Sepatu dimanfaatkan oleh masyarakat sebagai tanaman obat. Biasanya
sebagai obat demam pada anak-anak, obat batuk dan obat sariawan (Iqbal &
Sulistyorini, 2009).
Bunga Kembang Sepatu berkerabat dekat dengan Waru Gunung (Hibiscus
macrophyllus Roxb. ex Hornem), Mrambos Merah (Hibiscus radiatus Cav),
Rosella (Hibiscus sabdariffa var sabdariffa Linn.), Wora-wari Gantung (Hibiscus
schizopetalus (Mast.)Hook.F), Waru Gombong (Hibiscus similis BI), Bunga
Sepatu Mawar (Hibiscus syriacus L.), Waru Lengis (Hibiscus tiliaceus L.), Waru
Landak (Hibiscus mutabilis L.), Hibiscus (Hibiscus aculeatus Walt.), Yute Jawa
(Hibiscus cannabinus L.) (Plantanamor, 2008).
2.1.1 Klasifikasi Tanaman (Plantanamor, 2008)
Kingdom : Plantae (Tumbuhan)
Subkingdom : Tracheobionta (Tumbuhan berpembuluh)
Super Divisi : Spermatophyta (Menghasilkan biji)
Divisi : Magnoliophyta (Tumbuhan berbunga)
Kelas : Magnoliopsida (berkeping dua / dikotil)
Sub Kelas : Dilleniidae
Ordo : Malvales
Famili : Malvaceae (suku kapas-kapasan)
Genus : Hibiscus
2.1.2 Kandungan Kimia
Daun, bunga, dan akar Kembang Sepatu mengandung flavonoida. Di
samping itu daunnya juga mengandung saponin dan polifenol, bunga mengandung
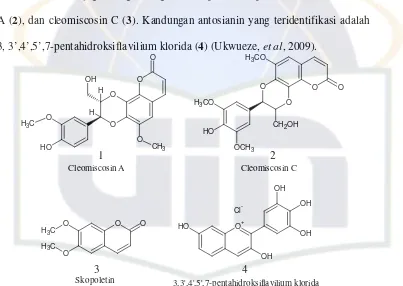
polifenol, akarnya juga mengandung tanin, saponin, skopoletin (1), cleomiscosin
A (2), dan cleomiscosin C (3). Kandungan antosianin yang teridentifikasi adalah
3, 3’,4’,5’,7-pentahidroksiflavilium klorida (4) (Ukwueze, et al, 2009).
Gambar 2. Struktur kandungan senyawa yang ada dalam Kembang Sepatu.
2.2 Rosella (Hibiscus sabdariffa Linn.)
Rosella (Hibiscus sabdariffa var sabdariffa Linn.) adalah tanaman hias
taman luar ruangan dari keluarga kembang sepatu, yang berasal dari Afrika dan
Timur Tengah. Biasa dikenal di Inggris dengan nama Rosella atau red sorrel dan
Gambar 3. Rosela (Hibiscus sabdariffa L).
Rosella merupakan tanaman perdu yang mempunyai tinggi 3-5 meter dan
akan mengeluarkan bunga berwarna merah jika sudah dewasa. Pigmen merah dari
bunga Rosella disebabkan karena kandungan antosianinnya yang tinggi (Mardiah,
2010), namun tidak stabil selama proses pemanasan (Gozales-Palomares, et al,
2009).
Tanaman Rosella memiliki dua varietas dengan budidaya dan manfaat
yang berbeda, yaitu: (i) Hibiscus sabdariffa var. Altisima, Rosella berkelopak
bunga kuning yang sudah lama dikembangkan untuk diambil serat batangnya
sebagai bahan baku pulp dan karung goni; dan (ii) Hibiscus sabdariffa var.
Sabdariffa, Rosella berkelopak bunga merah serta membentuk seperti cup. Jenis
Rosella var. Sabdariffa yang kini mulai diminati petani dan dikembangkan untuk
diambil kelopak bunga dan bijinya, dikonsumsi dibanyak negara sebagai
minuman dingin maupun minuman hangat (Ali, et al, 2005).
Rosella mempunyai kekerabatan dengan bunga Waru Gunung (Hibiscus
macrophyllus Roxb. ex Hornem), Mrambos Merah (Hibiscus radiatus Cav),
Kembang Sepatu (Hibiscus rosa-sinensis L.), Wora-wari Gantung (Hibiscus
schizopetalus (Mast.) Hook.F), Waru Gombong (Hibiscus similis BI), Bunga
Landak (Hibiscus mutabilis L.), Hibiscus (Hibiscus aculeatus Walt.), Yute Jawa
(Hibiscus cannabinus L.).
Di Indonesia sendiri Rosella dikenal dengan beberapa nama, seperti rosela,
perambos, gamet walanda (Sunda), kasturi roriha (Ternate). Di Inggris dikenal
dengan nama Roselle atau red sorrel, dan di Cina dengan nama luo shen kui dan
luo shen hua.
2.2.1 Klasifikasi Tanaman (Plantanamor, 2008)
Kingdom : Plantae (Tumbuhan)
Subkingdom : Tracheobionta (Tumbuhan berpembuluh)
Super Divisi : Spermatophyta (Menghasilkan biji)
Divisi : Magnoliophyta (Tumbuhan berbunga)
Kelas : Magnoliopsida (berkeping dua / dikotil)
Sub Kelas : Dilleniidae
Ordo : Malvales
Famili : Malvaceae (suku kapas-kapasan)
Genus : Hibiscus
Spesies : Hibiscus sabdariffa L.
2.2.2 Kandungan Kimia
Bunga dan biji Rosella dapat dimanfaatkan sebagai tanaman herbal dan
bahan baku minuman kesehatan, di dalam DepKes RI No SPP 1065/35.15/05,
setiap 100 gram kelopak bunga Rosella mempunyai kandungan gizi sebagai
O+
mg, zat besi 8,98 mg, malic acid 3,31%, fruktosa 0,82%, sukrosa 0,24%, karoten
0,029%, tiamin 0,117 mg, niasin 3,765 mg, dan vitamin C 244,4 mg. Kandungan
vitamin C yang tinggi ini dapat berfungsi sebagai bahan antioksidan dalam tubuh.
(Kustyawati & Sulastri, 2008).
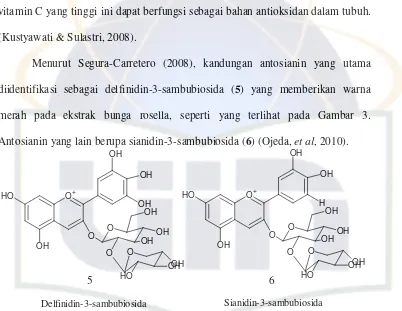
Menurut Segura-Carretero (2008), kandungan antosianin yang utama
diidentifikasi sebagai delfinidin-3-sambubiosida (5) yang memberikan warna
merah pada ekstrak bunga rosella, seperti yang terlihat pada Gambar 3.
Antosianin yang lain berupa sianidin-3-sambubiosida (6) (Ojeda, et al, 2010).
Gambar 4. Struktur antosianin dari bunga Kembang Sepatu.
2.3 Flavanoid
Flavonoid merupakan molekul polifenol yang larut air yang mengandung
15 atom karbon. Flavonoid termasuk kedalam famili polifenol. Kerangka dsar
flavonoid (7) dapat dilihat sebagai dua cincin benzena yang bergabung
bersama-sama dengan tiga rantai karbon yang pendek (Tanaka, et al, 2008). Lebih dari
4.000 jenis flavanoid telah teridentifikasi, banyak terdapat dalam buah-buahan,
sayuran dan minuman (teh, kopi, bir, minuman anggur dan buah).
Salah satu karbon dari rantai pendek selalu terhubung ke karbon dari salah
satu cincin benzene (A dan B), baik secara langsung atau melalui jembatan
oksigen, sehingga membentuk sebuah cincin tengah ketiga, yang beranggotakan
lima atau enam karbon (lingkaran cincin beroksigen atau cincin C). Penomoran
flavanoid (8) dapat dilihat pada Gambar 5 (Giacarini, 2008).
Gambar 5. Kerangka dasar dan penomoran flavanoid.
Flavonoid merupakan senyawa polifenol yang melimpah di alam dan
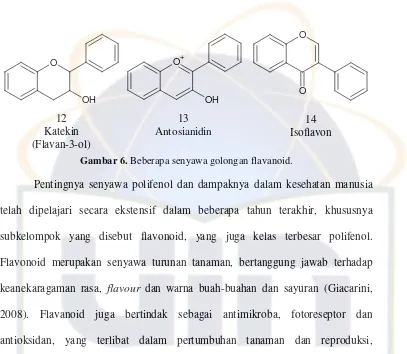
dikategorikan, menurut struktur kimianya, ke dalam flavonol, flavon, flavanon,
isoflavon, katekin, antosianidin, dan kalkon (Tanaka, et al, 2008). Flavanoid
dibagi ke dalam enam sub kelompok utama berdasarkan variasi pada cincin C:
flavon (9), flavonol (10), flavanon (11), flavanol (12) (katekin dan
Gambar 6. Beberapa senyawa golongan flavanoid.
Pentingnya senyawa polifenol dan dampaknya dalam kesehatan manusia
telah dipelajari secara ekstensif dalam beberapa tahun terakhir, khususnya
subkelompok yang disebut flavonoid, yang juga kelas terbesar polifenol.
Flavonoid merupakan senyawa turunan tanaman, bertanggung jawab terhadap
keanekaragaman rasa, flavour dan warna buah-buahan dan sayuran (Giacarini,
2008). Flavanoid juga bertindak sebagai antimikroba, fotoreseptor dan
antioksidan, yang terlibat dalam pertumbuhan tanaman dan reproduksi,
menyediakan ketahanan terhadap patogen dan predator dan melindungi tanaman
dari penyakit (Cheynier, 2005).
Menurut Pietta (2000), flavanoid bertindak sebagai antioksidan pada
tanaman, antimikroba, fotoreseptor, attractor visual, penolak makan, dan untuk
penyaringan cahaya. Banyak studi telah menyatakan bahwa flavonoid
menunjukkan aktivitas biologis, termasuk antiallergenic, antivirus, anti-inflamasi,
dan efek vasodilatasi (Jordheim, 2007).
2.4 Antosianin
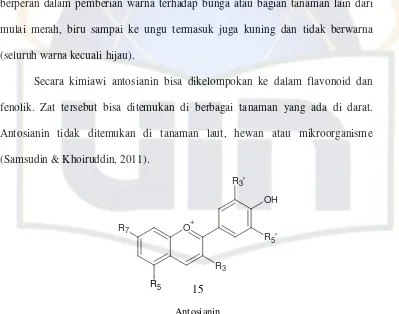
Antosianin (15) adalah molekul polar dengan hidroksil, karboksil,
kelompok metoksil dan glikolil terikat untuk cincin aromatik (Xavier, et al, 2008).
Keterangan:
Petunidin R3’=OCH3, R5’=OH Malvidin R3’=OCH3, R5’=OCH3
R3=OH
Capensinidin R5=CH3, R7=OH, R3’=OCH3, R5’=OCH3 Hirsutidin R5=OH, R7=OCH3, R3’=OCH3, R5’=OCH3
(dan bukan warna biru-hijau biasanya kita kaitkan dengan cyan) (Mortensen,
2006).
Antosianin menimbulkan warna biru-ungu-merah-oranye dari bunga dan
buah-buahan, khususnya, banyak tanaman (Mortensen, 2006). Zat tersebut
berperan dalam pemberian warna terhadap bunga atau bagian tanaman lain dari
mulai merah, biru sampai ke ungu termasuk juga kuning dan tidak berwarna
(seluruh warna kecuali hijau).
Secara kimiawi antosianin bisa dikelompokan ke dalam flavonoid dan
fenolik. Zat tersebut bisa ditemukan di berbagai tanaman yang ada di darat.
Antosianin tidak ditemukan di tanaman laut, hewan atau mikroorganisme
(Samsudin & Khoiruddin, 2011).
Antosianin adalah glikosida dari antosianidin (juga disebut aglikon) dan
gula. Antosianidin hampir selalu glikosilasi pada posisi 3, meskipun glikosilasi di
posisi lain dan lebih dari satu posisi pada satu waktu juga ditemui. Selanjutnya,
bagian gula dapat terasilasi dengan asam alifatik atau aromatik. Jadi, meskipun
jumlah antosianidin dikenal cukup terbatas (sekitar 25), jumlah antosianin
beberapa ratus karena keragaman besar yang ditawarkan oleh glikosilasi dan
asilasi (Mortensen, 2006).
Antosianin adalah zat warna yang bersifat polar dan akan larut dengan
baik pada pelarut–pelarut polar (Samsudin dan Khoirudin, 2011). Antosianin lebih
larut dalam air daripada dalam pelarut non polar dan karakteristik ini membantu
proses ekstraksi dan pemisahan (Xavier, et al, 2008). Oleh karena itu, antosianin
biasanya diekstrak dengan air, meskipun penggunaan alkohol yang lebih rendah
juga diizinkan (Mortensen, 2006).
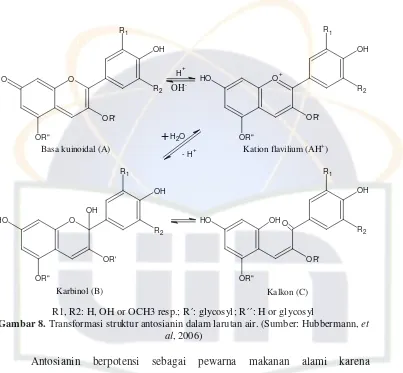
Antosianin mempunyai empat bentuk berbeda yang berada dalam
kesetimbangan dan termasuk ke dalam kation flavilium, basa kuinoidal, karbonil
pseudobase dan kalkon (Gambar 8). Jumlah relatif dari struktur dalam
kesetimbangan bervariasi dan tergantung pada pH dan struktur antosianin.
Beberapa antosianin lebih stabil daripada yang lain tergantung pada bentuk
strukturnya. Contohnya Malvidin glikosida, antosianin utama dalam anggur,
karena molekul dimetiloksilasi lebih stabil dari antosianin yang lainnya. Apalagi,
hasil hidroksilasi dari asam organik lebih stabil dalam beberapa kasus (Laleh, et
R1, R2: H, OH or OCH3 resp.; R´: glycosyl; R´´: H or glycosyl
Gambar 8. Transformasi struktur antosianin dalam larutan air. (Sumber: Hubbermann, et al, 2006)
Antosianin berpotensi sebagai pewarna makanan alami karena
keanekaragaman warna yang dimilikinya. Namun, mempunyai kelemahan dalam
stabilitas warnanya. Intensitas suatu stabilitas pigmen antosianin tergantung pada
berbagai faktor termasuk struktur dan konsentrasi dari pigmen, pH, suhu,
intensitas cahaya, kualitas dan kehadiran pigmen lain bersama-sama, ion logam,
enzim, oksigen, asam askorbat, gula dan gula metabolit, belerang oksida, dan
lain-lain (Tanaka, et al, 2008).
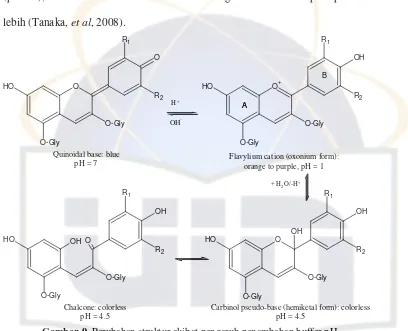
Perubahan warna antosianin tergantung pada pH, berdampingan dengan
senyawa berwarna (ko-pigmen, biasanya flavon dan flavonol), dan ion logam.
Dalam uji in vitro, antosianidin yang lebih merah dan lebih stabil sebagai bentuk
kation flavilium pada pH rendah (pH <3), berwarna sedikit di bawah kondisi asam O
Basa kuinoidal (A) Kation flavilium (AH+)
Kalkon (C) Karbinol (B)
-(pH 3-6), dan berwarna biru dan tidak stabil sebagai basa kuinoidal pada pH 6 dan
lebih (Tanaka, et al, 2008).
Gambar 9. Perubahan struktur akibat pengaruh penambahan buffer pH (Sumber: Lee, et al, 2005).
Faktor lain yang berkontribusi terhadap naungan warna adalah
kopigmentasi. Kopigmentasi adalah fenomena bahwa beberapa senyawa dapat
menyebabkan pergeseran merah dari penyerapan antosianin, dan karenanya
memberikan warna yang lebih kebiru-biruan, dan peningkatan bersamaan dalam
penyerapan. Senyawa aromatik seperti flavonoid dan asam sinamat ini sangat
efektif. Kopigmentasi diyakini terjadi dengan mengapit dari antosianin antara
interaksi satu atau dua kopigmen. Kopigmentasi mungkin antarmolekul atau
intramolekular jika residu gula (s) adalah/terasilasi dengan satu atau lebih asam
kopigmentasi juga memberikan stabilitas yang lebih tinggi ke antosianin
(Mortensen, 2006).
2.5Ekstraksi
Ekstrak adalah sediaan pekat yang diperoleh dengan mengekstraksi zat
aktif dari simplisia nabati atau hewani menggunakan pelarut yang sesuai,
kemudian semua atau hampir semua pelarut diuapkan dan massa atau serbuk yang
tersisa diperlakukan sedemikian hingga memenuhi baku yang telah ditetapkan.
Ada beberapa metode ekstraksi, salah satunya adalah maserasi. Maserasi
merupakan cara penyarian yang sederhana. Maserasi dilakukan dengan cara
merendam serbuk simplisia dalam cairan penyari. Cairan penyari akan menembus
dinding sel dan masuk ke dalam rongga sel yang mengandung zat aktif dan zat
aktif akan larut. Simplisia yang akan diekstraksi ditempatkan pada wadah atau
bejana yang bermulut lebar bersama larutan penyari yang telah ditetapkan, bejana
ditutup rapat kemudian dikocok berulang–ulang sehingga memungkinkan pelarut
masuk ke seluruh permukaan simplisia. Rendaman tersebut disimpan terlindung
dari cahaya langsung (mencegah reaksi yang dikatalisis oleh cahaya atau
perubahan warna). Waktu maserasi pada umumnya 5 hari, setelah waktu tersebut
keseimbangan antara bahan yang diekstraksi pada bagian dalam sel dengan luar
sel telah tercapai. Dengan pengocokan dijamin keseimbangan konsentrasi bahan
ekstraksi lebih cepat dalam cairan. Keadaan diam selama maserasi menyebabkan
2.6Pelarut
2.6.1 Air
Sebuah molekul air terdiri dari sebuah atom oksigen yang berikatan
kovalen dengan dua atom hidrogen. Atom hidrogennya mempunyai daya ikat
yang sangat besar antara kedunya. Perangkaian jarak atom-atomnya mirip kunci
yang masuk lubangnya, kecocokan begitu sempurna, sehingga air tergolong
senyawa alam yang paling baik. Semua atom dalam molekul air terjalin menjadi
satu oleh ikatan yang kuat, yang hanya dapat dipecahkan oleh perantara yang
paling agresif, misalnya energi listrik atau zat kimia lain seperti logam kalium.
Air berfungsi sebagai bahan yang dapat mendispersikan berbagai senyawa
yang ada dalam bahan makanan. Untuk beberapa bahan malah berfungsi sebagai
pelarut. Air dapat melarutkan berbagai bahan seperti garam, vitamin yang larut
air, mineral, dan senyawa-senyawa cita rasa seperti yang terkandung dalam teh
dan kopi.
2.6.2 Etanol
Sifat-sifat fisika etanol utamanya dipengaruhi oleh keberadaan gugus
hidroksil dan pendeknya rantai karbon etanol. Gugus hidroksil dapat berpartisipasi
ke dalam ikatan hidrogen, sehingga membuatnya cair dan lebih sulit menguap dari
pada senyawa organik lainnya dengan massa molekul yang sama.
Etanol tidak menyebabkan pembengkakan membran sel dan memperbaiki
stabilitas bahan obat terlarut. Keuntungan lain, etanol mampu mengendapkan
albumin dan menghambat kerja enzim. Umumnya yang digunakan sebagai cairan
campuran etanol-air. Etanol (70%) sangat efektif dalam menghasilkan jumlah
bahan aktif yang optimal, dimana bahan penganggu hanya skala kecil yang turut
ke dalam cairan pengekstraksi. Etanol dapat melarutkan alkaloid basa, minyak
menguap, glikosida, kurkumin, kumarin, antrakinon, flavonoid, steroid, damar
dan klorofil. Lemak, malam, tanin dan saponin hanya sedikit larut. Dengan
demikian zat pengganggu yang terlarut hanya terbatas. Untuk meningkatkan
penyarian biasanya menggunakan campuran etanol dan air. Perbandingan jumlah
etanol dan air tergantung pada bahan yang disari (Indraswari, 2008).
2.7 Pewarna Makanan
Menurut Peraturan Menteri Kesehatan RI No. 722/Menkes/Per/IX/1988,
pewarna adalah bahan tambahan makanan yang dapat memperbaiki atau memberi
warna pada makanan. Suatu bahan yang dinilai bergizi, enak, dan teksturnya
sangat baik tidak akan dimakan apabila memiliki warna yang tidak sedap
dipandang atau memberi kesan telah menyimpang dari warna seharusnya.
Penerimaan warna suatu bahan berbeda-beda tergantung dari faktor alam,
geografis, dan aspek sosial masyarakat penerima (Winarno, 1992).
Selain sebagai faktor yang ikut menentukan mutu, warna juga dapat
digunakan sebagai indikator kesegaran atau kematangan. Baik tidaknya cara
pencampuran atau cara pengolahan dapat ditandai dengan adanya warna yang
seragam dan merata.
Warna suatu bahan dapat diukur dengan menggunakan alat kolorimeter,
spektrofotometer, atau alat-alat lain yang dirancang khusus untuk mengukur
yang tembus cahaya seperti sari buah, bir, atau warna hasil ekstraksi. Untuk bahan
bukan cair atau padatan, warna bahan dapat diukur dengan membandingkannya
terhadap suatu warna standar yang dinyatakan dalam angka-angka.
Cara pengukuran warna yang lebih teliti dapat dilakukan dengan
mengukur komponen warna dalam besaran value, hue dan chroma. Nilai value
menunjukkan gelap terangnya warna, nilai hue mewakili panjang gelombang yang
dominan yang akan menentukan apakah warna tersebut merah, hijau, atau kuning,
sedangkan chroma menunjukkan intensitas warna. Ketiga komponen ini diukur
dengan menggunakan alat khusus yang mengukur nilai kromatisitas suatu bahan.
Angka-angka yang diperoleh utnuk setiap warna, kemudian angka-angka tersebut
diplot ke dalam diagram kromatisitas (Catrien, 2009).
Ada lima sebab yang dapat menyebabkan suatu bahan makanan berwarna
yaitu:
a. Pigmen yang secara alami terdapat pada tanaman dan hewan misalnya
klorofil berwarna hijau, karoten berwarna jingga, dan mioglobin
menyebabkan warna merah pada daging.
b. Reaksi karamelisasi yang timbul bila gula dipanaskan membantuk warna
coklat, misalnya warna coklat pada kembang gula karamel atau roti yang
dibakar.
c. Warna gelap yang timbul karena adanya reaksi Maillard, yaitu antara gugus
amino protein dengan gugus karbonil gula pereduksi; misalnya susu bubuk
yang disimpan terlalu lama akan berwarna gelap.
d. Reaksi antara senyawa organik dengan udara akan menghasilkan warna
serta enzim, misalnya warna gelap permukaan apel atau kentang yang
dipotong.
e. Penambahan zat warna, baik zat warna alami maupun zat warna sintetik, yang
termasuk dalam golongan bahan aditif makanan.
Masing-masing pigmen tersebut mempunyai kestabilan yang berlainan
terhadap berbagai kondisi pengolahan (Winarno, 1992).
Ketentuan mengenai penggunaan pewarna di Indonesia diatur dalam SK
Menteri Kesehatan RI No. 722/Menkes/Per/IX/1988 dan dalam SNI (Standar
Nasional Indonesia) 01-0222-1995 mengenai Bahan Tambahan Makanan (BTM).
Pewarna makanan terbagi menjadi tiga golongan, yaitu pewarna alami, pewarna
identik alami dan pewarna sintetik.
2.7.1 Pewarna Alami
Pewarna alami adalah zat warna alami (pigmen) yang diperoleh dari
tumbuhan, hewan, atau dari sumber-sumber mineral. Zat warna ini telah
digunakan sejak dulu dan umumnya dianggap lebih aman dari pada zat warna
sintetis, seperti annato sebagai sumber warna kuning alamiah bagi berbagai jenis
makanan begitu juga tannin, antosianin, antoxantin, karoten dan klorofil, Quonin,
xanthon, heme, flavonoid. Dalam daftar FDA pewarna alami dan pewarna identik
alami tergolong dalam ”uncertified color additives” karena tidak memerlukan
sertifikat kemurnian kimiawi. Keterbatasan pewarna alami adalah seringkali
memberikan rasa dan flavor khas yang tidak diinginkan, konsentrasi pigmen
rendah, stabilitas pigmen rendah, keseragaman warna kurang baik dan spektrum
Depkes RI (1988) mengurutkan daftar zat pewarna alami yang diizinkan di
Indonesia seperti yang tertera pada Tabel 1. berikut:
Tabel 1. Daftar Zat Pewarna Alami yang Diizinkan di Indonesia
No Nama ( Indonesia ) Nama (Inggris) No. Indeks
1 Anato Anatto (Orange 4) 75120
2 Karotenal Carotenal 80820
3 Karotenoat Carotenoic Acid (Orange 8) 40825
4 Kantasantin Canthaxanthine 40850
5 Karamel, Amonia Sulfit Proses Caramel Colour -
6 Karamel Caramel Colour (Plain) -
7 Karmin Carmine (red 4) 75470
8 Beta Karoten Beta Carotene (Yellow 26) 75130
9 Klorofil Chlorophyll (Green 3) 75810
10 Klorofil Tembaga Komplex Chlorophyll Copper Complex 75810
11 Kurkumin Curcumin (Yellow 3) 75300
12 Riboflavin Ribaflavina -
13 Titanium Dioksida Titanium Dioxide (White 6) 77891
Sumber : Departemen Kesehatan RI, 1988
Kemungkinan alasan untuk penggunaan pewarna dalam zat makanan yang
disebutkan, sebagai:
1) untuk menjaga penampilan makanan asli bahkan setelah pengolahan dan
selama penyimpanan;
2) untuk menjamin keseragaman warna untuk menghindari variasi musiman
dalam nada warna;
3) untuk mengintensifkan warna normal makanan dan dengan demikian
untuk menjaga kualitas;
4) untuk melindungi rasa dan vitamin rentan cahaya membuat cahaya -
dukungan layar, dan
5) untuk meningkatkan penerimaan pangan sebagai salah satu pengundang
2.7.2 Pewarna Identik Alami
Pewarna identik alami merupakan pewarna yang disentetis secara kimia
sehingga menghasilkan pewarna dengan struktur kimia yang sama/identik dengan
pewarna alami. Yang termasuk golongan ini adalah karotenoid murni, antara lain:
kantaxantin (merah) (16), apo-karoten (merahoranye) (17), beta-karoten
(oranye-kuning) (18). Semua zat warna ini memiliki batas konsentrasi maksimum
penggunaan, kecuali beta-karoten yang boleh digunakan dalam jumlah tidak
terbatas.
Gambar 10. Struktur senyawa golongan karotenoid murni.
2.7.3 Pewarna Sintetik
Pewarna sintetik merupakan bahan pewarna yang memberikan warna yang
tidak ada di alam dan dihasilkan dengan cara sintesis kimia, bukan dengan cara
ekstraksi atau isolasi. Pewarna sintetik mempunyai keuntungan yang nyata
dibandingkan pewarna alami, yaitu mempunyai kekuatan mewarnai yang lebih
kuat, lebih seragam, lebih stabil dan biasanya lebih murah.
Sejak tahun 1938 di Amerika juga telah dikeluarkan peraturan baru yaitu
yang disebut Food, Drug and Cosmetic Act (FD & C) yang memperluas ruang
lingkup peraturan tahun 1906 dalam mengatur penggunaan zat pewarna. Zat
pewarna dapat digolongkan atas tiga katagori yaitu FD & C Color, D & C Color,
dan D & C.
FD & C Color adalah zat pewarna yang diijinkan untuk makanan,
obat-obatan, dan kosmetik D & C diizinkan penggunaannya dalam obat-obatan dan
kosmetik, sedangkan untuk bahan makanan dilarang Ext D & C diizinkan dalam
jumlah terbatas pada obat-obatan luar dan kosmetik (Winarno, 1996).
Di Indonesia, peraturan mengenai zat pewarna yang diizinkan dan yang
dilarang untuk pangan diatur melalui SK Menteri kesehatan RI No.
722/Menkes/Per/IX/88 mengenai bahan tambahan makanan. Akan tetapi sering
Di bawah ini ditampilkan daftar zat pewarna sintetik yang diizinkan
beredar di pasar di Indonesia menurut Departemen Kesehatan RI Tahun 1988.
Tabel 2. Daftar Zat Pewarna Sintetik yang Diizinkan di Indonesia
Sumber: Departemen Kesehatan RI, 1988.
Menurut Tabel 2 yang memberikan warna merah adalah eritrosin,
karmoisin, merah allura, ponceau 4R, dan tartazine. Berdasarkan data tersebut,
penggunaan pewarna sintetik sebagai pembanding adalah pewarna karmoisin.
Pewarna makanan sintetik karmoisin telah diproduksi dalam skala besar oleh
salah satu produsen yang bergerak dalam bidang makanan. Pewarna karmoisin
mudah dijumpai karena sudah dijual bebas dipasaran dan biasanya dikemas dalam
bentuk cair.
Karmoisin (19) atau dalam industri makanan sering disebut sebaga Red 3
merupakan pewarna sintetik yang bersifat asam mengandung gugus kromofor NN
dan CC (pyrazolone dye). Merupakan pewarna merah, larut dalam air, mempunyai
titik leleh >300C, digunakan dalam pewarnaan makanan, kosmetik dan meication.
Mempunyai nama lain CI Food Red 3, Azorubine, E 122,atau CI No. 14720
(Anonimous, 2011).
No Nama ( Indonesia ) Nama ( Inggris ) No. Indeks 1 Biru Berlian Briliant Blue 42090 2 Coklat HT Chocolate Brown HT 20285
3 Eritrosin Erytrosine 45430
4 Hijau FCF Fast Green FCF 42053
5 Hijau S Fast Green S 44090
6 Indigotin Indigotine 73015
7 Karmoisin Carmoisine 14720
8 Kuning FCF Sunset Yellow 15985 9 Kuning Kuinolin Quinoline Yellow 47005 10 Merah Allura Allura Red AC 16035 11 Ponceau 4R Ponceau 4R 16255
Nama kimia senyawa karmoisin adalah
4-hidroksi-3-(4-sulfonat-1-naftilazo) naftalen-1-sulfonat. Dengan rumus empiris C20H12N2Na2O7S2. Struktur
kimia dari Food Red 3 ditampilkan pada Gambar 10.
Gambar 11. Struktur Kimia Carmoisine (Red 3).
Pewarna asam red 3 merupakan pewarna larut dalam air terlebih dalam
bentuk garam natrium dari asam sulfonat atau karboksilat. Merupakan senyawa
anionik yang menyerang dengan kuat kelompok kationik dalam serat langsung.
Dapat diaplikasikan dalam berbagai bentuk serat alam seperti wool, katun, dan
campuran dengan pewarna lain, marmalade dengan kadar 200 mg/kg, dan udang
kalengan dengan kadar 30 mg/kg, tunggal atau campuran dengan pewarna lain
(Femelia, 2009).
2.7.4 Bahaya Pewarna Sintetik
Beberapa penelitian yang menyatakan bahwa pewarna sintetik dapat
menyebabkan efek negatif pada kesehatan. Pada bulan November 2007, sebuah
hasil penelitian yang diterbitkan di jurnal medis terkemuka Lancet
mengungkapkan bahwa beberapa zat pewarna makanan meningkatkan tingkat
hiperaktivitas anak-anak usia 3-9 tahun. Anak-anak yang mengkonsumsi makanan
yang mengandung pewarna buatan itu selama bertahun-tahun lebih berisiko
menunjukkan tanda-tanda hiperaktif. Selain risiko hiperaktif, sekelompok sangat
kecil dari populasi anak (sekitar 0,1%) juga mengalami efek samping lain seperti:
ruam, mual, asma, pusing dan pingsan (Anonimous, 2011).
Bahan pewarna sintetis yang telah dihasilkan oleh para ahli kimia berasal
dari coal-tar yang jumlahnya ratusan. Pewarna buatan sangat disenangi oleh para
ahli teknologi untuk pewarnaan barang-barang industri, baik untuk industri
pangan ataupun untuk industri non pangan. Oleh karena itu, perlu ada pemisahan
antara pewarna yang hanya digunakan untuk industri non pangan. Akan tetapi,
masih sering terjadi penyalahgunaan pewarna sintetis non pangan untuk pangan
(Cahyadi, 2005).
Menurut DEPKES RI No. 239/Menkes/Per/V/85 ada 30 jenis zat warna
yang dinyatakan berbahaya bila digunakan dalam pengolahan makanan. Adapun
Tabel 3. Daftar Zat Pewarna Yang Dilarang di Indonesia
Sumber : Depkes RI No. 239/Menkes/Per/V/85
No Warna Nama No. Indeks
6 Orange Chrysoindine 11270
2.8 Spektrofotometer UV-Visible
2.8.1 Prinsip Dasar Spektrofotometer UV-Vis
Spektrofotometer adalah alat yang terdiri dari spektrometer dan fotometer.
Spektrometer menghasilkan sinar dari spektrum dengan panjang gelombang
tertentu dan fotometer adalah alat pengukur intensitas cahaya yang ditransmisikan
atau diadsorbsi. Jadi spektrofotometer digunakan untuk mengukur energi secara
relatif jika energi tersebut ditransmisikan sebagai fungsi dari panjang gelombang
(Underwood, 2001).
Spektrofotometer digunakan untuk mengukur jumlah cahaya yang
ditransmisikan atau diabsorpsi oleh molekul-molekul di dalam larutan. Spesi yang
mengabsorpsi dapat melakukan transisi elektron yang menimbulkan spektra
ultraviolet dan tampak (Fessenden, 1986).
Spektofotometer UV-Visible merupakan salah satu jenis spektrofotometer
yang sering digunakan dalam kegiatan analisis. Molekul-molekul dapat
mengabsorbsi atau mentransmisi radiasi gelombang elektromagnetik. Berkas
cahaya putih adalah kombinasi semua panjang gelombang spektrum tampak.
Perbedaan warna yang kita lihat sebenarnya ditentukan dengan bagaimana
gelombang cahaya tersebut diabsorbsi dan ditransmisikan (dipantulkan) oleh
objek atau suatu larutan. Spektrofotometer UV-Vis adalah bagian teknik analisis
spektroskopik yang memakai sumber radiasi elektromagnetik ultraviolet dekat
(190-380 nm) dan sinar tampak (380-780 nm) dengan memakai instrumen
spektrofotometer.
Ketika panjang gelombang cahaya diabsorpsi atau ditransmisikan melalui
molekul-molekul zat terlarut untuk mengabsorbsi cahaya pada panjang gelombang
tertentu dikenal dengan istilah absorbansi (A), yang setara dengan nilai
konsentrasi larutan tersebut dan panjang berkas cahaya yang dilalui ke suatu point
dimana persentase jumlah cahaya yang ditransmisikan atau diabsorbsi diukur
dengan fototube.
2.8.2 Hukum Beer-Lambert
Hukum Lambert-Beer dipenuhi berapapun panjang gelombang sinar yang
diserap sampel. Dengan mengukur transmitans larutan sampel, dimungkinkan
untuk menentukan konsentrasinya dengan menggunakan hukum Lambert-Beer.
Lambert menyatakan jika analisis dalam spektrofotometer UV-Vis selalu
melibatkan pembacaan absorbansi dan radiasi elektromagnetik yang diteruskan.
Absorbansi (A) tanpa satuan dan transmitan dengan satuan persen (%T). Jika
suatu radiasi elektromagnetik melalui suatu media serba sama, maka sebagian
sinar itu akan dipantulkan oleh media, kemudian sebagian lagi akan diserap dan
sebagian lagi akan diteruskan.
Bunyi hukum Lambert adalah ”Bila suatu cahaya monokromatik dialirkan
melalui suatu media, maka menurunnya intensitas cahaya berbanding lurus
dengan panjang media” atau dengan kata lain bahwa intensitas cahaya akan
menurun bila panjang media yang dilalui cahaya bertambah. “Bila suatu cahaya
monokromatik dialirkan melalui suatu media, maka kecepatan turunnya intensitas
cahaya berbanding lurus dengan kepekatan media”, artinya intensitas cahaya
Dari dua pernyataan di atas dapat dibuat persamaan Beer- Lambert
menjadi,
Keterangan :
Io = cahaya masuk
It = cahaya yang dipancarkan c = konsentrasi (M)
b = panjang media
ε = koefisien ekstingsi molar, untuk konsentrasi dalam molar A = absorbansi (A)
Lambert dan Beer membuat formulasi secara matematik hubungan antara
transmitan atau absorbansi terhadap intensitas radiasi atau konsentrasi zat yang
dianalisis dan tebal larutan yang mengabsorbsi. Dari persamaan di atas dapat
dilihat bahwa absorbansi berbanding lurus dengan konsentrasinya.
2.8.3 Instrumen Spektrofotometer UV-Vis
Bagian-bagian terpenting suatu spektrofotometer seperti yang ditunjukkan
secara skematik dalam gambar di dawah adalah sebagai berikut:
a. Sumber Cahaya
Beberapa macam sumber cahaya yang dipakai pada Spektrofotometer
UV-Visible adalah :
1. Lampu deuterium (D2O), dapat dipakai pada daerah panjang gelombang
190 nm- 380 nm (daerah ultraviolet dekat).
2. Lampu tungstent xenon, merupakan campuran dari filamen tungsten dan
xenon, oleh karena itu disebut sebagai sumber cahaya ”tungsten-xenon”.
Dipakai pada daerah visible dengan kisaran panjang gelombang 380-900
nm.
3. Lampu merkuri, digunakan untuk mengkalibrasi panjang gelombang pada
daerah ultraviolet, khususnya disekitar panjang gelombang 365 nm, serta
sekaligus mengecek resolusi dan monokromator.
b. Monokromator
Monokromator berfungsi untuk memilih panjang gelombang tertentu dari
sinar polikromatik sehingga dapat diperoleh sinar monokomatik dengan panjang
gelombang yang dikehendaki. Monokromator pada umumnya berbentuk cermin,
prisma, dan kisi difraksi (Saputra, 2009). Monokromator pada spektrofotometer
UV biasanya terdiri dari beberapa susunan, yatiu :
celah (slit) – masuk – filter – prisma – kisi (grating) – celah keluar.
1. Celah monokromator, adalah bagian yang pertama dan terakhir dari suatu
sistem optik monokromator pada spektrofotometer UV. Celah dibuat dari
logam yang kedua ujungnya diasah dengan cermat sehingga sama. Lebar
celah masuk dan celah keluar harus sama yang dapat diatur dengan
2. Prisma dan kisi merupakan bagian dari monokromator terpenting. Prisma
dan kisi pada prinsipnya mendispersi radiasi elektromagnetik sebesar
mungkin supaya didapatkan resolusi yang baik dari radiasi polikromatik.
3. Kisi grating terbuat dari lempengan kaca yang pada permukaannya dilapisi
oleh resin sintetis dengan garis-garis. Kemudian pada permukaannya
dilapisi lagi oleh kaca alumunium.
c. Sel kuvet
Kuvet atau sel merupakan wadah sampel yang dianalisis. Ditinjau dari
pemakaiannya kuvet ada dua macam, yaitu :
1. Kuvet permanen, yang terbuat dari bahan gelas atau leburan silica dan
dipakai pada daerah pengukuran panjang gelombang 190 nm – 1100 nm.
2. Kuvet disposibel, untuk satu kali pemakaian, yang terbuat dari teflon atau
plastik dan dipakai pada daerah pengukuran panjang gelombang 380 nm -
1100 nm, karena bahan dari gelas mengabsorbsi radiasi ultraviolet.
d. Detektor
Detektor cahaya atom disebut juga transducer, berfungsi mengubah energi
radiasi cahaya menjadi suatu sinyal elektrik yang besarnya setara dengan
intensitas cahaya yang sampai pada detektor tersebut.
e. Amplifier
Amplifier berfungsi sebagai penguat sinyal yang berasal dari detektor
menjadi suatu potensial yang cukup besar untuk dapat direkam. Suatu alat penguat
sinyal menangkap isyarat masuk (input) dari rangkaian detektor dan melalui
proses pengolahan sinyal menghasilkan isyarat keluaran (output) dengan secara
f. Rekorder atau pencatat tampilan
Alat ini merupakan rangkaian terakhir dari instrumen ini yang berfungsi
sebagai pencatat atau mengeluarkan hasil analisis, hasilnya dapat terekam secara
BAB III
METODE PENELITIAN
3.1 Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan pada Maret-Agustus 2011, di Laboratorium
Kimia Pusat Laboratoriun Terpadu UIN Syarif Hidayatullah Jakarta.
3.2 Alat dan Bahan
Alat yang digunakan adalah seperangkat alat gelas dan instrumen
spektrofotometer visible Ultrospec 100 pro λ 330-830 nm, spectral bandwith 8
nm, dengan sumber cahaya tungsten halogen dan detektor diode array. Bahan
yang digunakan adalah bunga Kembang Sepatu (Hibiscus rosa sinensis L.) yang
masih segar, bunga Rosella (Hibiscus sabdariffa L.) yang masih segar, pewarna
makanan sintetik Red 3, pelarut air dan etanol, H2O2, buffer sitrat pH 3, pH 4, dan
pH 5.
3.3 Prosedur Penelitian
Prosedur percobaan meliputi penyiapan bahan baku, ekstraksi dan uji
stabilitas warna. Pada tahap ekstraksi, bunga Kembang Sepatu dan bunga Rosella
yang masih segar dipotong dengan ukuran 1 cm dan dihaluskan dengan mortar.
Kemudian diekstraksi secara maserasi selama 120 menit menggunakan pelarut air
dengan perbandingan 1 : 1 (gr sampel : mL pelarut) (Inayati, 2009) pada
temperatur yang berbeda-beda (30 °C, 40 °C, 50 °C, 60 °C, 70 °C, 80 °C dan 90
gelombang 510-550 nm. Ekstrak etanol dilakukan dengan variasi konsentrasi
etanol 20 %, 40 %, 60 %, 80 % dan 96 % pada suhu ruang. Tahap akhir adalah uji
stabilitas warna terhadap pengaruh lingkungan. Diagram alir penelitian
ditampilkan dalam Lampiran 1.
3.4Uji Stabilias Warna
3.4.1 Pengaruh Temperatur Penyimpanan
Sampel disimpan pada temperatur kamar yaitu pada temperatur 27 °C dan
pada temperatur dingin yaitu 9 °C. Setelah 2 hari dilakukan pengenceran yaitu
dengan cara pigmen cair dilarutkan sebanyak 2 ml dalam 100 ml air kemudian
diukur absorbansinya pada panjang gelombang maksimum dan dilakukan
pengulangan sebanyak tiga kali. Dilakukan hal yang sama terhadap pewarna
sintetik Red 3 sebagai pembanding.
3.4.2 Pengaruh Lama Penyinaran Matahari
Sepuluh ml dari larutan dimasukkan ke dalam tabung reaksi kemudian
dijemur dibawah sinar matahari selama 6 jam dan setiap 3 jam sekali dilakukan
pengukuran absorbansi pada panjang gelombang maksimum dan dilakukan
pengulangan sebanyak tiga kali. Dilakukan hal yang sama terhadap pewarna
sintetik Red 3 sebagai pembanding.
3.4.3 Pengaruh Lama Penyinaran Lampu
Sepuluh ml larutan dimasukkan ke dalam tabung reaksi kemudian disinari
dilakukan pengamatan terhadap absorbansinya pada panjang gelombang
maksimum dan dilakukan pengulangan sebanyak tiga kali. Dilakukan hal yang
sama terhadap pewarna sintetik Red 3 sebagai pembanding.
3.4.4 Pengaruh Waktu Penambahan Oksidator
Sepuluh ml dari larutan masing-masing dimasukkan ke dalam tabung
reaksi dan ditambahkan oksidator H2O2 sebanyak 1 ml. Kemudian setiap 3 jam
sekali selama 6 jam dilakukan pengukuran absorbansi pada panjang gelombang
maksimum dan dilakukan pengulangan sebanyak tiga kali. Dilakukan hal yang
sama terhadap pewarna sintetik Red 3 sebagai pembanding.
3.4.5 Pengaruh Penambahan pH
Ekstrak pigmen dibuat dalam 3 tingkatan keasaman (pH: 3, 4 dan 5).
Sampel pigmen sebanyak 2 ml dilarutkan dalam 100 ml buffer asam sitrat sesuai
dengan variasi pH. Kemudian dilakukan pengukuran absorbansi pada panjang
gelombang maksimum dan dilakukan pengulangan sebanyak tiga kali. Dilakukan
BAB IV
HASIL DAN PEMBAHASAN
4.1 Optimasi Ekstraksi
Pada tahap ini dilakukan optimasi metode ekstraksi, dengan cara maserasi
menggunakan pelarut air dan etanol. Ekstraksi dengan metode maserasi
didasarkan pada sifat kelarutan dari komponen di dalam pelarut yang digunakan.
Metode maserasi juga mudah dilakukan sehingga bisa langsung diaplikasikan
dalam industri rumah tangga.
Pemilihan pelarut yang digunakan adalah air dan etanol. Hal ini karena air
merupakan pelarut polar, sehingga air dapat larut atau bercampur dengan senyawa
polar atau mempunyai nilai kepolaran yang hampir sama. Air juga merupakan
pelarut yang aman untuk dikonsumsi. Begitu pula dengan etanol yang mempunyai
kepolaran yang hampir sama dengan air. Karena ekstrak yang akan diambil
berupa antosianin yang merupakan senyawa polar, sehingga antosianin dapat
bercampur atau larut dalam pelarut air dan etanol.
Waktu yang dibutuhkan dengan metode maserasi ini adalah 120 menit,
karena menurut penelitian yang telah dilakukan oleh Inayati (2009) tentang
ekstraksi bunga Kembang Sepatu dengan variasi lamanya waktu maserasi
didapatkan nilai absorbansi maksimum pada waktu 120 menit. Begitu pula dengan
perbandingan yang digunakan antara sampel dengan pelarut adalah 1:1 karena
dihasilkan nilai absorbansi yang maksimum (Inayati, 2009).
Maserasi dengan pelarut air menggunakan variasi temperatur 30 °C, 40
0
Pelarut air
Kem bang Sepat u 530 nmRosella 520 nm
spektrofotometer visibel dari ekstrak bunga Kembang Sepatu dan Rosella
menggunakan pelarut air ditampilkan dalam Gambar 13.
Gambar 13. Hubungan absorbansi dengan variasi temperatur maserasi bunga Kembang Sepatu dan Rosella.
Dari Gambar 13 dapat dilihat terjadinya peningkatan dan penurunan nilai
absorbansi yang dihasilkan. Untuk bunga Kembang Sepatu, nilai absorbansi naik
dari 30 °C - 40 °C, kenaikan nilai absorbansi menunjukkan kenaikan intensitas
warna yang terekstrak. Kemudian turun pada temperatur 60 °C penurunan nilai
absorbansi menunjukkan penurunan intensita warna (zat warna yang tereksrak
turun). Lalu naik kembali pada temperatur 90 °C hingga mencapai nilai
absorbansi maksimum sebesar 0,920.
Nilai absorbansi maksimum pada temperatur 90 °C untuk bunga Kembang
Sepatu sebesar 0,920 dan bunga Rosella sebesar 0,987. Sehingga, untuk langkah
selanjutnya yang digunakan adalah kondisi optimum ini.
Jika melihat hasil tersebut, hal ini sesuai dengan penelitian yang telah
dilakukan oleh Mardiah (2010), dengan membandingkan temperatur ekstraksi
antara temperatur kamar dengan temperatur 60 °C didapatkan hasil ekstrak terbaik
0
Pelarut Etanol
Kem bang Sepat u 530 nmRosella 540 nm
kecepatan perpindahan massa dari solut ke solven akan semakin tinggi karena
temperatur mempengaruhi nilai koefisien transfer massa dari suatu komponen.
Proses pelarutan senyawa antosianin dari bunga Kembang Sepatu
menggunakan pelarut air melalui membrane semipermeabel dalam hal ini adalah
dinding sel merupakan proses untuk menghentikan osmosis yang disebut sebagai tekanan osmotik (π). sesuai dengan persamaan di bawah ini,
dimana, π = tekanan osmotik M = molaritas larutan
R = konstanta gas (0,0821 L.atm/k.mol) T = temperatur
Persamaan di atas menunjukkan bahwa tekanan osmotic berbanding lurus
dengan temperatur, sehingga semakin tinggi temperatur semakin tinggi tekanan
osmotik yang menyebabkan perpindahan massa dari solut ke solven semakin
cepat.
Pada penggunaan pelarut etanol dengan variasi konsentrasi 20 %, 40 %, 60
%, 80 % dan 96 % dari Gambar 14 terlihat peningkatan nilai absorbansi sesuai
dengan kenaikan konsentrasi etanol.
Gambar 14. Hubungan absorbansi dengan variasi konsentrasi etanol terhadap bunga Kembang Sepatu dan Rosella.
Pada konsentrasi 20 % nilai absorbansi bunga Kembang Sepatu adalah
0,359 dan Rosella adalah 0,535. Kemudian nilai absorbansi meningkat dan
didapatkan nilai absorbansi optimum pada konsentrasi 96 %, dengan nilai
absorbansi bunga Kembang Sepatu sebesar 0,684 dan Rosella sebesar 0,664. Nilai
absorbansi yang meningkat ini menandakan banyaknya konsentrasi pigmen yang
terekstrak.
Etanol dengan konsentrasi 75 % dan 96 % sering digunakan sebagai
pelarut dalam sebuah penelitian. Namun dalam penelitian ini, ekstraksi antosianin
dengan etanol 96 % menunjukkan hasil yang lebih baik daripada dengan etanol 75
%. Oleh sebab itu, pada pengujian stabilitas zat warna ekstrak bunga Kembang
Sepatu dan bunga Rosella menggunakan konsentrasi etanol 96 %.
Hasil ini dapat diperkuat oleh penelitian Wijaya, et al (2001) tentang
ekstraksi pigmen dari kulit buah rambutan. Hal ini disebabkan tingkat kepolaran
antosianin hampir sama dengan etanol 95 % sehingga dapat larut dengan baik
pada etanol 95 %. Hal ini dapat dijelaskan bahwa besar konsentrasi (M) etanol
berpengaruh terhadap perpindahan massa dari solute ke solven sesuai dengan persamaan π = MRT.
4.2 Uji Stabilitas Zat Warna
Setelah didapatkan hasil dari ekstraksi, yaitu maserasi dengan pelarut air
pada temperatur 90° C, sedangkan untuk pelarut etanol dimaserasi pada
konsentrasi 96%. Kemudian dilanjutkan dengan uji stabilitas zat warna dari bunga
cahaya, pH dan oksidator. Selain itu dilakukan pengukuran terhadap pewarna
makanan sintetik yang dijadikan sebagai pembanding, yaitu Karmoisin atau red 3.
4.2.1 Pengaruh Temperatur Penyimpanan
Pada uji stabilitas warna dengan pengaruh lama penyimpanan ekstrak
dilakukan selama 48 jam. Intensitas warna setelah penyimpanan dengan pelarut
air dan pelarut etanol menunjukkan perubahan baik pada temperatur 27 °C
maupun temperatur 9 °C. Perubahan yang terjadi ditandai dengan perubahan nilai
absorbansi.
Tabel 4. Persentase perubahan nilai absorbansi karena pengaruh temperatur penyimpanan.
Penyimpanan Bunga Kembang
Sepatu (%)
Bunga Rosella (%) Pewarna red 3
(%)
a b a b a b
9 °C 12.04 1.49 10.37 13.51 * *
27 °C 38.55 5.97 37.78 20.27 * *
a pelarut air dan b pelarut etanol
* Persentase nilai absorbansi sangat kecil
Lama penyimpanan dengan kondisi yang berbeda dapat meningkatkan
nilai absorbansi zat warna ekstrak bunga Kembang Sepatu dan bunga Rosella.
Persentase ekstrak air bunga Kembang Sepatu pada 9 °C dan 27 °C
masing sebesar 12,1 % dan 38,6 %. Persentase ekstrak air bunga Rosella
masing-masing sebesar 10,37 % dan 37,78 %. Jika dibandingkan dengan temperatur
penyimpanan, persentase nilai absorbansi pada temperatur 27 °C lebih besar
dibandingkan pada temperatur 9 °C (Tabel 4).
Begitu pula dengan ekstrak yang menggunakan pelarut etanol yang
mengalami perubahan persentase absorbansi setelah penyimpanan. Persentase
dibandingkan pada temperatur 9 °C. Persentase nilai absorbansi pada temperatur
27 °C dari ekstrak bunga Kembang Sepatu dan bunga Rosella masing-masing
sebesar 5,97 % dan 20,27 % (Tabel 4).
Dari kedua data tersebut diketahui bahwa nilai absorbansi lebih tinggi
terjadi pada penyimpanan dengan temperatur 27 °C dibandingkan pada temperatur
9 °C. Hal ini sesuai dengan penelitian yang telah dilakukan oleh McLellan dan
Cash (1979), penyimpanan pada temperatur 1,6 °C merupakan kondisi yang
paling baik dibandingkan dengan temperatur 18,3 °C dan 37,2 °C. Perubahan saat
penyimpanan dimungkinkan karena: 1) Reaksi kopigmentasi, 2) Diduga ekstrak
masih mengandung enzim polifenolase yang mengkatalis reaksi pencoklatan. Hal
tersebut yang menyebabkan kenaikan intensitas warna. Penyimpanan pada
temperatur 1,6 °C dapat menghambat reaksi tersebut.
Namun, jika dibandingkan dengan kedua ekstrak bunga tersebut,
persentase perubahan nilai absorbansi pada pewarna makanan sintetik red 3
sangatlah kecil. Persentase nilai sangat kecil ini menandakan tidak terjadi
perubahan yang berarti atau mempunyai nilai absorbansi yang relatif stabil. Hal
ini bisa disebabkan karena pewarna makanan sintetik yang beredar di pasaran
sudah diformulasi agar dapat tahan lama dan stabil pada berbagai macam kondisi
juga karena tidak ada senyawa pengganggu serta senyawanya lebih murni
(Cevallos, et al, 2004).
4.2.2 Pengaruh Lama Penyinaran Matahari
Sinar merupakan salah satu faktor yang dapat mempengaruhi stabilitas