STUDI OPTIMASI PROSES BIOSOLUBILISASI BATUBARA
OLEH KAPANG HASIL ISOLASI DARI PERTAMBANGAN
BATUBARA SUMATERA SELATAN
BERDASARKAN KARAKTERISTIK ENZIM
EKSTRASELULER DAN PRODUK YANG DIHASILKAN
HIDAYATI
106096003228
PROGRAM STUDI KIMIA
FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH
JAKARTA
STUDI OPTIMASI PROSES BIOSOLUBILISASI BATUBARA
OLEH KAPANG HASIL ISAOLASI DARI PERTAMBANGAN
BATUBARA SUMATERA SELATAN
BERDASARKAN KARAKTERISTIK ENZIM
EKSTRASELULER DAN PRODUK YANG DIHASILKAN
SKRIPSI
Sebagai Salah Satu Syarat untuk Memperoleh Gelar Sarjana Sains Pada Program Studi Kimia Fakultas Sains dan Teknologi
Universitas Islam Negeri Syarif Hidayatullah Jakarta
HIDAYATI
106096003228
PROGRAM STUDI KIMIA
FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH
JAKARTA
PERNYATAAN
DENGAN INI SAYA MENYATAKAN BAHWA SKRIPSI INI BENAR-BENAR HASIL KARYA SENDIRI YANG BELUM PERNAH DIAJUKAN SEBAGAI SKRIPSI ATAU KARYA ILMIAH PADA PERGURUAN TINGGI ATAU LEMBAGA MANAPUN.
Jakarta, Maret 2011
PENGESAHAN UJIAN
Skripsi berjudul “ Studi Optimasi Proses Biosolubilisasi Batubara oleh Isolat Kapang dari Pertambangan Batubara Sumatera Selatan Berdasarkan Karakteristik Enzim Ekstraseluler dan Produk yang Dihasilkan” yang ditulis oleh Hidayati NIM 106096003228 telah diuji dan dinyatakan LULUS dalam sidang munaqosyah Fakultas Sains dan Teknologi Universitas Islam Negeri Syarif Hidayatullah Jakarta pada tanggal 25 Februari 2011. Skripsi ini telah diterima sebagai salah satu syarat untuk memperoleh gelar Sarjana Strata Satu (S1) Program Studi Kimia.
Menyetujui
Penguji 1, Penguji 2,
Sandra Hermanto, M.Si Megga Ratnasari Pikoli, M.Si
NIP. 19750810 200501 1 005 NIP. 19720322 200212 2 002
Pembimbing I, Pembimbing 2,
Irawan Sugoro, M.Si La Ode Sumarlin, M.Si NIP. 19761018 200012 1 001 NIP. 150 408 693
Mengetahui,
Dekan
Fakultas Sains dan Teknologi Ketua Program Studi Kimia
xv
ABSTRAK
Studi Optimasi Proses Biosolubilisasi Batubara oleh Kapang Hasil Isolasi
dari Pertambangan Batubara Sumatera Selatan Berdasarkan Karakteristik
Enzim Ekstraseluler dan Produk yang Dihasilkan.
Biosolubilisasi adalah proses pencairan batubara dengan memanfaatkan
mikroorganisme. Mikroorganisme yang digunakan pada penelitian ini adalah
tujuh isolat kapang hasil isolasi dari batubara dan tanah pertambangan batubara
lignit di Sumatera Selatan. Tujuan dari penelitian ini adalah untuk mengetahui
kadar protein ekstraseluler, mengkarakterisasi enzim ekstraseluler dan mengetahui
produk biosolubilisasi batubara oleh kapang hasil isolasi dari pertambangan
batubara
.
Medium yang digunakan adalah MSS dengan penambahan batubara
lignit 5 %. Kandungan enzim ekstraseluler masing-masing isolat kapang relatif
berbeda. Pada kapang B1, B2, dan B3 terdeteksi enzim lakase (BM=54,8 kDa dan
73, 12 kDa) dan mangan peroksidase (BM=38,12 kDa). Enzim lignin peroksidase
(BM=45,76) hanya terdeteksi pada kapang B2 dan B3. Hasil analisis GCMS
menunjukkan bahwa kapang B3 menghasilkan persentase senyawa terbesar
dengan komposisi karbon yang setara dengan bensin yaitu 65,65% dan kapang B1
yang setara dengan solar yaitu 38,43%.
xv i
ABSTRACT
Optimation Study of Coal Biosolubilization Process by Fungi the Result of
Isolation from Coal Mining in South Sumatera Based on Extracellular
Enzyme and the Product.
Biosolubilization is coal liquefaction process by utilizing microorganisms.
The microorganism used in this research was seven molds which has isolated
from soil and coal South Sumatra in mining. The purpose of this research was to
determine levels of extracellular proteins, characterization of extracellular
enzymes and biosolubilization products by molds. MSS medium was used with
the addition of 5% lignite. Extracellular enzyme content in each of the diffent
relative mold isolated. In the B1, B2, and B3 molds was detected laccase
(MW=54,8 kDa and 73, 12 kDa) and mangan peroxidase enzyme (MW=38,12
kDa). Lignin peroxidase enzyme (MW=45,76 kDa) only detected in B2 and B3
molds. GCMS analysis showed that the B3 mold has the largest percentage of
compounds with carbon composition which was equivalent to gasoline 65,65%
and B1 mold which was equivalent to diesel 38,43%.
vi
KATA PENGANTAR
Assalamu’alaikum wr. wb.
Segala puji serta syukur penulis panjatkan kepada Allah SWT yang telah melimpahkan rahmat serta hidayah-Nya, sehingga penulis dapat menyelesaikan skripsi ini dengan judul “Studi Optimasi Proses Biosolubilisasi Batubara oleh Kapang Hasil Isolasi dari Pertambangan Batubara Sumatera Selatan Berdasarkan Karakteristik Enzim Ekstraseluler dan Produk yang Dihasilkan”. Shalawat serta salam semoga senantiasa dilimpahkan kepada Nabi Muhammad SAW beserta segenap keluarga, para sahabat dan para pengikutnya hingga yaumul kiyamah.
Terselesaikannya skripsi ini tidak lepas dari peranan berbagai pihak yang
telah ikut secara langsung maupun tidak langsung. Penulis sadar sepenuhnya,
bahwa bagaimanapun usaha yang ditempuh tanpa adanya bimbingan dan bantuan
dari pihak lain, penulisan skripsi ini tidak akan terselesaikan dengan baik. Maka
dalam kesempatan ini, penulis ingin mengucapkan terima kasih yang
sebesar-besarnya kepada:
1. Bapak DR. Syopiansyah Jaya Saputra, M.Sis, selaku dekan Fakultas Sains
dan Teknologi.
2. Bapak Drs. Dede Sukandar, M.Si, selaku ketua Program Studi Kimia.
3. Bapak Irawan Sugoro, M.Si, selaku dosen Pembimbing I yang telah
banyak memberikan dukungan, bantuan dalam penelitian maupun
vii
4. Bapak La Ode Sumarlin, M.Si, selaku dosen Pembimbing II yang telah
banyak membantu dan memberikan kritik dan saran yang membangun
dalam analisa hasil dan penulisan.
5. Ibunda dan Ayahanda tercinta serta kakak-kakak tersayang, yang kasih
sayangnya sepanjang masa dan telah memberikan dukungan moril, materil
serta spiritual.
6. Riska Suraya Dewi dan Miftahul Jannah, teman selama penelitian yang
sudah banyak membantu penulis.
7. Teman-teman seperjuangan prodi kimia ’06 yang telah bersama-sama
berjuang dari awal perkuliahan hingga sampai akhirnya penulis dapat
menyelesaikan skripsi ini.
Tak ada gading yang tak retak dan tidak ada sesuatu apapun yang
sempurna di dunia kecuali Allah SWT, sehingga penulis sangat menyadari
akan masih banyak kekurangan dan kelemahan dalam penulisan skripsi ini.
Saran dan kritik yang membangun demi perbaikan sangat diharapkan.
Akhirnya, penulis hanya dapat berdo’a semoga semua amal baik yang
telah diberikan tersebut mendapat balasan yang berlipat ganda dari Allah
SWT. Dan semoga skripsi ini dapat memberikan sumbangan pemikiran demi
kemajuan dan keberhasilan bersama. Amin.
Wassalamu’alaikum wr. wb.
Jakarta, Maret 2011
viii DAFTAR ISI
Halaman
LEMBAR PENGESAHAN
KATA PENGANTAR ... vi
DAFTAR ISI... viii
DAFTAR TABEL ... xi
DAFTAR GAMBAR ... xii
DAFTAR LAMPIRAN... xiv
ABSTRAK... xv
ABSTRACT... xvi
BAB I PENDAHULUAN ... 1
1.1. Latar Belakang ... 1
1.2. Perumusan Masalah ... 3
1.3. Hipotesis ... 3
1.4.Tujuan Penelitian ... 4
1.5.Manfaat Penelitian ... 4
BAB II TINJAUAN PUSTAKA ... 5
2.1. Batubara ... 5
2.1.1. Klasifikasi Batubara ... 5
2.2. Biosolubilisasi Batubara ... 8
2.3. Kapang ... 10
2.4. Enzim Ekstraseluler ... 12
2.4.1. Lignin Peroksidase ... 15
2.4.2. Mangan Peroksidase ... 16
ix
2.5. Metode untuk Penentuan Protein Ekstraseluler... 18
2.6. Elektroforesis Protein ... 19
2.7. Spektrofotometer UV-Vis ... 21
2.8. Kromatografi Gas Spektroskopi Massa ... 22
BAB III METODOLOGI PENELITIAN ... 25
3.1.Waktu dan Tempat Penelitian ... 25
3.2. Alat dan Bahan ... 25
3.2.1. Alat ... 25
3.2.2. Bahan... 25
3.3. Prosedur Kerja ... 26
3.3.1. Persiapan dan Sterilisasi Alat ... 26
3.3.2. Persiapan Serbuk Batubara ... 26
3.3.3. Pembuatan Medium Potato Dextrose Agar (PDA) ... 26
3.3.4. Pembuatan Medium MSS+ ... 26
3.3.5. Uji Kualitatif Enzim Ekstraseluler ... 27
3.3.5.1. Fenol Oksidase ... 27
3.3.5.2. Lignin Peroksidase ... 27
3.3.5.3. Mangan Peroksidase ... 27
3.3.6. Kultur Inokulum Spora ... 28
3.3.7. Biosolubilisasi Batubara ... 28
3.3.8. Pengukuran Kadar Protein Ekstraseluler ... 28
3.3.9. Profil Protein dengan Elektroforesis ... 29
3.3.10. Analisis Hidrolisis FDA ... 30
3.3.11. Pengukuran Biosolubilisasi Batubara ... 31
x
3.3.13. Analisa Data ... 32
BAB IV HASIL DAN PEMBAHASAN ... 33
4.1. Hasil Analisa Enzim Ekstraseluler secara Kualitatif ... 33
4.2. Perubahan pH Medium pada Masing-Masing Kapang selama Proses Solubilisasi………...……….. 34
4.3. Tingkat Biosolubilisasi Batubara Berdasarkan Nilai Absorbansi ... 38
4.4. Kadar Protein Ekstraseluler dalam Biosolubilisasi Batubara ... 43
4.5. Elektroforesis Protein ... 45
4.6. Analisis Hidrolisis Fluorescent Diacetate (FDA) ... 47
4.7. Analisis GC-MS Hasil Solubilisasi Batubara oleh Kapang Menggunakan GCMS ... 51
BAB V KESIMPULAN DAN SARAN... 58
5.1. Kesimpulan ... 58
5.2. Saran ... 58
DAFTAR PUSTAKA ... 59
xi
DAFTAR TABEL
[image:13.612.119.539.58.452.2]Halaman
Tabel 1. Enzim Ekstraseluler Pendegradasi Lgnin dari Kapang
Pelapuk Putih ... 13
Tabel 2. Jenis Perlakuan yang Digunakan………. 28
Tabel 3. Hasil Uji Kualitatif Enzim Ekstraseluler ... 33
Tabel 4. Senyawa Hasil Biosolubilisasi Batubara Menggunakan
xii
DAFTAR GAMBAR
Halaman
Gambar 1. Batubara Antrasit dan strukturnya ... 5
Gambar 2. Batubara Bituminus dan strukturnya ... 6
Gambar 3. Batubara Subbituminus dan strukturnya ... 7
Gambar 4. Batubara Lignit dan strukturnya ... 7
Gambar 5. Skema Sistem Degradasi Lignin oleh Phanerochaete chrysosporium ... 14
Gambar 6. Reaksi Enzim Peroksidase dengan Metilen Biru ... 16
Gambar 7. Reaksi Oksidasi oleh Enzim Fenol Oksidase ... 17
Gambar 8. Seperangkat Alat Elektroforesis 1 D ... 19
Gambar 9. Denaturasi Protein oleh SDS ………. 20
Gambar 10. Spektrofotometer UV-Vis... 21
Gambar 11. GCMS ... 23
Gambar 12. Grafik Perubahan Nilai pH Medium Selama Proses Solubilisasi Batubara pada Kapang... 35
Gambar 13. Reaksi Dearomatisasi Piridin ... 37
Gambar 14. Absorbansi pada Panjang Gelombang 250 nm pada Masing-Masing Kapang ... 38
Gambar 15. Reaksi Degradasi Lignin oleh Enzim Lignin Peroksidase ……... 39
Gambar 16. Reaksi oksidasi unit non fenolik dan fenolik oleh enzim lakase dan MnP ... 39
Gambar 17. Absorbansi pada Panjang Gelombang 450 nm pada Masing-Masing Kapang ... 40
Gambar 18. Reaksi Degradasi Poli Aromatik Hidrokarbon ... 41
xiii
Gambar 20. Hasil Elektroforesis SDS PAGE ... 46
Gambar 21. Reaksi Hidrolisis FDA dan Ester ... 48
Gambar 22. Absorbansi FDA pada Masing-Masing Kapang ... 49
Gambar 23. Persentase Area Senyawa Komponen Bensin dan Solar Hasil
xiv
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Komposisi Medium ... 62
Lampiran 2. Skema Kerja ... 63
Lampiran 3. Komposisi Larutan Lowry ... 64
Lampiran 4. Komposisi Larutan Elektroforesis………. 64
Lampiran 5. Data Hasil Penelitian ... 65
Lampiran 6. Kromatogram Hasil GC-MS Kontrol (Tanpa Isolat Kapang) ... 69
Lampiran 7. Kromatogram Hasil GC-MS oleh Kapang B1... 70
Lampiran 8. Kromatogram Hasil GC-MS oleh Kapang B2 ... 71
Lampiran 9. Kromatogram Hasil GC-MS oleh Kapang B3 ... 72
1 BAB I PENDAHULUAN
1.1.Latar Belakang
Batubara menjadi sumber energi yang penting di dunia, seiring dengan
semakin terbatasnya cadangan minyak dan gas alam (Tanaka, 1999). Alternatif
penggunaan batubara sebagai bahan bakar diperkirakan dapat menjadi solusi dari
krisis kelangkaan BBM sampai ratusan tahun mendatang. Berdasarkan laporan
Departemen Energi dan Sumber Daya Mineral (2008), potensi sumber daya
batubara di Indonesia pada akhir tahun 2008 sebanyak 105 miliar ton (Wahyuni,
2009). Setelah cadangan minyak dan gas alam habis, maka batubara akan
mendominasi pasar energi fosil (Tanaka, 1999).
Teknologi pencairan batubara sebagai bahan bakar yang hampir setara
dengan output minyak bumi merupakan cara untuk meningkatkan kualitas
batubara. Proses tersebut dinamakan liquefaksi. Terdapat berbagai metode
pencairan batubara yang telah diterapkan di berbagai negara di dunia. Pada
umumnya teknik yang digunakan adalah dengan metode kimia dan fisika yang
memakan biaya operasional yang cukup tinggi dan juga memerlukan instalasi
yang cukup rumit (Fakoussa and Hofrichter, 1998).
Alternatif lain untuk proses pencairan batubara yaitu dapat dilakukan
secara biologis dengan bantuan mikroorganisme. Proses pencairan batubara
dengan memanfaatkan mikroorganisme dikenal dengan biosolubilisasi atau
bioliquefaksi. Fakoussa (1981), menemukan bahwa beberapa mikroorganisme
2 mereka sementara mereka mensolubilisasi LRC, solubilisasi lignit oleh mikroba
telah banyak diselidiki di seluruh dunia. Mikroorganisme yang digunakan dalam
penelitian ini ada tujuh isolat yang berasal dari Sumatera Selatan. Beberapa
peneliti menyatakan bahwa enzim, kelat atau alkali terlibat dalam mekanisme
biosolubilisasi lignit. Secara khusus, enzim adalah faktor kunci (Tao et al., 2009).
Hasil penelitian sebelumnya oleh Sugoro et al., (2009) menyatakan bahwa
batubara cair hasil biosolubilisasi kapang pada batubara subbituminus Sumatera
Selatan dapat digunakan sebagai energi alternatif. Hasil biosolubilisasi batubara
adalah produk dengan berat molekul tinggi, tidak mengandung komponen
berbahaya karena mikroorganisme mampu membersihkan kandungan sulfur dan
nitrogen dari batubara dan kandungan oksigen yang tinggi (Cohen et al., 1990).
Proses biosolubilisasi terjadi karena adanya interaksi antara batubara
dengan enzim ekstraseluler. Enzim ekstraseluler adalah enzim yang diekskresikan
oleh kapang ke luar tubuhnya untuk mendegradasi substrat. Enzim ekstraseluler
tersebut akan menghasilkan medium yang lebih gelap akibat dari degradasi
batubara selama proses kultur cair atau cairan gelap pada permukaan kultur ketika
ditumbuhkan pada permukaan kultur agar (Faison et al., 1989). Produk enzim
ekstraseluler dapat diketahui dengan mengukur kadar protein bebas sel.
Diasumsikan jika kadar protein tinggi maka jumlah enzim ekstraseluler juga
tinggi. Karakterisasi enzim dilakukan dengan cara elektroforesis protein dengan
menggunakan Sodium Dodecyl Sulphate Polyacrylamide Gel Electrophoresis
(SDS-PAGE) untuk mengetahui profil protein bagi solubilisasi batubara dan
3 Enzim ekstraseluler berperan mendegradasi lignin sebagai substratnya.
Enzim pendegradasi lignin secara umum terdiri dari dua kelompok utama yaitu
lakase dan peroksidase. Enzim peroksidase terdiri dari lignin peroksidase (LiP)
dan mangan peroksidase (MnP). Ketiga enzim tersebut bertanggung jawab
terhadap pemecahan awal polimer lignin dan menghasilkan produk dengan berat
molekul rendah, larut dalam air dan CO2 (Akhtar et al., 1997). Ketiga enzim
tersebut memiliki nilai molecular weight (MW) sebesar 38-47 kDa (LiP), 38-50
kDa (MnP), dan 53-110 kDa (lakase) (Fakoussa and Hofrichter, 1998). Hasil
degradasi enzim ekstraseluler selanjutnya dianalisis oleh GCMS dengan
membandingkan komposisi senyawa hidrokarbon yang setara dengan bensin dan
solar.
1.2.Rumusan Masalah
1. Bagaimana kadar protein ekstraseluler pada isolat kapang selama proses
biosolubilisasi?
2. Bagaimana profil enzim ekstraseluler pada isolat kapang hasil isolasi dari
prtambangan batubara?
3. Apakah hasil analisis GCMS terhadap biosolubilisasi batubara memiliki
karakteristik senyawa hidrokarbon yang mendekati bensin atau solar?
1.3.Hipotesis
1. Kadar protein ekstraseluler pada isolat kapang berpengaruh terhadap
biosolubilisasi batubara .
2. Terdapat perbedaan profil enzim ekstraseluler di antara kultur kapang hasil
4 3. Hasil analisis GCMS terhadap biosolubilisasi batubara memiliki
karakteristik senyawa hidrokarbon yang mendekati bensin dan solar.
1.4. Tujuan Penelitian
Tujuan penelitian ini adalah sebagai berikut:
1. Mengetahui kadar protein ekstraseuler pada isolat kapang yang berperan
dalam proses biosolubilisasi batubara.
2. Mengetahui profil enzim ekstraseluler di antara kultur kapang hasil isolasi
dari pertambangan batubara.
3. Mengetahui karakteristik senyawa hidrokarbon dari batubara hasil
biosolubilisasi.
1.5. Manfaat Penelitian
Hasil penelitian ini yaitu profil protein kultur kapang hasil isolasi
dari pertambangan batubaradiharapkan dapat memberikan pengetahuan dan
informasi tentang enzim yang mampu mengsolubilisasi batubara untuk
5 BAB II
TINJAUAN PUSTAKA
2.1. Batubara
Batubara adalah sisa-sisa tumbuhan yang terakumulasi di dalam suatu
cekungan dan kemudian mengalami proses pembatubaraan (coalification) yang
disebabkan oleh faktor tekanan, suhu dan waktu geologi. Oleh karena itu,
batubara termasuk dalam kategori bahan bakar fosil. Batubara dapat terbentuk
berupa lapisan dengan ketebalan beberapa millimeter sampai dengan ratusan
meter atau dapat pula berupa bahan organik yang tersebar pada suatu batuan
sedimen (Rumidi, 1995).
2.1.1. Klasifikasi Batubara
Menurut Speight (1994), secara umum batubara diklasifikasikan menjadi
empat tipe utama berdasarkan kandungan karbon :
1. Batubara antrasit
Batubara antrasit merupakan batubara dengan tingkat metamorfik paling
tinggi (proses perubahan struktur batuan karena peristiwa tekanan atau pemanasan
yang sangat tinggi), dikenal dengan batubara keras dan memiliki kilau berlian.
6 Kandungan karbonnya mencapai 80-96 % dari beratnya sehingga dapat
menghasilkan energi paling tinggi dari jenis batubara lainnya, yaitu mencapai
20-28 juta British thermal unit (Btu)/ton. Biasanya dipakai untuk bahan pemanas
ruangan di rumah, perkantoran dan untuk pembuatan briket tanpa asap.
2. Batubara bituminus
Batubara bituminus berwarna hitam, agak keras, komposisi air sangat
kecil, mengandung bahan yang mudah menguap seperti sulfur yaitu sekitar 15-20
%, karbon sebanyak 45-80 % dari beratnya dan energi hasil pembakarannya
mencapai 19-32 juta Btu/ton.
[image:22.612.131.537.162.423.2]
Gambar 2. Batubara bituminus dan strukturnya (American Coal Foundation, 2007).
Hasil pembakaran batubara bituminus berupa api berwarna kuning yang
berasap dan berabu. Penggunaan batubara bituminus ditujukan untuk dikonversi
menjadi arang (coke) yang digunakan dalam industri baja.
3. Batubara subbituminus
Batubara subbituminus berwarna hitam, lunak, kandungan karbon sebesar
35-45 % dan energi yang dihasilkan berkisar antara 16-24 juta Btu/ton.
Kandungan karbon batubara subbituminus lebih rendah dibandingkan batubara
bituminus, akan tetapi menghasilkan pembakaran yang lebih bersih karena
7
Gambar 3. Batubara subbituminus dan strukturnya (American Coal Foundation, 2007).
Batubara ini merupakan batubara yang sering digunakan dalam industri
karena di Indonesia jumlahnya sangat melimpah. Pemanfaatan batubara
subbituminus terutama digunakan sebagai bahan bakar untuk Pembangkit Listrik
Tenaga Uap (PLTU).
4. Batubara lignit
Batubara lignit merupakan jenis batubara yang secara geologis tergolong
jenis batubara paling muda, sangat lunak, memiliki warna mulai dari cokelat
hingga hitam kecokelatan. Lignit sebagian besar terdiri dari material kayu kering
yang terkena tekanan tinggi.
[image:23.612.131.541.54.460.2]
Gambar 4. Batubara lignit dan strukturnya (American Coal Foundation, 2007). Kandungan karbon berkisar antara 20-35 % dari beratnya dan energi yang
dihasilkan berkisar antara 9-17 Btu/ton. Kandungan airnya lebih tinggi daripada
batubara subbituminus sehingga perlu dikeringkan terlebih dahulu sebelum
8 2.2. Biosolubilisasi Batubara
Biosolubilisaasi batubara adalah proses pelarutan batubara dalam suatu
medium dengan bantuan mikroorganisme. Biosolubilisasi dapat berupa upaya
untuk mencairkan batubara yang nantinya dapat digunakan sebagai bahan bakar
pengganti minyak bumi. Disamping untuk mencairkan batubara, biosolubilisasi
dapat pula digunakan untuk mengurangi kandungan sulfur atau logam toksik pada
batubara (Speight, 1994). Diketahui bahwa terdapat beberapa jenis
mikroorganisme dari jenis bakteri maupun fungi yang dapat mengubah batubara
padat menjadi produk cair, dengan minimalisasi hilangnya kandungan energi total
awal (Faison et al., 1989).
Biosolubiliasi lignit adalah teknologi yang menjanjikan, memanfaatkan
mikorba untuk mensolubilisasi padatan lignit sehingga diperoleh produk bersih,
sebagai sumber energi dengan biaya efektif. Pada tahun 1982, Cohen pertama kali
melaporkan bahwa lignit dari Amerika dapat disolubilisasi oleh jamur Polyporus
versicolor dan Poria montico. Kemudian pada tahun 1991, Catcheside
melaporkan bahwa lignit Australia dapat disolubiliasai oleh Coriolus versicolor,
Phanerochaete chrysosporium, dan 4 spesies lainnya. Pada tahun 1992,
biosolubilisasi dengan lignit Jerman menggunakan tujuh basidiomycetes telah
diteliti dan dikonfirmasi oleh Resis (Yin et al., 2009).
Pada tahun 2002, Machnikowska menemukan bahwa Polish lignite dapat
disolubilisasi oleh strain P. putida. Pada tahun 2003, Basaran dan rekannya telah
sukses menssolubilisasi lignit Turki ke bentuk cairan hitam dengan menggunakan
jamur Corilous versicolor. Saat ini, Shi dan rekan-rekannya telah mensolubilisasi
9 nilai pemanasan lignit mentah, yang mengemukakan bahwa hampir tidak ada
energi hilang selama proses biosolubilisasi dan hal ini pun menunjukkan proses
yang efisien dari transfer energi tersimpan dalam padatan lignit menjadi minyak
cair (Yin et al., 2009).
Dibandingkan dengan liquefaksi termal lignit, biosolubilisasi memiliki
beberapa keuntungan, yaitu :
1. Proses dilakukan dalam kondisi suhu dan tekanan atmosfer
2. Konversi lignit menjadi produk fase tunggal tanpa menghasilkan sejumlah
besar produk samping.
3. Fakta membuktikan bahwa mikroba dapat menggunakan hidrogen dari air
dan tidak membutuhkan energi eksternal hidrogen untuk membentuk lignit
tersolubilisasi.
4. Produk biosolubilisasi lignit tidak mengandung sulfur atau nitrogen, yang
berarti tidak akan menghasilkan SOx dan NOx selama proses pembakaran
dan itulah sumber energi bersih (Yin et al., 2009).
Dengan alasan di atas, maka biosolubilisasi lignit menjadi menarik untuk
diteliti lebih dalam di seluruh dunia. Akan tetapi, hasil solubilisasi yang rendah
dan dibutuhkannya waktu konversi yang lama menjadi penghambat
pengembangan biosolubilisasi lignit. Sepengetahuan autor, maksimum
biosolubilisasi lignit hanya mencapai 34%. Waktu terpendek untuk konversi
adalah 10 hari. Maksimum waktu biosolubilisasi membutuhkan sekitar 2 bulan.
Karena biosolubilisasi lignit umumnya diinduksi oleh enzim yang disekresikan
oleh mikroba, kebanyakan ilmuwan mencoba menemukan dan mengisolasi enzim
10 2.3. Kapang
Kapang adalah kelompok mikroorganisme yang tergolong dalam fungi.
Selain kapang, organisme lainnya yang termasuk ke dalam fungi adalah khamir
dan cendawan (mushroom). Kapang merupakan organisme multiseluler,
eukariotik, tidak berklorofil, dinding selnya tersusun dari kitin, bersifat heterotrof,
menyerap nutrien melalui dinding selnya, mengeksresikan enzim ekstraselular ke
lingkungan, menghasilkan spora atau konidia, bereproduksi seksual dan atau
aseksual (Hidayat et al., 2006).
Tubuh kapang terdiri dari hifa. Hifa berfungsi menyerap nutrien dari
lingkungan serta membentuk struktur reproduksi. Hifa adalah suatu struktur
berbentuk tabung menyerupai seuntai benang panjang yang terbentuk dari
pertumbuhan spora atau konidia. Kumpulan hifa yang bercabang-cabang
membentuk suatu jala dan umumnya berwarna putih yang disebut miselium. Ada
beberapa kapang dengan miselia longgar atau seperti bulu kapas sedangkan yang
lainnya kompak. Penampakan miselia ada yang seperti beludru (velvet) pada
permukaan atasnya, beberapa kering seperti bubuk, basah atau memiliki massa
seperti gelatin (Hidayat et al., 2006).
Pertumbuhan pada kapang adalah pertambahan volume sel, karena adanya
pertambahan protoplasma dan senyawa asam nukleat yang melibatkan sintesis
DNA dan pembelahan mitosis. Pada umunya, kapang mengekskresikan enzim
ekstraselular ke lingkungan. Enzim ekstraseluler tersebut menguraikan
komponen-komponen kompleks pada substrat menjadi komponen-komponen
sederhana yang dapat dengan mudah diserap kapang untuk mensintesis berbagai
11 suatu substrat dapat diketahui dengan adanya perubahan warna atau kekeruhan
pada substrat cair (Gandjar et al., 2006).
Pertumbuhan kapang pada substrat sebenarnya adalah suatu proses
fermentasi, yaitu kapang mengurai komponen-komponen kompleks yang ada
dalam substrat menjadi komponen-komponen sederhana yang dapat diserap sel
dan digunakan untuk sintesis aneka bagian sel dan untuk energi aktivitasnya
(Gandjar et al., 2006).
Sifat-sifat fisiologi kapang sangat penting dipenuhi agar pertumbuhan
kapang menjadi optimal. Gandjar et al., (2006) menerangkan sifat-sifat fisiologi
kapang sebagai berikut :
1. Kebutuhan air
Pada umumnya, fungi tingkat rendah seperti Rhizopus sp. dan Mucor sp.
memerlukan lingkungan dengan kelembaban nisbi 90 %, kapang Aspergillus
sp, Penicillium sp, Fusarium sp. dan banyak hypomycetes lainnya dapat
hidup pada kelembaban yang lebih rendah yaitu 80 % sedangkan kapang
xerofilik mampu hidup pada kelembaban 70 %.
2. Suhu
Kebanyakan kapang bersifat mesofilik yaitu tumbuh baik pada suhu kamar.
Suhu optimum pertumbuhan untuk kebanyakan kapang adalah sekitar 25-30°
C, tetapi beberapa kapang dapat tumbuh pada suhu 35-37° C atau lebih tinggi
seperti Aspergillus sp. Beberapa kapang mampu tumbuh pada suhu dingin
12 3. Kebutuhan oksigen
Semua kapang bersifat aerobik yaitu membutuhkan oksigen yang cukup
untuk pertumbuhannya.
4. Derajat keasaman (pH)
Kebanyakan kapang mampu tumbuh pada kisaran pH yang luas, yaitu 2-8.5,
akan tetapi pertumbuhannya akan lebih baik pada kondisi asam atau pH
rendah.
5. Substrat
Substrat merupakan sumber nutrien utama bagi kapang. Nutrien dalam
substrat baru dapat dimanfaatkan apabila kapang telah mengekskresikan
enzim-enzim ekstraseluler untuk menguraikan senyawa kompleks menjadi
sederhana.
6. Komponen penghambat
Beberapa kapang mengeluarkan komponen yang dapat menghambat
organisme lainnya seperti bakteri, komponen tersebut disebut antibiotik.
2.4.Enzim Ekstraselular
Sebagian besar mikroorganisme yang mampu mendegradasi lignin dapat
diaplikasikan juga untuk mendegradasi batubara (Cohen et al., 1990). Kapang
yang memiliki kemampuan paling baik dalam proses biosolubilisasi batubara
adalah Trametes versicolor, Pleurotus florida, P. ostreatus and P. sajorcaju.
Selain keempat isolat kapang tersebut, kapang lainnya seperti Trichoderma
atroviride, Fusarium oxysporum, Penicillium sp, Candida sp, Aspergillus sp,
Mucor sp, dan Sporothrix sp memiliki kemampuan mendegradasi batubara, akan
13 mendegradasi batubara menggunakan enzim ekstraselular, hal tersebut diperkuat
dengan penelitian bahwa proses biosolubilisasi pada batubara dikatalis melalui
[image:29.612.136.537.102.410.2]aktivitas enzim ekstraselular (Ward, 1990).
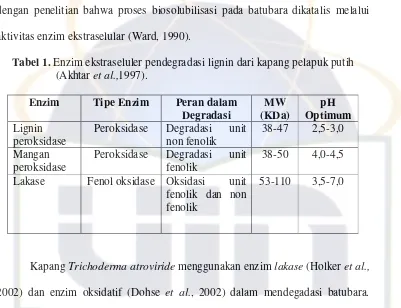
Tabel 1. Enzim ekstraseluler pendegradasi lignin dari kapang pelapuk putih (Akhtar et al.,1997).
Enzim Tipe Enzim Peran dalam Degradasi MW (KDa) pH Optimum Lignin peroksidase
Peroksidase Degradasi unit non fenolik
38-47 2,5-3,0
Mangan peroksidase
Peroksidase Degradasi unit fenolik
38-50 4,0-4,5
Lakase Fenol oksidase Oksidasi unit fenolik dan non fenolik
53-110 3,5-7,0
Kapang Trichoderma atroviride menggunakan enzim lakase (Holker et al.,
2002) dan enzim oksidatif (Dohse et al., 2002) dalam mendegadasi batubara.
Kapang Fusarium oxysporum, Penicillium sp, Candida sp, Aspergillus sp,Mucor
sp. dan Sporothrix sp. hanya menggunakan enzim oksidatif dalam mendegradasi
batubara (Gupta & Crawford, 2000).
Enzim ekstraseluler adalah enzim yang diekskresikan oleh kapang ke luar
tubuhnya untuk mendegradasi substrat. Enzim ekstraseluler tersebut akan
menghasilkan medium yang lebih gelap akibat dari degradasi batubara selama
proses kultur cair atau cairan gelap pada permukaan kultur ketika ditumbuhkan
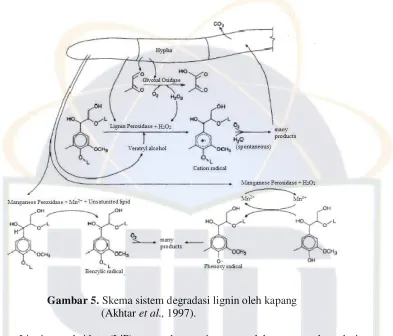
pada permukaan kultur agar (Faison et al., 1989). Skema sistem degradasi lignin
14 Gambar 5. Skema sistem degradasi lignin oleh kapang
(Akhtar et al., 1997).
Lignin peroksidase (LiP) merupakan enzim utama dalam proses degradasi
lignin karena mampu mengoksidasi unit non fenolik lignin. Oksidasi substruktur
lignin yang dikatalis oleh LiP dimulai dengan pemisahan satu elektron cincin
aromatik substrat donor dan menghasilkan radikal aril. LiP memotong ikatan Cα
-Cβ molekul lignin, pemotongan tersebut merupakan jalur utama perombakan
lignin oleh berbagai kapang pelapuk putih (Hammel, 1996).
Mangan peroksidase (MnP) berperan dalam oksidasi unit fenolik, sehingga
LiP dan MnP dapat bekerja secara sinergis. Siklus katalitik MnP dimulai dengan
pengikatan H2O2 atau peroksida organik dengan enzim ferric alami dan
pembentukan kompleks peroksida besi. Pemecahan ikatan oksigen peroksida
membutuhkan transfer dua electron dari heme untuk pembentukan Fe
15 dikeluarkan satu molekul air. Reaksi berlangsung sampai terbentuk MnP II, ion
Mn2+ bekerja sebagai donor satu-elektron untuk senyawa antara porfirin dan
dioksidasi menjadi Mn3+. Ion Mn3+ merupakan oksidator kuat yang dapat
mengoksidasi senyawa fenolik tetapi tidak dapat menyerang unit non fenolik
lignin (Perez et al., 2002).
Lakase ditemukan pada kapang, khamir, dan bakteri. Enzim ini tidak
membutuhkan H2O2 tetapi menggunakan molekul oksigen. Lakase mereduksi
oksigen menjadi H2O dalam substrat fenolik melalui reaksi satu elektron
membentuk radikal bebas yang dapat disamakan dengan radikal kation yang
terbentuk pada reaksi MnP (Kersten et al., 1990). Aksi lakase pada aromatik
fenolik menghasilkan pembentukan radikal fenoksi (Fakoussa and Hofrichter,
1998).
2.4.1.Lignin Peroksidase
Lignin peroksidase (LiP) adalah enzim pemecah lignin yang paling banyak
diselidiki dan pertama kali ditemukan dalam jamur Phanerochaete
chrysosporium (Glenn et al., 1983; Tien dan Kirk 1983). Kemudian, LiP ini juga
ditemukan pada beberapa jamur basidiomycetes (misalnya Phlebia radiata,
Hatakka et al., 1987; Trametes (Coriolus) versicolor, Dodson et al., 1987;
Bjerkandera adusta, Kimura et al., 1991; Nematoloma frowardii, Hofrichter dan
Fritsche 1997) dan satu ascomycota (Chrysonilia sitophila; Duran et al., 1987).
LiP adalah sebuah glikoprotein yang mengandung besi protoporphyrin IX (heme)
sebagai suatu kelompok prostetik dan membutuhkan H2O2 untuk aktivitas
katalitik (Gold et al., 1984; Tien dan Kirk 1984). Ini dinyatakan dalam beberapa
16 Gambar 6. Reaksi enzim peroksidase dengan metilen biru (www.
genchem.rutgers.edu)
Reaksi positif LiP ditandai dengan adanya warna yang memudar pada
medium jika diuji dengan metilen biru. Warna yang memudar terjadi karena
enzim peroksidase mereduksi metilen biru menjadi leukometilen biru (Gambar 6).
2.4.2. Mangan Peroksidase
Mangan peroksidase juga ditemukan dalam P. chrysosporium (Kuwahara
et al., 1984). Menyerupai enzim LIP, yaitu ekstraselular, glikosilasi dan
mengandung heme sebagai gugus prostetiknya. Tapi masing-masing
menggunakan Mn (II) dan Mn (III) sebagai substrat spesifik dan mediator. MnP
juga dinyatakan dalam beberapa bentuk dengan MW dari 38-50 kDa. Di samping
P. chrysosporium, MnP juga telah ditemukan di banyak jamur pelapuk putih
lainnya dan basidiomycetes pembusuk sampah, tetapi tidak dalam jamur atau
bakteri lain (Fakoussa and Hofrichter, 1998).
Uji kualitatif enzim mangan peroksidase digunakan medium padat yang
ditambahkan MnCl2.4H2O. Medium yang mengandung MnCl2.4H2O
17 diinokulasi beberapa hari. MnP mengkatalisis oksidasi MnCl2 menjadi MnO2
sehingga menghasilkan spot berwarna coklat hitam (TAO et al., 2009).
2.4.3. Lakase
Lakase ditemukan pada kapang, khamir, dan bakteri. Enzim ini tidak
membutuhkan H2O2 tetapi menggunakan molekul oksigen. Lakase mereduksi
oksigen menjadi H2O dalam substrat fenolik melalui reaksi satu elektron
membentuk radikal bebas yang dapat disamakan dengan radikal kation yang
terbentuk pada reaksi MnP (Kersten et al., 1990). Aksi lakase pada aromatik
fenolik menghasilkan pembentukan radikal fenoksi (Fakoussa and Hofrichter,
1998).
Beberapa indikasi yang diberikan bahwa lakase terlibat dalam konversi
lignit oleh T. versicolor dan enzim ini dianggap sebagai agen yang bertanggung
jawab pada kemampuan jamur untuk solubilisasi batubara (pembentukan cairan
hitam dari partikel batubara padat). Purifikasi lebih lanjut dari fraksi lakase
menunjukkan terdapat dua protein, yang pertama menunjukkan aktivitas lakase,
tetapi efeknya sedikit pada batubara, sementara yang lain memiliki sedikit lakase,
tetapi aktivitas solubilisasi batubaranya tinggi (Fakoussa and Hofrichter, 1998).
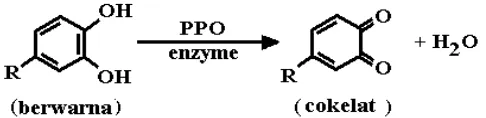
Aktivitas lakase pada medium padat yang ditambahnkan tannin ditandai dengan
[image:33.612.199.442.577.636.2]terbentuknya difusi warna cokelat pada medium.
Gambar 7. Reaksi oksidasi oleh enzim fenol oksidase (www.brsquared.org). Difusi warna coklat muncul setelah masing-masing kapang diinokulasi
18 senyawa fenolik kompleks yang memiliki berat molekul 500-3000. Tanin
berfungsi sebagai pengganti batubara, karena dalam batubara juga mengandung
senyawa fenol. Difusi warna cokelat muncul karena adanya proses oksidasi dari
tanin oleh enzim fenol oksidase (Gambar 7).
2.5.Metode untuk Penentuan Protein Ekstraseluler
Protein yang berasal dari kata proteos (utama atau pertama) merupakan
senyawa makromolekul yang memiliki peranan penting pada setiap makhluk
hidup. Protein dihasilkan dari proses ekspresi genetik molekul DNA yang terdapat
di dalam sel. Protein adalah suatu polipeptida dengan bobot molekul yang sangat
bervariasi, dari 5000 hingga lebih dari satu juta. Disamping berat molekul yang
berbeda-beda, protein mempunyai sifat yang berbeda-beda pula, dengan fungsi
yang spesifik ditentukan oleh gen yang sesuai (Poedjiadi dan Titin, 1994).
Pada penelitian ini, untuk menentukan kadar protein ekstraseluler
digunakan metode Lowry. Metode Lowry dikembangkan pada tahun 1951 dengan
menggunakan reagen pendeteksi Folin-Ciocalteu. Reaksi antara Cu2+ dengan
ikatan peptida dan reduksi asam fosfomolibdat dan asam fosfotungstat oleh tirosin
dan triptofan (merupakan suatu protein) akan menghasilkan warna biru. Warna
yang terbentuk terutama dari hasil reaksi fosfomolibdat dan fosfotungstat. Oleh
karena itu warna yang terbentuk tergantung pada kadar tirosin dan triptofan dalam
protein. Metode Lowry mempunyai keuntungan karena 100 kali lebih sensitif dari
metode biuret. Hasil reduksi ini dapat dianalisa lebih lanjut dengan melihat
puncak absorpsi yang lebar pada daerah panjang gelombang sinar tampak
(600-800 nm) (Apriyanto et al., 1989). Dalam kadar analisa protein dengan cara Lowry,
19 Albumin) yang memiliki rentang konsentrasi tertentu dimana konsentrasi sampel
protein berada di dalam rentang tersebut.
2.6. Elektroforesis Protein
Menurut Yuwono (2005), elektroforesis adalah suatu teknik pemisahan
molekul selular berdasarkan atas ukurannya, dengan menggunakan medan listrik
yang dialirkan pada suatu medium yang mengandung sampel yang akan
dipisahkan. Kecepatan gerak molekul tergantung pada nisbah (rasio) muatan
terhadap massanya, serta tergantung pula pada bentuk molekulnya.
Elektroforesis dapat digunakan untuk keperluan preparatif, selain bersifat
analitik, bentuknya ada yang bersifat kolom, ada pula yang lempengan. Salah satu
jenis elektroforesis adalah elektroforesis SDS-PAGE (Gambar 8). Sodium
Dodecyl Sulphate Polyacrylamide Gel Electrophoresis (SDS-PAGE) terutama
dilakukan untuk menetapkan berat molekul protein. SDS-PAGE adalah suatu
teknik biologi molekular yang digunakan untuk memisahkan protein sesuai
dengan ukuran. Pada tahun 1998, Laborda et al., menganalisis enzim-enzim
pengsolubilisasi batubara dengan menggunakan metode SDS PAGE. Enzim
esterase, lakase, mangan peroksidase serta enzim lignin peroksidase terbukti ada
[image:35.612.240.413.546.654.2]atau terdeteksi setelah dilakukan karakterisasi dengan SDS PAGE.
20 Pada mekanisme SDS PAGE, protein bereaksi dengan SDS yang
merupakan deterjen anionik membentuk kompleks yang bermuatan negatif.
Protein akan terdenaturasi dan terlarut membentuk kompleks berikatan dengan
SDS, berbentuk elips atau batang, dan berukuran sebanding dengan berat molekul
protein. Protein dalam bentuk kompleks yang bermuatan negatif ini terpisahkan
berdasarkan muatan dan ukurannya secara elektroforesis di dalam matriks gel
poliakrilamid. Berat molekul protein dapat diukur dengan menggunakan protein
standar yang telah diketahui berat molekulnya (Garfin, 2003). Gambar 9
[image:36.612.134.528.191.451.2]menunjukkan gambar denaturasi protein oleh SDS.
Gambar 9. Denaturasi protein oleh SDS (Experimental Biosciences, 2007).
Elektroforesis gel SDS dilakukan pada pH mendekati netral. Adanya SDS
menyebabkan protein rantai ganda akan terdisosiasi menjadi rantai-rantai
individual yang terdenaturasi oleh detergent ini, sehingga susunan yang tadinya
teratur (struktur 3 dimensi) menjadi rusak membentuk konfigurasi “Random
Coil”. Peristiwa ini dibantu oleh adanya merkaptoetanol yang memecah
ikatan-ikatan disulfida antar ataupun dalam rantai (mereduksi ikatan-ikatan disulfida menjadi
gugus-gugus sulfihidril) (Hames, 1998). Oleh karena itu protein dapat dipisahkan
21 besar mempunyai mobilitas yang lebih kecil dibandingkan dengan kompleks yang
lebih kecil (Garfin, 2003).
2.7.Spektrofotometer UV-Vis
Spektrofotometer sesuai dengan namanya adalah alat yang terdiri dari
spektrometer dan fotometer. Spektrometer menghasilkan sinar dari spektrum
dengan panjang gelombang tertentu dan fotometer adalah alat pengukur intensitas
cahaya yang ditransmisikan atau yang diabsorpsi. Jadi spektrofotometer
digunakan untuk mengukur energi secara relatif jika energi tersebut
ditransmisikan, direfleksikan atau diemisikan sebagai fungsi dari panjang
[image:37.612.131.532.132.440.2]gelombang (Khopkar, 2003).
Gambar 10. Spektrofotometer UV-Vis (Dokumentasi Pribadi, 2010).
Semua molekul dapat mengabsorpsi radiasi dalam daerah UV-Vis karena
mereka mengandung elektron, baik sekutu maupun menyendiri, yang dapat
dieksitasikan ke tingkat yang lebih tinggi. Panjang gelombang di mana absorpsi
itu terjadi, bergantung pada berapa kuat elektron itu terikat dalam molekul itu.
Gugus-gugus fungsional tertentu seperti karbonil, nitro, dan sistem terkonjugasi,
benar-benar menunjukkan puncak karakteristik, dan sering dapat diperoleh
informasi yang berguna mengenai ada atau tidaknya gugus semacam itu dalam
22 Pada penelitian ini analisis produk biosolubilisasi batubara dilakukan
dengan menggunakan spektroskopi sinar ultraviolet-visible (UV-Vis) dengan
merk Spectronic Genesys 2 (Gambar 10). Spektroskopi UV-Vis dapat
menentukan apakah ada ikatan tak jenuh dalam produk biosolubilisasi (Shi et al.,
2009). Panjang gelombang yang digunakan yaitu 250 nm (Shi et al., 2009) dan
450 nm (Laborda et al., 1998). Lignit cair yang dianalisis menggunakan
spektrofotometer UV-Vis pada panjang gelombang 250 nm bertujuan untuk
mengetahui adanya gugs fenolik, sedangkan pada panjang gelombang 450 nm
bertujuan untuk mengetahui apakah ada ikatan terkonjugasi atau tidak pada lignit
cair tersebut (Selvi and Banerjee, 2007).
Cara kerja spektrofotometer secara singkat adalah sebagai berikut. Larutan
pembanding ditempatkan, misalnya blangko dalam sel petrtama sedangkan larutan
yang akan dianalisis pada sel kedua. Kemudian dipilih fotosel yang cocok 200
nm-650 nm agar daerah yang diperlukan dapat terliputi. Dengan ruang fotosel
dalam keadaan tertutup ”nol” galvanometer dengan menggunakan tombol
dark-curent. Fotosel dibuka dan dilewatkan berkas cahaya pada blangko dan ”nol”
galvanometer didapat dengan memutar tombol sensitivitas. Dengan menggunakan
tombol transmitansi, kemudian diatur besarnya pada 100%. Berkas cahaya
dilewatkan pada larutan sampel yang akan dianalisis. Skala absorbansi
menunjukkan absorbansi larutan sampel (Khopkar, 2003).
2.8. Kromatografi Gas-Spektroskopi Massa (GCMS)
(Shi et al., 2009; Du et al., 2010 dan beberapa peneliti lainnya) melakukan
penelitian terhadap komponen-komponen yang terkandung dalam produk hasil
23 senyawa-senyawa produk hasil biosolubilisasi batubara. Kromatografi gas (GC)
digunakan untuk memisahkan komponen-komponen kimia dalam produk-produk
hasil biosolubilisasi batubara . Struktur kimia dari masing-masing komponen
kemudian diidentifikasi oleh spektroskopi massa (MS) (Shi et al., 2009). Dalam
kromatografi gas, fase bergeraknya adalah gas dan zat terlarut terpisah sebagai
uap. Pemisahan tercapai dengan partisi sampel antara fase gas bergerak dan fase
diam berupa cairan dengan titik didih tinggi (tidak mudah menguap) yang terikat
pada zat padat penunjangnya Sedangkan spektroskopi massa adalah suatu
instrumen yang dapat menyeleksi molekul-molekul gas bermuatan berdasarkan
[image:39.612.132.526.298.504.2]massa atau beratnya (Khopkar, 2003).
Gambar 11. GCMS (Dokumen Pribadi, 2010)
Massa dari molekul-molekul gas bermuatan tersebut dapat diukur
berdasarkan hasil deteksi berupa spektrum massa. Pada GC hanya terjadi
pemisahan untuk mendapatkan komponen yang diinginkan, sedangkan bila
dilengkapi dengan MS (berfungsi sebagai detektor) akan dapat mengidentifikasi
komponen tersebut, karena bisa membaca spektrum bobot molekul pada suatu
24 Cara kerja GCMS secara singkat adalah sebagai berikut. Sampel
diinjeksikan melalui suatu sampel injection port yang temperaturnya dapat diatur,
senyawa-senyawa dalam sampel akan menguap dan akan dibawa oleh gas
pengemban menuju kolom. Zat terlarut akan teradsorpsi pada bagian atas kolom
oleh fase diam, kemudian akan merambat dengan laju rambatan masing-masing
komponen. Komponen-komponen tersebut terelusi menuju ruang spektroskopi
massa yang berfungsi sebagai detektor (Khopkar, 2003). Kemudian
25 BAB III
METODOLOGI PENELITIAN
3.1. Tempat dan Waktu Penelitian.
Penelitian ini dilakukan selama 3 bulan, pada bulan April-Juni 2010 dan
bertempat di Badan Tenaga Nuklir Nasional, Pasar Jumat, Jakarta dan di Pusat
Laboratorium Terpadu UIN Syarif Hidayatullah Jakarta.
3.2. Alat dan Bahan 3.2.1. Alat
Alat yang digunakan dalam penelitian ini adalah cawan petri, erlenmeyer,
tabung reaksi, rak tabung reaksi, beaker glass, yellow tube, tabung Eppendorf,
short plate, spacer plate, spatula, ose, inkubator, timbangan analitik, mikropipet,
refrigerator, sentrifus, vortex, pH meter, laminar air flow, spektrofotometer
Uv-vis bermerk Ionic Genesys 2, GCMS bermerk Shimadzu dengan tipe QP2010S,
mini tank horizontal elektroforesis system, sisir pembentuk sumuran (comb),
aluminium foil, plastik tahan panas dan bunsen.
3.2.2. Bahan
Bahan yang digunakan dalam penelitian ini adalah tujuh isolat kapang
dari pertambangan batubara Sumatera Selatan, tisu, kapas, alkohol 75 %, minyak
spiritus, batubara, akuades, NaCl 0,85%, medium Potato Dextrose Agar (PDA),
medium Minimal Salt Solution+ (MSS+), larutan Lowry I dan II (Lampiran 3),
26 3.3.Prosedur Kerja
3.3.1. Persiapan dan Sterilisasi Alat
Alat-alat yang digunakan dibersihkan, lalu disterilkan dengan
menggunakan autoklaf pada suhu 121oC dan tekanan 2 atm selama 15 menit.
Peralatan yang tidak tahan panas dapat disterilkan dengan menggunakan alkohol
70%.
3.3.2. Persiapan Serbuk Batubara
Batubara dihaluskan menggunakan mortar secara aseptik di dalam
Laminar Air Flow Cabinet (LAFC), kemudian disaring menggunakan saringan
berukuran 0,2 mm (200 mesh). Serbuk batubara yang telah siap disimpan di dalam
cawan petri steril untuk digunakan sebagai sumber isolasi kapang indigenous
batubara lignit Sumatera Selatan dan campuran untuk pembuatan medium isolasi
dan seleksi kapang hasil isolasi tersebut (Silva et al., 2007).
3.3.3. Pembuatan Medium Potato Dextrose Agar (PDA)
Sebanyak 7,8 g PDA bubuk dilarutkan dalam aquades 200 ml pada
erlenmeyer. Kemudian dipanaskan dengan menggunakan hot plate dan magnetic
stirer hingga larut. Medium PDA tersebut dimasukkan kedalam autoklaf 2 atm
dengan suhu 121oC selama 15 menit setelah itu didinginkan dan dituang pada
cawan petri.
3.3.4. Pembuatan Medium Minimal Salt Solution+ (MSS+)
Pembuatan medium MSS+ dibuat dengan menyiapkan medium MSS
sebanyak 250 ml kemudian ditambahkan sukrosa 2,5 g lalu dihomogenkan.
Medium MSS+ dalam erlenmeyer dan tabung reaksi disterilisasi menggunakan
27 Minimal Salt (MMS) dibuat dengan cara menimbang sebanyak 0,52 g
MgSO4.7H2O ; 0,003 Zn SO4.7H2O pH 5,5; 5 g K2HPO4; 0,005 g FeSO4 dan 1 g
NH4SO4, lalu ditambahkan 1 liter aquades kemudian dilarutkan sampai homogen
(Silva et al, 2007).
3.3.5.Uji Kualitatif Enzim Ekstraselular 3.3.5.1. Fenol Oksidase
Reaksi-warna Bavendamm secara luas digunakan untuk mengidentifikasi
kapang. Kapang dikultur pada cawan petri yang mengandung tanin, terlihat difusi
cokelat pada permukaan media kultur. Adanya difusi berwarna cokelat
mengindikasikan adanya fenol oksidase. Tanin (4 mM / L) ditambahkan pada
medium PDA dan pada diameter pertumbuhan miselium dan lingkaran cokelat
tercatat setiap hari (Tao et al., 2009).
3.3.5.2. Lignin Peroksidase
Metode memudar digunakan untuk mengidentifikasi adanya peroksidase.
Metilen biru (0,1 g / L) ditambahkan ke dalam medium kultur PDA yang
ditumbuhi dengan kapang. Warna yang memudar dari medium menunjukkan
keberadaan enzim lignin peroksidase (Tao et al., 2009).
3.3.5.3. Mangan peroksidase (MnP)
MnCl2 · 4H2O (0,1g / L) telah ditambahkan ke dalam medium kultur PDA
dan kapang kemudian diinokulasi selama dua minggu. Selama waktu kultur
dilihat perkembangan bintik hitam cokelat. MnP mengkatalisis oksidasi MnCl2
menjadi MnO2 sehingga menghasilkan spot berwarna coklat hitam (Tao et al.,
28 3.3.6. Kultur Inokulum Spora
Isolat kapang diremajakan menggunakan medium PDA pada cawan petri
dan diinkubasi pada suhu ruang sampai menghasilkan spora. Sebanyak ± 10 ml
NaCl 0,85% dimasukkan kedalam cawan petri inokulum spora kemudian miselia
kapang dipecahkan menggunakan ose steril lalu dimasukkan ke dalam yellow tube
kemudian divortex sampai kapang larut dalam NaCl.
3.3.7. Biosolubilisasi Batubara
Kultur inokulum spora sebanyak 1 ml dimasukkan ke dalam tabung
erlenmeyer yang berisi 200 ml medium MSS+ dengan jumlah spora yang
diinginkan 108 sel/ml, lalu dihomogenkan. Kemudian dilakukan enam perlakuan,
[image:44.612.128.531.154.507.2]dimana perlakuan I, II, III digunakan sebagai kontrrol (tanpa batubara).
Tabel 2. Jenis Perlakuan yang digunakan
Perlakuan MSS+ (ml) Kultur Inokulum
Spora (1 ml)
Batubara (%)
I 200 ml B1 -
II 200 ml B2 -
III 200 ml B3 -
IV 200 ml B1 5%
V 200 ml B2 5%
VI 200 ml B3 5%
Tahap selanjutnya, yaitu diinkubasi dengan menggunakan shaking
incubator dengan kecepatan 120 rpm pada suhu ruang selama 28 hari.
Pencuplikan sampel kultur dilakukan pada hari ke 0, 7, 14, 21, dan 28 untuk
dilakukan pengamatan kolonisasi, pH medium, dan solubilisasi terhdap batubara.
3.3.8. Pengukuran Kadar Protein Ekstraselular
Sebanyak 0,5 ml sampel ditambahkan 2,5 ml larutan Lowry I dan
29 larutan Lowry II, divortek dan diinkubasi pada suhu ruang selam 30 menit.
Setelah itu absorbansi dibaca dengan Spektrofotometer UV/Vis pada panjang
gelombang 750 nm dan dibandingkan dengan standar Bouvine Serum Albumin
(BSA).
3.3.9. Analisis Profil Protein dengan Elektroforesis SDS-PAGE
Pada penelitian ini menggunakan metode elektroforesis 1 dimensi
SDS-PAGE dengan sistem buffer Laemmli. Konsentrasi gel poliakrilamida yang
digunakan adalah 10%.
a. Preparasi sampel
Kultur inokulum spora pada hari ke-21 untuk kapang B1 dan hari ke-7 untuk
kapang B2 dan B3 diambil sebanyak 75 µl dengan mikropipet ke dalam
tabung effendorf, lalu ditambahkan buffer sampel sebanyak 25 µl dan divortek
hingga homogen, kemudian dipanaskankan selama + 5 menit, setelah itu
disentrifugasi selama 5 menit.
b. Preparasi gel elektroforesis
- Separating gel (10%)
30% Acrylamide solution 6 ml ditambahkan separating gel buffer (1,5 M
Tris-HCl, pH 6,8) sebanyak 4,5 ml, kemudian aquabides 7,5 ml, SDS 50 µl dan 10% Ammonium persulfate 0,08 ml serta TEMED 0,01 ml.
- Stacking gel (45%)
30% Acrylamide solution 0,9 ml ditambahkan stacking gel buffer (0,5 M
30 c. Pembuatan kolom gel
Setelah separating gel dibuat kemudian dimasukkan sedikit demi sedikit ke
dalam alat elektroforesis dengan mikropipet, lalu ditambahkan aquabides
untuk meratakan separating gel tersebut. Setelah separating gel membeku
dimasukkan stacking gel sedikit demi sedikit, lalu pasang sisir pembentuk
kolom biarkan hingga stacking gel membeku lalu diangkat sisirnya. Kemudian
dipasang hasil gel tersebut pada perangkat elektroforesis.
d. Loading sampel
Larutan buffer dimasukkan ke dalam tangki elektroforesis. Kemudian sampel sebanyak 15 µl dimasukkan ke dalam kolom gel dengan hati-hati lalu
dielektroforesis selama + 100 menit pada 200 Volt, 40 mA.
e. Pewarnaan gel
Gel diangkat lalu diwarnai dengan coomassie brilliant blue staining gel warna
biru Coomassie R-250, selama + 1 jam.
f. Pencucian gel
Gel dicuci dengan larutan destain solution coomassie R-250, selama + 1 hari.
Selanjutnya hasil pencucian discan dan dianalisis menggunakan LabImage 1D.
3.3.10. Analisis Hidrolisis FDA
Dimasukkan 1 ml supernatan ke dalam tabung reaksi, kemudian
ditambahkan 4 ml KH2PO4 buffer (pH 7,8) 60 nM. Reaksi dimulai dengan menambahkan 40 µg FDA kemudian divorteks dan diinkubasi selama 20 menit.
Setelah penginkubasian segera ditambahkan aseton sebanyak 5 ml untuk
menghentikan reaksi lalu ditutup dengan aluminium foil. Suspensi disaring
31 ditutup dengan parafilm dan disimpan dalam es batu untuk menguapkan aseton.
Nilai absorbansi ditera dengan menggunakan spektrofotometer pada panjang
gelombang 490 nm (Breeuwer, 1996).
3.3.11.Pengukuran Absorbansi Produk Biosolubilisasi Batubara
Supernatan dari biosolubilisasi batubara disentrifugasi 5400 rpm selama
30 menit kemudian diukur nilai absorbansinya dengan menggunakan
SpektrofotometerUV-Vis Ionic Genesys 2 pada panjang gelombang 250 nm dan
450 nm untuk mengetahui tingkat solubilisasi batubara (Silva, 2007). Nilai
absorbansi yang tinggi berbanding lurus dengan tingkat solubilisasi batubara yang
tinggi pula, data tersebut digunakan sebagai dasar untuk menyeleksi isolat kapang.
3.3.12.Analisis Hasil Solubilisasi Batubara oleh Kapang Indigenous dengan Menggunakan GC-MS
Supernatan dari biosolubilisasi batubara dan pelarut dicampurkan dengan
perbandingan 1:1, pelarut yang digunakan adalah benzena : heksana : dietil eter
dengan perbandingan 3:1:1. Campuran tersebut dimasukkan ke dalam corong
Buchner lalu diaduk sampai bercampur kemudian didiamkan beberapa saat
sampai terbentuk fase atas dan bawah, fase atas dipakai untuk mengidentifikasi
jenis senyawa dan menentukan kadar hasil solubilisasi batubara dengan
menggunakan GC-MS (Silva, 2007).
Karakteristik produk biosolubilisasi dilakukan menggunakan alat GCMS
merk Shimadzu dengan tipe QP2010S (Gambar 11), suhu injektor 280 oC, injektor
mode split, waktu pengambilan sampel 1 menit, suhu kolom 40 – 270 oC dengan
pengaturan suhu awal 40 oC ditahan selama 5 menit, dan waktu 10 menit untuk
32 waktu program 88 menit, suhu detektor 280 oC, suhu interval 250 oC, gas
pembawa He, tekanan utama 500-900, Flow control mode pressure, tekanan 10,9
Kpa, total flow 58,8 ml/m, aliran kolom 0,55 ml/m, percepatan linier 26,0 cm/dt,
aliran pembersihan 3.0 ml/m, split ratio 99,8, jenis kolom Rtx-5MS, panjang kolom 30.00 m, ketebalan 0.25 µm, diameter 0,25 mm, dan jenis pengion EI
(Electron Impact) 70 eV (Whetstine et al., 2003).
3.3.13.Analisa Data
Data penelitian ini dianalisis berdasarkan data visual dengan bantuan
33 BAB IV
HASIL DAN PEMBAHASAN
4.1. Hasil Analisa Enzim Ekstraselular Secara Kualitatif
Untuk uji kualitatif terhadap enzim ekstraselular, digunakan tujuh sampel
kapang hasil isolasi dari pertambangan batubara yang digunakan yaitu dengan
kode B1, B2, B3, B4, B5, B6, dan B7. Ketujuh sampel kapang tersebut diuji
dengan menggunakan metilen biru, MnCl2.4H2O, dan tanin yang masing-masing
untuk mengetahui adanya enzim peroksidase, mangan peroksidase, dan fenol
[image:49.612.121.530.152.521.2]oksidase. Hasil dari uji kualitatif enzim ini dapat dilihat pada tabel 3 berikut.
Tabel 3. Hasil uji kualitatif enzim ekstraseluler. No. Kode Sampel Lignin
Peroksidase
Mangan peroksidase Fenol Oksidase
1. B1 ++ ++ ++
2. B2 ++ + +
3. B3 + + +
4. B4 - - +
5. B5 - - +
6. B6 - + -
7. B7 + - -
Keterangan : (++) : positif kuat, (+) : positif lemah, (-) : negatif.
Reaksi warna digunakan untuk menyelidiki enzim yang dikeluarkan oleh
masing-masing kapang. Dari ketujuh sampel tersebut, lima diantaranya
menunjukkan reaksi positif terhadap tanin (Tabel 3). Pada kapang B1 difusi coklat
yang dihasilkan cukup banyak (++) dibandingkan dengan empat kapang lainnya
yang hanya menunjukkan reaksi positif lemah ditandai dengan dihasilkannya
34 B7. Hal ini menunjukkan bahwa kapang B1 menghasilkan enzim ekstraselular
fenol oksidase yang lebih banyak dibandingkan kapang lainnya.
Kapang B1 dan B2 menunjukkan reaksi positif yang kuat, sedangkan pada
kapang B3 dan B7 menunjukkan reaksi positif lemah untuk uji kualitatif enzim
lignin peroksidase (Tabel 3). Ini berarti pada kapang B1 dan B2 mengekskresikan
enzim lignin peroksidase yang cukup banyak, sedangkan kapang B3 dan B7 hanya
sedikit. Untuk kapang B4, B5 dan B6 menunjukkan reaksi yang negatif terhadap
metilen biru.
Kapang B1 menunjukkan reaksi positif yang kuat, sedangkan kapang B2,
B3 dan B6 menunjukkan reaksi positif yang lemah, sementara ketiga kapang
lainnya menunjukkan reaksi yang negatif. Dari ketiga hasil uji kualitatif ini,
menunjukkan bahwa kapang yang menghasilkan enzim peroksidase, fenol
oksidase, dan mangan peroksidase adalah kapang B1, B2, dan B3. Ketiga kapang
ini yang selanjutnya akan digunakan untuk pengukuran parameter selanjutnya
pada penelitian ini.
4.2. Perubahan pH Medium pada Masing-Masing Kapang Selama Proses Solubilisasi
Perubahan pH merupakan hal yang menjadi salah satu faktor pengukuran
dalam proses solubilisasi batubara. Perubahan nilai pH medium memiliki pola
yang hampir sama pada masing-masing kapang (Gambar 12). Nilai pH medium
selama proses solubilisasi berfluktuasi berkisar antara 3-4,5. Perubahan pH terjadi
35 Gambar 12. Grafik perubahan nilai pH medium selama proses solubilisasi
batubara pada: (A) kapang B1, (B) kapang B2, (C) kapang B3.
pH awal pada medium kontrol kapang B1 yaitu 4,55 sedangkan pada
medium kapang yang ditambahkan batubara yaitu 3,845 (Gambar 12 A). Pada hari
ke-7, pH keduanya mengalami penurunan. Penurunan pH pada hari ketujuh ini
terjadi karena kapang masih mengkondisikan diri terhadap medium. Untuk
[image:51.612.149.540.56.540.2]36 peningkatan yang tidak terlalu besar pada hari ke-21 dan ke-28. Untuk
medium+batubara, pH meningkat pada hari ke 14 dan cenderung konstan hingga
hari ke-28.
Nilai perubahan pH pada isolat kapang B2 ditunjukkan pada Gambar 12 B.
pH awal pada medium kontrol dan medium+batubara, yaitu 4,545 dan 3,795.
Untuk medium kontrol, pH mengalami penurunan pada hari ke-7 dan meningkat
lagi pada hari ke-14 dan cenderung konstan hingga hari ke-28. Untuk
medium+batubara, pH juga mengalami penurunan yang cukup jauh pada hari ke-7
dan cenderung konstan hingga hari ke-28.
Nilai perubahan pH pada isolat kapang B3 terlihat pada Gambar 12 C. pH
awal pada medium kontrol, yaitu 4, 545 dan pada medium+batubara, yaitu 3,805.
pH keduanya mengalami penurunan pada hari ke-7 dan meningkat kembali pada
hari ke-14 dan cenderung konstan. Setelah hari ke-7 hingga hari ke-28, terlihat
pada gambar bahwa pH kontrol lebih rendah dibandingkan pH sampel.
Dari ketiga gambar tersebut, terlihat bahwa pH awal medium kontrol lebih
besar daripada pH awal medium+batubara. Hal ini terjadi karena pada batubara
terdapat senyawa-senyawa organik yang terlarut ke dalam medium, sehingga pH
nya menjadi lebih asam. pH yang dihasilkan pada proses biosolubilisasi yang
dilakukan oleh ketiga jenis kapang tersebut cenderung bersifat asam.
Penurunan pH terjadi kemungkinan karena terbentuknya asam-asam
organik seperti asam humat, asam fulvat, dan asam karboksilat (Cerniglia,1992).
Selain itu, pada proses solubilisasi batubara juga terbentuk produk berupa fenol,
aldehid dan keton (Shi et al., 2009). Fenol merupakan senyawa yang mengandung
37 terbentuk dari oksidasi alkohol primer, dan mempunyai kecenderungan untuk
dioksidasi lebih lanjut menjadi asam karboksilat. Keton terbentuk dari oksidasi
alkohol sekunder sehingga keton juga memiliki sifat asam Meningkatnya
konsentrasi asam organik ini diduga terjadi karena batubara tersebut telah
didegradasi oleh enzim lignin peroksidase, fenol oksidase, dan mangan
peroksidase yang telah diuji pada uji kualitatif enzim pada tahap awal penelitian
ini (Tabel 3).
Selain terjadi penurunan pH, juga terjadi peningkatan pH selama proses
biosolubilisasi. Peningkatan pH terjadi karena dihasilkannya senyawa ammonia
dari hasil degradasi piridin pada batubara (gambar 13). Ammonia dihasilkan
karena terbukanya cincin piridin menjadi pentanol dan ammonia (Du et al., 2010).
Menurut Fakoussa dan Hofrichter (1998), senyawa alkali seperti ammonia dan
amina berperan dalam proses biosolubilisasi karena senyawa alkali tersebut dapat
meningkatkan hidrofilisitas sehingga batubara dapat bercampur dengan air dan
[image:53.612.218.452.471.525.2]medium.
Gambar 13. Reaksi dearomatisasi piridin (Du et al., 2010).
Selain itu juga dihasilkan senyawa kimia alkali seperti amina dari kapang
(Shi et al., 2009). Senyawa amina ini dihasilkan karena terjadi peningkatan
jumlah sel kapang yang lisis. Sel yang lisis tersebut akan menyebabkan suasana
38 4.3. Tingkat Biosolubilisasi Batubara Berdasarkan Nilai Absorbansi
Dalam proses pencairan (solubilisasi) batubara, tingkat solubilisasi diamati
melalui absorbansi pada panjang gelombang 250 nm dan 450 nm. Pengukuran
absorbansi pada panjang gelombang 250 nm dan 450 nm ini bertujuan untuk
mengetahui produk hasil solubilisasi batubara oleh kapang (Selvi and Banerjee,
2007). Gambar 14 mempresentasikan performa masing-masing kapang dalam
melakukan solubilisasi batubara melalui pendeteksian secara spektroskopik.
Nilai absorbansi dari supernatan hasil fermentasi kapang pada panjang
gelombang 250 nm bernilai antara 0 sampai 0,981 (Gambar 14). Pengukuran
absorbansi pada panjang gelombang 250 nm ini bertujuan untuk mendeteksi
adanya gugus fenolik (Selvi and Banerjee, 2007). Gugus fenolik merupakan
[image:54.612.132.527.284.548.2]gugus yang terdapat pada proses degradasi lignin.
Gambar 14. Absorbansi pada panjang gelombang 250 nm pada masing-masing kapang.
Nilai absorbansi tertinggi pada λ 250 nm dimiliki oleh kapang B1 pada
hari ke-28 yaitu 0,981. Pada hari ke-7 nilai absorbansi semua kapang meningkat,
untuk kapang B1 nilai absorbansinya terus meningkat hingga hari ke-28.
Peningkatan nilai absorbansi ini terjadi karena adanya proses biosolubilisasi
39 senyawa fenol hasil solubilisasi senyawa lignin. Senyawa ini merupakan
komponen terbesar penyusun batubara, dengan bantuan enzim lignin peroksidase
yang mampu mengoksidasi unit non fenolik lignin dengan memotong ikatan Cα -Cβ molekul lignin. Pemotongan tersebut merupakan jalur utama perombakan
lignin oleh berbagai kapang pelapuk putih (Hammel, 1996) (Gambar 15).
Gambar 15. Reaksi degradasi lignin oleh enzim lignin peroksidase
(Hammel, 1996).
Untuk kapang B2 dan B3 nilai absorbansi menurun pada hari ke-14 hingga
hari terakhir inkubasi. Penurunan absorbansi ini terjadi karena batubara yang
sudah didegradasi dan melarut dalam bentuk senyawa yang lebih sederhana diurai
kembali menjadi senyawa-senyawa yang lebih sederhana (Perez et al.,2002).
Penguraian menjadi senyawa-senyawa yang lebih sederhana ini dilakukan oleh
enzim lakase yang mengoksidasi unit fenolik dan mangan peroksidase (MnP)
[image:55.612.138.534.179.396.2]yang mendegradasi unit fenolik (gambar 16).
40 Nilai absorbansi dari supernatan hasil fermentasi kapang pada panjang
gelombang 450 nm bernilai antara 0 sampai 0,065 (Gambar 17). Pengukuran pada
panjang gelombang 450 nm ini bertujuan untuk mengukur adanya ikatan
terkonjugasi pada senyawa aromatik batubara (Selvi and Benerjee, 2007). Pada
panjang gelombang 450 nm, senyawa yang terdeteksi adalah dengan sinar tampak.
Nilai absorbansi tertinggi pada λ 450 nm dimiliki oleh kapang B1 pada
hari ke-14, yaitu 0,065. Untuk kapang B1, nilai absorbansi sedikit meningkat pada
hari ke-7 lalu meningkat tajam pada hari ke-14, yaitu dari 0,02 menjadi 0,065.
Absorbansi pada kapang ini mengalami penurunan pada hari ke-21, lalu
meningkat lagi pada hari ke-28. Pada kapang B3, nilai absorbansi terus
mengalami sedikit peningkatan hingga hari ke-14 dan selanjutnya berfluktuasi