1
ISOLASI DAN OPTIMASI PRODUKSI SENYAWA ANTIMIKROB
BAKTERI ASAM LAKTAT
NOVAN KURNIAWAN
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2007
2
ABSTRACT
NOVAN KURNIAWAN. Isolation and Optimation of Antimicrobial Compound
Production of Lactic Acid Bacteria. Under the direction of LAKSMI AMBARSARI dan
SURYANI.
Lactic acid bacteria is the bacteria that naturally held in milk. Lactic acid bacteria is
able to produce antimicrobial compound that can be used as food preservatives. Thie
aim of this research is to isolate lactic acid bacteria from milk and yoghurt and to
optimize antimicrobial compound production by doing variation of production time, pH,
and temperature. Production time will be variated from 10, 15, 20, 25, 30, 35 hours, pH
from 2, 3, 4, 5, 6, 7, 8, and temperature from 50, 60, 70, 80, 90, 100 ºC.
Lactic acid bacteria has been isolated and were grown in
de Man Ragosa Sharpe
3
ABSTRAK
NOVAN KURNIAWAN. Isolasi dan Optimasi Produksi Senyawa Antimikrob Bakteri
Asam Laktat. Dibimbing oleh LAKSMI AMBARSARI dan SURYANI.
Bakteri asam laktat adalah bakteri yang secara alamiah terdapat pada susu. Bakteri
asam laktat mampu memproduksi senyawa antimikrob yang dapat digunakan sebagai
alternatif bahan pengawet produk pangan alami yang aman. Penelitian ini bertujuan
untuk mengisolasi bakteri asam laktat yang berasal dari susu dan yoghurt serta
mengoptimalisasikan produksi senyawa antimikrob yang dihasilkan dengan melakukan
variasi terhadap waktu produksi, pH, dan suhu. Waktu produksi di variasikan pada 10,
15, 20, 25, 30, 35 jam, pH pada 2, 3, 4, 5, 6, 7, 8, dan suhu pada 50, 60, 70, 80, 90, 100
°C.
Bakteri asam laktat telah berhasil diisolasi dan ditumbuhkan dalam media
de Man
Rogosa Sharpe
Agar (MRS). Hasil percobaan diperoleh 3 bentuk isolat, yaitu satu jenis
isolat berasal dari yoghurt (YI) dan dua jenis isolat berasal dari susu (SI dan SII). Hasil
penentuan aktivitas antimikrob terhadap bakteri
Salmonella thypimurium
dengan
metode sumur agar pada media
treptose proteose peptone yeast
(TPPY) diperoleh:
isolat YI memiliki aktivitas tertinggi dengan zona hambat sebesar 23 mm, isolat SII
sebesar 20 mm, sedangkan isolat SI tidak menunjukkan adanya aktivitas antimikrob.
Hasil penentuan optimasi produksi terhadap isolat YI diperoleh waktu produksi 15 jam,
pH 3, dan suhu 80 °C. Isolat YI mempunyai aktivitas antimikrob terhadap bakteri Gram
positif (
Bacillus subtilis
) dan Gram negatif (
Eschericia coli
) dengan zona hambat
masing-masing adalah 33 mm dan 29 mm.
4
ISOLASI DAN OPTIMASI PRODUKSI SENYAWA ANTIMIKROB
BAKTERI ASAM LAKTAT
NOVAN KURNIAWAN
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Program Studi Biokimia
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
5
Judul Skripsi : Isolasi dan Optimasi Produksi Senyawa Antimikrob Bakteri
Asam Laktat
Nama : Novan Kurniawan
NIM : G44102016
Disetujui
Komisi Pembimbing
Diketahui
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Prof. Dr. Ir. Yonny Koesmaryono, M.S
NIP 131473999
Tanggal Lulus :
Dr. Laksmi Ambarsari, M.S.
Ketua
Dr. Suryani, M.Sc.
Anggota
6
RIWAYAT HIDUP
Penulis dilahirkan di kota Palembang, Sumatra Selatan, pada tanggal 24 November
1984 sebagai anak pertama dari tiga bersaudara pasangan Rustam dan Hidayati. Penulis
menjalani pendidikan formal di TK Muhamadiah Lubuk Linggau Sumatera Selatan
(SUM-SEL), SD Xaverius Lubuk Linggau (SUMSEL), SD St. Yosep Lahat SUMSEL,
SMP Xaverius I Palembang SUMSEL, SMP St. Yosep Lahat SUMSEL, SMU Negeri I
Kolaka Sulawesi Tenggara (SULTRA), SMU Dwiwarna Bogor Jawa Barat (JABAR)
dan lulus pada tahun 2002. Pada tahun yang sama penulis lulus seleksi masuk IPB
melalui jalur undangan seleksi masuk IPB di Program Studi Biokimia, Jurusan Kimia,
yang saat ini sudah menjadi Departemen Biokimia.
Selama mengikuti perkuliahan penulis pernah aktif di BEM TPB IPB Departemen
Olahraga dan Seni periode 2002/2003, wakil ketua turnamen Futsal IPB, ketua
Dormitory Farewell Party
, Anggota Aktif
International Asosiation Agricultural Student
(IAAS), kepala Departemen Pengembangan Bahasa Inggris Himpunan Mahasiswa
Kimia IPB, ketua UKM (unit kegiatan mahasiswa) tenis lapangan, asisten mata kuliah
olahraga dan seni, dan wakil komandan tingkat Biokimia angkatan 39.
7
PRAKATA
Syukur alhamdullilah penulis panjatkan kepada Allah SWT, karena atas rahmat serta
hidayah-Nya akhirnya penulis dapat menyelesaikan penelitian dan penulisan karya
ilmiah dengan judul Isolasi dan Optimasi Produksi Senyawa Antimikrob Bakteri Asam
Laktat. Tak lupa pula penulis menyampaikan sholawat serta salam terhadap Rasulullah
SAW beserta para sahabatnya sampai akhir zaman kelak. Karya ilmiah ini merupakan
salah satu syarat untuk memperoleh gelar Sarjana Sains Program Studi Biokimia pada
Fakultas Matematika dan Ilmu Pengetahuan Alam yang dilakukan penulis sejak bulan
Januari 2007 sampai bulan Mei 2007, di laboratorium Biokimia, Fakultas Matematika
dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Terima kasih penulis ucapkan kepada berbagai pihak yang telah membantu dalam
penyelesaian karya ilmiah ini, terutama kepada kedua dosen pembimbing yaitu Dr.
Laksmi Ambarsari, MS dan Dr. Suryani, M.Sc yang telah memberikan arahan,
bimbingan, dan dorongan semangat selama menyusun karya ilmiah ini. Ucapan terima
kasih juga penulis sampaikan kepada teman-teman seperjuangan Yayu, Sunanti, Solina,
Eka, Dewi, Efi, Tisha, Putu atas kebersamaan dan bantuannya. Juga tak lupa untuk staf
laboratorium Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, dan Ir. AE
Zaenal Hasan, M.Si atas bantuan dan kerjasamanya. Penghargaan juga saya sampaikan
kepada mentor non akademik saya pak Rosadi dan pak Basith atas bimbingan tentang
kesabaran yang hakiki. Ucapan terima kasih juga penulis sampaikan kepada keluargaku
tercinta Ayah, Ibu, adikku Rico dan Aldi, serta Marisa Puspitasari yang telah
memberikan dukungan baik moril maupun materi serta segala doa dan kasih sayangnya.
Penulis menyadari bahwa karya ilmiah ini masih jauh dari sempurna, karena itu
penulis sangat mengharapkan kritik dan saran demi kesempurnaan karya ilmiah ini.
Akhirnya penulis berharap agar karya ilmiah ini dapat bermanfaat bagi semua pihak.
Bogor, Agustus 2007
8
DAFTAR ISI
Halaman
DAFTAR TABEL ... viii
DAFTAR GAMBAR... ix
DAFTAR LAMPIRAN ... x
PENDAHULUAN ... 1
TINJAUAN PUSTAKA
Senyawa Antimikrob ... 2
Yoghurt... 3
BAHAN DAN METODE
Bahan dan Alat ... 4
Metode ... 4
HASIL DAN PEMBAHASAN
Isolat Bakteri Asam Laktat ... 5
Ekstrak Kasar Senyawa Antimikrob... 5
Waktu Optimum Produksi Antimikrob ... 6
pH dan Suhu Optimum Aktivitas Antimikrob... 7
SIMPULAN DAN SARAN
Simpulan ... 9
Saran ... 9
DAFTAR PUSTAKA... 9
9
DAFTAR TABEL
Halaman
1 Pengaruh pH terhadap aktivitas senyawa antimikrob pada bakteri
S. thypimurium
... 7
2 Pengaruh suhu terhadap aktivitas senyawa antimikrob pada bakteri
S. thypimurium
... 8
3 Zona hambat senyawa antimikrob pada
E. coli
dan
B. subtilis
... 8
DAFTAR GAMBAR
Halaman
1 Isolat-isolat bakteri yang diisolasi dari susu dan ditumbuhkan di dalam
media MRS pada 42 °C selama 18 jam ... 6
2 Isolat-isolat bakteri yang diisolasi dari yoghurt dan ditumbuhkan
di dalam media MRS pada 42 °C selama 18 jam... 6
3 Perbandingan aktivitas antimikrob dari isolat yang diperoleh yang
ditumbuhkan didalam media NA pada 37 °C selama 18 jam... 6
4 Grafik hasil uji penentuan waktu optimum produksi senyawa
antimikrob pada selang waktu 10, 15, 20, 25, 30, dan 35 jam ... 7
5 Kurva pertumbuhan bakteri terhadap waktu... 7
6 Hasil uji senyawa antimikrob yang telah mengalami optimasi terhadap
bakteri
E.coli
yang ditumbuhkan di dalam media NA dengan waktu
inkubasi 18 jam pada suhu 37 °C ... 8
7 Hasil uji senyawa antimikrob yang telah mengalami optimasi terhadap
bakteri
B.subtilis
yang ditumbuhkan di dalam media NA dengan waktu
inkubasi 18 jam ada suhu 37 °C... 8
10
DAFTAR LAMPIRAN
Halaman
1 Alur strategi penelitian ... 12
2 Isolasi dan pengujian waktu optimum produksi senyawa antimikrob .. 13
3 Penentuan pH optimum untuk produksi senyawa antimikrob... 14
4 Penentuan suhu optimum untuk produksi senyawa antimikrob ... 15
1
ISOLASI DAN OPTIMASI PRODUKSI SENYAWA ANTIMIKROB
BAKTERI ASAM LAKTAT
NOVAN KURNIAWAN
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2007
2
ABSTRACT
NOVAN KURNIAWAN. Isolation and Optimation of Antimicrobial Compound
Production of Lactic Acid Bacteria. Under the direction of LAKSMI AMBARSARI dan
SURYANI.
Lactic acid bacteria is the bacteria that naturally held in milk. Lactic acid bacteria is
able to produce antimicrobial compound that can be used as food preservatives. Thie
aim of this research is to isolate lactic acid bacteria from milk and yoghurt and to
optimize antimicrobial compound production by doing variation of production time, pH,
and temperature. Production time will be variated from 10, 15, 20, 25, 30, 35 hours, pH
from 2, 3, 4, 5, 6, 7, 8, and temperature from 50, 60, 70, 80, 90, 100 ºC.
Lactic acid bacteria has been isolated and were grown in
de Man Ragosa Sharpe
3
ABSTRAK
NOVAN KURNIAWAN. Isolasi dan Optimasi Produksi Senyawa Antimikrob Bakteri
Asam Laktat. Dibimbing oleh LAKSMI AMBARSARI dan SURYANI.
Bakteri asam laktat adalah bakteri yang secara alamiah terdapat pada susu. Bakteri
asam laktat mampu memproduksi senyawa antimikrob yang dapat digunakan sebagai
alternatif bahan pengawet produk pangan alami yang aman. Penelitian ini bertujuan
untuk mengisolasi bakteri asam laktat yang berasal dari susu dan yoghurt serta
mengoptimalisasikan produksi senyawa antimikrob yang dihasilkan dengan melakukan
variasi terhadap waktu produksi, pH, dan suhu. Waktu produksi di variasikan pada 10,
15, 20, 25, 30, 35 jam, pH pada 2, 3, 4, 5, 6, 7, 8, dan suhu pada 50, 60, 70, 80, 90, 100
°C.
Bakteri asam laktat telah berhasil diisolasi dan ditumbuhkan dalam media
de Man
Rogosa Sharpe
Agar (MRS). Hasil percobaan diperoleh 3 bentuk isolat, yaitu satu jenis
isolat berasal dari yoghurt (YI) dan dua jenis isolat berasal dari susu (SI dan SII). Hasil
penentuan aktivitas antimikrob terhadap bakteri
Salmonella thypimurium
dengan
metode sumur agar pada media
treptose proteose peptone yeast
(TPPY) diperoleh:
isolat YI memiliki aktivitas tertinggi dengan zona hambat sebesar 23 mm, isolat SII
sebesar 20 mm, sedangkan isolat SI tidak menunjukkan adanya aktivitas antimikrob.
Hasil penentuan optimasi produksi terhadap isolat YI diperoleh waktu produksi 15 jam,
pH 3, dan suhu 80 °C. Isolat YI mempunyai aktivitas antimikrob terhadap bakteri Gram
positif (
Bacillus subtilis
) dan Gram negatif (
Eschericia coli
) dengan zona hambat
masing-masing adalah 33 mm dan 29 mm.
4
ISOLASI DAN OPTIMASI PRODUKSI SENYAWA ANTIMIKROB
BAKTERI ASAM LAKTAT
NOVAN KURNIAWAN
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Program Studi Biokimia
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
5
Judul Skripsi : Isolasi dan Optimasi Produksi Senyawa Antimikrob Bakteri
Asam Laktat
Nama : Novan Kurniawan
NIM : G44102016
Disetujui
Komisi Pembimbing
Diketahui
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Prof. Dr. Ir. Yonny Koesmaryono, M.S
NIP 131473999
Tanggal Lulus :
Dr. Laksmi Ambarsari, M.S.
Ketua
Dr. Suryani, M.Sc.
Anggota
6
RIWAYAT HIDUP
Penulis dilahirkan di kota Palembang, Sumatra Selatan, pada tanggal 24 November
1984 sebagai anak pertama dari tiga bersaudara pasangan Rustam dan Hidayati. Penulis
menjalani pendidikan formal di TK Muhamadiah Lubuk Linggau Sumatera Selatan
(SUM-SEL), SD Xaverius Lubuk Linggau (SUMSEL), SD St. Yosep Lahat SUMSEL,
SMP Xaverius I Palembang SUMSEL, SMP St. Yosep Lahat SUMSEL, SMU Negeri I
Kolaka Sulawesi Tenggara (SULTRA), SMU Dwiwarna Bogor Jawa Barat (JABAR)
dan lulus pada tahun 2002. Pada tahun yang sama penulis lulus seleksi masuk IPB
melalui jalur undangan seleksi masuk IPB di Program Studi Biokimia, Jurusan Kimia,
yang saat ini sudah menjadi Departemen Biokimia.
Selama mengikuti perkuliahan penulis pernah aktif di BEM TPB IPB Departemen
Olahraga dan Seni periode 2002/2003, wakil ketua turnamen Futsal IPB, ketua
Dormitory Farewell Party
, Anggota Aktif
International Asosiation Agricultural Student
(IAAS), kepala Departemen Pengembangan Bahasa Inggris Himpunan Mahasiswa
Kimia IPB, ketua UKM (unit kegiatan mahasiswa) tenis lapangan, asisten mata kuliah
olahraga dan seni, dan wakil komandan tingkat Biokimia angkatan 39.
7
PRAKATA
Syukur alhamdullilah penulis panjatkan kepada Allah SWT, karena atas rahmat serta
hidayah-Nya akhirnya penulis dapat menyelesaikan penelitian dan penulisan karya
ilmiah dengan judul Isolasi dan Optimasi Produksi Senyawa Antimikrob Bakteri Asam
Laktat. Tak lupa pula penulis menyampaikan sholawat serta salam terhadap Rasulullah
SAW beserta para sahabatnya sampai akhir zaman kelak. Karya ilmiah ini merupakan
salah satu syarat untuk memperoleh gelar Sarjana Sains Program Studi Biokimia pada
Fakultas Matematika dan Ilmu Pengetahuan Alam yang dilakukan penulis sejak bulan
Januari 2007 sampai bulan Mei 2007, di laboratorium Biokimia, Fakultas Matematika
dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Terima kasih penulis ucapkan kepada berbagai pihak yang telah membantu dalam
penyelesaian karya ilmiah ini, terutama kepada kedua dosen pembimbing yaitu Dr.
Laksmi Ambarsari, MS dan Dr. Suryani, M.Sc yang telah memberikan arahan,
bimbingan, dan dorongan semangat selama menyusun karya ilmiah ini. Ucapan terima
kasih juga penulis sampaikan kepada teman-teman seperjuangan Yayu, Sunanti, Solina,
Eka, Dewi, Efi, Tisha, Putu atas kebersamaan dan bantuannya. Juga tak lupa untuk staf
laboratorium Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, dan Ir. AE
Zaenal Hasan, M.Si atas bantuan dan kerjasamanya. Penghargaan juga saya sampaikan
kepada mentor non akademik saya pak Rosadi dan pak Basith atas bimbingan tentang
kesabaran yang hakiki. Ucapan terima kasih juga penulis sampaikan kepada keluargaku
tercinta Ayah, Ibu, adikku Rico dan Aldi, serta Marisa Puspitasari yang telah
memberikan dukungan baik moril maupun materi serta segala doa dan kasih sayangnya.
Penulis menyadari bahwa karya ilmiah ini masih jauh dari sempurna, karena itu
penulis sangat mengharapkan kritik dan saran demi kesempurnaan karya ilmiah ini.
Akhirnya penulis berharap agar karya ilmiah ini dapat bermanfaat bagi semua pihak.
Bogor, Agustus 2007
8
DAFTAR ISI
Halaman
DAFTAR TABEL ... viii
DAFTAR GAMBAR... ix
DAFTAR LAMPIRAN ... x
PENDAHULUAN ... 1
TINJAUAN PUSTAKA
Senyawa Antimikrob ... 2
Yoghurt... 3
BAHAN DAN METODE
Bahan dan Alat ... 4
Metode ... 4
HASIL DAN PEMBAHASAN
Isolat Bakteri Asam Laktat ... 5
Ekstrak Kasar Senyawa Antimikrob... 5
Waktu Optimum Produksi Antimikrob ... 6
pH dan Suhu Optimum Aktivitas Antimikrob... 7
SIMPULAN DAN SARAN
Simpulan ... 9
Saran ... 9
DAFTAR PUSTAKA... 9
9
DAFTAR TABEL
Halaman
1 Pengaruh pH terhadap aktivitas senyawa antimikrob pada bakteri
S. thypimurium
... 7
2 Pengaruh suhu terhadap aktivitas senyawa antimikrob pada bakteri
S. thypimurium
... 8
3 Zona hambat senyawa antimikrob pada
E. coli
dan
B. subtilis
... 8
DAFTAR GAMBAR
Halaman
1 Isolat-isolat bakteri yang diisolasi dari susu dan ditumbuhkan di dalam
media MRS pada 42 °C selama 18 jam ... 6
2 Isolat-isolat bakteri yang diisolasi dari yoghurt dan ditumbuhkan
di dalam media MRS pada 42 °C selama 18 jam... 6
3 Perbandingan aktivitas antimikrob dari isolat yang diperoleh yang
ditumbuhkan didalam media NA pada 37 °C selama 18 jam... 6
4 Grafik hasil uji penentuan waktu optimum produksi senyawa
antimikrob pada selang waktu 10, 15, 20, 25, 30, dan 35 jam ... 7
5 Kurva pertumbuhan bakteri terhadap waktu... 7
6 Hasil uji senyawa antimikrob yang telah mengalami optimasi terhadap
bakteri
E.coli
yang ditumbuhkan di dalam media NA dengan waktu
inkubasi 18 jam pada suhu 37 °C ... 8
7 Hasil uji senyawa antimikrob yang telah mengalami optimasi terhadap
bakteri
B.subtilis
yang ditumbuhkan di dalam media NA dengan waktu
inkubasi 18 jam ada suhu 37 °C... 8
10
DAFTAR LAMPIRAN
Halaman
1 Alur strategi penelitian ... 12
2 Isolasi dan pengujian waktu optimum produksi senyawa antimikrob .. 13
3 Penentuan pH optimum untuk produksi senyawa antimikrob... 14
4 Penentuan suhu optimum untuk produksi senyawa antimikrob ... 15
PENDAHULUAN
Kerusakan makanan sering kali terjadi pada produk-produk olahan hasil industri. Kerusakan ini biasanya ditimbulkan oleh mikroorganisme pembusuk dan bakteri pembentuk spora. Untuk mengatasi hal tersebut maka diperlukan suatu bahan tambahan makanan yang berfungsi untuk menghindari kerusakan akibat mikroorganisme sehingga tidak menimbulkan bahaya bagi kesehatan konsumen. Salah satu upaya untuk mencegah kerusakan oleh mikroorganisme adalah dengan penambahan zat pengawet. Zat pengawet dapat dibedakan dalam tiga golongan utama berdasarkan banyaknya dosisi yang dapat diterima per harinya. Pertama, zat pengawet yang termasuk dalam golongan GRAS (Generally Recognized as Safe) yang umumnya bersifat alami, sehingga aman dikonsumsi oleh masyarakat dengan dosisi yang tinggi (tidak menimbulkan efek samping). Kedua, zat pengawet yang termasuk dalam golongan ADI (Acceptable Daily Intake), yang selalu ditetapkan batas penggunaan hariannya
(daily intake) untuk melindungi kesehatan
konsumen. Ketiga, zat pengawet yang memang tidak layak dikonsumsi, seperti formalin karena dapat menyebabkan kanker paru-paru, gangguan pada alat pencernaan dan jantung (Broughton 1990).
Ada beberapa contoh pengawet yang berbahaya jika dikonsumsi secara berlebihan, yaitu kalsium benzoat. Bahan pengawet ini dapat menghambat pertumbuhan bakteri penghasil toksin (racun), bakteri spora dan bakteri bukan pembusuk. Asam benzoat digunakan untuk mengawetkan minuman ringan, minuman anggur, saus sari buah, sirup, dan ikan asin. Bahan ini bisa menyebabkan dampak negatif pada penderita asma dan bagi orang yang peka terhadap aspirin. Kalsium benzoat bisa memicu terjadinya serangan asma dan natrium benzoat dapat menyebabkan
sistemic lupus erythematosus (SLE) yang
menyerang sistem kekebalan tubuh. Menurut data yang dikutip dari rumah sakit Hasan Sadikin Bandung selama tahun 2006 ini sudah 350 orang yang terkena penyakit (anonymus 2006).
Kasus-kasus yang terjadi pada masyarakat mengindikasikan bahwa menggunakan zat pengawet alami adalah solusi yang tepat. Pengawet alami yang berasal dari mikroorganisme, tumbuhan, dan hewan seharusnya sudah mulai digunakan untuk menggantikan pengawet yang berbahaya. Sebagai contoh adalah zat pengawet yang berasal dari selasih. Selasih memiliki aktivitas
antibakteri terhadap Saphylococcus aureus,
Salmonella enteritidis, Escherichia coli ;
aktivitas antiseptik terhadap Proteus vulgaris,
Bacillus subtilis, Salmonella paratyph; aktivitas
antifungi terhadap Candida albicans,
Penicillium notatum, Microsporeum gyseum;
aktivitas larvasida terhadap lalat rumah dan nyamuk, serta repelan terhadap serangga (Adnyana 2006).
Bahan pengawet yang aman juga dapat berasal dari mikroorganisme, antara lain adalah bakteriosin yang dihasilkan oleh bakteri asam laktat. Hasil penelitian yang telah dilakukan sebelumnya disebutkan bahwa bakteriosin dapat menghambat pertumbuhan bakteri Gram positif dan Gram negatif (Oryazabal 1998). Bakteriosin juga dapat menghambat pertumbuhan bakteri S.
thypimurium, B.subtilis, dan E.coli (Wiryawan
2005).
Salah satu jenis bekteriosin yang telah diproduksi dalam skala industri adalah nisin. Nisin tidak dapat diproduksi secara sintetik melainkan oleh bakteri asam laktat. Nisin juga stabil dalam suhu tinggi dan stabil dalam kondisi asam sehingga dapat digunakan pada proses industri yang menggunakan suhu tinggi dan kondisi asam tanpa merusak kinerjanya. Penyimpanan yang dilakukan pada suhu antara 4-25 °C dapat menstabilkan nisin sampai dua tahun (anonymus 2001). Nilai LD50 nisin sama dengan nilai LD50 garam yaitu 7 g/kg berat badan (Naidu 2000).
Produksi senyawa antimikroba dari bakteri asam laktat belum dilakukan dalam skala industri di Indonesia, sehingga dibutuhkan penelitian pendahuluan untuk mendapatkan parameter yang valid agar diperoleh hasil yang optimal. Mengkombinasikan media produksi dengan waktu, pH, dan suhu, yang telah optimum, diharapkan dapat mengefektifkan produksi senyawa antimikrob agar dapat diperoleh manfaat maksimal sebagai pengganti bahan pengawet sintetik yang sangat merugikan kesehatan masyarakat.
13
TINJAUAN PUSTAKA
Senyawa Antimikrob
Senyawa antimikrob adalah senyawa yang memiliki aktivitas penghambatan terhadap pertumbuhan mikroba, terutama mikroba patogen. Senyawa tersebut umumnya berasal dari tumbuhan maupun mikroorganisme. Salah satu senyawa antimikrob yang terkenal adalah bawang putih yang dapat menghambat pertumbuhan bakteri S. thypimurium dengan konsentrasi 2% (Sunanti 2007).
Produksi dan penggunaan senyawa antimikrob yang berasal dari tanaman telah lama digunakan terutama pada pengobatan tradisional. Contohnya, kemangi dan selasih secara empiris telah digunakan dalam pengobatan tradisional untuk berbagai macam penyakit. Teh yang dibuat dari daun selasih atau herbanya digunakan untuk mengatasi mual, disentri, atau menurunkan panas (sebagai antipiretik). Dalam kitab pengobatan “Ayurveda”, selasih memiliki khasiat sebagai antibakteri, antiseptik, antispasmodik (sakit perut), diaforetik (peluruh keringat), sakit kepala, demam, sakit telinga, obat sakit ginjal dan sebagai afrodisiaka (peningkat libido). Penggunaannya dapat dalam bentuk jus, infus, dan serbuk (Adnyana 2006).
Senyawa antimikrob yang berasal dari mikroorganisme juga telah banyak digunakan antara lain nisin, nisin merupakan bagian dari bakteriosin yang dihasilkan oleh bakteri asam laktat. Nisin telah digunakan di banyak negara sebagai bahan pengawet yang aman, dan nisin memiliki aktivitas antimikroba khususnya pada bakteri Gram positif (Broughton 1990).
Bakteriosin
Bakteriosin adalah senyawa metabolit sekunder yang dihasilkan oleh bakteri asam laktat selama proses fermentasi yang bersifat menghambat petumbuhan mikroorganisme merugikan. Oyarzabal (1998), menyatakan bakteri asam laktat dapat menghasilkan substansi bakteriosin yang bersifat antimikrob terhadap pertumbuhan bakteri Gram positif dan atau Gram negatif. Pendapat ini telah didukung dengan beberapa penelitian diantaranya bakteriosin Plantaricin C yang mampu menghambat Bacillus subtilis, (Gonzalez et al., 1994), bakteriosin Pediocin L50, bersifat
“broad spectrum”, diantaranya menghambat E.
faecalis (Cintas et al. 1995), dan Salmonella
typhimurium (Steven et al. 1991).
Secara in vitro Audisio et al. (1999), melaporkan aksi hambat terhadap bakteri patogenik pada manusia dan unggas yaitu
Salmonella spp. (Galinarum, Pulorum,
Enteridis dan Typhymurium) didapat dengan
cara menggabungkan bakteri asam laktat dengan bakteriosin, sehingga berpeluang untuk dijadikan sebagai avian probiotics yang mahal saat ini. Hambatan pertumbuhan bakteri
Salmonella typhymurium FNCC 0050, E. coli
FNCC 0091 dan Bacillus cereus oleh bakteriosin juga dilaporkan oleh Djaafar et al., (1995). Hambatan pertumbuhan ditunjukkan dengan adanya perpanjangan fase lag maupun penekanan populasi pasca 12 jam inkubasi setelah ditambah metabolit bakteriosin, masing-masing pada S. thypimurium FNCC 0050 dari fase lag 1 jam menjadi 6 jam, E. coli FNCC 0091 dari 1 jam menjadi 3 jam, dan pada B.
cereus dari 3 jam menjadi 7 jam.
Nisin
Nisin, termasuk bakteriosin, merupakan senyawa polipeptida anti bakteri yang diproduksi dari hasil fermentasi bakteri asam laktat (BAL) Lactobacillus bulgaricus (Hoover & Davidson 1993) yang diakui penggunaannya oleh banyak negara sebagai pengawet alami makanan mentah atau makanan olahan yang aman dikonsumsi serta terbukti dapat mengontrol dan menghambat pertumbuhan bakteri pembusuk dan patogen. Nisin juga tidak menimbulkan efek samping pada manusia karena tidak toksik dan tidak aktif oleh enzim proteolitik dalam saluran pencernaan.
Nama nisin diturunkan dari “Grup N
streptococci (sekarang lebih dikenal dengan lactococci) Inhibitory Substances IN (yang merupakan akhiran untuk nama sebuah antibiotik)”. Bahan ini aktif melawan bakteri lain, terutama spora bakteri Gram positif (Broughton 1990).
14
sejalan dengan kelarutannya. Dalam HCl pada pH 2,5 atau kurang dan nisin akan tetap stabil sekalipun mengalami pemanasan tinggi (Adam 2000).
Nisin sebgai antimikrob memiliki kemampuan terbatas. Nisin tidak dapat menghambat bakteri Gram negatif (kecuali
Neisseria dan Flavobacter), khamir, virus serta
bakteri Gram positif tertentu, seperti beberapa spesies Lactobacillus dan Enterococcus
faecalis. Akan tetapi bakteri Gram negatif dapat
dihambat jika membran sel bakteri mengalami kerusakan (Steven et al.1991). Nisin menghambat bakteri Gram positif, terutama bakteri pembentuk spora seperti klostridia dan basili serta jenis-jenis bakteri lain yaitu stafilokoki, laktokoki, korinebakteria, leukonostok, pediokoki, pneumokoki, aktinomisetes, streptokoki, mikrokoki, laktobasili dan Mycobacteria. Sensitivitas mikrob terhadap nisin berbeda-beda (Broughton
1990). Pertumbuhan Bacillus
stearothermophillus dapat dihambat pada kadar
nisin kurang dari 2 IU/mL, B.cereus perlu 75-100 IU/mL. B. megaterium perlu 25-100 IU/mL
dan B. polymixa perlu 50 IU/mL, sedangkan
Clostridum botulinum tipe A dan B dihambat
pada taraf 500-2500 IU/mL serta untuk tipe B perlu 50-1000 IU/mL (Broughton 1990). Target penghambatan pada sel vegetatif mikrob adalah membran sitoplasma. Nisin menimbulkan kebocoran dengan keluarnya adenosin trifosfat, sehingga terjadi lisis pada membran. Kebocoran membran sitoplasma terjadi karena nisin mengaktifkan gugus sulfidril pada membran tersebut (Abee 1995). Pada spora, nisin lebih bersifat sporosidal daripada sporostatik. Nisin menghambat pertunasan spora pada saat awal penggembungan untuk tumbuh; spora yang rusak karena pemanasan lebih peka terhadap nisin (Broughton 1990).
Yoghurt
Yoghurt merupakan salah satu jenis produk fermentasi yang terkenal. Berbagai jenis susu dapat digunakan untuk membuat yoghurt, antara lain susu segar, susu krim, susu yang telah dihilangkan sebagian lemaknya dan susu skim (susu tanpa lemak). Pembuatan yoghurt merupakan salah satu metode yang tertua dalam sejarah pengawetan susu. Dewasa ini yoghurt telah mengalami perkembangan dalam proses pembuatannya sehingga menghasilkan yoghurt dengan cita rasa dan flavor yang semakin baik dan bervariasi. Yoghurt berasal dari bahasa Turki yaitu “jughurt” yang berarti susu asam.
Menurut SNI 01.2981.1982, yoghurt adalah produk yang diperoleh dari susu yang dipasteurisasi kemudian difermentasi dengan menggunakan bakteri tertentu sampai diperoleh bau dan rasa yang khas dengan atau tanpa penambahan bahan lain yang diizinkan.
Tamime dan Robinson (1989), mengklasifikasikan yoghurt komersial ke dalam tiga kelompok yaitu plain atau natural yoghurt,
fruit yoghurt, dan flavoured yoghurt. Natural
atau plain yoghurt merupakan tipe tradisional dengan bau tajam dan rasa asam, sedangkan
fruit yoghurt dibuat dengan penambahan
buah-buahan dan pemanis pada plain yoghurt dan
flavoured yoghurt dibuat dengan penggunaan
aroma buah dan senyawa sintesis.
Klasifikasi yoghurt berdasarkan metode pembuatannya, dibagi dalam tiga tipe, yaitu : set
yoghurt, stirred yoghurt, dan fluid yoghurt.Set
yoghurt diproduksi dengan inkubasi didalam
tempat-tempat kecil khusus, yoghurt yang dihasilkan berupa cairan kental dan setengah padat. Stirred yoghurt diinkubasi pada tempat besar dan selanjutnya koagulan yang terbentuk dipotong-potong dan didinginkan pada tempat-tempat khusus yang lebih kecil. Fluid yoghurt dibuat secara hampir sama dengan stirred
yoghurt, tetapi hasil yang diperoleh
kekentalannya berbeda yaitu lebih encer (Tamime dan Robinson 1989).
Kultur starter yoghurt pada umumnya terdiri dari bakteri asam laktat Lactobacillus
bulgaricus dan Streptococus thermophilus yang
merupakan pasangan bakteri utama dalam pembuatan yoghurt. Bergabungnya kedua bakteri ini akan menghasilkan nilai organoleptik yang lebih tinggi dibandingkan dengan penggunaan kultur tunggalnya. Keadaan ini disebabkan karena adanya simbiosis antara L.
bulgaricus dengan S. thermophilus yang saling
menguntungkan, karena bakteri yang satu mensintesis dan membebaskan senyawa yang saling menguntungkan atau menstimulasi bakteri lainnya (Tamime & Robinson 1999). Spesies L. bulgaricus merupakan bakteri berbentuk batang, gram positif, tidak berspora, non motil. Suhu optimum pertumbuhan 40-43 °C, masih dapat tumbuh pada suhu 45 °C atau kadang-kadang pada suhu 50-52 °C dan tidak dapat tumbuh pada suhu 15 °C (Deibel & Seeley 1974). Spesies L. bulgaricus bersifat anaerobik, yaitu lebih senang hidup tanpa atau dengan sedikit oksigen. Pada pembuatan yoghurt, L. bulgaricus berperan dalam penurunan pH sampai sekitar 4. selain itu,
L.bulgaricus juga memberi kontribusi terhadap
15
2003). L. bulgaricus di dalam susu lebih bersifat proteolitik yang berkontribusi pada tekstur dan aroma produk susu fermentasi, yaitu dengan membebaskan valin, histidin, dan glisin yang diperlukan oleh S. thermophilus selama pertumbuhannya. Bakteri penghasil asam laktat seperti L. bulgaricus ini juga menghasilkan senyawa yang berisfat antimikroba yang disebut nisin (Adams 2000).
Prinsip dasar fermentasi yoghurt adalah inokulasi bakteri kultur starter pada susu yang telah dipanaskan. Komponen karbohidrat utama pada susu adalah laktosa. Laktosa digunakan oleh kultur starter sebagai sumber energi untuk pertumbuhannya. Laktosa akan dihidrolisis dengan produk akhir asam piruvat. Selanjutnya asam piruvat akan diubah menjadi asam laktat oleh enzim laktat dehidrogenase. Selain menghasilkan aroma yang khas, asam laktat juga berperan dalam pembentukan gel yoghurt. Secara sederhana, reaksi perubahan laktosa menjadi asam laktat adalah sebagai berikut (Tamime & Robinson 1989):
Laktosa + air Æ Asam laktat C12H22O11 H2O 4C3H6O3
Asam yang terbentuk selama fermentasi yoghurt terutama adalah asam laktat. Asam laktat yang diproduksi berbeda dalam konfigurasi struktur dan rotasi optik. Dua isomer yang mungkin terjadi asam laktat leavo- dan dekstro-rotasi (Tamime & Deeth 1980).
Manfaat yoghurt bagi kesehatan tubuh telah banyak dibuktikan oleh banyak peneliti di dunia. Yoghurt memiliki kandungan nilai gizi yang baik dan mudah dicerna oleh tubuh. Selain untuk tujuan kesehatan, yoghurt juga sering dikonsumsi untuk tujuan diet. Yoghurt yang dikonsumsi secara teratur dapat menyeimbangkan mikroflora usus sehingga bakteri-bakteri yang merugikan dapat ditekan jumlahnya dan sebaliknya usus akan didominasi oleh bakteri yang menguntungkan bagi kesehatan (Silvia 2002).
Yoghurt pada umumnya digunakan sebagai bahan pencegah penyakit saluran pencernaan seperti diare. Khususnya pada bayi yang mengalami tidak dapat untuk mencerna laktosa, gastroenteritis (sakit perut), dan pengobatan konstipasi (sembelit). Bagi orang yang menderita tidak dapat mencerna laktosa, yoghurt adalah makanan alternatif yang sangat bermanfaat karena bakteri asam laktat, melalui proses fermentasi akan mengubah laktosa menjadi asam laktat, begitu pula penderita tidak toleran terhadap laktosa dapat mengkonsumsi yoghurt dengan aman (Gillian & Kim 1984).
BAHAN DAN METODE
Bahan dan Alat
Bahan-bahan yang digunakan adalah susu sapi perah, dengan jarak 30 menit setelah diperah, dan yoghurt tanpa rasa (plain yoghurt), bakteri uji Salmonella thypimurium, Bacillus
subtilis, Escherichia coli yang berasal dari
Fakultas Teknologi Pertanian Institut Pertanian Bogor, Media produksi antimikroba yang digunakan adalah treptose proteose peptone
yeast (TPPY) pH 6.0, dengan komposisi
(sukrosa 1 g, pepton 1 g, ekstrak khamir 1 g, K2HPO4 1 g, NaCl 0,2 g, MgSO4 0,02 g, akuades 95,78 mL). de Man Rogosa Sharpe Agar/MRS agar digunakan sebagai media seleksi bakteri dengan komposisi (pepton 10 g,
beef extract 10 g, yeast extract 5 g, K2HPO4 2
g, amonium sitrat 2 g, glukosa 2 g, sodium asetat 3H2O 20 g, MgSO4 7H2O 0,58 g, MnSO4
4H2O 0,28 g, agar 15 g, akuades sampai 1000 mL), alkohol 70%. Nutrien agar (NA) sebagai media tumbuh bakteri uji dengan komposisi
(beef extract 3 g, pepton 5 g, bacto agar 15 g,
akuades sampai 1000 mL).
Alat-alat yang digunakan pada penelitian ini adalah autoklaf, inkubator, oven, neraca analitik, bunsen, labu Erlenmeyer, tabung reaksi, kapas, sudip, gelas ukur, pipet, alumunium foil, karet, kertas, ruang laminar, magnetik stirer, sentrifus Beckman dengan rotor JA 20 untuk volume contoh 500 mL, cawan petri, jarum ose.
Metode Penelitian
Isolasi Bakteri Penghasil Senyawa Antimikrob dari Yoghurt dan Susu (Dwijoseputro 1978)
Sampel yoghurt dan susu masing-masing sebanyak 1 mL diencerkan 0-100 kali, kemudian dari masing-masing pengenceran diambil 0,1 mL dan disebar dengan menggunakan alat sebar pada media MRS agar yang telah padat pada cawan petri. Selanjutnya diinkubasi selama 18 jam, suhu 42 °C.
Isolasi Senyawa Antimikrob
16
diendapkan dengan menggunakan etanol absolut sebanyak dua kali volume dalam keadaan dingin, sambil diaduk, kemudian diendapkan selama satu malam pada suhu dingin. Selanjutnya disentrifugasi kembali pada kecepatan 10000 rpm selama 30 menit. Pelet yang diperoleh diuapkan di dalam oven pada suhu 40 °C selama 12 jam. Pelet yang sudah bebas dari pelarut etanol dilarutkan kembali dengan buffer Tris-HCl dengan konsentrasi 0,1 M kurang lebih 2 kali bobot pelet dan ditetesi 1-2 tetes HCl 0,5 M sampai pelet tersebut larut kembali. Pelet tersebut merupakan ekstrak kasar senyawa
antimikrob yang akan diujikan pada bakteri
S. thypimurium dengan menggunakan metode
sumur agar.
Uji Aktivitas Senyawa Antimikrob dari Isolat Bakteri
Pengujian terhadap bakteri uji (S.
thypimurium) dilakukan dengan menggunakan
metode sumur agar (well diffusion agar) (Bintang 1982). Biakan bakteri uji yang telah disegarkan dalam media NB, diambil sebanyak 0,1 mL dan diinokulasikan ke dalam cawan petri steril. Setelah petri yang berisi biakan bakteri dan media NA memadat, sumur (lubang) dibuat dengan menggunakan pangkal pipet Pasteur dengan diameter 6-7 mm. Ekstrak kasar senyawa antimikrob dari isolat yoghurt dan susu dipipet sebanyak 0,05 mL serta kontrol (pelarut Tris-HCl). Selanjutnya cawan diinkubasi pada suhu 25 °C selama 18 jam. Aktivitas antimikrob ditentukan dengan cara mengukur diameter zona bening yang terbentuk.
Penentuan Waktu Optimum Produksi Antimikrob
Isolat bakteri YI disegarkan di dalam media produksi TPPY sambil dilakukan pengocokan dengan menggunakan shaker water bath pada suhu 37 ºC selama 18 jam. Sebanyak 1% dari volume isolat yang telah disegarkan dipipet kedalam Erlenmeyer yang telah berisi media produksi TPPY. Ekstrak antimikroba diisolasi setelah melalui inkubasi dengan menggunakan variasi waktu 10, 15, 20, 25, 30, dan 35 jam pada suhu 37 ºC. Ekstrak kasar senyawa antimilrob selanjutnya akan diuji aktivitasnya terhadap bakteri S. thypimurium dengan menggunakan metode sumur agar.
Karakterisasi Antimikrob
Senyawa antimikrob diproduksi sesuai dengan waktu optimum yang telah diperoleh pada tahap sebelumnya. Hasil yang didapat kemudian diperlakukan dengan variasi pH dan suhu.
Penentuan pH dan suhu optimum produksi senyawa antimikrob dilakukan dengan memvariasikan pH pada 2, 3, 4, 5, 6, 7, 8 dan suhu pada 50, 60, 70, 80, 90, 100 °C. Masing-masing ekstrak kasar senyawa antimikrob diujikan aktivitas antimikrobnya dengan menggunakan bakteri S. thypimurium. Setelah diperoleh pH optimum dan suhu optimum maka dilakukan pengujian selanjutnya terhadap bakteri uji B. subtilis dan E. coli.
HASIL DAN PEMBAHASAN
Isolat Bakteri Asam Laktat
Isolat yang diperoleh diisolasi dari plain yoghurt (yoghurt murni yang belum diberikan zat tambahan dan mengalami pemanasan) dan susu yang telah mengalami pengenceran 0 sampai 100 kali. Hasil pengenceran selanjutnya ditumbuhkan di dalam media MRS, yang merupakan media selektif untuk pertumbuhan bakteri asam laktat, dengan cara disebar.
Hasil percobaan diperoleh 14 isolat dari susu dan 14 isolat dari yoghurt (Gambar 1 dan 2). Isolat-isolat yang didapat muncul setelah dilakukan inkubasi pada suhu 42 °C selama 18 jam. Isolat-isolat tersebut kemudian diseleksi dan didapatkan tiga bentuk isolat yang berbeda, satu bentuk isolat berasal dari yoghurt (YI) dan dua bentuk isolat berasal dari susu (SI dan SII). Isolat YI memiliki ciri-ciri berwarna putih, permukaan licin, dan berbentuk bulat memanjang; isolat SI berwarna coklat muda, permukaan kasar, dan berbentuk seperti akar; dan isolat SII berwarna putih kecoklatan, permukaan halus, dan berbentuk bulat. Ketiga bentuk isolat tersebut dipilih untuk pengujian aktivitas antimikrob.
17
dalam media MRS pada 42 °C selama 18 jam.
Gambar 2 Isolat-isolat bakteri yang diisolasi dari yoghurt dan ditumbuhkan di-
dalam media MRS pada 42 °C selama 18 jam.
Ekstrak Kasar Senyawa Antimikrob
Ekstrak kasar senyawa antimikrob diperoleh setelah melalui beberapa tahap. Tahap pertama adalah produksi senyawa antimikrob di dalam media TPPY selama 18 jam pada suhu 37 ºC. Tahap kedua adalah pemisahan sel dengan senyawa antimikrob. Pemisahan sel dilakukan dengan melakukan sentrifugasi pada kecepatan 10000 rpm selama 30 menit. Supernatan diambil dan ditambahkan etanol absolut, sambil diaduk, pada suhu dingin sebanyak dua kali volume dari volume supernatan. Penambahan etanol absolut dilakukan untuk mengendapkan senyawa antimikrob yang sebagian besar disusun oleh protein, selain itu juga merupakan tahap awal pemurnian senyawa antimikrob dari pengotor yang ada. Tahap ketiga adalah pemisahaan hasil pengendapan. Pemisahan dilakukan dengan sentrifugasi pada kecepatan 10000 rpm selama 30 menit. Pelet yang diperoleh kemudian dikeringkan pada oven untuk menguapkan etanol absolut. Tahap terakhir atau tahap keempat adalah pelarutan kembali hasil pengeringan pada bufer Tris-HCl sebanyak dua kali bobot pelet kering. Pelet yang telah dilarutkan didalam bufer Tris-HCl yang merupakan ekstrak kasar senyawa antimikrob yang akan diuji aktivitasnya. Pengujian dilakukan terhadap bakteri uji S. thypimurium yang ditumbuhkan di dalam media NA dan diinkubasi pada suhu 37 °C selama 18 jam. Berdasarkan hasil pengamatan diperoleh zona hambat dari isolat YI sebesar 23 mm, isolat SII 20 mm, dan isolat SI tidak menunjukan aktivitas penghambatan (Gambar 3). Zona hambat yang diamati menunjukkan aktivitas ekstrak kasar senyawa antimikrob terhadap pertumbuhan bakteri uji. Semakin besar zona hambat yang diamati maka semakin baik aktivitas senyawa antimikrob dari
masing-masing isolat. Dengan demikian dapat disimpulkan bahwa isolat YI lebih unggul dibandingkan isolat SI dan SII.
Waktu Optimum Produksi Antimikrob
Penentuan waktu optimum produksi senyawa antimikrob dilakukan untuk mengetahui waktu produksi terbaik bakteri asam laktat dalam menghasilkan senyawa antimikrob. Waktu optimum produksi senyawa antimikrob diperoleh dengan melakukan variasi waktu produksi dari 10, 15, 20, 25, 30, dan 35 jam. Produksi senyawa antimikrob dilakukan pada media TPPY dengan suhu inkubasi 37 °C dan variasi konsentrasi uji 5 mg/mL, 15 mg/mL, dan 20 mg/mL (b/v) terhadap bakteri
S.thypimurium. Variasi konsentrasi uji
dilakukan untuk mengetahui konsentrasi hambat efektif dari senyawa antimikrob.
Berdasarkan hasil pengamatan (Gambar 4) diperoleh waktu optimum produksi pada jam ke 15 dengan zona hambat terhadap bakteri S.
thypimurium,pada konsentrasi 20 mg/mL dan
15 mg/mL, adalah 16 mm dan 10 mm. Pada
Gambar 3 Aktivitas antimikrob isolat YI, SI, dan SII dengan kontrol KpH 2. Semua isolat ditumbuhkan di dalam media NA dan zona hambat isolat YI sebesar 23 mm.
Gambar 4 Grafik hasil uji penentuan waktu optimum produksi senyawa antimikrob. Zona hambat isolat YI
SII
SI
Y I
KpH2
Z o n a H a m b a tWaktu Inkubasi (jam)
18
dengan konsentrasi 20 (biru muda), 15 (biru tua), dan 5 mg/mL (ungu) pada selang waktu 10, 15, 20, 25, 30, dan 35 jam.
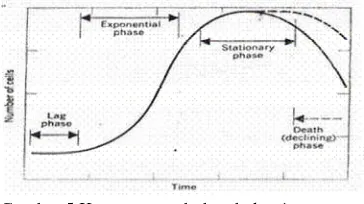
jam ke 10, tidak terdapat zona hambat pada konsentrasi 5 mg/mL dan 15 mg/mL, sedangkan pada waktu 20 sampai 35 jam kemampuan menghambat bakteri cenderung menurun. Kondisi ini dimungkinkan terjadi karena senyawa antimikrob yang merupakan metabolit sekunder telah di produksi pada jam ke 15 (tepat pada akhir fase log) sehingga pada jam ke 20 sampai 35 bakteri telah memasuki fase stasioner yang produksi senyawa antimikrobnya telah menurun dan perbandingan jumlah selnya telah konstan akibat metabolit sekunder yang diproduksi (Gambar 5). Pada konsentrasi uji 5 dan 15 mg/mL zona hambat yang dihasilkan lebih kecil dibandingkan dengan konsentrasi 20 mg/mL, sehingga dapat disimpulkan bahwa konsentrasi hambat efektif adalah 20 mg/mL. Hasil pengujian tersebut menunjukkan bahwa waktu optimum produksi diperoleh pada 15 jam setalah inkubasi dengan konsentrasi 20 mg/mL. Hal ini sesuai dengan hasil penelitian yang telah dilakukan oleh peneliti sebelumnya yang menunjukkan bahwa konsentrasi hambat efektif untuk penghambatan bakteri S.
thypimurium terdapat pada konsentrasi 20
mg/mL dengan waktu inkubasi selama 18 jam (Suarsana 2005).
pH dan Suhu Optimum Aktivitas Antimikrob
Karakterisasi senyawa antimikrob dilakukan dengan perlakuan pH dan suhu yang berbeda-beda. Variasi pH yang digunakan adalah pH 2, 3, 4, 5, 6, 7, 8. pH optimum yang diperoleh akan digunakan
untuk menentukan suhu optimum produksi
Gambar 5 Kurva pertumbuhan bakteri terhadap waktu
senyawa antimikrob. Variasi suhu yang digunakan adalah 50, 60, 70, 80, 90, 100 °C.
Data pada Tabel 1 menunjukkan bahwa pada pH 2 senyawa antimikrob menunjukkan zona hambat terbesar yaitu 27 mm. Kontrol pH 2 yang digunakan juga menunjukkan zona hambat sebesar 11 mm. Walaupun kinerja penghambatan pertumbuhan bakteri tertinggi terjadi pada pH 2, pH optimum untuk perlakuan adalah pada pH 3. Hal ini disebabkan karena zona hambat yang dihasilkan adalah murni dari aktivitas senyawa antimikrob tanpa dipengaruhi derajat keasaman yang tinggi dari pelarut yang digunakan. Jika pH optimum yang dipakai adalah pH 2, dikhawatirkan untuk produksi dalam skala industri, aktivitas penghambatan yang terjadi disebabkan karena keasaman pelarut bukan karena kinerja senyawa antimikrob itu sendiri. Kontrol pH 8 tidak digunakan dalam percobaan karena pada pH 8 senyawa antimikrob tidak larut (tidak ada aktivitas) sehingga efek yang ditimbulkan pada kontrol dan sampel uji adalah sama, murni aktivitas bufer.
Pada variasi pH yang lebih basa senyawa antimikrob menunjukan efektifitas zona hambat yang cenderung menurun. Menurunnya aktivitas ini dikarenakan berkurangnya kelarutan senyawa antimikrob terhadap bufer yang digunakan sehingga mengakibatkan kestabilan senyawa antimikrob terganggu.
Senyawa antimikrob yang dihasilkan menunjukkan efektivitas tinggi terhadap bakteri uji sampai pada pemanasan 80 °C selama 15 menit dengan zona hambat sebesar 24 mm. Pada suhu diatas 80 °C aktivitas senyawa antimikrob tersebut mengalami penurunan. Penurunan aktivitas tersebut disebabkan pemanasan dengan suhu yang tinggi, sehingga protein yang merupakan komponen utama senyawa antimikrob, menjadi rusak (terdenaturasi) dan cenderung untuk mengendap.
Tabel 1 Pengaruh pH terhadap aktivitas Senyawa antimikrob pada bakteri S. thypimurium
Perlakuan pH Zona hambat (mm)
2 27 3 24 4 24 5 19 6 14 7 14 8 13
K 2 11
K 3 -
K 4 -
K 5 -
K 6 -
19
Pada Tabel 2 terlihat jelas penurunan kemampuan hambat seiring dengan bertambahnya suhu. Pada suhu 90 °C zona hambat yang dihasilkan sebesar 15 mm, dan pada suhu 100 °C zona hambat yang dihasilkan lebih kecil yaitu 12 mm. Walaupun kemampuan hambat menurun akan tetapi senyawa antimikrob ini masih dapat melakukan penghambatan pada suhu tinggi, sehingga dapat dikatakan bahwa senyawa antimikrob bersifat termostabil. Hal ini dapat terjadi juga karena kestabilan dan kelarutan senyawa antimikrob yang baik pada pH rendah.
Senyawa antimikrob yang dihasilkan menunjukan kelarutan yang tinggi pada pH rendah. Kelarutan senyawa antimikrob pada pH 2 adalah 57 mg/mL, pada pH 6 adalah 1,5mg/mL dan pH 8,5 adalah 0,25 mg/mL. kestabilan senyawa ini sejalan dengan kelarutannya. Nisin dalam HCl pH 2,5 atau lebih rendah, akan tetap stabil sekalipun didihkan hingga suhu 115 °C selama 20 menit (Adam 2000).
Senyawa antimikrob yang telah diketahui kondisi optimumnya, kemudian diujikan terhadap bakteri Gram positif dan Gram negatif lainnya. Tujuan dari pengujian ini adalah untuk melihat efektifitas kerja dari senyawa antimikrob terhadap bakteri yang memiliki karakteristik berbeda. Bakteri yang digunakan adalah E. coli dan B. subtilis. Kedua bakteri ini adalah bakteri yang sering mencemari makanan. Hasil pengujian akitivitas senyawa antimikrob terhadap B. subtilis dan E. coli dapat dilihat pada Tabel 3. Data pada Tabel 3 menunjukkan bahwa zona hambat terbesar terjadi pada bakteri Gram positif B. Subtilis sebesar 33 mm, sedangkan pada bakteri Gram Tabel 2 Pengaruh suhu terhadap aktivitas senyawa antimikrob pada bakteri S. thypimurium
Perlakuan suhu (°C) Zona hambat (mm)
50 24 60 24 70 24 80 23 90 15 100 12
K pH 3 -
negatif E. coli sebesar 29 mm. Zona hambat yang diperoleh dapat dilihat pada Gambar 6 dan 7.
Bakteri Gram positif lebih peka terhadap senyawa antimikrob dibandingkan dengan bakteri Gram negatif (Fardiaz 1989). Hal ini dapat terjadi karena perbedaan pada komponen penyusun dinding sel bakteri. Struktur dinding
sel bakteri Gram positif lebih sederhana dibandingkan dengan bakteri Gram negatif. Struktur dinding sel bakteri Gram positif memiliki lebih banyak peptidoglikan, dan tidak memiliki membran terluar yang melindungi permukaan dinding sel sehingga memudahkan masuknya senyawa antimikrob langsung kedalam sel menuju sasaran kerja. Sedangkan bakteri Gram negatif memiliki struktur membran yang kompleks, berlapis tiga, yaitu lapisan luar yang berupa lipoprotein, lapisan tengah yang berupa peptidoglikan, dan laipsan dalam lipopolisakarida (Pelczar & Chan 1986).
Tabel 3 Zona hambat senyawa antimikrob pada E.coli dan B. subtilis
Jenis bakteri Zona hambat (mm)
E. coli 29
B. subtilis 33
Kontrol bufer -
Gambar 6 Hasil uji senyawa antimikrob terhadap bakteri E. coli yang ditumbuhkan di dalam media NA dengan waktu inkubasi 18 jam pada suhu 37 °C
Gambar 7 Hasil uji senyawa antimikrob terhadap bakteri B. subtilis yang
20
SIMPULAN dan SARAN
Simpulan
Pada penelitian ini didapatkan tiga bentuk isolat bakteri asam laktat. Isolat pertama (YI) berasal dari yoghurt sedangkan kedua isolat lainnya, (SI dan SII), berasal dari susu sapi. Isolat bakteri asam laktat yang berasal dari yoghurt (YI) memiliki aktivitas antimikrob terbesar dibandingkan dua isolat yang diperoleh dari susu (SI dan SII).
Senyawa antimikrob isolat Y1 memiliki aktivitas optimum pada waktu inkubasi 15 jam, dengan konsentrasi 20 mg/mL, pada pH 3, dan suhu 80 °C.
Aktivitas senyawa antimikrob terhadap bakteri B. subtilis memiliki zona hambatsebesar 33 mm,, E. coli 29 mm, dan S. thypimurium sebesar 24 mm. Zona hambat terbesar yaitu pada B. subtilis yang merupakan aktifitas penghambatan terbaik terhadap bakteri Gram positif.
Saran
Perlu dilakukan identifikasi isolat yang diperoleh agar dapat diketahui jenis bakteri yang berperan. Pemurnian lebih lanjut juga perlu dilakukan terhadap senyawa antimikrob dengan menggunakan metode kromatografi.
DAFTAR PUSTAKA
Abee T, Krockel L, Hill C. 1995. Bacteriocins: modes of action and potential in food preservation and
Control of food poisoning. Int. J Food Microbial. 28: 169-185.
Adams. 2000. Nisin in Multifactorial Food
Preservation. UK: University of
Surrey.
Adnyana, Firmansyah. 26 Jan 2006. Dari pecel lele, obat herba, sampai parfum.
Pikiran Rakyat:8(kolom 2).
Audisio MC, Olicer G, Apella MC. 1999. Antagonistic effect of Enterococcus
faecum against human and poultry
pathogenic Salmonella spp.. J Food
Prot. 62: 751-755.
Bintang ML. 1982. Perbaikan mutu simpan ikan pindang dengan pembubuhan bahan antimikroba dari Str. Lactis [tesis]. Bogor. Program Pascasarjana, Institut Pertanian Bogor.
Broughton JD. 1990. Nisin and Its Uses as a
Food Preservative. UK: Food
Technology.
Broughton JD. 2005. Nisin as a Food
Preservative. UK: Danisco.
Buchanan RE, Gibbons. 1975. Bergey’s Manual
of Determinative Bacteriology. Ed
ke-8. Baltimore: Woverly.
Cintas LM, Rodriguez JM, Fernandez MF, Sletten K, Nes IF, Hernandez PE , Holo H. 1995. Isolation and characterization of pediocin L50, a new bacteriocin from Pediococcus
acidilactici with a broad inhibitory
spectrum. App. J Environ Microbiol 7: 2643-2648.
Diebel RH, Seeley H. 1974. Stertococaceae in Bergeys Manual of Determinative
Bacteriology. Baltimore: Williams &
Wilkins.
Djaafar TF, Rahayu ES, Wibowo D, Sudarmadji S. 1995. Substansi antimikrobia bakteri asam laktat Lactobacillus casei subsp.
rhamnosus TGR-2 yang diisolasi dari
Growol. Seminar Nasional
Perhimpunan Biokimia dan Biologi
Molekuler Indonesia XII; Bali, 15-16
Mei 1994. Hlm 1-15.
Dwijoseputro. 1978. Dasar-dasar Mikrobiologi. Malang: Djambatan Press.
Fardiaz S. 1989. Mikrobiologi Pangan. Bogor: Pusat Antar Universitas Pangan dan Gizi, Institut Pertanian Bogor.
Gilliand SE, Kim HS. 1984. Effect of viable started culture bacteria in yoghurt on lactose utilization in humans. J Dariy Sci. 67: 1-6.
Gonzalez B, Arca P, Mayo B, Suarez JE. 1994. Detection, purification, and partial characterization of plantaricin C, a bacteriocin produced by a
Lactobacillus plantarum strain of dairy
origin. App. J Environ. Microbiol 6: 2158-2163.
Hudayanti M. 2004. Aktivitas antibakteri rimpang temulawak (Curcuma
xanthorrhiza Roxb.) [skripsi]. Bogor:
Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Davidson PM, Branen AL, editor. 1993. Bacteriocins with Potential for Use in
Foods. Ed ke-2. New york: DBC Press.
Naidu AS. 2000. Natural Food Antimicrobiol
System. New York: CRC Press.
21
Pelczar MJ, Chan ECS. 1986. Microbial
Physiology. Ed ke-2. Singapore: A
Wiley Intersciensce Publication. Silvia. 2002. Pembuatan yoghurt kedelai
(soyghurt) dengan menggunakan kultur campuran Bifidobacterium dan
Streptococus thermophilus [skripsi].
Bogor: Fakultas Teknologi Pertanian, Institut Pertanian Bogor.
Smid EJ. 2001. Biopreservation with Nisin. Netherland. Agrotechnological Research Institute.
Steven KA, Sheldon BW, Klapes NA, Klaenhammer TR. 1991. Nisin treatment for inactivation of
Salmonella and other Gram negatif
bacteria spp. J Environ. Microbiol 57: 3613-3615.
Stumbo CR. 1973. Thermobacteiology in Food
Processing. New York: Academic
Press.
Suarsana IN. 2005. Aktivitas In vitro Senyawa Antimikroba dari Sterptococus lactis.J
Veteriner Universitas Udayana 6:
34-41.
Sunanti. 2007. Aktivitas antibakteri ekstrak tunggal bawang putih (Allium sativum Linn.) dan rimpang kunyit (Curcuma
domestica Val.) terhadap Salmonella
thypimurium [skripsi]. Bogor: Fakultas
Matematika dan Ilmu pengetahuan Alam, Institut Pertanian Bogor.
Tamime AY, Deeth HC. 1980. Yoghurt technology and biochemistry. J Food
Protection 43: 77-93.
Tamime AY, Robinson RK. 1989. Yoghurt
science and tecnology. London:
Peramon Press.
Widowati S, Misgiyarta. 2000. Efektifitas bakteri asam laktat (BAL) dalam pembuatan produk fermentasi berbasis protein / susu fermentasi. J Balai Penelitian dan Sumber Daya Genetik
Pertanian 7: 23-43.
Winarno FG. 2003. Flavor Bagi Industri
Pangan. Bogor: Mbrio Press.
Wiryawan. 2005. Isolasi bakteri asam laktat penghasil antimikroba. J Veteriner
22
23
Isolasi bakteri
Seleksi melalui pengujian
aktifitas antimikrob
Penentuan Waktu Optimum
Produksi Antimikrob
Karakterisasi Antimkrob
(penentun suhu & pH optimum)
Uji Aktivitas Senyawa
Antimikrob Terhadap Bakteri
E.
Coli
dan
S. thypimurium
Lampiran 1 Alur strategi penelitian
Sumber Isolat
(susu & yoghurt)
Isolat-isolat Bakteri
Isolat Penghasil Antimikrob
Waktu Optimum Produksi Antimikrob
pH dan Suhu Optimum Aktivitas Antimikrob
24
Lampiran 2 Isolasi dan pengujian waktu optimum produksi senyawa antimikrob
1 Cara isolasi bakteri dari sample
1mL 1mL 1 mL
Sampel
100mL 100mL 100mL
akuades akuades akuades
0,1 mL 0,1mL 0,1mL
petri berisi MRS agar diinkubasi 24 jam 42°C
2 Penentuan Waktu Optimum Produksi Antimikrob
2
ose
Diinkubasi
37°C
24 jam
0,1mL
5 mL TPPY
10 jam 15 jam 20 jam 25 jam 30 jam 35jam
Setiap tabung berisi 5 mL media TPPY diinkubasi dengan suhu 37 °C
Disentrifugasi dengan kecepatan 10000 rpm 30 menit
(Isolasi Senyawa Antimikrob )
Supernatan diambil
0,05 mL 0,05 mL
25
Lampiran 3 Penentuan pH optimum untuk produksi senyawa antimikrob
1 ose
Kultur Stok
50 mL 50 mL 50 mL 50 mL
Media produksi TPPY, inkubasi waktu optimum
Disentrifugasi dengan kecepatan 10000 rpm
30 menit superntan diambil
Supernatan diendapkan dengan etanol
absolut 2 kali volume, didiamkan 24 jam.
disentrifugasi 10000 rpm 30 menit.
Endapan
Dikeringkan 40 °C selama 12 jam
Endapan kering
Dicampurkan dengan bufer Tris-HCl 0,1 M
pH 2, 3, 4, 5, 6, 7, 8
26
Lampiran 4 Penentuan suhu optimum untuk produksi senyawa antimikrob
1 ose
Kultur Stok
50 mL 50 mL 50 mL 50 mL
Media produksi TPPY, inkubasi waktu optimum
Disentrifugasi dengan kecepatan 10000 rpm
30 menit superntan diambil
Supernatan diendapkan dengan etanol
absolut 2 kali volume, didiamkan 24 jam.
disentrifugasi 10000 rpm 30 menit.
Endapan
Dikeringkan 40 °C selama 12 jam
Endapan kering
Dicampurkan dengan buffer Tris-HCl 0,1 M
pH optimum dan dipanaskan dengan suhu 50, 60,
70, 80, 90, 100 °C
27
Lampiran 5 Uji hasil optimasi terhadap
B. subtilis
dan
E. coli
Endapan kering
Dicampurkan dengan bufer Tris-HCl 0,1 M
pH optimum, suhu optimum, waktu
inkubasi optimum
I II