ISOLASI DAN KARAKTERISASI BAKTERI HALOTOLERAN
PADA PEDA IKAN KEMBUNG (Rastrelliger sp.)
Oleh :
Suci Dwi Novi Savitri
C34102034
PROGRAM STUDI TEKNOLOGI HASIL PERIKANAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
RINGKASAN
SUCI DWI NOVI SAVITRI. C34102034. Isolasi dan Karakterisasi Bakteri Halotoleran pada Peda Ikan Kembung (Rastrelliger sp.). Dibimbing oleh WINARTI ZAHIRUDDIN dan DESNIAR.
Ikan peda merupakan salah satu produk hasil fermentasi bergaram yang sangat digemari oleh masyarakat Indonesia karena cita rasa dan aromanya yang khas. Peda adalah produk hasil fermentasi bergaram yang menggunakan aktivitas bakteri dalam prosesnya. Bakteri tersebut akan menguraikan protein yang selanjutnya akan terbentuk senyawa-senyawa yang berperan dalam pembentukan cita rasa yang khas pada peda. Sehubungan dengan informasi mengenai jenis bakteri yang terdapat di dalam peda masih sangat kurang, maka perlu dilakukan isolasi bakteri halotoleran yang terdapat pada produk tersebut sehingga dapat diketahui karakteristik morfologi dan fisiologinya yang merupakan tahapan yang penting untuk melakukan identifikasi.
Tujuan penelitian ini adalah untuk mengisolasi dan mengetahui karakteristik bakteri halotoleran yang terdapat dalam produk fermentasi yaitu peda ikan kembung (Rastrelliger sp.).
Penelitian ini dilakukan dalam tiga tahap yaitu analisis bahan (yang meliputi pengukuran kadar garam, derajat keasaman (pH) dan perhitungan Total Plate Count (TPC)), isolasi bakteri dari ikan peda merah (dilakukan dengan cara menumbuhkan mikroba pada agar cawan dilanjutkan dengan goresan kuadran serta pengamatan morfologi koloni dan sel untuk mengetahui tingkat kemurnian isolat yang diperoleh) dan karakterisasi isolat bakteri murni (yang meliputi uji morfologi dan uji fisiologi). Sifat morfologi yang diamati adalah morfologi sel, sedangkan pengamatan sifat fisiologis bakteri, meliputi uji hidrolisis pati, uji hidrolisis protein, uji hidrolisis lemak, uji reduksi nitrat, uji katalase, uji oksidase, uji indol, uji H2S, uji fermentasi gula, uji oksidasif-fermentatif Baird Parker, uji kualitatif untuk Staphylococcus, uji manitol, uji koagulase dan pendugaan jenis bakteri.
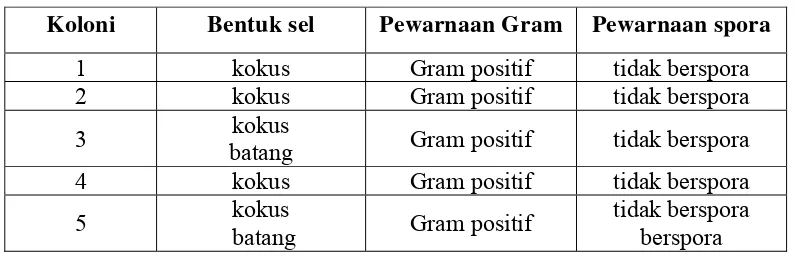
Pada analisis bahan diketahui bahwa kadar garam ikan peda merah sebesar 11,4 %, derajat keasaman (pH) sebesar 7,08 dan jumlah bakteri (Total Plate Count/ TPC) sebesar 1,04 x 104 koloni/ml. Pada tahap isolasi bakteri diketahui ada lima isolat yang diperoleh dari lima koloni dominan yang memiliki sifat morfologi koloni yang berbeda baik warna, bentuk, elevasi dan tepiannya.
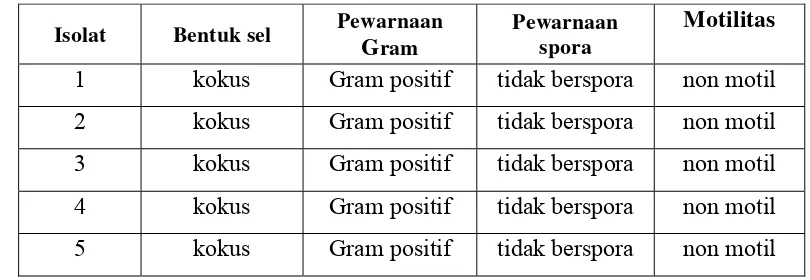
Berdasarkan hasil pengamatan morfologi sel bakteri, kelima isolat tersebut memiliki sifat yang sama yaitu bentuk sel kokus, gram positif, tidak mempunyai spora dan non motil. Sedangkan dari pengamatan sifat-sifat fisiologi bakteri, kelima isolat juga memiliki sifat yang sama yaitu dapat menghidrolisis pati, protein dan lemak; hidup secara aerob atau fakultatif anaerob; katalase positif; tidak dapat mereduksi nitrat; indol negatif, H2S negatif dan oksidase negatif; dapat memfermentasi glukosa dan menghasilkan asam; metabolisme selnya dilakukan secara fermentatif; serta termasuk dalam golongan Staphylococcus sp. yang bersifat tidak patogen.
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa skripsi dengan judul ” Isolasi dan Karakterisasi Bakteri Halotoleran pada Peda Ikan Kembung (Rastrelliger sp.)” adalah karya saya sendiri dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Desember 2006
ISOLASI DAN KARAKTERISASI BAKTERI HALOTOLERAN PADA PEDA IKAN KEMBUNG (Rastrelliger sp.)
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Fakultas Perikanan dan Ilmu Kelautan
Institut Pertanian Bogor
Oleh :
Suci Dwi Novi Savitri C34102034
PROGRAM STUDI TEKNOLOGI HASIL PERIKANAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
Judul : ISOLASI DAN KARAKTERISASI BAKTERI HALOTOLERAN PADA PEDA IKAN KEMBUNG (Rastrelliger sp.)
Nama : Suci Dwi Novi Savitri NRP : C34102034
Menyetujui,
Pembimbing I
Ir. Winarti Zahiruddin, MS NIP. 130 422 706
Pembimbing II
Desniar, SPi, MSi NIP. 132 159 705
Mengetahui,
Dekan Fakultas Perikanan dan Ilmu Kelauatan
Dr. Ir. Kadarwan Soewardi NIP. 130 805 031
KATA PENGANTAR
Syukur alhamdulillah penulis panjatkan kehadirat Allah SWT, Yang Maha
Pengasih dan Maha Penyayang. Atas berkat rahmat, hidayah dan kasih sayang
yang telah diberikan-Nya penulis dapat menyelesaikan penulisan skripsi dengan
judul “Isolasi dan Karakterisasi Bakteri Halotoleran pada Peda Ikan Kembung
(Rastrelliger sp.)”, sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Pada kesempatan kali ini penulis menyampaikan ucapan terima kasih kepada:
1. Ibu Ir. Winarti Zahiruddin, MS dan Ibu Desniar, SPi, MSi selaku dosen
pembimbing yang telah memberikan arahan, bimbingan dan nasehat selama
penulisan skripsi.
2. Ibu Dr. Tati Nurhayati, SPi, MSi dan Ibu Ir. Anna C. Erungan, MS selaku
dosen penguji, atas masukannya yang berharga dalam penulisan skripsi ini.
3. Bapak Agus Soematri (FKH) dan Ibu Ema atas bantuan yang telah diberikan
selama penelitian.
4. Bapak, Ibu, Mbak Wid, si kembar Angga & Ayu, Mas Ali, si kecil Ivan dan
Mbok’e serta keluarga di Semarang atas cinta kasih, doa, nasehat, perhatian,
dukungan dan keceriaan yang telah diberikan selama ini.
5. Titin, Vina, Nispi, Teguh dan Joddi atas bantuan dan kebersamaan selama
penelitian dan penulisan skripsi ini.
6. Teman-teman THP ”Unskill 39” atas kebersamaan, dukungan dan canda tawa
selama empat tahun lebih bersama.
7. Teman-teman di Wisma Nabila dan Pondok Harum atas hari-hari penuh
senyuman dan canda tawa yang telah kalian berikan selama ini.
8. Serta semua pihak yang tidak dapat penulis sebutkan satu persatu atas bantuan
yang telah diberikan dalam penyusunan skripsi ini.
Akhir kata, semoga skripsi ini dapat bermanfaat bagi penulis maupun pihak yang
membutuhkannya.
RIWAYAT HIDUP
Penulis bernama lengkap Suci Dwi Novi Savitri dan lahir di Semarang pada tanggal 25 November 1983. Penulis
adalah putri kedua dari empat bersaudara dari pasangan
Bapak Drs. Djumasri Yuwono Saputro dan Ibu Sri Kanti.
Penulis menyelesaikan pendidikan dasar di SD Negeri KIP
Karangayu pada tahun 1996. Kemudian dikota yang sama
pada tahun 1996 penulis melanjutkan pendidikan lanjutan tingkat pertama pada
SLTP Negeri 1 Semarang dan lulus pada tahun 1999.
Pada tahun yang sama, penulis melanjutkan pendidikan di SMU Negeri 3
Semarang dan lulus pada tahun 2002. Penulis diterima menjadi mahasiswa IPB
melalui jalur Undangan Seleksi Masuk IPB (USMI) pada tahun 2002 dan diterima
di Jurusan Teknologi Hasil Perikanan, Fakultas Perikanan dan Ilmu Kelautan.
Selama mengikuti perkuliahan penulis aktif di organisasi kemahasiswaan
baik sebagai anggota maupun pengurus antara lain Himpunan Mahasiswa Hasil
Perikanan (Himasilkan) pada tahun 2003-2005 dan Fish Processing Club (FPC) pada tahun 2003-2005. Selain itu penulis juga pernah menjadi asisten mata kuliah
Teknologi Pengolahan Hasil Perikanan Tradisional pada tahun ajaran 2005-2006.
Sebagai salah satu syarat untuk memperoleh gelar sarjana pada
Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu
Kelautan, Institut Pertanian Bogor, penulis melakukan penelitian dengan
DAFTAR ISI
Halaman
DAFTAR TABEL ... vii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN... ix
1. PENDAHULUAN 1.1. Latar Belakang ... 1
1.2. Tujuan ... 2
2. TINJAUAN PUSTAKA 2.1. Fermentasi Ikan ... 3
2.1.1. Faktor-faktor yang mempengaruhi fermentasi ... 4
2.1.2. Peranan garam dalam fermentasi ikan ... 5
2.2. Fermentasi Peda ... 7
2.2.1. Proses dan perubahan yang terjadi selama pembuatan... .. 9
2.2.2. Karakteristik peda... .. 11
2.2.3. Kerusakan produk fermentasi... .. 14
2.3. Isolasi dan Karakterisasi Bakteri pada Produk Fermentasi ... 14
3. METODOLOGI 3.1. Waktu dan Tempat ... 18
3.2. Alat dan Bahan ... 18
3.3. Metode Penelitian ... 19
3.3.1. Analisis bahan... 19
3.3.2. Isolasi bakteri dari ikan peda merah ... 19
3.3.3. Karakterisasi isolat bakteri... 19
3.4. Prosedur Analisis... 20
3.4.1. Pengukuran kadar garam sampel (AOAC 1995)... 20
3.4.2. Pengukuran pH sampel (AOAC 1995) ... 20
3.4.3. Perhitungan nilai Total Plate Count (TPC) (Fardiaz 1992) .... 21
3.4.4. Isolasi bakteri dari sampel (Fardiaz 1988) ... 21
3.4.5. Uji morfologi ... 22
3.4.6. Uji fisiologi ... 25
4. HASIL DAN PEMBAHASAN 4.1. Analisis Bahan... 33
4.3. Karakterisasi Isolat Bakteri ... 39
5. KESIMPULAN DAN SARAN 5.1. Kesimpulan... 59
5.2. Saran ... 59
DAFTAR PUSTAKA ... 61
DAFTAR TABEL
Nomor Halaman
1. Komposisi peda bermutu baik ... 12
2. Hasil analisis komposisi gizi peda pasar ... 12
3. Reaksi-reaksi yang terjadi pada uji fementasi gula... 28
4. Reaksi-reaksi yang terjadi pada uji H2S... 28
5. Tabel kunci identifikasi bakteri Gram positif ... 31
6. Tabel kunci identifikasi tahap kedua untuk Staphylococcus, Micrococcus dan Aerococcus... 32
7. Kadar garam, pH dan nilai Total Plate Count (TPC) ikan peda merah . 33 8. Morfologi koloni terpilih ... 36
9. Morfologi sel bakteri dari koloni terpilih... 37
10. Morfologi sel bakteri dari setiap tahapan isolasi... 38
11. Morfologi sel dari kelima isolat bakteri pada ikan peda merah ... 39
DAFTAR GAMBAR
Nomor Halaman
1. Tahapan pembuatan peda ... 11
2. Tahap-tahap pewarnaan gram ... 24
3. Tahap-tahap pewarnaan spora ... 25
4. Sampel peda merah ikan kembung perempuan (Rastrelliger neglectus). 33 5. Bentuk sel dan hasil pewarnaan gram bakteri... 40
6. Hasil uji motilitas bakteri ... 41
7. Hasil uji hidrolisis pati ... 43
8. Hasil uji hidrolisis protein... 45
9. Hasil uji hidrolisis lemak ... 46
10. Hasil uji reduksi nitrat... 49
11. Hasil uji indol... 50
12. Hasil uji fermentasi gula dan H2S ... 51
13. Hasil uji oksidase ... 53
14. Hasil uji oksidatif-fermentatif Baird-Parker ... 55
15. Hasil uji kualitatif untuk Staphylococcus... 56
16. Hasil uji koagulase ... 57
DAFTAR LAMPIRAN
Nomor Halaman
1. Bentuk pertumbuhan koloni di atas agar cawan ... 65
2. Hasil perhitungan pengukuran kadar garam ... 66
3. Hasil pengukuran derajat keasaman (pH) ... 66
4. Hasil perhitungan nilai Total Plate Count (TPC) ... 66
5. Cara pembuatan larutan pengencer ... 67
6. Komposisi media yang digunakan ... 67
1. PENDAHULUAN
1.1. Latar Belakang
Di Indonesia, ikan dan hasil perairan lainnya merupakan sumber komoditi
yang penting terutama sebagai sumber protein hewani selain yang berasal dari
hewan terestrial seperti sapi, ayam, kambing dan lain-lain. Ikan mempunyai harga
relatif lebih murah dibandingkan dengan sumber protein hewani lainnya seperti
daging sapi sehingga diharapkan ikan akan memberikan sumbangan yang besar
untuk memenuhi kebutuhan gizi penduduk Indonesia terutama protein. Sebagai
sumber protein hewani yang penting maka pendayagunaan ikan harus dilakukan
sedemikian rupa sehingga dapat dimanfaatkan semaksimal mungkin.
Mengingat ikan adalah bahan makanan yang mudah rusak maka usaha
pengolahan ikan mutlak diperlukan sehingga hasil tangkapan ikan yang tidak
dapat segera dipasarkan dalam bentuk segar tidak cepat menjadi busuk dan
terbuang percuma. Pengolahan yang sudah banyak dilakukan adalah pengolahan
ikan secara tradisional seperti penggaraman, pengeringan, perebusan, pengasapan
dan fermentasi, yang semuanya bertujuan untuk mengawetkan atau
memperpanjang masa simpan hasil perikanan tersebut. Hasil olahan secara
tradisional yang cukup dikenal oleh masyarakat Indonesia antara lain ikan asin,
ikan kering, pindang, ikan asap dan produk-produk fermentasi ikan bergaram
seperti peda, terasi dan kecap ikan.
Fermentasi ikan merupakan suatu proses penguraian secara biologis atau
semi biologis dari senyawa-senyawa kompleks terutama protein menjadi
senyawa-senyawa yang lebih sederhana dalam keadaan terkontrol
(Hadioetomo 1982). Bahan pangan yang difermentasi biasanya memiliki aroma
dan tekstur yang lebih baik, umur simpan yang lebih lama dan kebanyakan bahan
pangan hasil fermentasi dianggap aman. Selama fermentasi berlangsung, protein
ikan akan terhidrolisis menjadi asam amino dan peptida, kemudian
asam-asam amino akan terurai menjadi komponen-komponen yang berperan dalam
pembentukan cita rasa.
Menurut Irawadi (1979), fermentasi ikan merupakan salah satu cara
digemari oleh masyarakat. Dengan proses fermentasi akan diperoleh produk
dengan cita rasa dan aroma yang khas yang sulit ditinggalkan oleh para
penggemarnya. Fermentasi ikan bergaram merupakan suatu cara pengawetan
yang cocok dengan kondisi ekonomi nelayan, karena tidak membutuhkan biaya
yang tinggi dan suhu pembuatannya sesuai dengan suhu di Indonesia.
Peda adalah produk hasil fermentasi bergaram yang menggunakan aktivitas
bakteri dalam prosesnya. Diperkirakan bakteri yang berperan dalam proses
fermentasi bergaram ini adalah bakteri halofilik atau bakteri halotoleran.
Bakteri-bakteri tersebut memberi sumbangan dalam proses penguraian senyawa-senyawa
kompleks seperti protein, karbohidrat dan lemak yang selanjutnya akan terbentuk
senyawa-senyawa yang berperan dalam pembentukan cita rasa yang khas pada
peda (Jermolieva dan Bujanowskaja 1934; Messing 1934; Shewan 1938; dan
Omland 1955 diacu dalam FAO 1971). Akan tetapi tidak semua jenis bakteri
yang terdapat pada peda berperan dalam pembentukan cita rasa karena hanya
bakteri yang tidak membentuk spora, tahan garam dan dapat tumbuh dalam
kondisi aerobik maupun anaerobiklah yang memegang peranan tersebut
(Rahayu et al. 1992).
Mengingat informasi mengenai jenis-jenis bakteri yang terdapat di dalam
produk ikan peda masih sangat kurang, maka perlu dilakukan isolasi bakteri
halotoleran yang terdapat pada produk tersebut sehingga dengan demikian dapat
diketahui karakteristik morfologi dan fisiologi dari bakteri yang ada yang
merupakan tahapan yang penting untuk melakukan identifikasi.
1.2. Tujuan
Tujuan penelitian ini adalah untuk mengisolasi dan mengetahui
karakteristik bakteri halotoleran yang terdapat dalam produk fermentasi yaitu peda
2. TINJAUAN PUSTAKA
2.1. Fermentasi Ikan
Pada mulanya yang dimaksud dengan proses fermentasi adalah pemecahan
karbohidrat menjadi alkohol dan karbondioksida. Namun banyak proses
fermentasi tidak selalu menghasilkan alkohol dan karbondioksida. Fermentasi
adalah suatu proses penguraian senyawa dari bahan-bahan protein komplek
menjadi senyawa-senyawa yang lebih sederhana dalam keadaan yang terkontrol
atau teratur (controlled condition) (Moeljanto 1982). Selain karbohidrat, protein dan lemak dapat juga dipecah oleh mikroba atau enzim tertentu untuk
menghasilkan asam amino, asam lemak dan zat lainnya (Winarno et al. 1980).
Proses fermentasi biasanya ditujukan untuk a) membuat produk baru,
b) memperbaki nilai gizi, c) memperbaiki sifat fisik misalnya rupa, bentuk,
kekerasan dan flavour dan d) memperpanjang daya awet produk (Damayanthy dan Mudjajanto 1993). Terjadinya fermentasi dapat menyebabkan
perubahan sifat bahan pangan sebagai akibat pemecahan kandungan-kandungan
bahan tersebut (Winarno et al. 1980). Hasil fermentasi terutama tergantung pada jenis bahan pangan, jenis mikroba dan kondisi di sekeliling yang mempengaruhi
pertumbuhan dan aktivitas mikroba. Semua mikroba hidup memerlukan energi
yang diperoleh dari komponen-komponen bahan pangan tempat mikroba itu hidup
(Buckle et al. 1978).
Fermentasi oleh mikroba yang dikehendaki akan menghasilkan cita
rasa yang khas dan mengubah tekstur bahan pangan yang difermentasikan.
Bahan pangan yang mengalami fermentasi biasanya mengandung nilai gizi
yang lebih tinggi dari bahan asalnya. Hal ini disebabkan protein, lemak dan
polisakarida terhidrolisis menjadi senyawa yang lebih mudah dicerna. Adanya
mikroorganisme juga dapat meningkatkan jumlah vitamin, seperti kelompok
vitamin B yang terdapat dalam bahan pangan yang difermentasi
(Buckle et al. 1978)
Hasil fermentasi yang diperoleh sering tidak tetap mutunya. Hal ini
terjadi terutama karena dalam pembuatan produk tradisional menerapkan
mikroba yang ikut aktif biasanya beraneka ragam. Banyaknya jenis mikroba
tersebut menyebabkan hasilnya juga bermacam-macam dan tidak seragam, selain
itu mutu dan hasil yang diperoleh tidak menentu (Winarno dan Fardiaz 1981)
Selain membantu dalam mengawetkan makanan, fermentasi juga
memberikan sifat-sifat tertentu yang dapat menjadi daya tarik bagi konsumen.
Biasanya sifat-sifat ini hanya dapat dihasilkan melalui perubahan yang komplek
selama fermentasi (Pederson 1963)
Fermentasi makanan dapat dibedakan menjadi dua kelompok berdasarkan
sumber mikroba yang berperan dalam fermentasi, yaitu fermentasi spontan dan
fermentasi tidak spontan. Fermentasi spontan adalah fermentasi yang dalam
pembuatannya tidak ditambahkan mikroba dalam bentuk starter, tetapi mikroba yang berperan aktif dalam proses fermentasi berkembang biak secara spontan
karena tempat hidupnya yang dibuat sesuai untuk pertumbuhannya. Fermentasi
tidak spontan terjadi pada makanan yang dalam pembuatannya ditambahkan
mikroba dalam bentuk starter, dimana mikroba akan berkembang biak dan aktif mengubah bahan yang difermentasi menjadi produk yang diinginkan
(Fardiaz 1987).
2.1.1. Faktor-faktor yang mempengaruhi fermentasi
Faktor-faktor yang mempengaruhi keberhasilan suatu proses fermentasi
adalah sebagai berikut (Potter 1978):
a) Asam
Makanan yang mengandung asam biasanya tahan lama, tetapi jika oksigen
cukup jumlahnya dan kapang dapat tumbuh serta fermentasi berlangsung terus,
maka daya awet dari makanan asam tersebut menjadi hilang. Pada keadaan ini
mikroba proteolitik dan lipolitik dapat berkembang biak menghasilkan senyawa
yang berbau busuk
b) Alkohol
Seperti halnya asam, makanan atau minuman yang mengandung alkohol
dapat tahan lama tergantung konsentrasinya. Kandungan akohol yang terbentuk
selama fermentasi anggur tergantung pada kandungan gula dalam buah anggur,
c) Penggunaan starter
Fermentasi adakalanya dilakukan dengan menggunakan kultur murni yang
dihasilkan di laboratorium. Kultur ini dapat disimpan dalam keadaan kering atau
dibekukan. Adakalanya proses fermentasi tidak menggunakan kultur murni,
misalnya pada penggumpalan susu untuk pembuatan keju yang dilakukan dengan
cara memasukkan susu asam yang telah menggumpal ke dalam cairan susu yang
akan diproses .
d) Suhu
Suhu fermentasi sangat menentukan macam mikroorganisme yang
dominan selama fermentasi. Jika kondisi asam yang dikehendaki telah tercapai,
maka suhu dapat dinaikkan untuk menghentikan fermentasi. Suhu yang optimum
untuk proses fermentasi sekitar 25 0C sampai 35 0C.
e) Kandungan oksigen
Kandungan oksigen selama proses fermentasi akan mempengaruhi
pertumbuhan optimum mikroba tertentu. Misalnya bakteri Acetobacter yang penting dalam pembuatan cuka adalah bakteri aerob (membutuhkan oksigen),
sedangkan pertumbuhan ragi yang menghasilkan alkohol dari gula akan lebih baik
dalam keadaan anaerob.
f) Garam
Mikroba dapat dibedakan berdasarkan ketahanannya terhadap garam.
Mikroba pembentuk asam laktat dalam acar, sayur asin (sauerkraut), sosis dan lain-lain, biasanya toleran terhadap konsentrasi garam 10 % sampai 18 %.
Beberapa mikroba proteolitik penyebab kebusukan tidak toleran pada konsentrasi
garam 2,5 % dan terutama tidak toleran pada kombinasi antara garam dan asam.
2.1.2. Peranan garam dalam fermentasi ikan
Pada proses fermentasi, garam yang ditambahkan berpengaruh pada
populasi organisme mana yang dapat tumbuh dan yang tidak dapat tumbuh serta
jenis apa yang akan tumbuh, sehingga kadar garam dapat digunakan untuk
mengendalikan aktivitas fermentasi apabila faktor lainnya adalah sama
(Desroier 1988).
Penambahan garam dalam fermentasi ikan mempunyai beberapa fungsi,
pertumbuhan mikroorganisme (merangsang pertumbuhan mikroorganisme yang
diinginkan berperan dalam fermentasi dan menghambat pertumbuhan
mikroorganisme pembusuk dan patogen). Garam dapat berfungsi sebagai
penghambat pertumbuhan mikroorganisme pembusuk dan patogen karena
mempunyai sifat-sifat antimikroba sebagai berikut: a) garam dapat meningkatkan
tekanan osmotik substrat, b) garam dapat menyebabkan terjadinya penarikan air
dari dalam bahan pangan sehinggga aw bahan pangan akan menurun dan
mikroorganisme tidak akan tumbuh, c) garam mengakibatkan terjadinya penarikan
air dari dalam sel mikroorganisme, sehingga sel akan kehilangan air dan
mengalami pengerutan, d) ionisasi garam akan menghasilkan ion khlor yang
beracun terhadap mikroorganisme dan e) garam dapat menganggu kerja enzim
proteolitik karena dapat mengakibatkan terjadinya denaturasi protein
(Rahayu et al. 1992)
Jumlah garam yang digunakan dalam fermentasi ikan berpengaruh
terhadap produk akhir, karena di samping mengurangi laju reaksi enzimatik juga
akan menghambat pertumbuhan dan perkembangbiakan bakteri-bakteri pembusuk
yang dapat menimbulkan bau yang tidak dikehendaki (Reed 1982). Dalam
fermentasi garam, yang berperan dalam penguraian senyawa-senyawa adalah
enzim dari ikannya sendiri, terutama enzim dari isi perut dan mikroorganisme
yang berasal dari ikan maupun garam yang digunakan.
Garam yang biasa digunakan pada umumnya mengandung
bakteri-bakteri yang bersifat halotoleran (tahan garam), diantaranya Bacillus dan Micrococcus. Bakteri-bakteri penyebab kebusukan ikan yang terutama terdiri dari bakteri Gram negatif (Pseudomonas, Achromobacter dan Flavobacterium) tidak tahan akan kadar garam tinggi. Ikan yang diawetkan dengan menggunakan
kadar garam tinggi menyebabkan bakteri-bakteri Gram negatif tersebut terseleksi
sehingga digantikan oleh bakteri halofilik dan mikroorganisme halotoleran
seperti Micrococcus, beberapa khamir, bakteri pembentuk spora, bakteri asam laktat dan beberapa kapang. Bakteri yang berkembang biak selama fermentasi
Keamanan produk fermentasi ikan diperoleh karena kadar garamnya
yang tinggi meskipun suhu dan pH fermentasi berada pada kisaran
pertumbuhan berbagai mikroba yang tidak dikehendaki (Jay 1978). Kadar garam
yang tinggi dalam produk fermentasi garam dapat menghambat petumbuhan
bakteri patogen, kecuali Staphylococcus aureus yang masih mungkin tumbuh pada beberapa produk dengan kadar garam agak tinggi yaitu 7-10 %.
Staphylococcus aureus akan dihambat pertumbuhannya pada konsentrasi garam 15-20 % dan pH di bawah 4,5-5,0, sedangkan bakteri pembentuk toksin yang
berbahaya yaitu Clostridium botulinum tipe E yang sering ditemukan pada ikan segar dapat dihambat pertumbuhannya pada konsentrasi garam 10-12 %
dan pH di bawah 4,5. Salmonella akan terhambat pertumbuhannya pada konsentrasi garam 6 % (Enrichsen 1983 diacu dalamRahayu et al. 1992).
Bakteri halofilik membutuhkan konsentrasi NaCl tertentu untuk
pertumbuhannya. Kebutuhan garam untuk pertumbuhan optimum bervariasi,
yaitu 5-20 % untuk bakteri halofilik sedang, dan 20-30 % untuk bakteri halofilik
ekstrim. Spesies yang tumbuh baik pada medium yang mengandung 2-5 %
garam disebut halofilik ringan. Bakteri halotoleran (tahan garam) adalah bakteri
yang dapat tumbuh dengan atau tanpa garam. Bakteri halofilik dan halotoleran
sering ditemukan pada makanan berkadar garam tinggi atau di dalam larutan
garam (Fardiaz 1992).
2.2. Fermentasi Peda
Pengawetan ikan dengan cara fermentasi garam merupakan cara
pengawetan ikan tradisional di Indonesia dan negara-negara Asia Tenggara
lainnya (Putro 1978). Fermentasi ikan bergaram merupakan suatu cara
pengawetan ikan yang besar peranannya di Indonesia karena cara ini tidak
membutuhkan biaya yang terlalu tinggi, suhunya sesuai dengan suhu di Indonesia
dan menghasilkan citarasa dan aroma yang khas (Irawadi 1979). Tapi produk
fermentasi yang dibuat dengan menggunakan kadar garam yang tinggi tidak dapat
digunakan sebagai makanan sumber protein karena rasanya yang terlalu asin,
sehingga jumlah yang dikonsumsi juga sangat sedikit. Produk-produk semacam
ini biasanya hanya digunakan sebagai bahan perangsang makan, penyedap
Fermentasi ikan merupakan salah satu cara pengawetan bahan pangan,
dimana dengan proses ini mikroba yang dikehendaki diusahakan tumbuh dan
berkembang biak sedangkan mikroba yang tidak dikehendaki dihambat
pertumbuhannya (Winarno et al. 1980). Dalam proses fermentasi ikan, pertama-tama terjadi hidrolisis protein menjadi asam amino dan peptida, selanjutnya terjadi
perubahan asam amino menjadi komponen lainnya, dan akhirnya produk akan
berubah menjadi bentuk pasta atau cairan (Davies 1982).
Proses fermentasi ikan merupakan proses biologis atau semibiologis,
yang pada prinsipnya dapat dibedakan menjadi empat golongan
(Stanton dan Quee Lan Yeoh 1978 diacu dalam Rahayu et al.1992), yaitu :
1) Fermentasi menggunakan kadar garam tinggi misalnya dalam pembuatan
peda, kecap ikan dan bekasang.
2) Fermentasi menggunakan asam organik, misalnya dalam pembuatan silase
dengan cara menambahkan asam-asam propinoat dan format.
3) Fermentasi menggunakan asam-asam mineral, misalnya dalam pembuatan
silase ikan menggunakan asam-asam kuat.
4) Fermentasi menggunakan bakteri asam laktat, misalnya dalam pembuatan
bekasem dan chaoteri.
Dari segi hasil, proses fermentasi ikan dapat dibedakan menjadi dua
golongan, yaitu golongan yang menghasilkan senyawa-senyawa yang secara nyata
mempunyai kemampuan mengawetkan seperti pada pengolahan bekasang dan
proses fermentasi yang terjadi banyak penguraian atau transformasi yang
menghasilkan produk-produk yang mempunyai sifat yang sama sekali berbeda,
misalnya pengolahan terasi dan kecap ikan atau ikan peda (Moeljanto 1982).
Peda adalah hasil fermentasi spontan sehingga mutu produk tidak tetap
dari waktu ke waktu. Pada fermentasi spontan biasanya jumlah dan jenis mikroba
yang ikut aktif akan beraneka ragam, hal ini akan mengakibatkan mutu produk
tidak menentu (Winarno et al. 1980).
Prinsip proses fermentasi pada pembuatan peda adalah adanya aktivitas
enzim proteolitik dari tubuh ikan dan mikroba yang ada karena penggunaan
konsentrasi garam yang tinggi (FAO 1971). Hasil penguraian protein ini adalah
(Hobbs dan Hodgkiss 1982 diacu dalam Rahayu et al. 1992). Selain memberi sumbangan dalam proses penguraian protein, bakteri ini juga memegang peranan
penting dalam pembentukan cita rasa yang khas pada peda (Jermolieva dan
Bujanowskaja 1934; Messing 1934; Shewan 1938; dan Omland 1955 diacu
dalam FAO 1971).
2.2.1. Proses dan perubahan yang terjadi selama pembuatan peda
Belum tercatat adanya keseragaman dalam berbagai penulisan mengenai
proses pembuatan peda, tetapi garis besar pengolahannya adalah sama.
Pembuatan ikan peda meliputi tahap-tahap pembersihan, penggaraman,
pemeraman dan pematangan.
Setelah ikan dibersihkan, maka ikan ditempatkan ke dalam suatu wadah
dan dilumuri garam secara merata dan berlapis-lapis. Setelah itu dilakukan
penyimpanan secara anaerobik selama sehari atau lebih. Penyimpanan ikan dalam
garam ini disebut dengan fermentasi tahap I. Kemudian ikan dibersihkan dari
garam, dan kembali dilakukan penyimpanan sampai terbentuk cita rasa khas
peda. Tahap ini disebut sebagai tahap fermentasi II atau tahap pematangan
yang dapat berlangsung antara beberapa hari sampai berbulan-bulan
(Van Veen 1965 diacu dalam Suwandi 1988).
Pada umumnya, dalam pembuatan peda dilakukan dua kegiatan yaitu
proses penggaraman dan proses fermentasi. Proses penggaramannya hanya
dilakukan selama satu hari, dengan rasio antara garam dan ikan adalah 1 : 3
(Amano 1962 diacu dalam Suwandi 1988).
Pada tahap penggaraman, terjadi penetrasi garam ke dalam jaringan ikan
dan sebaliknya. Dengan adanya aktivitas garam, air dari dalam tubuh ikan akan
tertarik keluar. Proses aliran garam dan air ini berlangsung cepat pada tahap awal,
tetapi kecepatannya akan berkurang sampai terjadi keseimbangan tekanan osmotik
di luar dan di dalam daging ikan (FAO 1971).
Garam yang masuk ke dalam jaringan daging ikan akan menimbulkan
berbagai perubahan kimia dan fisik yang akan mengakibatkan perubahan
beberapa unsur, terutama protein dalam daging ikan. Garam akan
koagulasi. Akibat proses ini, maka air dalam tubuh ikan akan keluar dan daging
ikan akan mengkerut (Vonskresenky 1965 diacu dalam Suwandi 1988 ).
Tahap berikutnya setelah penggaraman adalah tahap pemeraman atau
fermentasi. Sebenarnya tahap fermentasi ini sudah dimulai pada akhir proses
penggaraman dan dilanjutkan pada saat ikan diperam setelah garam dihilangkan
(Hanafiah 1987 diacu dalam Suwandi 1988). Proses pemeraman atau
fermentasi peda tahap awal ini akan menyebabkan perubahan kimia pada jaringan
daging ikan, terutama pada protein dan lemak ikan. Selama tahap pemeraman
ini maka enzim proteolitik dan lipolitik yang ada pada tubuh ikan maupun
yang dihasilkan oleh bakteri akan memecah protein dan lemak menjadi
senyawa yang lebih sederhana (Amano 1962 diacu dalam Suwandi 1988).
Degradasi protein dan lemak ini akan menghasilkan tekstur yang empuk dan masir
(Anwar dan Sjahri 1979 diacu dalam Suwandi 1988).
Pada tahap awal pemeraman, enzim-enzim proteolitik dan lipolitik
yang berasal dari saluran pencernaan dan oleh katepsin dari jaringan daging
ikan yang paling aktif bekerja untuk memecah protein dan lemak, yang
selanjutnya aktivitas enzim ini akan merangsang aktivitas enzim-enzim
mikroba pada tahap selanjutnya. Bakteri-bakteri ini akan memetabolisme asam
amino ataupun peptida yang sudah dipecah secara autolisis
(Vonskresenky 1965 diacu dalam Suwandi 1988).
Pada fermentasi tahap kedua atau tahap pematangan setelah ikan
dibersihkan dari garam akan dihasilkan basa nitrogen menguap (TVB-N)
yang terbentuk dari hasil pemecahan protein oleh bakteri. Selama proses
pematangan ini jumlah basa nitrogen menguap pada peda mengalami
peningkatan dengan semakin berkurangnya kadar garam pada peda.
Meningkatnya pemecahan protein, dilihat dari terbentuknya basa nitrogen
menguap, menunjukkan bertambah banyaknya bakteri pemecah protein.
Nampaknya bakteri yang terdapat pada peda lebih mampu memanfaatkan protein
yang sudah terpecah dibandingkan protein yang masih utuh. Berarti bakteri
tersebut lebih banyak menghasilkan enzim-enzim peptidase dibandingkan
Selain protein, lemak ikan yang banyak mengandung ikatan rangkap juga
akan mengalami perubahan selama fermentasi peda terutama pada tahap
pematangan (fermentasi tahap II). Ikatan rangkap ini akan menyebabkan lemak
mudah teroksidasi. Adanya pro-oksidan pada ikan, terutama pada ikan yang
berkadar garam tinggi akan mempercepat proses oksidasi (FAO 1971).
Meskipun proses oksidasi lemak pada ikan akan mengakibatkan
ketengikan pada produk akhirnya tetapi produk-produk tertentu seperti peda
mempunyai cita rasa yang khas yang banyak disukai masyarakat sebagai akibat
terjadinya proses oksidasi lemak (Amano1962 diacu dalam Suwandi 1988).
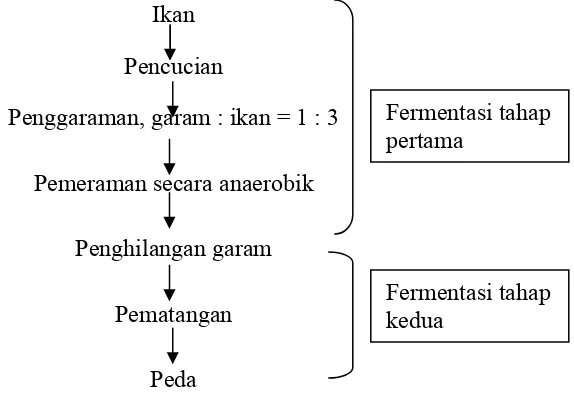
Diagram alir tahapan pembuatan peda dapat dilihat pada Gambar 1.
Ikan
Pencucian
Penggaraman, garam : ikan = 1 : 3 Fermentasi tahap pertama
Pemeraman secara anaerobik
Penghilangan garam
Fermentasi tahap kedua
Pematangan
Peda
Gambar 1. Tahapan pembuatan peda (Van Veen 1965 diacu dalam Suwandi 1988).
2.2.2. Karakteristik peda
Ikan peda pada umumnya dibuat dari ikan yang berkadar lemak tinggi.
Hal ini disebabkan ikan dengan kadar lemak yang tinggi akan menghasilkan
produk yang lebih baik daripada ikan dengan kadar lemak rendah. Selama waktu
fermentasi akan terjadi perubahan-perubahan kimiawi yang antara lain adalah
proses reaksi pada lemak yang nantinya akan memberikan cita rasa yang khas.
Peda dapat dibuat dari berbagai macam jenis ikan. Pada mulanya peda
adalah ikan lemuru (Sardinella sp.), ikan layang (Decapterus sp.) atau ikan selar (Caranx sp.) (Rahayu et al. 1992).
Berdasarkan jenis ikan yang digunakan dalam pembuatan peda terutama
dengan bahan baku ikan kembung (Rastrelliger sp.), maka dikenal dua jenis peda yaitu peda merah dari ikan kembung perempuan (Scomber neglectus) dan peda putih dari ikan kembung lelaki (Scomber kanagurta). Peda yang bermutu baik adalah peda yang berwarna merah segar, tekstur dagingnya masir dan mempunyai
pH antara 6,0-6,4 dan bercita rasa khas peda. Peda merah mempunyai mutu yang
lebih baik karena mempunyai kadar lemak yang tinggi yaitu 7-14 %, berwarna
merah dan teksturnya masir (Van Veen 1965 diacu dalam Suwandi 1988).
Komposisi kimia peda dapat dilihat pada Tabel 1 dan 2.
Tabel 1. Komposisi peda bermutu baik
Sumber : Van Veen (1965) diacu dalam Suwandi (1988).
Tabel 2. Hasil analisis komposisi gizi ikan segar dan peda pasar*
Komponen Ikan segar Peda pasar
Kadar air (%)
Nilai kadar abu dan kadar garam yang lebih tinggi pada peda pasar Bogor
disebabkan oleh proses penggaraman. Garam pada umumnya terdiri dari 39,39 %
natrium dan 60,69 % klorida. Garam rakyat yang digunakan dalam pembuatan
peda pasar mengandung zat-zat lain yang tercampur dalam garam (terutama
garam-garam magnesium, natrium, sulfat, logam dan lain-lain) menimbulkan
akibat yang kurang baik pada produk penggaraman (Moeljanto 1982). Mineral
atau logam yang tahan panas ini akan menyebabkan peningkatan kadar abu
dan kadar garam produk peda pasar Bogor bila dibandingkan ikan segar
(Derajat 1994).
Kadar lemak peda pasar Bogor yang lebih rendah dari kadar lemak ikan
segar diduga disebabkan adanya kerusakan lemak karena terjadinya oksidasi
lemak. Kadar protein peda pasar Bogor yang lebih tinggi dari kadar protein ikan
segar diduga karena kandungan air peda pasar Bogor lebih rendah, sedangkan
kadar protein dihitung berdasarkan berat basah (Derajat 1994).
Nilai pH, kadar TVN, kadar TMA serta kadar histamin peda pasar Bogor
yang lebih tinggi dari ikan segar diduga karena tingkat kesegaran pada bahan baku
peda pasar lebih rendah daripada ikan segar sehingga timbul perubahan-perubahan
seperti terbentuknya amonia, terlepasnya gugus nitrogen dari protein, perubahan
TMAO menjadi TMA serta berkembangbiaknya mikroba pembentuk histamin.
Perubahan-perubahan tersebut menyebabkan nilai pH, kadar TVN, kadar TMA
dan kadar histamin peda pasar lebih tinggi (Derajat 1994).
Bau khas peda disebabkan oleh persenyawaan metil keton, butil
aldehid, amonia, amino dan persenyawaan yang belum diketahui jenisnya
(Van Veen 1965 diacu dalam Suwandi 1988). Sedangkan bau khas ini
disebabkan oleh tingginya kandungan asam amino nitrogen
(Amano 1962 diacu dalam Suwandi 1988).
Konsistensi masir disebabkan oleh kandungan asam lemak ikan yang
tinggi dan oleh aktivitas enzim proteolitik yang secara alami ada pada daging
ikan dan saluran pencernaan (Amano 1962 diacu dalam Suwandi 1988).
Sedangkan warna merah pada peda disebabkan oleh interaksi antara gugus
karbonil yang berasal dari oksidasi lemak dengan gugus amino dari protein
Muchtadi et al. (1976) mengatakan bahwa mutu peda dipengaruhi oleh jenis ikan yang digunakan dan dari cara pengolahannya, sedangkan ketahanan
simpannya tergantung pada mutu peda yang dihasilkan dan cara penyimpanannya.
2.2.3. Kerusakan produk fermentasi
Produk-produk fermentasi ikan dapat mengalami kerusakan jika proses
yang terjadi tidak tepat dan suhu penyimpanan terlalu tinggi. Penyerapan garam
yang tidak baik ke dalam daging ikan dapat mengakibatkan kebusukan oleh
bakteri gram negatif. Jika kadar garam cukup tinggi tetapi kondisi sanitasi
kurang baik atau bahan baku ikan yang digunakan bermutu rendah,
kemungkinan tumbuh mikroorganisme yang bersifat halofilik, misalnya bakteri
halofilik yang membentuk pigmen merah muda dan kapang halofilik
(Farber 1965 dan Egan et al. 1981 diacu dalam Suwandi 1988).
Bakteri halofilik yang menyebabkan kebusukan tersebut bersifat
proteolitik aktif, mempunyai suhu optimum pertumbuhan 35-40ºC dengan kisaran
suhu pertumbuhan 5-50ºC dan dapat tumbuh dengan baik pada kisaran
pH 6,0-10,0. Bakteri ini bersifat halofilik obligat, yaitu memerlukan konsentrasi
garam yang tinggi untuk pertumbuhan, dan dapat tumbuh dengan baik pada
larutan garam jenuh, dan memproduksi hidrogen sulfida dan indol sebagai hasil
pemecahan protein. Kebusukan oleh bakteri halofilik dapat dicegah dengan cara
menurunkan aw produk sampai 0,70, atau dengan menambahkan asam sorbat
sebanyak 0,3 % (Hobbs dan Hodgkiss 1982 diacu dalam Rahayu et al. 1992). Kapang halofilik tidak menguraikan komponen ikan atau memproduksi
bau busuk, tetapi jika tumbuh pada produk fermentasi dapat menimbulkan
penampakan ikan yang tidak disenangi dan menurunkan mutu ikan. Pencegahan
pertumbuhan kapang halofilik dapat dilakukan dengan cara penyimpanan pada
suhu rendah atau pencelupan di dalam larutan asam sorbat sebelum dilakukan
fermentasi (Hobbs dan Hodgkiss 1982 diacu dalam Rahayu et al. 1992).
2.3. Isolasi dan Karakterisasi Bakteri pada Produk Fermentasi
Isolasi adalah pemisahan mikroba tertentu dari populasi campuran. Ada
lima cara untuk melakukan isolasi yaitu isolasi dengan agar cawan, media cair,
isolasi dengan biakan dua anggota, isolasi sel tunggal dan penggunaan media
gores dan metode tuang. Isolasi ini dilakukan pada mikroba yang dapat
membentuk koloni yang mudah terpisah pada media padat seperti kebanyakan
bakteri, khamir, kebanyakan jamur dan alga uniseluler (Rehm dan Reed 1981).
Isolasi media cair digunakan untuk beberapa bakteri besar, sebagian
protozoa, dan alga hanya tumbuh pada media yang cair. Prosedur isolasi media
cair menggunakan metode pengenceran. Biakan dua anggota digunakan jika
biakan murni tidak dapat diperoleh atau sulit untuk diperoleh sehingga tidak
praktis untuk dilakukan. Isolasi sel tunggal dilakukan jika teknik isolasi dengan
agar cawan dan media cair tidak dapat digunakan. Penggunaan media selektif
dapat digunakan untuk memperoleh mikroba dari alam dengan memanfaatkan
isolasi langsung atau dengan biakan diperkaya (Rehm dan Reed 1981).
Penggunaan media khusus bersifat memberi kemudahan bagi tumbuhnya
galur mikroba tertentu yang dikehendaki saja dan dapat menghalangi tumbuhnya
galur lain yang tidak dikehendaki. Namun cara ini masih memungkinkan
tumbuhnya galur yang lain dengan sifat hampir bersamaan, akan lebih baik bila
dilanjutkan dengan pengenceran sehingga hasilnya akan lebih meyakinkan
terutama dalam hal kemurniannya (Judoamidjojo et al. 1990).
Isolasi paling banyak dilakukan dengan cara memisahkan sel-sel individu
di dalam atau pada medium nutrien padat, dengan menggunakan metode cawan
gores atau cawan tuang. Namun demikian, diperolehnya satu koloni tunggal tidak
selalu menjamin kemurniannya, karena koloni dapat terbentuk tidak hanya dari
sel-sel individu tetapi juga dari sekumpulan sel. Dalam hal penghasil lendir,
kontaminasi seringkali melekat pada lendir tersebut; dalam hal spesies Bacillus atau aktomisetes, kontaminasi dapat terperangkap di dalam rantai atau filamen
yang dibentuk oleh organisme-organisme ini. Yang paling baik adalah
menggunakan medium non selektif untuk pemurnian karena kemungkinan besar
kontaminan lebih cepat tumbuh dam lebih mudah dikenali pada medium semacam
ini. Meskipun dengan medium nonselektif, sebaiknya jangan terlalu cepat
“mengambil” dan mensubkulturkan koloni, karena kontaminan yang tumbuhnya
lambat mungkin ada tetapi masih belum muncul (Hadioetomo 1988).
Biakan murni harus menghasilkan koloni-koloni yang tampak serupa satu
menampakkan sel-sel yang cukup serupa satu sama lain dalam hal penampilannya,
terutama diameter sel dan reaksi Gram (Hadioetomo 1988).
Karakterisasi merupakan tahap pendahuluan yang penting sebelum
identifikasi. Karakterisasi merupakan dasar dalam identifikasi mikroba secara
sistematik yang terdiri dari tiga tahap penting yaitu: a) klasifikasi:
mengelompokkan mikroorganisme ke dalam grup, b) nomenklatur: menetapkan
nama ilmiah internasional yang tepat terhadap organisme dan c) identifikasi
penetapan organisme ke dalam klasifikasi (a) yang diberi nama sesuai nomor (b)
(Fardiaz 1988).
Pada proses fermentasi peda, mikroba yang berperan selama fermentasi
adalah mikroba yang berasal dari ikan itu sendiri atau berasal dari garam yang
ditambah. Mikroba yang terdapat pada bahan baku ikan adalah mikroba yang
berasal dari permukaan kulitnya atau berasal dari dalam insang atau perut ikan.
Seperti diketahui bahwa dipermukaan tubuh ikan banyak dijumpai mikroba
Pseudomonas, Achromobacter, Micrococcus, Flavobacterium, Corynebacterium, Sarcina, Vibrio dan Bacillus. Pada perut ikan telah ditemukan bakteri jenis Achromobacter, Pseudomonas, Flavobacterium, Vibrio, Bacillus, Clostridium dan Escherichia. Bakteri-bakteri ini umumnya bersifat fakultatif anaerob dan beberapa diantaranya bersifat obligat anaerob (Frazier 1967).
Ikan kembung yang banyak digunakan untuk pembuatan ikan peda adalah
ikan yang berasal dari laut. Mikroflora yang ditemukan pada sisik, insang dan
ususnya terutama adalah bakteri Gram negatif, tidak membentuk spora, berbentuk
batang atau koki. Mikroba-mikroba tersebut antara lain adalah Pseudomonas, Vibrio, Maraxella, Acinetobacter dan Flavobacterium (Rahayu et al. 1992).
Pada saat fermentasi hanya mikroba yang bersifat halotoleran dan
halofilik dari jenis bakteri, kapang dan khamir yang akan hidup. Pada
umumnya mikroba yang akan tumbuh dan berkembang biak pada proses
penggaraman ikan adalah jenis Micrococcus, Bacillus dan Sarcina (Hobbs dan Hodgkiss 1982 diacu dalam Rahayu et al. 1992). Dalam
aktivitasnya, mikroba-mikroba tersebut dapat berperan sehingga dihasilkan cita
rasa yang khas. Pada peda, bakteri yang berperanan dalam pembentukan cita rasa
dan dapat tumbuh dalam kondisi aerobik maupun anaerobik (Rahayu et al. 1992). Bakteri yang bertanggung jawab terhadap pembentukan citarasa khas yang
dihasilkan produk tersebut adalah Staphylococcus sp. (Sjafi’i 1988).
Staphylococcus sp. merupakan bakteri berbentuk bulat yang terdapat dalam bentuk tunggal, berpasangan, tetrad, atau berkelompok seperti buah anggur
dan berdiameter 0,5-1,5 µm. Termasuk kedalam gram positif, non motil dan
tidak berspora. Anaerobik fakultatif, kemoorganotropik, dengan metabolisme
respirasi dan fermentasi. Koloni biasanya berwarna abu-abu, putih ataupun krem
dan kadang-kadang kuning hingga jingga. Umumnya katalase positif, terdapat
sitokrom tapi biasanya oksidase negatif. Nitrat kadang direduksi menjadi nitrit
dan biasanya tumbuh dengan konsentrasi NaCl 10 %. Temperatur pertumbuhan
optimumnya adalah 30-37ºC. Biasanya berasosiasi dengan kulit dan membran
selaput lendir pada vertebrata berdarah panas tapi sering terisolasi dari produk
makanan, debu dan air. Beberapa spesies bersifat patogen bagi manusia dan
hewan atau memproduksi toksin ekstraselullar (Holt et al. 1994).
Bakteri yang bersifat Gram positif berbentuk batang, dapat menghasilkan
asam organik yang khas, sedangkan bakteri Gram negatif berbentuk batang
agak bulat bersifat non motil dapat memproduksi bau yang merangsang dan
bakteri gram positif berbentuk batang panjang dapat memproduksi aroma
hasil degradasi asam amino (FAO 1971 diacu dalam Rahayu et al. 1992).
Hasil isolasi yang dilakukan terhadap ikan peda yang berasal dari daerah
Bogor menunjukkan adanya bakteri yang membentuk pigmen merah atau orange.
Bakteri-bakteri ini terutama dari jenis Gram positif berbentuk koki, bersifat non
motil, hidup secara aerob atau fakultatif anaerob, bersifat katalase positif serta
mempunyai sifat proteolitik. Bakteri tersebut bersifat indol negatif dan oksidase
negatif, beberapa diantaranya dapat mereduksi nitrat dan dapat menggunakan
sitrat sebagai sumber karbon untuk hidupnya. Bila dilihat dari sifat
pertumbuhannya, bakteri ini bersifat mesofilik dengan pH medium 6-8.
Sedangkan bila ditinjau dari pengaruh garam terhadap pertumbuhannya maka
bakteri tersebut tergolong dalam bakteri halotoleran hingga bakteri halofilik
3. METODOLOGI
3.1. Waktu dan Tempat Penelitian
Penelitian ini dimulai pada bulan Maret sampai dengan Juni 2006,
dilaksanakan di Laboratorium Mikrobiologi Hasil Perairan, Departemen
Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan; Laboratorium
Kimia Pangan, Departemen Ilmu dan Teknologi Pangan, Fakultas Teknologi
Pertanian dan Laboratorium Bakteriologi, Fakultas Kedokteran Hewan,
Institut Pertanian Bogor.
3.2. Alat dan Bahan
Peralatan yang digunakan pada penelitian ini adalah cawan petri, tabung
reaksi, tabung durham, pipet mohr ukuran 10 ml dan 1 ml, erlenmeyer, gelas
piala, gelas ukur, vortex, beaker glass, gelas objek, gelas penutup, sudip, ose, bunsen, autoklaf, inkubator, hot plate, mortar, mikroskop cahaya, timbangan analitik dan timbangan kasar, pH meter, lemari es, penangas air dan alat bantu
lainnya.
Sampel yang digunakan dalam penelitian ini adalah peda merah dari ikan
kembung perempuan (Rastrelliger neglectus) yang diperoleh dari pasar Lawang Seketeng Bogor. Ikan peda tersebut merupakan hasil produksi dari pengolah ikan
peda di daerah Indramayu dan produk tersebut telah mengalami proses fermentasi
dan penyimpanan ± 2 bulan.
Medium yang digunakan terdiri dari medium padat dan medium cair.
Medium padat yang digunakan meliputi Nutrient Agar (NA), Starch Agar (SA), Skim Milk Agar (SMA), Baird-Parker Agar (BPA), Trypticase Soy Agar (TSA) dan Triple Sugar Iron Agar (TSIA). Medium cair yang digunakan meliputi Nutrient Broth (NB), Nitrat Broth, Tryptone Broth, Brain Heart Infusion Broth (BHI) dan Manitol Broth.
Bahan kimia yang digunakan adalah NaCl, Tryptone, NaOH, larutan iodium, asam sulfanilat, dimetil-alpha-naftilamin, pereaksi kovac’s, plasma
kelinci, egg yolk steril, yeast extract, glukosa, bromocresol blue, 40 % KOH,
H2O2 3 %, kristal violet, lugol, alkohol, safranin, lemak (mentega), neutral red,
NaCl 0,85 % (garam fisiologis), spirtus, parafin, dan minyak imersi. Bahan-bahan
pembantu lainnya adalah kapas, aluminium foil, kertas serap (tissue).
3.3. Metode Penelitian
Metode penelitian ini dilakukan dalam 3 tahap yaitu analisis bahan, isolasi
bakteri dari ikan peda merah dan karakterisasi isolat bakteri yang diperoleh dari
isolasi.
3.3.1. Analisis bahan
Analisis bahan ini dilakukan untuk mengetahui kondisi fisik dan
karakteristik bahan sebelum dilakukan tahap selanjutnya. Analisis bahan ini
meliputi pengukuran kadar garam, derajat keasaman (pH) dan perhitungan Total Plate Count (TPC). Hasil pengukuran kadar garam dan pH ini digunakan sebagai acuan untuk membuat medium isolasi bakteri.
3.3.2. Isolasi bakteri dari ikan peda merah
Isolasi dan pemurnian bakteri dilakukan dengan tujuan memperoleh isolat
bakteri murni dari sampel sehingga dapat dilakukan uji-uji selanjutnya untuk
mengetahui karakteristiknya. Isolasi bakteri ini dilakukan dengan menggunakan
metode agar cawan dengan goresan kuadran. Tahap awal isolasinya dilakukan
pengamatan terhadap morfologi koloni dan sel sedangkan disetiap tahap isolasi
hanya dilakukan pengamatan morfologi sel untuk mengetahui tingkat kemurnian
isolat yang diperoleh .
3.3.3. Karakterisasi isolat bakteri
Karakterisasi bakteri ini dilakukan dengan tujuan untuk mengetahui
sifat-sifat morfologi dan fisiologi dari isolat bakteri yang diperoleh dari sampel.
Karakterisasi bakteri ini meliputi pengamatan sifat morfologi dan sifat fisiologi.
Sifat morfologi yang diamati adalah morfologi sel, sedangkan pengamatan sifat
fisiologi bakteri dilakukan dengan uji hidrolisis pati, uji hidrolisis protein, uji
hidrolisis lemak, uji reduksi nitrat, uji katalase, uji oksidase, uji indol, uji H2S, uji
fermentasi gula, uji oksidasif-fermentatif Baird Parker, uji kualitatif untuk
3.4. Prosedur Analisis
Prosedur analisis yang dilakukan berdasarkan tahap-tahap metode
penelitian adalah meliputi pengukuran kadar garam dan pH sampel, perhitungan
Total Plate Count (TPC), isolasi bakteri dari ikan peda merah, uji sifat morfologi dan uji sifat fisiologi.
3.4.1. Pengukuran kadar garam sampel (AOAC 1995)
Sampel uji diabukan setelah sebelumnya ditimbang sebanyak 2 gram,
kemudian sampel yang telah diabukan dalam cawan porselen ditambahkan
akuades sampai tiga seperempat cawan. Abu dalam cawan porselen diaduk-aduk
kemudian cairan tersebut ditempatkan ke dalam labu takar 100 ml dan
ditambahkan akuades sampai tanda tera. Selanjutnya dari labu takar dipipet
sebanyak 10 ml dan dimasukan ke dalam gelas piala 100 ml dan ditambahkan
K2CrO4 (kalium kromat) 2-3 tetes. Ke dalam buret dimasukkan larutan perak
nitrat 0,2 N. Kemudian campuran larutan sampel dalam beaker glass dititrasi dengan perak nitrat sampai terbentuk endapan putih (Ag2CrO4) atau berubah
warna menjadi jingga. Pengukuran kadar garam ini dilakukan secara duplo.
Perhitungan % NaCl adalah sebagai berikut:
% NaCl = 3 3 58,4 X100%
contoh mg
X fp X NAgNO X
VolumeAgNO
Volume AgNO3 adalah jumlah perak nitrat yang dibutuhkan dalam titrasi dan
Normalitas AgNO3 adalah 0,2
3.4.2. Pengukuran derajat keasaman (pH) sampel (AOAC 1995)
Sampel dalam wadah diukur pH-nya dengan menggunakan pH meter.
Sebelum digunakan, pH meter dikalibrasi dengan menggunakan larutan buffer
pH 4,31 dan 6,86. Sampel ditimbang sebanyak 1 gram yang ditambahkan 10 ml
akuades lalu diblender sehingga diperoleh larutan yang homogen. Setelah itu
sampel diukur pH-nya dengan menggunakan pH meter. Nilai pH diperoleh dari
hasil pembacaan pada skala pH meter saat angka digital menunjukkan nilai pH
3.4.3. Perhitungan nilai Total Plate Count (Fardiaz 1992)
Perhitungan nilai TPC digunakan untuk mengetahui mutu suatu bahan
pangan. Koloni yang tumbuh dapat juga digunakan untuk isolasi serta identifikasi
bakteri karena koloni yang terbentuk mungkin berasal dari suatu bakteri yang
mempunyai penampakan pertumbuhan spesifik.
Sampel ikan peda dihancurkan dalam mortar porselen untuk mendapatkan
kondisi sampel yang homogen. Selanjutnya sampel sebanyak 10 gram
dimasukkan ke dalam 90 ml larutan pengencer steril secara aseptis untuk
mendapatkan pengenceran 10-1. Untuk pengenceran 10-2 diambil 1 ml suspensi
contoh dari tabung pengencer 10-1 dan dimasukkan ke dalam tabung pengencer
yang lain yang berisi 9 ml larutan pengencer, kemudian sampel dikocok sampai
homogen. Hal yang sama dilakukan sampai mendapatkan pengenceran 10-5.
Cara pemupukan dalam metode hitungan cawan dilakukan dengan metode
tuang (pour plate). Dari setiap tingkat pengenceran, masing-masing diambil 1 ml suspensi sampel yang dimasukkan ke dalam cawan petri. Kemudian ke dalam
cawan petri ditambahkan medium Nutrien Agar (NA) yang telah steril sebanyak 15-20 ml dan digoyangkan supaya sampel menyebar rata. Medium NA yang
digunakan untuk menumbuhkan bakteri ini telah ditambahkan garam
(NaCl murni) yang sesuai dengan kadar garam yang terkandung di dalam sampel.
Setelah itu cawan petri diinkubasikan pada suhu kamar selama dua hari. Koloni
yang tumbuh diamati dan dihitung jumlahnya untuk mendapatkan nilai
Total Plate Count (TPC). Cara perhitungan TPC adalah sebagai berikut:
TPC (koloni/ml) = Jumlah koloni per cawan x
n pengencera faktor
1
3.4.4. Isolasi bakteri dari sampel (Fardiaz 1988)
Isolasi dan pemurnian bakteri bertujuan memisahkan koloni-koloni
bakteri yang masih tercampur hingga diperoleh suatu isolat murni. Pada tahap
pemurnian koloni bakteri yang dianggap terpisah dipisahkan dengan cara
penggoresan kuadran.
Berdasarkan hasil pengamatan setelah tahap perhitungan TPC, koloni
bakteri yang tampak berbeda dari koloni yang dominan masing-masing diambil
yang berbentuk agar miring, sebelumnya dilakukan pengamatan terhadap
morfologi koloni terpilih (bentuk, tepian, elevasi dan warna). Kultur bakteri
bakteri tersebut diinkubasi selama dua hari pada suhu kamar (30ºC).
Isolasi atau pemurnian dilakukan pada agar cawan dengan menggunakan
metode goresan kuadran. Kultur bakteri di dalam agar miring yang diperoleh
setelah dilakukan uji morfologi sel (pewarnaan Gram, spora dan bentuk sel)
digoreskan secara kuadran ke medium NA padat steril kemudian diinkubasi
selama dua hari. Dengan metode goresan kuadran ini diharapkan akan diperoleh
koloni terpisah kemudian dilakukan pengkulturan koloni terpilih pada agar
miring. Selanjutnya, tabung diinkubasi pada suhu kamar selama dua hari dan
dilakukan uji morfologi sel (pewarnaan Gram, spora dan bentuk sel) kembali.
Isolasi dan pemurnian ini dilakukan beberapa kali sampai didapat isolat yang
benar-benar murni
Setelah didapatkan koloni yang benar-benar terpisah, biakan murni
tersebut ditumbuhkan atau disimpan dalam agar miring dan disegarkan secara
berkala (1 minggu sekali).
3.4.5. Uji sifat morfologi
Untuk mengetahui sifat-sifat morfologi dari isolat bakteri yang diperoleh
dilakukan pengamatan morfologi koloni dan morfologi selnya.
a) Morfologi koloni
Pengamatan morfologi koloni dilakukan untuk mengetahui bentuk koloni
dari atas, bentuk tepi, bentuk elevasi dan warna koloni secara visual (Lampiran 1).
b) Morfologi sel
Uji morfologi sel meliputi pengamatan bentuk sel, pewarnaan Gram,
pewarnaan spora dan uji pergerakan bakteri atau motilitas.
Prosedur penyiapan olesan bakteri (preparat bakteri) yang baik merupakan
syarat untuk melakukan pewarnaan, baik pewarnaan Gram maupun spora.
Langkah pertama yaitu satu sampai dua mata ose air steril atau air suling
diletakkan pada gelas obyek, lalu diambil satu sampai dua mata ose biakan bakteri
kemudian dihomogenkan. Kemudian olesan dibiarkan kering oleh udara dan
(1) Bentuk sel
Berdasarkan hasil preparat bakteri yang telah dibuat diamati bentuk selnya
secara mikroskopik sehingga dapat diketahui bentuknya (kokus, batang atau
spiral).
(2) Pewarnaan Gram (Fardiaz 1989)
Pewarnaan Gram pada bakteri dilakukan dengan cara mengamati sel-sel
bakteri yang telah mati dan diwarnai. Dengan cara tersebut, bentuk sel akan
menjadi lebih jelas karena warna sel dibuat kontras dengan medium
disekelilingnya sehingga lebih mudah dilihat dibawah mikroskop. Bakteri yang
mempunyai sel dengan ukuran relatif kecil akan mudah dilihat. Pada pewarnaan
Gram diperlukan empat jenis larutan yaitu zat warna basa (kristal violet), larutan
iodium (lugol), alkohol dan safranin.
Preparat bakteri ditetesi dengan pewarna kristal violet dan dibiarkan
selama satu menit, kemudian dibilas dengan air. Selanjutnya preparat ditetesi
dengan larutan lugol dan dibiarkan selama satu menit, dicuci dengan air dan
dihilangkan warnanya menggunakan alkohol 96 % selama 10-20 detik atau
sampai warna ungu tidak luntur lagi. Setelah dicuci sebentar kemudian diwarnai
dengan larutan safranin dan dibiarkan selama 10-20 detik lalu dibilas dengan air,
kemudian dikeringkan dan diperiksa di bawah mikroskop menggunakan minyak
imersi dan diamati bentuk sel serta reaksi Gram.
Sel-sel bakteri yang tidak dapat melepaskan warna akan tetap berwarna
seperti warna violet kristal yaitu biru ungu disebut bakteri Gram positif. Sel-sel
bakteri yang dapat melepaskan violet kristal dan mengikat safranin sehingga
berwarna merah atau merah muda disebut bakteri Gram negatif. Tahap-tahap
Preparat bakteri pada gelas obyek
Ditetesi pewarna kristal violet, dibiarkan (1 menit), dibilas dengan air
Ditetesi larutan lugol (1 menit), dibilas dengan air
Ditetesi alkohol 96 % (10-20 detik) atau sampai warna ungu tidak luntur lagi, dibilas dengan air
Ditetesi safranin dan dibiarkan selama 10-20 detik
Dibilas dengan air dan dikeringkan
Diperiksa di bawah mikroskop dan diamati bentuk sel dan reaksi Gram
Gambar 2. Tahap-tahap pewarnaan Gram
(3) Pewarnaan spora (Hadioetomo 1985)
Pewarnaan spora merupakan pewarnaan yang bertujuan melihat adanya
suatu struktur di dalam sel bakteri yang disebut endospora. Jika sel semakin tua,
maka sel vegetatif akan pecah sehingga endospora akan terlepas menjadi spora
bebas. Berbeda dengan sel vegetatif, spora akan lebih tahan lama dalam keadaan
lingkungan yang ekstrim.
Pada prinsipnya pewarnaan ini digunakan untuk membedakan spora dari
sel vegetatif. Zat warna yang biasa digunakan adalah malachite green dan safranin.
Mula-mula pewarna hijau malachit diteteskan di atas preparat bakteri dan
dibiarkan hingga kering dengan pemanasan. Setelah kering, preparat dicuci
hati-hati dengan air selama 20-30 detik kemudian diberi safranin dan dibiarkan selama
30 detik, dibilas dengan air dan dikeringkan dengan kertas serap. Sel kemudian
diperiksa di bawah mikroskop dengan menggunakan minyak imersi. Endospora
biru, sedangkan sel vegetatif akan berwarna merah sampai merah muda.
Tahap-tahap pewarnaan spora dapat dilihat pada Gambar 3.
Preparat bakteri pada gelas obyek
Ditetesi pewarna hijau malachit dan dibiarkan hingga kering dengan pemanasan
Dicuci hati-hati dengan air selama 20-30 detik
Ditetesi safranin dan dibiarkan selama 30 detik
Dibilas dengan air dan dikeringkan
Diperiksa di bawah mikroskop dengan minyak imersi
Gambar 3. Tahap-tahap pewarnaan spora
(4) Uji pergerakan bakteri atau motilitas (Fardiaz 1989)
Uji motilitas merupakan uji yang digunakan untuk melihat sifat
pergerakan bakteri yang dapat dilihat dengan pergerakan selnya. Sifat pergerakan
ini biasanya ditandai dengan pertumbuhan yang menyebar atau tidak.
Pengujian ini dilakukan dengan cara sebagai berikut: secara aseptis
menggunakan ose yang lurus bagian ujungnya, isolat bakteri ditusukkan ke dalam
Nutrient Broth yang mengandung agar 0,5 % (agar lunak). Selanjutnya
diinkubasikan pada suhu 35ºC selama dua hari. Bila pertumbuhan menyebar,
maka bakteri tersebut bergerak atau motil, dan bila pertumbuhan bakteri tidak
menyebar, hanya berupa garis saja, maka bakteri tersebut bersifat tidak bergerak
(non motil).
3.4.6. Uji sifat fisiologi
Uji sifat-sifat fisiologi meliputi uji hidrolisis pati, uji hidrolisis protein, uji
hidrolisis lemak, uji reduksi nitrat, uji indol, uji fermentasi gula, uji katalase, uji
oksidase, uji H2S, uji oksidatif-fermentatif Baird-Parker, uji kualitatif untuk
Staphylococcus, uji koagulase, uji manitol dan pendugaan jenis bakteri. a) Uji hidrolisis pati (Lay 1994)
Pengujian hidrolisis pati bertujuan untuk mengetahui kemampuan bakteri
yang lebih sederhana. Pengujian ini dilakukan karena banyak bakteri yang
mempunyai kemampuan untuk menghidrolisis pati.
Isolat yang akan diuji digoreskan pada setengah bagian cawan yang berisi
medium Starch Agar (SA), dan diinkubasikan pada suhu 30ºC selama dua hari. Pengamatan pada isolat yang diuji dilakukan dengan cara meneteskan larutan
iodium pada koloni yang tumbuh. Uji aktivitas hidrolisis pati ini dikatakan
positif jika tidak terbentuk warna biru sewaktu penambahan larutan iodium ke
dalam media.
b) Uji hidrolisis protein (Fardiaz 1989)
Pengujian hidrolisis protein bertujuan untuk mengetahui adanya enzim
proteinase ekstraseluler pada bakteri, yang dapat memecah protein menjadi
senyawa-senyawa yang lebih sederhana seperti peptida dan asam amino.
Isolat yang akan diuji digoreskan pada setengah bagian cawan yang berisi
Skim Milk Agar (SMA). Inkubasi dilakukan pada suhu 30ºC selama dua hari. Uji dikatakan positif jika terbentuk areal bening disekeliling koloni.
c) Uji hidrolisis lemak (Fardiaz 1989)
Pengujian hidrolisis lemak bertujuan untuk mengetahui adanya enzim
lipase pada bakteri. Enzim ini juga merupakan enzim ekstraseluler dan tergolong
dalam kelompok esterase, yaitu enzim yang mampu menghidrolisis substansi yang
mengandung ikatan ester. Enzim lipase akan memecah lemak menjadi asam lemak
dan gliserol.
Isolat yang akan diuji digoreskan pada setengah bagian cawan yang berisi
Nutrien Agar (NA) + 1% lemak + neutral red. Inkubasi dilakukan pada suhu 30ºC selama dua hari. Koloni yang dapat menghidrolisis lemak menjadi gliserol dan
asam lemak akan menyebabkan terbentuknya warna merah pada bagian bawah
koloni, dan hal ini menunjukkan uji aktivitas hidrolisis lemak positif.
d) Uji katalase (Fardiaz 1987)
Uji katalase digunakan untuk mengetahui adanya enzim katalase pada
bakteri, dimana enzim ini berperan dalam memecah hidrogen peroksida menjadi
air dan oksigen. Uji ini penting dilakukan untuk mengetahui sifat bakteri terhadap
Secara aseptis diambil satu ose kultur bakteri dari agar miring dan
dipindahkan pada gelas obyek. Kemudian diteteskan 1-3 tetes larutan H2O2 3 %.
Adanya enzim katalase ditandai dengan terbentuknya gelembung-gelembung kecil
oksigen yang terlihat seperti busa sabun.
e) Uji reduksi nitrat (Hadioetomo 1985)
Beberapa mikroorganisme mampu menggunakan molekul bukan oksigen
sebagi akseptor elektron terakhir. Nitrat yang direduksi menjadi nitrit oleh
mikroorganisme tertentu digunakan sebagai akseptor elektron terakhir.
Dalam uji reduksi nitrat, isolat yang akan diuji diinokulasikan ke dalam
Nitrat Broth. Setelah diinkubasi pada suhu 37ºC selama dua hari, masing-masing isolat yang akan diuji diberi tiga tetes larutan asam sulfanilat dan tiga tetes larutan
dimetil-alfa-naftilamin. Bila dalam isolat yang diuji terdapat nitrit, maka akan
segera terbentuk warna merah, berarti uji nitrit positif. Bila tidak jelas perubahan
warnanya, dapat ditambahkan sedikit serbuk seng kedalam tabung yang berisi
isolat yang diuji, dan bila terbentuk warna merah, berarti uji reduksi nitrat negatif,
sedangkan bila tidak terjadi perubahan warna berarti uji reduksi nitrat positif.
f) Uji indol (Hadioetomo 1985)
Uji indol digunakan untuk mengetahui adanya enzim triptofanase pada
bakteri, dimana enzim triptofanase ini dapat menghidrolisis asam amino triptofan
menjadi indol dan asam piruvat.
Dalam uji indol medium yang digunakan adalah medium Tryptone Broth semi padat. Isolat yang akan diuji diinokulasi ke dalam tabung reaksi yang berisi
Tryptone Broth semi padat dan diinkubasi pada suhu 35ºC selama dua hari. Setelah inkubasi, masing-masing tabung ditambahkan 0,5 ml pereaksi Kovac’s.
Uji ini dikatakan positif jika terbentuk warna merah yang menunjukkan adanya
indol dalam medium.
g) Uji fermentasi gula dan H2S (Fardiaz 1989)
Uji fermentasi gula dilakukan untuk mengetahui kemampuan bakteri untuk
memfermentasi gula-gula tertentu dengan menghasilkan asam dan atau gas.
Sedangkan uji H2S dilakukan untuk mengetahui kemampuan bakteri untuk
Dalam uji fermentasi gula digunakan medium Triple Sugar Iron Agar (TSIA). Isolat yang akan diuji diinokulasi pada agar miring TSIA dengan cara
membuat goresan pada agar miring dan menusukkannya pada bagian bawah agar.
Kemudian diinkubasi pada suhu 37ºC selama dua hari. Reaksi-reaksi yang terjadi
dapat diamati pada Tabel 3 dan 4.
Tabel 3. Reaksi-reaksi yang terjadi pada uji fermentasi gula
Bagian bawah agar Bagian atas agar
reaksi warna reaksi warna
Keterangan
Bagian bawah agar Bagian atas agar Keterangan
Agar pecah/terangkat keatas
h) Uji oksidase (Hadioetomo 1985)
Uji oksidase merupakan salah satu uji yang cukup penting dalam
karakterisasi bakteri. Uji oksidase berfungsi untuk menentukan oksidase sitokrom
yang biasanya terdapat pada mikroorganisme patogen.
Pada uji oksidase kultur bakteri ditumbuhkan pada medium
Trypticase Soy Agar (TSA) dan diinkubasi pada suhu 35ºC selama dua hari. Koloni yang tumbuh digenangi dengan pereaksi p-aminodimetil-anilin oksalat
1 %. Uji positif ditandai dengan berubahnya koloni menjadi merah muda lalu
merah tua, merah gelap dan akhirnya hitam.
i) Uji oksidasi-fermentatif Baird-Parker (Baird-Parker 1969 diacu dalam Minor dan Marth 1976)
Uji ini dilakukan untuk mengetahui metabolisme dari isolat bakteri yang
diuji dilakukan dengan cara oksidatif atau fermentatif terhadap karbohidrat yang