IDENTIFIKASI KOMPONEN TEMU IRENG (
Curcuma
aeruginosa
) DENGAN POLA SIDIK JARI KROMATOGRAFI
CAIR-SPEKTROSKOPI MASSA DAN KEMOMETRIK
DEWI ANGGRAINI SEPTANINGSIH
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Identifikasi Komponen Temu Ireng (Curcuma aeruginosa) dengan Pola Sidik Jari Kromatografi Cair-Spektroskopi Massa dan Kemometrik adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Mei 2015
Dewi Anggraini Septaningsih
RINGKASAN
DEWI ANGGRAINI SEPTANINGSIH. Identifikasi Komponen Temu Ireng (Curcuma aeruginosa) dengan Pola Sidik Jari Kromatografi Cair-Spektroskopi Massa dan Kemometrik. Dibimbing oleh LATIFAH K DARUSMAN dan FARIT MOCHAMAD AFENDI.
Temu ireng (Curcuma aeruginosa) dikenal sebagai komponen jamu dengan berbagai aktivitas biologis. Beberapa studi, temu ireng memiliki potensi sebagai antirematik, penyakit dalam, pembersih darah, antiinflamasi, penghambatan HIV, dan aktivitas antikanker. Karakteristik aktivitas biologis dalam tumbuhan sangat ditentukan oleh kandungan senyawa aktif kimia atau metabolit yang bekerja secara sinergis. Kromatografi cair-spektroskopi massa (KC-SM) salah satu teknik yang dapat digunakan dalam mengidentifikasi metabolit. Penelitian ini bertujuan mengidentifikasi kandungan metabolit temu ireng terkait aktivitas biologisnya sebagai antioksidan dan toksisitas dengan menggunakan sidik jari KC-SM yang dikombinasi dengan kemometrik.
Sampel temu ireng berasal dari tiga daerah penghasil jamu di pulau Jawa, Indonesia. Temu ireng dimaserasi dengan etanol dan ditentukan aktivitas antioksidannya menggunakan metode Cupric Reduction Antioxidant Capacity
(CUPRAC) serta toksisitasnya melalui Brine Shrimp Lethality Test (BSLT). Selanjutnya, sampel dianalisis dengan KC-SM dan dihasilkan data yang besar. Hasil analisis KC-SM bersama dengan hasil analisis aktivitas biologis diolah dengan metode kemometrik Principle Component Analysis (PCA) dan Partial Least Square (PLS).
Analisis profil metabolit dari seluruh sampel memberikan 175 senyawa dugaan dengan senyawa dominan berupa senyawaan seskuiterpena dari genus Curcuma. Dengan teknik PCA, profil metabolit ini dapat memilah sampel berdasarkan daerah asalnya. Interpretasi dengan teknik PLS menunjukan bahwa hubungan antara komposisi metabolit terhadap bioaktivitasnya bergantung pada keberadaan senyawa dengan massa ion 312.275 dan 248.149 yang keduanya memberikan potensi antioksidan dan toksisitas paling tinggi. Senyawa dengan massa ion 248.149 diduga sebagai senyawa 9-okso-neoprokurkumenol, 7α,11α ,-epoksi-5 -hidroksi-9-guaiaen-8-on, kurkumalakton A, atau kurkumalakton B, sedangkan senyawa dengan massa ion 312.275 diduga sebagai tetrahidro-bisdemetoksikurkumin.
SUMMARY
DEWI ANGGRAINI SEPTANINGSIH. Identification of Metabolites of Curcuma aeruginosawith Liquid Chromatography Mass Spectrometry (LC-MS) Fingerprint and Chemometrics. Supervised by LATIFAH K DARUSMAN and FARIT MOCHAMAD AFENDI.
Curcuma aeruginosa (temu ireng) is known as a component of herbal medicine with various biological activities. Many studies demonstrate that C. aeruginosa has the potential as an ingredient in herbal for internal diseases, blood cleanser, anti-inflammatory, HIV inhibitor, and anti-cancer. Biological activity characteristics of a plant are highly specified by the chemical active compounds or metabolites working in synergy. Liquid chromatography–mass spectroscopy (LC-MS) as one technique can used identifying metabolite compounds. This research identified the metabolites content of C.aeruginosa related to their biological activities through fingerprinting by using LC-MS continued with chemometric data processing.
Samples rhizomes of C. aeruginosa were collected from three regions producing herbs on the island of Java, Indonesia. C.aeruginosa was macerated with ethanol then the antioxidant activity and the toxicity was determined by using Cupric Reduction Antioxidant Capacity (CUPRAC) and Brine Shrimp Lethality Test (BSLT) respectively. Afterward, the samples were analyzed by LC-MS. The result of antioxidant activity and toxicity determination join with LC-MS analysis was processed by Principle Component Analysis (PCA) and Partial Least Square (PLS) methode.
The metabolites profiling of all samples gave 175 supossed compounds, with the mayor compounds are sesquiterpene of Curcuma genus. The metabolites profiles could sorted the samples based on their origin by using PCA. Interpretation with PLS showed that the correlation between metabolites profiles and their bioactivities depend on the presence of compounds with ion mass of 312.275 and 248.149, which gave the highest antioxidant and toxicity potentials. Compounds with ion mass 248.149 was supposed to be 9-oxo-neoprocurcumenol, 7α,11α,-epoxy-5 -hydroxy-9-guaiaen-8-one, curcumenolactone A, or curcumenolactone B, while compound with ion mass 312.275 was supposed to be tetrahydro-bisdemethoxycurcumin.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Kimia
IDENTIFIKASI KOMPONEN TEMU IRENG (
Curcuma
aeruginosa
) DENGAN POLA SIDIK JARI KROMATOGRAFI
CAIR-SPEKTROSKOPI MASSA DAN KEMOMETRIK
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
Judul Tesis : Identifikasi Komponen Temu Ireng (Curcuma aeruginosa) dengan Pola Sidik Jari Kromatografi Cair-Spektroskopi Massa dan Kemometrik
Nama : Dewi Anggraini Septaningsih NIM : G451120061
Disetujui oleh Komisi Pembimbing
Prof Dr Ir Latifah K. Darusman, MS Ketua
Dr Farit Mochamad Afendi, SSi. MSi Anggota
Diketahui oleh
Ketua Program Studi Kimia
Prof Dr Dyah Iswantini, MAgr
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
Tanggal Ujian: 20 April 2015
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Judul penelitian ini adalah Identifikasi Komponen Temu Ireng (Curcuma aeruginosa) dengan Pola Sidik Jari Kromatografi Cair-Spektroskopi Massa dan Kemometrik.
Terima kasih penulis ucapkan kepada Ibu Prof. Dr. Ir. Latifah K Darusman, MS dan Bapak Dr. Farit Mochamad Afendi, S.Si M.Si selaku pembimbing, serta Bapak Rudi Heryanto S.Si. M.Si yang telah banyak memberikan saran dan masukan. Selain itu, penghargaan penulis sampaikan kepada staf Pusat Studi Biofarmaka, dan Staf Laboratorium Kimia Analitik Departemen Kimia, Institut Pertanian Bogor yang telah membantu selama proses penelitian. Ungkapan terima kasih juga disampaikan kepada Ibu, Bapak, Suami serta seluruh keluarga dan teman-teman, atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Mei 2015
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 2
Ruang Lingkup Penelitian 3
2 TINJAUAN PUSTAKA 3
Temu Ireng 3
kromatografi Cair-Spektrometer Massa 4
Antioksidan 5
aktivitas Antioksidan dengan Metode CUPRAC 6
Aktivitas toksisitas 7
Kemometrik 8
Analisis Komponen Utama (PCA) 8
Partial Least Square (PLS) 9
3 METODE 10
Bahan 10
Alat 10
Prosedur Analisis Data 10
4 HASIL DAN PEMBAHASAN 13
Analisis Fitokimia, Kadar Air, dan Kadar Abu 13
Aktivitas Antioksidan dengan Metode CUPRAC 15
Aktivitas Toksisitas dengan BSLT 16
Pengelompokan Ekstrak Temu Ireng 17
Identifikasi Komponen Bioaktif Rimpang Temu Ireng 17 Pola Pengelompokan Metabolit dengan Kemometrik 20 Hubungan Komposisi Senyawa Metabolit Terhadap Uji Bioaktivitas 22
5 SIMPULAN DAN SARAN 24
Simpulan 24
Saran 24
DAFTAR PUSTAKA 29
LAMPIRAN 26
DAFTAR TABEL
1 Hasil kadar air, kadar abu, dan rendemen rimpang temu ireng 14
2 Hasil Uji fitokimia ekstrak temu ireng 15
3 Keragaman total analisis PCA pada ekstrak rimpang temu ireng 21 4 Parameter statistik untuk data analisis rimpang temu ireng dengan
model PLS 23
5 Identifikasi senyawa metabolit yang terhadap LC50 dan antioksidan 23
DAFTAR GAMBAR
1 Rimpang temu ireng 3
2 Reaksi reduksi bisneokuproin-tembaga(II) uji antioksidan dengan
Metode CUPRAC 7
3 Komponen utama dari peubah X1,X2, dan X3 9
4 Bagan prinsip PLS 10
5 Pemrosesan Data Kromatogram KC-SM 13
6 Aktivitas antioksidan ekstrak temu ireng 15
7 Aktivitas toksisitas ekstrak etanol rimpang temu ireng 16 8 Kromatogram KC-SM ekstrak etanol rimpang temu ireng 18 9 Kandungan komposisi metabolit dominan dalam ekstrak etanol rimpang
temu ireng 19
10 Struktur senyawa kimia dalam temu ireng 20
11 Plot skor analisis PCA ekstrak etanol rimpang temu ireng 21 12 Plot loading analisis PCA ekstrak etanol rimpang temu ireng 22
DAFTAR LAMPIRAN
1 Diagram alir penelitian 29
2 Kadar air simplisia rimpang temu ireng 30
3 Kadar abu simplisia rimpang temu ireng 31
4 Rendemen ekstrak etanol rimpang temu ireng 32
5 Aktivitas antioksidan ekstrak etanol rimpang temu ireng 33 6 Hasil uji toksisitas ekstrak etanol rimpang temu ireng 35 7 Hasil Uji Bioaktivitas antioksidan dan toksisitas temu ireng dan
pengelompokan sampel 36
8 Kromatogram ekstrak temu ireng daerah Cikabayan, Nagrak, dan
Tawangmangu 37
9 Identifikasi senyawa metabolit ekstrak etanol rimpang temu ireng 38 10 Hasil analisis metode PLS pada aktivitas antioksidan dan toksisitas
dengan 308 variabel massa ion 41
11 Hasil analisis metode PLS pada aktivitas antioksidan dan toksisitas
dengan 781 variabel massa ion 42
12 Hasil RMSE pada analisis PLS untuk aktivitas toksisitas dengan 308
13 Hasil RMSE pada analisis PLS untuk aktivitas toksisitas dengan 308
variabel 44
14 Hasil RMSE pada analisis PLS untuk aktivitas antioksidan dengan 781
variabel 45
15 Hasil RMSE pada analisis PLS untuk aktivitas toksisitas dengan 781
variabel 46
16 Plot Standardisasi koefisien Analisis PLS hubungan respon LC50
dengan m/z 47
17 Plot Standardisasi koefisien Analisis PLS hubungan respon antioksidan
1
PENDAHULUAN
Latar Belakang
Temu ireng merupakan tumbuhan yang rimpangnya dimanfaatkan sebagai campuran obat/ jamu. Dalam pengobatan tradisional, rimpang temu ireng digunakan sebagai ramuan jamu galian, antirematik, penyakit dalam, dan pembersih darah (Djauhariya dan Sufiani 2001). Pada penelitian Nurbara (2009), ekstrak etanol temu ireng dengan konsentrasi 20% secara in vitro cukup kuat untuk dikembangkan menjadi alternatif sebagai obat flu burung. Beberapa studi lain, temu ireng memiliki potensi sebagai antiinflamasi, penghambatan HIV, dan aktivitas anti kanker. Temu ireng mengandung minyak atsiri sebesar 0.52% yang terdiri dari β komponen utama α-guanien, kariofilen, dan 28 komponen minor (Sutaryo et al. 1996), saponin, flavonoid, dan polifenol (Syamsuhidayat S dan Hutapea J 1991), dan kurkumin (Nurbara 2009). Komponen zat aktif lain pada temu ireng yakni kurkumenol diduga berfungsi sebagai antiviral, antikonvulsan, dan anti karsinogenik.
Karakteristik aktivitas biologis dalam tanaman sangat ditentukan oleh kandungan senyawa aktif kimia atau metabolit yang bekerja secara sinergis (Liang
et al. 2009). Sebagai contoh, sifat antikanker dalam temu ireng yang menyebabkan terjadinya nekrosis hepatosit mencit diduga dipengaruhi senyawa 9-metiltetrasiklotetradekana; epikurzerenon; dan cis-1,3-dimetil-2-metilena sikloheksana (Hestiana et al. 2014). Oleh karena itu, konsistensi maupun inkonsistensi dalam tumbuhan obat dipengaruhi keragaman dan kadar metabolitnya. Keragaman metabolit yang terdapat dalam tanaman ini dapat dipengaruhi oleh kondisi pertumbuhan, jenis tanah, lingkungan budidaya, serta waktu panen dan ketinggian (Yi et al. 2007). Dengan meningkatnya permintaan konsistensi bioaktivitas dari suatu obat herbal, maka proses standarisasi/kontrol kualitas profil ekstrak tanaman diperlukan dengan menunjukan kadar 1 atau beberapa senyawa target atau bahkan senyawa untarget (Rohaeti et al. 2015; Wang et al. 2004). Identifikasi dan kuantifikasi molekul kecil metabolit yang ditargetkan dan untarget dapat dilakukan dengan pendekatan metabolomik (Wishart DS 2007; Patti G et al. 2012).
Identifikasi dalam studi metabolomik memberikan wawasan yang lebih luas akan komposisi kimia suatu tumbuhan pada kondisi tertentu. Umumnya teknik ini mengandalkan pemisahan metabolit dengan kromatografi gas (KG) atau kromatografi cair (KC) yang dikombinasi dengan spektrometer massa (SM) untuk menganalisis senyawa kompleks metabolit. Kromatografi cair adalah metode yang paling popular untuk analisis obat-obatan herbal karena mudah dipelajari dan penggunaannya tidak dibatasi oleh volatilitas atau stabilitas senyawa sampel. Teknik KC-SM tidak mengharuskan derivatisasi sampel untuk mengelompokan metabolit dan telah terbukti mendeteksi berbagai kelas metabolit (De vos et al.
2007). Profil metabolit KC-SM memisahkan komponen kimia individu menjadi puncak terpisah dan digunakan dalam mengungkap metabolit minor (Farag et al.
2
2013), senyawa ginsenoside pada akar Panax ginseng (Steenkamp et al. 2006), dan senyawa aktif pentasiklik triterpenoid pada Centella asiatica (James et al.
2013).
Analisis KC-SM menghasilkan spektrum atau kromatogram yang terdiri dari data yang besar. Untuk meringkas dan mengekstrak informasi dari data yang besar dapat menggunakan teknik pengenalan pola dalam kemometrika. Lebih jauh penggunaan kemometrik dapat digunakan dengan karateristik lain seperti kualitas atau aktivitas biologisnya. Evaluasi analisis KC-SM terkait aktivitasnya dapat menggunakan kemometrik dengan teknik Principle Component Analysis (PCA) dan Partial Least Square (PLS). Teknik PCA telah digunakan untuk pengelompokan dari Centella asiatica yang dipengaruhi senyawa Asiatic acid, asiaticoside, madecassic acid, dan masecassiside (James et al. 2013). Teknik PLS dapat digunakan untuk mengkorelasi aktivitas antioksidan dan perubahan metabolit dari fermentasi kedelai dengan analisis KC-SM (Kim et al. 2011). Adapun tujuan penelitian ini untuk mengidentifikasi metabolit bioaktif temu ireng dari tiga lokasi di Pulau Jawa sebagai sentra produksi jamu dengan KC-SM yang dikaitkan dengan aktivitas biologisnya. Aktivitas biologis yang ditentukan adalah aktivitas antioksidan dengan metode Cupric Reduction Antioxidant Capacity
(CUPRAC) dan toksisitas dengan metode Brine Shrimp Lethality Test (BSLT).
Perumusan Masalah
Perumusan masalah dalam tulisan ini adalah melihat potensi aktivitas biologis (antioksidan dan toksisitas) dari rimpang temu ireng.Potensi bioaktivitas dari temu ireng tersebut dapat diidentifikasi dari keberadaan senyawa aktif atau metabolit yang terkandung dalam sampel. Senyawa metabolitakan bekerja secara sinergis dapat menyebabkan meningkatkan atau menurunkan potensi bioaktivitas temu ireng. Keberadaan senyawa metabolit dapat diidentifikasi dengan cara penentuan sifat kimia dengan SM.Selain itu, seberapa jauh penggunaan KC-SM yang dikombinasi dengan kemomterik dalam mengolah data, sehingga dapat memberikan profil dari sampel temu ireng yang berpengaruh terhadap potensi bioaktivitas rimpang temu ireng.
Tujuan Penelitian
Tujuan penelitian ialah mengkaji dan menganalisis aktivitas antioksidan dan toksisitas pada temu ireng, mengkaji dan menganalisis metabolit pada temu ireng yang berpengaruh terhadap bioaktivitas, dan penggunaan KC-SM yang dikombinasi dengan teknik kemometrik diharapkan dapat memberikan informasi mengenai metabolit yang terkandung pada temu ireng.
Manfaat Penelitian
3 memberikan teknik kombinasi KC-SM dan kemometrik dalam menjelaskan informasi yang ada pada data. Interpretasi data KC-SM yang sulit untuk mengidentifikasi dapat dipermudah dengan penggunaan kemometrik. Teknik ini dapat menganalisis data yang besar dan mengolah data KC-SM sehingga dapat memberikan informasi dari data tersebut.
Ruang Lingkup Penelitian
Subyek penelitian ini adalah identifikasi senyawa aktif atau metabolit pada temu ireng dengan analisis KC-SM dan kemometrik. Obyek penelitian adalah sampel temu ireng dari pulau Jawa, Indonesia. Observasi dilakukan pada tiga sampel temu ireng dari tiga daerah penghasil jamu di pulau Jawa, Indonesia.
2
TINJAUAN PUSTAKA
Temu Ireng
Tanaman temu ireng merupakan tanaman yang termasuk kedalam jenis temu-temuan (Gambar 1).Tanaman temu hitam berasal dari Burma (Myanmar), yang kemudian menyebar ke daerah tropik lainnya seperti Kamboja dan Indonesia.Tanaman temu ireng juga mudah dikenali dari rimpangnya.Rimpang yang terbentuk pada umumnya memiliki aroma khas dengan bau yang agak menyengat.Baunya yang khas disebabkan oleh minyak atsiri yang terkandung didalam rimpangnya.
Temu ireng memiliki penamaan yang berbeda dari setiap daerah.Temu ireng merupakan istilah bagi penduduk di daerah Jawa Tengah dan Jawa Timur. Di daerah Jawa Barat temu hitam dikenal dengan istilah ‘koneng hideung’. Nama daerah lainnya mencakup ‘tamu hitam, temo ereng, tamu leteng’ dan ‘temu lotong’. Berikut merupakan sistematika tanaman temu hitam (Curcuma aeruginosa Roxb.).
Divisi : Spermatophyta Sub divisi : Angiospermae
4
Kelas : Monocotyledonae Ordo : Zingiberales Famili : Zingiberaceae
Genus : Curcuma
Jenis : Curcuma aeruginosa Roxb.
Temu ireng dimanfaatkan sebagai bahan baku ramuan pengobatan tradisional. Tanaman ini memiliki khasiat untuk mengobati beberapa penyakit seperti rematik, cacingan, luka menahun, dan pendarahan pada saat haid. Selain itu, rimpang temu ireng digunakan untuk ramuan jamu galian, penyakit dalam, dan pembersih darah (Djauhariya dan Sufiani 2001). Selain itu, ekstrak etanol temu ireng dengan konsentrasi 20% secara invitro cukup kuat untuk dikembangkan menjadi alternatif sebagai obat flu burung (Nurbara 2009). Beberapa studi menunjukan bahwa temu ireng memiliki potensi sebagai antiinflamasi, penghambatan HIV, dan aktivitas anti kanker. Selain bagian rimpang, daun temu hitam juga dimanfaatkan sebagai bahan baku pengobatan karena kandungan minyak esensialnya yang cukup tinggi. Rimpang temu ireng mengandung saponin, minyak atsiri, flavonoid, kurkuminoid, zat pahit, damar, lemak, mineral, minyak dan saponin. Temu ireng mengandung minyak atsiri sebesar 0.5β% yang terdiri dari β komponen utama α-guanien, kariofilen, dan 28 komponen minor (Sutaryo et al. 1996),saponin, flavonoid, dan polifenol (Syamsuhidayat S dan Hutapea J 1991), dan kurkumin (Nurbara 2009). Komponen zat aktif kurkumenol diduga memiliki fungsi sebagai antiviral, antikonvulsan, dan anti karsinogenik. Sifat antikanker dalam temu ireng yang menyebabkan terjadinya nekrosis hepatosit mencit diduga dipengaruhi senyawa 9-methyltetracyclo tetradecane; epicurzerenone; dan cis-1,3-dimethyl-2-methylene cyclohexane (Hestiana et al. 2014).
Kromatografi Cair-Spektrometer Massa (KC-SM)
Kromatografi Cair- Spektrometer Massa (KC-SM) merupakan teknik kimia yang menggabungkan pemisahan fisik kromatografi cair dengan kemampuan analisis bobot molekul senyawa yang terpisahkan.Penggunaan KC-SM berorientasi terhadap pendeteksian dan identifikasi potensi bahan kimia dalam keberadaan bahan kimia lainnya (senyawa yang kompleks). KC-SM dapat digunakan untuk dereplikasi bahan alam, skrining bioafinitas, skrining in vivo, stabilitas metabolit, identifikasi metabolit, identifikasi kemurnian suatu obat, identifikasi degradant, kualitas kontrol dan kuantitatif bioanalisis suatu obat (Khairan et al, 2009). Kelebihan kromatografi cair dibandingkan dengan jenis kromatografi lainadalah sensitivitasnya tinggi, dapat memisahkan senyawa yang tidak atsiri, analisisnya cepat, dapat memisahkan komponen dalam jumlah yang sedikit, memiliki daya pisah yang tinggi, kolom dapat digunakan kembali, dan dapat menganalisis molekul besar. KC-SM memiliki sensitivitas dan selektivitas yang tinggi. Kelebihan KC-SM dapat memberikan informasi massa dari semua senyawa hasil pemisahan dari sistem kromatografi.
5 metabolit dengan teknik spray. Molekul yang terdeteksi merupakan ion dalam bentuk tetesan (droplet) agar tidak saling menempel. Ion yang terdeteksi dapat berupa [M+H]+,[M-H]-, dan analit dengan tambahan seperti Na+, K+, H3O+, NH4+, dan molekul dari fase gerak, seperti asetonitril atau metanol (Ardrey, 2003). Sehingga tidak akan ditemukan fragmen –fragmen dari molekul tersebut.
Berbagai jenis penganalisa massa yang terdapat pada spektroskopi massa diantaranya Single Quadrupole, Triple Quadrupole, Ion Trap dan Quadrupole – Time Of Flight (QTOF). QTOF merupakan metode spektrometri massa di mana rasio massa terhadap muatan ion ditentukan melalui pengukuran waktu partikel mencapai detektor.QTOF-MS memungkinkan analisis MS/MS dan menyediakan massa akurat untuk kedua prekursor dan produk ion, yang merupakan identifikasi massa lebih teliti dibandingkan mass analyzer lain (Lacorte dan Alba 2006).Kemampuan mass analyzer QTOF dapat mendeteksi berat molekul sampai dengan 4 desimal, sehingga meskipun spektrum massa suatu komponen belum tersedia dalam database library, dapat dilakukan identifikasi dengan pendekatan rumus empiris berdasarkan pembacaan berat molekul secara akurat.
Hasil pemisahan dengan KC-SM disajikan dalam sidik jari kromatografi dan spektrum. Sidik jari yang dihasilkan pada obat herbal bersifat sangat khas. Sidik jari tersebut merepresentasikan senyawa aktif yang terdapat dalam obat herbal dan interaksi yang terjadi antar komponen aktif dengan fase gerak dan fase diam sehingga dapat menjadi pendekatan yang efektif karena menjelaskan karakteristik obat herbal secara komprehensif. Parameter yang diukur pada analisis sidik jari meliputi waktu retensi, luas puncak dan m/z.
KC-SM sangat umum digunakan dalam studi farmakokinetika terutama dalam hal pengembangan obat (Khairan et al. 2009). Penggunaan KC-SM sebagai kontrol kualitas bahan baku obat herbal telah dilakukan dengan analisis sidik jari KC-SM dengan senyawa ginsenosides (Xiaohui Fet al. 2006). Selain itu Bogusz
et al. (2006) menerapkan LC-ESI-MS-MS untuk mendeteksi adulterants sintetis dalam obat herbal. KC-SM telah digunakan untuk identifikasi senyawa atractyloside pada Callilepis laureola (Lee at al. 2013), ginsenoside pada akar
Panax ginseng (Steenkamp et al. 2006), dan senyawa aktif pentasiklik triterpenoid pada Centella asiatica (James et al. 2013). Kromatografi cair adalah metode yang paling popular untuk analisis obat-obatan herbal karena mudah dipelajari dan penggunaannya tidak diatasi oleh volatilitas atau stabilitas senyawa sampel. Teknik KC-SM tidak mengharuskan derivatisasi sampel untuk mengelompokan metabolit dan telah terbukti mendeteksi berbagai kelas metabolit (De vos et al.
2007). Profil metabolitKC-SMmemisahkan komponen kimia individu menjadi puncak terpisah, sehingga dapat digunakan dalam mengungkap metabolit minor (Farag et al. 2012).
Antioksidan
6
dengan aktivitas penangkapradikal bebas memiliki relevansi yang besar pada pencegahan dan pengobatanpenyakit yang berhubungan dengan oksidasi atau radikal bebas.
Berdasarkan sumbernya antioksidan digolongkan menjadi antioksidan sintetik dan antioksidan alami. Antioksidan sintetik yaitu butylated hdroxyanisol
(BHA), butylated hidroxytoluene (BHT), propil galat, tert-butil hidroxy quinon
(TBHQ) dan tokoferol (vitamin E). Sedangkan antioksidan alami yang paling umum adalah flavonoid (flavonol, isoflavonol, flavon, katekin dan flavonon), derivat asam sinamat, kumarin, dan asam organik polifungsional (Pratt 1992).
Berdasarkan mekanisme kerjanya, antioksidan dapat digolongkan menjadi tiga bagian, yaitu antioksidan primer, sekunder dan tersier. Antioksidan primer (pemecah rantai), yaitu antioksidan yang dapat bereaksi dengan radikal lipida lalu mengubahnya ke bentuk yang lebih stabil. Suatu molekul antioksidan dapat disebut sebagai antioksidan primer (AH), jika dapat mendonorkan atom hidrogennya secara cepat ke radikal lipida (RO˙) dan radikal turunan antioksidan tersebut (A˙)lebih stabil dibanding radikal lipida, atau mengubahnya ke bentuk yang lebih stabil (Gordon 1990). Beberapa contoh antioksidan primer adalah superoksida dismutase (SOD), butylated hdroxyanisol (BHA), butylated hidroxytoluene (BHT), dan tokoferol.
Antioksidan sekunder disebut juga antioksidan eksogeneus atau non enzimatis. Antioksidan dalam kelompok ini disebut pertahanan preventif. Sistem pertahanan ini, pembentukan senyawa oksigen relatif dihambat dengan cara pengkelatan metal, atau dirusak pembentukannya (Winarsi 2007). Antioksidan sekunder juga berfungsi memperlambat laju autooksidasi dengan berbagai mekanisme di luar mekanisme pemutusan rantai autooksidasi dengan pengubahan radikal lipida ke bentuk lebih stabil (Gordon 1990). Beberapa contoh antioksidan sekunder adalah asam askorbat (vitamin C), vitamin E, beta karoten, asam urat, bilirubin dan albumin, asam erithorbat (D-isomer asam askorbat) dan garam sodiumnya, dilauril tiopropionat (Winarno 2008).
Kelompok antioksidan tersier meliputi sistem enzim DNA-repair dan metionin sulfoksida reduktase.Enzim-enzim ini berfungsi dalam perbaikan biomolekuler yang rusak akibat reaktivitas radikal bebas. Kerusakan DNA yang terinduksi senyawa radikal bebas dicirikan oleh rusaknya single dan double strand,
baik gugus non basa maupun basa (Winarsi 2007).
Aktivitas Antioksidan dengan Metode CUPRAC
7
Aktivitas peredaman radikal bebas biasanya dinyatakan sebagai konsentrasi yang menyebabkan hilangnya 50% aktivitas radikal (IC50). Nilai IC50 dianggap sebagai ukuran yang baik dari efisiensi antioksidan senyawa-senyawa murni ataupun ekstrak.Tetapi dapat juga dinyatakan dengan koefisien TEAC (troloks equivalent antioxidant capacity). TEAC adalah konsentrasi troloks yang memiliki kapasitas antioksidan yang ekuivalen dengan sampel yang dianalisis. Penggunaan troloks sebagai standar, karena troloks merupakan antioksidan sintetik yang mempunyai aktivitas antioksidan lebih tinggi dibandingkan senyawa α-tokoferol, BHA, serta BHT (Belitz 1999).
Aktivitas Toksisitas
Uji toksisitas umumnya bertujuan menilai resiko yang mungkin ditimbulkan dari suatu zat kimia, menekan resiko bahaya yang terjadi, dan mengetahui potensi suatu tumbuhan sebagai obat. Uji ini juga bertujuan untuk menjamin keamanan bahan baku ekstrak yang digunakan. Hal ini dilakukan untuk menjamin obat herbal memiliki mutu yang terukur, terjaminnya keamanan serta terbebas dari bahan dan mikroba berbahaya (Nurani et al. 2014). Umumnya uji toksisitas dilakukan pada binatang, hewan bersel tunggal, atau sel kultur. Uji toksisitas adalah suatu uji untuk menentukan potensial suatu senyawa sebagai racun, mengenali kondisi biologis/lingkungan munculnya efek toksik dan mengkarakterisasi aksi/efek. Bila dianggap praktis uji toksisitas dapat menggunakan satu atau lebih spesies yang secara biologis memperlakukan suatu bahan.Selain itu dapat menggunakan beberapa tingkatan dosis, karena aksi/efek pada manusia dan hewan berkaitan dengan dosis, efek yang ditimbulkan pada tingkat dosis yang lebih tinggi bermanfaat untuk melukiskan kerja mekanisme aksi.
Nilai toksisitas merupakan sebuah parameter dalam mengindikasikan bahwa ekstrak tumbuhan mampu memberikan sifat toksik sebagai bahan baku biofarmaka. Uji toksisitas sangat penting dilakukan guna mengukur dan mengevaluasi karakteristik toksik dari suatu bahan kimia. Nilai ambang batas toksisitas yang diperkenankan dilihat dari nilai 50% kematian (LC50) yaitu kurang
8
dari 1000 ppm, artinya jika suatu ekstrak tumbuhan memiliki nilai LC50 lebih dari 1000 ppm maka tidak efektif dimanfaatkan sebagai bahan baku obat. Meyer (1982) mengemukakan bahwa suatu ekstrak bersifat toksik (bioaktif) dalam uji toksisitas jika dapat menyebabkan kematian hewan uji (larva Leach) sebanyak 50% pada konsentrasi kurang dari 1000 ppm.Sebagai contoh, ekstrak etanol
Curcuma xantorhiza (Nurcholis 2012) dan ekstrak methanol Curcuma longa (Aly
et al.2011)memiliki potensi tokssitas dengan LC50 dibawah 100 ppm. Kemometrik
Kemometrik adalah disiplin ilmu kimia yang menggunakan matematika, statistik, dan logika formal yang digunakan untuk merancang atau memilih prosedur eksperimental yang optimal, untuk memberikan informasikimia maksimum yang relevan dengan menganalisis data kimia, dan untuk memperoleh pengetahuan tentang suatu sistem kimia (Hopke 2003). Kemometrik menyediakan teknik untuk mengurangi data berukuran besar yang diperoleh dari instrumen seperti spektrofotometer (Varmuza 2002). Teknik kemometrik yang umum digunakan dalam analisis kimia adalah pengolahan data, pengelompokan suatu bahan, dan analisis kuantitaif. Kalibrasi multivariat merupakan salah satu bentuk teknik analisis kemometrik yang dapat digunakan untuk menentukan campuran dari beberapa senyawa. Teknik kalibrasi multivariat ini antara lain berupaprinciple component analysis (PCA) dan partial least square (PLS) (Brereton 2000).
Analisis Komponen Utama (PCA)
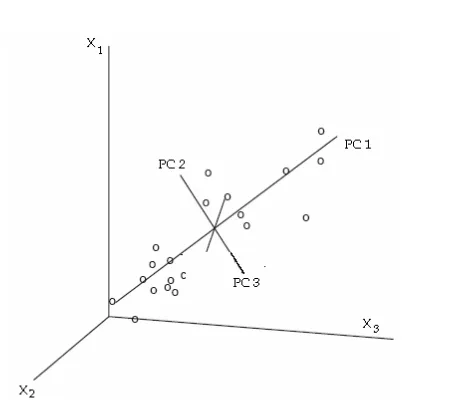
Principle Component Analysis (PCA) merupakan suatu teknik untuk mengurangi jumlah peubah dalam suatu matrik data. Prinsip PCA adalah mencari komponen utama/peubah baru yang merupakan kombinasi linear dari peubah asli.Analisis Komponen Utama biasanya digunakan untuk mengidentifikasi peubah baru yang mendasari data peubah ganda, mengurangi banyaknya dimensi himpunan peubah dan menghilangkan peubah-peubah asal yang mempunyai sumbangan informasi yang relatif kecil. Peubah baru /komponen utama mempunyai ciri kombinasi linier peubah-peubah asal, jumlah kuadrat koefisien dalam kombinasi linier tersebut berrnilai satu, tidak berkorelasi, dan mempunyai ragam berurut dari yang terbesar ke yang terkecil.Pemilihan komponen utama dilakukan sehingga komponen utama pertama memiliki variasi terbesar dalam set data, sedangkan komponen utama kedua tegak lurus terhadap komponen utama pertama dan memiliki variasi terbesar berikutnya (Gambar 3) (Miller & Miller 1984). Kedua komponen utama pertama ini pada umumnya digunakan sebagai bidang proyeksi untuk pemeriksaan visual data multivariat. Jika jumlah varians dari komponen utama satu (PC1) dan dua (PC2) lebih besar dari 70%, maka score plot memperlihatkan visualisasi dua dimensi yang baik (Varmuza 2002).
Teknik PCA berdasar pada dekomposisi matriks data X (N × K) menjadi 2, yaitu matriks T (N × A) dan matriks P (K × A) yang saling tegak lurus:
9
Matriks T disebut matriks scores yang menggambarkan varians dalam objek, sedangkan matriks P yang disebut matriks loading menjelaskan pengaruh peubah terhadap komponen utama. Matriks P terdiri atas data asli dalam sistem koordinat baru. Galat dari model yang terbentuk dinyatakan dalam E (Lohninger 2004), sedangkan nilai A adalah jumlah PC yang digunakan untuk membuat model (Brereton 2000).
Teknik Kemometrik dengan model PCA telah banyak dikembangkan.Teknik PCA telah dimanfaatkan sebagai metode yang sangat fleksibel dan dapat diandalkan untuk penilaian kualitas Curcuma longa dengan metode sidik jari GC-MS. Pengelompokan Curcuma longa dari Guizhou dan Fujian dipisahkan dari sampel lain dengan PC1, sementara, PC2 kontribusi untuk pemisahan lebih lanjut (Li Ming et al. 2009).
Partial Least Square (PLS)
Partial least square (PLS) adalah salah satu metode klasifikasi yang sering diterapkan dalam bidang kemometrik dengan berlandaskan pendekatan partial least square (PLS). Peubah yang tidak bebas (Y) diprediksi dari serangkaian peubah bebas (X) yang memiliki kolinieritas tinggi, jumlahnya yang banyak, dan memiliki struktur sistematik menggunakan regresi kuadrat terkecil (Brereton 2000). Peubah X dan Y tersebut didekomposisi menjadi dua matriks, yaitu matriks skor dan loading.
Gambar 4 menunjukkan bahwa matriks X diuraikan menjadi matriks skor T, matriks loading P′, dan matriks galat E, sedangkan matriks Y diuraikan menjadi matriks skor U, matriks loading Q′, dan galat F. Kedua persamaan ini disebut “hubungan luar‟. Hasil dari T dan P′ mendekati data spektrum, sedangkan hasil U
dan Q′ mendekati respon. Tujuan dari algoritma PLS adalah meminimumkan F
dengan terus menjaga korelasi antara X dan Y dalam hubungan dalam hubungan
U=BT (Gambar 4)(Lohninger 2004). Kebaikan suatu model klasifikasi dalam metode PLSDA dapat dilihat dari nilai determination coefficient (R2), root mean square error of calibration (RMSEC), dan root mean square error of prediction
10
temulawak, dan kunyit dalam rangka proses standardisasi dan kontrol kualitas obat herbal (Rohaeti, 2015).
3
METODE
Metode penelitian yang dilaksanakan meliputi analisis kualitatif dan kuantitaif.Tahapan analisis yang dilakukan dengan pengambilan sampel temu ireng, proses ekstraksi, analisis dengan KC-SM, dan pengolahan data dengan pendekatan kemometrik (Lampiran 1).
Bahan
Temu ireng yang digunakan berasal dari 3 daerah di Jawa (Nagrak, Cikabayan, dan Tawangmangu). Etanol 70% digunakan sebagai pelarut dalam ekstraksi temu ireng. Etanol, bufer amonium asetat CuCl2.2H2O, neokuproin, bufer amonium asetat pH 7, troloks, dan Artemia salina digunakan dalam pengukian aktivitas biologis. Asam format dan asetonitril digunakan sebagai eluen dalam analisis dengan KC-SM.
Alat
Alat-alat yang digunakan adalah alat-alat gelas, rotary evaporator, spektrofotometer, KC-SM Waters Xevo G2-S TOF, perangkat lunak MZmine, perangkat statistika Minitab 14.0.
Prosedur Penyiapan Bahan Baku
Sampel rimpang temu ireng yang digunakan pada penelitian berasal dari 3 daerah di Pulau Jawa yaitu Cikabayan, Nagrak, dan Tawangmangu. Daerah Cikabayan memiliki ketinggian 200 mdpl, sedangkan Nagrak dan Tawangmangu
11 memiliki ketinggian 550 dan 600 mdpl. Pengambilan sampel dilaksanakan pada bulan Oktober tahun 2013.
Setiap lokasi diambil 7 sampel rimpang temu ireng dan dijadikan sebagai pengulangan tiap daerah asal sampel.Sampel rimpang temu ireng yang digunakan dalam penelitian dicuci hingga bersih, diiris dan dikeringkan pada suhu 40 oC. Rimpang kering tersebut kemudian dihaluskan dan disimpan.
Penetapan Kadar Air (AOAC 2005)
Cawan porselen dikeringkan pada suhu 105 oC selama 30 menit, lalu ditempatkan di dalam deksikator dan ditimbang massa cawan porselen. Setelah itu, simplisia temu ireng ditimbang sebanyak 5 gram dan dimasukkan ke dalam cawan porselen. Contoh beserta cawannya dioven pada suhu 105 oC selama 8 jam. Setelah dioven, dimasukkan ke dalam deksikator kemudian ditimbang. Prosedur dilakukan berulang kali sampai didapat bobot tetap dengan selisih kurang dari 1 mg. Pekerjaan dilakukan triplo.
Kadar air ditentukan dengan persamaan:
Kadar air (%) = 100%
Keterangan: A = bobot contoh awal (g) B = bobot contoh kering (g).
Ekstraksi (BPOM 2005)
Ekstraksi simplisia temu ireng menggunakan teknik maserasi dengan pelarut etanol 70%. Sebanyak 10 g simplisia temu ireng dan 100 mL etanol 70% dimasukkan ke dalam erlenmeyer dan direndam selama 6 jam sambil sesekali diaduk. Sampel direndam selama 24 jam dalam ruang gelap. Selanjutnya maserat dipisahkan dengan menyaring filtrat menggunakan kertas saring. Setiap maserat dari masing-masing sampel diuapkan dengan rotavapor penguap vakum pada suhu 400C hingga diperoleh ekstrak kental. Ekstrak simpilisia yang telah pekat siap digunakan untuk uji selanjutnya.
UJi Fitokimia (Harbone 1987)
Uji Flavonoid. Sebanyak 1 gram ekstak temu ireng, ditambahkan air panas kemudian dididihkan selama 5 menit dan disaring. Filtrat yang diperoleh kemudian diambil sebanyak 10 ml, ditambah serbuk Mg 0,5 gram, 1 ml HCl pekat, dan 1 ml amil alkohol. Campuran dikocok dan diamati warna yang terbentuk. Uji positif ditandai dengan munculnya warna merah, kuning, atau jingga pada lapisan amil alkohol.
Uji Terpenoid dan Steroid. Ekstrak temu ireng dimaserasi dengan etanol panas kemudian disaring dan residu ditambahkan eter. Filtrat ditambahkan 3 tetes asam asetat anhidrat dan 1 tetes asam sulfat pekat. Larutan dikocok secara perlahan. Uji positif terpenoid ditandai dengan terbentuknya warna merah atau ungu serta steroid ditandai terbentuknya dengan warna hijau atau biru.
12
Uji Saponin. Sebanyak 1 gram ekstrak temu ireng ditambahkan air panas kemudian dididihkan selama 5 menit lalu disaring. 10 ml filtrat dikocok dalam tabung reaksi selama 10 detik untuk kemudian dibiarkan selama 10 menit. Adanya saponin ditunjukan dengan terbentuknya buih yang stabil.
Uji Tanin. Sebanyak 1 gram ekstrak temu ireng ditambahkan air panas kemudian dididihkan dan disaring. Sebanyak 10 ml filtrat ditambah 10 ml FeCl3 1%. Uji positif ditandai munculnya warna hijau kehitaman.
Uji Kapasitas antioksidan dengan Metode Cuprac (Apak et.al, 2008)
Sebanyak 1 ml ekstrak temu ireng 200 ppm masing-masing daerah dilarutkan dalam etanol 96% ditambahkan 1 ml CuCl2.2H2O 0,01 M; 1 ml neokuproin etanolik 0,0075 M; 1 ml bufer amonium asetat pH 7 1M; dan 0.1 ml akuades. Larutan didiamkan selama 30 menit dan diukur absorbans dengan spektrofotometer pada panjang gelombang 450 nm. Sebagai blanko digunakan campuran larutan tanpa ekstrak. Kurva kalibrasi dibuat menggunakan larutan troloks dengan berbagai konsentrasi. Kapasitas antioksidan dinyatakan dalam μmol troloks/g serbuk kering.
Uji Toksisitas dengan Metode BSLT (Krishnaraju et al. 2005)
Sebanyak 0.5 g telur Artemia salina yang sudah siap ditetaskan ditimbang kemudian dimasukkan ke dalam wadah yang berisi air laut yang sudah disaring dan diaerasi. Telur dibiarkan selama 48 jam di bawah pencahayaan lampu agar menetas sempurna. Telur yang telah menetas menjadi larva digunakan untuk uji toksisitas. Sebanyak 25 mg ekstrak temu ireng dilarutkan dalam 25 ml air laut. Kemudian larutan diencerkan dengan berbagai konsentrai. Apabila ekstrak tidak larut ditambahkan DMSO. Ke dalam multiwell dimasukkan 10 ekor larva udang dalam 1 ml air laut, dan 1 ml ekstrak. Ulangan dilakukan sebanyak 3 kali. Multiwell ditutup dengan aluminium foil dan diinkubasi selama 24 jam. Nilai konsentrasi letal 50% (LC50) ditentukan dengan menggunakan kurva hubungan antara konsentrasi ekstrak (sumbu x) dengan rerata persen kematian larva udang (sumbu y).
Analisis dengan KC-SM
Ekstrak rimpang temu ireng masing-masing dilarutkan dengan metanol. Ekstrak terlarut kemudian disaring menggunakan milipore filter unit dengan ukuran 0.45 mikron. Sebanyak 5 μL filtrat sampel diinjeksikan ke dalam sistem instrumen LC-ESI-QTOF.
13 perbandingan 5:95, menit ke 17-20 elusi gradient linier pelarut A dari 5% hingga 95%.
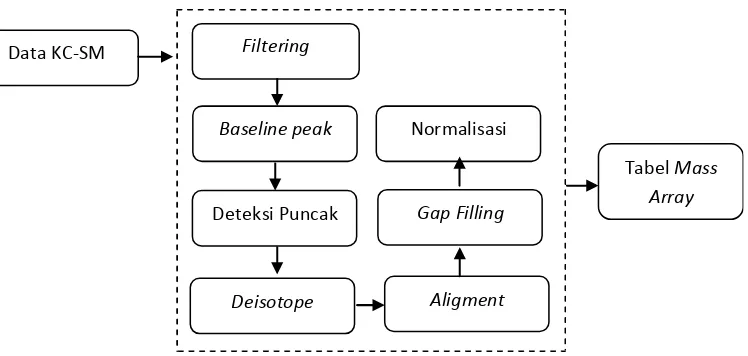
Pemrosesan Data Kromatogram KC-SM
Data kromatogram yang dihasilkan dikonversi menjadi format NetCDF untuk mempermudah dalam mengolah data dengan MZmine. Data kromatogram dari masing-masing ekstrak temu ireng dikumpulkan dan diolah melalui beberapa tahap yaitu, filtering, baseline peak, peak detection, deisotope, aligment, gap filling, dan normalisasi (Gambar 5). Hasil yang diperoleh setelah dilakukan beberapa tahap merupakan data mass array dari kromatogram masing-masing ekstrak yang meliputi 3 variabel yaitu m/z, waktu retensi, dan intensitas puncak.
Identifikasi senyawa metabolit yang terkandung dalam masing-masing sampel ekstrak temu ireng dilakukan dengan mencocokkan m/z dari kromatogram yang dihasilkan dengan massa akurat dari data base untuk senyawa metabolit yang terkandung dalam Genus Curcuma. Klasifikasi kualitas sampel dilakukan dengan penentuan senyawa metabolit penciri yang terdapat dalam sampel dengan metode PCA dan PLS menggunakan program statistik untuk melihat pengaruh senyawa penciri dugaan terhadap bioaktivitasnya.
4
HASIL DAN PEMBAHASAN
Analisis Fitokimia, Kadar Air, dan Kadar Abu
Rimpang temu ireng berasal dari 3 daerah yang memiliki kondisi geografis yang berbeda-beda yakni Nagrak, Cikabayan, dan Tawangmangu. Rimpang dikeringkan dan diperkecil ukurannya menjadi 100 mesh. Pengeringan rimpang dilakukan agar rimpang dapat disimpan dan tidak mudah rusak akibat mikroba. Dengan pengeringan maka kadar air akan kecil sehingga mikroba tidak dapat
Data KC-SM
Tabel Mass
Array Filtering
Deteksi Puncak
Deisotope Baseline peak
Aligment Gap Filling Normalisasi
14
tumbuh dan merusak rimpang. Kadar air, kadar abu, dan rendemen rimpang temu ireng ditampilkan pada Tabel 1.
Kadar air rimpang temu ireng dari daerah Cikabayan, Nagrak, dan Tawangmangu diperoleh kurang dari 11%. Kadar air daerah Cikabayan 10.06%, Nagrak 8,34%, dan Tawangmangu 9.89%. Kadar air ini akan menjadi faktor daya simpan ekstrak akibat kerusakan sampel oleh mikroba dan koreksi bobot pada saat penentuan rendemen. Kadar air dari 3 rimpang menunjukan sekitar 10% yang menunjukan daya simpan ekstrak cukup baik. Sampel yang telah diekstraksi dapat disimpan dalam jangka waktu cukup lama untuk dapat dianalisis dan diuji bioaktivitasnya. Jumlah mineral yang terkandung dalam bahan dapat ditentukan dengan melihat kadar abu dari rimpangnya. Berdasarkan Tabel 1, temu ireng dari daerah Tawangmangu lebih tinggi dibandingkan 2 daerah lainnya (6.65%). Perbedaan kondisi pertumbuhan, pemupukan, waktu panen, teknik panen, dan perlakuan setelah pemanenan akan mempengaruhi kadar abu dari suatu sampel.
Ekstraksi simplisia temu ireng dilakukan dengan teknik maserasi dengan pelarut etanol 70%. Penggunaan teknik maserasi bertujuan mengambil semua komponen bioaktif dalam temu ireng karena merupakan teknik ekstraksi cara dingin sehingga komponen yang tidak tahan terhadap panas tidak rusak dan ikut terbawa dalam ekstrak. Pelarut etanol 70% digunakan agar seluruh komponen bioaktif baik komponen yang polar dan kurang polar dalam simplisia dapat larut. Dari hasil rendemen pada Tabel 1, ekstrak etanol rimpang temu ireng dari daerah Tawangmangu memiliki rendemen yang paling tinggi sebesar 17.74%. Komponen bioaktif yang larut dari Tawangmangu memiliki jumlah yang lebih banyak dibandingkan daerah Cikabayan dan Nagrak. Hal ini dapat dipengaruhi dari keadaan geografis yang berbeda.
Hasil kandungan senyawa metabolit sekunder ekstrak temu ireng dapat dilihat pada Tabel 2. Uji fitokimia ini dilakukan secara kualitatif dan hasilnya menunjukkan bahwa ekstrak etanol 70% temu ireng baik daerah Cikabayan, Nagrak, dan Tawangmangu mengandung beberapa senyawa metabolit sekunder yaitu flavonoid, terpenoid, steroid, dan alkaloid.
Keberadaan flavonoid dapat terdeteksi dengan terbentuknya warna kuning pada lapisan amil alkohol.Terpenoid dapat terdeteksi dengan terbentuknya warna ungu ketika direaksikan dengan asam sulfat pekat, sedangkan steroid ditandai terbentuknya dengan warna hijau atau biru. Keberadaan alkaloid terdeteksi dari terbentuknya endapan saat direaksikan dengan pereaksi Dragendorf. Saponin dan tannin tidak terdeteksi pada ekstrak etanol 70% temu ireng. Menurut Syamsuhidayat dan Hutapea (1991) rimpang temu ireng mengandung saponin, flavonoid, dan polifenol disamping minyak atsiri. Selain itu penelitian Erickkatulistiawan (2012) menyatakan terdapat saponin pada ekstrak etanol rimpang
Tabel 1. Hasil kadar air, kadar abu, dan rendemen rimpang temu ireng dari tiga daerah
Daerah Kadar air (%) Kadar abu (%) Rendemen (%)
Cikabayan 10.06 ± 1.53 4.57 ± 0.09 14.95 ± 1.86 Nagrak 8.34 ± 1.56 6.47 ± 0.04 14.48 ± 2.12 Tawangmangu 9.89 ±1.68 6.65 ± 0.32 17.74 ± 2.04
15
temu ireng. namun baik rimpang dari Cikabayan, Nagrak, dan Tawangmangu saponin tidak ditemukan. Hal ini dapat disebabkan adanya senyawa yang lebih dominan sehingga kestabilan busa yang menunjukan saponin tidak terbentuk.
Aktivitas Antioksidan dengan metode CUPRAC
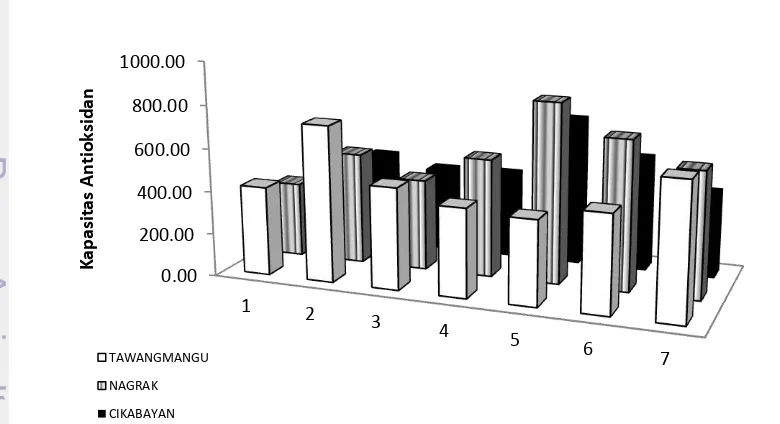
Pengujian aktivitas antioksidan ekstak etanol 70% rimpang temu ireng menggunakan metode CUPRAC. Pengukuran kapasitas antioksidan ekstrak etanol 70% etanol rimpang temu ireng diawali dengan memuat regresi dari standar troloks. Regresi standar troloks yang dihasilkan y = 0.002x + 0.048 dan koefisien regresi 0.967 (Lampiran 5). Kapasitas antioksidan masing-masing ekstrak temu ireng dari 3 daerah diperoleh berdasarkan regresi dari standar troloks sehingga kapasitas antioksidan dinyatakan dalam jumlah mol troloks per gram ekstrak (µ mol troloks/g ekstrak). Hasil uji antioksidan ekstrak etanol 70% rimpang temu ireng ditampilkan pada Gambar 6.
Gambar 6 Kapasitas antioksidan ekstrak temu ireng
0.00
Tabel 2. Hasil Uji fitokimia ekstrak temu ireng
Senyawa Cikabayan Nagrak Tawangmangu Keterangan
Flavonoid +++ ++ ++ (+) terbentuk warna
cokelat, dan merah jingga
Tanin - - - (+) bila terbentuk warna
hijau kehitaman
16
Aktivitas antioksidan berdasarkan nilai kapasitas antioksidan dari ekstrak etanol 70% rimpang temu ireng daerah Nagrak memiliki kapasitas antioksidan paling tinggi dibandingkan daerah Cikabayan dan Tawangmangu. Kapasitas antioksidan rerata temu ireng daerah Nagrak yaitu 567.74 ± 163.95µmol troloks/g ekstrak, Cikabayan 472.03 ± 107.78 µmol troloks/g ekstrak, dan Tawangmangu 501.72 ± 127.61 µmol troloks/g ekstrak. Sehingga urutan kapasitas antioksidan rimpang temu ireng dari 3 daerah adalah Nagrak > Tawangmangu > Cikabayan. Kandungan kurkuminoid dalam temu ireng diduga mempunyai sifat sebagai antioksidan.
Berdasarkan hasil uji statistika ANOVA, kapasitas antioksidan rimpang temu ireng dari 3 daerah tersebut tidak berbeda nyata (nilai P > 0.05). artinya tidak ada perbedaan kapasitas antioksidan antar rimpang temu ireng masing-masing daerah. Hal ini menunjukan perbedaan lokasi tumbuhnya rimpang ini tidak mempengaruhi kandungan senyawa yang berperan sebagai senyawa antioksidan.
Aktivitas Toksisitas dengan BSLT
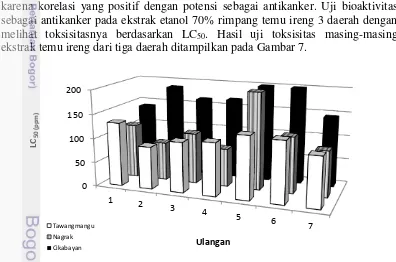
Metode skrining awal dalam uji toksisitas dari suatu bahan dapat dilakukan uji terhadap larva udang Artemis salina Leach. Metode ini banyak digunakan karena korelasi yang positif dengan potensi sebagai antikanker. Uji bioaktivitas sebagai antikanker pada ekstrak etanol 70% rimpang temu ireng 3 daerah dengan melihat toksisitasnya berdasarkan LC50. Hasil uji toksisitas masing-masing ekstrak temu ireng dari tiga daerah ditampilkan pada Gambar 7.
Nilai LC50 ditentukan melalui analisa probit dengan memuat hubungan linier antara konsentrasi ekstrak etanol 70% rimpang temu ireng dengan angka probit kematian dari larva udang Artemia salina. Suatu zat dikatakan aktif atau toksik bila nilai LC50< 1000 ppm untuk ekstrak dan < 30 ppm untuk suatu senyawa. Jika ekstrak dengan LC50 ≤ γ0 ppm tergolong sangat toksis, sedangkan 30-1000 ppm tergolong toksik (Meyer et al. 1982). Data pada Lampiran 6 diketahui rerata hasil uji sitotoksik pada ekstrak etanol 70% rimpang temu ireng
Gambar 7 Uji toksisitas ekstrak etanol rimpang temu ireng
17 dari daerah Tawangmangu sebesar 113.48 ± 16.46 ppm, Nagrak 113.68 ± 44.48 ppm, dan Cikabayan 174.08 ± 27.53ppm. Sehingga urutan toksisitas rimpang temu ireng dari 3 daerah adalah Tawangmangu > Nagrak > Cikabayan. Hasil uji sitotoksik menunjukan bahwa seluruh rimpang temu ireng dari 3 daerah bersifat toksik dan memiliki potensi sebagai antikanker. Perbedaan nilai toksisitas diperkirakan disebabkan oleh kandungan senyawa yang ada di dalam ekstrak temu ireng pada tiap daerah berbeda jumlahnya karena faktor geografis.
Berdasarkan hasil uji statistika ANOVA, LC50 dari uji toksisitas rimpang temu ireng dari 3 daerah yang berbeda tersebut berbeda nyata (nilai P<0.05). Artinya terdapat perbedaan aktivitas toksisitas antar rimpang tiap daerah. Hal ini menunjukan perbedaan lokasi tumbuhnya rimpang ini mempengaruhi kandungan metabolit yang berperan sebagai senyawa antikanker.
Pengelompokan Ekstrak Temu Ireng
Pengelompokan ekstrak etanol 70% rimpang temu ireng dilihat dari tingkat tinggi atau rendahnya aktivitas antioksidan dan toksisitas. Aktivitas antioksidan tinggi (+) jika di atas nilai rerata dari kapasitas antioksidan (513.86 µmol troloks/g ekstrak) dan rendah (-) jika di bawah rerata. Sedangkan untuk aktivitas toksisitas tinggi (+) jika di bawah rerata nilai LC50 (133.75 ppm) dan rendah (-) jika di atas rerata LC50. Sehingga terdapat 4 kategori jika dikombinasikan antar antioksidan dan toksisitas (Lampiran 7).
Berdasarkan hasil pengelompokan berdasarkan aktivitas biologis, 5 dari 7 rimpang temu ireng daerah Cikabayan memiliki aktivitas toksisitas di atas rerata LC50 dan aktivitas antioksidan di bawah rerata kapasitas antioksidan sehingga menunjukan kecenderungan daerah Cikabayan tergolong dalam kategori I (aktivitas toksisitas dan antioksidan rendah). Rimpang temu ireng daerah Nagrak kecenderungan dalam kategori IV (aktivitas toksisitas dan antioksidan tinggi), dan daerah Tawangmangu tergolong kategori III (aktivitas toksisitas rendah dan antioksidan tinggi).
Identifikasi Komponen Bioaktif Rimpang Temu Ireng dengan KC-SM
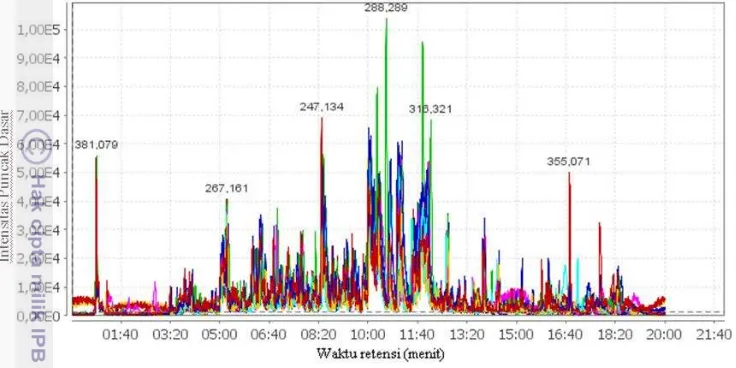
Informasi mengenai banyaknya komponen kimia dalam ekstrak etanol rimpang temu ireng menggunakan sidik jari KC-SM. Sebanyak lima sampel dari 7 sampel rimpang temu ireng yang mewakili kategori masing-masing daerah selanjutnya dianalisis dengan KC-SM. Informasi yang diperoleh berupa kromatogram dan spektrum. Kromatogram ekstrak etanol rimpang temu ireng ditunjukan dengan waktu retensi sebagai sumbu x dan intensitas puncak sebagai sumbu y. Bentuk kromatogram yang dihasilkan dari 3 daerah memiliki kemiripan pola (Gambar 8). Secara umum pola kromatogram dari 3 daerah ditunjukan pada Lampiran 3.
18
memiliki ciri puncak tertinggi pada waktu retensi 11.09 dengan puncak dasar m/z 228.123. Temu ireng daerah Nagrak dan Tawangmangu memiliki puncak tertinggi yang sama yaitu pada waktu retensi 10.04 dengan puncak dasar m/z 234.170.
Data yang diperoleh dari masing-masing kromatogram merupakan data yang berukuran sangat besar dengan 3 dimensi yaitu, waktu retensi, massa terhadap muatan (m/z), dan intensitas puncak. Data yang besar ini sangat kompleks sehingga menyulitkan dalam proses data. Kompleksitas data tersebut dapat diatasi dengan menggunakan program MZmine. Pada proses ini data yang besar dan kompleks akan menjadi data yang lebih sederhana dengan menghilangkan pengaruh adanya geseran garis dasar (background) dan noise atau derau pada kromatogram. Penyederhanaan ini diharapkan dapat meningkatkan hasil dengan kemometrik.
Data analisis dengan KC-SM di konvert ke dalam bentuk NetCDF agar lebih mudah diolah dalam program MZmine. Pada program dilakukan beberapa tahapan yaitu, filtering, koreksi baseline, peak detection, deisotope, aligment, gap filling, normalisasi. Tahap koreksi baseline bertujuan untuk memisahkan puncak kromatogram yang berupa sinyal dan noise (pengganggu). Tahap berikutnya, deteksi puncak untuk identifikasi dan kuantifikasi sinyal yang terkait dengan molekul dalam sampel, serta mereduksi kompleksitas data, sehingga analisis data tersebut menjadi lebih mudah. Tahap deisotop bertujuan menyederhanakan matriks data untuk tahap analisis berikutnya, dengan cara menyederhanakan informasi yang melimpah. Tahap alignment merupakan tahap yang penting untuk membandingkan sifat metabolit di antara sampel yang dianalisis dengan cara mencocokkan dan mengelompokkan puncak yang dihasilkan sampel, sebelum memasuki tahap analisis secara statistika. Tahap gap filling diperlukan untuk mendeteksi puncak dengan intensitas yang sangat rendah, kualitas bentuk yang kurang baik, atau adanya kesalahan dalam mendeteksi puncak, sehingga dapat mencegah terjadinya penarikan simpulan yang kurang tepat. Data yang telah diidentifikasi mengalami normalisasi untuk mengoreksi dan menyempurnakan data. Normalisasi dapat dilakukan melalui menghilangkan bias sistematik yang tidak diinginkan dalam pengukuran (Castillo et al. 2011).
19 Hasil yang diperoleh dari program MZmine adalah tabel mass array
meliputi data massa akurat, waktu retensi, dan intensitas puncak yang ternomalisasi dengan jumlah data yang diperoleh 781 data/puncak. Data massa akurat selanjutnya digunakan dalam identifikasi senyawa metabolit dugaan yang terkandung dalam sampel. Sebanyak 308 dari 781 data dapat mengidentifikasi senyawa dugaan dalam sampel dengan mencocokan massa akurat yang terukur dengan m/z teoritis metabolit Curcuma. Senyawa metabolit untuk Genus Curcuma teridentifikasi sebanyak 211 senyawa dengan 4 kelompok besar difenil-alkanoid, turunan fenilpropanoid, terpenoid, dan senyawa lain (Ravindran et al. 2007). Berdasarkan hasil dari perbandingan massa akurat dengan teoritis dapat diidentifikasi total senyawa metabolit dugaan yang terkandung dari masing-masing sampel daerah Cikabayan, Nagrak, dan Tawangmangu sebanyak 175 senyawa dugaan (Lampiran 9). Kemiripan jumlah senyawa metabolit dari masing-masing daerah tidak diimbangi dengan kandungan yang dimiliki setiap komponen metabolitdari masing-masing daerah. Kandungan metabolit dinyatakan dalam satuan % area relatifyang merupakan luas suatu puncak terhadap luas total seluruh puncak yang terdeteksi.Semakin tinggi % area relatif kadar suatu metabolit semakin banyak. Hal ini menunjukan bahwa asal geografis tumbuhnya rimpang temu ireng mempengaruhi komposisi kimianya.
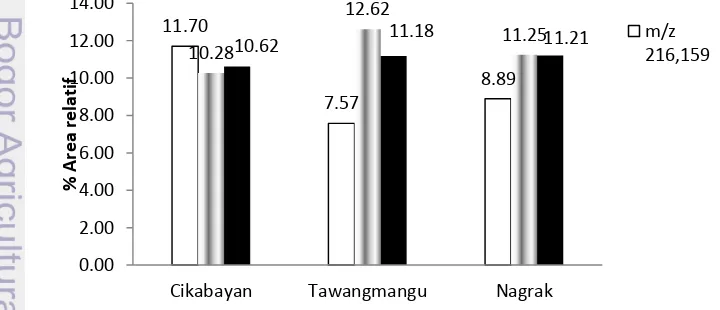
Berdasarkan % area relatif dapat ditentukan senyawa metabolit dugaan yang dominan diantara 175 senyawa dugaan(Lampiran 6).Ketiga daerah memiliki kesamaan senyawa metabolit dugaan yang dominan. Gambar 9 menunjukan % area relatif senyawa dugaan dominan pada masing-masing daerah.Senyawa dominan dari ketiga daerah adalah senyawa dengan mass ion 216.159, 230.138, dan 234.170.Senyawa mass ion 216.159 diduga sebagai senyawa ar-turmeron, kurzerena, furanodiena.Senyawa mass ion 230.138 diduga kurzerenon, 5-epi-kurzerenon, furanodienon, dan isofuranodienon. Sedangkan Kurbumenon, kurmadion, kurkumenon, isokurkumadion, dehidrokurdion, germakron 4,5-epoksida, 13-hidroksigermakron, kurkumenol, epi-kurkumenol, 4-epi-kurkumenol, isokurkumenol, neokurkumenol, isoprokurkumenol, neoprokurkumenol, 4-hidroksi-7(11), 10(14)-guaiadien-8-on, kurkumanolida A, kurkumanolida B, gajutsulakton A, gajutsulakton B, merupakan senyawa dugaan untuk mass ion 234.170 (Gambar 10).
20
Jumlah komposisi senyawa dugaan dalam sampel diketahui dengan melihat % area relatif yang merupakan luas suatu puncak terhadap luas total 781 puncak yang terdeteksi. Rimpang temu ireng daerah Cikabayan memiliki jumlah senyawa m/z 216.159 yang lebih besar dibandingkan Tawangmangu dan Nagrak. % area relatif m/z 230.140 dan 234.170 di ketiga daerah tidak berbeda jauh.Hal ini dapat disebabkan kondisi geografi seperti ketinggian daerah yang berbeda akanmempengaruhi komposisi dan konsistensi kandungan senyawa kimiannya.
Pola Pengelompokan Metabolit dengan Kemometrik
Pengelompokan daerah sampel berdasarkan komposisi metabolit dilakukan dengan teknik PCA.Teknik ini merupakan teknik analisis yang peubah ganda yang menyederhanakan peubah yang diamati dengan cara mereduksi dimensinya dan memberi gambaran pengelompokan data melalui penentuan komponen utama (PC), yakni PC 1, PC 2, PC 3, dan seterusnya (Theodoridis et al.
2012). Teknik ini membentuk visualisasi pengelompokan data dan evaluasi kesamaan antar kelompok menjadi lebih mudah. Teknik kemometrik PCA diaplikasikan pada tabel mass array dengan nilai massa akurat sebagai variabel
Gambar 10 Beberapa struktur senyawa kimia pada temu ireng
ar-Turmeron
9-okso-neoprokurkumenol Kurkumenolakton A R= -H
21 bebas. Teknik PCA dilakukan dengan membandingkan 2 set data, yaitu set data I dengan variabel massa akurat yang telah diketahui senyawa dugaannya (308 variabel m/z) dan set data II dengan menggunakan variabel massa akurat dengan senyawa dugaan yang sudah diketahui maupun yang belum diketahui (781 variabel m/z). Hasil analisis PCA ditampilkan Tabel 3. Hasil menunjukan kedua data dikatakan baik karena memiliki keragaman total yang besar dengan komponen utama yang sedikituntuk memberikan pengelompokan sampel yang efektif dengan pemisahan yang jelas antara kelompok.
Indikasi pengelompokan rimpang berdasarkan lokasi digambarkan dalam skor plot (Gambar 11). Plot skor bertujuan untuk melihat apakah profil metabolit masing-masing sampel dapat terbedakan berdasarkan daerah asalnya. Sampel yang menunjukan kemiripan profil metabolitnya akan berkelompok menjadi satu. dan sampel yang menunjukan perbedaan akan membentuk kelompok lain. Pada set data I dan II terdapat kemiripan pengelompokan yang hampir sama.Temu ireng daerah Cikabayan cenderung membentuk kelompok tersendiri.Sampel dari Cikabayan cenderung membentuk kelompok sendiri pada PC pertama, tetapi terdapat Nagrak 5 sebagai pencilan (outlier). Daerah Tawangmangu membentuk kelompok di PC1 dan 2. Sedangkan untuk kelima sampel daerah Nagrak cenderung menyebar di daerah Cikabayan dan Tawangmangu. Sampel Nagrak 2 tidak memberikan gambaran baik di Tawangmangu dan Cikabayan.Hasil ini menunjukan analisis PCA dengan 308 dan 781 variabel dapat mengelompokan daerah Cikabayan dan Tawangmangu, namun tidak untuk daerah Nagrak.
Dasar dalam pengelompokan adalah adanya suatu penciri (biomarker) yang memberikan identitas dari kelompok tersebut dan dapat dilihat melalui analisis kemometrik melalui nilai loading dalam analisis PCA (Gambar 11). Plot
2
Score Plot of 132.101, ..., 456.183_1
5
Score Plot of 103.107, ..., 496.308
a b
Gambar 11 Plot skor analisis PCA ekstrak etanol rimpang temu ireng 308 variabel (a) dan 781 variabel (b)
Tabel 3 Keragaman total analisis PCA pada ekstrak rimpang temu ireng
308 variabel 781 variabel
PC 1 63.3 % 54.5 %
PC 2 12.3 % 12.5 %
PC 3 9.5 % 8.8 %
22
loading menjelaskan komposisi dan variasi metabolit masing-masing sampel mempengaruhi pengelompokan sampel temu ireng berdasarkan daerah asalnya. Ketika dibandingkan antara plot score dan plot loading menunjukan bahwa daerah Cikabayan dibedakan dengan daerah lain akibat adanya senyawa dengan m/z 216.159. Senyawa tersebut diduga merupakan senyawa ar-turmerone, curzerene,atau furanodiene. Daerah Tawangmangu terbedakan akibat adanya variabel m/z 236.185 yang diduga merupakan senyawa 3-hidroksi-1,10-bisaboladien-9-on, 4-hirdoksibisabola-2,10-dien-9-on, 4S-dihidrokurkumenon, kurdione, neokurdion, kurkumol, dan kurkumalakton. Selain itu senyawa m/z 230.139 pada set data II yang diduga senyawa kurzerenon, 5-epi-kurzerenon, furanodienone, dan isofuranodienon juga mempengaruhi pengelompokan daerah Tawangmangu. Sementara sampel daerah Nagrak yang menyebar sehingga tidak dapat diidentifikasi senyawa penciri spesifik yang dimiliki rimpang temu ireng daerah Nagrak. Temu ireng Nagrak 5 masuk dalam kelompok daerah Cikabayan sehingga diduga memiliki senyawa penciri yang sama dengan temu ireng daerah Cikabayan. Sedangkan Nagrak 4 dan 6 masuk dalam kelompok Tawangmangu karena memiliki senyawa penciri yang sama. Kesamaan senyawa penciri dapat pula dibedakan karena adanya perbedaan keragaman metabolit dan % area relatif setiap sampel. Penyebaran sampel Nagrak pada pengelompokan PCA diduga akibat kondisi daerah yang tidak stabil.
Hubungan Komposisi Senyawa Metabolit Terhadap Uji Bioaktivitas
Untuk melihat adanya pengaruh dari m/z dengan antioksidan dan LC50 dengan membuat model menggunakan metode Partial Least Square. Metode kuadrat terkecil (PLS) digunakan untuk memprediksikan serangkaian variabel tak bebas (respon) dari variabel bebas (prediktor) dalam jumlah banyak yang memiliki struktur sistematik linier dan nonlinear dengan atau tanpa data yang hilang dan memiliki kolinearitas yang tinggi. Pembentukan model PLS juga dilakukan dengan dua set data. Variabel m/z (308 variabel dan 781 variabel) yang digunakan sebagai prediktor dan nilai antioksidan dan LC50/toksisitas sebagai respon. Hasil analisis metode PLS untuk kedua set data ditampilkan pada 444.121_1444.120_1444.120_2398.360444.121444.120444.120_3444.119398.363 398.308_1398.308 264.144_5264.144_3264.144_1264.144_2264.144_4264.144 264.143 228.123_7228.123_6228.123_3228.123_5228.123_2228.123_4 228.123_1
Loading Plot of 132.101, ..., 456.183_1
a b
23 parameter seperti R-Square, nilai F, dan root meas square error (RMSE). Parameter kebaikan model PLS untuk kedua set data ditampilkan dalam Tabel 4.
Suatu model dikategorikan baik dan dapat dipercaya jika nilai parameter memenuhi standar.Sebagai contoh, R-Square yang merupakan koefisien determinasi (r2) dari model. Nilai r2 semakin mendekati 1 mengartikan kelinearan suatu model semakin baik. Tingginya nilai R-Square pada 781 variabel baik dikedua aktivitas menunjukan pengaruh m/z terhadap nilai respon sangat kuat, hanya sedikit pengaruh dari faktor luar. Nilai F menjelaskan uji signifikan terhadap data. Nilai yang cukup besar di kedua set data menunjukan nilai bioaktivitas berbeda signifikan terhadap hasil. Selain itu, nilai RMSE pada 781 variabel lebih kecil dibandingkan 308 variabel.Nilai RMSE mendekati 0 maka semakin baik model tersebut.
Senyawa metabolit yang berperan terhadap bioaktivitas dapat dilihat melalui plot standardisasi koefisien yang menunjukan besarnya pengaruh masing-masing prediktor pada model dan berhubungan untuk standardisasi variabel x dan y (Lampiran 16 dan 17).Identifikasi senyawa metabolit yang berpengaruh baik positif dan negatif terhadap LC50 (toksisitas)dan antioksidan ditampilkan pada Tabel 5.
Pada Tabel 5, senyawa m/z 312.275 berpengaruh terhadap potensi sebagai antioksidan dan antikanker baik di kedua set data. Senyawa tersebut diduga senyawa tetrahidro-bisdemetoksikurkumin.Senyawa 9-okso-neoprokurkumenol,
Tabel 5 Identifikasi senyawa metabolit yang terhadap LC50 dan antioksidan
Bioaktivitas Pengaruh 308 variabel 781 variabel
m/z Senyawa dugaan m/z Senyawa dugaan
Toksisitas + 262.128 teridentifikasi(*) 312.275 (*)
312.275 (*) 448.336 Tidak teridentifikasi
250.165 (*) 248.149 (*)
- 368.170 (*) 444.120 (*)
206.105 (*) 280.159 (*)
368.169 (*) 244.118 Tidak teridentifikasi
Antioksidan + 312.275 (*) 312.275 (*)
202.179 (*) 248.149 (*)
248.149 (*) 202.179 (*)
- 234.168 (*) 262.128 (*)
262.128 (*) 444.120 (*)
216.155 (*) 244.118 Tidak teridentifikasi
(*) Senyawa dugaan pada Lampiran 9
Tabel 4 Parameter statistik untuk data analisis rimpang temu ireng dengan
24
kurkumalakton A, kurkumalakton B dan 7α,11α,-epoksi-5 -hidroksi-9-guaiaen-8-on (m/z 248.149) pada set data II memiliki kemampuan meningkatan potensi di kedua uji bioaktivitas. Senyawa (1E, 3E)-1,7-difenil-1,3-heptadien-5-on (m/z 262.128) diduga berpotensi toksisitas pada set data I, tetapi senyawa tersebut justru berlawanan terhadap aktivitas antioksidan. Senyawa m/z 262.128 menurunkan potensi temu ireng sebagai antioksidan dikedua set data. Selain itu, penurunan antioksidan dan toksisitas juga dipengaruhi senyawa difurokumenon (m/z 444.120) dan senyawa m/z 244.118 yang belum teridentifikasi pada Genus Curcuma.
5
SIMPULAN DAN SARAN
Simpulan
Identifikasi komponen bioaktif dalam rimpang temu ireng ditentukan dengan pendekatan sidik jari kromatografi cair-spektrofotometri massa (KC-SM). Berdasarkan asal geografis dari 3 daerah (Cikabayan, Nagrak, dan Tawangmangu). rimpang temu ireng memiliki bioaktivitas setiap sampel berbeda diakibatkan variasi kandungan komponen kimia maupun kadarnya. Potensi antioksidan pada ekstrak etanol rimpang temu ireng daerah Nagrak lebih besar dibandingkan Cikabayan dan Tawangmangu. Hasil toksisitas LC50 daerah Cikabayan lebih besar Tawangmangu dan Nagrak. Identifikasi senyawa metabolit dari ekstrak etanol rimpang temu ireng dengan KC-SM didapatkan 175 total metabolit. Hasil analisis Senyawa metabolit dugaan yang dominan dari ekstrak etanol rimpang temu ireng yaitu dengan m/z 216.159 (ar-Turmeron, kurzeren, furanodin),230.140 (kurzerenon, 5-epi-Kurzerenon, furanodienon, dan isofuranodienon), dan 234.170 (kurbumenon, kurmadion, kurkumenon, isokurkumadion, dehidrokurdion, germakron 4,5-epoksida, 13-hidroksigermakrone, kurkumenol, epi-kurkumenol, 4-epi-kurkumenol, isokurkumenol, neokurkumenol, isoprokurkumenol, neoprokurkumenol, 4-hidroksi-7(11), 10(14)-guaiadien-8-on, kurkumanolida A, kurkumanolida B, gajutsulakton A, gajutsulakton B) termasuk golongan sesquiterpene pada Genus Curcuma. Pengelompokan berdasarkan daerah asalnya menggunakan teknik PCA menunjukan rimpang temu ireng daerah Cikabayan dan Tawangmangu dapat berkelompok masing-masing daerah. sedangkan daerah Nagrak cenderung menyebar. Rimpang temu ireng daerah Cikabayan diduga memiliki senyawa penciri dengan m/z 216.159 dan Tawangmangu yang memiliki senyawa penciri dengan m/z 236.185 (3-hidroksi-1,10-bisaboladien-9-on, 4-hidroksibisabola-2,10-dien-9-on, neokurdion, kurkumol, 4S-dihidrokurkumenon, kurdion, dan kurkumalakton. Berdasarkan bioaktivitas, senyawa yang berpengaruh positif terhadap antikanker dan antioksidan diduga dipengaruhi oleh senyawa dengan m/z 312.275 (tetrahidro-bisdemetoksikurkumin)
Saran
Identifikasi komponen bioaktif yang dilakukan pada rimpang temu ireng terdapat keterbatasan dalam database. Perlu dilakukan pengembangan database