ZEOLIT SINTETIS
TERFUNGSIONALISASIMERKAPTOPROPILTRIMETOKSI SILANA
SEBAGAI ADSORBEN LOGAM CuDAN BIRU METILENA
NURUL AFIATI AFLAKHAH
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK
CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Zeolit Sintetis Terfungsionalisasi Merkaptopropil Trimetoksi Silanasebagai Adsorben Logam Cu dan Biru Metilenaadalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Februari 2016
RINGKASAN
NURUL AFIATI AFLAKHAH. Zeolit Sintesis Terfungsionalisasi Merkaptopropil Trimetoksi Silanasebagai Adsorben Logam Cu dan Biru Metilena. Dibimbing oleh SRI SUGIARTI dan CHARLENA.
Zeolit sintetis banyak digunakan dibandingkan dengan zeolit alam sebagai adsorben, penukar kation, maupun katalis. Hal ini disebabkan karena zeolit sintetis memiliki tingkat kemurnian yang lebih tinggi, serta keseragaman ukuran pori bila dibandingkan dengan zeolit alam. Kaolin sebagai bahan baku pembuatan zeolit sintetis telah umum digunakan, karena mengandung silika dan alumina dengan rasio Si/Al yang mendekati zeolit sintetis tipe A. Metode yang umum digunakan dalam sintesis zeolit berbahan dasar kaolin adalah metode hidrotermal. Pada penelitian ini dilakukan sintesis zeolit dengan menggunakan metode sol-gel.Hasil dari zeolit sintetis yang diperoleh kemudian dianalisis menggunakan difraktometer sinar-X serta mikroskop pemindai elektron. Zeolit yang diperoleh dari penelitian ini adalah zeolit Y, zeolit A serta sodalit. Modifikasi menggunakan Merkapto Propil Trimetoksi Silana terhadap zeolit sintetis hanya berhasil dilakukan pada sodalit serta serta zeolit A. Penggunaan HCl pada proses modifikasi zeolit Y menggunakan Merkaptopropil Trimetoksi Silan, dapat menghambat proses pembentukan kristal zeolit Y. Adanya proses modifikasi terbukti dapat meningkatkan nilai kapasitas adsorpsi pada zeolit sintetis yaitu sodalit dan zeolit A. Nilai adsorpsi terbaik didapatkan pada zeolit A termodifikasi yaitu 30,11 mg/g. Nilai kuadrat terkecil zeolit sintetis secara keseluruhan mengikuti pola isoterm Langmuir.
SUMMARY
NURUL AFIATI AFLAKHAH. FunctionalizedSyntheticZeolite byMercaptopropyl Trimethoxy Silane asTheAdsorbenof CuandMethylene Blue. Supervised by SRI SUGIARTIand CHARLENA.
Synthetic zeolite are more commonly used as adsorbent, ion exchange, and catalyst than the natural zeolite, because the higher purity and uniform poresize in synthethiczeolite. Kaolin isa commonly used raw material for synthesis of zeolite, because their abundant and the low cost. This research employed sol-gel method to produce synthetic zeolit from kaolin as a substrat. The resulting synthetic zeolite were then characterized using X-ray Difractometry and Scanning Electron Microscope.The commonly method in synthesis zeolite base on kaolin is hodrothermal method.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Kimia
ZEOLIT SINTETIS TERFUNGSIONALISASIMERKAPTOPROPIL
TRIMETOKSI SILANA SEBAGAI ADSORBEN LOGAM Cu
DANBIRU METILENA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
PRAKATA
Syukur alhamdulillah penulis panjatkan kehadirat ALLAH SWT karena berkat rahmatNya penulis dapat menyelesaikan penulisan Tesis dengan judul Zeolit Sintesis Terfungsionalisasi Merkaptopropil Trimetoksi Silanasebagai Adsorben Logam Cu dan Biru Metilena.
Terima kasih penulis ucapkan kepada Ibu Sri Sugiarti, Ph.D dan Ibu Dr. Charlena, MS selaku komisi pembimbing yang telah dengan sabar memberikan bimbingan, dan motivasi selama penulis melakukan penelitian dan penyusunan tesis. Penulis juga mengucapkan terimakasih kepada rekan-rekan mahasiswa pasca sarjana kimia serta seluruh pihak yang telah membantu kelancaran studi dan terselesaikannya penelitian serta penyusunan tesis ini. Ungkapan terimakasih juga disampaikan kepada kedua orang tua , suami, serta buah hati atas semua doa dan kasihsayangnya.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTARTABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Hasil pencirian zeolit AX2 dengan XRD 11
Hasil pencirian zeolit AX2 dengan SEM 13
Uji adsorpsi zeolit AX2 14
Isoterm Adsorpsi zeolit AX2 15
Hasil pencirian zeolit AX4 dengan XRD 15
Hasil pencirian zeolit AX4 dengan SEM 17
Uji adsorpsi zeolit AX4 18
Isoterm Adsorpsi zeolit AX4 18
Hasil pencirian zeolit AZ3 dengan XRD 19
Hasil pencirian zeolit AZ3 dengan SEM 20
Uji adsorpsi zeolit AZ3 21
Isoterm Adsorpsi zeolit AZ3 22
SIMPULAN DAN SARAN 23
Simpulan 23
Saran 23
DAFTAR PUSTAKA 24
LAMPIRAN 26
DAFTAR GAMBAR
1 Struktur Zeolit Tiga Dimensi 4
2 Struktur Kaolin 5
3 Difraktogram Metakaolin 11
4 Difraktogram Zeolit AX2 12
5 Difraktogram Zeolit AX2 termodifikasi 13
6 Hasil analisis SEM Zeolit AX2 13
7 Difraktogram Zeolit AX4 16
8 Difraktogram Zeolit AX4 termodifikasi 16
9 Hasil analisis SEM Zeolit AX4 17
10 Hasil analisis SEM zeolit AX4 termodifikasi 17
11 Difraktogram Zeolit AZ3 20
12 Difraktogram Zeolit AZ3 termodifikasi 20
13 Hasil analisis SEM Zeolit AZ3 21
14 Hasil analisis SEM zeolit AZ3 termodifikasi 21
DAFTAR TABEL
1 Rumus Oksida berbagai jenis zeolit sintetik 5 2 Perbandingan volume dalam sintesis Zeolit AX 8
3 Perbandingan volume sintesis Zeolit AZ 9
4 Nilai kapasitas adsorpsi zeolit AX2 14
5 Nilai kuadrat terkecil isoterm adsorpsi zeolit 15
6 Nilai kapasitas adsorpsi zeolit AX4 18
7 Nilai kuadrat terkecil isoterm adsorpsi zeolit AX4 18
8 Nilai kapasitas adsorpsi zeolit AZ3 21
9 Nilai kuadrat terkecil isoterm adsorpsi zeolit AZ3 22
DAFTAR LAMPIRAN
1 Bagan Alir Penelitian 26
2 Diagram alir pembuatan natrium aluminat 28
3 Diagram alir pembuatan zeolit 28
DAFTAR LAMPIRAN (lanjutan)
1
PENDAHULUAN
Latar Belakang
Logam berat merupakan bahan pencemar paling berbahaya,meskipun jumlahnya sedikit namun memiliki tingkat toksisitas yang tinggi. Hal ini disebabkan logam berat tidak dapat dibiodegradasi dan dapat terakumulasi dalam jaringan mahluk hidup. Pencemaran logam berat akan cenderung meningkat sejalan dengan meningkatnya eksploitasi berbagai sumber alam dan berbagai kegiatan industri yang mengandung logam berat.
Beberapa contoh logam yang dapat mencemari lingkungan adalah tembaga (Cu). Tembaga biasanya digunakan untuk bahan baku industri dan kegiatan pertanian. Pada sektor industri tembaga digunakan untuk zat warna, industri kimia, peleburan logam, dan penambangan. Logam Cu dalam jumlah yang sedikit di butuhkan oleh tubuh, akan tetapi dalam jumlah yang berlebihan tidak mampu di metabolisme oleh tubuh. Tembaga dapat memasuki udara terutama melalui proses pembakaran bahan bakar fosil. Logam ini akan terus berada diudara hingga mengendap ke tanah melalui hujan. Sebagian besar senyawa tembaga akan menetap dan terikat di tanah atau terserap dalam sumber air yang dapat menimbulkan ancaman kesehatan seperti kanker, hemolisis, dan lain-lain (Surbakti. 2011).
Metode konvensional untuk menghilangkan ion logam berat terlarut meliputi presipitasi kimia, oksidasi kimia, filtrasi, pertukaran ion dan lain-lain. Namun proses-proses teknologi tersebut memiliki kelemahan, contohnya pada proses presipitasi kimia limbah berupa logam berat dapat terpengaruh oleh pH rendah. Pada proses pertukaran ion biaya relatif mahal,serta operasional yang sulit. Beberapa kelemahan dari metode teknologi tersebut maka proses adsorpsi dapat digunakan sebagai metode alternatif dalam menghilangkan ion logam berat. Adsorpsi merupakan suatu proses yang efisien dan memiliki aplikasi luas dalam pengurangan ion logam dari air limbah. Proses ini membutuhkan adsorben yang tepat sebagai faktor penentunya. Salah satu jenis adsorben yang sering digunakan dalam adsorpsi logam berat adalah zeolit.
Jenis pencemar lain yang merupakan hasil samping dari proses industri adalah zat warna Biru Metilena. Biru Metilena banyak digunakan dalam proses industri kertas dan merupakan senyawa non-biodegradable, yang mengandung senyawa azo dan bersifat karsinogenik. Zat warna Biru metilena merupakan senyawa organik yang tidak jenuh yang berasal dari senyawa aromatik, didalam air akan bermuatan positif sehingga umumnya disebut zat warna bersifat basa. Kontaminasi air yang disebabkan oleh Biru metilena akan menyebabkan terhambatnya proses masuknya sinar matahari ke lingkungan. Untuk meminimalisasi efek tersebut maka dapat dilakukan suatu proses adsorpsi dengan menggunakan adsorben yaitu zeolit.
2
yang melimpah dialam. Zeolit terbagi atas dua yaitu zeolit alam dan zeolit sintetik.
Untuk kepentingan komersial zeolit sintetis lebih sering digunakan dibandingkan dengan zeolit alam, hal ini dikarenakan zeolit sintetis memiliki keseragaman ukuran partikel dan tingkat kemurnian yang tinggi. Keuntungan lainnya adalah bahwa zeolit sintetis dapat dibuat struktur zeolit yang diinginkan yang tidak terdapat pada zeolit alam. Saat ini permasalahan yang terjadi pada penelitian tentang zeolit sintetis adalah tentang ketersediaan sumber silika dan alumina serta biaya yang diperlukan untuk mencari bahan dasar yang bernilai ekonomis dan mudah didapatkan.
Kaolin merupakan salah satu tipe lempung yang di dalamnya tersusun atas mineral kaolinit yang penggunaannya sangat luas untuk aspek industri. Berdasarkan pada kemurnian serta komposisi mineralnya maka kaolin dapat digunakan sebagai bahan baku pembuatan zeolit. Beberapa penelitian tentang zeolit sintetis menggunakan mineral alam serta aplikasinya telah banyak dilakukan. Atta et al. 2007 mempelajari pembuatan zeolit X dengan bahan dasar kaolin yang berasal dari Kankara. Georgiev et al. 2009 melakukan ulasan tentang berbagai cara pembuatan zeolit, struktur serta klasifikasinya. Dalam ulasannya dikatakan bahwa terdapat perkembangan beberapa cara yang dapat digunakan untuk membuat zeolit, dan juga cara memodifikasi zeolit. Trivana. 2012 telah melakukan sintesis zeolit X dan nanokomposit zeolit/TiO2 dari kaolin. Untuk menambah nilai rasio Si dari zeolit, Trivana menggunakan sekam padi sebagai sumber silika lainnya. Penggunaaan natrium silika sebagai sumber silika didasari untuk meningkatkan nilai rasio Si pada zeolit yang akan disintesis.
Proses sintesis zeolit berbahan dasar kaolin dapat dilakukan menggunakan metode sol gel. Radityo. 2012 telah melakukan sintesis zeolit ZSM-5 melalui proses sol gel, yang kemudian dimanfaatkan sebagai katalis. Metode ini digunakan karena kemampuannya dalam mengontrol tekstural dan sifat-sifat dari campuran oksida. Keuntungan lain dari proses sol gel, adalah materi yang terbentuk memiliki homogenitas dan kemurnian yang tinggi, serta kondisi sintesis dapat divariasikan.
Pada struktur permukaan kaolin terdapat beberapa gugus silanol, yang keberadaannya serta konsentrasinya berperan pada proses penentuan kapasitas adsorpsi dan dalam mekanisme pelepasan adsorbat. Salah satu cara untuk meningkatkan nilai kapasitas adsorpsi zeolit sintetis dari kaolin adalah dengan melakukan modifikasi pada permukaan. Cara ini dilakukan dengan mereaksikan gugus silanol pada permukaan menggunakan suatu pereaksi organosilan yaitu Merkapto Propil Trimetoksi Silana (MPTS). Pereaksi organosilan memiliki struktur secara umum R-SiX3, dengan R merupakan gugus fungsional organik yang terikat pada silika dalam keadaan hidrolitik yang stabil. X dapat berupa gugus alkoksi yang dapat dihidrolisis ( seperti –OCH3 (metoksi), atau –OC2H5 (etoksi). Gugus tersebut kemudian dapat diubah menjadi gugus silanol melalui reaksi hidrolisis. Dan R merupakan gugus fungsional organik yang bersifat reaktif, seperti –NH2 (amina), -SH (merkapto) atau dapat terdiri dari beberapa gugus kimia fungsional.
3 silika dan alumina. Dari penelitiannya diperoleh dengan adanya modifikasi pada permukaan sepiolit dapat meningkatkan nilai kapasitas adsorpsinya terhadap logam Cr(VI), dibandingkan sepiolit tanpa proses modifikasi.Karena pertimbangan tersebut maka akan dilakukan penelitian sintesis zeolit dengan menggunakan metode sol gel, dan dilakukan peningkatan nilai Si dengan penambahan sumber silikat.
Perumusan Masalah
Permasalahan dalam penelitian ini berdasarkan uraian diatas adalah belum adanya metode sintesis zeolit untuk menghasilkan nilai rasio Si/Al yang diinginkan. Hal lainnya adalah belum adanya penelitian tentang modifikasi zeolit melalui metode sol gel, untuk meningkatkan kapasitas adsorpsi zeolit sintetis sebagai suatu adsorben.
Tujuan Penelitian
Penelitian ini bertujuan untuk mensintesis zeolit dari kaolin serta memodifikasinya menggunakan MPTS, melakukan pencirian zeolit sintetis dan zeolit sintetis termodifikasi menggunakan XRD dan SEM, dan uji adsorpsi dari kedua zeolit tersebut terhadap logam Cu (II) dan Biru Metilena.
Manfaat Penelitian
Penelitian ini diharapkan akan memberikan informasi tentang cara sintesis zeolit tertentu melalui penambahan sumber silika lain menggunakan metode sol gel, dan cara meningkatkan kapasitas adsorpsi zeolit sintetis sebagai adsorben dengan proses fungsionalisasi.
Hipotesis
Sintesis zeolit dari kaolin serta modifikasinya menggunakan MPTS dapat dilakukan menggunakan metode sol gel, sehingga dapat meningkatkan nilai kapasitas adsorpsinya terhadap logam Cu (II), dan Biru Metilena.
2 TINJAUAN PUSTAKA
Zeolit
4
Zeolit terbagi atas dua yaitu zeolit alam dan zeolit sintetik. Bentuk tiga dimensi dari zeolit dapat digambarkan sebagai berikut.
Gambar 1 Struktur Zeolit tiga dimensi
Zeolit alam pada umumnya terbentuk karena ada proses kimia dan fisika yang kompleks dari batu-batuan yang mengalami berbagai macam perubahan dialam. Zeolit alam adalah zeolit yang ditambang langsung dari alam. Dengan demikian harganya jauh lebih murah daripada zeolit sintesis. Zeolit alam merupakan mineral yang jumlahnya banyak tetapi distribusinya tidak merata.
Zeolit alam ditemukan dalam bentuk mineral dengan komposisi yang berbeda, terutama dalam nisbah Si/Al dan jenis logam yang menjadi komponen minor. Beberapa contoh jenis zeolit alam yang ditemukan adalah klinoptilolit (Na4K4)(Al8Si40O96).24H2O, modernit Na8(Al8Si40O96).24H2O, analsim Na16(Al16Si32O96).16H2O dan lain-lain (Auerbach etal. 2012). Zeolit alam memiliki beberapa kelemahan, diantaranya banyak mengandung pengotor seperti Na, Ca, Mg, K, dan Fe serta sifat kristalinitasnya yang kurang baik. Keberadaan pengotor tersebut dapat mengurangi aktivitas dari zeolit. Untuk dapat memperbaiki karakter zeolit alam sehingga dapat digunakan sebagai adsorben, katalis, atau aplikasi lainnya biasanya dilakukan aktivasi dan modifikasi terlebih dahulu. Selain untuk dapat menghilangkan pengotor-pengotor yang terdapat pada zeolit alam , proses aktivasi zeolit juga bertujuan untuk memodifikasi sifat-sifat yang dimilikinya,seperti luas permukaan dan keasaman. Salah satu kelebihan zeolit alam adalah memiliki luas permukaan dan keasaman yang mudah dimodifikasi. Aktivasi zeolit alam dapat dilakukan baik secara fisika maupun kimia. Aktivasi secara fisika dilakukan melalui pengecilan ukuran butir,pengayakan, dan pemanasan pada suhu tinggi, yang bertujuan untuk menghilangkan pengotor-pengotor organik, memperbesar pori, dan memperluas permukaan. Sedangkan aktivasi secara kimia dilakukan melalui pengasaman, yang bertujuan untuk menghilangkan pengotor anorganik (Yuanita. 2010). Rasio Si/Al yang terdapat pada zeolit alam bergantung kepada jenis mineral alam penghasil zeolit tersebut. Akan tetapi pada zeolit sintetis nilai rasio Si/Al dapat diatur berdasarkan proses sintesis yang dilakukan.
5 berkembangnya penelitian maka dikenal berbagai zeolit sintetik dan disajikan dalam Tabel 1.
Tabel 1 Rumus Oksida berbagai jenis zeolit sintetik (Georgiev et al. 2009) Zeolit Rumus Oksida
Zeolit A Na2O.Al2O3.2SiO2.4,5H2O
Zeolit N-A (Na,TMA)2O.Al2O3.4,8SiO2.7H2O TMA (CH3)4N+
Zeolit H K2O.Al2O3.2SiO2.4 H2O Zeolit L (K2Na2)O. Al2O3.6SiO2.5H2O Zeolit X Na2O.Al2O3.2,5SiO2.6H2O Zeolit Y Na2O.Al2O3.4.8SiO2.8,9H2O Zeolit P Na2O.Al2O3.2-5SiO2.5H2O
Zeolit O (Na2,K2,TMA2)O. Al2O3.7SiO2.3,5H2O;TMA (CH3)4N+
Zeolit Ω (Na,TMA)2O. Al2O3.7SiO2.5H2O;TMA (CH3)4N+
Zeolit ZK-4 0,85Na2O.0,15(TMA)2O. Al2O3.3,3SiO2.6H2O Zeolit ZK- 5 (R,Na2)O. Al2O3.4-6SiO2.6H2O
Dewasa ini zeolit sintetik terus dikembangkan, dengan dua fokus utama yaitu bahan baku dan metode.
Kaolin
Kaolinit adalah komponen utama dari kaolin. Proses pembentukan kaolin disebut kaolinisasi.Kaolin merupakan suatu jenis tanah liat berwarna putih, biasa digunakan dalam pembuatan kertas,cat,karet dan berbagai macam produk lainnya. Bentuk alami kaolin adalah serbuk halus yang berwarna putih.Struktur kaolin terdiri atas lapisan silika tetrahedral yang berseling dengan lapisan alumina oktahedral, yang membentuk lapisan mineral lempung dengan perbandingan 1:1 seperti ditunjukkan pada gambar 1. Pengulangan lapisan 1:1 dihubungkan satu dan lainnya dengan adanya ikatan hidrogen. Kaolin bila dilihat dengan menggunakan mikroskop elektron terlihat terdiri atas permukaan yang heksagonal, dengan ukuran kristal tipis berkisar antara 0,1 µm-10 µm atau lebih besar. Dialam kaolin dapat ditemukan dalam jumlah yang bervariasi dari berbagai mineral seperti muskovit, quartz dan anatase (Johnson. 2014). Struktur dari kaolin dapat dilihat pada Gambar 2.
6
Kaolin merupakan salah satu zat dengan kandungan silika dan alumina yang tinggi, sehingga dapat digunakan sebagai dasar pembuatan zeolit. Proses sintesis zeolit berbahan dasar kaolin pada tahapan awal melibatkan proses kalsinasi pada rentang suhu 700-1000 °C, sehingga dapat diperoleh suatu metakaolin melalui proses dehidroksilasi. Reaksi dari proseses metakaolinisasi adalah sebagai berikut :
Kaolinit Metakaolin
Si2Al2O5(OH)4 Al2O3.2SiO2 + 2H2O
Proses Sol-Gel
Proses sol-gel merupakan suatu teknik kimia basah untuk pembuatan suatubahan dengan materi awal berupa larutan kimia atau partikel-partikel koloidyang kemudian dapat menghasilkan suatu kesatuan disebut gel. Proses ini biasanya memungkinkan sintesis padatan pada temperatur ruang, yang diawali dengan terbentuknya larutan sol dan diikuti pembentukan gel dengan proses pemanasan sehingga menghasilkan padatan. Pada proses ini prekursor yang bisa digunakan adalah alkoksida logam dan klorida logam yang dapat mengalami reaksi hidrolisis dan polikondensasi membentuk koloid. Secara umum proses sol-gel dapat dibagi menjadi beberapa tahap meliputi pembentukan larutan, pembentukan gel, penuaan (aging), pengeringan dan pemadatan (Brinker dan scherer. 1990).Pada proses sol-gel dipengaruhi oleh beberapa faktor seperti konsentrasi dan tipe prekursor yang digunakan, bentuk geometri, ukuran bejana serta proses pengadukkan. Pembentukkan gel dari sol dapat berlangsung dalam hitungan detik atau beberapa hari. Proses sol-gel memiliki beberapa keuntungan diantaranya materi yang terbentuk memiliki homogenitas dan tingkat kemurnian yang tinggi, dapat dilakukan pengaturan pembentukkan struktur, dan variasi kondisi sintesis. Proses sol gel meliputi reaksi hidrolisis dan kondensasi yang berlangsung lebih dominan dibandingkan tahapan yang lain.
Adsorpsi
Adsorpsi adalah proses yang terjadi ketika fasa gas atau cairan terlarut terakumulasi pada permukaan adsorbat membentuk suatu lapisan molekul atau atom-atom. Menurut Oscik (1982) adsorpsi adalah fenomena yang terjadi pada permukaan akibat adanya gaya-gaya yang tidak seimbang pada batas antar muka, sehingga menyebabkan perubahan jumlah molekul, atom atau ion. Adsorpsi dapat dibedakan mejadi dua jenis yaitu adsorpsi kimia (chemisorption) dan adsorpsi fisika (physisorption).
Proses adsorpsi fisika molekul-molekul teradsorpsi dengan ikatan yang lemah pada permukaan adsorben, proses adsorpsi ini dapat balik sehingga memungkinkan terjadinya desorpsi pada temperatur yang sama. Energi yang menyertai proses adsorpsi fisika 0-20 kJ/mol (Jaycock etal. 1981). Adsorpsi fisika umumnya terjadi pada temperatur rendah, dan jumlah zat yang teradsorpsi akan semakin kecil dengan naiknya temperatur.Jumlah zat yang teradsorpsi dapat mencapai beberapa lapis (multilayer). Waktu kesetimbangan tercapai segera
550 °C
7 setelah adsorbat bersentuhan dengan adsorben, hal ini disebabkan karena adsorpsi fisika tidak melibatkan energi aktivasi.
Adsorpsi kimia melibatkan proses kimia pada zat yang teradsorpsi oleh adsorben, yaitu terjadi penurunan dan pembentukan ikatan sehingga sifat-sifat yang dimiliki adsorben dan adsorbat akan berubah. Energi yang diperlukan dalam proses adsorpsi kimia relatif tinggi sekitar 400 kJ/mol (Jaycock etal. 1981). Jumlah zat yang teradsorpsi hanya mencapai satu lapis (monolayer), dan biasa terjadi pada temperatur rendah dan tekanan yang tinggi dibandingkan dengan adsorpsi fisika. Adsorpsi kimia bersifat tidak dapat balik dan memerlukan energi yang tinggi untuk melepaskan adsorbat dari permukaan adsorben.
Isoterm adsorpsi Langmuir merupakan model adsorpsi yang sering digunakandalam pengolahan data. Isoterm ini digunakan untuk menunjukkan hubungan antara aktivitas adsorben dan jumlah zat teradsorpsi pada temperatur konstan. Langmuirmenyatakan bahwa pada permukaan adsorben terdapat sejumlah tertentu situsaktif yang sebanding dengan luas permukaannya. Menurut Shaw. 1983isotermadsorpsi Langmuir hanya dapat diterapkan jika ada asumsi bahwa adsorpsi hanyaberlangsung satu lapis (monolayer), adsorpsi terlokalisasi, dan panas adsorpsi tidak tergantung pada lapisan permukaan.Persamaan isoterm adsorpsi Langmuir dapat dituliskan sebagai berikut :
qe = qmbCe 1 + bCe
Dengan qe adalah jumlah adsorbat yang teradsorpsi per unit bobot adsorben pada kesetimbangan (mg/g), qm kapasitas adsorpsi maksimum (mg/g), Ce konsentrasi kesetimbangan adsorbat dalam larutan(mg/L), b konstanta yang berhubungan dengan energi bebas adsorpsi(L/mg). Harga energi adsorpsi dapatditentukan melalui persamaan :
E = -ΔG ° = RT ln K
Dengan R = 8,314 J/mol K, K = konstanta kesetimbangan dan T = 300 K
3 METODE
Tempat dan waktu penelitian
Penelitian dilaksanakan pada bulan Desember 2014 sampai Juni 2015 di Laboratorium SMK Farmasi dan Laboratorium Akademi Kimia Analisis Bogor.
Bahan dan Alat
Kaolin Bangka Belitung, natrium silikat dengan kandungan Na2O 7.5-8.5%. SiO2 25.5-28.7% (Merck),HCl 37%,3-merkaptopropil-trimetoksisilana (Merck),NaOH, Al(OH)3, larutan ion logam Cu(II)CuSO4.2H2O (Merck), biru
metilena (Merck) dan akuades.
8
Lingkup Kerja
Penelitian ini terdiri dari beberapa tahap, yaitu preparasi metakaolin, sintesis natrium aluminat, sintesis zeolit, fungsionalisasi zeolit sintetis dengan MPTS, dan adsorpsi logam Cu(II) serta biru metilena terhadap zeolit sintetis dan zeolit sintetis terfungsionalisasi MPTS.
Prosedur Penelitian Preparasi Metakaolin (Trivana. 2013)
Kaolin dianalisis berasal dari Provinsi Bangka Belitung. Preparasi metakaolin dimulai dengan memanaskan kaolin Bangka Belitung pada suhu 900 °C selama 6 jam, sehingga akan diperoleh suatu metakaolin. Proses persiapan selanjutnya adalah melakukan sintesis natrium silikat dengan menggunakan kaolin yang telah dikalsinasi.
Pembuatan Larutan Natrium Aluminat (Kovo.2009)
Sebanyak 30.50 gram NaOH dilarutkan dalam 100 mL akuades kemudian dipanaskan hingga larut. Larutan tersebut ditambahkan 21.65 gram Al(OH)3 diaduk dan diencerkan sampai dengan volumenya 250 mL.
Proses sintesis zeolit
Proses sintesis zeolit dilakukan menggunakan metode sol gel. Sintesis zeolit dilakukan dengan menggunakan bahan baku yang berbeda, yaitu melalui penambahan sumber silika dan tanpa penambahan sumber silika.
Sintesis sampel AX
Proses sintesis zeolit dilakukan dengan menambahkan sejumlah tertentu natrium silikat yang dibuat dari metakaolin dengan penambahan sumber natrium silikat. Setiap campuran tersebut kemudian diaduk selama 2 jam sehingga akan terbentuk gel berwarna putih. Kemudian dilakukan sintesis pada temperatur 80°C selama 8 jam. Hasil sintesis dicuci dengan akuades sampai pH netral. kemudian dikeringkan dioven pada suhu 120°C selama 3 jam (Kovo. 2011). Hasil yang diperoleh kemudian dikarakterisasi menggunakan XRD, dan SEM. Nilai perbandingan volume pencampuran kedua natrium silikat dapat dilihat pada Tabel 2.
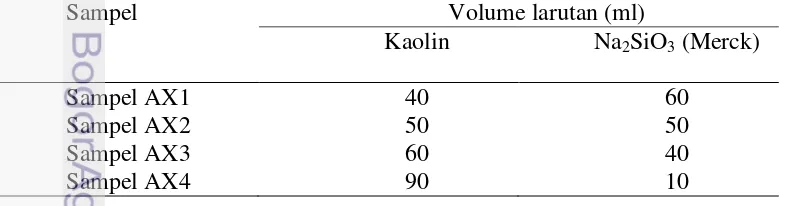
Tabel 2 Perbandingan volume dalam sintesis zeolit AX
Sampel Volume larutan (ml)
Kaolin Na2SiO3 (Merck)
Sampel AX1 40 60
Sampel AX2 50 50
Sampel AX3 60 40
9 Sintesis sampel AZ
Proses sintesis zeolit AZ dilakukan dengan menambahkan sejumlah tertentu metakaolin dengan penambahan natrium aluminat. Setiap campuran tersebut kemudian diaduk selama 2 jam sehingga akan terbentuk gel berwarna putih. Kemudian dilakukan sintesis pada temperatur 80°C selama 8 jam. Hasil sintesis dicuci dengan akuades sampai pH netral, kemudian dikeringkan dioven pada suhu 120°C selama 3 jam (Kovo. 2011). Hasil yang diperoleh kemudian dikarakterisasi menggunakan XRD, dan SEM. Nilai perbandingan volume pencampuran kedua larutan dapat dilihat pada Tabel 3.
Tabel 3 Perbandingan volume sintesis zeolit AZ
Sampel Volume larutan (ml)
Kaolin Na-Aluminat
Sampel AZ1 40 60
Sampel AZ2 50 50
Sampel AZ3 60 40
Fungsionalisasi zeolit dengan MPTS (Nuryono.2011)
Fungsionalisasi zeolit dengan MPTS dilakukan dengan cara menambahkan 2 mL MPTS kedalam proses sintesis zeolit AX serta AZ. Kemudian ditambahkan HCl 3M tetes demi tetes sambil diaduk dengan pengaduk magnet sehingga diperoleh gel sampai dengan pH 7. Gel yang diperoleh didiamkan semalam, kemudian dicuci dengan akuades hingga pH netral, dan dikeringkan didalam oven selama 2 jam pada suhu 100°C.
Adsorpsi Cu(II)
Sebanyak 100 mg zeolit sintetis ditempatkan dalam wadah plastik. Adsorpsi dilakukan dengan sistem batch dengan cara menambahkan larutan Cu(II) dengan variasi konsentrasi 10, 20, 30, 40, 50 mg/L. dengan volume masing-masing sebanyak 50 ml. Campuran adsorben dan larutan logam diaduk dengan pengaduk magnet selama 1 jam. Selanjutnya larutan disentrifuse dengan kecepatan 2000 rpm untuk memisahkan supernatan dan adsorben. Masing-masing supernatan dianalisis menggunakan spektrometer serapan atom (AAS) untuk menentukan jumlah ion logam yang teradsorpsi. Hal yang sama dilakukan pula zeolit yang termodifikasi MPTS.
Adsorpsi Biru Metilena (Trivana.2013)
10
Q = V[Co-Ca] m Keterangan :
Q = kapasitas adsorpsi (mg/g) V= volume larutan (mL) Co= konsentrasi awal (ppm) Ca= konsentrasi akhir (ppm) m = massa adsorben (gram)
4 HASIL DAN PEMBAHASAN Hasil Kalsinasi Kaolin
Kaolin digunakan sebagai bahan baku untuk pembentukan kerangka zeolit. karena komponen utamanya merupakan silika dan alumina. Kaolin yang akan digunakan terlebih dahulu dikalsinasi pada suhu 900 ˚C selama 6 jam. Proses kalsinasi atau pemanasan dapat menguapkan H2O sehingga terjadi pelepasan ikatan –OH pada kaolinit. Peristiwa ini mengakibatkan kaolin yang berbentuk kristalin menjadi lebih amorf.
Proses kalsinasi bertujuan untuk menghasilkan fase metakaolin, disertai dengan adanya transformasi kaolin. Fase metakaolin akan terbentuk alumina amorf dan silika amorf. Pada proses ini terjadi perubahan dari kaolin menjadi metakaolin, dengan hilangnya gugus-OH sehingga dapat meningkatkan nilai reaktivitas dari kaolin pada fasa metastabil sehingga dapat diubah menjadi bentuk zeolit. Reaksi kaolin menjadi metakaolin adalah sebagai berikut :
Kaolinit Metakaolin
Si2Al2O5(OH)4 Al2O3.2SiO2 + 2H2O
Metakaolin hasil kalsinasi dianalisis dengan menggunakan XRD, seperti ditunjukkan pada Gambar 3.Hasil XRD kaolin menjadi metakaolin menunjukkan adanya puncak yang landai. Terbentuknya kaolin dapat didentifikasi pada perubahan sudut 2θ 15˚-37˚. Hal ini menjelaskan metakaolin yang diperoleh berbentuk amorf. Proses kalsinasi meruntuhkan struktur lembaran oktahedral pada kaolin, sehingga pada metakaolin yang terbentuk hanya terdapat struktur tetrahedral yang dapat digunakan sebagai kerangka pembangun zeolit sintetis. Metakaolin yang diperoleh kemudian digunakan untuk membuat larutan natrium silikat.
11
Gambar 3 Difraktrogram Metakaolin Zeolit Sampel AX
Pada sintesis zeolit sampel AX digunakan natrium silikat yang telah dibuat dari metakaolin dan dicampurkan pada proses sol-gel dengan beberapa variasi volume. Dari beberapa perbandingan volume yang tertera pada Tabel 2, sintesis zeolit hanya dapat terjadi pada sampel AX2 dan AX4. Proses sintesis zeolit dengan menambahkan Na2SiO3 bertujuan untuk menambahkan sumber silika lain sehingga dapat meningkatkan nilai rasio Si pada zeolit yang akan disintesis. Zeolit Sampel AX2 dan AX4 yang terbentuk kemudian dimodifikasi dengan menggunakan MPTS. Fungsionalisasi pada zeolit sintetis ini bertujuan untuk dapat meningkatkan nilai kapasitas adsorpsi dari zeolit tersebut.
Hasil Pencirian Zeolit AX2 dan AX2 termodifikasi dengan XRD
Pencirian Zeolit AX2 dengan teknik difraksi sinar-X pada kondisi : atom target Cu, panjang gelombang 1.540598 Å, dan rentang sudut 8-65˚. Difraksi sinar-X digunakan untuk mengidentifikasi jenis mineral zeolit. Puncak difraksi yang didapatkan. selanjutnya dicocokkan dengan puncakstandar difraksi sinar-X. yaitu JCPDS (PDF 38-0240) (Joint Commited on Powder Difraction Standards) dan dari beberapa jurnal hasil penelitianliteratur. . Hasil XRD sampel AX2 ditampilkan pada Gambar 4.Hasil XRD sampel AX2 memberikan nilai puncak serapan pada daerah 2θ 26.7˚, 27.53˚, 30.61˚ dan 31.26˚. Zeolit yang terbentuk merupakan zeolit Ydengan rumus molekul Na2O.Al2O3.4,8SiO2.8.9H2O (Georgiev. 2009). Kerangka kerja Zeolit Y memiliki kemiripan seperti faujasit alam yang kaya silikon (Weitkamp and Puppe. 1999). Jika dibandingkan dengan zeolit A, rasio Si/Al yang dimiliki zeolit Y antara 1.5-3. Hal ini menunjukan zeolit yang yangdihasilkan tergolong rendah (<5). Tinggi rendahnya rasio Si/Al akan mempengaruhi kestabilan dari kristal.
int
ensit
12
Gambar 4 Difraktrogram zeolit sampel AX2 Sampel AX2 termodifikasi
Hasil pencirian sampel AX2 termodifikasi MPTS menunjukkan serapan 2θ pada daerah 27.53˚ dan 31.26˚ (Gambar 5).Hilangnya serapan pada daerah 2θ 26.7˚ dan 30.26˚ akibat adanya proses modifikasi.Pada proses sol-gel. penambahan asam (HCl) bertujuan untuk membentuk jaringan gel yang dapat membentuk gugus silanol dan siloksan. Namun proses ini berlawanan dengan proses pembentukan kristal zeolit yang berlangsung pada suasana basa,sehingga penambahan HCl dapat merusak zeolit Y yang terbentuk. Pada suasana basa akan terjadi polimerisasi ion-ion pembentuk zeolit dan terbentuk anion Al(OH4)- atau AlO2- yang merupakan anion pembentuk zeolit yang bersumber dari alumina. Jika pH larutan asam antara 1-4, maka spesies Al yang dominan adalah [Al(H2O)6]3+ (Sriatun. 2004). Kation tersebut dapat menghambat pembentukan kerangka aluminasilikat dari zeolit. Rendahnya nilai rasio Si/Al zeolit Y yang dihasilkan, serta penambahan asam pada saat proses modifikasi dapat merusak kestabilan kristal. Kondisi asam atau panas akan menyebabkan kerangka tetrahedral pada zeolit tidak stabil, sehingga dapat menghambat proses pembentukkan kristal dari zeolit sintetis.
13
Gambar 5 Difraktogram sampel AX2 termodifikasi MPTS Hasil Pencirian Zeolit AX2 dan AX2 termodifikasi dengan SEM Mikroskop pemindai elektron (SEM) digunakan untuk mengetahui struktur mikro suatu material, meliputi tekstur, morfologi, komposisi dan informasi kristalografi permukaan sampel. Hasil SEM sampel AX2 dan AX2 termodifikasi MPTS ditunjukkan pada Gambar 6.
Gambar 6 Hasil analisis SEM sampel AX2 (a) dan sampel AX2 termodifikasi MPTS (b)
Zeolit Y memiliki ukuran diameter pori sekitar 7.4 Å. Zeolit Y sebelum dan telah dimodifikasi memiliki ukuran partikel yang sama dengan perbesaran 1000x. Namun bentuk kristal antara kedua sampel berbeda. Berkurangnya penampakan struktur kristal dari zeolit Y kemungkinan diakibatkan karena rusaknya kristal zeolit Y yang terbentuk dengan adanya penambahan MPTS. Keseragaman ukuran partikel dari zeolit Y sebelum dilakukan modifikasi tampak lebih baik bila
a
ZeolitY termodifikasi
14
dibandingkan setelah terjadi modifikasi. Struktur dasar unit pembangun zeolit Y adalah kerangka dari sodalit yang tersusun membentuk kerangka dengan ukuran lebih besar (Taufiqurahmi. 2011). Kerangka Al- di dalam struktur zeolit Y merupakan pusat asam, tetapi juga merupakan titik lemah kristal zeolit. Kerangka tersebut dapat rusak apabila zeolit Y dipanaskan pada suhu tinggi.
Uji adsorpsi Cu(II) dan biru metilena pada sampel AX2 dan AX2 termodifikasi
Zeolit hasil sintesis kemudian diuji kemampuannya sebagai adsorben dengan menggunakan logam Cu(II) dan dalam menyerap zat warna Biru Metilena. Interaksi Logam Cu(II) dan zat warna biru metilena dengan air akan menghasilkan ion positif, sedangkan zeolit bemuatan negatif sebagai akibat dari subtitusi Al3+ terhadap Si4+ dalam struktur jaringannya. Muatan negatif tersebut dapat dinetralkan oleh kation alkali atau alkali tanah. Kation-kation ini mampu dipertukarkan oleh logam Cu(II) maupun zat warna Biru Metilena, sehingga keduanya dapat terjerap dan dapat diamati kapasitas adsorpsi dari zeolit sintetis yang dihasilkan.
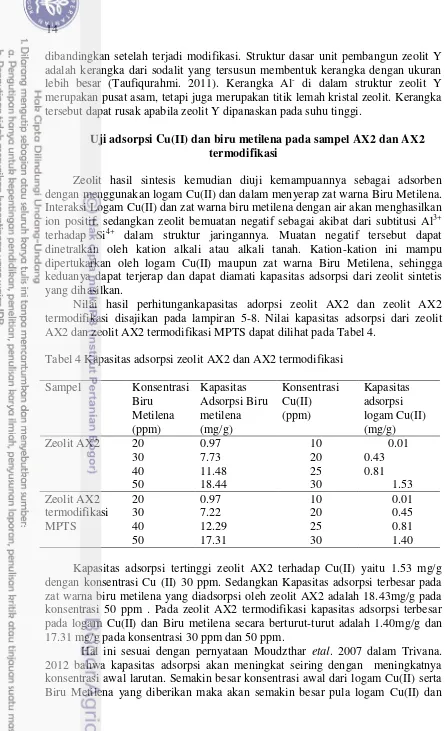
Nilai hasil perhitungankapasitas adorpsi zeolit AX2 dan zeolit AX2 termodifikasi disajikan pada lampiran 5-8. Nilai kapasitas adsorpsi dari zeolit AX2 dan zeolit AX2 termodifikasi MPTS dapat dilihat pada Tabel 4.
Tabel 4 Kapasitas adsorpsi zeolit AX2 dan AX2 termodifikasi Sampel Konsentrasi
Biru dengan konsentrasi Cu (II) 30 ppm. Sedangkan Kapasitas adsorpsi terbesar pada zat warna biru metilena yang diadsorpsi oleh zeolit AX2 adalah 18.43mg/g pada konsentrasi 50 ppm . Pada zeolit AX2 termodifikasi kapasitas adsorpsi terbesar pada logam Cu(II) dan Biru metilena secara berturut-turut adalah 1.40mg/g dan 17.31 mg/g pada konsentrasi 30 ppm dan 50 ppm.
15 Biru Metilena yang terjerap. Proses ini terjadi apabila masih terdapat tapak aktif sampel untuk menjerap logam ataupun zat warna.
Isoterm adsorpsi
Isoterm adsorpsi bertujuan untuk menentukan hubungan kesetimbangan antara konsentrasi adsorbat dalam fluida dan dalam permukaan adsorben. Persamaan adsorpsi logam Cu(II) dan Biru Metilena yang digunakan adalah persamaan Freundlich dan Langmuir. Nilai kuadrat terkecil (R2) isoterm Freundlich dan Langmuir ditunjukkan pada Tabel 5.
Tabel 5 Nilai kuadrat terkecil (R2) isoterm adsorpsi logam Cu(II) dan Biru Nilai kuadrat terkecil (R2) dari kedua persamaan Langmuir dan Freundlich yang memiliki nilai paling besar atau mendekati satu merupakan kurva yang paling sesuai. Berdasarkan nilai kuadrat terkecil (R2). Adsorpsi Cu(II)dan Biru Metilena oleh sampel zeolit AX2 dan zeolit AX2 termodifikasi MPTS mengikuti persamaan Langmuir. Hal ini menunjukkan bahwa proses adsorpsi hanya berlangsung satu lapis (monolayer).
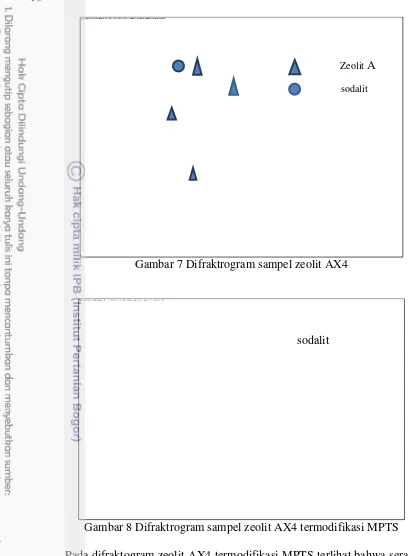
Hasil Pencirian Zeolit AX4 dan AX4 termodifikasi dengan XRD Hasil pencirian zeolit AX4 dan zeolit AX4 termodifikasi akan ditunjukkan pada Gambar 7 dan 8 .Pada difraktogram sampel AX4 terdapat beberapa puncak pada nilai 2θ yaitu 21.62˚ 23.94 ˚. 26.05˚. dan 27.08˚. Puncak-puncak tersebut merupakan interpretasi data dari zeolit A yang sesuai dengan data JCPDS . Sudut 2θ lainnya adalah 24.13˚ adalah puncak yang dimiliki oleh sodalit (Ahmad Yani. 2015).
16
Gambar 7 Difraktrogram sampel zeolit AX4
Gambar 8 Difraktrogram sampel zeolit AX4 termodifikasi MPTS Pada difraktogram zeolit AX4 termodifikasi MPTS terlihat bahwa serapan pada daerah 2θ zeolit A hilang (Gambar 8). Serapan pada daerah sudut 2θ ciri dari sodalit bertahan pada 24.13˚ (Yani. 2015). Hal ini menunjukkan bahwa penambahan MPTS tidak merusak struktur kristal dari sodalit,karena sodalit memiliki struktur kristal yang lebih stabil bila dibandingkan zeolit A.
Hasil Pencirian Zeolit AX4 dan AX4 termodifikasi dengan SEM
Zeolit AX4 dari sodalit dan zeolit A menghasilkan bentuk partikel-partikel kecil yang menyebar pada perbesaran 1000x (Gambar 9). Bentuk yang berbeda
Zeolit A sodalit
17 dihasilkan dari zeolit AX4 termodifikasi MPTS (Gambar 10). Setelah proses modifikasi tampak bahwa ukuran dan bentuk partikel dari sodalit lebih besar bila dibandingkan sebelum proses modifikasi. Bentuk partikel dari zeolit A hilang dan hanya terdapat bentuk partikel dari sodalit saja. Hal ini disebabkan nilai rasio Si/Al pada sodalit antara 2-5 sehingga strukturnya lebih stabil bila dibandingkan dengan zeolit A. Proses modifikasi menggunakan MPTS tidak merusak pembentukan kristal dari sodalit.
Gambar 9 Hasil analisis SEM sampel zeolit AX4
Gambar 10 Hasil analisis SEM sampel zeolit AX4 termodifikasi MPTS Uji adsorpsi Cu(II) dan Biru Metilena pada sampel AX4 dan AX4
termodifikasi
Nilai hasil perhitungan nilai kapasitas adorpsi zeolit AX4 dan zeolit AX4 termodifikasi disajikan pada lampiran 9-12. Nilai kapasitas adsorpsi logam Cu(II)
sodalit
Zeolit A
18
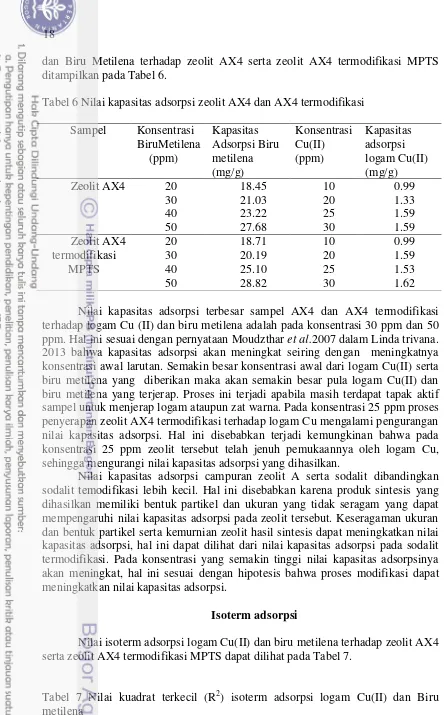
dan Biru Metilena terhadap zeolit AX4 serta zeolit AX4 termodifikasi MPTS ditampilkan pada Tabel 6.
Tabel 6 Nilai kapasitas adsorpsi zeolit AX4 dan AX4 termodifikasi Sampel Konsentrasi terhadap logam Cu (II) dan biru metilena adalah pada konsentrasi 30 ppm dan 50 ppm. Hal ini sesuai dengan pernyataan Moudzthar et al.2007 dalam Linda trivana. 2013 bahwa kapasitas adsorpsi akan meningkat seiring dengan meningkatnya konsentrasi awal larutan. Semakin besar konsentrasi awal dari logam Cu(II) serta biru metilena yang diberikan maka akan semakin besar pula logam Cu(II) dan biru metilena yang terjerap. Proses ini terjadi apabila masih terdapat tapak aktif sampel untuk menjerap logam ataupun zat warna. Pada konsentrasi 25 ppm proses penyerapan zeolit AX4 termodifikasi terhadap logam Cu mengalami pengurangan nilai kapasitas adsorpsi. Hal ini disebabkan terjadi kemungkinan bahwa pada konsentrasi 25 ppm zeolit tersebut telah jenuh pemukaannya oleh logam Cu, sehingga mengurangi nilai kapasitas adsorpsi yang dihasilkan.
Nilai kapasitas adsorpsi campuran zeolit A serta sodalit dibandingkan sodalit temodifikasi lebih kecil. Hal ini disebabkan karena produk sintesis yang dihasilkan memiliki bentuk partikel dan ukuran yang tidak seragam yang dapat mempengaruhi nilai kapasitas adsorpsi pada zeolit tersebut. Keseragaman ukuran dan bentuk partikel serta kemurnian zeolit hasil sintesis dapat meningkatkan nilai kapasitas adsorpsi, hal ini dapat dilihat dari nilai kapasitas adsorpsi pada sodalit termodifikasi. Pada konsentrasi yang semakin tinggi nilai kapasitas adsorpsinya akan meningkat, hal ini sesuai dengan hipotesis bahwa proses modifikasi dapat meningkatkan nilai kapasitas adsorpsi.
Isoterm adsorpsi
Nilai isoterm adsorpsi logam Cu(II) dan biru metilena terhadap zeolit AX4 serta zeolit AX4 termodifikasi MPTS dapat dilihat pada Tabel 7.
19
Nilai kuadrat terkecil (R2) dari kedua persamaan Langmuir dan Freundlich yang memiliki nilai paling besar atau mendekati satu merupakan kurva yang paling sesuai. Berdasarkan nilai kuadrat terkecil (R2). adsorpsi Cu(II) dan biru metilena oleh sampel zeolit AX4 dan zeolit AX4 termodifikasi MPTS mengikuti persamaan Langmuir. Hal ini menunjukkan bahwa proses adsorpsi hanya berlangsung satu lapis (monolayer).
Hasil pencirian Zeolit AZ3 dan AZ3 termodifikasi dengan XRD
Pada sintesis zeolit sampel AZ digunakan natrium silikat yang telah dibuat dari metakaolin dan mencampurkannya dengan natrium aluminat melalui proses sol-gel pada beberapa variasi volume. Hasil interpretasi data dari puncak-puncak difraktogram beberapa sudut 2θ pada sampel AZ3 memiliki puncak khas yang dimiliki oleh zeolit A adalah 10.16˚. 12.46˚. 16.10˚. 21.66˚ dan 34.15˚ (Gambar 11).
Hasil interpretasi data dari puncak-puncak difraktogram beberapa sudut 2θ pada sampel AZ3 termodifikasi MPTS tidak berbeda dengan sebelum termodifikasi 10.07˚, 12.48˚, 16.00˚, 21.55˚ dan 34.16˚ merupakan puncak khas yang dimiliki oleh zeolit A. Beberapa penelitian menunjukkan bahwa zeolit A berhasil disintesis dengan menggunakan bahan baku kaolin seperti yang dilakukan oleh Kwakye et al. 2014 berhasil mensintesis zeolit A menggunakan metode hidrotermal.
Proses sintesis zeolit antara kaolin dan natrium aluminat mengakibatkan adanya interaksi antara aluminat dan silikat sehingga diperoleh gel berwarna putih. Hal ini menunjukkan terdapatnya interaksi yang kuat antara kedua spesies tersebut dan merupakan dimulainya proses polimerisasi dari silikat dan aluminat. Pembentukan kristal zeolit dapat terjadi saat kondensasi disertai polimerisasi spesies aluminat dan silikat dalam larutan lewat jenuh.
20
suhu 120 ˚C selama 3 jam akan menyempurnakan pertumbuhan kristal, sehingga akan diperoleh padatan berupa suatu zeolit A.
Proses modifikasi pada zeolit A dapat mempengaruhi nilai serapan yang dihasilkan, hal ini dapat terlihat pada difraktogram Gambar 11 dan 12, bila dibandingkan maka nilai serapan zeolit A pada sudut-sudut 2θ pada Gambar 11 tampak lebih tajam dibandingkan pada Gambar 12.
Gambar 11 Difraktogram sampel AZ 3
Gambar 12 Difraktogram sampel AZ 3 termodifikasi MPTS
Hasil Pencirian Zeolit AZ3 dan AZ3 termodifikasi dengan SEM Pencirian bentuk partikel dari zeolit AZ3 dan zeolit AZ3 termodifikasi pada perbesaran 4000x ditampilkan pada Gambar 13 dan 14. Bentuk partikel dari zeolit A didapatkan pada sintesis zeolit AZ3 dan zeolit AZ3 termodifikasi. Bentuk partikel dari zeolit A pada perbesaran yang sama sebelum dilakukan proses
Zeolit A
21 modifikasi menggunakan MPTS ukurannya tidak seragam. Setelah dilakukan modifikasi pada zeolit A ukuran partikelnya tampak lebih seragam. Zeolit A memiliki nilai rasio Si/Al = 1 adanya perbandingan nilai rasio yang sesuai. serta kemurnian hasil dari sintesis AZ3 menyebabkan strukturnya tampak lebih stabil ketika dilakukan proses modifikasi menggunakan MPTS. Bentuk kerangka dari zeolit A merupakan suatu molekul tetrahedral aluminosilikat. yang banyak mengandung penukar kation. Semakin seragam bentuk molekulnya maka diharapkan akan meningkatkan jumlah penukar kation di dalamnya. sehingga semakin baik digunakan untuk mengadsorpsi logam serta zat warna.
Gambar 13 Hasil analisis SEM sampel AZ3
Gambar 14 Hasil analisis SEM sampel AZ3 termodifikasi MPTS Uji adsorpsi Cu(II) dan biru metilena pada sampel AZ3 dan AZ3
termodifikasi
22
Tabel 8 Nilai kapasitas adsorpsi zeolit AZ3 dan AZ3 termodifikasi
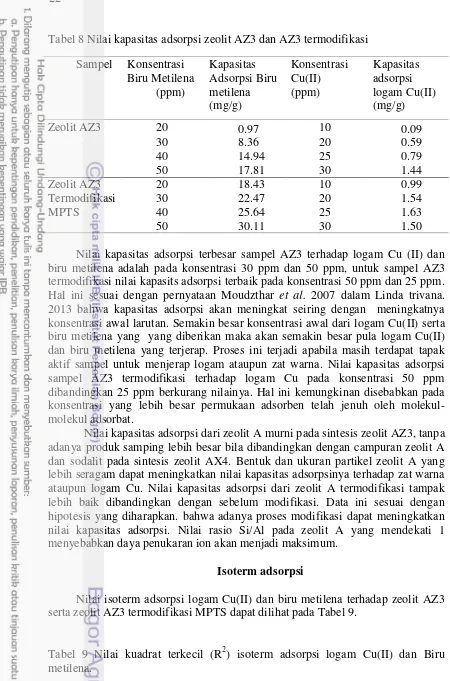
Nilai kapasitas adsorpsi terbesar sampel AZ3 terhadap logam Cu (II) dan biru metilena adalah pada konsentrasi 30 ppm dan 50 ppm, untuk sampel AZ3 termodifikasi nilai kapasits adsorpsi terbaik pada konsentrasi 50 ppm dan 25 ppm. Hal ini sesuai dengan pernyataan Moudzthar et al. 2007 dalam Linda trivana. 2013 bahwa kapasitas adsorpsi akan meningkat seiring dengan meningkatnya konsentrasi awal larutan. Semakin besar konsentrasi awal dari logam Cu(II) serta biru metilena yang yang diberikan maka akan semakin besar pula logam Cu(II) dan biru metilena yang terjerap. Proses ini terjadi apabila masih terdapat tapak aktif sampel untuk menjerap logam ataupun zat warna. Nilai kapasitas adsorpsi sampel AZ3 termodifikasi terhadap logam Cu pada konsentrasi 50 ppm dibandingkan 25 ppm berkurang nilainya. Hal ini kemungkinan disebabkan pada konsentrasi yang lebih besar permukaan adsorben telah jenuh oleh molekul-molekul adsorbat.
Nilai kapasitas adsorpsi dari zeolit A murni pada sintesis zeolit AZ3, tanpa adanya produk samping lebih besar bila dibandingkan dengan campuran zeolit A dan sodalit pada sintesis zeolit AX4. Bentuk dan ukuran partikel zeolit A yang lebih seragam dapat meningkatkan nilai kapasitas adsorpsinya terhadap zat warna ataupun logam Cu. Nilai kapasitas adsorpsi dari zeolit A termodifikasi tampak lebih baik dibandingkan dengan sebelum modifikasi. Data ini sesuai dengan hipotesis yang diharapkan. bahwa adanya proses modifikasi dapat meningkatkan nilai kapasitas adsorpsi. Nilai rasio Si/Al pada zeolit A yang mendekati 1 menyebabkan daya penukaran ion akan menjadi maksimum.
Isoterm adsorpsi
Nilai isoterm adsorpsi logam Cu(II) dan biru metilena terhadap zeolit AZ3 serta zeolit AZ3 termodifikasi MPTS dapat dilihat pada Tabel 9.
Tabel 9 Nilai kuadrat terkecil (R2) isoterm adsorpsi logam Cu(II) dan Biru metilena.
23
Sampel Isoterm R2
Cu(II) Biru metilena Zeolit AX4
Nilai kuadrat terkecil (R2) dari kedua persamaan Langmuir dan Freundlich yang memiliki nilai paling besar atau mendekati satu merupakan kurva yang paling sesuai. Berdasarkan nilai kuadrat terkecil (R2). adsorpsi Cu(II)dan biru metilena oleh sampel zeolit AZ3 dan zeolit AZ3 termodifikasi MPTS mengikuti persamaan Langmuir. Hal ini menunjukkan bahwa proses adsorpsi hanya berlangsung satu lapis (monolayer). Nilai kuadrat terkecil pada isoterm adsorpsi terhadap zat warna biru metilena lebih besar dibandingkan pada logam Cu, hal ini menjelaskan bahwa zeolit A termodifikasi baik digunakan sebagai adsorben pada zat warna.
5 SIMPULAN DAN SARAN
Simpulan
Zeolit Y dan zeolit A serta sodalit berhasil disintesis menggunakan bahan baku kaolin melalui proses sol-gel. Modifikasi menggunakan MPTS terhadap zeolit sintetis hanya berhasil dilakukan pada sodalit serta serta zeolit A. Penggunaan HCl pada proses modifikasi zeolit Y menggunakan MPTS, dapat menghambat proses pembentukan kristal zeolit Y. Modifikasi pada zeolit AX4 serta AZ3 dapat meningkatkan nilai kapasitas adsorpsi dari zeolit yang dihasilkan. Nilai kapasitas adsopsi terbesar dimiliki oleh zeolit AZ3 untuk menjerap biru metilena , yaitu 30.11 mg/g. Pada proses adsorpsi terhadap logam Cu kapasitas adsorpsi terbaik dimiliki oleh zeolit AZ3 termodifikasi MPTS dengan nilai 1. 63 mg/g. Kapasitas adsorpsi terhadap biru metilena oleh zeolit AZ3 mengalami peningkatan bila dibandingkan dengan penelitian Jamil. 2011 hanya menghasilkan kapasitas adsorpsi dengan nilai 4. 22 mg/g. Adsorpsi yang terjadi pada semua jenis zeolit sintetis mengikuti isoterm Langmuir.
Saran
Perlu dilakukan metode lain untuk memodifikasi zeolit sintetis menggunakan MPTS, tanpa melibatkan proses penambahan asam, dan dilakukan penelitian lanjutan untuk mengetahui proses modifikasi zeolit sintesis pada suasana basa.
24
Auerbach. Scott M. Prabbir K. 2003. Handbook of zeolit science and technology. Marcel Dekker Inc. New York.
Azizi SN. Maybodi AS. Fatemi MH. and Asemi N. 2013. Using Taguchi experimental Design to develop an Optimized Synthesis Procedure of Sodalite Prepared by Microwave and Ultrasonic Assisted Aging.Caspian Journal of Chemistry. 2(5): 1-7.
Aznar AJ et al. 1995. Silica from sepiolite:preparation.textural properties.and use as support to catalyst. Journal of microporous materials.6(2) :105-114 Brinker CJ. Scherer WJ. 1990. Gel Science : The Physic andChemistry of
Sol-Gel Processing. Academic Press. San Diego.
Georgiev D. Bogdanov B. Krasimira A. Irena M. Hristov Y. 2009. Synthetic zeolites-structure.classification.current trends in zeolites synthetic review. International Science Conference. Bulgaria.
Johnson EBG. Sazmal EA. 2014. Hydrothermally synthesized zeolites based on kaolinite : a review. Journal of Applied Clay Science. 95 (2):215-221. Kwakye AB. Vonkiti B. Buamah R. Nkrumah I. Williams C. 2014. Effect of
crystallization time on hydrothermal synthesis of zeolites from kaolin and bauxite. International Journal of Scientific and Engineering Research. 5 (2):734-741.
Marjanovic V. Lazarevic S. JankovicCV. Potkonjak B. Janackovic D. Petrovic R. 2011. Chromium (VI) removal from aqueos solution using mercaptosilane functionalized sepiolites.Journal of chemical engineering v 6(11): 198-206. Marjanovic V. Lazarevic S. JankovicCV. Potkonjak B. Janackovic D. Petrovic R.
2013. Functionalization of thermo-acid activated sepiolite by amine-silane and mercapto silane for chromium (VI) adsorption from aqueos solution.Scientific paper. Hem Ind .67(5):715-728.
Nickolov R. Tzevtkova R. 2012. Modified and Unmodified Silica Gel used for heavy metal ions removal from aqueous solution. Journal of university of chemical technology and methalurgy. 47(5):498-504.
Oscik. J. 1982. Adsorption. Ellis Horwood Limited. England.
Puppe L. Weitkamp J .1999. Catalysis and Zeolites Fundamental and aplications. Springer. NewYork.
Putra R. Khamidinal. Didik K. 2015. Adsorpsi ion Mn(II) pada zeolit yang disintesis dari abu dasar batubara termodifikasi Ditizon. Prosiding Seminar Nasional Teknik Kimia Kejuangan.
Radityo D. 2012. Optimasi Kondisi Operasi pada Pembentukan Sol-Gel Aluminosilikat menggunakan Jet Bubble Column untuk Efisiensi Rute Pembuatan ZSM-5 [skripsi]. Jakarta [ID] : Universitas Indonesia. Jakarta. Rahman MM. Awang MB. Yusof AM. 2012. Preparation.Characterization and
Application of Zeolite-Y for Waste Filtration. Australian Journal of Basic and Applied Sciences.6(1) : 50-54.
Reyes. Carlos AR.Luz Y.2011. Application of Illite and Kaolinite rich clays in the synthesis of zeolites for wastewater treatment. Earth and Enviromental Science. In Tech. Croatia.
25 Absorption Spectrometry. American Journal of Analytical Chemistry. 4(3) : 584-593.
Silva VJ . Rodrigues JJ. Soares RR. Napolitano MN.Rodrigues MGF. 2013. Cobalt supported on ZSM-5 Zeolite using kaolin and silicon and aluminum sources for fischer-tropsch synthetis. Brazilian journal of petroleum and gas 7(3) :083-094.
Sriatun, Arina O, Darmawan. 2008. Modifikasi zeolit alam dengan ligan EDTA untuk adsorpsi ion logam Pb2+ dan Cd2+. Jurnal Kimia Sains dan Aplikasi. 11(3): 1-7.
Taufiqurahmi N. Abdul RM. and Subhash B. 2011. Nanocrystallline Zeolite Y : Synthesis and Characterization. IOP Conference series: Materials Sciences and Engineer . 17(2011) : 1-7.doi:10.1088/1757-899X/17/1/012030.
Trivana L. 2012. Sintesis Zeolit X dan nanokomposit zeolit/TiO2 dari kaolin dengan sekam padi sebagai sumber silika [skripsi]. Bogor [ID]: Institut Pertanian Bogor.
Weitkamp J .Puppe L. 1999. Catalysis and Zeolites. Springer. New York
Yani A. Lia D. Nelly W. 2013. Sintesis Zeolit A dengan variasi sumber silika dan alumina. JKK volume 2(1) :1-6.
26
Lampiran 1 Diagram alir penelitian
A. Sintesis dan karakterisasi zeolit sintetis
Kaolin Metakaolin
Natrium silikat Natrium aluminat
Zeolit AZ Zeolit
AX
KarakterisasiSEM dan
27 B. Sintesis dan karakterisasi zeolit terfungsionalisasi
Zeolit AZ
5 mL MPTS 5 mL MPTS
Zeolit AX terfungsionalisasi
Zeolit AZ terfungsionalisasi
Analisis XRD,
28
Lampiran 2 Diagram alir pembuatan natrium aluminat
Lampiran 3 Diagram alir proses pembuatan Zeolit
a. Pencampuran kaolin dengan Natrium silikat (Merck) Kaolin
Didiamkan 40 °C selama 6 jam
Dioven 100 °C, 24 jam
Dicuci hingga pH = 7
Dioven selama 6 jam pada suhu 100°C
Zeolit
Natrium silikat Ditambahkan kedalamnya 21,65 gram Al(OH)3
Dilarutkan 30,5 gram NaOH
100 mL
diaduk
29 b. Pencampuran kaolin dan natrium aluminat
kaolin
Pengadukan gel selama 3 jam
Di oven selama 8 jam pada 80°C
Dicuci hingga pH = 7
Dioven selama 3 jam pada suhu 120°C
Zeolit
30
Lampiran 4 Diagram alir proses fungsionalisasi zeolit dengan MPTS
a. Pencampuran kaolin dan Natrium silikat (Merck)
kaolin Natrium
silikat
Wadah plastik
Ditambahkan MPTS 2 mL
Ditambahkan HCl 3 M tetes demi tetes
Diaduk hingga pH 7
Didiamkan 24 jam
Dicuci dengan akuades hingga pH netral
31 a. Pencampuran kaolin dan natrium aluminat
kaolin Natrium
aluminat
Wadah plastik
Ditambahkan MPTS 2 mL
Ditambahkan HCl 3 M tetes demi tetes
Diaduk hingga pH 7
Didiamkan 24 jam
Dicuci dengan akuades hingga pH netral
32
Lampiran 5 Kapasitas adsorpsi zeolit AX2 pada logam Cu
Isoterm Langmuir Isoterm Freundlich
Co
Nilai x = Cteradsorpsi (ppm) x volume larutan(l) x 1g/1000 mg
isoterm Freundlich
-1.5000 -1.0000 -0.5000 0.0000 0.5000 1.0000 1.5000
33 Lampiran 6 Kapasitas adsorpsi sampel AX2 termodifikasi terhadap Cu
Nilai x = Cteradsorpsi (ppm) x volume larutan(l) x 1g/1000 mg
Log C
y = 0.123x + 0.003 R² = 0.998
0.0000 0.5000 1.0000 1.5000 2.0000
0 5 10 15
isoterm Langmuir
y = 0.104x + 0.809 R² = 0.961
0.0000 0.2000 0.4000 0.6000 0.8000 1.0000
-1.5000 -1.0000 -0.5000 0.0000 0.5000 1.0000 1.5000
isoterm Freundlich
Isoterm Langmuir Isoterm Freundlich
Co
(mg/l) Bobot (g) (mg/l) Ce (mg/l) Ct (mg/g) Q (g) X (mg/g) x/m c/(x/m) (g/l) log c log x/m 10 0.1 9.9109 0.0891 0.01 0.00050 4.9555 0.0180 -1.0501 0.6951 20 0.1 15.4689 4.5311 0.45 0.00077 7.7345 0.5858 0.6562 0.8884 25 0.1 16.8877 8.1123 0.81 0.00084 8.4439 0.9607 0.9091 0.9265 30 0.1 15.9989 14.0011 1.40 0.00080 7.9995 1.7503 1.1462 0.9031
c /(x/m) (g/l)
Ct (ppm)
34
Lampiran 7 Kapasitas adsorpsi zeolit AX2 pada biru metilena
Isoterm Langmuir Isoterm Freundlich Co
Nilai x = Cteradsorpsi (ppm) x volume larutan(l) x 1g/1000 mg
Log C
0.0000 5.0000 10.0000 15.0000 20.0000 25.0000
isoterm Langmuir
-0.5000 0.0000 0.5000 1.0000 1.5000
35 Lampiran 8 Kapasitas adsorpsi zeolit AX2 termodifikasi pada biru metilena
Isoterm
Langmuir Freundlich Isoterm Co
Nilai x = Cteradsorpsi (ppm) x volume larutan(l) x 1 g/1000 mg
Log C
0.0000 5.0000 10.0000 15.0000 20.0000 25.0000
isoterm Langmuir
-0.5000 0.0000 0.5000 1.0000 1.5000
36
Lampiran 9 Kapasitas adsorpsi sampel AX4 pada logam Cu Isoterm
Langmuir Isoterm Freundlich Co
Nilai x = Cteradsorpsi (ppm) x volume larutan(l) x 1 g/1000 mg
Log C
-1.5000 -1.0000 -0.5000 0.0000 0.5000 1.0000 1.5000
37 Lampiran 10 Kapasitas adsorpsi sampel AX4 termodifikasi pada logam Cu
Isoterm
Nilai x = Cteradsorpsi (ppm) x volume larutan(l) x 1 g/1000 mg
Log C
-1.5000 -1.0000 -0.5000 0.0000 0.5000 1.0000 1.5000
38
Lampiran 11 Kapasitas adsorpsi sampel AX4 pada biru metilena
Isoterm
Nilai x = Cteradsorpsi (ppm) x volume larutan(l) x 1 g/1000 mg
y = 0.052x + 0.220
-0.2000 0.0000 0.2000 0.4000 0.6000 0.8000 1.0000 1.2000 1.4000
39 Lampiran 12 Kapasitas adsorpsi sampel AX4 termodifikasi pada biru metilena
Isoterm Langmuir Freundlich Isoterm
Co
Nilai x = Cteradsorpsi (ppm) x volume larutan(l) x 1 g/1000 mg
y = 0.033x + 0.069
0.0000 5.0000 10.0000 15.0000 20.0000 25.0000
isoterm Langmuir
-0.5000 0.0000 0.5000 1.0000 1.5000
40
Lampiran 13 Kapasitas adsorpsi sampel AZ3 terhadap logam Cu Isoterm
Langmuir Iosterm Freundlich
Co Nilai x = Cteradsorpsi (ppm) x volume larutan(l) x 1 g/1000 mg
y = 0.120x + 0.079
0.0000 5.0000 10.0000 15.0000 20.0000
isoterm Langmuir
-0.20000.0000 0.2000 0.4000 0.6000 0.8000 1.0000 1.2000 1.4000
41 Lampiran 14 Kapasitas adsorpsi sampel AZ3 termodifikasi terhadap Cu
Isoterm
Langmuir Freundlich Isoterm
Co Nilai x = Cteradsorpsi (ppm) x volume larutan(l) x 1 g/1000 mg
y = 0.132x - 0.016
-1.5000 -1.0000 -0.5000 0.0000 0.5000 1.0000 1.5000
42
Lampiran 15 Kapasitas adsorpsi sampel AZ3 terhadap biru metilena
Isoterm
Langmuir Freudlich Isoterm
Co
Nilai x = Cteradsorpsi (ppm) x volume larutan(l) x 1 g/1000 mg
y = 0.029x + 0.060
0.0000 5.0000 10.0000 15.0000 20.0000 25.0000
isoterm Langmuir
-0.5000 0.0000 0.5000 1.0000 1.5000
43 Lampiran 16 Kapasitas adsorpsi sampel AZ3 termodifikasi terhadap Biru metilena
Isoterm
Langmuir Isoterm Freundlich
Co Nilai x = Cteradsorpsi (ppm) x volume larutan(l) x 1 g/1000 mg
y = 0.032x + 0.048
-0.5000 0.0000 0.5000 1.0000 1.5000
44
RIWAYAT HIDUP
Penulis dilahirkan di Yogyakarta pada tanggal 28 Februari 1983 sebagai anak sulung dari pasangan Agus Taufiq dan Sri Wahyuni. Pendidikan sarjana ditempuh di Program Studi Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam UGM, lulus tahun 2008. Pada tahun 2012 penulis diterima di Program Studi Kimia Program Pasca Sarjana IPB dan menamatkannya tahun 2016.