PENCIRIAN ELEKTRODE MEMBRAN TERMODIFIKASI
ZEOLIT UNTUK PENGUKURAN KROMIUM(VI)
LAELA WULAN SARI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
LAELA WULAN SARI. Pencirian Elektrode Membran Termodifikasi Zeolit
untuk Pengukuran Kromium(VI). Dibimbing oleh RUDI HERYANTO dan ETI
ROHAETI.
Penelitian ini berhasil membuat elektrode membran termodifikasi zeolit untuk
pengukuran Cr(VI). Zeolit yang digunakan termasuk jenis mordenit dengan
ukuran partikel 414.3 nm. Elektrode selektif ion (ESI) dibuat dengan modifikasi
membran dengan difenilkarbazida (DPC) (ESI I), zeolit (ESI II), dan gabungan
keduanya (ESI III). Ketiga ESI dicirikan berdasarkan nilai faktor Nernst, trayek
pengukuran, limit deteksi, waktu respons, dan koefisien selektivitas. Nilai faktor
Nernst ESI I, II, dan III pada trayek pengukuran 10
-1–
10
-6M berturut-turut ialah
-18.4; -29.11; dan -28.8
mV/dekade, dengan limit deteksi masing-masing 1.44 ×
10
-6, 1.91 × 10
-6, dan 2.14 × 10
-6M. Waktu respons rata-rata dari yang tercepat
hingga terlambat adalah ESI I, III, dan II. Berdasarkan koefisien selektivitas,
ketiga ESI lebih selektif terhadap ion Cr(VI) dibandingkan dengan ion
pengganggu Cu
2+dan Fe
3+,
kecuali untuk ESI I lebih selektif terhadap ion Fe
3+pada konsentrasi tinggi, yaitu 10
-1–
10
-3M. Hasil uji parameter secara keseluruhan
menunjukkan bahwa elektrode membran termodifikasi gabungan zeolit dan DPC
memiliki kinerja yang lebih memuaskan.
ABSTRACT
LAELA WULAN SARI. Characterization of Zeolite-Modified Membrane
Electrode for Measurement of Chromium(VI). Supervised by RUDI HERYANTO
and ETI ROHAETI.
PENCIRIAN ELEKTRODE MEMBRAN TERMODIFIKASI
ZEOLIT UNTUK PENGUKURAN KROMIUM(VI)
LAELA WULAN SARI
Skripsi
Sebagai salah satu syarat memperoleh gelar Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul Skripsi
: Pencirian Elektrode Membran Termodifikasi Zeolit untuk
Pengukuran Kromium(VI)
Nama
: Laela Wulan Sari
NIM
: G44096029
Disetujui
Pembimbing I
Rudi Heryanto, SSi, MSi
NIP 19760428 200504 1002
Pembimbing II
Dr Eti Rohaeti, MS
NIP 19600807 198703 2 001
Diketahui
Ketua Departemen Kimia
Prof Dr Ir Tun Tedja Irawadi, MS
NIP 19501227 197603 2 002
PRAKATA
Puji dan syukur penulis panjatkan ke hadirat Allah SWT atas segala karunia
kesehatan dan kemudahan yang dilimpahkan-Nya selama proses penyusunan
karya ilmiah dengan judul “
Pencirian Elektrode Membran Termodifikasi Zeolit
untuk Pengukuran Kromium(VI)
“. Karya ilmiah ini disusun berdasarkan
penelitian yang dilaksanakan pada bulan Oktober 2011 hingga Januari 2012 di
Laboratorium Analitik Departemen Kimia dan Laboratorium Terpadu Fakultas
Peternakan, Kampus IPB Dramaga, Bogor. Penelitian ini didanai oleh proyek dari
Kerja Sama Kemitraan Penelitian Pertanian dengan Perguruan Tinggi (KKP3T)
Badan Penelitian dan Pengembangan Pertanian Departemen Pertanian dengan No
Kontrak 897/LB.620/I.1/3/2011.
Terima kasih penulis ucapkan kepada Bapak Rudi Heryanto, SSi, MSi
selaku pembimbing pertama dan Ibu Dr Eti Rohaeti, MS selaku pembimbing
kedua yang telah memberikan arahan, bimbingan, motivasi, dan doa selama
penelitian. Ungkapan terima kasih juga penulis sampaikan kepada Ibu Prof Dr Ir
Latifah K Darusman, MS, seluruh laboran, analis, dan staf Laboratorium Analitik.
Terima kasih penulis juga sampaikan kepada Bapak Dr Ir M Ridla, MAgr sebagai
Kepala Laboratorium Terpadu Fakultas Peternakan IPB, Bapak Sulistioso Giat
Sukaryo, MT, dan Bapak Drs Bambang Sugeng, MT atas bantuannya dalam
analisis menggunakan difraksi sinar-X. Tidak lupa penulis juga mengucapkan
terima kasih kepada Ibunda tercinta, almarhum Ayahanda, saudara-saudariku,
Laen, teman-teman Ekstensi Kimia IPB, dan seluruh pihak yang telah membantu
penulis dalam menyelesaikan karya ilmiah ini yang tidak dapat disebutkan satu
per satu tanpa maksud mengurangi rasa terima kasih atas doa, semangat, kasih
sayang, dan dukungannya selama masa studi hingga proses penyusunan karya
ilmiah ini. Semoga Allah SWT memberikan balasan atas segala amal yang
diperbuat dan menyertai hamba-Nya dengan kasih dan sayang-Nya.
Semoga karya ilmiah ini dapat memberikan manfaat.
Februari 2012
RIWAYAT HIDUP
Penulis dilahirkan di Cianjur pada tanggal 2 Februari 1984 sebagai putri dari
Bapak Muhammad Yahya Abdullah dan Ibu Dewi Kartini. Penulis lulus dari
SMA Insan Kamil Bogor pada tahun 2002 dan pada tahun yang sama diterima di
Akademi Kimia Analisis (AKA) Bogor melalui jalur ujian seleksi. Penulis lulus
dari AKA Bogor dengan predikat sangat memuaskan pada tahun 2005 dan
melanjutkan pendidikan S1 melalui Program Penyelenggaraan Khusus
Departemen Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam Institut
Pertanian Bogor (IPB) pada tahun 2009.
vi
DAFTAR ISI
Halaman
DAFTAR TABEL ... vii
DAFTAR GAMBAR ... vii
DAFTAR LAMPIRAN ... viii
PENDAHULUAN ... 1
BAHAN DAN METODE
Bahan dan Alat ... 2
Metode Penelitian ... 2
Pencirian Zeolit ... 2
Pembuatan Membran Termodifikasi dan Perakitan ESI Cr(VI) ... 3
Pencirian ESI ... 4
HASIL DAN PEMBAHASAN
Preparasi dan Aktivasi Zeolit ... 4
Hasil Pencirian Zeolit dengan PSA, XRD, dan SEM ... 5
Kapasitar Tukar Kation ... 5
Kapasitas Adsorpsi Zeolit terhadap Cr(VI) dan Analisis Cr(VI) ... 6
Konsentrasi, pH, dan Waktu Kontak Optimum Adsorpsi ... 6
Elektrode Selektif Ion Cr(VI) ... 8
Faktor Nernst dan Trayek Pengukuran ... 9
Limit Deteksi ... 10
Waktu Respons... 10
Pengaruh pH Terhadap ESI ... 11
Koefisien Selektivitas ... 12
SIMPULAN DAN SARAN
Simpulan ... 12
Saran ... 12
DAFTAR PUSTAKA ... 13
vii
DAFTAR TABEL
Halaman
1 Puncak XRD zeolit alam mordenit dan zeolit Cikembar sebelum aktivasi ... 5
2 Puncak XRD zeolit alam mordenit dan zeolit Cikembar setelah aktivasi ... 5
3 Limit deteksi ketiga jenis ESI ... 10
4 Waktu respons rerata ketiga jenis ESI ... 11
5 Koefisien selektivitas ESI terhadap ragam ion pengganggu ... 12
DAFTAR GAMBAR
Halaman
1 Morfologi permukaan zeolit. ... 5
2 Reaksi 1,5-difenilkarbazida (DPC) dan Cr (VI). ... 6
3 Kurva penentuan konsentrasi optimum adsorpsi zeolit terhadap Cr (VI). ... 7
4 Kurva penentuan pH optimum adsorpsi zeolit terhadap Cr(VI). ... 7
5 Kurva penentuan waktu kontak optimum adsorpsi zeolit terhadap Cr(VI). ... 8
6 Diagram skematik dari rangkaian sel potensiometri selektif-ion. ... 8
7 Diagram Pourbaix spesies ion Cr(VI) pada suhu 25
oC. ... 9
8 Kurva hubungan (-) log [K
2Cr
2O
7] dengan potensial (mV) pada ketiga ESI.. 10
9 Kurva pengaruh pH terhadap ESI. ... 11
viii
DAFTAR LAMPIRAN
Halaman
1 Bagan alir penelitian ... 16
2 Difraktogram sinar-X zeolit sebelum dan setelah aktivasi ... 17
3 Data
2θ
difraktogram zeolit alam Cikembar sebelum dan setelah diaktivasi 18
4
Basis data puncak 2θ nomor arsip 29
-1257 pada PCDFWIN untuk zeolit alam
(mordenit)... 20
5 Kurva standar analisis Cr(VI) ... 20
6 Konsentrasi optimum adsorpsi zeolit terhadap Cr(VI) ... 21
7 pH optimum adsorpsi zeolit terhadap Cr(VI) ... 22
8 Waktu kontak optimum adsorpsi zeolit terhadap Cr(VI) ... 22
9 Hubungan (-) log [KCl] dengan potensial kawat Ag/AgCl hasil elektrolisis
(mV) ... 23
10 pH larutan standar K
2Cr
2O
710
-1–
10
-6M ... 23
11 Potensial larutan standar K
2Cr
2O
7dengan ESI ... 24
12 Limit deteksi ESI ... 25
13 Waktu respons elektrode kerja membran ESI ... 27
14 Potensial ESI larutan K
2Cr
2O
710
-3M pada rentang pH larutan 2
–
14 ... 27
15 Potensial ESI larutan standar K
2Cr
2O
7pada pH 9 ... 28
16 Potensial ESI larutan K
2Cr
2O
710
-3M tanpa ion pengganggu ... 28
PENDAHULUAN
Logam kromium (Cr) terdapat dalam 2 bentuk oksida, yaitu Cr(III) dan Cr(VI). Dalam larutan, ion Cr(VI) dapat berada dalam beberapa bentuk spesies, sebagai kromat (CrO42−), dikromat (Cr2O72−), hidrogen kromat (HCrO4−), hidrogen dikromat (HCr2O72−), dan asam kromat (H2CrO4) (Yari & Bagheri 2009). Kromium(III) relatif tidak berbahaya dan memiliki peran dalam metabolisme tubuh, sedangkan Cr(VI) memiliki potensi 100
–
1000 kali lebih beracun daripada Cr(III) karena memiliki potensi oksidasi yang tinggi. Menurut Organisasi Kesehatan Dunia (WHO), konsentrasi Cr(VI) dalam tanah tidak boleh lebih dari 0.05 mg/L atau 50 ppb (Welch et al.2005). Senyawaan Cr(VI) juga memiliki sifat genotoksik, mutagenik, dan karsinogenik (Ertürün et al. 2007). Sifat racun yang dibawa oleh logam ini dapat membahayakan organ vital seperti hati, ginjal, menyebabkan timbulnya penyakit kanker paru-paru, keracunan akut, kronis, iritasi pada sistem pernapasan, dan iritasi pada kulit manusia (Slamet et al. 2005).
Seiring dengan berkembangnya teknologi dan ilmu pengetahuan, penggunaan logam-logam berat terutama dalam industri semakin meningkat (Sudiarta & Yulihastuti 2010). Keberadaan logam berat dalam lingkungan bisa membahayakan makhluk hidup dan perlu dihilangkan. Oleh karena itu, sangat penting dilakukan penentuan kadar logam berat, salah satunya adalah Cr(VI), dalam berbagai bidang pemanfaatannya dan di lingkungan sekitar. Penentuan kromium dapat dilakukan antara lain dengan teknik analisis spektrofotometer serapan atom (AAS) dan kromatografi cair kinerja tinggi (HPLC), namun biaya operasionalnya sangat mahal. Oleh karena itu, telah dikembangkan teknologi sensor untuk penentuan ion logam secara potensiometri menggunakan elektrode selektif ion (ESI). Keunggulan metode ini ialah memiliki rentang pengukuran yang lebar, respons pengukuran yang cepat, proses pengukuran yang mudah, biaya murah (Górski et al. 2010), memiliki tingkat sensitivitas dan selektivitas yang tinggi, tidak dipengaruhi oleh warna, limit deteksi yang rendah, dan akurasi yang tinggi (Arvand et al. 2008).
ESI merupakan sensor kimia yang spesifik dan selektif terhadap aktivitas ion atau konsentrasi ion tertentu dalam suatu larutan contoh (Arvand et al. 2008). Penentuan aktivitas ion ditentukan dari perubahan potensial keaktifan ion yang dianalisis.
Mekanisme yang terjadi adalah proses pertukaran ion antara membran dan larutan uji. Membran akan membiarkan suatu ion yang diinginkan untuk menembusnya dan menghalangi ion-ion lain untuk melewatinya.
Sensor membran selektif ion mengandung beberapa bagian, yaitu matriks polimer, ionofor, pelarut membran, dan zat aditif ionik (Faridbod et al. 2007). Komponen utama dalam membran yang menentukan keselektifan ESI adalah ionofor (Gorski et al.
2010). Ionofor merupakan suatu ligan dalam fase cair membran yang dapat membentuk kompleks dengan kation atau anion tertentu bergantung pada jenis ionofor yang digunakan pada ESI (Rezaei et al. 2009). Ionofor memiliki kemampuan menangkap dan mentransfer ion melalui media lipofilik, bersifat selektif, dan dapat membedakan ion-ion berdasarkan ukurannya (Ramadani et al.
2006). Ionofor yang pernah digunakan pada penelitian sebelumnya untuk penetapan Cr(VI) adalah difenilkarbazida (DPC). DPC merupakan pereaksi selektif yang digunakan pada penentuan Cr(VI) secara kualitatif dan kuantitatif (Paniagua et al. 1991).
penelitian ini zeolit digunakan sebagai ionofor membran pada ESI Cr(VI).
Zeolit yang digunakan berasal dari Cikembar dan dicirikan terlebih dahulu dengan penganalisis ukuran partikel (PSA), mikroskop elektron payaran (SEM), difraksi sinar-X (XRD), serta ditentukan kapasitas tukar kation (KTK) dan kapasitas adsorpsinya pada kondisi optimum untuk melihat interaksinya terhadap Cr(VI). Tahap selanjutnya ialah pembuatan membran ESI menggunakan ionofor berupa zeolit, DPC, dan gabungan keduanya untuk mengetahui pengaruh masing-masing komposisi membran terhadap kinerja ESI mendeteksi Cr(VI). Kinerja ESI ditentukan dari parameter faktor Nernst, trayek pengukuran, limit deteksi, pengaruh pH, waktu respons, dan koefisien selektivitas (Sanchez-Moreno et al. 2010).
BAHAN DAN METODE
Bahan dan Alat
Bahan-bahan yang digunakan dalam penelitian ini antara lain zeolit alam dari Cikembar, difenilkarbazida (DPC) (Merck), polivinil klorida (PVC) (Merck), asetofenon (Merck), asam oleat (Merck), kalium dikromat (K2Cr2O7) (Merck), kalium klorida (KCl) (Merck), tetrahidrofuran (THF) (Merck), natrium hidroksida (NaOH) (Merck), asam sulfat (H2SO4) (Merck), dan asam klorida (HCl) (Merck).
Peralatan yang digunakan antara lain potensiometer (EUTECH Instrument pH 510), kawat Ag/AgCl, shaker K Model VRN-360,
PSA Delsa Tm Nano Serpong, spektrofotometer UV-Vis, SEM JEOL JSM-836 OLA (Pusat Penelitian dan Pengembangan Geologi Kelautan Bandung), XRD Shimadzu XRD-7000 (Puslitbang Hutan Bogor), XRD Shimadzu X-Ray Diffractometer XD-610 (Batan), saringan 200 dan 325 mesh, pengaduk, sentrifuga, dan alat-alat kaca yang lazim di laboratorium.
Metode Penelitian
Penelitian ini terdiri atas 3 tahap. Tahap pertama merupakan pencirian zeolit yang akan digunakan pada membran ESI yang meliputi preparasi dan aktivasi zeolit, analisis morfologi zeolit dengan PSA, XRD, dan SEM untuk mengetahui jenis zeolit, penentuan KTK, dan penentuan kapasitas adsorpsi zeolit terhadap Cr(VI) pada kondisi optimum. Tahap kedua adalah pembuatan membran termodifikasi zeolit, DPC, dan gabungan
keduanya serta perakitan masing-masing ESI. Pada tahap ketiga, masing-masing ESI dicirikan melalui penentuan harga faktor Nernst, trayek pengukuran, limit deteksi, waktu respons, pengaruh pH terhadap ESI, dan koefisien selektivitas. Metode penelitian yang digunakan diringkaskan dalam diagram alir (Lampiran 1).
Pencirian Zeolit
Preparasi dan Aktivasi Zeolit (Ozkan & Ulku 2004)
Zeolit dicuci dengan akuades dan dikeringkan dalam oven pada suhu 180 oC kemudian diayak dengan saringan 200 mesh. Selanjutnya zeolit diaktivasi secara kimia, yaitu dengan cara pengasaman. Sebanyak 5 g zeolit dilarutkan ke dalam 100 mL HCl 0.032 M. Campuran diaduk dengan pengaduk magnet pada suhu 25 oC selama 3 jam lalu dibilas dengan akuades sampai pH netral dan bebas ion klorin. Zeolit kemudian dikeringkan dalam oven pada suhu 300 oC selama 3 jam. Zeolit yang telah diaktivasi diayak dengan saringan 325 mesh.
Analisis Morfologi Zeolit
Zeolit yang sudah diaktivasi dan disaring 325 mesh dicirikan menggunakan PSA, SEM, dan XRD. Analisis XRD juga dilakukan terhadap zeolit sebelum aktivasi.
Penentuan Kapasitas Tukar Kation (Balai Penelitian Tanah 2005)
3
V (C0 –C)
m
ini digunakan untuk pengukuran KTK dengan cara spektrofotometri.
Sebanyak 0.5 mL filtrat dan beberapa konsentrasi standar NH4+ dimasukkan ke dalam tabung reaksi, lalu ditambahkan 9.5 mL air bebas ion (pengenceran 20×). Kemudian masing-masing 2 mL larutan tersebut diambil dan dimasukkan ke dalam tabung reaksi lain. Ke dalam setiap tabung selanjutnya ditambahkan berturut-turut larutan sangga-tartat dan Na-fenat masing-masing sebanyak 4 mL, dikocok dan didiamkan selama 10 menit. Setelah itu, 4 mL NaOCl 5% ditambahkan dan dikocok, lalu larutan diukur menggunakan spektrofotometer pada panjang gelombang 636 nm.
Penentuan Kapasitas Adsorpsi dan Analisis Cr(VI) (modifikasi Clescery et al. 2005)
Analisis kromium dimulai dengan membuat kurva standar Cr(VI). Larutan standar Cr(VI) dibuat dari K2Cr2O7 dengan ragam konsentrasi 1, 2, 4, 6, dan 8 ppm. Larutan standar sebanyak 25 mL dimasukkan ke dalam labu takar 50 mL, ditambahkan 5 tetes H2SO4 9 M dan 2 mL DPC 0.25%, lalu dikocok. Blangko dibuat dengan menggantikan larutan standar dengan air bebas ion dalam jumlah yang sama. Larutan-larutan ini diukur serapannya dan dibuat kurva standar hubungan antara konsentrasi Cr(VI) dan serapan untuk menentukan konsentrasi kromium contoh.
Analisis Cr(VI) filtrat hasil penyaringan dilakukan dengan menempatkan semua filtrat ke dalam labu takar 50 mL kemudian ditambahkan 5 tetes H2SO4 9 M dan 2 mL DPC 0.25%, dan dikocok. Setelah itu, didiamkan selama 10 menit agar warna yang dihasilkan stabil. Larutan lalu diukur absorbansnya pada λ 543 nm untuk menentukan konsentrasi sisa kromium setelah proses adsorpsi. Tahap selanjutnya ialah menghitung kapasitas adsorpsi menggunakan persamaan
Q =
Keterangan:
Q = Kapasitas adsorpsi (mg/g adsorben)
V = Volume larutan (mL)
C0 = Konsentrasi Cr(VI) awal (ppm)
C = Konsentrasi Cr(VI) sisa (ppm)
m = Massa zeolit (g)
Penentuan Konsentrasi Optimum
Sebanyak masing-masing 0.5 g zeolit dimasukkan ke dalam erlenmeyer yang berisi
25 mL larutan Cr(VI) dengan ragam konsentrasi 5
–
280 ppm. Larutan dikocok dengan shaker 150 rpm selama 24 jam, kemudian filtratnya disaring. Konsentrasi larutan Cr(VI) sisa diukur dengan spektrofotometer UV-Vis pada λ 543 nm dan kapasitas adsorpsi dihitung. Konsentrasi awal larutan Cr(VI) dialurkan pada kurva sebagai sumbu x dan nilai kapasitas adsorpsi sebagai sumbu y.Penentuan pH Optimum
Sebanyak masing-masing 0.5 g zeolit dimasukkan ke dalam erlenmeyer yang berisi 25 mL larutan Cr(VI) 200 ppm, kemudian diatur ragam pH 2, 3, 4, 5, dan 6. Larutan dikocok dengan shaker selama 24 jam dalam suhu kamar. Filtrat dipisahkan dan konsentrasi Cr(VI) sisa diukur menggunakan spektrofotometer UV-Vis pada λ 543 nm. Kapasitas adsorpsi kemudian ditentukan. pH larutan Cr(VI) dialurkan pada kurva sebagai sumbu x dan nilai kapasitas adsorpsi sebagai sumbu y.
Penentuan Waktu Kontak Optimum
Sebanyak masing-masing 0.5 g zeolit dimasukkan ke dalam erlenmeyer yang berisi 25 mL larutan Cr(VI) 200 ppm pada pH optimum yang diperoleh. Campuran diaduk dengan ragam waktu kontak selama 3, 6, 12, 24, 36, dan 48 jam dalam suhu kamar. Filtrat dipisahkan dari sampel. Konsentrasi Cr(VI) sisa ditentukan menggunakan spektrofoto-meter UV-Vis pada λ 543 nm, kemudian dihitung kapasitas adsorpsinya. Ragam waktu kontak dialurkan pada kurva sebagai sumbu x
dan nilai kapasitas adsorpsi sebagai sumbu y.
Pembuatan Membran Termodifikasi dan Perakitan ESI Cr(VI)
dilakukan Sanchez-Moreno et al. (2010), Asri (2011), dan Arvand (2008).Membran tersebut kemudian disimpan dalam larutan standar K2Cr2O7 10-3 M.
Elektrode terbagi menjadi 3 tipe, yaitu ESI I dengan ionofor DPC, ESI II dengan ionofor zeolit, dan ESI III dengan ionofor gabungan keduanya. Prosedur yang digunakan merupakan modifikasi dari penelitian Faridbod et al. (2007). Pertama-tama kawat perak (Ag) yang telah dielektrolisis dimasukkan ke dalam badan elektrode sebagai elektrode pembanding dalam Ag/AgCl. Membran ditempelkan pada mulut elektrode dan larutan elektrolit pembanding dalam, yaitu K2Cr2O7 10-3 M, ditambahkan secukupnya ke dalam mulut elektrode tersebut. Pada saat pemasangan, elektrode Ag/AgCl diatur agar tercelup dalam larutan elektrolit pembanding dalam, tanpa pembentukan gelembung udara dan tanpa perembesan larutan keluar dari mulut elektrode maupun dari badan elektrode.
Pencirian ESI
Faktor Nernst dan Trayek Pengukuran
Pengamatan potensial (E) dilakukan pada 3 tipe ESI Cr(VI) terhadap larutan standar K2Cr2O7 dengan konsentrasi 10-1
–
10-6 M. Pengukuran dilakukan dalam sel elektrokimia dengan susunan ESI Cr(VI) sebagai katode, elektrode Ag/AgCl sebagai anode, dan potensiometer penganalisis ion EUTECH Instruments pH 510 sebagai penunjuk potensial. Potensial yang ditunjukkan oleh ESI Cr(VI) masing-masing ditabulasikan dan dibuat kurva hubungan antara E (mV) sebagai sumbu y dan –log [Cr2O72−] sebagai sumbu xsehingga terbentuk persamaan garis regresi linear.
Limit Deteksi (IUPAC 2006)
Limit deteksi ditentukan dengan membuat titik potong antara kurva yang linear dan yang taklinear pada kurva pengukuran potensial larutan standar K2Cr2O7 oleh ESI. Titik potong tersebut diekstrapolasikan ke absis, maka akan diperoleh nilai limit deteksi dari masing-masing tipe elektrode.
Waktu Respons (Buchari & Irdhawati 2002)
Larutan standar K2Cr2O7 dengan konsentrasi 10-1
–
10-6 M disiapkan. Waktu respons adalah saat pembacaan potensial menunjukkan nilai yang stabil.Pengaruh pH (Ardakani et al. 2005)
Larutan standar K2Cr2O7 10-3 M disiapkan dengan pH diragamkan dari 2 sampai 14 menggunakan larutan NaOH 0.1 M dan HCl 0.1 M. Setiap larutan diukur potensialnya menggunakan ketiga tipe ESI sehingga dapat dilihat rentang pH yang menunjukkan kestabilan pembacaan potensial. Tahap selanjutnya ialah pengukuran potensial larutan standar K2Cr2O7 10-1
–
10-6 M yang dibuat pada rentang pH tersebut.Koefisien Selektivitas (Umezawa et al.
2000)
Koefisien selektivitas ditentukan dengan metode larutan tercampur dengan teknik fixed primary method (FPM). Larutan yang mengandung ion utama, digunakan larutan K2Cr2O7 10-3 M, diukur terlebih dahulu potensialnya. Selanjutnya diukur potensial campuran larutan K2Cr2O7 10-3 M dengan larutan yang mengandung ion pengganggu dengan nisbah volume 1:1. Larutan ion pengganggu yang digunakan adalah larutan CuSO4 dan FeCl3 dengan konsentrasi beragam 10-1
–
10-6 M. Nilai koefisien selektivitas dapat dihitung menggunakan persamaan 1:K = (10∆E/S– 1)( [K+] / [Xm]1/m)……… (1) Keterangan:
K = Koefisien selektivitas
∆E = Selisih potensial larutan ion utama saja dan larutan campuran ion
S = Faktor Nernst
[K+] = Konsentrasi ion utama [X m] = Konsentrasi ion utama
m = Muatan ion pengganggu
HASIL DAN PEMBAHASAN
Preparasi dan Aktivasi Zeolit
5
dengan pemanasan atau kalsinasi dalam oven pada suhu 300
–
400 oC selama 3–
4 jam (Suwardi 2000). Proses ini bertujuan menguapkan air yang terperangkap dalam pori-pori kristal zeolit sehingga pori-porinya menjadi kosong dan dapat digunakan untuk pertukaran ion dan proses adsorpsi.Zeolit yang telah diaktivasi diayak kembali dengan saringan 325 mesh untuk menghasilkan ukuran pori yang lebih kecil sehingga memperluas permukaan atau bidang kontak adsorben (zeolit) dengan adsorbat (Rohaeti 2007). Hal ini dapat meningkatkan daya adsorpsi zeolit serta pergerakan logam-logam alkali dan alkali tanah yang ada di dalamnya.
Hasil Pencirian Zeolit dengan PSA, XRD, dan SEM
PSA bertujuan menentukan ukuran partikel dan distribusinya dari sampel yang representatif. Zeolit yang telah diaktivasi dan diayak 325 mesh dianalisis menggunakan PSA, diperoleh ukuran partikel rata-ratanya sebesar 414.3 nm. Zeolit juga dianalisis menggunakan SEM untuk melihat morfologi permukaan zeolit. Analisis dengan SEM dilakukan dengan perbesaran 3000×, fotonya ditunjukkan pada Gambar 1. Terlihat rongga-rongga zeolit di sebelah kanan dan kiri.
Gambar 1 Morfologi permukaan zeolit.
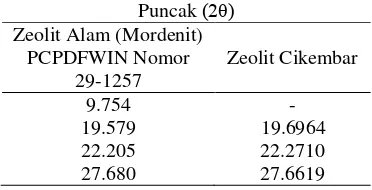
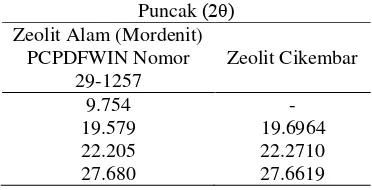
Zeolit sebelum dan setelah aktivasi dicirikan dengan XRD untuk mengetahui jenis mineral zeolit asal Cikembar. Puncak-puncak khas 2θ yang diperoleh (Lampiran 2 dan 3) dibandingkan dengan data-data nilai 2θ puncak standar pada PCPDFWIN dari ICDD (Lampiran 4). Diperoleh kemiripan nilai 2θ dengan basis data standar nomor arsip 29-1257 yang merupakan jenis mordenit. Karena itu, zeolit yang digunakan dalam penelitian diduga termasuk ke dalam jenis mordenit. Pembandingan nilai 2θ dari puncak-puncak khas tersebut ditunjukkan pada Tabel 1 dan 2.
Tabel 1 Puncak XRD zeolit alam mordenit dan zeolit Cikembar sebelum aktivasi
Puncak (2θ) Zeolit Alam (Mordenit)
PCPDFWIN Nomor 29-1257 Zeolit Cikembar 9.754 19.579 9.785 19.647
22.205 22.049
27.680 27.692
Tabel 2 Puncak XRD zeolit alam mordenit dan zeolit Cikembar setelah aktivasi
Puncak (2θ) Zeolit Alam (Mordenit)
PCPDFWIN Nomor 29-1257 Zeolit Cikembar 9.754 19.579 - 19.6964
22.205 22.2710
27.680 27.6619
Kapasitar Tukar Kation
Sifat fisis mineral zeolit adalah memiliki 3 komponen, yaitu kerangka aluminasilikat dan ruang kosong atau pori yang dapat diisi oleh molekul air yang dapat berkoordinasi dengan kation (Wahyudi et al. 2010). Sifat kimia zeolit adalah kemampuannya mengikat kation yang tinggi atau memiliki nilai KTK yang tinggi.
6
berupa NH4Cl ditampung dalam labu takar. Kation NH4+ inilah yang diukur sebagai KTK. Menurut Al-Jabri (2008), KTK zeolit berdasarkan SNI 13-3494-1994 dinyatakan lolos uji mutu (LUM) jika nilainya 100 cmol(+)kg-1. Berdasarkan Permentan No. 02/Pert/HK.060/2/2006, KTK zeolit dikatakan tinggi jika nilainya 80 cmol(+)kg-1. Hasil analisis KTK zeolit setelah diaktivasi pada penelitian ini sebesar 46.22 cmol(+)/kg. Nilai ini tergolong kecil, namun nilai KTK juga bergantung pada jenis dan asal daerah zeolit yang digunakan. Zeolit yang berasal dari tempat yang berbeda akan memiliki kondisi morfologi yang beragam dan komposisi yang berbeda pula. Hal ini dibuktikan dalam penelitian sebelumnya berdasarkan prosedur Permentan No 02/Pert/HK.060/2/2006 terhadap beberapa zeolit, salah satunya berasal dari Sukabumi juga menghasilkan nilai KTK yang kecil, yaitu 39 cmol(+)/kg (Al-Jabri 2008). Nilai KTK zeolit juga sangat ditentukan oleh sifat pergerakan logam-logam alkali dan alkali tanah yang ada di dalamnya (K, Na, Ca, Mg, dan Fe) (Susetyaningsih et al.
2009). Distribusi kation dapat-tukar zeolit bergantung pada suhu pemanasan spesies kationik, dan tingkat hidrasi (Yang 2003). Nilai KTK yang kecil ini juga dapat menunjukkan kemungkinan zeolit memiliki kemampuan mengadsorpsi anion lebih besar daripada kation (Furi 2010). Hal ini sesuai dengan pemanfaatannya sebagai adsorben untuk adsorpsi Cr(VI), karena Cr(VI) yang berasal dari larutan K2Cr2O7 dalam larutan akan berada dalam bentuk anionnya.
Kapasitas Adsorpsi Zeolit terhadap Cr(VI) dan Analisis Cr(VI)
Metode adsorpsi yang digunakan adalah metode tumpak (batch adsorption). Pada metode tumpak, larutan contoh yang berisi adsorbat dan adsorben dicampur kemudian dikocok selama waktu tertentu hingga tercapai kesetimbangan. Kesetimbangan terjadi saat adsorben telah jenuh oleh adsorbat. Tahap selanjutnya dilakukan penyaringan sehingga dapat diukur konsentrasi sisa dalam larutan untuk menentukan kapasitas adsorpsi. Kapasitas adsorpsi menyatakan jumlah adsorbat yang dapat teradsorpsi tiap gram adsorben. Faktor-faktor yang memengaruhi proses adsorpsi antara lain sifat fisis dan kimia adsorben (luas permukaan, ukuran pori partikel, dan komposisi kimia), sifat fisis dan kimia adsorbat (ukuran molekul dan komposisi kimia), serta konsentrasi adsorbat dalam fase cairan.
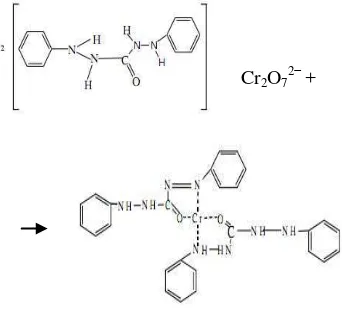
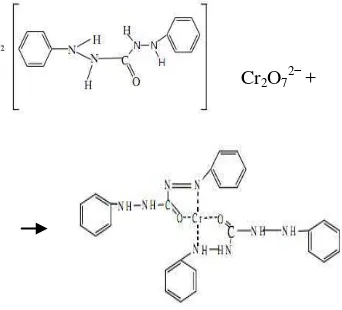
Pada penelitian ini, adsorben yang digunakan adalah zeolit dan adsorbat yang ingin dijerap adalah Cr(VI). Penentuan kapasitas adsorpsi diawali dengan pengukuran konsentrasi sisa larutan Cr(VI) yang tidak teradsorpsi oleh zeolit. Metode yang umum digunakan untuk pengukuran kadar kromium total dan heksavalen adalah spektroskopi sinar tampak. Metode ini didasarkan pada pengukuran serapan larutan berwarna ungu kemerahan yang menunjukkan terbentuknya kompleks antara DPC dan Cr(VI) (Gambar 2). Reaksi ini berlangsung cepat dan spesifik. Senyawa kompleks berwarna lembayung yang terbentuk menyerap pada panjang gelombang ~540 nm (Wulandari 2010).
Cr2O72−+
Gambar 2 Reaksi 1,5-difenilkarbazida (DPC) dan Cr(VI).
Penentuan kapasitas adsorpsi zeolit terhadap Cr(VI) dilakukan dengan meragamkan konsentrasi larutan Cr(VI), pH, dan waktu kontak sehingga dapat diperoleh konsentrasi, pH, dan waktu kontak optimum pada penentuan kapasitas adsorpsi. Penentuan kapasitas adsorpsi dilakukan dengan mengukur konsentrasi sisa larutan Cr(VI) yang tidak teradsorpsi oleh zeolit menggunakan spektrofotometer. Konsentrasi awal larutan Cr(VI) juga diukur dengan spektrofotometer agar dapat diketahui konsentrasi sebenarnya. Pengukuran dilakukan pada panjang gelombang maksimum 543 nm. Kurva standar pengukuran konsentrasi Cr(VI) menghasilkan linearitas sebesar 99.81% (Lampiran 5).
Konsentrasi, pH, dan Waktu Kontak Optimum Adsorpsi
7
sampai 280 ppm. Konsentrasi optimum dicapai pada konsentrasi 200 ppm dengan kapasitas adsorpsi sebesar 3.227 mg/g adsorben (Gambar 3).
Gambar 3 Kurva penentuan konsentrasi optimum adsorpsi zeolit terhadap Cr(VI).
Gambar 3 memperlihatkan peningkatan kapasitas adsorpsi seiring dengan kenaikan konsentrasi awal larutan Cr(VI). Kenaikan konsentrasi akan meningkatkan jumlah ion logam adsorbat yang dapat diadsorpsi oleh adsorben selama tapak aktif adsorben masih memungkinkan untuk mengadsorpsinya. Pada konsentrasi awal larutan Cr(VI) 220 ppm terjadi penurunan kapasitas adsopsi menjadi 2.993 mg/g. Penurunan terus berlanjut sampai konsentrasi 260 ppm, yaitu mencapai 2.286 mg/g. Pada konsentrasi 280 ppm terjadi sedikit kenaikan menjadi 2.888 mg/g, namun tetap berada di bawah nilai kapasitas adsorpsi pada konsentrasi 200 ppm (Lampiran 6.) Hal ini menunjukkan bahwa adsorpsi zeolit terhadap Cr(VI) telah mengalami kondisi jenuh. Permukaan zeolit telah terisi penuh oleh Cr(VI) pada konsentrasi larutan Cr(VI) 200 ppm sehingga ketika konsentrasi dinaikkan, zeolit tidak mampu mengadsorpsi Cr(VI) lebih banyak dan dapat mengalami proses desorpsi, yaitu pelepasan ikatan antara tapak aktif adsorben dan adsorbat (Suprayogi 2009) yang menyebabkan kapasitas adsorpsi berbalik menurun.
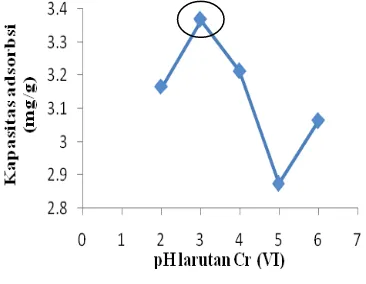
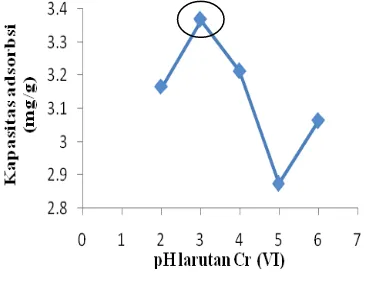
Penentuan kondisi pH optimum adsorpsi zeolit terhadap larutan Cr(VI) dilakukan dengan meragamkan pH larutan Cr(VI) 200 ppm dari 2
sampai
6. pH optimum dicapai pada pH 3 dengan kapasitas adsorpsi sebesar 3.376 mg/g adsorben. Hal ini menunjukkan bahwa adsorpsi Cr(VI) oleh zeolit lebih mudah dilakukan pada kondisi asam. PadaLampiran 7 dan Gambar 4 dapat dilihat penurunan kapasitas adsorpsi saat pH larutan Cr(VI) dinaikkan.
Gambar 4 Kurva penentuan pH optimum adsorpsi zeolit terhadap Cr(VI).
Peningkatan dan penurunan kapasitas adsorpsi Cr(VI) dapat dipengaruhi oleh terjadinya kesetimbangan kromat-dikromat dalam larutan.
2CrO4
2−+ 2H+⇋
Cr2O7 2−+ H
2O Kc = 4.2 × 10
14
Penambahan basa akan menggeser ketimbangan ke arah kiri sehingga bentuk ion Cr(VI) yang lebih dominan pada suasana basa adalah kromat (CrO42−). Sebaliknya, penambahan asam akan menggeser kesetimbangan ke arah kanan sehingga bentuk ion Cr(VI) yang lebih dominan pada suasana asam adalah dikromat (Cr2O72−) (Yari & Bagheri 2009).
8
menunjukkan bahwa proses pengocokan dengan waktu kontak yang semakin lama menyebabkan semakin banyak ion Cr(VI) yang teradsorpsi zeolit sampai dengan waktu pengocokan selama 24 jam. Pada waktu kontak 24 jam kontak zeolit sebagai adsorben dan Cr(VI) sebagai adsorbat telah mencapai kesetimbangan, permukaan zeolit menjadi jenuh karena seluruhnya telah dipenuhi oleh ion Cr(VI). Jika waktu kontak terus dinaikkan, maka dapat terjadi proses desorpsi.
Gambar 5 Kurva penentuan waktu kontak optimum adsorpsi zeolit terhadap Cr(VI).
Elektrode Selektif Ion Cr(VI)
Pengukuran ESI Cr(VI) menggunakan potensiometer. Pengamatan dasar pada pengukuran potensiometri adalah potensial (E) yang timbul antara 2 elektrode pada kondisi sekitar aliran arus nol. Sel potensiometri lengkap terdiri atas elektrode rujukan dalam (elektrode kerja) dan elektrode rujukan luar (elektrode pembanding). Elektroda rujukan dalam merupakan ESI Cr(VI) yang pada penelitian ini dibuat dari kawat Ag yang dilapisi AgCl melalui elektrolisis dan bahan pengenal atau ionofor yang ditempatkan dalam membran. Sementara elektrode rujukan luar yang digunakan adalah elektode Ag/AgCl. Pada ESI, yang diukur adalah beda potensial dari sel elektrokimia yang dihasilkan (potensial ESI versus elektrode rujukan luar) yang menunjukkan hubungan linear dengan logaritma aktivitas ion dalam larutan.
Komponen penting ESI adalah membran selektif ionnya, terutama bahan pengenal ion atau ionofor. Beberapa sifat harus dimiliki oleh membran selektif ion agar elektrode memiliki selektivitas dan sensitivitas yang baik terhadap kation dan anion, yaitu tidak
larut dalam air, stabil terhadap pH, lentur, tahan terhadap keretakan dan mudah dalam penanganan, dapat menghantarkan listrik, serta bereaksi secara selektif dengan ion-ion analit melalui 3 jenis ikatan, yaitu pertukaran ion, kristalisasi, dan kompleksasi (Bailey 1983).
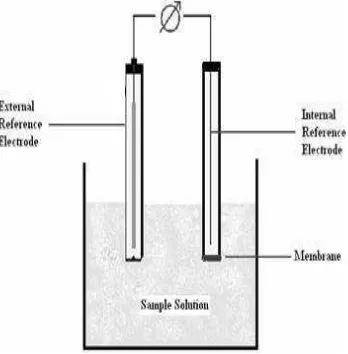
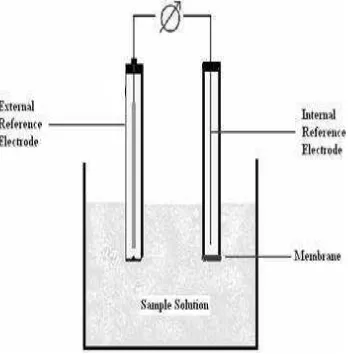
Mekanisme ESI secara umum adalah ion dapat melewati batas antara fase organik dan fase berair, maka akan dikenali oleh ionofor dalam membran selektif ion. Kesetimbangan secara elektrokimia akan tercapai dengan adanya beda potensial di antara 2 fase tersebut. Bahan pengenal hanya dapat menukarkan satu jenis ion di antara 2 fase. Karena itu, bahan ini menjadi sumber selektivitas dari sensor. Beda potensial yang dihasilkan kemudian akan diatur hanya oleh aktivitas ion tertentu dalam 2 fase larutan dan juga dalam fase membran (Faridbod et al. 2007). Diagram skematik dari rangkaian sel potensiometri selektif-ion ditunjukkan pada Gambar 6.
Gambar 6 Diagram skematik dari rangkaian sel potensiometri selektif-ion.
Potensial elektrode yang terjadi saat pengukuran dapat ditulis
Esel = Eref dalam - Eref luar + Ememb + Ej (2) Membran yang bersifat selektif bergantung pada aktivitas ion di kedua sisi. Persamaan potensial yang dihasilkan dapat ditulis
Ememb = RT/nF ln (ai1/ai2) (3) Bila persamaan (3) disubstitusikan ke persamaan (2), maka menjadi persamaan (4):
Esel = Eref dalam - Eref luar + RT/nF ln (ai1)
9
Potensial setengah sel kedua elektrode pembanding bersifat konstan. Kondisi larutan contoh dan larutan di dalam membran dapat diatur sehingga Ej akan konstan, maka
persamaan 4 dapat disederhanakan menjadi
Esel = RT/nF ln ai1+ K (5) Keterangan:
ai1 = Aktivitas ion di bagian luar membran atau contoh
ai2 = Aktivitas di bagian dalam membran
K = Tetapan total dari elektrode
R = Tetapan molar gas (8.314 J/K mol)
T = Suhu (K)
N = Muatan ion
F = Bilangan Faraday (96 500 C)
Pada penelitian ini digunakan PVC sebagai matriks polimer, THF sebagai pelarut membran, asetofenon, asam oleat sebagai pemlastis, dan aseton sebagai pelarut ionofor. Ionofor yang digunakan pada penelitian ini adalah DPC, zeolit, dan gabungan keduanya.
Komposisi dari masing-masing bahan didasarkan pada penelitian Asri (2011) yang memberikan hasil membran terbaik untuk digunakan pada ESI. Asam oleat dan asetofenon merupakan bahan pemlastis yang apabila dicampurkan dengan PVC akan menghasilkan membran yang tipis sehingga daya difusi ion terhadap membran akan lebih besar. Jika komposisi PVC ditambah, membran akan semakin tebal dan kaku (Asri 2011), porositasnya menjadi kecil, kerapatan ion akan semakin besar, sedangkan daya difusi ion akan semakin kecil sehingga ion semakin tidak bebas dipertukarkan, maka nilai faktor Nernst dan linearitas semakin rendah (Fardiyah 2003). Pemlastis ditambahkan untuk menurunkan nilai Tg (suhu transisi kaca) sehingga diperoleh membran yang lentur dan viskositas yang rendah.
Faktor Nernst dan Trayek Pengukuran
Faktor Nernst dan trayek pengukuran dapat dijadikan ukuran sensitivitas suatu elektrode. Faktor Nernst diperoleh dari kemiringan kurva persamaan Nernst, yaitu 2.303RT/nF. Kisaran konsentrasi tertentu yang berada pada garis linear disebut trayek pengukuran.
Nilai faktor Nernst pada suhu 25 ºC adalah 59.2/n mV/dekade dengan n adalah jumlah elektron yang terlibat dalam proses oksidasi dan reduksi (Rahmat 2007) atau muatan ion
yang akan dideteksi, misalnya untuk ion monovalen nilainya 59.2 mV/dekade karena nilai n = 1 (Fardiyah 2003). Harga faktor Nernst juga dapat ditentukan berdasarkan ion paling dominan yang terdapat dalam larutan (Zazoua et al. 2008).
Pada penelitian ini, tiap ESI dilakukan perlakuan yang sama, yaitu dibuat 6 ulangan pembuatan elektrode kemudian ditentukan faktor Nernst dan koefisien korelasi terbaik.
Kawat Ag/AgCl yang digunakan pada ESI dielektrolisis terlebih dahulu dan ditentukan pula faktor Nersntnya melalui pengukuran potensial larutan KCl standar 10-1
–
10-5 M (Lampiran 9). Nilai faktor Nernst untuk kawat Ag/AgCl harus mendekati nilai teoretis faktor Nernst untuk ion monovalen karena Ag memiliki muatan +1.Fraksi spesies kromat yang dominan dan paling dominan pada larutan ditunjukkan pada diagram Pourbaix pada Gambar 7.
Gambar 7 Diagram Pourbaix spesies ion Cr(VI) pada suhu 25 oC (Welch
et al. 2005).
10
memiliki kisaran konsentrasi 10-1
–
10-6 M dengan rentang pH sekitar 4–
6 (Lampiran 10). Karena itu, spesies kromat paling dominan pada larutan adalah HCrO4−.Pada ESI I yang menggunakan membran termodifikasi DPC, elektrode terbaik memiliki koefisien korelasi paling tinggi, yaitu 0.9954, dengan faktor Nernst -18.4 mV/dekade (Lampiran 11). Nilai faktor Nernst untuk transfer ion monovalen adalah 59.2 mV/dekade, namun faktor Nernst yang ditunjukkan dengan nilai kemiringan pada ESI I (Gambar 8) mengindikasikan respons Nernst untuk ion trivalen. Hal ini dapat disebabkan ketika terjadi pertukaran ion antara fase organik, yaitu membran yang mengandung ionofor DPC, dan larutan K2Cr2O7, ion yang paling dominan, yaitu HCrO4−, terekstraksi ke dalam fase organik dengan mengalami reduksi secara spontan menjadi Cr(III) (Choi & Moon 2004).
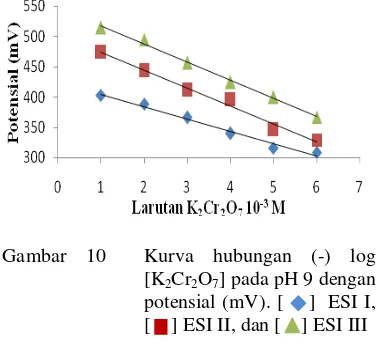
Gambar 8 Kurva hubungan (-) log [K2Cr2O7] dengan potensial (mV) pada ketiga ESI. [ ] ESI I, [ ] ESI II, dan [ ] ESI III.
Pada ESI II yang menggunakan membran termodifikasi zeolit, elektrode terbaik memiliki koefisien korelasi tertinggi 0.9938 dan nilai faktor Nernst -29.11 mV/dekade (Lampiran 11 dan Gambar 8) yang mengindikasikan bahwa ion paling dominan saat pengukuran adalah Cr2O72−. Nilai ini lebih sesuai dengan pernyataan Welch et al.
(2005) dan diperkuat oleh Hasan et al. (2005) bahwa ion HCrO4− dan Cr2O72− paling dominan dan terdapat bersama-sama di dalam larutan K2Cr2O7 dengan rentang pH 2
–
6, namun berbeda dari pernyataan Yari & Bagheri (2009) dan Choi & Moon (2004). Perbedaan ini dapat disebabkan oleh perbedaan jenis ionofor yang digunakan pada membran ESI dalam penelitian ini, yaitu DPC dan zeolit, sehingga kemungkinan dapat memengaruhi kinerja ESI. Namun, padapenelitian ini mekanisme keselektifan membran termodifikasi zeolit terhadap Cr2O72− dibandingkan dengan HCrO4− tidak dipelajari.
Pada ESI III yang menggunakan membran termodifikasi zeolit dan DPC, elektrode terbaik memiliki koefisien korelasi tertinggi 0.9946 dan nilai faktor Nernst -28.8 mV/dekade (Lampiran 11). Nilai ini juga mendekati nilai faktor Nernst untuk ion divalen, yaitu 29.6 mV/dekade. Seperti halnya ESI II, ion paling dominan yang berada pada larutan saat pengukuran adalah Cr2O72−.
Limit Deteksi
Limit deteksi adalah konsentrasi ion yang merupakan batas antara daerah linear dan taklinear pada kurva persamaan Nernst. Daerah kurva yang taklinear tidak memenuhi hukum Nernst dan terjadi pada konsentrasi rendah (Saputra 2009). Limit deteksi ditentukan dengan mencari titik potong antara fungsi garis lurus dan garis lengkung pada kurva hubungan (-) log konsentrasi K2Cr2O7 dengan potensial larutan standar K2Cr2O7 hasil pengukuran dengan ESI (Lampiran 12). Ekstrapolasi titik potong yang dihasilkan terhadap absis menghasilkan nilai limit deteksi. Hasilnya ditunjukkan pada Tabel 3. Pada konsentrasi yang lebih kecil dari nilai limit deteksi, ESI tidak dapat digunakan karena akan menghasilkan koefisien korelasi (r) yang jelek dan tidak linear.
Tabel 3 Limit deteksi ketiga jenis ESI ESI Limit Deteksi (10-6 M)
I 1.44
II 1.91
III 2.14
Waktu Respons
11
adanya ion pengganggu dalam larutan, dan kecepatan melarutnya ionofor membran (Naibaho 2007).
Tabel 4 Waktu respons rerata ketiga jenis ESI
Konsentrasi (M)
Waktu respons (detik)
ESI I ESI II ESI III 10-1 5 15 15
10-2 10 24 24 10-3 10 67 67
10-4 12.5 225 190
10-5 15 480 247
10-6 15 262 262
Tabel 4 memperlihatkan, ESI I memiliki waktu respons yang lebih cepat dibandingkan dengan ESI II dan III. Waktu respons yang dihasilkan untuk setiap konsentrasi juga relatif hampir sama cepat. Hal ini dapat disebabkan ionofor larut sempurna dalam pembuatan membran sehingga membran yang dihasilkan ketebalannya merata. Berdasarkan pengamatan, membran ESI I terlihat lebih tipis dibandingkan dengan ESI II dan ESI III. Semakin tipis membran ESI, pertukaran ion Cr(VI) dari larutan ke dalam membran akan semakin mudah sehingga waktu respons semakin cepat.
Waktu respons ESI II semakin lambat seiring dengan penurunan konsentrasi, tetapi pada konsentrasi 10-6 waktu respons lebih cepat dibandingkan dengan pada konsentrasi 10-5. Hal ini dapat disebabkan ion-ion dalam larutan yang akan dideteksi tidak tersebar merata sehingga dimungkinkan difusi ion ke dalam membran melambat. Hal ini dapat diatasi dengan mengaduk larutan sebelum pengukuran potensial, tetapi akan lebih baik lagi jika selama pengukuran, larutan terus diaduk menggunakan pengaduk magnetik. Kecepatan pengadukan yang homogen diharapkan dapat menghasilkan data yang homogen. Data lengkap pengukuran waktu respons ditampilkan pada Lampiran 13.
Pengaruh pH Terhadap ESI
Penentuan pengaruh pH terhadap ESI dilakukan dengan meragamkan pH larutan standar K2Cr2O7 10-3 M dari 2 sampai 14, kemudian diukur potensialnya menggunakan ESI I, II, dan III. Data yang diperoleh (Lampiran 14) dialurkan ke dalam kurva hubungan pH larutan standar K2Cr2O7 dengan potensial yang dihasilkan (Gambar 9). Berdasarkan kurva tersebut, kisaran pH yang memberikan pembacaan potensial yang stabil untuk ketiga jenis ESI adalah sama, yaitu 8– 12. Hasil ini sesuai dengan penelitian sebelumnya oleh Ardakani et al. (2005) yang
menyatakan bahwa ESI yang dibuat cocok untuk pengukuran larutan K2Cr2O7 pada kisaran pH 8
–
12.Gambar 9 Kurva pengaruh pH terhadap ESI. [ ] ESI I, [ ] ESI II, dan [ ] ESI
III.
Tahap selanjutnya ialah pengukuran larutan standar K2Cr2O7 10-1
–
10-6 M pada kisaran pH 8–
12 (dipilih pH 9), untuk mengamati pengaruh pH terhadap faktor Nernst dan koefisien korelasi. Hasil yang diperoleh ditunjukkan pada Lampiran 15.Kurva hubungan (-) log konsentrasi larutan standar K2Cr2O7 pada pH 9 dengan potensial yang dihasilkan (Gambar 10) menunjukkan perubahan nilai faktor Nernst dan koefisien korelasi, namun tidak terlalu signifikan. Diagram Pourbaix pada Gambar 8 menunjukkan, spesies yang dominan pada pH larutan K2Cr2O7 lebih dari 7 adalah CrO42−. Hal ini menjelaskan nilai faktor Nernst untuk ESI II dan ESI III yang mendekati nilai teoretis untuk ion divalen. Namun, pada ESI I nilai faktor Nernst yang diperoleh tetap mendekati nilai teoretis untuk ion trivalen. Ion yang paling dominan memang CrO42−, namun ion tersebut diduga terekstraksi ke dalam fase organik dengan secara spontan mengalami reduksi menjadi Cr(III).
Koefisien Selektivitas
Koefisien selektivitas merupakan besaran khas yang menunjukkan kemampuan ESI untuk membedakan atau merespons pengaruh aktivitas ion lain terhadap ion utama dalam pengukuran aktivitas berbagai ion pada larutan yang sama. Pada umumnya, ada 2 metode untuk menentukan koefisien selektivitas, yaitu metode larutan terpisah dan larutan tercampur. Pada metode larutan terpisah, potensial ion utama dan pengganggu diukur terpisah. Metode ini kurang baik karena dilakukan pada kondisi larutan yang berbeda sehingga keterulangannya kurang baik.
Metode larutan tercampur dapat dilakukan pada larutan yang mengandung ion utama dengan aktivitas beragam dan ion pengganggu dengan aktivitas tertentu, yang dikenal dengan
fixed interfering ion method (FIM) atau komposisi sebaliknya, yang dikenal dengan
fixed primary ion method (FPM) (Umezawa et al. 2000). Pada penelitian ini digunakan metode tercampur FPM. Data hasil pengukuran potensial untuk penentuan koefisien selektivitas ditunjukkan pada Lampiran 16 dan 17. Nilai koefisien selektivitas ESI terhadap variasi ion pengganggu ditampilkan pada Tabel 5.
Tabel 5 Koefisien selektivitas ESI terhadap ragam ion pengganggu
[A]
(M) ESI I ESI II ESI III Cu2+ 10-1 0.1160 0.0717 0.0184 10-2 0.0739 0.0203 0.0581 10-3 0.0936 0.0381 0.1248 10-4 0.1721 0.0268 0.0616 10-5 0.2749 0.0260 0.1192 10-6 0.6496 0.0822 0.1733 Fe3+ 10-1 1.4304 0.4994 0.1345 10-2 6.6358 0.7342 0.0557 10-3 2.7800 0.1766 0.1542 10-4 0.0299 0.0607 0.0262 10-5 0.0975 0.3190 0.0288 10-6 0.0455 0.5676 0.0491 Keterangan: [A] = Konsentrasi ion pengganggu
Jika koefisien selektivitas (K) < 1, maka ESI lebih selektif kepada ion utama. Jika K > 1, maka ESI lebih selektif terhadap ion pengganggu. Berdasarkan Tabel 5, ion pengganggu Cu2+ tidak berpengaruh pada pengukuran ketiga jenis ESI, karena koefisien selektivitas yang dihasilkan kurang dari 1. Ini berarti ESI I, II, maupun III selektif terhadap ion utama, yaitu Cr(VI), dibandingkan dengan ion Cu2+. Hal ini sesuai dengan penelitian sebelumnya yang dilakukan oleh
Sanchez-Moreno et al. (2010): Cu2+ tidak memengaruhi kinerja ESI Cr(VI) yang dimodifikasi dengan DPC. Keberadaan ion Fe3+ pada ESI I berpengaruh hanya pada konsentrasi tinggi, sedangkan untuk ESI II dan ESI III keberadaan Fe3+ tidak berpengaruh pada pengukuran. Keselektifan ESI II dan III terhadap ion utama dapat disebabkan adanya zeolit pada komposisi membrannya. Zeolit pada penelitian ini memiliki KTK yang kecil sehingga kation yang akan dipertukarkan jumlahnya sedikit. Hal ini kemungkinan dapat disebabkan oleh potensi pertukaran anion yang lebih besar. Karena itu, Cr(VI) yang terdapat dalam bentuk anionnya akan lebih mudah terjerap dibandingkan dengan kation Fe3+ dan Cu2+.
SIMPULAN DAN SARAN
Simpulan
Zeolit Cikembar termasuk jenis mordenit, memiliki nilai KTK 46.22 cmol(+)/kg. Kapasitas adsorpsi zeolit tersebut terhadap Cr(VI) diperoleh pada konsentrasi Cr(VI) 200 ppm, yaitu sebesar 3.227 mg/g. Kondisi optimum ini dicapai pada pH 3 dengan waktu kontak 24 jam. Data pendukung ini menunjukkan adanya interaksi yang kuat antara zeolit dan Cr(VI).
Penggunaan zeolit sebagai ionofor pada membran ESI Cr(VI) memberikan respons hasil yang baik dan nilai koefisien selektivitas <1. Hal ini menunjukkan bahwa ESI dengan membran termodifikasi zeolit berhasil menjadi ESI yang selektif terhadap Cr(VI). Faktor Nernst ESI termodifikasi DPC, zeolit, dan gabungan keduanya (ESI I, II, dan III) pada trayek pengukuran 10-1
–
10-6 M berturut-turut -18.4; -29.11; dan -28.8 mV/dekade, dengan limit deteksi masing-masing 1.44 × 10-6, 1.91 × 10-6, dan 2.14 × 10-6 M. Waktu respons ESI I lebih cepat dibandingkan dengan ESI II dan III. Semakin tinggi konsentrasi, waktu respons semakin cepat. Keberadaan ion Cu2+ dalam larutan Cr(VI) tidak memengaruhi kinerja ketiga jenis ESI, sedangkan keberadaan ion Fe3+ hanya berpengaruh pada ESI I pada konsentrasi tinggi dari 10-1–
10-3 M. Hasil uji parameter secara keseluruhan menunjukkan bahwa ESI III memiliki kinerja yang lebih memuaskan.Saran
mendapatkan kinerja ESI yang lebih baik. Pengukuran ketebalan membran secara kuantitatif dapat dilakukan untuk melihat pengaruhnya terhadap kinerja ESI. Pengukuran SEM juga diperlukan terhadap membran termodifikasi zeolit. Selain itu, karena ion Cr(VI) terdapat dalam bentuk anionnya perlu dilakukan pengukuran kapasitas tukar anion (KTA).
DAFTAR PUSTAKA
Al-Jabri M. 2008. Kajian metode penetapan kapasitas tukar kation zeolit sebagai pembenah tanah untuk lahan pertanian terdegradasi. J Standardisasi 10:56-69. Ardakani MM, Dastanpour A, Salavati-Nisari
M. 2005. Novel coated-wire membrane sensor based on bis(acetylacetonato) cadmium(II) for the determination of chromate ions. Microchim Acta 150:67-72. Arvand M, Vejdani M, Moghimi M. 2008. Construction and performance characterization of an ion selective electrode for potentiometric determination of atenololin pharmaceutical preparations.
Desalination 225:176-184.
Asri BH. 2011. Pembuatan dan pencirian elektrode ion selektif ion Lu3+ dengan ionofor 4-dodekanadiolbis-(1-fenil-3-metil)-5-pirazolon [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Bailey PL. 1983. Analysis with Ion Selective Electrodes. London: Heyden and Sons. Balai Penelitian Tanah. 2005. Analisis Kimia
Tanah, Tanaman, Air, dan Pupuk. Ed ke-1. Bogor: Badan Penelitian dan Pengembangan Pertanian, Departemen Pertanian.
Buchari, Irdhawati. 2002. Pembuatan dan karakterisasi ESI nitrat kawat terlapis membran PVC dengan dopa metal trioktil ammonium nitrat sebagai ionofor. Di dalam: Prosiding Seminar Kimia Bersama UKM ITB K-5; Hotel Equatorial, 16-17 Jul 2002. Malaysia: Universitas Kebangsaan Malaysia. hlm159-168.
Choi Y-W, Moon S-H. 2004. Determination of Cr(VI) using an ion selective electrode with SLMs containing aliquat336. Environ Monitoring Assessment 92:163-178.
Clescery LS, Greenberg AE, Eaton AD. 2005.
Standard Methods for Examination of Water and Wastewater. Ed ke-21.
Washington DC: American Public Health Association.
Ertürün KEH, Yılmaz M, Kılıc E. 2007.
Construction of an anion-selective electrode: Dichromate-selective electrode.
Sensors and Actuators B 127:497-504. Fardiyah Q. 2003. Aplikasi elektrode ion
selektif nitrat tipe kawat terlapis untuk penentuan secara tidak langsung gas [tesis]. Bandung: Sekolah Pascasarjana, Institut Teknologi Bandung.
Faridbod F, Ganjali MR, Dinarvand R, Norouzi P. 2007. The fabrication of potentiometric membrane sensors and their applications. African J Biotechnol 6:2960-2987.
Furi PR. 2010. Pengembangan pengekstrak fase padat berbasis zeolit untuk adsorpsi kromium heksavalen [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Górski Ł, Matusevicha A, Parzuchowski P,
Łuciuk I, Malinowskaa E. 2010. Fluoride-selective polymeric membrane electrodes based on Zr(IV)- and Al(III)-salen ionophores of various structures. Anal Chim Acta 665:39-46.
Hasan MSS, El-Shahawi SM, Othman MA, Mosaad AM. 2005. A potentiometric rhodamine-B based membrane sensor for the selective determination of chromium ion in wastewater. Anal Chem 21:673-677. IUPAC. 2006. General terms relevant to ion selective electrodes [terhubung berkala]. http://www.iupac.org/publications/analytic compendium.pdf [8 Des 2011].
Muhammad S, Munawar E. 2007. Nanocrystalline zeolite Y: Synthesis and heavy metal removal. J Rekayasa Kim dan Lingkungan 6:55-62.
Muresan ML. 2011. Zeolite modified-electrodes with analytical applications.
Pure Appl Chem 83:325-343.
Naibaho S. 2007. Pencirian dan penggunaan elektrode selektif ion klorida untuk penentuan klorida dalam larutan sistem hidroponik [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Ozkan, Ulku S. 2005. The effect of HCl treatment on water vapor adsorption characteristics of clinoptilolite rich natural zeolite. Microporous Mesoporous Mat
77:47-53.
14
a diphenylcarbazide-modified carbon paste electrode. Electroanalysis 5:155-163. Rahmat NA. 2007. Pembuatan dan pencirian
elektrode selektif ion H2PO4− dan penerapannya pada tanaman hidroponik [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Ramadani, Siswanta D, Jumina. 2006. Pemanfaatan tetrakis(N-ropildihidro oxazina)-C-metil kaliks(4)resorsinarena sebagai komponen membran elektrode selektif ion perak. J Sains & Sibernatika
19:243-256.
Rezaei B, Meghdadi S, Bagherpour S. 2009. Perchlorate-selective polymeric membrane electrode based on bis(dibenzoyl methanato) cobalt(II) complex as a neutral carrier. J Hazardous Mat 161:641-648. Rohaeni A. 2005. Penetapan kapasitas jerapan
zeolit dan zeolit termodifikasi heksadesiltrimetil amonium bromida terhadap K2Cr2O7 [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Rohaeti E. 2007. Pencegahan pencemaran lingkungan oleh logam berat krom limbah cair penyamakan kulit (Studi kasus di Kabupaten Bogor) [disertasi]. Bogor: Fakultas Matematika dan Ilm Pengetahuan Alam, Institut Pertanian Bogor.
Sanchez-Moreno AR, Gismera JM, Sevilla TM, Procopio RJ. 2010. Evaluation of solid-state platforms for chromium(VI) potentiometric sensor development.
Sensors and Actuators 143:716-723. Saputra ARD. 2009. Pembuatan dan pencirian
elektrode selektif ion kalium [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Senthilkumar S, Saraswathi R. 2009. Electrochemical sensing of cadmium and lead ions at zeolite-modified electrodes: Optimization and field measurements.
Sensors and ActuatorsB 141:65-75. Slamet R, Arbianti, Daryanto. 2005.
Pengolahan limbah organik (fenol) dan logam berat (Cr VI atau Pt IV) secara simultan dengan fotokatalis TiO2, ZNO-TiO2, dan CDS-TiO2. Makara Teknol 9:66-71.
Sudiarta IW, Yulihastuti DA. 2010. Biosorpsi kromium(VI) pada serat sabut kelapa hijau (Cocos nucifera). J Kim 4:158-166. Suprayogi D. 2009. Adsorpsi dan desorpsi
kromium(VI) pada zeolit alam asli Lampung termodifikasi heksadesiltrimetil amonium bromida [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Susetyaningsih R, Kismolo E, Prayitno. 2009.
Karakterisasi zeolit alam pada reduksi kadar chrom dalam limbah cair. Di dalam:
Prosiding Seminar Nasional V SDM Nuklir Yogyakarta; Yogyakarta, 5 Nov 2009. Yogyakarta:Sekolah Tinggi Teknologi Nuklir-BATAN. hlm 741-748. Suwardi. 2000. Mineral Zeolit: Sifat-Sifat dan
Pemanfaatan di Bidang Pertanian. Bogor: Departemen Manajemen Sumber Daya Lahan, Fakultas Pertanian, Institut Pertanian Bogor.
Umezawa Y, Buhlmanni P, Umezawa K, Tohda K, Amemiyai S. 2000. Potentiometric selectivity coefficients of-ion selective electrodes Part 1. Inorganic cations Pure Appl Chem. 72:1851-2082. Wahyudi A, Amalia D, Sariaman, Rochani S.
2010. Sintesis nanopartikel zeolit secara top down menggunakan Planetary Ball Mill dan ultrasonikator. M&E 8:32-36. Welch CM, Nekrassova O, Compton RG.
2005. Reduction of hexavalent chromium at solid electrodes in acidic media: Reaction mechanism and analytical applications. Talanta 65:74-80.
Wulandari M. 2010. Resin pengkhelat Amberlite XAD-16-1,5-difenilkarbazida untuk prakonsentrasi dan analisis selektif kromium(VI) [tesis]. Bandung: Sekolah Pasca sarjana, Institut Teknologi Bandung. Yang RT. 2003. Adsorbent: Fundamental and
Applications. New Jersey: J Wiley. Yari A, Bagheri H. 2009. Determination of
Cr(VI) with selective sensing of Cr(VI) anions by PVC-membrane electrode based on quinaldine red. J Chin Chem Soc
56:289-295.
16
Lampiran 1 Bagan alir penelitian
Pengukuran KTK zeolit
Pembuatan membran elektrode
termodifikasi DPC, zeolit, dan gabungannya
Perakitan ESI Cr(VI)
Analisis data
Penentuan kapasitas adsorpsi zeolit terhadap Cr(VI)
Analisis morfologi zeolit dengan PSA, XRD, dan SEM
Pencirian ESI dengan penentuan faktor Nernst, trayek pengukuran, limit
deteksi, waktu respons, pengaruh pH terhadap ESI, dan koefisien
selektivitas
Penentuan kondisi optimum konsentrasi, pH, dan
17
Lampiran 2 Difraktogram sinar-X zeolit sebelum dan setelah aktivasi
Sebelum aktivasi
18
Lampiran 3 Data
2θ
difraktogram zeolit alam Cikembar sebelum dan setelah
diaktivasi
Sebelum aktivasi
2Theta d (A) Height Area FWHM 2Theta d (A) Height Area FWHM
5.675 15.56043 4.7 114.1 0.7320 39.599 2.27406 4.7 86.0 0.5420 6.545 13.49319 2.9 28.1 0.3520 40.473 2.22695 3.1 46.5 0.4070 7.576 11.65998 0.9 12.7 0.3790 41.556 2.17140 2.6 36.3 0.3790 8.222 10.74437 2.3 26.4 0.3260 42.436 2.12836 4.6 63.2 0.5150 9.146 9.66184 3.7 54.0 0.4330 43.321 2.08693 3.5 48.8 0.3790 9.785 9.03231 19.2 324.7 0.4600 43.895 2.06096 0.5 3.5 0.1900 11.173 7.91252 5.6 88.2 0.4330 44.402 2.03861 2.2 24.7 0.3520 11.847 7.46440 2.6 28.1 0.2980 44.945 2.01523 2.0 26.0 0.3520 12.365 7.15268 1.7 9.7 0.1630 45.808 1.97926 1.2 9.6 0.2710 13.429 6.58838 14.0 237.5 0.4610 46.240 1.96175 2.3 20.8 0.2440 14.585 6.06850 4.2 40.5 0.2980 46.671 1.94462 3.2 39.4 0.3800 15.211 5.82027 5.5 82.3 0.4070 47.469 1.91381 1.7 14.9 0.2980 15.853 5.58574 2.5 32.5 0.3520 47.897 1.89770 0.9 7.8 0.2440 16.891 5.24471 3.4 57.8 0.4870 48.378 1.87994 1.2 8.0 0.2430 17.537 5.05315 2.4 42.7 0.4880 48.978 1.85830 1.8 31.0 0.5420 18.338 4.83408 1.6 21.4 0.3800 50.282 1.81311 4.9 73.3 0.4070 18.850 4.70388 1.0 10.4 0.2710 50.942 1.79118 3.4 34.2 0.2980 19.647 4.51483 13.2 221.7 0.4600 51.366 1.77737 2.1 19.9 0.2980 20.870 4.25293 13.5 213.6 0.4330 52.117 1.75352 1.6 5.2 0.2170 22.049 4.02818 29.8 834.0 0.7580 52.898 1.72946 4.1 27.5 0.4330
23.528 3.77819 6.2 105.0 0.4610 53.311 1.71703 1.7 15.2 0.2440 24.542 3.62435 4.0 68.0 0.4610 53.798 1.70263 2.3 22.1 0.2710 25.671 3.46739 23.7 380.0 0.4340 54.199 1.69098 2.4 16.1 0.1900 26.638 3.34368 39.8 595.5 0.4060 54.676 1.67733 4.1 65.5 0.4330 27.692 3.21882 23.1 620.8 0.7310 55.653 1.65017 3.0 33.1 0.4060
19
20
Lampiran 4
Basis data puncak 2θ nomor arsip 29
-1257 pada PCDFWIN untuk
zeolit alam (mordenit)
Lampiran 5 Kurva standar analisis Cr(VI)
[Cr(VI)]
(ppm) Absorbans
1 0.388
2 0.792
4 1.536
6 2.081
21
Lampiran 6 Konsentrasi optimum adsorpsi zeolit terhadap Cr(VI)
[Cr(VI)] dibuat (ppm)
Ulangan
Massa zeolit (g)
A
terukur
A
Sisa
[Cr(VI)] terukur
(ppm)
[Cr(VI)] sisa (ppm)
Kapasitas adsorpsi
(mg/g)
Rerata (mg/g)
5 1 0.5053 0.993 0.725 5.293 3.680 0.080
2 0.5006 0.983 0.775 5.233 3.982 0.062 0.071 10 1 0.5047 0.794 1.437 10.227 7.982 0.111
2 0.5081 0.792 1.444 10.196 8.024 0.107 0.109 20 1 0.5005 0.808 0.624 20.876 15.347 0.276
2 0.5000 0.793 0.635 20.423 15.680 0.237 0.257 30 1 0.5031 0.625 0.543 30.695 25.801 0.243
2 0.5006 0.605 0.48 29.486 21.994 0.374 0.309 40 1 0.5038 0.807 0.631 41.692 31.118 0.525
2 0.5038 0.807 0.631 41.692 31.118 0.525 0.525 50 1 0.502 0.976 0.77 51.903 39.517 0.617
2 0.5010 0.984 0.784 52.387 40.363 0.600 0.608 60 1 0.5053 1.174 0.923 63.867 48.761 0.747
2 0.5048 1.148 0.88 62.296 46.163 0.799 0.773 70 1 0.5025 0.626 0.426 76.888 46.828 1.496
2 0.5039 0.572 0.406 68.731 43.807 1.237 0.366 80 1 0.5065 0.672 0.474 83.837 54.079 1.469
2 0.505 0.635 0.463 78.248 52.417 1.279 1.374 90 1 0.5097 0.758 0.551 96.828 65.710 1.526
2 0.5097 0.72 0.551 91.088 65.710 1.245 1.386 100 1 0.5019 0.795 0.6 102.417 73.112 1.460
2 0.5036 0.782 0.588 100.453 71.299 1.447 1.453 110 1 0.5001 0.847 0.645 110.272 79.909 1.518
2 0.5001 0.847 0.645 110.272 79.909 1.518 1.525 120 1 0.5006 0.925 0.598 122.054 72.810 2.459
2 0.5030 0.888 0.673 116.465 84.139 1.607 2.033 130 1 0.5055 1.005 0.705 134.139 88.973 2.234
2 0.5066 0.967 0.733 128.399 93.202 1.737 1.980 140 1 0.5039 1.085 0.785 146.224 101.057 2.241
2 0.5044 1.028 0.764 137.613 97.885 1.969 2.105 150 1 0.5090 1.134 0.789 153.625 101.662 2.552
2 0.5001 1.126 0.8 152.417 103.323 2.454 2.503 160 1 0.504 0.654 0.482 162.236 110.574 2.563
2 0.5006 1.197 0.88 163.142 115.408 2.384 2.473 180 1 0.5005 0.724 0.531 183.384 125.378 2.897
2 0.5055 1.33 0.534 183.233 126.284 2.816 2.857 200 1 0.5023 0.805 0.596 207.855 145.015 3.128
22
[Cr(VI)] dibuat (ppm) Ulangan Massa zeolit (g) A terukur A Sisa [Cr(VI)] terukur (ppm) [Cr(VI)] sisa (ppm) Kapasitas Adsorpsi (mg/g) Rerata (mg/g)220 1 0.5069 0.84 0.636 218.429 157.100 3.025
2 0.5000 0.844 0.647 219.637 160.423 2.961 2.993 240 1 0.5040 0.904 0.712 237.764 180.060 2.862
2 0.5013 0.913 0.689 240.483 173.112 3.360 3.111 260 1 0.5021 0.991 0.839 264.048 218.429 2.271
2 0.5021 0.991 0.839 264.048 218.429 2.271 2.286 280 1 0.5022 1.065 0.873 286.405 228.701 2.873
2 0.5022 1.065 0.873 286.405 228.701 2.873 2.888
Lampiran 7 pH optimum adsorpsi zeolit terhadap Cr(VI)
pH Ulangan
Bobot zeolit (g) A terukur A sisa [Cr(VI)] terukur (ppm) [Cr(VI)] sisa (ppm) Kapasitas adsorpsi (mg/g) Rerata (mg/g)
2 1 0.5011 0.791 0.572 205.988 140.419 3.271
2 0.5064 0.791 0.584 205.988 144.012 3.060 3.165 3 1 0.5070 0.791 0.569 205.988 139.521 3.277
2 0.5005 0.791 0.560 205.988 136.826 3.455 3.366 4 1 0.5014 0.791 0.577 205.988 141.916 3.195
2 0.5030 0.791 0.574 205.988 141.018 3.229 3.212 5 1 0.5062 0.791 0.601 205.988 149.102 2.809
2 0.5014 0.791 0.594 205.988 147.006 2.941 2.875 6 1 0.5058 0.791 0.575 205.988 141.317 3.196
2 0.5032 0.791 0.594 205.988 147.006 2.930 3.063
Lampiran 8 Waktu kontak optimum adsorpsi zeolit terhadap Cr(VI)
Waktu
(jam) Ulangan
Bobot zeolit (g) A terukur A sisa [Cr(VI)] terukur (ppm) [Cr(VI)] sisa (ppm) Kapasitas adsorpsi (mg/g) Rerata (mg/g)
3 1 0.5031 0.794 0.604 206.886 150.000 2.827
2 0.5030 0.794 0.611 206.886 152.096 2.723 2.783 6 1 0.5068 0.794 0.605 206886 150.299 2.791
2 0.5035 0.794 0.609 206.886 151.497 2.750 2.779 12 1 0.5010 0.794 0.615 206.886 153.293 2.674
2 0.5048 0.794 0.611 206.886 152.096 2.713 2.702 24 1 0.5020 0.794 0.604 206.886 150.000 2.833
2 0.5059 0.794 0.603 206.886 149.701 2.826 2.838 36 1 0.5038 0.794 0.609 206.886 151.497 2.749
2 0.5013 0.794 0.608 206.886 151.198 2.777 2.772 48 1 0.5003 0.794 0.610 206.886 151.796 2.753
23
Lampiran 9 Hubungan (-) log [KCl] dengan potensial kawat Ag/AgCl hasil
elektrolisis (mV)
[KCl] (M) (-) log [KCl] Potensial (mV)
10-1 1 255
10-2 2 323
10-3 3 379
10-4 4 452
10-5 5 480
Lampiran 10 pH larutan standar K
2Cr
2O
710
-1–
10
-6M
[K2Cr2O7] (M) pH
10-1 4.43
10-2 4.64
10-3 5.16
10-4 5.77
10-5 6.16
24
Lampiran 11 Potensial larutan standar K
2Cr
2O
7dengan ESI
ESI I
Ulangan
Potensial ESI (mV) pada [K2Cr2O7]
(M) S A (r)
10-1 10-2 10-3 10-4 10-5 10-6
1 478 449 426 403 394 388 -18.23 486.80 0.9703 2 470 454 444 414 390 383 -18.77 491.53 0.9868 3 470 463 441 414 396 389 -18.09 422.13 0.9854 4 490 475 456 428 415 409 -17.51 505.20 0.9853 5 452 438 401 395 385 355 -18.57 469.33 0.9779 6 470 456 441 414 397 382 -18.40 491.07 0.9954
ESI II
Ulangan
Potensial ESI (mV) pada [K2Cr2O7]
(M) S A (r)
10-1 10-2 10-3 10-4 10-5 10-6
1 492 453 404 374 349 333 -32.49 514.53 0.9846 2 457 434 393 335 312 306 -33.68 490.73 0.9764 3 342 319 278 260 246 215 -24.91 363.87 0.9899 4 464 442 391 370 344 323 -29.14 491.00 0.9895 5 471 445 420 369 335 329 -31.17 503.93 0.9848 6 499 459 431 398 372 354 -29.11 520.73 0.9938
ESI III
Ulangan
Potensial ESI (mV) pada [K2Cr2O7]
(M) S A (r)
10-1 10-2 10-3 10-4 10-5 10-6
1 465 407 388 358 339 323 -26.97 474.40 0.9735 2 471 463 434 400 373 360 -24.54 502.73 0.9882 3 421 398 377 362 345 292 -23.40 447.73 0.9739 4 364 348 325 285 228 218 -32.22 407.67 0.9801 5 357 317 287 265 230 212 -28.80 378.80 0.9946 6 356 319 290 271 230 216 -28.17 378.93 0.9934
Keterangan:
S = kemiringan (faktor Nernst) (mV/dekade)
A = Intersep
25
Lampiran 12 Limit deteksi ESI
ESI I
[K2Cr2O7] (M) (-) log [K2Cr2O7] Potensial (mV)
10-1 1 470
10-2 2 456
10-3 3 441
10-4 4 414
10-5 5 397
10-6 6 382
10-7 7 380
10-8 8 376
10-9 9 370
Penentuan limit deteksi ESI I:
-18.4
x
+ 491.07
= -4
x
+ 407
x
= 5.84
-log [Cr
2O
7]
2-= 5.84
[Cr
2O
7]
2-= 1.44 × 10
-6M
ESI II
[K2Cr2O7] (M) (-) log [K2Cr2O7] Potensial (mV)
10-1 1 499
10-2 2 459
10-3 3