IDENTIFIKASI KERAGAMAN DNA MIKROSATELIT
PADA SAPI BALI DI PULAU BALI DAN
PULAU NUSA PENIDA
ALWIYAH
DEPARTEMEN ILMU PRODUKSI DAN TEKNOLOGI PETERNAKAN FAKULTAS PETERNAKAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi penelitian berjudul Identifikasi Keragaman DNA Mikrosatelit pada Sapi Bali di Pulau Bali dan Pulau Nusa Penida adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juni 2015
Alwiyah
ABSTRAK
ALWIYAH. Identifikasi Keragaman DNA Mikrosatelit pada Sapi Bali di Pulau Bali dan Pulau Nusa Penida. Dibimbing oleh JAKARIA dan MUHAMAD BAIHAQI.
Sapi bali merupakan salah satu sumber daya genetik ternak asli Indonesia. Sapi bali telah tersebar di berbagai daerah, namun Pulau Bali adalah wilayah pusat pemurnian. Keragaman merupakan hal yang sangat penting dalam mempertahankan suatu populasi. DNA Mikrosatelit adalah metode yang mudah untuk identifikasi keragaman genetik. Tujuan dari penelitian ini adalah mempelajari keragaman dari sapi bali dengan lokus ETH225, SPS115 dan INRA037 di Pulau Bali dan Pulau Nusa Penida dengan metode DNA Mikrosatelit berlabel. Jumlah sampel yang digunakan yaitu 48 sampel dari Pulau Bali dan 47 sampel dari Pulau Nusa Penida. Hasil genotiping dianalisis menggunakan program GenAlEx 6.41. Hasil penelitian menunjukkan bahwa lokus SPS115, ETH225 dan INRA37 memiliki keragaman yang tinggi. Nilai heterosigosits tertinggi ditunjukkan oleh lokus ETH225 di Pulau Bali. Nila laju inbreeding pada sapi Bali dalam penelitian ini sampai 14.1%. Dari penelitian ini dapat disimpulkan bahwa sapi bali yang terdapat di Pulau Bali dan Pulau Nusa Penida berbeda. Kata kunci : DNA mikrosatelit, keragaman, Pulau Bali, Pulau Nusa Penida, sapi
bali
ABSTRACT
ALWIYAH. Polymorphism identification of microsatelite DNA on Bali cattle in Bali island and Nusa Penida island. Supervised by JAKARIA and MUHAMAD pholymorpism loci bali cattle from SPS115, ETH225, and INRA37 in Bali island and Nusa Penida island with microsatelite DNA labeling system. SPS115, ETH225 and INRA37 had been annalyzed from total sample of 48 Bali cattle in Bali Island and 47 in Nusa Penida Island. The result of sequent were analyzed by GenAlEx 6.41. The results of this research showed that SPS115, ETH225 and INRA37 are higher diversity. The highest heterozygosity were found in loci ETH225 in Bali island. The highest PIC were found in loci INRA37 in Nusa Penida Island. The inbreeding rate of Bali cattle until 14.1%. From this research, that bali cattle in Bali island and Nusa Penida island is different.
IDENTIFIKASI KERAGAMAN DNA MIKROSATELIT
PADA SAPI BALI DI PULAU BALI DAN
PULAU NUSA PENIDA
ALWIYAH
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Peternakan
pada
Departemen Ilmu Produksi dan Teknologi Peternakan
DEPARTEMEN ILMU PRODUKSI DAN TEKNOLOGI PETERNAKAN FAKULTAS PETERNAKAN
INSTITUT PERTANIAN BOGOR BOGOR
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Penelitian yang dilaksanakan sejak bulan September 2014 hingga Maret 2015 berjudul Identifikasi Keragaman pada Sapi Bali di Pulau Bali dan Pulau Nusa Penida. Skripsi ini disusun sebagai salah satu syarat untuk mendapatkan gelar Sarjana Peternakan.
Penulis menyadari bahwa proses penelitian dan penyusunan karya ilmiah ini tidak dapat berjalan dengan lancar tanpa bantuan dan dukungan dari banyak pihak. Terima kasih penulis ucapkan kepada yang terhormat Dr Jakaria, SPt MSi dan Muhammad Baihaqi, SPt MSc selaku komisi pembimbing atas curahan waktu, bimbingan dan dorongan semangatnya. Terima kasih juga kepada yang terhormat Dr Ir Henny Nuraini, MSi selaku pembimbing akademik yang selalu memberikan dukungan selama perkuliahan. Terima kasih juga kepada yang terhormat Sigit Prabowo, SPt MSc selaku dosen penguji ujian akhir.
Ungkapan terima kasih terdalam penulis sampaikan kepada kedua orang tua Anis Hamzah Alhiyed dan Sofiah Alatas, Kakak tercinta Fatimahtuzahro, Paman terbaik Kadzim Salim Alhiyed, serta seluruh keluarga atas doa, kasih sayang, dukungan serta motivasi yang selalu diberikan pada penulis. Semoga penulis dapat menjadi sumber kebahagiaan bagi kedua orang tua dan keluarga.
Penulis sampaikan terima kasih kepada Shelvi, SSi, Ferdy, SPt MSi, Wike Andre, SPt MSi, Komang Alit P, SPt MSi, Isyana, SPt, Furqon, SPt, Roaslein P, SPt, Pandu, SPt, Muhsinin, SPt, Ria Putri Rahmadani, SPt dan teman teman ABGSci atas segala dukungan dan kebersamaannya di Laboratorium Genetika Molekuler Ternak. Kepada yang terkhusus Aulia Rahmad Hasyim, Rindang, Ninin, Ulfa Dj, Mustika, Hadi, Mujo, Kak Riri, Maulita,Uswatun, Riskia, Feronika, Valen, Salva, Bibeh, Rani, Dwiki, Zuriyansyah, Tanto, Wafi, Yaher, Fandi, Anggita dan IPTP48, Rina, Mey, Anis, teman-teman Duta Promosi IPB terima kasih atas kebersamaan dan motivasi yang diberikan.Terimakasih juga kepada Direktorat Pendidikan Tinggi (DIKTI) atas beasiswa Bidik Misi yang telah diperoleh selama menjalankan pendidikan ini. Semoga hasil penelitian ini bermanfaat. Saya ucapkan terima kasih kepada semua pihak yang telah membantu, yang tidak dapat disebutkan satu persatu. Semoga karya ilmiah ini bermanfaat.
Bogor, Juni 2015
DAFTAR ISI
DAFTAR TABEL viii
DAFTAR GAMBAR viii
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan Penelitian ... 2
Ruang Lingkup Penelitian ... 2
METODE ... 2
Waktu dan Tempat Penelitian ... 2
Bahan ... 2
Alat 3
Prosedur ... 3
HASIL DAN PEMBAHASAN ... 4
Amplifikasi DNA ... 4
Keragaman Lokus Mikrosatelit ... 5
SIMPULAN DAN SARAN ... 9
Simpulan ... 9
Saran ... 10
DAFTAR PUSTAKA ... 10
LAMPIRAN ... 13
DAFTAR TABEL
1 Lokus dan susunan nukleotida 3
2 Frekuensi alel lokus SPS115 di Pulau Bali dan Nusa Penida 6 3 Frekuensi alel lokus ETH225 di Pulau Bali dan Nusa Penida 6 4 Frekuensi alel lokus INRA037 di Pulau Bali dan Nusa Penida 7 5 Nilai ho, he, dan PIC dari tiga lokus mikrosatelit 8 6 Jarak genetik dan identitas genetik sapi Bali 9
DAFTAR LAMPIRAN
1 Lokus berdasarkan Genebank 13
2 Hasil perhitungan AMOVA 17
3 Hasil fluoresen lokus SPS115 18
1
PENDAHULUAN
Latar Belakang
Sapi bali (Bos javanicus) sebagai ternak asli Indonesia hasil domestikasi banteng (Payne dan Rollison 1974) merupakan sumberdaya genetik ternak yang tidak ternilai harganya dan telah diakui oleh FAO sebagai salah satu bangsa sapi di dunia (DGLS 2003). Sapi bali memiliki beberapa keunggulan yaitu mampu beradaptasi terhadap lingkungan marjinal dan memiliki daya reproduksi yang tinggi terutama pada kondisi pakan yang buruk (Talib 2002).Distribusi sapi bali di Indonesia selain di Pulau Bali juga tersebar di beberapa daerah utama populasi sapi bali, yaitu Sulawesi Selatan, Nusa Tenggara Timur, dan Nusa Tenggara Barat (Purwantara et al. 2012). Diberbagai lingkungan pemeliharaan di Indonesia, sapi bali memperlihatkan kemampuannya untuk berkembang biak dengan baik yang disebabkan beberapa keunggulan yang dimiliki sapi Bali. Keunggulan sapi bali dibandingkan sapi lain yaitu memiliki daya adaptasi sangat tinggi terhadap lingkungan yang kurang baik (Masudana 1990), seperti dapat memanfaatkan pakan dengan kualitas rendah (Sastradipradja 1990), mempunyai fertilitas dan
conception rate yang sangat baik (Oka dan Darmadja 1996), persentase karkas yang tinggi yaitu 52 sampai 57.7% (Payne dan Rollinson 1973) dan tahan terhadap parasit internal dan eksternal (National Research Council 1983).
Program pelestarian dan pengembangan sapi bali di Pulau Bali dan salah satunya adalah kemungkinan rencana relokasi program pembibitan sapi bali ke daerah lain khususnya di luar Pulau Bali yaitu Pulau Nusa Penida. Program pelestarian dan pengembangan sapi bali dilaksanakan di Pulau Bali, namun terdapat kemungkinan untuk merelokasi program pembibitan ke luar Pulau Bali yaitu ke Pulau Nusa Penida. Pulau Nusa Penida memiliki populasi sapi bali yang cukup besar. Direktorat Jenderal Peternakan dan Kesehatan Hewan telah mencanangkan Program Pembibitan sapi bali di Pulau Nusa Penida dengan SK No.18020/kpts/PD.420/F2.3/02/2013.
2
Tujuan Penelitian
Tujuan dari penelitian ini adalah mempelajari keragaman genetik dari sapi Bali dengan ETH225, SPS115, dan INRA037 di Pulau Bali dan Pulau Nusa Penida dengan metode DNA Mikrosatelit berlabel.
Ruang Lingkup Penelitian
Identifikasi keragaman lokus SPS115, ETH225, dan INRA037 pada sapi bali yang terdapat di Pulau Bali dan Pulau Nusa Penida dengan menggunakan DNA Mikrosatelit berlabel.
METODE
Waktu dan Tempat Penelitian
Penelitian ini dilakukan di Laboratorium Genetika Molekuler Ternak, Bagian Pemuliaan dan Genetika, Departemen Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan, Institut Pertanian Bogor. Penelitian berlangsung dari bulan September sampai Maret 2015.
Bahan
Sampel Darah
Sampel darah yang digunakan berasal dari 48 sampel dari sapi bali di Pulau Bali dan 47 sampel dari sapi bali di Pulau Nusa Penida.
Ekstraksi DNA
Bahan-bahan yang digunakan untuk ekstraksi DNA terdiri atas larutan EtOH absolute 70%, DW (destilation water), SDS (sodium dodecylsulphate) 10%, proteinase-K (5 mg mL-1), 1×STE (sodium tris-EDTA), phenol solution, CIAA (chloroform isoamylalcohol), NaCl 5M, dan TE (tris EDTA) 80%.
Amplifikasi DNA Template dan Pemotongan Produk PCR
Bahan-bahan yang digunakan pada teknik amplifikasi yaitu sampel DNA, DW (destiltion water), Green MM (Master Mix) dan pasangan primer forward
3
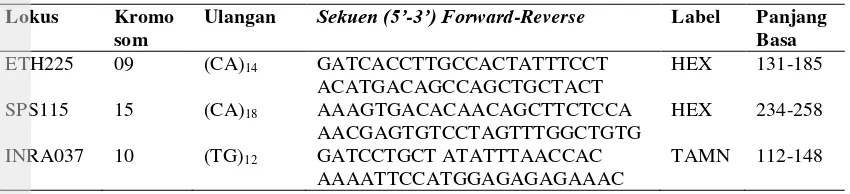
Tabel 1 Lokus dan susunan nukleotida Lokus Kromo
som
Ulangan Sekuen (5’-3’) Forward-Reverse Label Panjang Basa ETH225 09 (CA)14 GATCACCTTGCCACTATTTCCT
ACATGACAGCCAGCTGCTACT
HEX 131-185
SPS115 15 (CA)18 AAAGTGACACAACAGCTTCTCCA
AACGAGTGTCCTAGTTTGGCTGTG
HEX 234-258
INRA037 10 (TG)12 GATCCTGCT ATATTTAACCAC
AAAATTCCATGGAGAGAGAAAC
TAMN 112-148
Sumber : FAO (2011)
Alat
Alat yang dibutuhkan untuk pengambilan darah yaitu tabung ependorf 1.5 mL, syringe 3 mL dan spidol permanen. Alat yang dibutuhkan untuk ekstraksi DNA yaitu tabung ependorf 1.5 mL, 1 set pipet mikro beserta tipnya, vortex, centrifuge, inkubator dan freezer. Alat yang dibutuhkan untuk amplifikasi DNA yaitu 1 set pipet mikro beserta tipnya dan mesin PCR thermocycler.
Alat yang dibutuhkan untuk proses elektroforesis yaitu timbangan, pipet mikro beserta tipnya, gelas piala, microwave, hotplate, tray pencetak gel, dan tank elektroforesis (mupid) dilengkapi dengan power supply 100 V dan UV transilluminator.
Prosedur
Pengambilan Sampel
Sampel yang diambil merupakan sampel darah sapi bali. Pengambilan sampel darah sapi dilakukan pada bagian vena jugularis externa dengan menggunakan jarum dan ditampung pada tabung venoject yang mengandung EDTA. terbentuk dibuang. Endapan ditambahkan 40 μL SDS 10%, 10 μL proteinase-K (5 mgml-1) dan 1×STE sampai 400 μL, kemudian diinkubasi pada suhu 55 °C selama 2 jam sambil digoyang secara perlahan menggunakan tilter.
4
Amplifikasi DNA Mikrosatelit
Fragmen DNA diamplifikasi dengan teknik PCR. Sampel DNA hasil ekstraksi sebanyak 2 μL dimasukkan ke dalam tabung PCR, lalu ditambahkan 28 μL larutan premix. Premix tersusun atas 0.3 μL primer, 12.4 μL DW, 6 μL Green Master Mix. Campuran ini difortex lalu di sentrifugasi menggunakan spin down, kemudian diinkubasi dalam thermocycler untuk diamplifikasi. Denaturasi awal dilakukan pada suhu 95 °C selama 15 menit, selanjutnya denaturasi berlangsung selama 20 detik pada suhu yang sama.
Kondisi PCR yaitu meliputi pradenaturasi 95 °C 5 menit, dilanjutkan dengan langkah denaturasi pada 95 °C 10 detik, 20 detik annealing 58 oC , langkah elongasi pada suhu 72 oC selama 30 detik dan final elongasi pada suhu 72 oC selama 5 menit. Proses amplifikasi DNA ini dilakukan hingga 35 siklus.
Elektroforesis
Bahan-bahan yang digunakan dalam teknik elektroforesis terdiri atas
agarose, 0.5×TBE (tris borat-EDTA), etidium bromida (EtBr) 10%, loading dye, dan DNA marker. Elektroforesis DNA dilakukan dalam agarose gel 1%. Elektroforesis produk PCR dilakukan dalam agarose gel 1.5%. Produk restriksi dielektroforesis dalam agarose gel 2%.
Alat-alat yang digunakan yaitu timbangan analitik, microwave, magnetic vortex, tray pencetak gel, elektroforesis (MUPID), dan UV transilluminator. Setelah didapatkan produk hasil PCR kemudian dilakukan fragmentasi dengan cara sequents.
Genotiping
Produk PCR yang telah diperoleh dari ketiga lokus ( ETH225, SPS115 dan INRA037) yang telah dianalisis dilakukan teknik fragmentasi dengan menggunakan sekuen berlabel HEX untuk SPS115 dan ETH225 dan TAMN untuk lokus INRA037. Proses sekuensing dilakukan dikirimkan ke perusahaan 1st Base di Selangor Malaysia.
Analisis Data
Alel, jumlah alel (NA) dari berbagai lokus, pengamatan nilai heterosigositas (H0) dan heterosigositas yang diharapkan (He), jumlah alel efektif (NE) tiap lokus, jarak genetik dan analisis variasi molekuler menggunakan program GenAlEx 6.501 (Peakall et al. 2012).
HASIL DAN PEMBAHASAN
Amplifikasi DNA
5
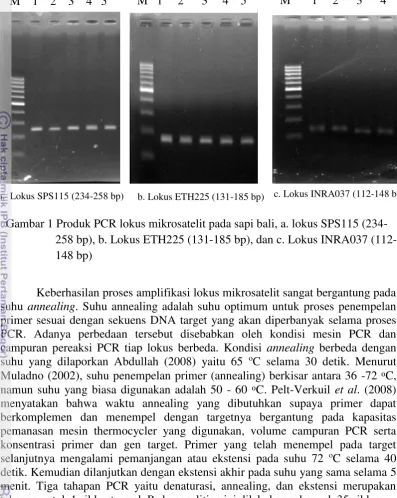
a. Lokus SPS115 (234-258 bp) b. Lokus ETH225 (131-185 bp) c. Lokus INRA037 (112-148 bp)
Keberhasilan proses amplifikasi lokus mikrosatelit sangat bergantung pada suhu annealing. Suhu annealing adalah suhu optimum untuk proses penempelan primer sesuai dengan sekuens DNA target yang akan diperbanyak selama proses PCR. Adanya perbedaan tersebut disebabkan oleh kondisi mesin PCR dan campuran pereaksi PCR tiap lokus berbeda. Kondisi annealing berbeda dengan suhu yang dilaporkan Abdullah (2008) yaitu 65 oC selama 30 detik. Menurut Muladno (2002), suhu penempelan primer (annealing) berkisar antara 36 -72 oC,
namun suhu yang biasa digunakan adalah 50 - 60 oC. Pelt-Verkuil et al. (2008)
menyatakan bahwa waktu annealing yang dibutuhkan supaya primer dapat berkomplemen dan menempel dengan targetnya bergantung pada kapasitas pemanasan mesin thermocycler yang digunakan, volume campuran PCR serta konsentrasi primer dan gen target. Primer yang telah menempel pada target selanjutnya mengalami pemanjangan atau ekstensi pada suhu 72 oC selama 40 detik. Kemudian dilanjutkan dengan ekstensi akhir pada suhu yang sama selama 5 menit. Tiga tahapan PCR yaitu denaturasi, annealing, dan ekstensi merupakan tahapan untuk 1 siklus termal. Pada penelitian ini dilakukan sebanyak 35 siklus.
Keragaman Lokus Mikrosatelit
Alel dan Lokus Polimorfik
Hasil analisis lokus SPS115, ETH225, dan INRA037 berdasarkan hasil genotiping dikelompokan berdasarkan populasi yaitu Pulau Bali dan Pulau Nusa Penida. Frekuensi alel setiap lokus dan setiap populasi sapi bali disajikan pada Tabel 2.
M 1 2 3 4 5 M 1 2 3 4 M 1 2 3 4 5
6
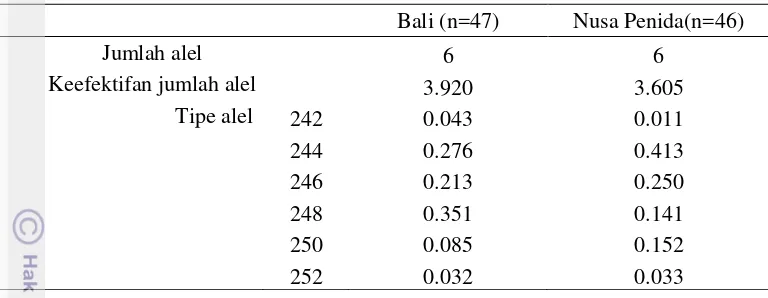
Tabel 2 Frekuensi alel lokus SPS115 di Pulau Bali dan Nusa Penida Bali (n=47) Nusa Penida(n=46)
Jumlah alel 6 6
Keefektifan jumlah alel 3.920 3.605
Tipe alel 242 0.043 0.011
Tabel 2 menunjukkan alel yang didapatkan di lokus SPS115 baik di Pulau Bali maupun Pulau Nusa Penida. Jumlah alel sapi bali pada lokus SPS115 di Pulau Bali dan Pulau Nusa Penida berjumlah sama yaitu 6. Hasil penelitian Soldatovic et al. (1994) dan Vucinic (1996) pada sapi Yuglosovia di Serbia menunjukkan bahwa lokus SPS115 memiliki jumlah alel yang sama. Namun pada penelitian Radko et al. ( 2009) jumlah alel pada sapi Polish Merah-Putih pada lokus SPS115 adalah 5 dan lokus SPS115 merupakan lokus yang rendah polimorfiknya. Nomer efektif alel di populasi Pulau Bali lebih tinggi (3.920) dibandingkan dengan di Nusa Penida (3.605). Tabel 2 menunjukkan bahwa lokus SPS115 memiliki frekuensi alel tertinggi pada tipe alel 244 di Pulau Nusa Penida. Adapun frekuensi alel dari lokus ETH225 disajikan pada Tabel 3.
Tabel 3 Frekuensi alel lokus ETH225 di pulau Bali dan Nusa Penida
Alel Bali (n=46) Nusa Penida (n=47)
jumlah alel 7 6
Keektifan jumlah alel 3.201 3.938
Tipe alel 149 0.011 0.011
7
populasi Pulau Nusa Penida. Frekuensi alel pada lokus INRA037 disajikan pada Tabel 4
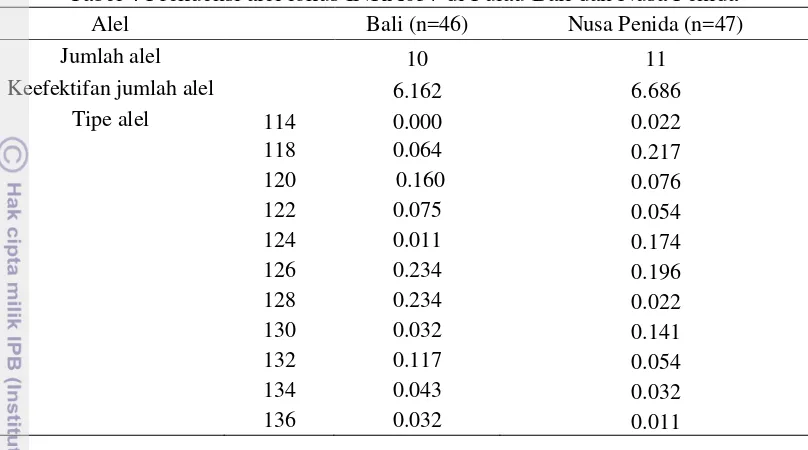
Tabel 4 Frekuensi alel lokus INRA037 di Pulau Bali dan Nusa Penida
Alel Bali (n=46) Nusa Penida (n=47)
Jumlah alel 10 11
Keefektifan jumlah alel 6.162 6.686
Tipe alel 114 0.000 0.022 sapi Creolo Uruguay menyatakan bahwa lokus INRA037 merupakan lokus yang paling polimorfik pada mikrosatelit dengan jumlah sepuluh alel. Lokus INRA037 memiliki frekuensi alel tertinggi pada tipe alel 126 dan 128 yaitu 0.234. Tipe alel 114 tidak ditemukan di pulau Bali namun ditemukan di pulau Nusa Penida. Adanya alel spesifik tersebut bisa menjadi alel penciri untuk sapi Bali yang terdapat di pulau Nusa Penida. Nomer keefektifan alel pada lokus INRA037 yang tertinggi terdapat di populasi pulau Nusa Penida.
Pengukuran keragaman genetik sampel sapi bali dengan menggunakan 3 lokus mikrosatelit, menunjukkan lokus yang digunakan pada sapi bali di Pulau Bali dan Pulau Nusa Penida adalah polimorfik. Nei (1987) menyatakan bahwa suatu alel dikatakan polimorfik jika memiliki frekuensi alel sama dengan atau kurang dari 0.99. Keragaman genetik atau polimorfisme genetik adalah terdapatnya lebih dari 1 bentuk atau macam genotipe di dalam populasi.
Fenomena jumlah alel yang tinggi pada sapi bali karena variasi genetik sapi bali pada lokus-lokus mikrosatelit tersebut sangat beragam. Keragaman mikrosatelit disebabkan karena adanya variasi dalam jumlah pengulangan runutan basa. Perbedaan yang muncul dianggap sebagai alel yang berbeda. Perbedaan alel yang dihasilkan disebabkan perbedaan jumlah pengulangan basa (Bennet 2000).
8
dibandingkan dengan motif tetra-nukleotida. Variasi lokus penting untuk memberikan gambaran mengenai keragaman genetik pada suatu populasi. Menurut Lan et al.(2013) lokus mikrosatelite yang memiliki jumlah alel lebih dari 4, maka sangat efektif untuk digunakan sebagai evaluasi keragaman genetik.
Nilai Heterosigositas
Lokus SPS115, ETH225, dan INRA037 memiliki keragaman yang tiggi berdasarkan nilai heterozigositasnya. Tabel 5 menyajikan hasil nilai heterosigositas.
Tabel 5 Nilai Ho, He dan PIC dari 3 lokus mikrosatelit
Populasi Lokus N Ho He PIC
Marson et al. (2005) menyatakan bahwa keragaman genetik suatu populasi dapat diukur menggunakan nilai heterosigositas yang bertujuan untuk membantu program seleksi. Tabel 3 menunjukkan bahwa nilai heterosigositas pengamatan (Ho) sapi bali di Pulau Bali cukup tinggi yaitu 0.745, 0.753 dan 0.553. Sapi bali di Pulau Nusa Penida memiliki nilai Ho yang tidak terlalu berbeda jika dibandingkan dengan Ho di Pulau Bali. Namun kedua wilayah tersebut memiliki nilai heterosigositas yang cukup tinggi, menurut Javanmard et al. (2005) bahwa nilai heterosigositas di bawah 0.5 (50%) mengindikasikan rendahnya variasi suatu gen dalam populasi. Tombasco et al. (2003) menyatakan bahwa jika nilai Ho (heterosigositas pengamatan) lebih rendah dari He (heterosigositas harapan) maka dapat mengindikasikan adanya proses seleksi yang intensif. Hal ini terlihat dari Tabel 3 sapi bali yang terdapat di Pulau Bali dan Nusa Penida pada lokus SPS115 dan INRA037 nilai Ho lebih rendah dari He. Menurut Tambasco et al. (2003) perbedaan antara nilai heterosigositas pengamatan (Ho) dan nilai heterosigositas harapan (He) dapat dijadikan sebagai indikator adanya ketidakseimbangan genotipe pada populasi sapi yang diamati yang diindikasikan bahwa sudah ada kegiatan seleksi yang dilakukan dan tidak adanya perkawinan acak. Allendorf et al. (2013) menyatakan bahwa suatu populasi dinyatakan berada dalam keseimbangan jika frekuensi genotipe dan frekuensi alelnya konstan dari generasi ke generasi yang diakibatkan oleh penggabungan gamet yang terjadi secara acak dalam populasi yang besar. Keseimbangan gen dalam populasi terjadi jika tidak adanya mutasi, seleksi, migrasi, dan genetic drift.
Lokus ETH225 di Pulau Bali merupkan lokus yang memiliki nilai Ho yang tinggi, namun nilai He yang tinggi ditunjukkan pada lokus INRA037 di Nusa Penida. Heterosigositas yang tinggi dalam suatu populasi menunjukkan bahwa sapi ini mengandung alel-alel sapi lain atau alel mutasi dengan frekuensi rendah Keterangan: N: jumlah sampel; Ho: heterozigositas observasi; He: heterozigositas harapan; PIC:
9
(Abdullah 2008). Nilai PIC yang tertinggi terdapat pada lokus INRA037 di Pulau Bali. Nilai PIC yang tinggi menggambarkan tingkat informasi penciri atau lokus yang digunakan sangat informatif sebagai penciri (marker).
Jarak Genetik dan Keragaan Sapi Bali
Hasil perhitungan nilai jarak genetik pada sapi bali di Pulau Bali dan Pulau Nusa Penida terdapat pada Tabel 6.
Tabel 6 Jarak genetik dan identitas genetik sapi bali Wilayah Jarak genetik Kesamaan genetik Fit
Bali – Nusa Penida 0.111 0.895 0.141
Keterangan : Fit: laju inbreeding total
Matriks jarak genetik Pairwise, menunjukkan bahwa sapi bali di Pulau Bali memiliki tingkat perbedaan sebesar 11.1%. Hal ini berarti sapi bali yang terdapat di Pulau Bali dengan Pulau Nusa Penida memiliki kesamaan. Kesamaan antara sapi bali di Pulau Bali dan Nusa Penida sebesar 89.5%. Penelitian ini memberi gambaran bahwa sapi bali yang terdapat di Pulau Bali dan Nusa Penida mengandung materi gentik yang hampir sama.
Hasil AMOVA menunjukkan bahwa keragaan pada 3 lokus yang digunakan untuk sapi Bali yang terdapat di pulau Bali dan Nusa Penida berbeda nyata dengan taraf perbedaan 3%. Hal ini menunjukkan bahwa sapi bali yang terdapat di Pulau Bali dan Pulau Nusa Penida berbeda.
Hasil aanlisis tiga lokus mikrosatelit yang digunakan menunjukkan nilai laju inbreeding total (Fit) (0.141) pada kedua populasi sapi bali. Laju Inbreeding yang tinggi akan cenderung menghilangkan variasi genetik. Hal ini tidak diharapkan, jika variasi genetik yang hilang tersebut adalah variasi genetik yang menguntungkan.
Sapi bali masih terus dikembangkan dan ditingkatkan produktivitasnya, baik yang ada di Pulau Bali maupun di luar daerah yang diketahui sebagai daerah tempat pengembangan sapi bali. Sapi bali yang terdapat di daratan Nusa Penida ditetapkan sebagai wilayah pembibitan dan pemurnian sapi bali. Rendahnya nilai keragaman dalam populasi juga bisa disebabkan oleh penggunaan jumlah lokus yang terbatas. Jumlah lokus yang digunakan dalam penelitian ini adalah 3 lokus. Menurut FAO (2011) jumlah lokus yang sebaiknya digunakan untuk mengidentifikasi keragaman genetik pada sapi adalah 30 lokus mikrosatelit.
SIMPULAN DAN SARAN
Simpulan
10
Saran
Sebaiknya perlu dilakukan penelitian mengenai keragaman DNA mikrosatelit pada wilayah pengembangan sapi bali di Indonesia dengan menambahkan jumlah lokus yang digunakan. Selain itu pengaturan pola perkawinan harus disesuaikan dengan target pemuliaan yang ingin dicapai. Penggunaan jantan untuk kawin juga harus diatur dengan baik.
DAFTAR PUSTAKA
Abdullah MAN. 2008. Karakterisasi genetik sapi aceh menggunakan analisis keragaman fenotipik, daerah D-Loop DNA mitokondria dan DNA mikrosatelit [disertasi]. Bogor (ID):Institut Pertanian Bogor.
Allendorf FW, Luikart G, Aitken SN. 2013. Conservation and The Genetics of Populations. 2th ed. UK (GB): Wiley-Blackwel.
Amstrong E, Postiglioni1 A, Martínez A, Rincón1 G and Vega-Pla J L. 2006. Microsatellite analysis of a sample of Uruguayan Creole bulls (Bos taurus). J Genet Mol Biol. 29(2):267-272.
Arora R, Bhatia S, Jain A 2010. Morphological and genetic characterization of Ganjam sheep. J Anim. Genet. Resour. 46:1- 9.
Bennet P. 2000. Microsatellites. J Clin Pathol Mol. Pathol 53:177-183.
[DGLS] Directorate Generale of Livestock Services. 2003. National report on animal genetic resources in Indonesia. Directorate Generale of Livestock Services, Directorate of Livestock Breeding (ID).
[Ditjennak] Direktorat Jenderal Peternakan. 2002. Buku Statistik Peternakan Tahun 2002. Direktorat Jenderal Bina Produksi Peternakan. Jakarta (ID). Departemen Pertanian.
[FAO] Food and Agriculture Organization of the United Nations. 2011. Moleculer Genetic Characterization of Animal Genetic Resource. ISAG-FAO recommended microsatelite markers. Hal 68-69.
Javanmard A, Asadazadeh N, Banabazi MH, Tavakolian J. 2005. The allele and genotype frequencies of bovine pituitary specific transcription factor and leptin genes in Iranian cattle and buffalo populations using PCR-RFLP. J Iranian Biotechnol. 3: 104-108.
Lan DP, Duy ND, Nguyen TB, Le QN, Nguyen VB, Tran TT, Tran XH, Vu CC, Haja N, Kadarmideen. 2003. Assessment of genetic diversity and structure of Vietnam indigineus cattle population by microsatellite. J Lives Sci. 155:17-22.
Marson EP, Ferraz JBS, Meirelles FV, Balieiro JCC, Eler JP, Figuerido LGG, Mourao GB. 2005. Genetic characterization of European-Zebu composite bovine using RFLP markers. J Genet Mol Res. 4: 496-505.
Masudana I W. 1990. Perkembangan sapi Bali di Bali dalam sepuluh tahun terakhir (1980- 1990). Proceeding Seminar Nasional Sapi Bali. Denpasar, 20-22 September 1990. Denpasar (ID) : Fakultas Peternakan Universitas Udayana. Hlm A-11-A-30.
11
Muladno. 2006. Aplikasi teknologi molekuler dalam upaya peningkatan produktivitas hewan. Pelatihan Teknik Diagnostik Molekuler untuk Peningkatan Produksi Peternakan dan Perikanan di Kawasan Timur Indonesia. Kerjasama Pusat Studi Ilmu Hayati, Lembaga Penelitian dan Pemberdayaan Masyarakat Institut Pertanian Bogor dan Direktorat Jenderal Pendidikan Tinggi Depdiknas, Bogor (ID).
Muladno. 2010. Teknologi Rekayasa Genetika. Ed Ke-2. Bogor (ID): IPB Pr. [NRC] National Research Council. 1983. Little-Known Asian Animals with a
Promising Economic Future. Washington, D.C (US): National Academic Press.
Nei M, Kumar S. 2000. Molecular Evolution and Phylogenetics. New York (US): Oxford University Pr.
Nei M. 1987. Molecular Evolutionary Genetics. New York (US): Columbia University Pr.
Oka IGL, Darmadja D. 1996. History and development of Bali Cattle. Proceeding seminar on Bali Cattle, a special spesies for the dry tropics, held by Indonesia Australia Eastern University Project (IAEUP), 21 September 1996. Bukit Jimbaran, Bali (ID) : Udayana University Lodge
Payne W J A, Rollinson DHL. 1973. Bali cattle. J World Anim. Rev. 7: 13-21. Peakall R, Smouse O. 2012. GenAlEx 6.5: Genetic analysis in Excel. Population
genetic software for teaching and research – an update. J Bioinformatics. 28: 1-3.
Pelt-Verkuil, van E, Belkum van A, Hays JP. 2008. Principles and Technical Aspects of PCR Amplification. Netherlands (NL): Springer.
Purwantara B, Noor RR, Anderson G, Rodriguez-Martinez H. 2012. Banteng and Bali cattle in Indonesia: status and forecasts. Reprod Dom Anim. 47(1):2-6. doi: 10.1111/j.1439-0531.2011.01956.x.
Radko A, Rychlik T. 2009. Use of blood group tests and microsatellite DNA markers for parentage verification in a population of Polish Red-and-White cattle. J Anim Sci. 9(2):119–125.
Sambrook J, Fritsch EF, Medrano JF. 1989. Molecular Cloning: a Laboratory Manual. 2th ed. New York (US): Cold Spring Harbor Laboratory Pr. Sastradipradja, D. 1990. Potensi internal sapi Bali sebagai salah satu sumber
plasma nutfah untuk menunjang pembangunan peternakan sapi potong dan ternak kerja secara nasional. Procceding Seminar Nasional Sapi Bali. Denpasar, 20-22 September 1990. Denpasar (ID) : Fakultas Peternakan Universitas Udayana. Hal A-47–A54.
Soldatovic B, Stanimirovic Z, Vucinic M, Djokic D, Vucicevic M. 1994: Robertsonian fusion in a Simmental cow-bull mother (part II). J Acta Veterinaria. 44:(173–178).
Talib C. 2002. Sapi Bali di daerah sumber bibit dan peluang pengembangannya. Wartazoa 12(3):100-107.
12
Vucinic M, Soldatovic B, Stanimirovic Z. 1996. Robertsonian translocation T1/29 in the bovine karyotype. Strategia and Faculty of Veterinary Medicine
University of Belgrade, Belgrade, Serbia, 1–163. (in Serbian).
Weber J L. 1990, Informativeness of Human (dCdA) n.(dG-dT)n polymorphisms.
13
Mammalia; Eutheria; Laurasiatheria; Cetartiodactyla; Ruminantia;
Pecora; Bovidae; Bovinae; Bos.
REFERENCE 1 (bases 1 to 189)
AUTHORS Steffen,P., Eggen,A., Dietz,A.B., Womack,J.E., Stranzinger,G. and
Fries,R.
TITLE Isolation and mapping of polymorphic microsatellites in
cattle
JOURNAL Unpublished
REFERENCE 2 (bases 1 to 189)
AUTHORS Fries,R.
TITLE Direct Submission
JOURNAL Submitted (09-JUL-1992) Ruedi Fries, Animal Science, Swiss
14
ORIGIN
1 gatcaccttg ccactatttc ctccaacata tgtgtgtgcg tgcacacaca cacacacaca
61 cacacacaca cacacacatg atagccactc ctttctctaa tgccacagaa ttacacagtc
121 aactctctag tagcagctgg ctgtcatgtg tcatttggca atatccatat cttcccccct
181 Tgctgtaaa
B.taurus microsatellite sequence INRA037
GenBank: X71551.1
LOCUS X71551 164 bp DNA linear MAM 23-OCT-2008
DEFINITION B.taurus microsatellite sequence INRA037.
ACCESSION X71551
AUTHORS Vaiman,D., Mercier,D., Moazami-Goudarzi,K., Eggen,A.,
Ciampolini,R., Lepingle,A., Velmala,R., Kaukinen,J.,
Varvio,S.L., Martin,P. et al.
TITLE A set of 99 cattle microsatellites: characterization, synteny
mapping, and polymorphism
JOURNAL Submitted (20-APR-1993) D. Vaiman, Laboratoire de Gloique
Biochimique, INRA-CRJ Domaine de Vilvert, 78352
15
/standard_name="microsatellite INRA037"
ORIGIN
1 gatcctgctt atatttaacc accatgtatg tgtgtgtgtg tgtgtgtgtg tgcatgcatg
61 acgctcagtc tggattgtag cctccaagtt tctctctcca tggaattttc caggcaagaa
121 tcctggagtg ggttgttgtt tccttctcca ggggatcctc taga
Bos taurus isolate SC06 microsatellite SPS115 sequence
GenBank: FJ828564.1
FASTA Graphics PopSet
Go to:
LOCUS FJ828564 255 bp DNA linear MAM
07-FEB-2011
DEFINITION Bos taurus isolate SC06 microsatellite SPS115 sequence.
ACCESSION FJ828564
VERSION FJ828564.1 GI:226433860
KEYWORDS .
TITLE Species specific alleles at three microsatellite loci in yak
and
JOURNAL Submitted (15-MAR-2009) CAAS-ILRI Joint Laboratory on
16
source 1..255
/organism="Bos taurus"
/mol_type="genomic DNA"
/isolate="SC06"
/db_xref="taxon:9913"
/clone="1"
/country="China: Tibet, Sibu"
repeat_region 1..255
/rpt_type=tandem
/rpt_unit_range=41..76
/rpt_unit_seq="ca"
/satellite="microsatellite:SPS115"
ORIGIN
1 aaagtgacac aacagcttct ccagagcatc tccaatatct cacacacaca cacacacaca
61 cacacacaca cacacataca cacacacaca tctcattcct ctagtgtctt ttgcctttaa
121 agaaaaaaaa aactaagcag atcaacatgg gatctccttt ttgtagattt atagaaaggg
181 ttcctttgtt gcgcactcac ttgtaagaaa atgagacaaa aacgtgaaac ccacagccaa
241 actaggacac tcgtt
17
Lampiran 2 Hasil perhitungan AMOVA
Data Sheet 1 sampel sapi bali1.
Data Title data mikrosatelite sapi bali nawal
Jumlah sampel 95
Jumlah Populasi 2 Jumlah region 1
No. Permutations 999
No. PW Pop
Permutations 999
Hasil Tabel AMOVA
Sumber
Derajat Bebas
Jumlah Kuadrat
Kuadrat Tengah
Estimasi
Keragaman %
Diantara Populasi 1 6.749 6.749 0.084 3% Dalam Populasi 93 258.387 2.778 2.778 97%
Total 94 265.137 2.862 100%
Stat Value P(rand >= data)
PhiPT 0.029 0.003
Among Pops 3%
Within Pops 97%
18
Lampiran 3 Hasil flouresen
19
RIWAYAT HIDUP
Penulis lahir di Cirebon pada tanggal 20 April 1993. Penulis adalah anak dari pasangan Anis Hamzah Alhiyed dan Sofiah Alatas. Penulis merupakan anak kedua dari 2 bersaudara yaitu Fatimmah Tuzahro. Penulis mengawali pendidikan sekolah dasar pada tahun 1999 di SD Negeri Lawu Asih dan menyelesaikan sekolahnya pada tahun 2005. Selanjutnya penulis melanjutkan pendidkan ke tingkat pertama pada tahun 2005 di SMPN 2 Cirebon dan selesai pada tahun 2008. Penulis melanjutkan pendidikan di SMA Muhammadiyah Cirebon dari tahun 2008 hingga 2011.
Penulis diterima di Institut Pertanian Bogor pada tahun 2011 melalui jalur SNMPTN Tulis dan diterima di Departemen Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan. Selama menjadi mahasiswa, Penulis mendapatkan Beasiswa Bidik Misi dari DIKTI. Selama menjadi mahasiswa penulis aktif di berbagai organisasi mahasiswa, sebagai Bendahara di Keluarga Allawiyin IPB 2011-2013. Sebagai pengurus Divisi Eksternal 2012-2013 dan Ketua Divisi Internal 2013-2014 di Himpunan Mahasiswa Peternakan (HIMAPROTER), sebagai Ketua Divisi Internal KSPR 2013-2014, sebagai pengurus divisi Budaya, Olahraga dan Seni di Ikatan Kekeluargaan Cirebon (IKC), sebagai Ketua Teater Kandang Fapet 2013-2014. Penullis juga menjadi juara 1 baca puisi di Cowboy Show Time 2015. Penulis juga menjadi juara 1 tahun 2014 dan juara 2 tahun 2015 lomba lari estafet Dekan Cup. Penulis juga pernah mengikuti Program Kreativitas Mahasiswa tahun 2013 Bidang Karsa Cipta yang didanai DIKTI yang berjudul Sistem Informasi dan Manajemen Cattle