AKTIVITAS ANTIOKSIDAN, KADAR FENOLIK, DAN
FLAVONOID TOTAL TUMBUHAN SURUHAN
(
Peperomia pellucida
L. Kunth)
ELSHA UKIEYANNA
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
ELSHA UKIEYANNA. Aktivitas Antioksidan, Kadar Fenolik, dan Flavonoid
Total Tumbuhan Suruhan (Peperomia pellucida L. Kunth). Dibimbing oleh Dr.
Suryani, MSc dan Dr. Anna P Roswiem, MS.
Suruhan (Peperomia pellucida
L. Kunth) merupakan tumbuhan semak yang
tersebar luas di seluruh wilayah Indonesia dan memiliki khasiat untuk meredakan
nyeri rematik, sebagai antikanker, dan antibakteri. Penelitian ini bertujuan untuk
menguji aktivitas ekstrak herba suruhan sebagai antioksidan alami dan mengukur
kadar fenolik dan flavonoid total dalam suruhan. Sampel yang digunakan berupa
ekstrak etanol 70% dan ekstrak air dari herba suruhan. Ekstrak didapat dengan
metode maserasi dan dilakukan uji antioksidan dengan metode DPPH kemudian
dilakukan uji kandungan fenolik dan flavonoid total ekstrak serta dianalisis
korelasi kedua senyawa ini terhadap aktivitas antioksidannya. Rendemen yang
dihasilkan oleh ekstrak etanol 70% sebesar 20.43 ± 3.33% sedangkan rendemen
ekstrak air sebesar 10.03 ± 2.85%. Kedua ekstrak menunjukkan aktivitas
antioksidan dalam penangkapan radikal bebas DPPH. Nilai IC
50ekstrak air
sebesar 256.67 ± 21.65 ppm yang diikuti oleh ekstrak etanol sebesar 297.79 ±
17.75 ppm. Kandungan fenolik ekstrak air sebesar 755.79 ± 65.87 mg TAE/g dan
ekstrak etanol sebesar 622.46 ± 179.43 mg TAE/g. Kandungan flavonoid total
ekstrak etanol sebesar 4.058 ± 0.352 mg QE/g dan ekstrak air sebesar 0.67 ±
0.352 mg QE/g. Kandungan total fenol berkorelasi linier dengan aktivitas
antioksidan tetapi aktivitas antioksidan tidak memiliki korelasi dengan flavonoid.
ABSTRACT
ELSHA UKIEYANNA
.
Antioxidant Activity, Phenol, and Flavonoid Content of
Suruhan (Peperomia pellucida L. Kunth). Under direction of Dr. Suryani, MSc
and Dr. Anna P Roswiem, MS.
Suruhan (Peperomia pellucida L.Kunth) is the bush had widespread in Indonesia
and has efficacy as arthritis pain relief, anticancer, and antibacterial. The aim of
this study was testing the activity of
suruhan’s herb
extracts as natural
antioxidants and measured the total phenolic and flavonoid content in suruhan.
The sample used in the form of 70% ethanol extract and aqueous extract of the
suruhan. The extract obtained by maceration method and tested antioxidants with
DPPH method and then tested the content of total phenolic and flavonoid extracts
and analyzed the correlation of these compounds to antioxidant activity. The yield
of 70% ethanol extract was 20.43 ± 3.33% whereas the yield of aqueous extract
was 10.03 ± 2.85%. Both of extract has produced the antioxidant activity of free
radical DPPH capture. IC
50values of aqueous extract of 256.67 ± 21.65 ppm,
followed by ethanol extract of 297.79 ± 17.75 ppm. Total phenolic content of
aqueous extract was 755.79 ± 65.87 mgTAE/g and ethanol extract was 622.46 ±
179.43 mg TAE/g. Total flavonoid content of ethanol extract was 4.058 ± 0.352
mg QE/g and aqueous extract was 0.67 ± 0.352 mg QE/g extract for aqueous. The
phenol content have linier correlation with their antioxidant activity but the
flavonoid content didn’t have correlation with antioxidant activity.
AKTIVITAS ANTIOKSIDAN, KADAR FENOLIK, DAN
FLAVONOID TOTAL TUMBUHAN SURUHAN
(
Peperomia pellucida
L. Kunth)
ELSHA UKIEYANNA
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biokimia
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul Skrips : Aktivitas Antioksidan, Kadar Fenolik, dan Flavonoid Tumbuhan
Suruhan (Peperomia pellucida L. Kunth)
Nama
: Elsha Ukieyanna
NIM
: G84080053
Disetujui
Komisi Pembimbing
Dr. Suryani, MSc
Dr. Anna P Roswiem, MS
Ketua
Anggota
Diketahui
Dr. Ir. I Made Artika M. App. Sc
Ketua Departemen Biokimia
PRAKATA
Puji syukur penulis ucapkan kepada Allah SWT dengan rahmat dan
karunia-Nya skripsi dengan judul Aktivitas Antioksidan, Kadar Fenolik, dan Flavonoid
Tumbuhan Suruhan (Peperomia pellucida
L. Kunth) dapat diselesaikan. Skripsi
ini disusun berdasarkan penelitian yang dilaksanakan dari bulan Februari 2012
sampai Juli 2012 di Laboratorium Pusat Studi Biofarmaka IPB.
Ucapan terima kasih yang tak terhingga penulis sampaikan kepada
pihak-pihak yang telah membantu penyusunan skripsi ini, khususnya kepada Dr. Suryani
dan Dr. Anna P Roswiem yang telah membimbing, memberi pengarahan, dan
dorongan dalam rangka penyelesaian laporan penelitian ini. Selain itu penulis
mengucapkan terima kasih kepada Bapak Waras Nurcholis yang telah
memberikan pendapat dan sarannya serta teman-teman civitas Biokimia IPB,
Nursofiana, Dewi Eriyanti, Wulan Widianti, Khairunnisa, Leli Dwinovita, Setyo,
Maritrana, dan Fitriani Fauziah. Secara khusus penulis menyampaikan terima
kasih sedalam-dalamnya kepada keluarga tercinta, Ayahanda Marzuki dan Ibunda
Yuliar serta Bella dan Andre yang telah memberikan dorongan dan doanya.
Semoga penelitian ini dapat bermanfaat untuk menambah pengetahuan
dalam hal yang terkait dengan potensi tumbuh-tumbuhan sebagai antioksidan dan
juga dapat dijadikan bahan rujukan dalam penelitian selanjutnya. Terima kasih.
Bogor, 15 Juni 2012
RIWAYAT HIDUP
Penulis dilahirkan di Pekanbaru pada tanggal 15 September 1990 dari
Bapak Marzuki Mahadan dan Ibu Yuliar. Penulis merupakan anak pertama dari
tiga bersaudara. Penulis menyelesaikan studi di SMU Negeri 3 Pekanbaru pada
tahun ajaran 2008. Pada tahun yang sama penulis diterima di Institut Pertanian
Bogor (IPB) pada Program Studi Biokimia FMIPA melalui jalur Undangan
Seleksi Masuk IPB (USMI).
DAFTAR ISI
Halaman
DAFTAR GAMBAR...
vi
DAFTAR TABEL... ....
vi
DAFTAR LAMPIRAN ...
vi
PENDAHULUAN ...
1
TINJAUAN PUSTAKA ... 1
Tumbuhan Suruhan ...
1
Ekstraksi ...
2
Fenolik dan Flavonoid ...
3
Antioksidan ...
4
Uji Aktivitas Penangkap Radikal Bebas ...
4
BAHAN DAN METODE ...
5
Bahan dan Alat ...
5
Metode Penelitian...
5
HASIL DAN PEMBAHASAN ... 6
Ekstrak Suruhan ...
6
Aktivitas Antioksidan Suruhan ...
7
Kadar Fenolik Total dan Flavonoid Total ...
9
SIMPULAN DAN SARAN ...
11
DAFTAR PUSTAKA ...
11
DAFTAR GAMBAR
Halaman
1
Tumbuhan suruhan (Peperomia pellucida L. Kunth) ...
2
2
Kerangka dasar flavonoid ...
3
3
Reaksi DPPH dengan antioksidan ...
4
4
Rendemen ekstrak air dan etanol herba suruhan ...
6
5
Kadar fenolik total ekstrak suruhan ...
9
6
Kadar flavonoid total ekstrak suruhan ...
10
DAFTAR TABEL
Halaman
1
Nilai % inhibisi dan IC
50aktivitas antioksidan ekstrak suruhan ...
7
2
Inhibisi ekstrak air dan etanol herba suruhan berdasarkan analisis
Duncan ...
8
3
Korelasi aktivitas antioksidan dengan kadarvfenolik atau flavonoid
total ...
10
DAFTAR LAMPIRAN
Halaman
1
Diagram alir penelitian...
15
2
Ekstraksi air suruhan ...
16
3
Ekstraksi etanol suruhan ...
17
4
Uji aktifitas antioksidan dengan metode DPPH ...
18
5
Kadar air suruhan, rendemen ekstrak, dan analisis ragam ekstrak ...
19
6
Perhitungan inhibisi dan IC
50ekstrak suruhan ...
20
7
Analisis ragam persentase inhibisi ekstrak dan uji lanjut Duncan ...
24
8
Uji kadar fenolik total suruhan (Peperomia pellucida L. Kunth) ...
25
9
Uji kadar flavonoid total suruhan (Peperomia pellucida L. Kunth) ...
28
PENDAHULUAN
Metabolisme yang terjadi di dalam tubuh melibatkan proses oksidasi dan reduksi. Proses oksidasi dapat menyebabkan terbentuknya suatu oksidan atau radikal bebas yang berbahaya bagi tubuh (Halliwel
et al. 1995). Oksidan merupakan molekul yang tidak stabil karena memiliki elektron yang tidak berpasangan sehingga molekul ini dapat menyerang makromolekul sel seperti lipid, protein, atau DNA. Makromolekul yang terserang oleh oksidan dapat mengalami kondisi oksidasi yang menyebabkan terjadinya kerusakan protein, DNA, penuaan dini, kanker, serangan jantung, dan penyakit degeneratif lainnya (Middleton et al. 1998). Oleh karena itu oksidan ini perlu dihambat dengan senyawa antioksidan.
Antioksidan merupakan senyawa kimia yang menyumbangkan elektron yang dikandungnya kepada radikal bebas (Suhartono 2002). Secara alami tubuh dapat menghasilkan senyawa antioksidan yang terdiri dari antioksidan enzimatik dan non enzimatik. Namun, senyawa antioksidan ini tidak mampu menghambat oksidan yang terbentuk akibat stress oksidatif sehingga diperlukan antioksidan yang berasal dari luar tubuh (eksogen) (Halliwel et al. 1995).
Antioksidan eksogen dapat diperoleh dalam bentuk sintetik (buatan) atau secara alami. Antioksidan buatan seperti asam benzoat, BHA (Butylated Hydroxy Anisol), BHT (Butylated Hydroxy Toluene) atau TBHQ (Tertier Butylated Hydroxy Quinone) dapat menimbulkan efek samping pada kesehatan tubuh. BHA dan BHT telah diteliti dapat menimbulkan tumor pada hewan coba jika digunakan dalam jangka waktu yang lama dan juga dapat menimbulkan kerusakan hati jika dikonsumsi secara berlebihan (Andarwulan
et al. 1996). Efek samping yang ditimbulkan oleh penggunaan antioksidan sintetik mendorong perkembangan penelitian terhadap antioksidan alami yang lebih aman dan lebih mampu dalam mengurangi radikal bebas dalam tubuh.
Antioksidan alami dapat diperoleh dari tumbuh-tumbuhan atau buah-buahan. Indonesia merupakan salah satu negara yang memiliki populasi flora yang luas dan paling banyak di dunia. Tumbuh-tumbuhan mengandung senyawa metabolit sekunder berupa flavonoid dan fenolik yang berguna sebagai penangkap radikal bebas (Cos et al.
2001). Duenas et al. (2009) menyatakan bahwa senyawa ksanton serta turunan flavonoid (kuersetin dan katekin) yang dihasilkan oleh tumbuhan memiliki kemampuan menghambat kerja radikal bebas.
Salah satu tumbuhan yang mengandung senyawa metabolit flavonoid dan fenolik adalah tumbuhan suruhan. Suruhan atau
Peperomia pellucida L. Kunth merupakan tumbuhan semak yang dapat hidup pada daerah tropis dan lembab. Suruhan tersebar luas di setiap daerah di Indonesia. Suruhan dapat dikonsumsi sebagai lalapan. Secara empiris tumbuhan ini telah digunakan dalam pengobatan demam, penyakit perut, atau pengobatan luar lainnya (Heyne 1987). Menurut Cao (2011), suruhan berkhasiat untuk mengatasi nyeri pada rematik, penyakit asam urat, sakit kepala, sakit perut, abses, bisul, jerawat, radang kulit, luka memar, dan luka bakar ringan. Berdasarkan uji fitokimia yang telah dilakukan dalam beberapa studi menunjukkan bahwa tumbuhan suruhan mengandung senyawa flavonoid dan polifenol. Kedua senyawa yang dikandung suruhan ini telah digunakan dalam kemoterapi antikanker. Kanker dapat terjadi akibat adanya radikal bebas yang merusak sel pada jaringan tertentu (Gianello
et al. 2009).
Adanya penelitian Gianello et al. (2009) tentang aktivitas antikanker dari suruhan dapat diduga suruhan juga mampu dalam menangkap radikal bebas sehingga dapat dijadikan sebagai salah satu sumber antioksidan alami. Penelitian ini bertujuan untuk mengetahui aktivitas antioksidan, kandungan fenolik dan flavonoid ekstrak air dan etanol suruhan. Manfaat penelitian ini diharapkan dapat menambah referensi tumbuhan yang mempunyai aktivitas antioksidan dan suruhan dapat digunakan sebagai salah satu antioksidan alami bagi tubuh.
TINJAUAN PUSTAKA
Tumbuhan Suruhan
halaman rumah, tepi jalan, di pinggiran selokan, dan di tempat lain yang lembab atau berair. Tumbuhan ini berbunga sepanjang tahun. Tumbuh berumpun secara liar pada iklim tropis dan subtropis. Tingginya sekitar 10-20 cm, dengan dahan berbuku-buku serupa tumbuhan sirih dan bunga majemuk berbentuk bulir yang terdapat pada pangkal atau ketiak daun. Batang dari suruhan ini tegak dan lunak dengan akar yang serabut dangkal dan berwarna putih. Lebar daun suruhan ini sekitar 0.5-2 cm berbentuk hati dan panjang sekitar 4 cm (Djauhariya dan Hernani 2004).
Peperomia pellucida L. Kunth secara lokal dikenal sebagai suruhan sering digunakan sebagai ramuan dalam pengobatan tradisional. Peperomia pellucida
secara luas didistribusikan di banyak negara Amerika dan Asia Selatan (Arrigoni-Blank 2004). Tumbuhan ini memiliki manfaat dalam pengobatan sakit kepala, demam, eksim, sakit perut, dan kejang-kejang (Ghani 1998). Menurut laporan Manila medical society tahun 2011 (Cao 2011), suruhan dapat digunakan untuk meredakan nyeri rematik. Tumbuhan ini dapat digunakan sebagai antibakteri, antiinflamasi, dan analgesik. Isolasi arilpropanoid dari suruhan digunakan sebagai antijamur, sedangkan peperomin dapat digunakan sebagai antikanker. Meskipun tumbuhan ini memiliki aktivitas antibakteri, namun belum diketahui senyawa aktif yang berperan sebagai antibakteri tersebut (Cao 2011). Sifat analgesik dari tumbuhan diduga berhubungan dengan efeknya pada sintesis prostaglandin. Hal ini mungkin disebabkan adanya potensi sebagai antibiotik, seperti yang ditunjukkan dalam tes terhadap
Staphylococcus aureus, Bacillus subtilis,
Pseudomonas aeruginosa, dan Escherichia coli. Ekstrak kloroform dari daun kering suruhan menunjukkan aktivitas antijamur
terhadap Trichophyton mentagrophytes
secara in vitro. Meskipun tumbuhan ini dapat menyebabkan asma dengan gejala seperti hipersensitivitas, namun belum ada data klinis yang dilaporkan dari gejala tersebut (Aziba et al. 2001).
Tumbuhan suruhan ini sudah lama dikenal oleh masyarakat luas sebagai obat, bahkan telah diperdagangkan dengan nama dagang suruhan. Di Filipina tumbuhan ini disebut tangon-tangon atau pansit-pansitan, dan telah lama dimanfaatkan sebagai obat, antara lain untuk membantu mengatasi gangguan artritis, bisul, bengkak bernanah, dan masalah pada ginjal. Secara empiris herba suruhan juga dapat mengatasi sakit kepala, nyeri perut, dan membantu mengatasi timbulnya jerawat. Suruhan umumnya dikonsumsi dengan cara diseduh, tetapi ada juga yang mengkonsumsinya sebagai lalapan segar (Cao 2011). Senyawa kimia yang terdapat dalam suruhan diantaranya adalah alkaloid, flavonoid, tanin, saponin, polifenol, kalsium oksalat, lemak, dan minyak atsiri (Djauhariya dan Hernani 2004).
Ekstraksi
Pengambilan bahan aktif dari suatu tumbuhan, dapat dilakukan dengan ekstraksi. Dalam proses ekstraksi ini, bahan aktif akan terlarut oleh zat penyari yang sesuai sifat kepolarannya. Metode ekstraksi dipilih berdasarkan beberapa faktor seperti sifat dari bahan mentah obat, daya penyesuaian dengan tiap macam metode ekstraksi, dan kepentingan dalam memperoleh ekstrak yang sempurna atau mendekati sempurna (Ansel 1989).
Metode-metode ekstraksi yang sering digunakan diantaranya ialah metode maserasi. Maserasi merupakan cara ekstraksi yang paling sederhana. Bahan simplisia yang dihaluskan sesuai dengan syarat farmakope (umumnya terpotong-potong atau berupa serbuk kasar) disatukan dengan bahan pengekstraksi. Selanjutnya rendeman tersebut disimpan terlindung dari cahaya langsung (mencegah reaksi yang dikatalisis cahaya atau perubahan warna) dan dikocok kembali. Waktu lamanya maserasi berbeda-beda antara 4-10 hari. Secara teoritis pada suatu maserasi tidak memungkinkan terjadinya ekstraksi absolut. Semakin besar perbandingan cairan pengekstraksi terhadap simplisia, akan semakin banyak hasil yang diperoleh (Voigt 1994).
Maserasi digunakan untuk penyarian simplisia yang mengandung zat aktif yang mudah larut dalam cairan penyari, tidak mengandung zat yang mudah mengembang dalam cairan penyari, tidak mengandung benzoin, sitrat, dan lain-lain. Maserasi dilakukan dengan merendam serbuk simplisia dalam cairan penyari. Cairan penyari atau pelarut yang digunakan dapat berupa air, etanol, air-etanol, atau pelarut lain. Pelarut-pelarut tersebut dapat bersifat polar contohnya air dan ada bersifat nonpolar atau pelarut organik seperti aseton, etil asetat, etanol, dan lainnya. Ketika simplisia yang akan dimaserasi direndam dalam pelarut yang dipilih, maka cairan penyari akan menembus dinding sel dan masuk ke dalam sel yang banyak mengandung zat aktif dan zat aktif tersebut akan larut dalam cairan penyari sehingga penyari yang masuk ke dalam sel akan mengandung zat aktif. Sementara itu, penyari yang berada di luar sel belum mengandung zat aktif sehingga menimbulkan perbedaan konsentrasi zat aktif di dalam dan di luar sel yang akan menimbulkan gaya difusi. Larutan yang terpekat akan keluar untuk mencapai keseimbangan konsentrasi antara zat aktif di dalam dan di luar sel. Proses keseimbangan ini akan berhenti, setelah terjadi keseimbangan konsentrasi atau telah mencapai kondisi jenuh. Dalam kondisi ini zat aktif di dalam dan di luar sel akan memiliki konsentrasi yang sama (Voigt 1994).
Fenolik dan Flavonoid
Fenol adalah senyawa dengan satu gugus hidroksil (-OH) yang terikat pada cincin aromatik (Fessenden dan Fessenden 1986). Fenolik merupakan metabolit sekunder yang tersebar dalam tumbuhan. Senyawa fenolik dalam tumbuhan dapat berupa fenol sederhana, antraquinon, asam fenolat, kumarin, flavonoid, lignin dan tanin (Harborne 1996). Senyawa fenolik telah diketahui memiliki berbagai efek biologis seperti aktivitas antioksidan melalui mekanisme sebagai pereduksi, penangkap radikal bebas, pengkhelat logam, peredam terbentuknya oksigen singlet serta pendonor elektron (Karadeniz et al. 2005).
Salah satu antioksidan alami yaitu asam galat (3, 4, 5-trihydroxybenzoic acid). Asam galat termasuk dalam senyawa fenolik dan memiliki aktivitas antioksidan yang kuat (Lee et al. 2003). Penentuan kandungan
fenolik total dapat dilakukan dengan menggunakan pereaksi Folin-Ciocalteu (Lee
et al. 2003). Metode ini berdasarkan kekuatan mereduksi dari gugus hidroksil fenolik. Semua senyawa fenolik termasuk fenol sederhana dapat bereaksi dengan reagen Folin Ciocalteu, walaupun bukan penangkap radikal (antiradikal) efektif (Huang et al. 2005). Adanya inti aromatis pada senyawa fenolik dapat mereduksi fosfomolibdat fosfotungstat menjadi molibdenum yang berwarna biru (Sudjadi dan Rohman 2004).
Kandungan fenolik total dalam tumbuhan dinyatakan dalam GAE (gallic acid equivalent) yaitu jumlah kesetaraan miligram asam galat dalam 1 gram sampel (Lee et al. 2003). Flavonoid tersebar luas di alam, terutama dalam tumbuhan tingkat tinggi dan jaringan muda. Sekitar 5 – 10% metabolit sekunder tumbuhan adalah flavonoid. Flavonoid merupakan grup senyawa alami dengan ragam struktur fenolat yang dapat ditemukan pada buah, sayuran, gandum, teh, dan anggur (Middleton et al. 1998). Flavonoid sebagai derivat benzo-γ-piron mempunyai banyak kegunaan di samping fungsinya yang utama sebagai bahan tambahan untuk meningkatkan resistensi dan menurunkan permeabilitas kapiler darah. Efek lain flavonoid sangat banyak macamnya terhadap berbagai organisme dan efek ini dapat menjelaskan alasan tumbuhan yang mengandung flavonoid dapat digunakan dalam pengobatan. Flavonoid dapat berfungsi sebagai antivirus, antialergi, antimikroorganisme, dan antioksidan untuk mengendalikan radikal bebas yang dapat menyebabkan tumor (Middleton et al. 1998). Flavonoid mempunyai kerangka dasar yang terdiri atas 15 atom karbon dengan 2 cincin benzena terikat pada suatu rantai propana membentuk susunan C6-C3-C6 seperti yang terlihat pada Gambar 2. Susunan tersebut dapat menghasilkan 3 struktur, yaitu 1,3-diaril propana (flavonoid), 1,2-diarilpropana (isoflavonoid), dan
diarilpropana (neoflavonoid) (Markham 1988). Kerangka dasar karbon pada flavonoid merupakan kombinasi antara jalur sikhimat dan jalur asetat-malonat yang merupakan dua jalur utama biosintesis cincin aromatik. Cincin A dari struktur flavonoid berasal dari jalur poliketida (jalur asetat-malonat), yaitu kondensasi tiga unit asetat atau malonat, sedangkan cincin B dan tiga atom karbon dari rantai propan berasal dari jalur fenilpropanoid (jalur sikhimat) (Achmad 1985).
Flavonoid merupakan senyawa pereduksi yang baik, menghambat banyak reaksi oksidasi, baik secara enzimatis maupun non enzimatis. Flavonoid bertindak sebagai penampung radikal hidroksi dan superoksida yang baik dengan demikian dapat melindungi lipid membran terhadap reaksi yang merusak. Aktivitas antioksidannya dapat menjelaskan alasan flavonoid tertentu dapat menjadi komponen aktif tumbuhan yang digunakan secara tradisional untuk mengobati gangguan fungsi hati (Robinson 1995). Flavonoid dikenal sebagai antioksidan dan memberikan daya tarik sejumlah peneliti untuk meneliti flavonoid sebagai obat yang berpotensi mengobati penyakit yang disebabkan oleh radikal bebas (Cos et al. 2001).
Kandungan flavonoid total dapat ditentukan secara spektrofometri dengan reagen AlCl3 dan dinyatakan dalam RE
(rutin equivalent) (Karadeniz et al. 2005). Prinsip penetapan berdasarkan gugus orto dihidroksi dan gugus hidroksi keton yang membentuk kompleks dengan reagen AlCl3
sehingga memberikan efek batokromik (Harborne 1996).
Antioksidan
Antioksidan adalah senyawa kimia yang dapat menyumbangkan satu atau lebih elektron kepada radikal bebas, sehingga radikal bebas tersebut dapat diredam. Antioksidan didefinisikan sebagai senyawa yang dapat menunda, memperlambat, dan mencegah proses oksidasi lipid. Secara khusus, antioksidan adalah zat yang dapat menunda atau mencegah terbentuknya reaksi radikal bebas (peroksida) dalam oksidasi lipid (Dalimartha dan Soedibyo 1999).
Berdasarkan mekanismenya, antioksidan dapat dikelompokkan menjadi dua, yaitu antioksidan primer dan antioksidan sekunder. Antioksidan primer mengikuti mekanisme pemutusan rantai reaksi radikal dengan mendonorkan atom hidrogen secara
cepat pada suatu lipid yang radikal, produk yang dihasilkan lebih stabil dari produk awal (Vaya dan Aviram 2001). Contoh antioksidan ini adalah flavonoid, tokoferol, senyawa thiol, yang dapat memutus rantai reaksi propagasi dengan menyumbang elektron pada peroksi radikal dalam asam lemak. Antioksidan sekunder merupakan antioksidan yang dapat menghilangkan penginisiasi oksigen maupun nitrogen radikal atau bereaksi dengan komponen atau enzim yang menginisiasi reaksi radikal antara lain dengan menghambat enzim pengoksidasi dan menginisiasi enzim pereduksi atau mereduksi oksigen tanpa membentuk spesies radikal yang reaktif. Contoh antioksidan sekunder: sulfit, vitamin C, betakaroten, asam urat, billirubin, dan albumin (Vaya dan Aviram 2001). Antioksidan dapat dibedakan juga dari sumbernya yaitu antioksidan endogen yang berasal dari daam tubuh dan antioksidan eksogen yang berasal dari diet makanan.
Uji Aktivitas Penangkap Radikal Bebas
Radikal bebas yang umumnya digunakan sebagai model dalam penelitian antioksidan atau peredam radikal bebas adalah 1,1-difenil-2-pikrilhidrazil (DPPH) (Windono et al. 2001). Metode DPPH merupakan metode yang sederhana, cepat, dan mudah untuk penapisan aktivitas penangkap radikal beberapa senyawa, selain itu metode ini terbukti akurat, efektif dan praktis (Prakash
et al. 2001). DPPH digunakan sebagai model radikal bebas. Radikal bebas DPPH akan ditangkap oleh senyawa flavonoid (Gambar 3). Flavonoid akan dioksidasi oleh radikal bebas DPPH menghasilkan bentuk radikal yang lebih stabil, yaitu radikal dengan kereaktifan rendah. Flavonoid mendonorkan
radikal hidrogen (H•) dari cincin
aromatiknya untuk mengurangi radikal bebas yang bersifat toksik menghasilkan
radikal flavonoid (FlO•) yang terstabilkan
resonansi dan membuatnya tidak toksik (Amic et al. 2003).
Radikal DPPH adalah suatu senyawa organik yang mengandung nitrogen tidak
stabil dengan absorbansi kuat pada max
517 nm dan berwarna ungu gelap. Setelah bereaksi dengan senyawa antioksidan, DPPH tersebut akan tereduksi dan warnanya akan berubah menjadi kuning. Perubahan tersebut dapat diukur dengan spektrofotometer, dan diplotkan terhadap konsentrasi (Reynertson 2007). Parameter yang umum digunakan untuk mengetahui besarnya aktivitas antioksidan pada suatu ekstrak bahan adalah dengan menentukan nilai konsentrasi hambatan 50% (inhibition concentration / IC50) bahan antioksidan
tersebut. Penurunan intensitas warna yang terjadi disebabkan oleh berkurangnya ikatan rangkap terkonjugasi pada DPPH. Hal ini dapat terjadi apabila adanya penangkapan satu elektron oleh zat antioksidan, menyebabkan tidak adanya kesempatan elektron tersebut untuk beresonansi.
BAHAN DAN METODE
Bahan dan Alat
Bahan-bahan yang digunakan adalah batang dan daun suruhan, akuades, etanol, kloroform, HCl pekat, larutan DPPH 1 mM, kontrol positif vitamin C, kontrol positif asam tanat, pereaksi Follin Ciocalteu 50%, Na2CO3 5%, larutan heksametilentetramina
(HMT) 0.5%, aseton, 10% AlCl3, asam
asetat glasial, dan etil asetat.
Alat - alat yang digunakan adalah neraca analitik, penggilingan, batang pengaduk, tabung reaksi, sudep, gelas piala, erlenmeyer, kertas aluminium foil, corong, pipet volumetrik, pipet mikro, cawan porselin, oven, eksikator, vacuum evaporator, pinggan porselin, penangas air, corong pisah, shaker, kapas, labu ukur,
biotek's epoch micro -volume spectrophotometer system, dan spektofotometer UV-VIS Perkin Elmer Lambda 20.
Metode Penelitian
Ekstraksi Tumbuhan Suruhan
Penelitian ini dilakukan dengan menggunakan ekstrak air dan ekstrak etanol campuran batang dan daun suruhan. Kedua ekstrak dilakukan uji antioksidan dengan metode DPPH lalu diukur kandungan fenolik total dan flavonoid dari masing-masing ekstrak tersebut.
Persiapan sampel. Kegiatan diawali dengan sortasi basah yang bertujuan
memisahkan kotoran atau bahan-bahan asing lainnya dari batang dan daun suruhan. Kemudian dilakukan pencucian untuk menghilangkan tanah dan pengotor lainnya yang masih menempel pada bahan yang sudah disortasi basah. Tahap berikutnya adalah perajangan untuk mempermudah proses pengeringan dan penggilingan. Selanjutnya, sampel dikeringkan dalam oven pada suhu 50OC hingga kadar air kurang dari 10%. Hasil pengeringan digiling sampai berbentuk serbuk.
Penentuan kadar air. Metode penentuan kadar air mengacu pada metode AOAC (1995). Prinsip analisis kadar air ialah untuk mengetahui kandungan kadar air dalam suatu bahan. Cawan porselin dikeringkan dalam oven pada suhu 105OC selama 30 menit, lalu cawan didinginkan di dalam eksikator selama 30 menit dan ditimbang bobot kosongnya. Sampel ditimbang sekitar 3 g dan dimasukkan ke cawan porselin. Sampel beserta cawannya dipanaskan pada suhu 105OC selama 3 jam di dalam oven. Setelah didinginkan dalam eksikator selama 30 menit, cawan beserta isinya ditimbang. Penentuan kadar air dilakukan sebanyak 3 kali ulangan (triplo).
Ekstraksi air. Berdasarkan BPOM (2004), ekstraksi air dilakukan dengan cara perendaman serbuk dengan nisbah sampel : pelarut air sama dengan 1:10 selama 6 jam sambil sekali-sekali diaduk, kemudian didiamkan selama 24 jam. Maserat dipisahkan dan proses diulangi sebanyak dua kali dengan jenis dan jumlah pelarut yang sama. Semua maserat dikumpulkan dan diuapkan dengan vacuum evaporator hingga diperoleh ekstrak kering.
Ektraksi etanol. Berdasarkan BPOM (2004), ekstraksi etanol dilakukan dengan cara perendaman serbuk dengan nisbah sampel pelarut : etanol 70% sama dengan 1:10 menggunakan metode maserasi selama 6 jam sambil sekali-sekali diaduk, kemudian didiamkan selama 24 jam. Maserat dipisahkan dan proses diulangi sebanyak dua kali dengan jenis dan jumlah pelarut yang sama. Semua maserat dikumpulkan dan diuapkan dengan vacuum evaporator hingga diperoleh ekstrak kering.
Uji Antioksidan dengan Metode DPPH
ppm). Masing-masing ekstrak dimasukkan ke dalam tabung reaksi dan dilarutkan dengan etanol. Kemudian sampel dimasukkan ke dalam microplate dan dilakukan pengenceran dengan etanol berdasarkan konsentrasi yang diukur. Ke dalam tiap well ditambahkan 100 l larutan
DPPH 1 mM dan diinkubasi pada ruangan gelap selama 30 menit, selanjutnya serapannya diukur pada panjang gelombang 517 nm menggunakan microplate reader. Sebagai kontrol positif dan pembanding digunakan vitamin C (konsentrasi
0.625,
1.25, 2.5, 5, 10, dan 20 ppm)
Uji Kandungan Fenolik Total
Pengukuran kandungan fenolik total dilakukan berdasarkan metode Andarwulan
et al. (1999) yang dimodifikasi. Pembuatan standar asam tanat dilakukan dengan melarutkan 5 mg asam tanat ke dalam aquades menggunakan labu takar 25 ml. Kemudian dari larutan tersebut, dibuat standar dengan konsentrasi 10, 20, 30, 40, 50, dan 60 ppm. Pengujian kandungan fenolik total dilakukan dengan melarutkan 20 mg ekstrak air atau ekstrak etanol dengan aquades dalam labu takar 25 ml dan dihomogenisasi dengan shaker. Kemudian diambil 0,5 mL dari larutan tersebut dan ditambahkan dengan pereaksi Follin Ciocalteu 50% sebanyak 1 ml, dan didiamkan 5 menit. Setelah itu ditambahkan 1 ml Na2CO3 5% dan dihomogenisasi dalam
gelap selama 1 jam. Lalu nilai absorbansnya diukur pada panjang gelombang 725 nm menggunakan alat spektrofotometer UV-VIS.
Uji Kandungan Flavonoid total
Berdasarkan metode BPOM (2004), penentuan kandungan flavonoid total diawali dengan penimbangan ekstrak sebanyak 200 mg dan dimasukkan ke dalam labu takar. Kemudian ditambah 1 mL larutan heksametilentetramina (HMT) 0.5%, 20 mL aseton, dan 2 mL larutan HCl, kemudian campuran dihidrolisis dengan cara direfluks selama 30 menit. Campuran disaring menggunakan kapas, filtrat dimasukkan ke dalam labu ukur 100 mL. Campuran filtrat ditambah dengan aseton sampai volume 100 mL. Filtrat diambil sebanyak 20 mL dan dimasukkan ke dalam corong pisah, kemudian ditambah 20 mL air dan diekstraksi sebanyak tiga kali masing-masing dengan 15 mL etil asetat. Fraksi etil asetat dikumpulkan dan ditambah dengan
etil asetat sampai volume mencapai 50 mL ke dalam labu ukur. Selanjutnya 10 ml dari campuran tersebut dimasukkan ke dalam labu ukur 25 ml dan ditambahkan dengan 10% AlCl3 sampai tanda tera pada labu dan
dilarutkan dengan asam asetat glasial. Campuran divorteks dan dibaca nilai absorbansnya pada panjang gelombang 370,8 nm menggunakan spektrofotometer UV-VIS.
Metode Analisis
Metode analisis statistik yang digunakan adalah pengujian analisis sidik ragam (ANOVA) menggunakan program SPSS 16.0. Uji dilanjutkan dengan uji Duncan jika diperoleh pengaruh nyata terhadap perlakuan. Pengujian ini dilakukan untuk mengetahui perbedaan kapasitas antioksidan pada tiap ekstrak dan juga melihat pengaruh kandungan flavonoid dan fenolik pada aktivitas antioksidan tiap ekstrak. Sedangkan untuk melihat hubungan-hubungan variabel flavon total atau fenolik total terhadap antioksidan dianalisis dengan menggunakan analisis regresi linier. Korelasi bernilai 1 jika terdapat hubungan linier yang positif, bernilai -1 jika terdapat hubungan linier yang negatif.Semakin dekat dengan -1 atau +1, semakin kuat korelasi antara kedua variabel tersebut.
HASIL DAN PEMBAHASAN
Ekstrak Suruhan
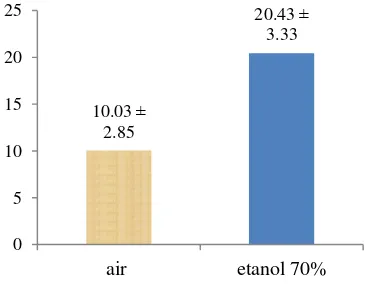
Suatu sampel uji baik digunakan jika mengandung kadar air kurang dari 10% (Winarno 2008). Kadar air yang didapat digunakan untuk memperkirakan jumlah
10.03 ± 2.85
20.43 ± 3.33 0 5 10 15 20 25
air etanol 70%
Gambar 4 Rendemen ekstrak air dan etanol campuran daun dan batang suruhan
sampel yang dibutuhkan saat ekstraksi sehingga didapat nilai koreksi rendemen dari ekstrak tersebut (Harjadi 1993). Kadar air yang didapat untuk simplisia herba suruhan sebesar 5.04% sehingga berdasarkan hasil tersebut simplisia dapat digunakan untuk dilakukan ekstraksi sampel. Ekstraksi herba suruhan dalam penelitian ini dilakukan dengan menggunakan pelarut air dan etanol 70%. Ekstrak yang didapat dalam penelitian ini berbentuk serbuk kering dengan nilai rerata rendemen dari ekstrak air sebesar 10.03
± 2.85
% sedangkan ekstrak etanol 70 % memiliki rendemen rata-rata sebesar 20.43± 3.33
%. Hasil rendemen ini menunjukkan bahwa kadar rendemen ekstrak etanol lebih tinggi daripada ekstrak air sebab etanol dapat melarutkan senyawa polar dan nonpolar. Pada analisis ragam rendemen terhadap ekstrak dihasilkan nilai yang berbeda nyata antara ekstrak air dan ekstrak etanol ( p<0.05). Hal ini menunjukkan bahwa jenis pelarut berpengaruh terhadap hasil rendemen ekstrak. Hasil analisis ragam rendemen ekstrak air dan ekstrak etanol suruhan dapat dilihat pada Lampiran 5. Penentuan rendemen berfungsi untuk mengetahui kadar metabolit sekunder yang terbawa oleh pelarut tersebut namun tidak dapat menentukan jenis senyawa yang terbawa tersebut.Ekstraksi dilakukan pada bahan alam bertujuan untuk mengambil senyawa kimia yang terkandung dalam bahan alam tersebut. Prinsip ekstraksi ini didasarkan pada perpindahan massa komponen zat yang terlarut ke dalam pelarut sehingga terjadi perpindahan pada lapisan antar muka dan berdifusi masuk ke pelarut (Harbone 1996). Jenis pelarut yang digunakan tergantung pada tingkat kepolarannya. Penelitian ini menggunakan pelarut air sebagai pelarut polar dan pelarut etanol 70% sebagai pelarut semipolar.
Ekstraksi dengan pelarut air diharapkan dapat membawa komponen-komponen polar yang terdapat pada suruhan. Pemilihan etanol sebagai pelarut didasarkan pada asumsi bahwa etanol mampu menggabungkan gugus polar dan nonpolar sehingga komponen pada suruhan yang bersifat polar dan nonpolar dapat terekstrak.
Pelarut yang bersifat polar dapat mengikat komponen senyawa fenolik termasuk flavonoid. Flavonoid dapat terlarut oleh pelarut seperti air dan etanol karena mempunyai gugus hidroksil sehingga
flavonoid larut dalam pelarut polar. Ekstrak kasar yang diperoleh dipekatkan dengan
vacuum evaporator dan dilakukan perhitungan rendemen pada masing-masing ekstrak. Proses ekstraksi dapat dihentikan apabila warna ampas serbuk daun telah berubah menjadi lebih pucat atau maserat berwarna lebih bening, sehingga dapat dianggap semua senyawa berbobot molekul rendah telah terekstraksi (Harbone 1996).
Sampel dalam bentuk ekstrak memiliki kelebihan antara lain, banyak nya senyawa bioaktif yang terlarut karena semua senyawa tersebut di dalam tanaman berbentuk konsentrat serta masih dalam bentuk alami. Komposisi alami memungkinkan semakin kecil efek samping dan perubahan aktivitas senyawa bioaktif serta mempermudah standarisasi sampel (Sinambela 2003).
Aktivitas Antioksidan Suruhan
Aktivitas antioksidan ekstrak suruhan dinyatakan dalam persentase inhibisi radikal bebas DPPH (Langseth 1995). Persen inhibisi didapat dari perbandingan serapan antara absorban DPPH dengan absorban sampel yang diukur dengan spektrofotometer UV-Vis (Andayani et al.
2008). Perhitungan persen inhibisi dan IC50
dapat dilihat pada Lampiran 6. Antioksidan pembanding yang digunakan adalah vitamin C sebagai antioksidan standar yang merupakan senyawa murni sehingga penghambatan radikal DPPH lebih efektif dengan konsentrasi yang rendah. Konsentrasi ekstrak air dan etanol herba suruhan yang digunakan berkisar antara 50 ppm sampai dengan 400 ppm. Konsentrasi ini merupakan konsentrasi optimum pada ekstrak air dan etanol suruhan yang diperoleh melalui penentuan konsentrasi optimum yang dilakukan pada interval konsentrasi 10 ppm sampai dengan 2000 ppm. Pada konsentrasi kurang dari 50 ppm atau lebih dari 400 ppm, persentase inhibisi tidak stabil. Nilai persentase inhibisi DPPH oleh ektrak air dan suruhan dapat dilihat pada Tabel 1. Hubungan antara konsentrasi dan persen inhibisi DPPH berbanding lurus yaitu semakin tinggi konsentrasi maka semakin tinggi persen inhibisi yang didapat sehingga semakin banyak radikal DPPH yang berikatan dengan ekstrak air atau etanol suruhan.
Parameter pengukuran aktivitas antioksidan tertinggi dapat dilihat dari nilai IC50 yaitu konsentrasi sampel yang mampu
melalui persamaan regresi linier. Semakin rendah nilai IC50 sampel uji maka semakin
tinggi aktivitas antioksidan yang dimiliki oleh sampel tersebut. Nilai IC50 diperoleh
dari persamaan regresi linier persentase inhibisi DPPH. Hasil IC50 dari
masing-masing ekstrak ditunjukkan oleh Tabel 1. Berdasarkan hasil yang diperlihatkan pada Tabel 1, aktivitas antioksidan ekstrak etanol 70% lebih rendah daripada ekstrak air. Hal ini terlihat dari IC50 rata-rata dari
ekstrak etanol berada pada konsentrasi 297.79 ± 17.75 ppm lebih besar daripada ekstrak air yang berada pada konsentrasi rata-rata 256.67 ± 21.65 ppm. Hasil ini bertolak belakang dengan hasil rendemen pada ekstrak etanol yang mempunyai nilai rendemen lebih besar daripada ekstrak air. Hal ini dapat terjadi karena etanol yang bersifat semipolar sehingga dapat menarik senyawa polar dan nonpolar lebih banyak daripada pelarut air. Aktivitas antioksidan ekstrak etanol yang lebih rendah dapat disebabkan oleh adanya senyawa-senyawa nonpolar yang terekstrak bukan merupakan senyawa antioksidan yang kuat seperti minyak atsiri, lemak, dan minyak. Selain itu, besarnya rendemen ekstrak etanol diduga dapat diakibatkan oleh adanya klorofil yang terekstrak, terbukti dari warna hijau pekat pada ekstrak etanol. Wasmund et.al (2006) menyatakan bahwa etanol merupakan pelarut yang dapat mengekstrak klorofil pada daun dengansangat baik. Klorofil yang terdapat pada ekstrak dapat mengganggu proses penangkapan radikal bebas DPPH. Zat warna hijau yang ditimbulkan dapat mempengaruhi terjadinya proses reduksi radikal bebas sehingga perubahan warna pada sampel menjadi berwarna merah bukan kuning. Warna yang terserap pada alat
microplate reader akan mempengaruhi nilai absorban yang merupakan hasil inhibisi radikal DPPH.
Bila dibandingkan dengan Vitamin C yang memiliki IC50 rata-rata pada
konsentrasi 3.252 ± 28.11 ppm, aktivitas antioksidan ekstrak etanol 70% dan air masih tergolong rendah. Menurut Blois (2005) suatu senyawa memiliki antioksidan sangat kuat apabila nilai IC50 kurang dari 50
ppm, kuat apabila nilai IC50 antara 50-100
ppm, sedang apabila nilai IC50 berkisar
antara 100-150 ppm, dan lemah IC50 berkisar
antara 150-200 ppm. Berdasarkan dari klasifikasi tersebut maka aktivitas antioksidan ekstrak air dan ekstrak etanol suruhan (Peperomia pellucida L. Kunth) tergolong lemah.
Aktivitas antioksidan daun suruhan ini dibandingkan dengan tumbuhan famili
Piperacea termasuk rendah. IC50 ekstrak
etanol daun sirih hijau sebesar 10.59 ppm dan IC50 daun sirih merah sebesar 28.05 ppm
(Serlahwaty et al. 2011). Jika dibandingkan dengan tanaman lain seperti lengkuas merah dan buah goji berry, ekstrak etanol suruhan memiliki aktivitas antioksidan yang lebih tinggi. Ekstrak etanol rimpang lengkuas merah (Alpinia galanga) memiliki aktivitas antioksidan yang dinyatakan dengan IC50 sebesar 712.0928 ppm dan untuk buah goji berry (Lycium barbarum L.) memiliki nilai IC50 sebesar 416.37 ppm (Wahyu 2008; Tessa 2011).
Nilai penghambatan radikal bebas DPPH pada vitamin C termasuk tinggi karena vitamin C merupakan senyawa murni sehingga dapat mengikat radikal DPPH secara efektif. Bila dibandingkan dengan ekstrak etanol 70% dan ekstrak air, kedua ekstrak tersebut masih tergolong ekstrak kasar sehingga diduga masih terdapat senyawa pengganggu seperti protein dan senyawa lainnya yang menghalangi proses penangkapan radikal bebas. Kemurnian suatu sampel saat proses ekstraksi mempengaruhi aktivitas antioksidan sampel tersebut.
Adanya senyawa protein atau lemak pada ekstrak dapat mengganggu proses penangkapan radikal bebas oleh senyawa fenolik atau flavonoid. Protein atau lemak pada tumbuhan dapat memberikan atom hidrogen yang dimilikinya sehingga akan berikatan dengan radikal hidroksil pada DPPH (Pine et al. 1988). Hal ini menyebabkan radikal DPPH semakin aktif sehingga tidak terjadi proses reduksi. Oleh karena itu DPPH tetap berwarna ungu dan mengganggu pengukuran serapan absorban ekstrak. Adanya senyawa pengganggu
Sampel % Inhibisi pada berbagai konsentrasi (ppm) IC50 (ppm)
50 100 200 300 400
Ekstrak air 6.55 29.75 41.20 54.65 61.09 256.67 ± 21.65
tersebut dapat meningkatkan nilai rendemen ekstrak namun tidak dapat meningkatkan aktivitas antioksidan ekstrak tersebut seperti yang terlihat pada ekstrak etanol suruhan yang memiliki rendemen yang lebih tinggi daripada ekstrak air namun aktivitas antioksidan yang dihasilkan lebih rendah daripada ekstrak air.
Data hasil pengukuran aktivitas antioksidan selanjutnya dianalisis secara statistik dengan menggunakan analisis ragam. Hasil pengolahan statistik data hasil pengukuran aktivitas antioksidan dengan metode uji aktivitas kemampuan mereduksi dapat dilihat pada Lampiran 7. Data hasil pengolahan analisis ragam menunjukkan bahwa nilai signifikan sampel adalah 0.000 sedangkan nilai signifikan level adalah 0.05. Nilai signifikan sampel yang lebih kecil daripada nilai signifikan level menunjukkan bahwa pada selang kepercayaan 95%, sampel
ekstrak suruhan yang diujikan berbeda nyata sehingga setiap perlakuan memiliki pengaruh pada inhibisi.
Analisis ragam dinyatakan berbeda nyata sehingga dapat dilanjutkan dengan uji lanjut Duncan pada selang kepercayaan 95%. Data hasil pengolahan dengan uji lanjut Duncan (Lampiran 7) menunjukkan bahwa setiap konsentrasi dari kedua ekstrak memiliki keragaman yang berbeda-beda. Dari hasil uji Duncan terlihat untuk inhibisi antara ekstrak air dan ekstrak etanol tidak jauh berbeda. Hasil dari setiap konsentrasi ekstrak air dan etanol yang berbeda
menghasilkan 4 subset dengan α sebesar
0.05. Ekstrak air 400 ppm memiliki inhibisi yang tertinggi dengan nilai rata-rata inhibisi sebesar 61.09%. Namun air 300 ppm juga
memiliki aktivitas yang sama dengan ekstrak air 400 ppm yang berada pada satu subset
yang sama. Sampel yang berada pada satu subset yang sama memiliki pengaruh yang sama terhadap inhibisi radikal bebas.
Kadar Fenolik Total dan Flavonoid Total
Pengujian aktivitas fenolik total merupakan dasar dilakukan pengujian aktivitas antioksidan, karena diketahui bahwa
senyawa fenolik berperan dalam mencegah terjadinya peristiwa oksidasi. Fenolik total ekstrak herba suruhan pada penelitian ini diukur dengan menggunakan prinsip Folin-Ciocalteau yang didasarkan pada reaksi oksidasi-reduksi. Reagen Folin yang terdiri dari asam fosfomolibdat dan asam fosfotungstat akan tereduksi oleh senyawa polifenol menjadi molibdenum-tungsen (Kusumaningati 2009). Reaksi ini membentuk kompleks warna biru. Semakin tinggi kadar fenolik pada sampel, semakin banyak molekul kromagen (biru) yang terbentuk sehingga semakin tinggi nilai absorbansi pada sampel tersebut. Intensitas dari warna yang dibentuk diukur pada panjang gelombang 765 nm. Hasil pengukuran kadar fenolik total pada ekstrak air dan ekstrak etanol 70% dari tumbuhan suruhan (Peperomia pellucida L. Kunth) dapat dilihat pada Lampiran 8. Asam tanat digunakan sebagai standar pengukuran dikarenakan asam tanat merupakan senyawa polifenol yang terdapat pada hampir semua tanaman. Kandungan fenol asam organik ini bersifat murni dan stabil (Kusumaningati 2009).
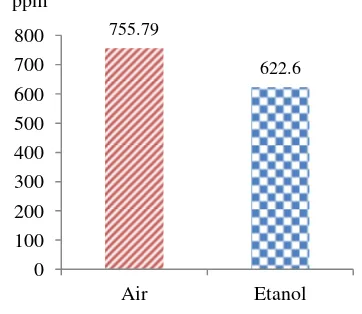
Gambar 5 menunjukkan kadar fenol total yang didapat pada ekstrak air dan ekstrak etanol berbeda. Pada ekstrak air diperoleh kadar fenolik total rata-rata
Konsentrasi (ppm)
Inhibisi (%)
Ekstrak Air Ekstrak Etanol
50 6.55a 11.98a
100 29.75b 31.67b
200 41.20bc 38.07b
300 54.65d 51.41cd
400 61.09d 57.70d Tabel 2 Inhibisi ekstrak air dan etanol herba suruhan 755.79 622.6 0 100 200 300 400 500 600 700 800
Air Etanol ppm
Gambar 5 Kadar fenolik total ekstrak suruhan
sebesar 755.79 ± 65.87 mg TAE/g ekstrak lebih besar daripada ekstrak etanol dengan kadar fenolik total rata-rata sebesar 622.46 ± 179.43 mg TAE/g ekstrak. Hal ini menunjukkan bahwa senyawa fenolik lebih banyak terekstrak pada ekstrak air (polar) daripada ekstrak etanol (semipolar). Banyaknya kadar fenolik ini menunjukkan pengaruhnya terhadap inhibisi dan IC50
masing-masing ekstrak suruhan. Ekstrak air yang memiliki kandungan fenolik total lebih banyak mempunyai aktivitas antioksidan lebih tinggi daripada ekstrak etanol.
Perbedaan tingkat kepolaran pelarut menentukan struktur kimia senyawa fenolik yang terekstrak. Deore et al. (2009) menyatakan bahwa pengujian fenolik total sangat tergantung pada struktur kimianya. Senyawa fenolik yang mempunyai gugus fungsi hidroksil yang banyak atau dalam kondisi bebas (aglikon) akan menghasilkan kandungan fenolik total yang tinggi. Sifat polar pada air mampu menarik senyawa fenolik dalam jumlah yang banyak. Senyawa fenolik yang bersifat polar memiliki aktivitas antioksidan yang tinggi.
Pengukuran kandungan flavonoid total dari esktrak air dan ekstrak etanol suruhan (Peperomia pellucida L. Kunth) dilakukan dengan metode pewarnaan AlCl3. Prinsip
dari metode pewarnaan ini adalah AlCl3
membentuk kompleks asam yang stabil dengan C-4 gugus keto, lalu dengan C-3 atau C-5 gugus hidroksil dari flavon dan flavonol. Selain itu AlCl3 juga membentuk
kompleks asam yang labil dengan gugus orto dihidroksil pada cincin A atau B dari flavonoid (Fessenden dan Fessenden 1986) sehingga akan mempunyai serapan maksimum pada panjang gelombang 370.8 nm.
Pengukuran flavonoid total ini dimulai dengan melakukan hidrolisis terhadap sampel. Hal ini bertujuan flavonoid dalam bentuk glikosida (flavonoid yang masih terikat dengan gugus gula) dapat terurai menjadi flavonoid dalam bentuk aglikon (flavonoid tunggal) karena analisis flavonoid akan lebih baik jika berada dalam bentuk aglikonnya (Harborne 1996).
Berdasarkan persamaan linier dari standar kuersetin yaitu y = 0.0947x – 0.0211 didapat rerata kadar flavonoid total untuk ekstrak air suruhan sebesar 0.670± 0.326 mg QE/g ekstrak dan rerata kadar flavonoid total ekstrak etanol 70% suruhan sebesar 4.058 ± 0.352mg QE/g ekstrak. Ekstrak etanol 70% suruhan memiliki kandungan flavonoid total
yang lebih besar daripada ekstrak air suruhan. Hal ini menunjukkan bahwa pelarut etanol dapat mengekstrak senyawa flavonoid baik yang bersifat polar ataupun nonpolar. Hasil perbandingan kadar flavonoid total ekstrak air dan ekstrak etanol suruhan disajikan pada Gambar 6.
Korelasi antara fenolik total terhadap aktivitas antioksidan atau korelasi flavonoid total tehadap antioksidan telah banyak dipelajari pada berbagai jenis tumbuhan dan buah- buahan (Kiselova et al. 2006, Klimezak et al. 2007, Jayaprakasha et al.
2008). Beberapa penelitian tersebut menunjukkan hubungan antara banyaknya fenolik total atau
flavonoid total yang dikandung maka semakin efektif aktivitas antioksidan yang dihasilkan.
Penelitian ini menganalisis korelasi flavonoid total dan fenolik total yang terkandung dalam ekstrak air dan ekstrak etanol herba suruhan terhadap aktivitas antioksidannya. Hasil analisis korelasi dapat dilihat pada Tabel 3.Berdasarkan analisis korelasi terdapat hubungan korelasi yang positif antara aktivitas antioksidan degnan fenolik total namun tidak kuat. Korelasi antara aktivitas antioksidan pada ekstrak air dengan fenolik totalnya menunjukkan nilai korelasi yang lemah yaitu 77.09%, begitu juga dengan ekstrak etanol sebesar 87.35%. dari hasil ini dapat dinyatakan bahwa aktivitas antioksidan ekstrak air dan etanol dipengaruhi oleh kandungan total fenolnya.
Hasil analisis korelasi flavonoid total dengan aktivitas antioksidan ekstrak air dan etanol masing-masing sebesar 12.06% dan 27.09%. Nilai ini hampir mendekati nol sehingga dapat dinyatakan bahwa flavonoid total tidak berkorelasi dengan aktivitas
0.670 4.058 0 1 2 3 4
Air Etanol ppm
antioksidannya. Hal ini terbukti pada ekstrak etanol yang memiliki kandungan flavonoid total yang lebih banyak daripada ekstrak air namun memiliki aktivitas antioksidan yang lebih rendah. Hal ini dapat terjadi diduga akibat kandungan flavonoid yang terekstrak pada etanol paling banyak adalah flavonoid golongan nonpolar yang memiliki aktivitas antioksidan yang rendah karena masih terikat pada gugus glikosidanya sehingga menghambat pengikatan radikal bebas DPPH. Hubungan kandungan fenolik total dengan flavonoid total ekstrak suruhan mempunyai nilai korelasi sebesar 28.04%. Hal ini menyatakan bahwa fenolik total tidak memiliki hubungan linier dengan flavonoid total karena nilai korelasi hampir mendekati nol. Hasil ini menunjukkan bahwa kandungan fenol dari setiap ekstrak tidak selalu bersumber pada golongan senyawanya. Beberapa senyawa metabolit sekunder maupun senyawa metabolit primer yang dihasilkan oleh tumbuhan dapat menjadi senyawa antioksidan ataupun senyawa pengganggu aktivitas antioksidan.
Aktivitas antioksidan tidak hanya dipengaruhi oleh adanya fenolik maupun flavonoid saja, tetapi dapat juga disebabkan oleh adanya beberapa senyawa fitokimia lain seperti asam askorbat, tokoferol, dan pigmen yang memberikan efek sinergis. Beberapa jenis fenolik dapat memiliki aktivitas antioksidan yang berbeda tergantung pada struturnya. Fenolik termasuk flavonoid yang terkandung pada ekstrak air dan ektrak etanol suruhan mungkin memiliki aktivitas antioksidan yang berbeda sehingga tidak dapat diukur dengan metode DPPH saja.
SIMPULAN DAN SARAN
Simpulan
Herba suruhan memiliki aktivitas antioksidan yang lemah. Ekstrak air suruhan memiliki aktivitas antioksidan yang lebih
tinggi daripada ekstrak etanol. Kandungan fenolik total ekstrak air lebih besar daripada ekstrak etanol namun kandungan flavonoid totalnya lebih kecil daripada ekstrak etanol. Kandungan total fenol tidak memiliki korelasi dengan total flavonoidnya tetapi memiliki korelasi yang yang linier dengan aktivitas antioksidannya.
Saran
Perlu dilakukan penelitian lanjutan berupa pemurnian ekstrak kasar, pengujian antioksidan ekstrak murni dan identifikasi senyawa bioaktif lainnya yang terdapat pada suruhan tersebut serta penentuan golongan senyawa fenolik dan flavonoid terekstraksi. Pengujian aktivitas antioksidan dapat dilakukan dengan metode lain seperti FRAP atau CUPRAC.
DAFTAR PUSTAKA
Achmad SA. 1985. Kimia Organik Bahan Alam.. Jakarta: Departemen Pendidikan dan. Kebudayaan, Universitas Terbuka.
Amic D, Beslo D, Trinajstic N, Davidovic. 2003. Structure-Radical Scavenging Activity Relationships of Flavonoids.
Croatia Chem Acta 76(1): 55-61. Ansel HC.1989. Pengantar Bentuk Sediaan
Farmasi. Edisi 4. Jakarta : UI Press. Andarwulan N, Wijaya H, Cahyono DT.
1996. Aktivitas Antioksidan dari Daun Sirih (Piper betle L). Teknologi dan Industri Pangan. Hal 29-30.
Andarwulan ,S Fardiaz, Apriyanto P, Haryadi, NK Shetty. 1999. Mobilization of primary metabolites and phenolics during natural fermentation in seeds of Pangiumedule Reinw. Process Biochemistry. 35: 197-204.
Andayani R, Y Lisawati, Maimunah. 2008. Penentuan Aktivitas Antioksidan, Kadar Fenol Total, dan Likopen pada Buah Tomat (Solanum lycupersicum L). Jurnal Sains dan Teknologi Farmasi, Vol 13, No.1
AOAC. 1995. Official Methods of Analysis. Association of Official. Washington DC: Agricultural Chemists.
Arrigoni-Blank et al . 2004. Seed germination, phenology, and antiedematogenic activity of Hubungan
Nilai korelasi (%)
IC50
Ekstrak Air
IC50
Ekstrak Etanol
Fenolik 77.09 87.35
Peperomia pellucida (L.) HBK BMC.
Pharmacol 2:12-19.
Aziba PI, Adedeji A, Ekor M, Adeyemi O. 2001. Analgesic activity of Peperomia pellucida aerial parts in mice.
Fitoterapia 72: 57–58
Badan Pengawas Obat dan Makanan. 2004.
Monografi Ekstrak Tumbuhan Obat Indonesia. Jakarta: BPOM RI.
Blois MS. 2005. Antioxidant determination by the use of stable free radical. Nature
181:1191-1200.
Cao Hu Jiao. 2011. Philipine Medicinal Plant: Pansit-pansitan. Manila : Manila Medical Society.
Cos P et al. 2001. Structure-activity relationship and clasification of flavonoids as inhibitors of xanthin oxidase and superoxide scavengers. J. Nat. Prod. 61: 71-76.
Dalimartha S, Soedibyo M. 1999. Awet Muda dengan Tumbuhan Obat dan Diet Supleme. Jakarta: Trubus Agriwidya.
Deore SL, Khadabadi SS, Baviskar BA, Khangenbam RA, Koli US, Daga NP, Gadbail PA, Jain PA. 2009. In vitro antioxidant activity and phenolic content of Croton caudatum.
International Journal of Chemical Technology Research 1(2):174-176. Djauhariya E, Hernani. 2004. Gulma
Berkhasiat Obat. Jakarta : Penebar Swadaya.
Duenas M, Manzano SO, Paramas AG, Buelga SC. 2009, Antioxidant evaluation of O-methylated metabolites of catechins, epicatechin, and quersetin. Journal of Pharmaceutical and Biomedical Analysis.
Fessenden RJ, Fessenden JS. 1986. Kimia Organik. Edisi Ketiga. Jakarta: Erlangga.
Ghani A. 1998. Medicinal Plants of Bangladesh. Bangladesh : Asia Society of Bangladesh.
Gianello Mikhail Domingo P. Cera, Nicole Rose B. Ramos, Nerisse Isabella T. Siazon. 2009. In vitro Evaluation of Potential Chemotherapeutic and Chemopreventive Properties of P. pellucida (L.) Kunth on HCT 116
Cancer Cell Line. Quezon: Ateneo de Manila University.
Halliwel B, Aeschbach R, Lolinger J, Auroma OI. 1995. Toxicology. J Food Chem, 33: 60.
Harbone JB. 1996. Metode Fitokimia: Penentuan Cara Modern Menganalisa Tumbuhan. Terjemahan Kosasih Padmawinata dan Iwang Soediro. Bandung: ITB.
Harjadi W. 1993. Kimia Analitik. Jakarta: Gramedia.
Heyne K. 1987. Tumbuhan Berguna Indonesia Jilid III. Jakarta: Yayasan Sarana Wana Jaya.
Huang C et al. 2005. Identification of an Antifungal Chitinase from a Potential Biocontrol Agent, Bacillus cereus.
Journal of Biochemistry and molecular Biology, 38 : 82-88.
Jayaprakasha GK, Girennavar B, Patil BS. 2008. Radical scavenging activities of Rio Red grapefruits and Sour orange fruit extracts in different in vitro model systems. Bioresour. Techno, 99: 4484-4494.
Karadeniz F et al. 2005. Antioxidant activity of selected fruits and vegetables grown in Turkey. Turkish Journal of Agricultural and Forest 89: 297–303. Kiselova Y, Ivanova D, Chervenkov T,
Gerova D, Galunska B and Yankova T. 2006. Correlation between the in vitro
antioxidant activity and polyphenol content of aqueous extracts from bulgaria herbs. Phytother. Res, 20: 961- 965.
Klimczak I, Malecka M, Szlachta M and Gliszczynska-Swiglo A (2007). Effect of storage on the content of polyphenols, vitamin C and the antioxidant activity of orange juices. J. Food Compost. Anal, 20: 313-322. Kusumaningati RW. 2009. Analisa
Kandungan Fenol Total Jahe (Zingiber officinale Rosc.) Secara In vitro.
Jakarta: Fakultas Kedokteran. Universitas Indonesia.
Langseth L. 1995. Oxidants, Antioxidants and Disease Prevention. Belgium: ILSI Europe.
Phytochemical and A Higher Antioxidant Capacity than Teas and Red Wine, J. Agric. Food Chem, 51 (25): 7292-7295.
Markham KR. 1988. Cara Mengidentifikasi Flavonoid. Penerjemah: Kosasih Padmawinata. Bandung: ITB.
Middleton EC, Kandaswami, TC Theoharides. 1998. The effects of plant flavonoids on mammalian cells: implications for inflammation, heart disease, and cancer. Pharmacological Reviews 52:673-751.
Pine HS et al . 1988. Radikal Bebas. Bandung: ITB. Terjemahan dari:
Organic Chemistry 2.
Prakash A, Rigelhof F, Miller E. 2001. Antioxidant Activity. Medalliaon Laboratories Analitycal Progress, Vol 10.
Reynertson KA. 2007. Phytochemical Analysis of Bioactive Constituens fromEdible Myrtaceae Fruit, Dissertation. New York : The City University of New York.
Robinson T. 1995. Kandungan Organik Tumbuhan Tinggi. Edisi ke-4 Terjemahan Kosasih Padmawinata. Bandung : ITB Press.
Serlahwaty D, Sugiastuti S, Ningrum RC. 2011. Aktivitas Antioksidan Ekstrak Air dan Etanol Daun Sirih Hijau (Piper betle L.) dan Sirih Merah (Piper cf. fragile Benth.) dengan Metode Peredaman Radikal Bebes DPPH [skripsi]. Jakarta: Fakultas Farmasi. Universitas Pancasila Jakarta.
Sinambela JM. 2003. Standarisasi sediaan obat herba. Prosiding seminar dan Pameran Nasional Tumbuhan Obat Indonesia XXIII. hlm 36-43.
Sudjadi dan Rohman A. 2004. Analisis Obat dan Makanan. Yogyakarta: Pustaka Pelajar.
Suhartono E, Fujiati, Aflanie I. 2002. Oxygen toxicity by radiation and effect of glutamic piruvat transamine (GPT) activity rat plasma after vitamine C treadment. International seminar on Environmental Chemistry and Toxicology. Yogyakarta.
Tessa Jimmy. 2011. Karakterisasi Simplisia, Skrining Fitokimia dan Uji Aktivitas Antioksidan Ekstrak Etanol Buah Goji Berry (Lycium barbarum L.) [skripsi]. Medan : Fakultas Farmasi. Universitas Sumatera Utara.
Vaya Jacob, Aviram Michael. 2001. Nutritional antioxidant : mechanism of action, analyses of activities and medical applications, Curr. Med. Chem-Imm,Endoc. &Metab Agents, vol 1 hal 99-117.
Voigt R. 1994. Buku Pelajaran Teknologi Farmasi. Penerjemah Dr. Soendani Noerono. Edisi Kelima. Yogyakarta: Gadjah Mada University Press.
Wahyu Oktariana Eka. 2008. Uji Aktivitas Antioksidan Ekstrak Etanol Rimpang Lengkuas Merah (Alpinia galanga) dengan Metode DPPH (1,1-Difenil-2-Pikrilhidrazil) [skripsi]. Semarang : Fakultas matematika dan Ilmu Pengetahuan Alam. Universitas Diponegoro.
Wasmund N, Topp I, Schories D. 2006. Optimising the storage and extraction of chlorophyll samples. Oceanologia
48(1):125–144.
Windono T et al. 2001. Uji Peredam Radikal Bebas Terhadap 1,1-Diphenil-2-picrylhydrazyl (DPPH) dari Ekstrak Kulit Buah dan Biji Anggur (Vitis vinifera L) Probolinggo Biru dan Bali.
Artocarpusvol 1 hal 34-43.
Winarno. 2008. Kimia Pangan dan Gizi.
Lampiran 1 Diagram alir penelitian
Sortasi basah, pengeringan,
penggilingan menjadi serbuk
Penentuan
kadar air
Ekstrasi
air
Uji antioksidan dengan
metode DPPH
Uji kandungan fenolik dan
uji kandungan flavonoid
Ekstrasi
etanol
Uji antioksidan dengan
metode DPPH
Uji kandungan fenolik dan
uji kandungan flavonoid
Ekstra
k Eta
nol
Ekstra
k a
Lampiran 2 Ekstraksi air suruhan
20 gram serbuk suruhan
dimaserasi dengan air
(1:10)
Didiamkan selama 24 jam
sambil dikocok sekali-kali
Maserat dipisahkan dan
dimaserasi kembali dengan air
sebanyak tiga kali ulangan
Ekstrak ditimbang
Ekstrak diuapkan hingga
kental dengan evaporator
Lampiran 3 Ekstraksi etanol suruhan
20 gram serbuk suruhan
dimaserasi dengan etanol
70% (1:10)
Didiamkan selama 24 jam
sambil dikocok sekali-kali
Maserat dipisahkan dan dimaserasi
kembali dengan etanol sebanyak
tiga kali ulangan
Ekstrak ditimbang
Ekstrak diuapkan hingga
kental dengan evaporator
Lampiran 4 Uji aktivitas antioksidan dengan metode DPPH
Seb
anyak 500 g DPPH
ditimbang dan dilarutkan ke
dalam 10 ml etanol
Setiap sampel dimasukkan ke
dalam microplate dengan
konsentrasi 50,100, 200, 300,
dan 400 ppm
Diinkubasi selama 30
menit pada suhu 37°C
Serapan sampel dibaca
pada panjang gelombang 517 nm
Lampiran 5 Kadar air suruhan , rendemen ekstrak, dan analisis ragam
rendemen
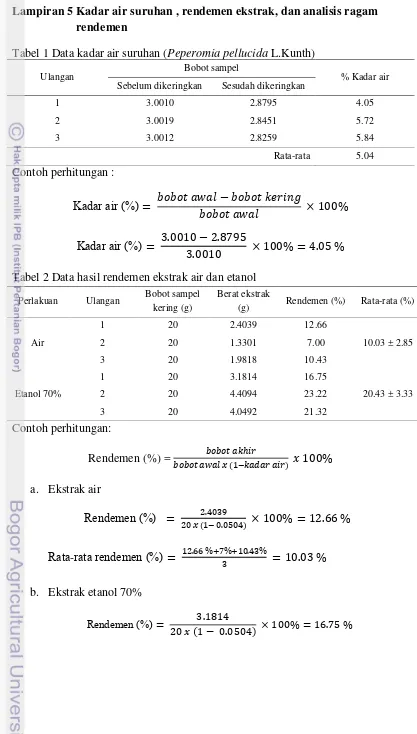
Tabel 1 Data kadar air suruhan (Peperomia pellucida L.Kunth)
Ulangan Bobot sampel % Kadar air
Sebelum dikeringkan Sesudah dikeringkan
1 3.0010 2.8795 4.05
2 3.0019 2.8451 5.72
3 3.0012 2.8259 5.84
Rata-rata 5.04
Contoh perhitungan :
adar air ( )
adar air ( )
Tabel 2 Data hasil rendemen ekstrak air dan etanol
Perlakuan Ulangan Bobot sampel kering (g)
Berat ekstrak
(g) Rendemen (%) Rata-rata (%)
Air
1 20 2.4039 12.66
10.03 ± 2.85
2 20 1.3301 7.00
3 20 1.9818 10.43
Etanol 70%
1 20 3.1814 16.75
20.43 ± 3.33
2 20 4.4094 23.22
3 20 4.0492 21.32
Contoh perhitungan:
Rendemen (%) =
a.
Ekstrak air
endemen ( )
ata
-
rata rendemen ( )
b.
Ekstrak etanol 70%
endemen ( )
ata rata rendemen ( )
Tabel 3 Hasil analisis ragam rendemen ekstrak suruhan
Sumber
Keragaman Jumlah Kuadran Derajat Bebas
Kuadran
Tengah F Hitung
Nilai P (P Value)
Perlakuan 146.52 1 146.52 16.985 0.015
Galat 34.506 4 8.627
Total 181.027 5
Lampiran 6 Perhitungan inhibisi dan IC
50ekstrak suruhan
I.
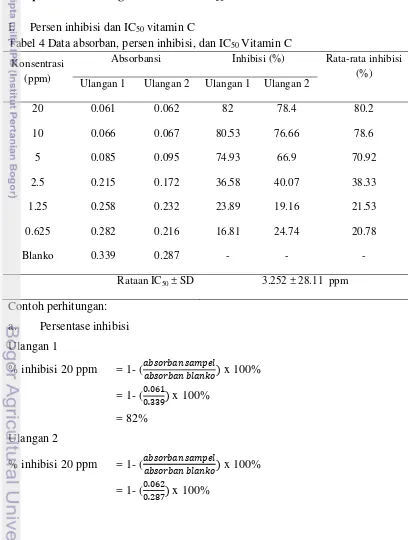
Persen inhibisi dan IC
50vitamin C
Tabel 4 Data absorban, persen inhibisi, dan IC
50Vitamin C
Konsentrasi
(ppm)
Absorbansi
Inhibisi (%)
Rata-rata inhibisi
(%)
Ulangan 1
Ulangan 2
Ulangan 1
Ulangan 2
20
0.061
0.062
82
78.4
80.2
10
0.066
0.067
80.53
76.66
78.6
5
0.085
0.095
74.93
66.9
70.92
2.5
0.215
0.172
36.58
40.07
38.33
1.25
0.258
0.232
23.89
19.16
21.53
0.625
0.282
0.216
16.81
24.74
20.78
Blanko
0.339
0.287
-
-
-
Rataan IC
50± SD
3.252 ± 28.11 ppm
Contoh perhitungan:
a.
Persentase inhibisi
Ulangan 1
% inhibisi 20 ppm
= 1- (
x 100%
= 1- (
x 100%
= 82%
Ulangan 2
% inhibisi 20 ppm
= 1- (
x 100%
= 1- (
= 78.40%
ata rata inhibisi( )
b.
IC50
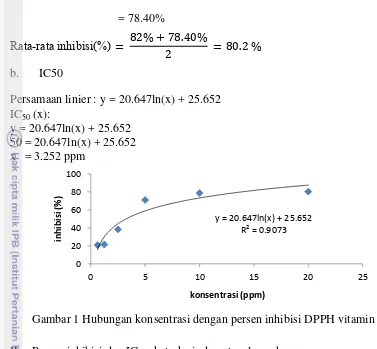
Persamaan linier : y = 20.647ln(x) + 25.652
IC
50(x):
[image:30.595.103.480.74.423.2]y = 20.647ln(x) + 25.652
50 = 20.647ln(x) + 25.652
x = 3.252 ppm
Gambar 1 Hubungan konsentrasi dengan persen inhibisi DPPH vitamin C
II.
Persen inhibisi dan IC
50ekstrak air dan etanol suruhan
Tabel 5 Data absorbans sampel dan blanko menggunakan DPPH
konsentrasi absorbansi sampel
air 1 air 2 air 3 etanol 1 etanol 2 etanol 3
50 0.409 0.47 0.453 0.431 0.42 0.41
100 0.35 0.342 0.31 0.319 0.332 0.327 200 0.212 0.289 0.335 0.252 0.304 0.328
300 0.19 0.213 0.242 0.202 0.218 0.272 400 0.174 0.184 0.196 0.192 0.197 0.216 blanko 0.475 0.493 0.458 0.497 0.471 0.465
Tabel 6 Data persentase inhibisi dan IC
50masing-masing sampel
konsentrasi % Inhibisi
air 1 air 2 air 3 Rerata etanol 1 etanol 2 etanol 3 Rerata
50 13.89 4.67 1.09 6.55 13.28 10.83 1.83 11.98
100 26.32 30.63 32.31 29.75 35.81 29.51 29.68 31.67 200 55.37 41.38 26.86 41.2 49.3 35.46 29.46 38.07 300 60 56.79 47.16 54.65 59.36 53.72 41.15 51.41 400 63.37 62.68 57.21 61.09 61.37 58.17 53.55 57.7
Rataan
IC50 ± SD 256.67 ± 21.65 ppm 297.79 ± 17.75 ppm
y = 20.647ln(x) + 25.652 R² = 0.9073
0 20 40 60 80 100
0 5 10 15 20 25
in
h
ib
isi
(
%
)
Contoh Perhitungan:
a.
Persentase inhibisi
Ekstrak air
Ulangan 1
% inhibisi 400 ppm = 1- (
x 100%
= 1- (
x 100%
= 63.37%
Ulangan 2
% inhibisi 400 ppm = 1- (
x 100%
= 62.68%
Ulangan 3
% inhibisi 400 ppm = 1- (
x 100%
= 57.51%
Ekstrak etanol
Ulangan 1
% inhibisi 400 ppm = 1- (
x 100%
= 1- (
x 100%
= 61.37%
Ulangan 2
% inhibisi 400 ppm = 1- (
x 100%
= 58.17%
Ulangan 3
% inhibisi 400 ppm = 1- (
x 100%
= 53.55%
b.
IC
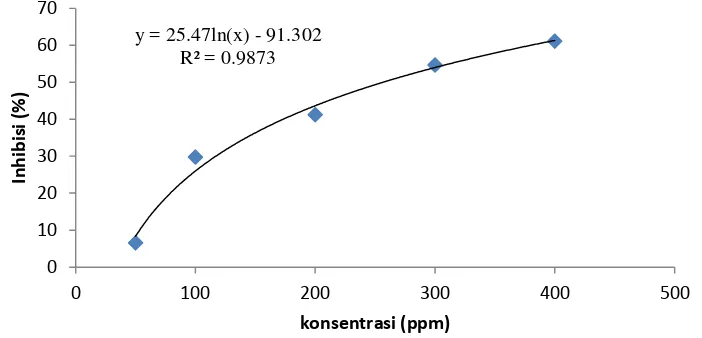
50Ekstrak air
Persamaan linier : y = 25.47ln(x)
–
91.302
IC
50(x):
Ekstrak etanol
Persamaan linier : y = 20.721ln(x)
–
67.684
IC
50(x):
Gambar 2 Hubungan konsentrasi dengan persen inhibisi DPPH ekstrak air
suruhan
Gambar 3 Hubungan konsentrasi dengan persen inhibisi DPPH ekstrak etanol
suruhan
Gambar 4 Hasil uji antioksidan dengan metode DPPH
y = 25.47ln(x) - 91.302 R² = 0.9873
0 10 20 30 40 50 60 70
0 100 200 300 400 500
In
h
ib
isi
(
%
)
konsentrasi (ppm)
y = 20.721ln(x) - 67.684 R² = 0.9724
0 10 20 30 40 50 60
0 100