PROFIL IMUNOHISTOKIMIA ANTIOKSIDAN
SUPEROKSIDA DISMUTASE (SOD) PADA USUS HALUS
TIKUS YANG DIBERI PROBIOTIK DAN
ENTEROPATHOGENIC E. coli (EPEC)
SRI RAHMATUL LAILA
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
ABSTRACT
SRI RAHMATUL LAILA. Immunohistochemical Profiles of Antioxidant Superoxide Dismutase (SOD) in Small Intestine of Probiotic and Enteropathogenic E. coli (EPEC)-treated Rats. Under direction of TUTIK WRESDIYATI.
Dismutase (SOD) pada Usus Halus Tikus yang Diberi Probiotik dan Enteropathogenic E. coli (EPEC). Dibimbing oleh TUTIK WRESDIYATI.
Saluran pencernaan merupakan bagian tubuh yang sering terpapar oleh benda asing termasuk agen patogen. Keberadaan patogen di dalam saluran pencernaan bisa mengakibatkan berbagai penyakit, seperti diare. Penyebab utama diare pada anak-anak di Indonesia ialah enteropathogenic Escherichia coli
(EPEC) yang prevalensinya mencapai 55%. Infeksi EPEC akan menyebabkan peradangan dan menimbulkan radikal bebas yang dapat merusak sel-sel tubuh.
Belakangan ini, upaya yang dilakukan masyarakat untuk mengatasi gangguan saluran pencernaan, yaitu dengan mengonsumsi probiotik. Kemampuan probiotik dalam mencegah infeksi pada saluran pencernaan sudah banyak diteliti. Namun belum diketahui efek probiotik terhadap profil antioksidan superoksida dismutase sebagai pertahanan terhadap radikal bebas pada usus halus.
Penelitian ini bertujuan untuk menganalisis pengaruh probiotik
Lactobacillus plantarum dan Lactobacillus fermentum terhadap gambaran histologi dan profil imunohistokimia enzim antioksidan copper,zinc superoksida dismutase (Cu,Zn-SOD) pada usus halus tikus yang dipapar enteropathogenic E. coli (EPEC).
Tikus yang digunakan pada penelitian ini berjumlah 90 ekor yang dibagi ke dalam 6 kelompok, yaitu; kelompok kontrol negatif (A), kelompok perlakuan L. plantarum (B), kelompok perlakuan L. fermentum (C), kelompok perlakuan L. plantarum + EPEC (D), kelompok perlakuan L. fermentum + EPEC (E), dan kelompok perlakuan EPEC atau kontrol positif (F). Pemberian probiotik kepada kelompok tikus perlakuan B, C, D, dan E dilakukan selama tiga minggu. Pada kelompok tikus perlakuan D, E, dan F diberikan cekok tambahan EPEC pada minggu kedua. Gambaran histologi usus halus tikus dilihat pada preparat yang diwarnai dengan hematoksilin-eosin, sedangkan kandungan enzim antioksidan Cu,Zn-SOD dilihat pada preparat usus halus yang diwarnai dengan pewarnaan imunohistokimia menggunakan monoklonal antibodi Cu,Zn-SOD.
PROFIL IMUNOHISTOKIMIA ANTIOKSIDAN
SUPEROKSIDA DISMUTASE (SOD) PADA USUS HALUS
TIKUS YANG DIBERI PROBIOTIK DAN
ENTEROPATHOGENIC E. coli (EPEC)
SRI RAHMATUL LAILA
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada
Fakultas Kedokteran Hewan
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa skripsi dengan judul Profil Imunohistokimia Antioksidan Superoksida Dismutase (SOD) pada Usus Halus Tikus yang Diberi Probiotik dan Enteropathogenic E. coli (EPEC) adalah karya saya dengan arahan dari pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Juli 2011
Sri Rahmatul Laila
© Hak Cipta milik IPB, tahun 2011
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
Nama : Sri Rahmatul Laila
NIM : B04070072
Disetujui
Prof. drh. Tutik Wresdiyati, Ph.D, PAVet Ketua
Diketahui
Dr. Nastiti Kusumorini
Wakil Dekan Fakultas Kedokteran Hewan
PRAKATA
Segala puji dan syukur sebesar-besarnya penulis ucapkan kepada Allah SWT atas segala rahmat dan hidayah-Nya berupa kekuatan lahir dan batin sehingga skripsi ini dapat diselesaikan. Judul skripsi ini ialah Profil Imunohistokimia Antioksidan Superoksida Dismutase (SOD) pada Usus Halus Tikus yang Diberi Probiotik dan Enteropathogenic E. coli (EPEC) yang dilaksanakan di Laboratorium SEAFAST Center IPB dan Laboratorium Histologi FKH IPB pada bulan Juni 2009 sampai Juli 2010.
Terimakasih penulis sampaikan kepada Ibu Prof. drh. Tutik Wresdiyati, Ph.D, PAVet selaku dosen pembimbing atas waktu, arahan, kritik, dan saran yang mendukung terselesaikannya skripsi ini dengan baik. Terimakasih kepada Direktorat Penelitian dan Pengabdian kepada Masyarakat, Direktorat Jenderal Pendidikan Tinggi, Kementerian Pendidikan Nasional RI, yang telah memberikan dana penelitian melalui Hibah Kompetensi, atas nama Prof. Dr. Ir. Made Astawan, MS. Terimakasih atas kerjasama dan bimbinganya saya ucapkan kepada semua peneliti yang terlibat dalam tim penelitian ini: Prof. Dr. Ir. Made Astawan, MS (FATETA); Dr. Ir. Irma Isnafia Arief (FAPET); dan Prof. drh. Tutik Wresdiyati, Ph.D, PAVet (FKH). Tidak lupa juga penulis mengucapkan banyak terimakasih kepada Bapak drh. Adi Winarto, Ph.D dan Bapak drh. I Ketut Mudite Adnyane, M.Si atas bantuan dan dukungannya selama penelitian. Penulis juga ingin menyampaikan terima kasih kepada laboran Bapak Maman Suparman dan Bapak Iwan Rochmana yang telah banyak membantu penelitian ini. Kepada teman-teman satu penelitian (Fenny Fitrian Utami, Kristina Dwi Wulandari, dan Yeni Setiorini) penulis berterimakasih atas kerjasama dan bantuannya selama penelitian.
Ucapan terima kasih juga disampaikan kepada Apa, Ibu, Kakak, dan Adik tersayang (H. Drs. Hendri Lefi, Hj. Dice Farida, Wilmas Herdifa, S.IP, Dwipa Maherdi, dan Irfani Rahmi), serta keluarga besar atas doa, semangat, dan cinta yang telah diberikan. Selanjutnya terimakasih penulis ucapkan kepada keluarga besar Ikatan Pelajar dan Mahasiswa Minang (IPMM) Bogor dan teman-teman Angkatan 44 Fakultas Kedokteran Hewan Institut Pertanian Bogor (Gianuzzi FKH IPB) yang sama-sama berjuang dalam menempuh pendidikan di FKH IPB.
Penulis menyadari penulisan skripsi ini tidak luput dari kekurangan, untuk itu penulis sangat berterimakasih atas kritik dan saran-saran yang bersifat membangun dari semua pihak demi kesempurnaan skripsi ini. Semoga skripsi ini dapat bermanfaat.
Bogor, Juli 2011
dari ayah H. Drs. Hendri Lefi dan ibu Hj. Dice Farida. Penulis merupakan anak ketiga dari empat bersaudara.
Pendidikan formal penulis dimulai dari SD N 1 Muara Panas Kab. Solok hingga lulus pada tahun 2001, yang kemudian dilanjutkan ke SMP N 1 Kota Solok dan lulus pada tahun 2004. Pendidikan SMA penulis selesaikan di SMA N 1 Kota Solok dan lulus pada tahun 2007, kemudian melanjutkan ke IPB pada tahun yang sama melalui jalur Undangan Seleksi Masuk IPB (USMI). Mayor yang dipilih penulis ialah Kedokteran Hewan, Fakultas Kedokteran Hewan, Institut Pertanian Bogor (FKH IPB).
DAFTAR ISI
Potensi BAL sebagai probiotik pada saluran pencernaan ... 8
Enterpathogenic E. coli (EPEC) ... 9
Radikal bebas dan antioksidan ... 11
Imunohistokimia dan Cu,Zn-SOD ... 12
Penelitian pendahuluan ... 14
Perlakuan terhadap hewan percobaan dan sampling .... 21
Pemrosesan jaringan ... 22
Pewarnaan ... 23
Pewarnaan hematoksilin-eosin (HE) ... 23
Pewarnaan imunohistokimia cooper,zinc superoxide dismutase Cu,Zn-SOD ... 23
Analisis data ... 24
Histologi jaringan usus halus ... 25
Kandungan Cu,Zn-SOD jaringan usus halus ... 39
SIMPULAN DAN SARAN ... 54
Simpulan ... 54
Saran ... 54
DAFTAR PUSTAKA ... 55
DAFTAR GAMBAR
Halaman 1 Histologi usus halus ... 5 2 Bentuk infeksi EPEC pada epitel usus ... 10 3 Struktur ikatan antigen-antibodi pada pewarnaan imunohistokimia 13 4 Prinsip pewarnaan imunohistokimia metode perokdidase ... 13 5 Saluran pencernaan pada tikus ... 17 6 Bagan alur penelitian ... 19 7 Fotomikrograf hasil pewarnaan hematoksilin-eosin pada duodenum
tikus hari ke-8 ... 27 8 Fotomikrograf hasil pewarnaan hematoksilin-eosin pada jejunum
tikus hari ke-8 ... 28 9 Fotomikrograf hasil pewarnaan hematoksilin-eosin pada ileum tikus
hari ke-8 ... 29 10 Fotomikrograf hasil pewarnaan hematoksilin-eosin pada duodenum
tikus hari ke-15 ... 32 11 Fotomikrograf hasil pewarnaan hematoksilin-eosin pada jejunum
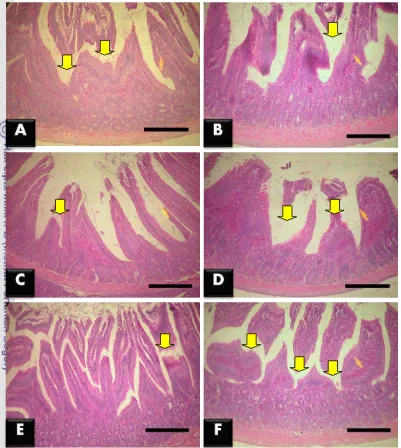
tikus hari ke-15 ... 33 12 Fotomikrograf hasil pewarnaan hematoksilin-eosin pada ileum tikus
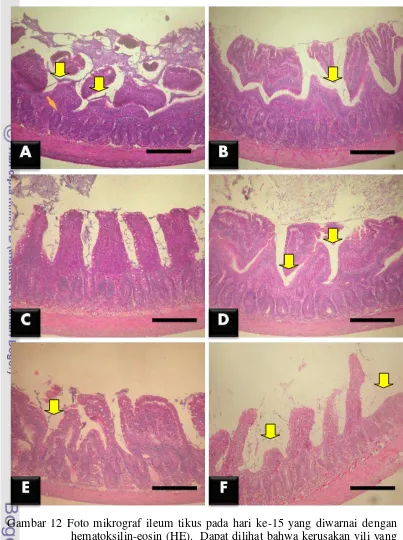
hari ke-15 ... 34 13 Fotomikrograf hasil pewarnaan hematoksilin-eosin pada duodenum
tikus hari ke-22 ... 36 14 Fotomikrograf hasil pewarnaan hematoksilin-eosin pada jejunum
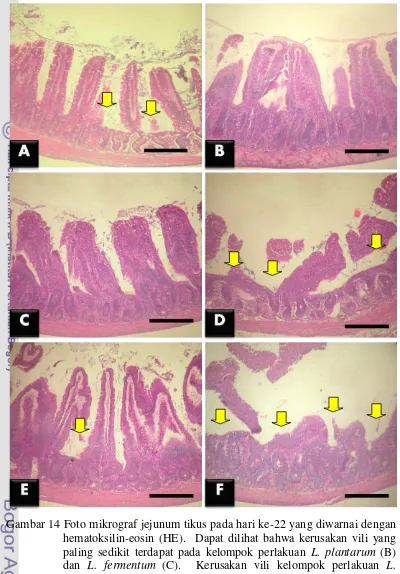
tikus hari ke-22 ... 37 15 Fotomikrograf hasil pewarnaan hematoksilin-eosin pada ileum tikus
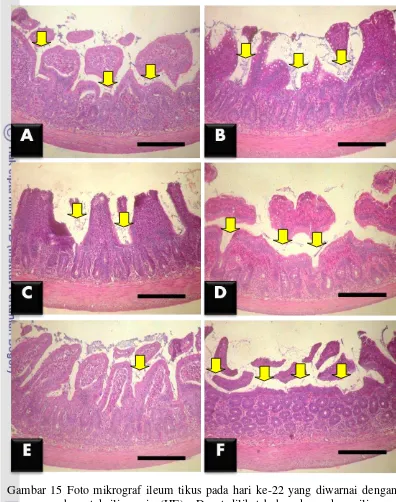
hari ke-22 ... 38 16 Fotomikrograf hasil pewarnaan imunohistokimia Cu,Zn-SOD
duodenum tikus pada hari ke-8 ... 42 17 Fotomikrograf hasil pewarnaan imunohistokimia Cu,Zn-SOD
jejunum tikus pada hari ke-8 ... 43 18 Fotomikrograf hasil pewarnaan imunohistokimia Cu,Zn-SOD ileum
tikus pada hari ke-8 ... 44 19 Fotomikrograf hasil pewarnaan imunohistokimia Cu,Zn-SOD
duodenum tikus pada hari ke-15 ... 46 20 Fotomikrograf hasil pewarnaan imunohistokimia Cu,Zn-SOD
tikus pada hari ke-15 ... 48 22 Fotomikrograf hasil pewarnaan imunohistokimia Cu,Zn-SOD
duodenum tikus pada hari ke-22 ... 50 23 Fotomikrograf hasil pewarnaan imunohistokimia Cu,Zn-SOD
jejunum tikus pada hari ke-22 ... 51 24 Fotomikrograf hasil pewarnaan imunohistokimia Cu,Zn-SOD ileum
DAFTAR TABEL
Halaman 1 Komposisi campuran ransum basal tikus ... 21 2 Kelompok tikus perlakuan ... 21 3 Data persentase kerusakan vili usus halus ... 26 4 Kandungan enzim Cu,Zn-SOD pada jaringan usus halus tikus
Halaman 1 Diagram alir pembuatan sediaan (preparat) untuk pewarnaan HE dan
imunohistokimia Cu,Zn-SOD dari organ usus halus tikus percobaan 62 2 Diagram alir pewarnaan HE pada sediaan (preparat) usus halus tikus
percobaan ... 63 3 Diagram alir pewarnaan sediaan (preparat) secara imunohistokimia
untuk analisis Cu, Zn-SOD dari usus halus tikus percobaan ... 64 4 Uji statistik (ANOVA) dengan SPSS untuk kerusakan vili
duodenum pada hari ke-8 ... 66 5 Uji statistik (ANOVA) dengan SPSS untuk kerusakan vili jejunum
pada hari ke-8 ... 67 6 Uji statistik (ANOVA) dengan SPSS untuk kerusakan vili ileum
pada hari ke-8 ... 68 7 Uji statistik (ANOVA) dengan SPSS untuk kerusakan vili
duodenum pada hari ke-15 ... 69 8 Uji statistik (ANOVA) dengan SPSS untuk kerusakan vili jejunum
pada hari ke-15 ... 70 9 Uji statistik (ANOVA) dengan SPSS untuk kerusakan vili ileum
pada hari ke-15 ... 71 10 Uji statistik (ANOVA) dengan SPSS untuk kerusakan vili
duodenum pada hari ke-22 ... 72 11 Uji statistik (ANOVA) dengan SPSS untuk kerusakan vili jejunum
pada hari ke-22 ... 73 12 Uji statistik (ANOVA) dengan SPSS untuk kerusakan vili ileum
PENDAHULUAN
1. Latar belakang
Saluran pencernaan merupakan bagian tubuh yang sering terpapar oleh benda asing termasuk agen patogen. Keberadaan patogen di dalam saluran pencernaan bisa mengakibatkan berbagai penyakit, salah satunya diare (Schiller & Sellin 2006). Departemen Kesehatan RI melaporkan setiap anak di Indonesia mengalami diare 1.6-2 kali dalam setahun (Prasetyo & Fadlyana 2004). Belakangan ini, upaya masyarakat untuk mengurangi penyakit saluran pencernaan di antaranya dengan mengonsumsi pangan fungsional. Definisi pangan fungsional menurut American Dietetic Association ialah semua makanan yang tidak dimodifikasi maupun dimodifikasi yang memiliki manfaat kesehatan melebihi nutrisi pokok (Hasler et al. 2004).
Pangan fungsional yang berkhasiat untuk saluran pencernaan dan banyak diminati oleh masyarakat ialah probiotik. Menurut FAO/WHO (2006), probiotik yaitu mikroorganisme hidup yang jika diberikan dalam jumlah memadai akan menimbulkan manfaat kesehatan bagi inangnya atau ketika dikonsumsi dalam jumlah yang cukup sebagai bagian dari pangan, akan memberikan manfaat kesehatan bagi inangnya. Probiotik telah terbukti efektif dalam mencegah dan mengontrol berbagai penyakit seperti diare (Patricia 2009), infeksi Helicobacter pylori, alergi makanan, dan laktosa intoleran (Zubillaga et al. 2001). Oleh sebab itu, konsumsi probiotik dirasa perlu untuk menunjang kesehatan, khususnya kesehatan saluran pencernaan.
Probiotik yang sering digunakan pada produk pangan komersial, yaitu bakteri asam laktat (BAL) jenis Lactobacillus dan Bifidobacterium (Saulnier et al.
2009; Miyazaki et al. 2010). Arief et al. (2008) telah menemukan 10 BAL isolat lokal yang diambil dari daging sapi peranakan Ongol yang dijual di beberapa pasar tradisional di daerah Bogor, Jawa Barat. Bakteri asam laktat yang ditemukan tersebut telah diuji secara in vitro mempunyai potensi sebagai probiotik. Hasil penelitian Astawan et al. (2009) menunjukkan ada dua bakteri terbaik dari 10 jenis BAL tersebut, yaitu Lactobacillus plantarum dan
BAL isolat lokal ini perlu dilakukan, di antaranya eksplorasi mengenai potensi BAL ini dalam menjaga kondisi kesehatan usus halus dari paparan patogen.
Pada saluran pencernaan, khususnya usus halus, patogen yang sering menyebabkan gangguan adalah enteropathogenic Escherichia coli (EPEC).
Seperti yang dilaporkan Kang et al. (2006) bahwa di negara berkembang, sebagian besar diare akut pada manusia disebabkan oleh E. coli yang bersifat patogen. Budiarti (1997) menyatakan bahwa penyebab utama diare pada anak-anak di Indonesia ialah EPEC yang prevalensinya mencapai 55%. Selain menyebabkan diare, infeksi EPEC pada mukosa usus halus juga menyebabkan inflamasi dan peningkatan aktifitas fagositosis oleh sel radang. Dalam peristiwa fagositosis, makrofag menghasilkan dan melepaskan molekul mikrobisidal berupa radikal bebas (Roitt 2002). Radikal bebas yang terbentuk ini terakumulasi dan dapat menimbulkan kondisi stres oksidatif (Halliwell & Gutteridge 1999). Stress oksidatif akan merusak sel-sel tubuh (Jones 2008).
Radikal bebas dapat dinetralisir oleh antioksidan. Superoksida dismutase (SOD) merupakan antioksidan endogen berbentuk enzim yang diproduksi oleh sel-sel tubuh. Enzim SOD terdiri atas tiga bentuk, yaitu copper,zinc superoxide dismutase (Cu,Zn-SOD), manganese superoxide dismutase (Mn-SOD), dan
extracelular superoxide dismutase (ECSOD) (Miao et al. 2009). Keberadaan enzim SOD di dalam jaringan merupakan cerminan pertahanan jaringan tersebut. Enzim SOD bekerja spesifik untuk mengeliminasi radikal bebas anion superoksida (Carroll et al. 2007).
Sejauh ini, informasi mengenai manfaat probiotik dari jenis Lactobacillus
3
dan meningkatkan kesehatan usus halus. Hal tersebut dapat dilihat dari morfologi jaringan usus halus secara mikroskopis (histologi) dan gambaran imunohistokimia kandungan enzim Cu,Zn-SOD di dalam jaringan usus halus.
2. Tujuan
1. Usus halus
Usus halus merupakan bagian dari saluran pencernaan manusia yang terletak di antara lambung dan usus besar. Dinding usus halus kaya akan pembuluh darah yang mengangkut zat-zat nutrisi menuju hati melalui vena porta. Dinding usus halus melepaskan lendir yang melumasi isi usus dan air yang membantu melarutkan pecahan-pecahan makanan yang dicerna. Dinding usus halus juga melepaskan sejumlah kecil enzim yang membantu proses pencernaan (Guyton et al. 2002).
Usus halus manusia terdiri atas beberapa lapisan, yaitu lapisan mukosa, lapisan otot melingkar, lapisan otot memanjang, dan lapisan serosa (David et al.
2006). Usus halus pada manusia dan hewan (mamalia dan unggas) memiliki lipatan mukosa yang disebut vili (Gambar 1). Vili usus halus manusia memiliki tinggi 0.5-1.5 mm, terbentuk di permukaan mukosa. Vili tersusun atas kumpulan
sel epitel silindris sebaris yang berjejer dan jaringan ikat longgar lamina propria. Sel epitel manusia memiliki mikrovili di permukaannya dengan panjang 1 µm dan diameter 0.1 µm. Mikrovili berfungsi untuk menyerap nutrisi (Jonqueira & Carneiro 2005). Kerusakan mikrovili dan atropi vili usus halus dapat mengganggu penyerapan nutrisi (malabsorbtion syndrome). Di bagian bawah vili, baik pada manusia maupun hewan (mamalia dan unggas) terdapat kripta dan kelenjar Liberkun yang terdiri atas stem sel, sel goblet, sel Panet, dan enteroendokrin sel (Jonqueira & Carneiro 2005; Samuelson 2007).
5
Secara histologis, duodenum pada manusia maupun hewan memiliki jumlah vili yang banyak, tinggi, dan berbentuk seperti lembaran daun. Duodenum juga memiliki kripta dan kelenjar Liberkun dengan jumlah dan keadaan yang paling baik. Selain itu, terdapat kelenjar submukosa (Brunner). Jejunum hampir mirip dengan duodenum tetapi vilinya lebih kecil dan lebih sedikit. Di jejunum tidak terlalu nampak adanya kelenjar submukosa (Brunner) namun jejunum memiliki banyak sel goblet pada permukaan vilinya. Ileum adalah bagian akhir dari usus halus, bentuk vilinya seperti ibu jari dengan jumlah kelenjar Liberkun yang sedikit. Ileum memiliki lebih sedikit sel goblet namun dilengkapi dengan jaringan limfatik yang besar yaitu daun Peyer (Jonqueira & Carneiro 2005; Samuelson 2007).
Gambar 1 Histologi usus halus (Samuelson 2007).
miosin yang berfungsi untuk pergerakan mikrovili, serta mengandung jaringan terminal sebagai reseptor perlekatan mikroba (Inamoto et al. 2008).
Sejak lahir, usus halus pada manusia dan hewan terus ditantang oleh antigen terutama dari kontaminasi makanan. Karena permukaan usus halus yang sangat luas (akibat involusi kompleks kripta dan vili), saluran usus halus rentan sebagai tempat kolonisasi dan masuknya agen patogen. Beberapa patogen menyerang permukaan epitel dan yang lain menyerang hingga menembus epitel. Pertahanan fisik pada usus halus manusia dan hewan di antaranya adalah lapisan epitel, mikroflora normal, dan lendir yang disekresikan oleh sel goblet. Lendir di permukaan mukosa akan mencegah patogen menyerang epitel (David et al. 2006).
2. Mikroflora usus halus
Terkait fungsinya, usus halus manusia dan hewan memiliki komponen mikroflora normal yang menunjang proses pencernaan makanan. Keseimbangan mikroflora normal usus halus sangat penting untuk menjaga kesehatan saluran pencernaan. Usus halus manusia mengandung sekitar 100 spesies bakteri sebagai mikroflora. Mikroflora ini dapat tumbuh pada kondisi aerob maupun anaerob dan berkoloni pada bagian-bagian tetentu dari organ pencernaan manusia (Turroni 2009). Pada hewan tikus, telah dilaporkan jumlah populasi mikroflora normal
pada usus halusnya sebesar 1014 cfu (colony forming unit), terdiri atas 0-105 cfu di jejunum dan 103-109 cfu di ileum (Qi et al. 2008).
Kolonisasi mikroflora usus halus pada manusia maupun hewan dimulai segera setelah lahir. Ada beberapa kontribusi dari mikroflora normal usus terhadap pertahanan tubuh, misalnya mencegah kolonisasi patogen dengan bersaing mendapatkan tempat dan nutrisi penting. Selain itu, mikroflora tersebut juga dapat memproduksi zat yang menghambat maupun membunuh bakteri patogen (David et al. 2006). Beberapa penelitian menunjukkan bahwa mikroflora usus yang seimbang dapat menstimulasi sistem imun, memproduksi enzim pencernaan, dan membantu mengontrol pembentukan radikal bebas (Dutcosky et al. 2006).
7
maupun hewan. Komposisi mikroflora normal usus pada manusia dapat dipengaruhi oleh usia, makanan, kontaminasi bakteri, dan kondisi tubuh (stres) (David et al. 2006). Menurut Lourens-Hattingh dan Viljoen (2001), mikroflora pada usus individu dewasa relatif stabil, namun akan kembali berubah seiring bertambahnya usia. Oleh sebab itu, keseimbangan mikroflora ini perlu tetap dijaga.
3. Probiotik dan BAL
Istilah probiotik pertama kali dikemukakan oleh Lilley dan Stiwell yang mendefinisikan probiotik sebagai senyawa yang dihasilkan mikroba untuk menstimulasi pertumbuhan mikroba lainya. Kemudian definisi probiotik berkembang menjadi organisme atau senyawa yang memiliki kontribusi terhadap keseimbangan mikroflora saluran pencernaan. Definisi lainya dari probiotik adalah sediaan sel mikroba hidup atau komponen dari sel mikroba yang memiliki pengaruh menguntungkan terhadap kesehatan dan kehidupan inangnya (Salminen
et al. 1999). Definisi probiotik terbaru dikeluarkan oleh FAO/WHO (2006), yaitu mikroorganisme hidup yang jika diberikan dalam jumlah memadai akan memberikan manfaat kesehatan bagi inangnya, atau ketika dikonsumsi dalam jumlah yang cukup sebagai bagian dari pangan, akan memberikan manfaat
kesehatan bagi inangnya.
Probiotik dapat berupa bakteri gram positif, negatif, khamir, dan fungi. Probiotik biasanya dimasukkan ke dalam pangan fermentasi yang berbasis susu. Probiotik dapat dijadikan alternatif untuk mengobati infeksi saluran pencernaan dan untuk mencegah diare. Manfaat kesehatan dari probiotik, yaitu kemampuannya memelihara keseimbangan mikroflora normal usus, menghambat bakteri patogen, dan meningkatkan sistem imun (Rolfe 2000).
pada produk pangan komersial, yaitu Lactobacillus dan Bifidobacterium (Saulnier
et al. 2009; Miyazaki et al. 2010).
Probiotik dikembangkan sebagai pangan yang mendukung kesehatan manusia. Fungsinya untuk pencegahan dan pengobatan penyakit di saluran pencernaan seperti diare, gastroenteritis, laktosa intoleran, dan kanker kolon (Yan & Polk 2008). BAL dari genus Lactobacillus dan Bifidobacteria telah terbukti memiliki efek sebagai probiotik pada manusia. Beberapa Lactobacillus dapat menghambat bakteri patogen, seperti E. coli, Salmonella Enteritidis, dan Vibrio cholera (Liong 2007).
Yan dan Polk (2008) mengemukakan manfaat probiotik bagi saluran pencernaan, yaitu; (1) meningkatkan pencernaan dan penyerapan nutrisi, (2) memelihara keseimbangan mikroflora usus, (3) mengatur crosstalk antara epitel usus dengan sistem imun, dan (4) mengatur fungsi imun. Berdasarkan penelitian Harimurti dan Rahayu (2009), probiotik dapat meningkatkan tinggi dan lebar vili pada usus halus ayam broiler sebagai hewan percobaanya. Hal ini disebabkan oleh peningkatan asam lemak rantai pendek dari hasil fermentasi oleh probiotik. Asam lemak rantai pendek beperan dalam stimulasi perbanyakan sel epitel usus karena asam lemak ini merupakan komponen fosfolipid membran sel.
4. Potensi BAL sebagai probiotik pada saluran pencernaan
Aktivitas probiotik BAL sangat penting dalam mengatur keseimbangan ekosistem saluran pencernaan. Menurut Naidu dan Clemens (2000), aktivitas probiotik BAL terbagi atas tiga spektrum yaitu nutrisi, fisiologi, dan efek antimikroba. Dalam spektrum nutrisi, BAL menyediakan enzim untuk membantu metabolisme komponen laktosa dalam makanan, sintesis beberapa vitamin (vitamin K, folat, piridoksin, pantotenat, biotin, dan ribovlavin) serta menghilangkan racun metabolit dari makanan di dalam usus. Pada spektrum fisiologi, BAL mampu menjaga keseimbangan komposisi mikroflora normal usus dan menstimulasi sistem kekebalan di usus. Dalam spektrum antimikroba, BAL mampu memperbaiki ketahanan tubuh terhadap bakteri patogen.
9
empedu, (3) memproduksi senyawa antimikroba, (4) mampu menempel pada sel usus manusia serta tumbuh dan berkembang baik dalam saluran pencernaan, dan (5) dapat berkoagregasi membentuk lingkungan mikroflora normal yang seimbang dalam saluran pencernaan. Kemampuan BAL untuk hidup di dalam saluran pencernaan dapat menekan pertumbuhan bakteri patogen sehingga bisa dimanfaatkan untuk menjaga kesehatan saluran pencernaan. Inilah alasanya BAL berpotensi sebagai probiotik.
Jumlah minimal sel bakteri yang memenuhi syarat sebagai probiotik sampai sekarang masih dalam kontroversi. Di Jepang, Fermented Milks And Lactic Acid Bacteria Association mensyaratkan jumlah minimal untuk probiotik adalah 1x107 cfu Bifidobacteria /g atau /ml produk. Penelitian Galdeano dan Perdigon (2006) menunjukkan sebanyak 1x108 cfu Lactobacillus cassei bisa meningkatkan pertahanan alami mukosa usus. Penelitian lain menyatakan jumlah probiotik
Lactobacillus acidophillus dan Bifidobacterium bifidum yang dapat digunakan untuk terapi gastritis dan duodenitis adalah 1x109 cfu (Zubillaga et al. 2001). Namun jumlah sel yang ditetapkan di atas masih dalam rentang yang dikemukakan oleh Lee dan Salminen (2009) yaitu sebanyak 107-1010 cfu.
5. EnteropatogenicE. coli (EPEC)
Escherichia coli merupakan bakteri gram negatif yang berbentuk batang lurus, berukuran 1.1-1.5 µm x 2.0-6.0 µm, tidak berspora dan bersifat fakultatif anaerobik. Bakteri ini memiliki pili, fimbia, dan flagella peritrikus. Suhu optimum untuk E. coli adalah 37 ºC. Bakteri E. coli adalah flora normal saluran pencernaan, namun ada beberapa strain E. coli yang bersifat patogen (Evans & Evans 2001).
Berdasarkan gen virulensi, E. coli dibedakan atas lima tipe, yaitu enterotoxigenic E. coli (ETEC), enteroinvasive E. coli (EIEC), enterohemorrhagic E. coli (EHEC), enteropatogenic E. coli (EPEC), dan enteroaggregative E. coli
(EAggEC). Bakteri EPEC didefinisikan sebagai bakteri yang memiliki karakteristik berikut: (1) kemampuan menimbulkan diare, (2) kemampuan membentuk lesio pedestal sebagai akibat dari aktivitas attaching and effacing
(verocytotoxin). Semua tipe E. coli (kecuali ETEC) bersifat invasif (David et al.
2006). Bakteri EPEC yang bersifat invasif menyebabkan diare sekaligus inflamasi pada mukosa usus (Lodes et al. 2004).
Pada usus halus, EPEC berikatan secara kuat pada permukaan epitel vili sehingga merusak mikrovili, dikenal dengan istilah “attaching and effacing”
(A/E) (Grüenheid et al. 2001). Patogenesa infeksi EPEC diawali dengan perlekatan bundle-forming pilus (BFP) pada permukaan sel epitel diikuti sekresi faktor virulen Tir (translicated intimin receptor). Tir berfungsi sebagai reseptor membran plasma untuk perlekatan EPEC, sehingga EPEC tidak perlu mencari reseptor spesifik pada sel inang (Lowe 2009). EPEC kemudian mengikat Tir melalui protein membran luar (intimin) dan mulai mengeluarkan senyawa proteolitik yang merusak mikrovili.
Setelah menempel dan merusak mikrovili, EPEC mensekresikan senyawa protein untuk merangsang sitoskeleton aktin yang berada di dalam sel epitel berkumpul dan tersusun di permukaan sel membentuk struktur pedestal sebagai tempat bersarangnya EPEC (Gambar 2). Infeksi EPEC juga menyebabkan perubahan konsentrasi kalsium intraseluler (Lu & Walker 2001).
Gambar 2 Bentuk infeksi EPEC pada epitel usus
(
Lu & Walker 2001).11
6. Radikal bebas dan antioksidan
Radikal bebas merupakan suatu atom atau beberapa atom yang memiliki satu atau lebih elektron yang tidak berpasangan pada orbit terluarnya sehingga bersifat sangat labil dan mudah membentuk senyawa baru. Radikal bebas yang terdapat dalam tubuh bisa berasal dari dalam (endogen) maupun dari luar tubuh (eksogen). Radikal bebas endogen merupakan radikal bebas yang terbentuk sebagai respon normal dari peristiwa biokimia di dalam tubuh secara kontinu. Peristiwa biokimia tersebut meliputi reaksi reduksi-oksidasi normal di dalam mitokondria maupun peroksisom, detoksikasi senyawa xenobiotik, metabolisme obat-obatan, dan fagositosis (Halliwell & Gutteridge 1999).
Radikal bebas berasal dari senyawa hidrogen, oksigen, dan logam transisi. Contoh senyawa radikal bebas yaitu reactive oxigen species (ROS) seperti superoksida (O2-), radikal hidroxil (OH), dan hidrogen peroksida (H2O2). Superoksida merupakan radikal bebas yang sangat reaktif dan paling berbahaya bagi sel. Superoksida bersifat reduktan dan oksidan serta dapat bereaksi dengan berbagai substrat biologis. Secara fisiologis, radikal bebas berperan dalam proses transpor elektron, metabolisme tubuh dalam keadaan aerobik, fagositosis, serta sintesis DNA dan protein. Namun jika jumlah radikal bebas terlalu banyak akan mengakibatkan kerusakan pada sel-sel tubuh terutama perubahan makromolekul
seperti DNA, lipid, dan protein (Jones 2008; Evans et al. 2004).
Radikal bebas di dalam tubuh akan menarik elektron dari makromolekul biologis disekitarnya (protein, asam nukleat, DNA, dll) untuk memenuhi keganjilan elektronnya. Makromolekul yang teroksidasi akan terdegradasi dan apabila makromolekul tersebut bagian dari sel maka sel akan rusak. Senyawa radikal bebas akan membentuk pasangan dengan mengambil elektron dari atom molekul lain sehingga menghasilkan senyawa radikal baru yang berbahaya bagi tubuh. Radikal bebas di dalam tubuh biasanya dinetralisir oleh antioksidan endogen. Antioksidan endogen utama pada sel-sel tubuh adalah enzim superoksida dismutase (SOD). Enzim ini bekerja spesifik untuk mengeliminasi radikal bebas anion superoksida (Carroll et al. 2007).
dan menstabilisasi radikal bebas (Margail 2005). Antioksidan dibedakan atas antioksidan endogen dan antioksidan eksogen. Antioksidan endogen umumnya berbentuk enzim, contohnya superoksida dismutase (SOD), katalase, glutation peroksidase, dan glutation reduktase. Antioksidan eksogen contohnya askorbat, tokoferol, dan karoten (Nayak 2001).
Jumlah radikal bebas berpengaruh terhadap kerja antioksidan endogen. Jumlah radikal bebas yang sedikit akan meringankan kerja antioksidan endogen, sehingga antioksidan tersebut bisa dipertahankan di dalam sel. Namun jika radikal bebas terlalu banyak, antioksidan endogen tidak akan mampu menetralisirnya. Kekurangan antioksidan menyebabkan stres oksidatif yang berujung pada kerusakan sel dan menyebabkan timbulnya berbagai macam penyakit degeneratif (penuaan dini, kanker, dll) (Evans et al. 2004).
7. Imunohistokimia dan Cu,Zn-SOD
Imunohistokimia adalah suatu teknik untuk mendeteksi keberadaan berbagai macam komponen yang terdapat di dalam sel atau jaringan dengan menggunakan prinsip reaksi ikatan antigen (Ag) dan antibodi (Ab). Teknik imunohistokimia dapat digunakan untuk mempelajari distribusi enzim spesifik serta mendeteksi keberadaan berbagai komponen aktif yang terdapat di dalam sel atau jaringan
seperti protein dan karbohidrat (Furuya et al. 2004).
13
Gambar 3 Struktur ikatan antigen-antibodi pada pewarnaan imunohistokimia; metode langsung (kiri) dan metode tidak langsung (kanan) (Ramos & Vara 2005).
Prinsip pewarnaan imunohistokimia metode peroksidase, yaitu antigen yang ada pada jaringan diikatkan dengan antibodi primer yang spesifik. Lalu antibodi primer yang terikat antigen kemudian diikatkan pula dengan antibodi sekunder (antiantibodi primer) yang telah dilabel enzim peroksidase. Penambahan substrat yang berisi kromogen dan H2O2 akan memunculkan endapan berwarna coklat dan H2O. Endapan coklat merupakan hasil penguraian substrat (kromogen dan H2O2) oleh enzim peroksidase (Gambar 4). Warna coklat yang muncul menandakan
reaksi positif (+), yang artinya di dalam jaringan terdapat antigen. Apabila di jaringan tersebut tidak terdapat antigen, maka tidak akan muncul warna coklat (Ramos & Vara 2005).
Gambar 4 Prinsip pewarnaan imunohistokimia metode perokdidase. Jaringan
Antibodi sekunder
Antibodi primer
Antigen
Peroksidase
Teknik imunohistokimia yang digunakan pada penelitian ini bertujuan untuk mendeteksi kandungan enzim antioksidan superoksida dismutase (SOD) yang terdapat di dalam jaringan usus halus. Enzim SOD merupakan enzim antioksidan endogen yang mempunyai peranan penting secara langsung melindungi sel dari gangguan radikal bebas, dan secara tidak langsung memelihara keseimbangan oksigen yang bersifat toksik (Wresdiyati et al. 2002). Pengukuran kandungan enzim antioksidan SOD merupakan cara untuk mengetahui kondisi pertahanan sel terhadap radikal bebas. Aktivitas SOD bervariasi pada beberapa organ. Aktivitas SOD tertinggi terdapat pada hati, diikuti kelenjar adrenal, ginjal, darah, limpa, pankreas, otak, paru-paru, usus, ovarium, dan timus (Halliwell & Gutteridge 1999).
Enzim SOD pada mamalia terdiri atas tiga bentuk, yaitu copper,zinc superoxide dismutase atau Cu,Zn-SOD yang berada terutama di sitoplasma,
manganese superoxide dismutase atau Mn-SOD yang berada di mitokondria, dan
extracelular superoxide dismutase atau ECSOD. Secara umum fungsi Cu,Zn-SOD sama dengan Mn-Cu,Zn-SOD dan ECCu,Zn-SOD, namun ketiganya berbeda dalam struktur protein, lokasi kromosom, metal kofaktor, distribusi gen, dan kompartemen selular (Miao et al. 2009).
Enzim SOD mengkatalis dismutase oksigen menjadi hidrogen peroksida dan
mengubahnya menjadi air dan oksigen yang stabil (Gurer & Ercal 2000). Enzim SOD berperan dalam proses degradasi senyawa ROS. ROS ialah senyawa yang mempunyai gugus oksigen reaktif dan mamiliki bentuk serta aktivitas sebagai radikal bebas. Senyawa ini cenderung menyumbangkan atom oksigen atau elektron pada senyawa lainya (Halliwell & Gutteridge 1999).
8. Penelitian pendahuluan
15
mempunyai kemampuan bertahan pada pH asam lambung (pH 2) dan pH usus (pH 7.2), serta pada kondisi garam empedu 0.5%. Bakteri asam laktat tersebut juga mempunyai aktivitas penghambatan yang baik terhadap tiga jenis bakteri patogen enterik, yaitu Salmonella Thypimurium, enterotoxigenic E. coli (ETEC), dan Staphylococcus aureus.
Bakteri asam laktat (BAL) ini juga mempunyai kemampuan bakterisidal terhadap mikroba patogen karena bakteri tersebut mampu menghasilkan senyawa bioaktif asam laktat, asam asetat, serta senyawa bakteriosin. Kesepuluh isolat ini layak dikatakan sebagai probiotik. Sifat fungsional lainya telah diteliti oleh Astawan et al. (2009), yaitu mengenai kemampuan bakterisidal dari 10 isolat BAL terhadap bakteri enteropatogenic E. coli (EPEC) secara in vitro. Hasilnya menunjukkan bahwa terdapat dua spesies BAL yang mempunyai kemampuan terbaik dalam melawan EPEC, yaitu Lactobacillus plantarum dan Lactobacillus fermentum. Kedua BAL inilah yang dipakai pada penelitian ini.
9. Hewan percobaan
Hewan percobaan adalah hewan yang sengaja dipelihara dan diternakkan untuk dipakai sebagai hewan model dalam mempelajari dan mengembangkan berbagai bidang ilmu dalam skala penelitian atau pengamatan laboratorik. Hewan
percobaan banyak digunakan pada penelitian di bidang fisiologi, farmakologi, biokimia, patologi, dan komparatif zoologi (Malole & Pramono 1989). Di bidang kedokteran, hewan percobaan banyak digunakan untuk keperluan diagnosis. Penelitian-penelitian medis untuk kepentingan manusia sering dilakukan menggunakan hewan percobaan. Hewan percobaan terbagi atas 5 kelompok, yaitu: (1) hewan laboratorium berukuran kecil, seperti mencit, tikus, dan kelinci; (2) karnivora, seperti kucing dan anjing; (3) primata, seperti Macaca dan babon; (4) hewan domestik besar, seperti domba, sapi, serta babi; dan (5) kelompok hewan lainnya, seperti unggas (Wolfensohn & Lloyd 1998).
enterobaktericeae dapat menggunakan hewan coba mencit maupun tikus. Hewan percobaan kelinci baik digunakan pada penelitian mengenai hiperkolestrerolemia karena peka terhadap kolesterol dan bisa menyimpan lemak tubuh dalam jumlah yang besar. Berbeda dengan anjing, kucing, dan tikus yang resisten terhadap pakan yang mengandung kolesterol (Sirois 2005).
Hewan percobaan yang paling cocok untuk penelitian mengenai manusia ialah primata (Wolfensohn & Lloyd 1998). Hal itu dikarenakan kedekatan kekerabatan serta kemiripan anatomis, fisiologis, dan patologis. Namun penggunaan hewan coba primata menemui banyak kendala, seperti sulitnya pengadaan hewan, perawatan yang rumit dan mahal, handling yang sulit, serta adanya bahaya penyakit menular (Sirois 2005). Hewan percobaan lain yang memiliki karakter fisiologis mirip dengan manusia maupun mamalia lain adalah tikus. Ada dua spesies tikus, yaitu tikus hitam (Rattus rattus) dan tikus putih (Rattus norvegicus). Spesies yang sering dipakai sebagai hewan model pada penelitian mengenai mamalia adalah Rattus norvegicus (Malole & Pramono 1989).
Rattus norvegicus memiliki ciri rambut berwarna putih dan mata berwarna merah. Sebagai hewan percobaan, Rattus norvegicus memiliki beberapa keunggulan, yaitu pemeliharaan dan penanganan mudah, kemampuan reproduksi
tinggi dan masa kebuntingan singkat, serta cocok untuk berbagai penelitian (Malole & Pramono 1989). Rata-rata umur Rattus norvegicus adalah 4 sampai 5 tahun dengan berat badan umum tikus jantan dewasa berkisar antara 267 sampai 500 gram dan betina 225 sampai 325 gram. Tikus memasuki usia dewasa pada umur 40-60 hari, masa bunting selama 23 hari dan disapih pada umur 21 hari (Smith & Mangkoewidjojo 1989). Penelitian yang dapat dilakukan menggunakan
Rattus norvegicus di antaranya penelitian mengenai hipertensi, diabetes melitus, obesitas, dan lain-lain (Sirois 2005).
Rattus norvegicus mempunyai 3 galur, yaitu Sprague Dawley, Wistar, dan
17
serta bulu pada kepala dan bagian tubuh depan berwarna hitam (Malole & Pramono 1989).
Pada penelitian ini, hewan percobaan yang digunakan adalah Rattus norvegicus galur Sprague Dawley. Rattus norvegicus adalah hewan percobaan paling populer dalam penelitian yang berkaitan dengan pencernaan (Hofstetter et al. 2005). Hewan ini dipakai dengan pertimbangan: (1) pola makan omnivora seperti manusia (Malole & Pramono 1989); (2) memiliki saluran pencernaan dengan tipe monogastrik seperti manusia (Hofstetter et al. 2005); (3) kebutuhan nutrisi hampir menyamai manusia (Wolfensohn & Lloyd 1998); serta (4) mudah di cekok dan tidak mengalami muntah karena tikus ini tidak memiliki kantung empedu (Smith & Mangkoewidjojo 1989). Saluran pencernaan tikus dapat dilihat pada Gambar 5.
Gambar 5 Saluran pencernaan pada tikus (Hofstetter et al. 2005).
Penelitian ini difokuskan pada pengamatan bagian usus halus dari saluran pencernaan tikus. Usus halus tikus terdiri atas duodenum, jejunum, dan ileum. Pada bagian mukosa terdapat vili, kripta, dan kelenjar Liberkun. Di permukaan
jam. Jumlah kelenjar Liberkun pada usus halus tikus relatif konstan, baik pada duodenum, jejunum maupun ileum, sedangkan jumlah vili menurun dari duodenum sampai ke ileum. Pada bagian submukosa duodenum terdapat kelenjar Brunner yang berfungsi menghasilkan mukus dan bikarbonat, namun kelenjar ini hanya terdapat pada bagian proksimal dari duodenum tikus (Clarke 1970). Proses penyerapan makanan pada tikus dan manusia terjadi di bagian jejunum dan ileum dari usus halus. Penyerapan dilakukan oleh mikrovili sel epitel. Penyerapan glukosa, asam amino, dan asam lemak terutama terjadi di bagian jejunum (DeSesso & Jacobson 2001).
BAHAN DAN METODE
Alur penelitian yang akan dilakukan secara umum digambarkan dalam skema pada Gambar 5.
Gambar 6 Alur penelitian.
1. Waktu dan tempat penelitian
Penelitian dilaksanakan pada bulan Juni 2009 sampai Juli 2010 bertempat di SEAFAST dan Laboratorium Histologi Departemen Anatomi Fisiologi dan Farmakologi Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Pengujian Lactobacillus plantarum (BAL1)dan Lactobacillus fermentum (BAL2) pada tikus dengan perlakuan: kontrol negatif, BAL1, BAL2, BAL1 + EPEC, BAL2 + EPEC, dan kontrol
positif (EPEC)
Analisis kerusakan mukosa usus secara
mikroskopis
Analisis kandungan enzim antioksidan intraselular (SOD)
pada usus Terminasi
Hasil: BAL probiotik yang memiliki fungsi terbaik dalam memelihara keutuhan mukosa dan kandungan enzim antioksidan SOD pada usus halus
2. Bahan dan alat
Bahan yang digunakan pada penelitian ini adalah Lactobacillus plantarum,
Lactobacillus fermentum, enteropathogenic E. coli, tikus, ransum standar tikus (kasein, minyak jagung, mineral mix, carboximethylcelulose, dan maizena), NaCl 0.9%, Bouin (asam pikrat jenuh, formalin, dan asam asetat glasial dengan perbandingan 15: 5: 1), alkohol 70%, 80%, 90%, 95%, dan 100% (absolut), xylol, parafin, akuades, hematoksilin-eosin (HE), neophren in toluene 0.2%, phosphate buffered saline (PBS), metanol, H2O2, serum normal, antibodi primer Cu,Zn-SOD (SIGMA S2147), antibodi sekunder Dako Envision Peroxidase System (K1491), kromogen Diamino Benzidine (DAB), air bebas ion (MiliQ), dan label.
Alat yang digunakan dalam penelitian ini adalah gelas kimia, erlenmeyer, wadah penampung, mikropipet, kapas, tissue, alumunium foil, alat bedah (gunting, pinset, alas bedah), pipet tetes, pipet Mohr, gelas ukur, tissue basket, tabung Ependorf, exhause fan, mikrotom putar, waterbath, gelas objek,
coverglass, inkubator, mikroskop cahaya, kamera, dan kotak preparat.
3. Tahap-tahap perlakuan
3.1 Hewan percobaan
Hewan yang digunakan dalam penelitian ini ialah 90 ekor tikus putih albino norway rats (Rattus norvegicus) galur Sprague Dawley umur 5-6 minggu dengan berat badan berkisar 140-240 g, berjenis kelamin jantan hasil pengembangbiakan dari Badan POM RI.
3.2 Kandang dan ransum
Kandang yang digunakan adalah kandang yang berukuran 17.5 x 23.75 x 17.5 cm, dengan jumLah sesuai dengan jumLah tikus yang digunakan. Kandang terbuat dari stainless steel. Kandang tikus ditempatkan pada ruangan yang bebas dari suara ribut dan terjaga dari asap industri atau polutan lainya. Lantai kandang mudah dibersihkan dan disanitasi.
21
Table 1 Komposisi campuran ransum basal tikus
Ket: Komposisi atau data proksimat kasein untuk pembuatan ransum tikus percobaan berdasarkan sertifikat analisis terdiri atas 97.4% protein (basis kering) atau 86.0% protein (basis basah), 1.8% abu, 11.6% air, 1.1% lemak, dan < 0.1% laktosa.
3.3 Perlakuan terhadap hewan percobaan dan sampling
Tikus dibagi menjadi 6 kelompok perlakuan, yaitu; 1) kelompok kontrol negatif (akuades) (A), 2) kelompok perlakuan Lactobacillus plantarum (B), 3) kelompok perlakuan Lactobacillus fermentum (C), 4) kelompok perlakuan
Lactobacillus plantarum + EPEC (D), 5) kelompok perlakuan Lactobacillus fermentum + EPEC (E), dan kelompok kontrol positif (EPEC) (F) (Tabel 2).
Tabel 2 Kelompok tikus perlakuan
C Tikus yang dicekok Lactobacillus fermentum mulai hari ke-1 sampai hari ke-21
D Tikus yang dicekok Lactobacillus plantarum mulai hari ke-1 sampai hari ke-21, ditambah cekok EPEC pada hari ke-8 sampai hari ke-14
E Tikus yang dicekok Lactobacillus fermentum mulai hari ke-1 sampai hari ke-21, ditambah cekok EPEC pada hari ke-8 sampai hari ke-14
F
Kontrol positif, yaitu tikus yang dicekok akuades pada hari ke-1 sampai hari ke-7, kemudian dicekok EPEC pada hari ke-8 sampai hari ke-14, setelah itu dicekok akuades lagi hari ke-15 sampai hari ke-21
Ket: cekok akuades pada kelompok kontrol positif dan kontrol negatif adalah sebagai pengganti cekok L. plantarum, L. fermentum, ataupun EPEC. Akuades diberikan secara per oral menggunakan sonde.
Komponen Sumber JumLah
Serat Carboxymethylcellulose (CMC) 1 1
Air Air 5 3.62
Semua tikus diberi ransum standar dan air minum ad libitum. Kultur
Lactobacillus plantarum dan Lactobacillus fermentum yang diberikan sebanyak 1 mL dengan populasi 108 cfu/mL, sedangkan kultur enteropathogenicE. coli yang digunakan sebanyak 1 mL dengan populasi 106 cfu/mL untuk satu kali cekok.
Lactobacillus plantarum, Lactobacillus fermentum, dan EPEC diberikan pada tikus percobaan secara per oral menggunakan sonde lambung (Oyetayo 2004).
Proses terminasi (pengakhiran perlakuan) dan sampling organ usus halus dilakukan tiga kali, yaitu pada hari ke-8 (T1), hari ke-15 (T2), dan hari ke-22 masing-masing bagianya (duodenum, jejunum, dan ileum). Potongan jaringan duodenum, jejunum, dan ileum kemudian didehidrasi (penarikan molekul air dari dalam jaringan) dengan alkohol bertingkat (70%, 80%, 90%, 95%) masing-masing selama 24 jam dan alkohol absolut (I, II, dan III) masing-masing-masing-masing selama 1 jam. Selanjutnya dilakukan penjernihan (clearing) dalam larutan xylol I, II, III, masing-masing selama 1 jam.
Tahap berikutnya adalah infiltrasi parafin kedalam jaringan dengan memasukkan sampel jaringan ke dalam parafin cair I, II, III, masing-masing selama 1 jam dengan suhu 60 oC. Setelah itu dilakukan penanaman organ dalam parafin (embedding), kemudian dibuat blok-blok jaringan sesuai ukuran organ. Blok jaringan dipotong setebal 4 µm dengan mikrotom putar. Hasil potongan direndam dalam akuades (suhu ruang), kemudian dimasukkan ke dalam akuades yang dipanaskan dalam waterbath (suhu 37 oC). Selanjutnya potongan jaringan terbaik diletakkan pada gelas objek. Untuk pewarnaan imunohistokimia, gelas objek yang digunakan dilapisi (dilem) dengan neophren in toluene (neophren :
23
5. Pewarnaan
Pewarnaan dimulai dengan deparafinisasi potongan jaringan dalam xylol
(III, II, I) masing-masing 5 menit. Rehidrasi jaringan dilakukan dengan merendam preparat dalam alkohol absolut III, II, I, 95%, 90%, 80%, 70% masing masing 3 menit. Setelah itu dilakukan pencucian dengan air kran selama 5 menit dilanjutkan pencucian dengan akuades selama 3 menit.
5.1 Pewarnaan hematoksilin-eosin (HE) (Kiernan 1990)
Pewarnaan jaringan diawali dengan pemberian hematoksilin selama 3 menit, lalu direndam dalam air kran selama 10 menit dan akuades 5 menit, dilanjutkan dengan pemberian Eosin selama 2 menit. Tahap pewarnaan diakhiri dengan dehidrasi pada alkohol bertingkat 70%, 80%, 90%, 95%, absolut I, II masing-masing beberapa detik, kemudian absolut III satu menit. Dilanjutkan dengan
clearing pada xylol I, II, beberaapa detik dan xylol III satu menit, diakhiri dengan
mounting (penutupan sediaan dengan coverglass).
5.2 Pewarnaan imunohistokimia cooper,zinc superoxide dismutase Cu,Zn-SOD (Wresdiyati et al. 2002)
Proses pewarnaan imunohistokimia diawali dengan tahap penghilangan peroksidase endogen dengan merendam preparat dalam campuran metanol (30 mL) dan H2O2 (0.3 mL) selama 15 menit. Kemudian dilakukan pencucian dengan
akuades dan PBS masing-masing dua kali selama 10 menit. Setelah itu, setiap preparat ditetesi dengan 50-60 µl serum normal dan diinkubasi pada suhu 37 oC selama 60 menit. Lalu dilakukan pencucian dengan PBS sebanyak tiga kali masing-masing 5 menit. Tahap selanjutnya adalah penetesan antibodi primer Cu,Zn-SOD (SIGMA S2147) sebanyak 50-60 µl pada masing-masing preparat, lalu diinkubasi pada suhu 4 oC selama 2 malam (44 jam).
dengan air bebas ion (MiliQ) sebanyak tiga kali masing-masing 5 menit. Preparat tersebut kemudian diwarnai (di-counterstain) dengan hematoksilin agar terlihat warna yang kontras antara inti sel yang mengadung SOD dan yang tidak. Preparat lalu dicelupkan ke dalam akuabides untuk memperkuat warna biru yang dibentuk oleh hematoksilin. Selanjutnya preparat didehidrasi pada alkohol bertingkat 70%, 80%, 90%, 95%, dan absolut I, II masing-masing beberapa detik, kemudian absolut III selama 1 menit. Proses dilanjutkan dengan clearing pada xylol I, II beberapa detik dan xylol III selama 1 menit, dan diakhiri dengan mounting.
6. Analisis data
Pengamatan terhadap preparat yang telah diwarnai dengan HE dilakukan menggunakan mikroskop cahaya. Pengamatan dilakukan secara kuantitatif terhadap gambaran histologi organ usus halus. Data yang diambil ialah persentase kerusakan vili usus halus (duodenum, jejunum, dan ileum). Persentase kerusakan vili usus dihitung dengan rumus:
%kerusakan vili = (jumlah vili yang rusak : jumlah total vili) x 100% Hasil perhitungan dianalisis secara statistik dengan one way ANOVA dan uji lanjut Duncan.
Pengamatan terhadap preparat yang telah diwarnai dengan pewarnaan
HASIL DAN PEMBAHASAN
1. Histologi jaringan usus halus
Kerusakan vili pada usus halus dapat dilihat dari gambaran histologi jaringan usus halus tersebut. Keberadaan vili berpengaruh terhadap penyerapan makanan dan kondisi kesehatan saluran pencernaan. Vili yang rusak tidak akan bisa menyerap makanan secara baik, sehingga asupan nutrisi bagi individu akan berkurang dan kondisi kesehatan menurun (Schiller & Sellin 2006). Pada penelitian ini, persentase kerusakan vili mukosa usus halus (duodenum, jejunum, dan ileum) tikus percobaan dapat dilihat pada Tabel 3.
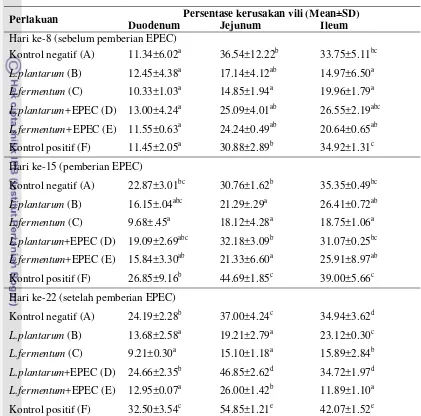
Analisis statistik menunjukkan pada hari ke-8 kerusakan vili duodenum tidak berbeda nyata (p>0.05) untuk setiap kelompok perlakuan (Gambar 7). Pada jejunum, kelompok perlakuan L. fermentum menunjukkan kerusakan vili yang nyata (p<0.05) lebih rendah dibandingkan dengan dengan kelompok kontrol negatif dan kontrol positif, namun tidak berbeda nyata (p>0.05) terhadap
kelompok perlakuan L. plantarum, L. plantarum + EPEC, dan L. fermentum + EPEC (Gambar 8). Analisis statistik menunjukkan pemberian L. plantarum dan
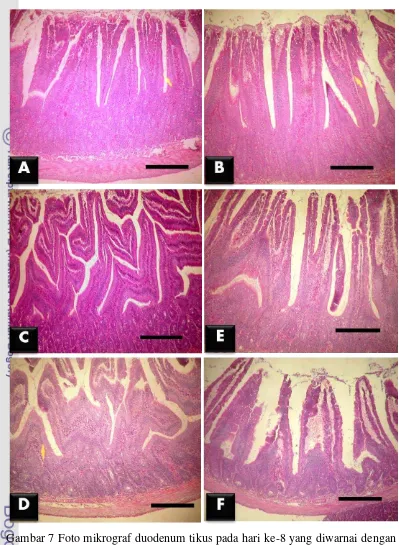
L. fermentum pada ileum menimbulkan kerusakan vili yang tidak berbeda nyata (p>0.05), baik pada kelompok perlakuan L. plantarum, L. fermentum, L. plantarum + EPEC, maupun L. fermentum + EPEC. Namun kelompok perlakuan
L. plantarum dan L. fermentum menunjukkan kerusakan vili yang lebih rendah secara nyata (p<0.05) dibandingkan dengan dengan kelompok kontrol negatif dan kontrol positif (Gambar 9).
menunjukkan pengaruh yang nyata terhadap kesehatan vili usus halus tikus percobaan.
Tabel 3 Data persentase kerusakan vili usus halus
Perlakuan Persentase kerusakan vili (Mean±SD)
Duodenum Jejunum Ileum
Hari ke-8 (sebelum pemberian EPEC)
Kontrol negatif (A) 11.34±6.02a 36.54±12.22b 33.75±5.11bc
L.plantarum (B) 12.45±4.38a 17.14±4.12ab 14.97±6.50a
L.fermentum (C) 10.33±1.03a 14.85±1.94a 19.96±1.79a
L.plantarum+EPEC (D) 13.00±4.24a 25.09±4.01ab 26.55±2.19abc
L.fermentum+EPEC (E) 11.55±0.63a 24.24±0.49ab 20.64±0.65ab
Kontrol positif (F) 11.45±2.05a 30.88±2.89b 34.92±1.31c
Hari ke-15 (pemberian EPEC)
Kontrol negatif (A) 22.87±3.01bc 30.76±1.62b 35.35±0.49bc
L.plantarum (B) 16.15±.04abc 21.29±.29a 26.41±0.72ab
L.fermentum (C) 9.68±.45a 18.12±4.28a 18.75±1.06a
L.plantarum+EPEC (D) 19.09±2.69abc 32.18±3.09b 31.07±0.25bc
L.fermentum+EPEC (E) 15.84±3.30ab 21.33±6.60a 25.91±8.97ab
Kontrol positif (F) 26.85±9.16b 44.69±1.85c 39.00±5.66c
Hari ke-22 (setelah pemberian EPEC)
Kontrol negatif (A) 24.19±2.28b 37.00±4.24c 34.94±3.62d
L.plantarum (B) 13.68±2.58a 19.21±2.79a 23.12±0.30c
L.fermentum (C) 9.21±0.30a 15.10±1.18a 15.89±2.84b
L.plantarum+EPEC (D) 24.66±2.35b 46.85±2.62d 34.72±1.97d
L.fermentum+EPEC (E) 12.95±0.07a 26.00±1.42b 11.89±1.10a
Kontrol positif (F) 32.50±3.54c 54.85±1.21e 42.07±1.52e
Ket: angka yang diikuti dengan huruf yang sama pada satu kolom pada masing-masing minggu menunjukan tidak berbeda nyata pada taraf 5%
Penelitian Panigrahim (2008) menunjukkan bahwa dalam waktu 7 hari pemberian L. plantarum sudah bisa meningkatkan keragaman bakteri gram positif dan menurunkan jumlah bakteri gram negatif pada usus individu yang baru lahir. Hasil penelitian Strompfová (2006) menunjukkan bahwa pemberian 1x109 cfu/ml
L. fermentum selama 7 hari dapat meningkatkan populasi mikroba Lactobacillus
27
Gambar 8 Foto mikrograf jejunum tikus pada hari ke-8 yang diwarnai dengan hematoksilin-eosin (HE). Dapat dilihat bahwa kerusakan vili yang lebih sedikit terdapat pada kelompok perlakuan L. fermentum (C).
29
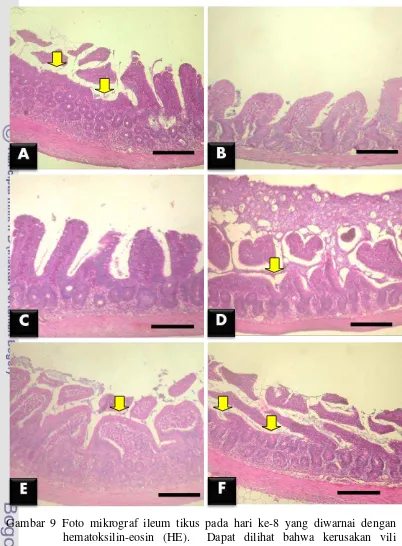
Pada terminasi hari ke-15, kelompok perlakuan L. fermentum memiliki kerusakan vili yang lebih kecil secara nyata (p<0.05) dibandingkan dengan kelompok kontrol negatif dan kontrol positif di semua bagian usus halus. Pada duodenum, kelompok perlakuan L. plantarum menunjukkan kerusakan vili yang tidak berbeda nyata (p>0.05) dengan kelompok perlakuan L. fermentum, L. plantarum + EPEC, maupun L. fermentum + EPEC. Hal ini menunjukkan pemberian L. plantarum dan L. fermentum mempunyai efek yang hampir sama pada duodenum, baik saat dipapar maupun tidak dipapar EPEC (Gambar 10).
Pada jejunum, kelompok perlakuan L. plantarum menunjukkan kerusakan vili yang tidak berbeda nyata (p>0.05) dengan kelompok perlakuan L. fermentum
dan L. fermentum + EPEC, namun lebih rendah secara nyata (p<0.05) dibandingkan dengan kelompok perlakuan L. plantarum + EPEC. Hal ini menunjukkan bahwa pemberian L. fermentum lebih baik dibandingkan dengan L. plantarum dalam mempertahankan vili jejunum dari serangan EPEC. Kelompok perlakuan L. plantarum + EPEC menunjukkan kerusakan vili yang tinggi namun tidak berbeda nyata (p>0.05) dengan kelompok kontrol negatif. Hal ini
menunjukkan bahwa L. plantarum masih mampu mempertahankan kondisi kesehatan vili usus halus seperti kondisi kontrol negatif (Gambar 11).
Menurut Anderson et al. (2010), L. plantarum mempertinggi pertahanan selular pada mukosa usus halus dengan meningkatkan jumlah protein tight junction. Tight junction adalah protein yang menghubungkan antara membran sel satu dan membran sel yang lain untuk mengatur perpindahan material interselular. Meningkatnya jumlah tight juction akan menurunkan permeabilitas selular sehingga sel lebih selektif dalam menerima zat atau bahan-bahan asing dari luar.
Probiotik L. fermentum meningkatkan kesehatan dan pertahanan mukosa usus inang dengan beberapa mekanisme, di antaranya dia menempel dengan sangat baik pada permukaan sel mukosa usus inang terutama di jejunum dan ileum (Plant & Conway 2001), sehingga bisa menghambat penempelan bakteri patogen. Selain itu, L. fermentum juga mensekresikan metabolit antimikroba (Mikelsaar & Zilmer 2009) dan metabolit antiinflamasi (Peran et al. 2005).
31
Sedangkan asam laktat, asam asetat, dan asam propionat berfungsi untuk menurunkan pH lingkungan sehingga menghambat sebagian besar bakteri gram negatif termasuk EPEC. Sebuah studi menunjukkan bahwa pH rendah berpengaruh terhadap permeabilitas membran luar bakteri gram negatif, saat permeabilitas membran terganggu, senyawa antimikroba akan masuk dan menyebabkan kematian pada bakteri tersebut (Alakomi et al. 2001).
Pada bagian ileum, kelompok perlakuan L. fermentum menunjukkan kerusakan vili yang rendah dan tidak berbeda nyata (p>0.05) dengan kelompok perlakuan L. fermentum + EPEC dan L. plantarum. Analisis statistik menunjukkan bahwa kerusakan vili kelompok perlakuan L. plantarum + EPEC tidak berbeda nyata (p>0.05) dengan kelompok kontrol negatif dan kontrol positif. Hal ini menunjukkan bahwa L. plantarum mampu mempertahankan kondisi kerusakan vili usus halus yang dipapar EPEC seperti kondisi kelompok kontrol negatif. Paparan EPEC pada kelompok kontrol positif juga menimbulkan kondisi kerusakan vili yang sama seperti kontrol negatif (Gambar 12).
Kerusakan vili duodenum dan ileum kelompok kontrol positif tidak berbeda
nyata (p>0.05) dengan kelompok kontrol negatif. Hal ini karena aktivitas pertumbuhan mikroorganisme patogen di duodenum cenderung sedikit. Faktor yang menghambat pertumbuhan mikroorganisme tersebut di antaranya kondisi
lumen duodenum yang kaya akan garam empedu dan sekreta pankreas (Jonqueira & Carneiro 2005). Selain itu, pergerakan peristaltik duodenum yang cepat juga mencegah menetapnya patogen di duodenum (Lu & Walker 2001). Sedangkan ileum dilengkapi dengan jaringan limfatik yang besar yaitu daun payer sebagai pertahanan terhadap patogen (Samuelson 2007).
Di jejunum, kelompok kontrol positif memiliki persentase kerusakan vili yang paling tinggi secara nyata (p<0.05) dibandingkan dengan kelompok perlakuan lain. Bakteri EPEC merupakan strain E. coli yang bersifat patogen. Patogenesa dari infeksi EPEC dimulai dengan berikatan secara kuat pada permukaan epitel vili usus kemudian merusak mikrovili, dikenal dengan istilah
33
35
Bakteri EPEC terutama menyerang jejunum karena ukuran jejunum yang lebih panjang dibandingkan dengan dengan duodenum dan ileum sehingga paparan EPEC cenderung lebih lama di jejunum. Selain itu, jejunum memiliki regenerasi sel epitel vili yang lebih lambat dibandingkan dengan dengan duodenum dan ileum, sehingga eliminasi EPEC yang menempel pada sel epitel vili juga menjadi lebih lambat (Louaka et al. 2009). Di jejunum pertahanan mukosa yang dominan adalah sekresi mukus dari sel goblet, karena jumlah sel goblet terbanyak terdapat pada jejunum (Samuelson 2007). Namun telah dilaporkan bahwa EPEC mampu untuk tumbuh pada kondisi mukus yang tinggi seperti di jejunum (Edelman et al. 2003).
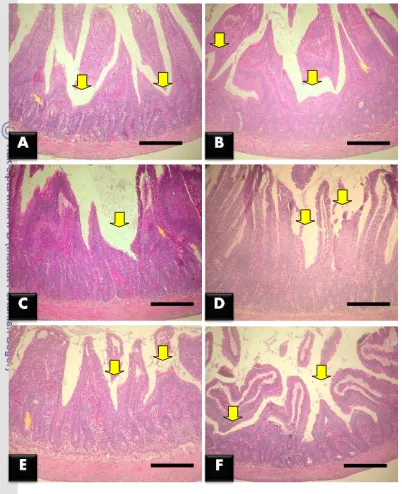
Pada hari ke-22, persentase kerusakan vili usus halus tikus percobaan dapat dilihat pada Tabel 3. Pada duodenum, kerusakan vili pada kelompok perlakuan L. fermentum, L. fermentum + EPEC, dan L. plantarum nyata (p<0.05) lebih kecil dibandingkan dengan kelompok perlakuan L. plantarum + EPEC, kontrol negatif, dan kontrol positif. Hal ini menunjukkan bahwa pemberian tunggal L. plantarum
dan L. fermentum dapat menekan kerusakan vili duodenum. Pada tikus yang dipapar EPEC, L. fermentum dapat menekan kerusakan vili usus halus lebih besar dibandingkan dengan L. plantarum. Kerusakan vili usus kelompok perlakuan L. plantarum + EPEC tidak berbeda nyata (p>0.05) dengan kontrol negatif. Hal ini menunjukkan bahwa L. plantarum bisa melawan serangan EPEC dan mempertahankan kondisi mukosa duodenum seperti kondisi kontrol negatif (Gambar 13).
Gambar 13 Foto mikrograf duodenum tikus pada hari ke-22 yang diwarnai dengan hematoksilin-eosin (HE). Dapat dilihat bahwa kerusakan vili yang paling sedikit terdapat pada kelompok perlakuan L. plantarum
37
39
Pada ileum tikus percobaan, selain pada kelompok kontrol negatif dan kelompok perlakuan L. plantarum + EPEC, setiap kelompok memiliki kerusakan vili yang berbeda nyata antara satu dan yang lainnya. Urutan kelompok perlakuan dengan kerusakan vili yang terkecil sampai yang terbesar, yaitu L. fermentum + EPEC, L. fermentum, L. plantarum, L. plantarum + EPEC dan kontrol negatif, kemudian kontrol positif. Kerusakan vili kelompok perlakuan L. plantarum + EPEC tidak berbeda nyata (p>0.05) dengan kontrol negatif. Hal ini menunjukkan bahwa L. plantarum mampu mempertahankan kondisi vili ileum terhadap serangan EPEC seperti kondisi kontrol negatif. Jaringan duodenum, jejunum, dan ileum pada kelompok kontrol positif (EPEC) hari ke-22 mengalami kerusakan vili yang nyata (p<0.05) paling tinggi dibandingkan dengan dengan kelompok perlakuan lainnya. Ini membuktikan bahwa EPEC menyebabkan kerusakan yang berlanjut pada vili usus halus, walaupun pemberian dari luar telah dihentikan (Gambar 15).
Hasil di atas menunjukkan bahwa pemberian probiotik dengan jumlah yang tepat bisa memperbaiki kondisi kesehatan mukosa saluran usus halus, sedangkan
yang tidak diberi probiotik mengalami kerusakan vili yang berlanjut. Penelitian Peran et al. (2005) menunjukkan bahwa pemberian L. fermentum selama 3 minggu bisa memperbaiki mukosa usus besar pada tikus colitis dengan
merangsang pertumbuhan sel epitel dan sel goblet.
2. Kandungan Cu,Zn-SOD jaringan usus halus
tidak ditemukan adanya enzim Cu,Zn-SOD. Hal ini ditandai dengan tidak adanya warna coklat pada jaringan tunika serosa.
Enzim Cu,Zn-SOD merupakan enzim antioksidan endogen yang mempunyai peranan penting secara langsung melindungi sel terhadap gangguan radikal bebas, dan secara tidak langsung memelihara keseimbangan oksigen yang bersifat toksik (Wresdiyati et al. 2002). Enzim Cu,Zn-SOD bekerja melalui sistem pertahanan preventif, menghambat atau merusak proses pembentukan radikal bebas, serta mengkatalisasi radikal bebas anion superoksida dan mengubahnya menjadi hidrogen peroksida (Carroll et al. 2004), yang selanjutnya diubah lagi oleh enzim katalase menjadi air dan oksigen yang stabil (Gurer & Ercal 2000).
Kandungan enzim Cu,Zn-SOD pada usus halus tikus percobaan dapat dilihat pada Tabel 4. Pada duodenum dan ileum hari ke-8, kelompok perlakuan L. fermentum menunjukkan kandungan enzim Cu,Zn-SOD yang paling banyak dibandingkan dengan kelompok perlakuan lainnya. Kelompok perlakuan lain menunjukkan kandungan enzim Cu,Zn-SOD yang sama dengan kelompok kontrol
negatif. Hal ini dimungkinkan karena jangka waktu pemberian L. plantarum dan
L. fermentum tergolong masih singkat, sehingga belum menunjukkan pengaruh yang nyata terhadap peningkatan kandungan enzim Cu,Zn-SOD pada usus halus.
Selain itu, kelompok perlakuan kontrol positif (EPEC), L. plantarum + EPEC, dan
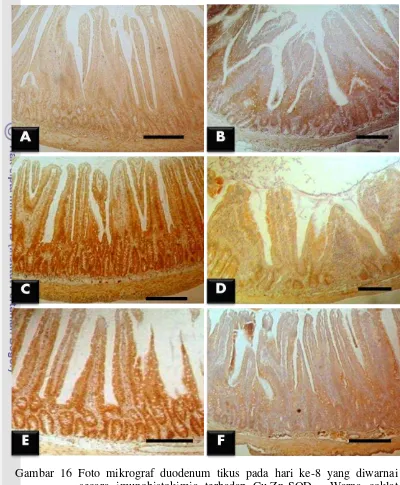
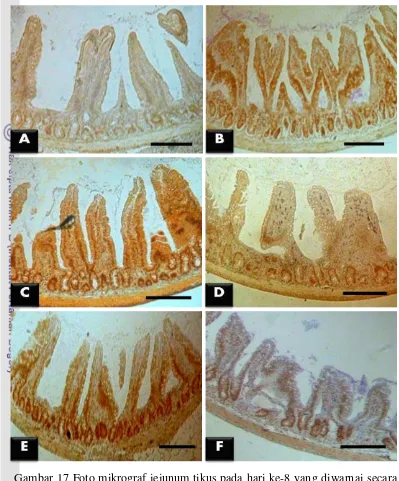
L. fermentum + EPEC belum diberi cekok EPEC (Gambar 16 dan Gambar18). Di jejunum, kelompok perlakuan L. fermentum dan L. fermentum + EPEC menunjukkan kandungan enzim Cu,Zn-SOD yang paling tinggi dibandingkan dengan kelompok lainnya. Hal ini menunjukkan bahwa L. fermentum sudah memberikan pengaruh baik terhadap kandungan enzim Cu,Zn-SOD di jejunum dalam waktu satu minggu. Kelompok perlakuan yang diberi L. plantarum
41
Pada hari ke-15, kelompok perlakuan L. fermentum pada duodenum, jejunum, dan ileum menunjukkan kandungan enzim Cu,Zn-SOD yang paling tinggi dibandingkan dengan kelompok lainnya. Kelompok perlakuan L. plantarum
juga memiliki kandungan enzim Cu,Zn-SOD yang tinggi pada duodenum dan jejunum, namun tidak sebanyak kelompok perlakuan L. fermentum. Hal ini menunjukkan bahwa pemberian tunggal L. fermentum dan L. plantarum selama dua minggu memberikan efek yang baik terhadap peningkatan kandungan enzim Cu,Zn-SOD pada semua jaringan usus halus.
Tabel 4Kandungan enzim Cu,Zn-SOD pada jaringan usus halus tikus percobaan
Perlakuan Kandungan Cu,Zn-SOD
43
45
Pada duodenum, jejunum, dan ileum kelompok perlakuan L. fermentum +
EPEC menunjukkan kandungan enzim Cu,Zn-SOD yang lebih tinggi dibandingkan dengan kelompok kontrol positif dan kontrol negatif. Pada kelompok perlakuan L.plantarum + EPEC kandungan enzim Cu,Zn-SOD nya sama dengan kelompok kontrol negatif, namun lebih tinggi dibandingkan dengan kelompok kontrol positif. Hal ini menunjukkan bahwa pada duodenum, jejunum, dan ileum, pemberian L. fermentum dan L. plantarum bisa menjaga kandungan enzim Cu,Zn-SOD jaringan usus halus yang dipapar EPEC (Gambar 19, Gambar 20, dan Gambar 21).
Kelompok kontrol positif pada terminasi hari ke-15 kehilangan sebagian besar kandungan enzim Cu,Zn-SOD di dalam jaringan usus halusnya. Menurut Cheng et al. (2006), invasi bakteri dan fungi patogen ke dalam tubuh inang menyebabkan kandungan SOD menurun. Menurut Yan & Polk (2008) penempelan EPEC pada permukaan sel epitel akan mengaktifkan mekanisme inflamasi yaitu teraktivasinya dendritik sel yang kemudian menyebabkan peningkatan sekresi sitokin. Mekanisme ini menyebabkan infiltrasi leukosit,
terutama neutrofil dan makrofag di mukosa dan infiltrasi limfosit B dan limfosit T di submukosa. Neutrofil dan makrofag ini akan memfagosit bakteri EPEC.
Menurut Roitt (2002), ketika fagositosis dimulai, terjadi peningkatan
kegiatan hexose monophosphate shunt yang membangun NADPH. Kemudian elektron-elektron keluar dari NADPH menuju ke membran flavoprotein yang mengandung FAD dan selanjutnya menuju ke sitokrom dan membran plasma. Elektron tersebut membuat terbentuknya radikal bebas. Radikal bebas yang dihasilkan berupa reactive oxigen species (ROS) dan reactive nitrogen species
(RNS), contohnya hidrogen peroksida (H2O2), nitrit oksida (NO), dan anion superoksida (Mikelsaar & Zilmer 2009).
Gambar 19 Foto mikrograf duodenum tikus pada hari ke-15 yang diwarnai secara imunohistokimia terhadap Cu,Zn-SOD. Warna coklat menandakan adanya kandungan enzim Cu,Zn-SOD di dalam sel. Dapat dilihat bahwa kandungan enzim tertinggi terdapat pada kelompok perlakuan L. fermentum (C), diikuti kelompok perlakuan L. fermentum + EPEC (E) dan L. plantarum (B). Kandungan enzim Cu,Zn-SOD kelompok perlakuan L. plantarum
47