TRANSFORMASI
GENETIK
JARAK
PAGAR
(
Jatropha
curcas
L.)
DENGAN
GEN
MmCuZn-SOD
PENYANDI
SUPEROKSIDA
DISMUTASE
MELALUI
PERANTARA
Agrobacterium
tumefaciens
ANITA
THERESIA
SEKOLAH
PASCA
SARJANA
INSTITUT
PERTANIAN
BOGOR
PERNYATAAN
MENGENAI
TESIS
DAN
SUMBER
INFORMASI
Dengan ini saya menyatakan bahwa tesis berjudul Transformasi Genetik
Jarak Pagar (Jatropha curcas L.) de ngan gen MmCuZn-SOD pe nyandi
superoksida dismutase melalui perantara Agrobacterium tumefaciens adalah karya
bersama saya dengan komisi pembimbing dan belum diajukan dalam bentuk
apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau
dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah
disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir
tesis ini.
Bogor, Januari 2012
Anita Theresia
ABSTRACT
ANITA THERESIA. Genetic Transfor mation of Jatropha curcas L. with
MmCuZn-SOD gene by Agrobacterium tumefaciens. Supervised by
SUHARSONO and UTUT WIDYASTUTI SUHARSONO.
This research has an objective to ob tain the transgenic Jatropha curcas
shoo ts containing MmCuZn-SOD gene. For genetic transfor mation, we used the
pieces of cotyledons as an explants. These cotyledons were obtained from 2 week
old seedlings. By co-cultivation with Agrobacterium tumefaciens containing
MmCuZn-SOD gene under the control of 35S CaMV promoter linked to
hygromyc in phosphotrans ferase selectable marker gene. We have successfully
regenerated the putative transgenic shoots of J. curcas from the explants. The
selection of putative transgenic shoots was carried out by using 1.5 mg/l
hygromycin. Molecular analysis by PCR showed that two of sixteen independe nt
putative transgenic shoots resulted from indirect selection contain the target gene.
These results indicated that we already successfully introduced the MmCuZn-SOD
gene into J. curcas and obtained the transgenic adventives shoo t of J. curcas.
RINGKASAN
ANITA THERESIA. Transformasi Genetik Jarak Pagar (Jatropha curcas L.)
dengan gen MmCuZn-SOD penyandi superoks ida dismutase melalui perantara
Agrobacterium tumefaciens. Dibimbing oleh SUHARSONO dan UTUT
WIDYASTUTI SUHARSONO.
Jarak pagar (Jatropha curcas L.) adalah tanaman sumber bioenergi yang
menjanjikan. Namun, budidaya J. curcas secara besar-besaran akan menggeser
penggunaan lahan untuk tanaman pangan. Penggunaan lahan marginal adalah
jalan keluar yang bisa dilakukan mengingat Indonesia masih mempunyai banyak
lahan marginal yang belum optimal dimanfaatkan. Untuk membuat J. curcas tetap
menghasilkan biji dengan kuantitas dan kualitas yang baik jika ditanam di lahan
marginal, perbaikan genetik tanaman ini perlu dilakukan. Superoksida dismutase
adalah enzim yang berperan penting dalam mengatasi cekaman abiotik yang
banyak terdapat di lahan marginal sehingga ekspresi berlebih gen pe nyandi enzim
ini pada tanaman J. curcas dapat memperbaiki toleransi tanaman ini terhadap
ceka man abiotik.
Penelitian ini bertujuan unt uk mendapatka n tunas J. curcas transgenik
yang mengandung gen MmCuZn-SOD. Untuk mendapa tka n tanaman transgenik,
eksplan diambil dari daun kotiledon yang berasal dari kecambah yang berumur 2
minggu. Potongan kotiledon yang berukuran 0.7 cm x 0.7 cm diinokulasi dengan
Agrobacterium tumefaciens LBA4404 yang mengandung gen MmCuZn-SOD di
bawah kendali promoter 35S CaMV dan terminator Nos dan ditumbuhkan secara
bersama-sama (ko-kultivasi) selama 3 hari. Setelah ko-kultivasi, eksplan
ditumbuhkan di media induksi kalus tanpa agen seleksi selama 3 minggu. Kalus
ditumbuhkan di media regenerasi sampai menghasilkan tunas. Regenerasi dengan
menggunakan agen seleksi 1.5 mg/l higromisin dari mulainya proses regenerasi
(media SR1) hanya menghasilkan 2 tunas transgenik putatif dari 59 kalus atau 3.4
% sedangkan penggunaan agen seleksi yang sama pada 2 minggu setelah tanam di
media regenerasi (media SR2) menghasilkan 23 tunas transgenik putatif
independen dari 60 kalus atau 26.7%. Tunas-tunas ini dipindahkan ke media
perpa njangan tunas yang mengandung 1.5 mg/l higromisin. Analisis molekular
terhadap tunas transgenik putatif yang dihasilkan dari media SR2 dengan PCR
menggunakan primer 35sF dan MmsodR menunjukkan bahwa 2 dari 16 tunas
transgenik putatif mengandung gen sasaran MmCuZn-SOD. Walaupun sudah
mendapatkan tunas transgenik, penelitian ini belum berhasil mendapatkan
tanaman transgenik yang mempunyai akar. Hal ini kemungkinan disebabkan oleh
penggunaan antibiotik cefotaxime dan higromisin yang terus menerus dan J.
curcas sangat sensitif terhadap antibiotik. Cefotaxime selalu diberikan dari sejak
induksi kalus sampai dengan proses pengakaran untuk mematikan A. tumefaciens.
Untuk meningkatkan efisiensi transformasi, penggunaan ant ibiot ik seperti
higromisin, kanamisin, cefotaxime harus dikurangi atau ditiadakan, diganti
dengan sistem seleksi yang lain.
©
Hak
cipta
milik
IPB,
tahun
2012
Hak
cipta
dilindungi
Undang-Undang
1. Dilarang mengutip sebagian atau seluruh karya tesis tanpa
mencantumkan atau menyatakan sumber
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah.
b. Pengutipan tidak merugikan kepentingan yang wajar Institut Pertanian Bogor.
TRANSFORMASI
GENETIK
JARAK
PAGAR
(
Jatropha
curcas
L.)
DENGAN
GEN
MmCuZn-SOD
PENYANDI
SUPEROKSIDA
DISMUTASE
MELALUI
PERANTARA
Agrobacterium
tumefaciens
ANITA
THERESIA
Tesis
Sebagai salah satu syarat untuk memperoleh gelar
Magister Sains pada
Program Studi Bioteknologi
SEKOLAH
PASCASARJANA
INSTITUT
PERTANIAN
BOGOR
Judul Tesis : Transformasi Jarak Pagar (Jatropha curcas L.) dengan gen MmCuZn-SOD pe nyandi superoksida dismutase melalui
perantara Agrobacterium tumefaciens
Nama Mahasiswa : Anita Theresia
NIM : P051090081
Program Studi : Bioteknologi
Disetujui
Komisi Pembimbing
Prof. Dr. Ir. Suharsono, DEA
Dr. Ir. Utut W. Suharsono, M.Si.
Ketua Anggota
Diketahui
Ketua Program Studi Bioteknologi Dekan Sekolah Pascasarjana
Prof. Dr. Ir. Suharsono, DEA
Dr. Ir. Dahrul Syah, M.Sc.Agr
NIP 19610428 198703 1 003 NIP 19650814 199002 1 001
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah pencipta alam semesta
atas segala limpahan rahmat-Nya sehingga penelitian dan penulisan tesis ini
berhasil diselesaikan. Tesis dengan judul Transformasi Jarak Pagar (Jatropha
curcas L.) denga n gen MmCuZn-SOD penyandi superoksida dismutase melalui
perantara Agrobacterium tumefaciens ini disusun sebagai salah satu syarat untuk
memperoleh gelar Magister Sains pada Program Studi Bioteknologi, Sekolah
Pascasarjana, Institut Pertanian Bogor.
Selama menjalani perkuliahan hingga terselesaikannya tesis ini, penulis
banyak mendapat bantuan moral maupun material dari berbagai pihak. Oleh
karena itu penulis menyampaikan terimakasih kepada: Bapak Prof. Dr. Ir.
Suharsono, DEA dan Ibu Dr. Ir. Utut W. Suharsono, M.Si selaku komisi
pembimbing atas arahan dan bimbingan selama penelitian dan penulisan tesis
dengan penuh kesabaran dan ketelitian. Penulis juga menyampaikan terimakasih
kepada Hibah Kompetensi dari Ditjen Pendidikan Tinggi (DIKTI), Kementerian
Pendidika n Nasional de ngan judul “Isolasi dan Ekspresi gen dalam rangka
perakitan tanaman yang toleran terhadap cekaman asam dan alumunium” atas
nama Dr. Suharsono dengan no kontrak 224/PH2H/PP/DP2M/III/2010 tanggal 1
Maret 2010 yang telah membiayai penelitian ini. Terimakasih kepada Bapak Dr.
Aris Tjahjoleksono, DEA selaku Penguji Luar Komisi pada Ujian Tesis, yang
telah memberikan saran dan bantuan untuk perbaikan Tesis.
Ungkapan terimakasih juga disampaikan kepada seluruh dosen pengajar,
staf dan rekan mahasiswa Program Studi Bioteknologi terutama angkatan 2009.
Kepada Bu Hanum, Bu Yohana, Pak Ulung, Bu Ratna dan Pak Radite yang telah
banyak membantu dalam penelitian dan penulisan tesis, kepada Pak Asri, Bu
Hani, Bu Ifa, Bu Ida, Mbak Pepi, Mbak Nia, Mbak Sarah, Pak Mulya, Pak Itar,
Pak Asep, Pak Yusman, Mbak Yani, Pak Adi, Pak Edi, Mbak Ulfa, Nurul, Ophie,
Davis, serta seluruh anggota Biorin lainnya dari angkatan lama sampai dengan
angkatan terbaru penulis mengucapkan terimakasih untuk proses saling
menguatkan semangat.
Terimakasih penulis sampaikan kepada Ayahanda Sarwiyoto, Ibunda
Mulyani, Leo, Wawan dan Sari serta seluruh keluarga atas dukungan do’a, moral
sampai dengan bantuan finansial. Semoga semua kebaikan yang telah diberikan
akan dikembalikan oleh Allah dengan berlipat ganda.
Penulis menyadari bahwa tesis ini masih belum sempurna. Namun penulis
berharap laporan tesis ini dapat bermanfaat.
Bogor, Januari 2012
RIWAYAT
HIDUP
Penulis dilahirkan di Salatiga pada tanggal 6 April 1981 dari ayah
Sarwiyoto dan ibu Mulyani. Penulis merupakan putri pertama dari empat
bersaudara.
Tahun 1999 penulis lulus dari SMU N 2 Pelepat, Muara Bungo, Jambi dan
pada tahun yang sama lulus seleksi masuk UGM melalui jalur ujian masuk
perguruan tinggi negeri (UMPTN). Penulis memilih Program Studi Biologi,
Fakultas Biologi. Penulis masuk Program Pascasarjana IPB Program Studi
DAFTAR
ISI
Halaman
DAFTAR TABEL ………. xii
DAFTAR GAMBAR ………. xiii
DAFTAR LAMPIRAN ……….. xiv
PENDAHULUAN ……….. 1
Latar Belakang……… 1
Tujuan Penelitian……… 2
TINJAUAN PUSTAKA ……… 3
Biologi Jatropha curcas ……… 3
Potensi Jatropha curcas sebagai Sumber Bioenergi ……….. 4
Lahan Marginal dan Permasalahannya ……….. 6
Superoksida Dismutase ……… 7
Transformasi pada Jatropha curcas ………. 9
BAHAN DAN METODE ………. 11
Bahan Penelitian ……… 11
Metode Penelitian ………. 11
Sterilisasi dan Pengecambahan Biji Jatropha curcas ……….. 11
Ko-kultivasi Eksplan Jatropha curcas ………. 12
Regenerasi Eksplan Jatropha curcas ……… 12
Isolasi DNA Total Jatropha curcas ……….. 13
Analisis Integrasi Gen MmCuZn-SOD……… 13
HASIL DAN PEMBAHASAN ……….. 15
Persiapan Eksplan Kotiledon ………. 15
Transformasi Genetik Jatropha curcas ………. 15
Analisis Integrasi Gen MmCuZn-SOD di dalam Genom Jatropha curcas ………. 19
Pertumbuhan Tunas Transgenik Jatropha curcas ……… 20
KESIMPULAN DAN SARAN ……….. 22
DAFTAR PUSTAKA………. 23
DAFTAR
TABEL
Halaman
1 Komposisi asam lemak pada beberapa minyak tumbuhan (%) (Akbar et
al. 2009) ……….. 6
2 Jumlah ka lus da n jumlah tunas transgenik putatif pada perlakuan
DAFTAR
GAMBAR
Halaman
1 Tanaman jarak pagar (Jatropha curcas) ………. 3
2 Peta fisik pada daerah T-DNA yang diapit oleh right border (RB) & left
border (LB) dari pGWB5 rekombinan ……… 11
3 Persiapan eksplan kotiledon. ……… 15
4 Ko-kultivasi eksplan kotiledon ……… 16
5 Pertumbuhan eksplan Jatropha curcas non-transgenik di media callus
induction (CI) dan di media shoot regeneration (SR) tanpa cefotaxime
pada umur 3-4 minggu ………. 17
6 Pembentuka n kalus dari eksplan yang telah diinok ulasi de ngan
Agrobacterium tumefaciens pada media CI mengandung cefotaxime ……. 18
7 Regenerasi tunas dari kalus di media SR ………. 18
8 Hasil analisis PCR dengan primer 35sF dan MmsodR ……… 19
DAFTAR
LAMPIRAN
Halaman
1 Komposisi media MS (Murashige & Skoog 1962) ……….. 29
PENDAHULUAN
Latar Belakang
Biji Jatropha curcas sebagai sumber energi alternatif dan energi yang
terbarukan sudah banyak digunakan. Hal ini terjadi karena biji J. curcas dapat
digunakan sebagai sumber bioenergi yaitu sebagai bahan baku biodiesel yang
dapat menggantikan posisi solar untuk bahan bakar transportasi tanpa
mengganggu minyak makan (Lapola et al. 2009). Dibandingkan dengan solar,
biodiesel dari J. curcas yang merupaka n energi terbaruka n aka n lebih ramah
terhadap lingkungan dan sangat sesuai dengan ekonomi rakyat (Francis et al.
2005).
Untuk menyediaka n biji J. curcas sebagai bahan baku biodiesel,
dibutuhkan tanaman yang berkualitas. Tanaman yang berkualitas diharapkan akan
menghasilkan kuantitas dan kualitas biji yang baik. Meskipun tanaman jarak
dikenal sebagai tanaman yang dapat tumbuh di lahan yang kurang optimal atau
sering disebut lahan marginal, be lum ada yang melaporkan bahwa kondisi tersebut
tidak mempengaruhi kuantitas dan kualitas bijinya (Zong et al. 2010). Sebaliknya,
hasil biji J. curcas dipengaruhi oleh berbagai faktor seperti lingkungan
(Openshaw 2000), genetik (Ginwal et al. 2004 ), da n manajemen budida ya (Gour
2006).
Manipulasi terhadap salah satu faktor yang mempengaruhi kualitas biji
yaitu genetik diharapka n mampu memperbaiki kualitas tanaman (Zong et al.
2010). Disamping itu, faktor lain seperti lingkungan dapat menjadi pertimbangan
dalam melakukan manipulasi genetik. Berdasarkan pertimbangan bahwa budida ya
J. curcas diharapkan tidak mengganggu lahan tanaman pangan, pengembangan
penanaman J. curcas diarahkan ke lahan marginal tetapi lahan yang demikian
memberikan faktor lingkungan yang kurang menguntungkan untuk produksi biji
J. curcas. Faktor lingkungan yang dimaksud adalah banyaknya cekaman
lingk ungan abiotik di lahan marginal (Yuwono 2009). Oleh karena itu, manipulasi
genetik terhadap sifat toleran cekaman lingkungan abiotik diharapkan mampu
menambah kualitas tanaman J. curcas.
Cekaman lingkungan abiotik pada tanaman menyebabkan meningkatnya
peroksida (H2 O 2 ), single oks igen da n radika l ok sigen (Badawi et al. 2004;
Suharsono 2006). ROS ini bersifat sitotoksik dan dapat menyebabkan gangguan
pada metabolisme yaitu dengan pengrusakan oksidatif terhadap lipid, asam
nukleat, dan protein (Imlay & Linn 1988). Hal ini menyebabkan mutasi,
penghancuran protein dan peroksidasi membran lipid sehingga terjadi proses
degeneratif pada sel tanaman (karsinogenesis, imonodefisiensi dan penuaan)
(Miller et al. 2007). Mekanisme pertahanan terhadap pengrusakan oksidatif ini
dilakukan oleh beberapa enzim. Enzim yang terlibat dalam pertahanan pertama
pada mekanisme ini adalah superoksida dismutase (SOD).
Ekspresi berlebih (over exspression) gen SOD dilaporkan dapat
meningkatkan toleransi tanaman terhadap kekeringan dan lahan asam (Sens et al.
1993; Luit et al. 1995; Hasegawa et al. 2000; Hannum 2009). Badawi et al.
(2004) melaporkan bahwa ekspresi berlebih CuZn-SOD pada Nicotiana tabacum
transgenik mampu meningkatkan sistem antioksidan pada tanaman tersebut.
Hannum et al. (2009) telah berhasil mengisolasi gen CuZn-SOD dari Melastoma
malabatricum (MmCuZn-SOD).
Tujuan Penelitian
Penelitian ini bertujuan untuk merakit tunas J. curcas transgenik yang
mengandung gen MmCuZn-SOD melalui pe rantara Agrobacterium tumefaciens
TINJAUAN
PUSTAKA
Biologi Jatropha curcas
Tanaman J. curcas merupakan tanaman yang berasal dari Meksiko,
Amerika tengah yang menyebar ke Malaka dan Filipina setelah tahun 1700-an
(Heller 1996). Tumbuhan ini masuk ke Indonesia selama penjajahan Jepang
(1942-1945). J. curcas termasuk salah satu spesies dari genus Jatropha, famili
Euphorbiaceae, ordo Euphorbiales, kelas Dicotyledonae, sub divisi Angiospermae
(Hambali et al. 2007). Menurut Hasnam dan Mahmud (2006) sebagian besar
genus ini mempunyai jumlah kromosom 2n=44.
Hasnam dan Mahmud (2006) menyebutkan tanaman J. curcas berupa
perdu dengan tinggi tanaman bisa mencapai 5-10 m, de ngan sistem percabangan
tidak teratur (Gambar 1A). Batangnya berkayu dan silindris, bila terluka
mengeluarkan getah berwarna putih. Batang J. curcas umumnya menghasilkan
cabang primer dan sekunder. Menurut Raden (2009), tanaman J. curcas secara
alami mempunyai pola pertumbuhan cabang secara spiral, tipe percabangannya
adalah dikotomus (membagi dua) yang tumbuh dari tunas terminal dan bersifat
indeterminate. Sudut cabang J. curcas berkisar 40-45 derajat yang menunjukkan
bahwa arah tumbuh atau sifat percabangan J. curcas condong ke atas (patens).
Gambar 1 Tanaman jarak pagar (Jatropha curcas). (A) pohon, (B) buah J.
curcas, (D’Ayala 2008) (C) biji J. curcas.
Berdasarkan hasil penelitian Raden (2009), stadia perkembangan daun
mempengaruhi karakter morfologi dan fisiologi daun J. curcas. Daun J. curcas
dapat bertahan sampai umur 14 minggu (3.5 bulan) dengan posisi dan penyebaran
daun yang memiliki filotaksis 5/13 dengan sudut antar daun 138 drajat sehingga
curcas pada saat muda berwarna merah kecoklatan. Seiring dengan bertambahnya
umur daun, warna daun berubah menjadi hijau muda kemudian berubah menjadi
hijau tua hingga akhirnya mengalami senesens.
Kebiasaan pembungaan J. curcas dapat dilihat dari pertumbuhan daun dan
cabangnya. Tanaman yang berasal dari biji atau cabang yang tumbuh dari setek,
terlebih dahulu akan membentuk 60-70 daun, sebelum membentuk cabang. Jadi
diperluka n waktu 4-5 bulan sebelum tanaman membentuk cabang (umumnya 2
cabang). Pada tiap cabang akan terbentuk 8-10 daun sebelum keluar bunga
majemuk (inflorescence/malai/tandan), demikian seterusnya, diperlukan 8-10
daun keluar sebelum malai ke-2 terbentuk, jadi selang pembentukan malai 16-30
hari. Umur daun 60-75 hari, dan setelah masa tersebut daun akan gugur, atau
gugur karena kekeringan. Jika kondisi tumbuh baik, biasanya dari satu cabang
akan terbentuk 3-4 malai, atau setelah terbentuk 3 malai akan terbentuk cabang
baru. Jika kondisi kurang baik, buah atau malai akan gugur (mengalami
degenerasi), sehingga produktivitas tanaman akan menurun. Oleh sebab itu jika
kondisi tumbuh baik dapat dilakukan panen dua kali, yaitu buah dari malai 1 dan
2 dari inflorescen 3 dan 4 (Hasnam & Mahmud 2006).
Buah J. curcas (Gambar 1B) terdiri atas kulit buah dan biji (Gambar 1C).
Kulit buah maupun kulit biji digunakan untuk kayu bakar dan bahan baku pupuk
organik. Biji J. curcas dapat dipress sampai mengeluarkan minyak jarak dan
menyisakan bungkil. Minyak jarak digunakan sebagai salah satu sumber
biodiesel. Hasil samping pembuatan biodiesel berupa gliserin dapat digunakan
sebagai bahan baku pembuatan sabun. Bungkil J. curcas dapat diolah menjadi
arang briket yang dapat dijadikan sebagai salah satu sumber energi alternatif
untuk b ahan bakar rumah tangga (Hasnam & Mahmud 2006).
Potensi Jatropha curcas sebagai Sumbe r Bioenergi
Bioenergi dipertimbangkan sebagai energi alternatif pengganti ba han
bakar minyak bumi untuk mengurangi emisi karbon ke udara dan untuk mengatasi
meningkatnya harga minyak bumi. Dua macam sumber bioenergi yang saat ini
dipertimbangkan adalah bioethanol untuk menggantikan bensin dan minyak
tumbuhan (biodiesel) untuk menggantikan solar (Lapo la et al. 2009).
minyak yang renewable dan ramah lingkungan. Salah satu sumber biodiesel yang
diperhitungkan adalah minyak dari J. curcas. Minyak J. curcas dipertimbangkan
sebagai sumber biodiesel yang sesuai dengan ekonomi rakyat (Francis et al.
2005).
Minyak J. curcas be rasal dari bijinya. Buah menghasilkan biji dan biji ini
yang mengandung minyak yang kemudian dapat digunakan sebagai sumber bahan
bakar (Jongschaap et al. 2007; Gupta et al. 2008). Berdasarkan kondisi fisiologis
dan lingkungan tumbuhnya, rata-rata bahan kering tanaman J. curcas terdiri atas
25% batang, 25% daun dan 50% buah. Energi kotor biji berkisar antara 20.8-25.5
MJ/kg dengan kadar minyak biji rata-rata sebesar 35% (Jongschaap et al. 2007).
Informasi lain yang dikemukakan oleh Li et al. (2008) mengatakan bahwa
kandungan minyak biji J. curcas berkisar 51.3-61.2%. Penelitian Akbar et al.
(2009) menunjukkan ba hwa kandungan minyak J. curcas mencapai 63.16%.
Kandungan ini lebih tinggi jika dibandingkan dengan kandungan minyak pada biji
rami, kedelai dan kelapa sawit yang masing- masing adalah 33.33% , 18.35% dan
44.6% (Gunstone 1994).
Ada berbagai macam minyak tumbuhan yang berpo tensi untuk
memprod uksi asam lemak methyl ester atau biodiesel, akan tetapi kualitasnya
dipengaruhi oleh komposisi di dalam minyak tersebut. Ada tiga tipe asam lemak
yang dapat ditemukan dalam minyak yaitu saturated, monounsaturated dan
polyunsaturated dengan 2 atau 3 ikatan ganda. Idealnya, minyak tumbuhan
seharusnya renda h asam lemak saturated juga polyunsaturated dan tinggi asam
lemak monounsaturated (Gunstone 2004). Minyak tumbuhan yang kaya asam
lemak polyunsaturated menghasilkan biodiesel dengan stabilitas oksidasi yang
rendah. Minyak tumbuhan dengan asam lemak saturated yang tinggi
menghasilkan biodiesel yang titik bekunya tinggi. Minyak dengan kandungan
asam lemak saturated yang tinggi ini tidak diharapkan karena akan menjadi padat
pada suhu rendah meskipun akan sangat baik pada iklim yang panas. J. curcas
yang mempunyai kandungan asam lemak monounsaturated 45.4%,
polyunsaturated 33%, saturated 21.6% (Tabel 1), dan mempunyai ka ndungan
layak digunakan sebagai sumber biodiesel di daerah beriklim tropis dan subtropis
(Akbar et al. 2009).
Tabe l 1 Komposisi asam lemak pada beberapa minyak tumbuhan (%) (Akbar et
al. 2009)
Asam lemak Biji
J. curcas
Biji
kelapa
Biji bunga
matahari
Biji
kedelai
Buah
kelapa
sawit sawit
Saturated 21.6 82.1 11.3 15.1 49.9
Monounsaturated 45.4 15.4 21.1 23.4 39.2
Polyunsaturated 33 2.4 66.2 61.1 10.5
Lahan Marginal dan Permas alahannya
Di Indo nesia, laha n marginal dijumpai baik pada lahan basah maupun
lahan kering. Lahan basah berupa laha n gambut, lahan sulfat masam dan rawa
pasang surut seluas 24 juta ha, sementara lahan kering berupa tanah Ultisol 45.7
juta ha da n Oxisol 18 juta ha (Suprapto 2002; Subagyo et al. 2004). Indo nesia
memiliki panjang garis pantai mencapai 106000 km dengan potensi luas lahan
1060000 ha yang secara umum termasuk lahan marginal. Berjuta-juta hektar lahan
marginal tersebut tersebar di beberapa pulau, prospeknya baik untuk
pengembangan pertanian namun sekarang ini belum dikelola dengan baik. Lahan-
lahan tersebut ko ndisi kesuburannya rendah sehingga diperlukan inovasi teknologi
untuk memperbaiki produktivitasnya (Yuwono 2009).
Ultisol sebagai salah satu jenis tanah yang memiliki sebaran luas di
Indonesia, yaitu 45789000 ha yang meliputi hampir 25% dari total daratan
Indo nesia (Suba gyo et al. 2004) merupaka n jenis tanah yang memberikan banyak
ceka man abiotik ba gi tanaman. Tanah ultisol umumnya mempunyai nilai
kejenuhan basa < 35%, reaks i tanah ini pada umumnya sangat asam (pH 3.10-5).
Nilai kejenuhan Al yang tinggi terdapat pada tanah Ultisol dari bahan sedimen
dan granit, mencapai > 60%. Seperti yang dijelaskan oleh Prasetyo dan
Suriadikarta (2006 ), kesuburan alami tanah Ultisol umumnya terdapat pada
hor izon A yang tipis dengan kandungan bahan organik yang renda h. Unsur hara
makro seperti fosfor dan kalium yang sering kahat, reaksi tanah asam hingga
sering menghambat pertumbuhan tanaman. Toksisitas Al juga menjadi masalah
utama yang menghambat produktivitas pertanian pada lahan asam di dunia,
dimana luasan lahan asam mencapai 40% dari luasan bumi (Kochian 1995).
Konsentrasi mikromolar senyawa Al yang larut dalam tanah sudah dapat
mengakibatkan toksisitas yang serius pada tanaman. Produksi tanaman juga dapat
menurun secara drastis karena uptake air dan unsur hara terganggu (Kochian
1995). Tidak semua bentuk dari Al bersifat toksik, masing- masing bentuk
memiliki tingkat toksisitas yang berbeda. Pada umumnya kation trivalen bersifat
toksik bagi tanaman dan Al3+ merupakan bentuk yang paling toksik, meskipun Al
dalam bentuk divalen dan monovalen juga bersifat toksik. Larutan dengan pH
yang lebih rendah dari 5.0 menyebabkan ion Al berada dalam bentuk oktahedral
heksahidrat, Al(H2 O)63+, sering disingkat, dengan Al3+. Pada pH 5-7, Al(H2 O)63+
mengalami deprotonasi menjadi Al(OH)2+ dan Al(OH)2 +. Peningkatan pH akan
mengakibatkan Al berbentuk solid Al(OH)3 dan mengendap. Pada keadaan basa
Al akan membentuk tetrahedral, Al(OH)4 - (Delhaize & Ryan 1995; Kochian
1995).
Keracunan ion Al3+ merupakan hambatan yang pa ling nyata terhadap
produksi pertanian di tanah asam. Keracunan Al ini mampu mengakibatkan
produksi tanaman menurun 25% sampai 85% (Kochian 1995). Rendahnya
produktivitas menyebabkan tanah asam yang luas ini masih belum bisa
dimanfaatkan secara optimal sebagai lahan pertanian. Cekaman-cekaman akibat
keracunan Al3+ dan lahan asam sering disebut cekaman abiotik. Selain kedua
cekaman tersebut masih ada cekaman yang lain seperti kekeringan dan keracunan
logam berat selain Aluminum.
Superoksida Dis mutas e
Superoksida dismutase (SOD) adalah metaloenzim yang merupakan
pertahanan pertama dalam proses detoksifikasi untuk mengatasi cekaman abiotik.
SOD mengubah O 2.- menjadi H2 O 2 dan air (H2 O) (Suharsono 2006). Baik O 2.-
maupun H2 O2 adalah ROS yang diprod uksi semakin banyak oleh sel sebagai
akibat adanya cekaman pada tanaman. ROS bersifat sitotoks ik da n dapat
mengacaukan metabolisme normal melalui kerusakan oks idatif terhadap lipid,
peroksidasi membran lipid sehingga menyebabkan penyakit dan proses
degeneratif (McKersie et al. 1994; Suharsono 2006).
Kloroplas, peroksisom, dan mitokondria adalah pusat utama produksi ROS
pada tumbuh-tumbuhan hijau. Beberapa tipe ROS yang diproduksi oleh tanaman
adalah O 2.-, H2 O2 , radikal hidroksil (HO.) dan single oksigen (1O 2) sebagai
konsekuensi metabolisme aerobik (Suharsono 2006; Martins et al. 2011).
Beberapa tipe ROS tersebut diproduksi secara spesifik di dalam organel sel, 1O2
di produksi di dalam fotosistem II, O 2.- di dalam fotosistem I dan mitokondria,
sedangkan peroksisom memproduksi O 2.- dan H2 O 2 (Moller et al. 2007). H2 O2
relatif lebih stabil dan dapat dibuang dengan sistem antioksidan sel yang normal
(Yannarelli et al. 2006). Sel-sel tanaman membutuhkan kontrol tingkat
keberadaan ROS untuk mengatasi ke lebihan ROS. Untuk membantu detoksifikasi
terhadap kelebihan ROS, tanaman mempunyai sistem pertahanan antioksidan
yang efisien yang terdiri atas mekanisme enzimatik dan non-enzimatik. SOD
adalah salah satu enzim yang termasuk dalam mekanisme enzimatik selain
katalase, peroksidase dan reduktase. SOD, seperti disebut sebelumnya, mengubah
O 2.- menjadi H2 O 2 yang dapat ditemuka n hampir di semua kompartemen sel, dan
merupakan satu dari siklus pembuangan ROS yang penting di dalam kloroplas,
sitosol, mitokondria, peroksisom, apoplas (Mittler 2002).
Sebagai enzim penting dalam proses detoksifikasi terhadap kelebihan
ROS, SOD menjadi perhatian banyak peneliti. Badawi et al. (2004) melaporkan
keberhasilannya dalam menyisipkan gen CuZn-SOD dari Oryza sativa ke dalam
N. tabacum. Mereka melakuka n uji terhadap tanaman transgenik tembaka u yang
diperoleh dan ternyata ekspresi berlebih SOD tersebut menambah kemampuan
tanaman N. tabacum untuk tetap hidup pada cekaman garam, cekaman kekeringan
dan cekaman polietilen glikol (PEG). Lee et al. (2007) mengukur degradasi
klorofil yang diinduksi ROS akibat cekaman oleh metal viologen (MV), H2 O2
dan logam berat cadmium, arsenik dan copper pada tanaman Festuca arundinacea
kemudian membandingkannya dengan tanaman transgenik F. arundinacea yang
mengekspresikan secara berlebih gen CuZn-SOD dari ubi ka yu dan askorbat
peroksidase (APX) dari kacang polong. Hasil penelitian Lee et al. (2007) ini
berat cadmium, arsenik dan copper tersebut secara signifikan berkurang pada
tanaman F. arundinacea transgenik. Isolasi gen CuZn-SOD dari M.
malabathricum telah dilakukan. Pembungka man terhadap gen tersebut
menyebabkan kematian ketika tanaman M. malabathricum dipapar oleh aluminum
(Hannum et al. 2009). Hal ini membuktikan bahwa SOD mempunyai peranan
dalam detoksifikasi yang disebabkan oleh cekaman aluminum.
Transformas i pada Jatropha curcas
Sebagai sumber bioenergi, J. curcas ke mudian dianggap sebagai salah satu
komoditi penting sehingga penanamannya dalam skala besar menjadi sebuah isu
penting juga. Salah satu kelemahan J. curcas sebagai bahan bakar adalah bahwa
hasil pa nennya masih renda h. Oleh sebab itu, perbaikan genetik J. curcas sangat
dibutuhkan. Usaha pe muliaan suda h menghasilka n ke majuan yang cukup ba ik
dalam peningkatan hasil pa nen (Basa & Sujatha 2009). Meskipun demikian,
belum banyak kemajuan yang diperoleh dari pemuliaan tradisional yang
menyangkut pada ketahanan dan toleransi J. curcas terhadap cekaman abiotik
maupun biot ik. Inovasi bioteknologi ke mudian dipertimba ngka n seba gai cara
perba ika n genetik pada hasil panen J. curcas, seperti pembuatan tanaman
transgenik (Travella et al. 2005 ; Trivedi et al. 2009; Kumar et al. 2010).
Inovasi bioteknologi memunculkan beberapa penelitian mengenai
transformasi J. curcas menggunakan A. tumefaciens. Penelitian-penelitian tersebut
meliputi metode transformasi pada J. curcas. Li et al. (2008) berhasil membuat
tanaman transgenik dengan efisiensi 15%, dengan perantara A. tumefaciens,
menggunakan eksplan yang paling baik adalah eksplan kotiledon dan zat pengatur
tumbuh benzil adenine (BA), 3-asam indolbutirat (IBA) dan asam giberilat
(GA3). Menur ut Pan et al. (2010), kunci keberhasilan mereka dalam
menghasilkan tanaman transgenik adalah tidak menggunakan antibiotik untuk
menyeleksi pada saat pertumbuhan eksplan di dalam media induksi kalus. Seleks i
dilakukan pada saat regenerasi dengan menggunakan 20 mg/l kanamisin. Efisiensi
transformasi yang diperoleh adalah 30.8%. Efisiensi yang hampir sama diperoleh
pada penelitian Kumar et al. (2010) dengan menggunakan eksplan daun yaitu
29%. Menurut Kumar et al. (2010) hasil yang terbaik diperoleh dengan
diikuti 4 hari ko-kultivasi. Semua pe nelitian tersebut menggun aka n A.
BAHAN
DAN
METODE
Bahan Penelitian
Bahan yang akan ditransformasi adalah eksplan kotiledon yang diperoleh
dari pengecambahan biji J. curcas kultivar IP-2P yang diperoleh dari perkebunan
J. curcas Pakuwon (Puslitbun, Deptan) di Sukabumi. Sementara itu, gen yang
akan diintrod uks ika n ada lah gen MmCuZn-SOD ya ng diisolasi dari M.
malabathricum, diklon ke dalam plasmid pGWB5 dan sudah disisipkan ke dalam A. tumefaciens LBA4404 (Hannum 2009). Selain mengandung gen MmCuZn-
SOD, plasmid ini mengandung gen penanda seleksi neomyc in phosphotransferase
II (NPT II), green fluorescent protein (GFP) da n higromisin phosphotransferase
(HPT). Primer 35sF (5’-AAACCTCCTCGATTCCATT-3’) dan MmsodR (5’-
TTAACCCTGGAGACCAATGAT-3’) digunakan untuk mendeteksi integrasi gen
MmCuZn-SOD di dalam tanaman J. curcas transgenik. Primer ini didesain
berdasarkan urutan nukleotida pada promoter 35S CaMV dan gen MmCuZn-SOD
(Gambar 2).
Gambar 2 Peta fisik pada daerah T-DNA yang diapit oleh right border (RB) &
left border (LB) dari pGWB5 rekombinan (Hannum 2011,
komunikasi pribadi). : primer untuk amplifikasi transgen
MmCuZn-SOD di dalam genom tanaman transgenik.
Metode Penelitian
Sterilisas i dan penge cambahan biji Jatropha curcas. Sterilisasi
dilakukan dengan merendam biji J. curcas yang sudah dikupas kulitnya pada
ethanol 70% selama 30 detik kemudian dimasukkan ke dalam larutan pemutih
(NaClO 5.25%) 40% selama 30 menit. Biji yang sudah disterilisasi selanjutnya
dicuci dengan air steril sebanyak 5 kali. Biji dikecambahkan pada media ½ dari
terang pada 28 C. Kotiledon dari kecambah diambil dan dipotong menjadi
suhu 28 C, kemudian dicuci dengan air steril dan air yang mengandung 100 mg/l
tanpa cahaya da n suhu 28 C. Media CI adalah media MS yang ditamba h dengan
suhu 28 C selama 4 minggu. Media SR adalah media MS yang ditambah dengan
o
berukuran 0.7 cm x 0.7 cm untuk dijadikan eksplan.
Ko-kultivas i Eksplan Jatropha curcas. Bakteri A. tumefaciens strain
LBA4404 yang membawa gen MmCuZn-SOD ditumbuhkan di dalam 20 ml media
Luria Bertani (LB) (Lampiran 2) cair yang mengandung 50 mg/l Streptomisin, 50
mg/l Kanamisin dan 50 mg/l Higromisin pada suhu ruang dan kondisi gelap
selama semalam dengan penggoyangan. Bakteri diendapkan dengan sentrifugasi
pada 5000 rpm selama 10 menit. Endapan bakteri disuspensikan di dalam 20 ml
media ko-kultivasi cair (media MS dengan 1.5 mg/l BA, 0.05 mg/l IBA dan 20
mg/l Asetosiringone). Proses ko-kultivasi dilakukan dengan mengikuti metode Li
et al. (2008) yaitu dengan merendam eksplan di dalam suspensi bakteri selama 10
menit, pada OD600 = 0.4-0.5. Setelah dikeringkan dengan tissue steril, eksplan
dikulturkan di atas medium ko-kultivasi padat selama 3 hari dalam gelap pada
o
cefotaxime.
Regenerasi Eksplan Jatropha curcas. Eksplan yang telah ditransformasi
dengan A. tumefaciens strain LBA4404 ditumbuhkan pada media penginduksi
ka lus yang disebut media callus induction (CI) selama 3 minggu pada kondisi
o
1.5 mg/l BA, 0.05 mg/l IBA, 100 mg/l cefotaxime dan 3 g/l polivinil pirolidon
(PVP). Setelah muncul kalus, eksplan dipindahkan pada media penginduksi tunas
yang disebut media shoot regeneration (SR) dan dikultivasi dengan cahaya pada
o
1.5 mg/l BA, 0.05 mg/l IBA, 0.5 mg/l GA3, 100 mg/l cefotaxime, 3 g/L PVP dan
1.5 mg/l higromisin. Tunas yang tumbuh selanjutnya dipindahkan ke media
perpanjangan tunas yang disebut media shoot elongation (SE) sampai panjang
tunas mencapai 2.5 cm dan selanjutnya dipindahkan ke media penginduksi akar
yang disebut media root induction (RI) selama ± 1 bulan. Media SE adalah media
MS yang ditamba h dengan 0.3 mg/l BA, 100 mg/l cefotaxime, 3 g/L PVP dan 1.5
mg/l higromisin sedangkan media RI adalah media ½ MS yang ditamba h dengan
0.3 IBA, 100 mg/l cefotaxime, 3 g/L PVP dan 1.5 mg/l higromisin (Li et al. 2008;
PVP. Ekstrak diinkubasi pada suhu 65 C selama 30 menit. Pemurnian dilakukan
perlahan. Suspensi disentrifugasi pada kecepatan 10000 rpm pada suhu 4 C
pada suhu 4 C selama 20 menit. Supernatan diendapkan dengan penambahan
volume kemudian disentrifugasi 10000 rpm suhu 4 C selama 5 menit. Endapan
0.1 volume RNAse (10 mg/ml), diinkubasikan semalam pada suhu 37 C dan
dipanaskan pada suhu 70 C selama 30 detik.
PCR adalah 94 C selama 5 menit, denaturasi 94 C selama 30 detik, penempelan
primer 55 C selama 30 detik, pemanjangan 72 C selama 1 menit, dengan 30
siklus, diakhiri dengan pasca-PCR pada suhu 72 C selama 5 menit. Hasil PCR
Isolasi DNA total Jatropha curcas. Isolasi DNA tot al J.curcas dilakukan
dengan mengikuti prosedur Suharsono (2002) dengan modifikasi. Sampel diambil
dari daun tunas J.curcas yang ditumbuhka n di media regenerasi. Daun tersebut
ditimbang sebanyak 0.1 g, dipotong-potong, dimasukkan ke dalam mortar,
ditambah nitrogen cair dan digerus hingga halus. Bubuk jaringan daun ini
kemudian dimasukkan ke dalam tabung eppendorf yang berisi 600 µl larutan
penyangga cetyltrimethyl-ammonium bromide (CTAB) dan 2 µl β-
merkaptoetanol. Larutan penyangga CTAB terdiri atas 2% CTAB, 0.1 M Tris-
HCl pH 9.5, 20 mM ethylen diamine tetra acetic (EDTA), 1.4 M NaCl dan 2%
o
di dalam campuran larutan kloroform dan isoamil alkohol (CIAA) dengan
perbandingan 24:1 sebanyak 1x volume ekstrak. Suspensi dibolak-balik secara
o
selama 20 menit. Supernatan yang diperoleh ditambah dengan 1x volume
campuran larutan PCI (Phenol: Chloroform: Isoamilalkohol dengan perbandingan
25:24:1) lalu dibolak-balik. Campuran disentrifugasi dengan kecepatan 10000 rpm
o
sodium asetat 2 M pH 5.2 sebanyak 0.1x volume dan etanol absolut sebanyak 2x
o
DNA dibilas dengan 500 µl alkohol 70% (v/v). Endapan DNA kemudian
dikeringkan dengan vakum, lalu disuspensikan dengan 50 µl ddH2 O, ditambah
o
o
Analisis Integrasi Gen MmCuZn-SOD. Keberadaan gen MmCuZn-SOD
di dalam tunas transgenik dideteksi dengan analisis polymerase chain reaction
(PCR) menggunakan primer spesifik 35sF dan MmsodR. Kompo sisi reaks i PCR
adalah 1.5 µl DNA, 1x taq buffer, 0.2 mM dNTP mix, 4% DMSO, 1.25 U taq
DNA polymerase, 0.5 µM primer 35sF dan 0.5 µM primer MmsodR. Kondisi
o o
o o
dielektroforesis di gel agarosa dengan konsentrasi 1% (b/v) pada 120 volt selama
20 menit. Gel direndam di dalam larutan 0.5 mg/l EtBr selama 20 menit kemudian
direndam di dalam air selama 15 menit. Selanjutnya, gel divisualisasi di atas UV
15 Persiapan Eksplan Kotiledon
Salah satu penentu keberhasilan transformasi gen pada tanaman adalah
jenis eksplan yang digunakan. Menurut Li et al. (2008), jenis eksplan yang paling
baik untuk transformasi genetik pada J. curcas menggunakan A. tumefaciens
adalah kotiledon dibandingka n de ngan pe tiol, hipokotil, epikotil dan daun. Oleh
karena itu, penelitian ini menggunakan kotiledon yang berumur 2 minggu sebagai
eksplan (Gambar 3).
Gambar 3 Persiapan eksplan kotiledon. (A) perkecambahan biji Jatropha curcas
berumur 3 hari di media ½ MS, (B) kecambah J. curcas berumur 14
hari di media ½ MS. Skala bar = 1 cm.
Transformasi genetik Jatropha curcas
Proses transformasi J. curcas meliputi proses ko-kultivasi dan proses
regenerasi tunas dari eksplan. Proses ko-kultivasi merupakan proses inkubasi
eksplan J. curcas dengan bakteri A. tumefaciens yang suda h membawa vektor
biner pGWB5 (Gambar 4). Proses ini memberi kesempatan kepada bakteri untuk
memindahkan gen MmCuZn-SOD ke da lam kromosom sel tana man. Gen
MmCuZn-SOD tersebut dapat dipinda hka n karena sekuen gen ini telah disisipkan
ke dalam vektor biner pGWB5 yang berfungsi seperti plasmid Ti bagi A.
tumefaciens. Tidak hanya gen MmCuZn-SOD saja yang berpindah dari A. tumefaciens ke sel tanaman tetapi juga semua DNA yang dibatasi oleh RB dan
LB yaitu gen pe nya ndi NPT II, GFP dan HPT. Gen-gen tersebut menyebabkan
sel-sel tanaman yang berhasil di transformasi akan mempunyai sifat resisten
terhadap kanamisin, berpendar di dalam gelap dan resisten terhadap higromisin.
Sifat-sifat ini dapat digunakan untuk menyeleksi sel-sel tanaman yang berhasil
ditransformasi de ngan gen MmCuZn-SOD. Sifat yang digunaka n untuk
menyeleksi sel-sel tanaman transgenik pada percobaan ini adalah ketahanan
terhadap higromisin dengan pertimbangan bahwa gen penyandi HPT berada
akan masuk ke sel tanaman setelah gen MmCuZn-SOD karena proses transfer
TDNA dimulai dari RB (Chawla 2002).
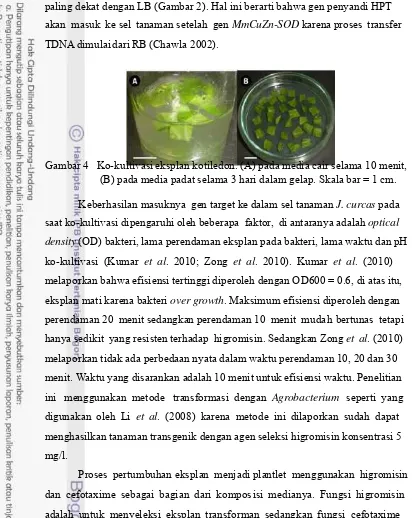
Gambar 4 Ko-kultivasi eksplan kotiledon. (A) pada media cair selama 10 menit,
(B) pada media padat selama 3 hari dalam gelap. Skala bar = 1 cm.
Keberhasilan masuknya gen target ke dalam sel tanaman J. curcas pada
saat ko-kultivasi dipengaruhi oleh beberapa faktor, di antaranya adalah optical
density (OD) bakteri, lama perendaman eksplan pada bakteri, lama waktu dan pH
ko-kultivasi (Kumar et al. 2010; Zong et al. 2010). Kumar et al. (2010)
melaporkan bahwa efisiensi tertinggi diperoleh dengan OD600 = 0.6, di atas itu,
eksplan mati karena bakteri over growth. Maksimum efisiensi diperoleh dengan
perendaman 20 menit sedangkan perendaman 10 menit muda h bertunas tetapi
hanya sedikit yang resisten terhadap higromisin. Sedangkan Zong et al. (2010)
melaporkan tidak ada perbedaan nyata dalam waktu perendaman 10, 20 dan 30
menit. Waktu yang disarankan adalah 10 menit untuk efisiensi waktu. Penelitian
ini menggunakan metode transformasi dengan Agrobacterium seperti yang
digunakan oleh Li et al. (2008) karena metode ini dilaporkan sudah dapat
menghasilkan tanaman transgenik dengan agen seleksi higromisin konsentrasi 5
mg/l.
Proses pertumbuhan eksplan menjadi plantlet menggunakan higromisin
dan cefotaxime sebagai bagian dari kompos isi medianya. Fungsi higromisin
adalah untuk menyeleksi eksplan transforman sedangkan fungsi cefotaxime
adalah untuk membunuh bakteri A. tumefaciens pada eksplan. Higromisin sebagai
agen seleksi akan membunuh sel-sel tanaman yang tidak mengekspresikan gen
hpt. Menurut Sulistyaningsih et al. (2010) tanaman transgenik sulit diperoleh pada
media yang mengandung higromisin 5 mg/l. Pada konsentrasi ini, eksplan
[image:32.612.61.475.67.585.2]itu, dalam penelitian ini eksplan non-transgenik ditumbuhkan pada ko nsentrasi
higromisin 1.5 ; 3 ; 4.5 mg/l untuk mengetahui dosis letal yang lebih rendah dari 5
mg/l. Pada proses pembentukan kalus non-transgenik, pembentukan kalus tidak
memperlihatkan perbedaan yang menyolok antara eksplan yang ditanam di media
tanpa higromisin dengan yang ditanam di media dengan higromisin sampai
dengan konsentrasi 4.5 mg/l sampai dengan 3 minggu setelah tanam (MST).
Pengaruh higromisin terlihat pada proses regenerasi di media SR yaitu kalus tidak
bertunas pada konsentrasi mulai dari 1.5 mg/l higromisin (Gambar 5). Oleh karena
itu, penelitian ini menggunakan ko nsentrasi 1.5 mg/l untuk seleksi tanaman
transgenik.
Gambar 5 Pertumbuhan eksplan Jatropha curcas non-transgenik di media callus
induction (CI) dan di media shoot regeneration (SR) tanpa cefotaxime
pada umur 3-4 minggu. (A) di media CI tanpa higromisin, (B) di
media CI yang mengandung 1.5 mg/l higromisin, (C) di media SR
tanpa higromisin, (D) di media SR yang mengandung 1.5 mg/l
higromisin. Skala bar = 1 cm.
Tanaman J. curcas sensitif terhadap higromisin dan pada saat
pembentukan kalus, gen hpt yang terintegrasi ke dalam genom belum
diekspresikan dengan baik, sehingga pada saat proses pembentukan kalus, eksplan
tidak diperlakukan dengan higromisin. Hal yang serupa ternyata dilakukan juga
oleh Pan et al. (2010) yang menyatakan bahwa kunci kesuksesan perakitan
tanaman J. curcas transgenik adalah tidak memberikan agen seleksi kanamisin
pada media pembentukan kalus. Oleh karena itu, pada penelitian ini, untuk
memperoleh tanaman transgenik, eksplan J. curcas ditumbuhkan pada media
mengandung higromisin 1.5 mg/l pembentukan kalus terlihat lebih sedikit
dibandingkan dengan media tanpa higromisin (Gambar 6).
Gambar 6 Pembentukan kalus dari eksplan yang telah diinokulasi dengan
Agrobacterium tumefaciens pada media CI mengandung cefotaxime
(A) tidak mengandung higromisin, (B) mengandung 1.5 mg/l
higromisin. Skala bar = 1 cm.
Seleksi eksplan transforman J. curcas yang tahan higromisin baru
dilakukan setelah kalus ditumbuhkan pada media SR (Gambar 7). Penelitian ini
menggunakan 2 macam pendekatan untuk melakukan seleksi kalus yang tahan
terhadap higromisin. Pendekatan pertama adalah seleksi kalus yang tahan
higromisin dilakukan sejak ditumbuhkan pada media SR (media SR 1).
Pendekatan kedua ada lah seleks i ka lus yang tahan higromisin dilakuka n setelah 2
minggu ditumbuhkan pada media SR tanpa higromisin (media SR 2).
Gambar 7 Regenerasi tunas dari kalus di media SR. (A) tunas non transgenik,
(B) tunas transgenik putatif. Skala bar = 1 c m.
Tabe l 2 Jumlah kalus dan jumlah tunas transgenik putatif pada perlakuan
higromisin dalam media regenerasi
Perlakuan
media
Jumlah kalus Jumlah kalus yang
menghasilkan tunas
transgenik putatif
Jumlah tunas
transgenik
putatif
SR 1 59 2 2
Keberadaan higromisin dalam media SR sangat mempengaruhi inisiasi
pertumbuhan tunas transgenik putatif dari kalus. Pengaruh ini terlihat dari
perbedaan jumlah tunas transgenik putatif yang dihasilkan (Tabel 2). Ketika kalus
terpapar oleh higromisin di media SR, kalus yang tidak membawa gen hpt akan
mengalami cekaman sehingga metabolisme terhambat dan akibatnya sel kalus
tidak dapat bertumbuh menjadi tunas. Itulah sebabnya kalus transgenik putatif
yang dihasilkan oleh media SR 1 jauh lebih sedikit daripada media SR 2. Tunas
transgenik putatif yang dihasilka n o leh media SR 2 be lum tentu memba wa gen hpt
karena diseleksi setelah kalus tumbuh besar yang berumur 2 minggu. Dari 23
tunas hasil regenerasi di media SR2, 16 tunas dianalisis secara molekular dengan
PCR.
Analisis Integrasi gen MmCuZn-SOD di dalam Genom Jatropha curcas
Amplifikasi transgen MmCuZn-SOD PCR dengan primer 35sF dan
MmsodR menghasilkan DNA berukuran sekitar 800 pb pada tunas transgenik
putatif. DNA yang berukuran sekitar 800 pb ini terdiri dari 363 pb ujung 3’ dari
promoter 35S CaMV dan 456 pb ujung 5’ dari MmCuZn-SOD. Dari 16 tunas
yang dihasilkan dari media SR2 yang dianalisis, 2 tunas diantaranya pos itif
membawa gen MmCuZn-SOD. PCR dengan menggunakan jaringan daun pada
tunas non-transgenik sebagai DNA cetakan tidak menghasilkan amplikon
(Gambar 9). Hal ini menunjukkan bahwa proses transformasi genetik J. curcas
dengan gen MmCuZn-SOD suda h berhasil dilakuka n.
Gambar 8 Hasil analisis PCR dengan primer 35sF dan MmsodR (M: Marker,
K+: plasmid rekombinan yang diisolasi dari E. coli, S: sampe l, K-:
tanaman control/non transgenik).
Jumlah tunas transgenik yang diperoleh masih lebih sedikit yaitu 2/16
(transgenik/putatif transgenik) apabila dibandingkan dengan hasil Sulistyaningsih
et al. (2010) yaitu 10/10. Sedikitnya jumlah tunas transgenik yang diperoleh
higromisin penyeleksi sehingga banyak kalus yang dapat tumbuh meskipun tidak
membawa gen target. Efisiensi dapat ditingkatkan dengan memodifikasi proses
transformasi karena keberhasilan masuknya gen target ke dalam sel tanaman J.
curcas pada saat ko-kultivasi dipengaruhi oleh beberapa faktor, di antaranya
adalah optical density (OD) bakteri, lama perendaman eksplan pada bakteri, lama
waktu dan pH ko-kultivasi (Kumar et al. 2010; Zong et al. 2010). J. curcas sangat
sensitif terhadap antibiotik sehingga penggunaan higromisin dan cefotaxime tidak
menghasilkan efisiensi yang baik untuk transformasi J. curcas. Oleh sebab itu,
untuk seleksi tanaman J. curcas transgenik sebaiknya menggunakan sistem seleksi
yang tidak menggunakan antibiotik, seperti yang telah dilakukan Wienstroer et al.
(2012) yang menggunakan vektor pGWB2-D-LDH de ngan D-Lactate medium
sebagai media seleksi pada tanaman Arabidopsis thaliana transgenik. Selain itu,
untuk menghindari penggunaan cefotaxime pada media secara terus menerus,
perlu modifikasi pencucian eksplan dengan cefotaxime setelah ko-kultivasi yaitu
dengan menamba h perlakua n pe nggoyangan da n waktu pe ncucian.
Pertumbuhan Tunas Transge nik Jatropha curcas
Tunas J. curcas transgenik putatif yang ditumbuhka n di media
pemanjangan tunas SE yang menggandung higromisin dan cefotaxime
mempunyai pertumbuhan yang berbeda dengan tunas non-transgenik yang
ditumbuhkan pada media yang sama tetapi tidak mengandung higromisin dan
cefotaxime (Gambar 8). Tunas transgenik putatif tumbuh lebih lambat daripada
tunas non-transgenik. Hal ini kemungkinan disebabkan oleh karena adanya
antibiotik pada media yang menyebabkan tunas transgenik putatif ini mendapat
cekaman antibiotik higromisin da n cefotaxime. Cefotaxime selalu ditambahkan ke
Gambar 9 Pertumbuhan tunas Jatropha curcas di media shoot elongation (SE).
(A) tunas non transgenik berumur 4 minggu, (B) tunas transgenik
putatif berumur 2 minggu, (C) tunas transgenik putatif berumur 4
minggu, (D) tunas transgenik putatif berumur 6 minggu. Skala bar = 1
cm.
Kultivasi tanaman J. curcas secara invitro masih banyak dipelajari karena
tanaman ini adalah tanaman berkayu yang mengeluarkan getah sehingga
kultivasinya lebih sulit (Shrivastava & Banerjee 2008). Selain itu, J. curcas sangat
sensitif terhadap antibiotik. Itulah sebabnya dalam penelitian ini, regenerasi
tanaman transgenik hanya dapat dilakukan sampai perpanjangan tunas pada media
yang mengandung ant ibiot ik yang berbeda dengan tanaman ko ntrol yang bisa
sampai memperoleh plantlet yang berakar. Oleh sebab itu, kajian tentang sistem
seleks i untuk J. curcas transgenik dengan senyawa yang bukan antibiotik perlu
dilakukan.
Tunas transgenik J. curcas dalam penelitian ini tidak dapat diinduksi
membentuk akar karena selain daunnya gugur, batangnya masih terlalu lunak,
kemungkinan belum berkayu. Menurut Camellia et al. (2009) salah satu faktor
keberhasilan perakaran pada J. curcas adalah sudah adanya kayu pada batang
karena banyak mengandung karbohidrat. Tunas transgenik putatif ini juga
KESIMPULAN
DAN
SARAN
Tunas J. curcas transgenik telah berhasil dirakit dengan menggunakan gen
MmCuZn-SOD melalui A. tumefaciens. Media regenerasi menggunakan seleksi
higromisin 1.5 mg/l, menghasilkan 2 tunas transgenik dari 12 tunas transgenik
putatif berdasarkan analisis PCR dengan primer 35sF dan MmsodR.
Untuk meningkatkan efisiensi transformasi perlu dilakukan modifikasi
transformasi. Modifikasi bisa dilakukan pada media pertumbuhan eksplan yaitu
dengan tidak menggunakan antibiotik karena tanaman J.curcas sensitif terhadap
antibiotik. Higromisin sebagai agen seleksi dapat diganti dengan sistem agen
seleksi lain yang bukan antibiotik, penggunaan cefotaxime di media dikurangi
namun dimaksimalkan penggunaannya pada proses pencucian eksplan setelah ko-
DAFTAR
PUSTAKA
Akbar E, Yaakob Z, Kamarudin SK, Ismail M, Salimon J. 2009. Characteristic
and composition of Jatropha curcas oil seed from Malaysia and its
potential as biodiesel feedstock. Eur J Sci Res 29: 396-403.
Badawi GH, Yamauchi Y, Shimada E, Sasaki R, Kawano N, Tanaka K, Tanaka
K. 2004. Enhanced tolerance to salt stress and water deficit by
overexpressing superoxide dismutase in tobacco (Nicotiana tabacum)
chloroplasts. Plant Sci 166: 919–928.
Basa SD, Sujatha M. 2009. Genetic analysis of Jatropha species and interspecific
hybrids of Jatropha curcas using nuclear and or ganelle specific markers.
Euphytica 168: 197–214.
Camellia NAN, Thohirah LA, Abdullah NAP, Khidir OM. 2009. Improvement on
Rooting Quality of Jatropha curcas Using Indole Butyric Acid (IBA). Res
J Agric Biol Sci 5(4): 338-343.
Chawla HS. 2002. Introduction to Plant Biotechnology. Plymouth: Science
Publishers. 13 pages.
D’Ayala PG. 2008. Jatropha curcas, a magic spell for island development. Int J
Island Affairs 17: 70-73.
Delhaize E, Ryan PR. 1995. Aluminum toxicity and tolerance in plants. Plant
Physiol 107:315-321.
Francis G, Edinger R, Becker K. 2005. A concept for simultaneous wasteland
reclamation, fuel prod uction, and socio-economic development in
degraded areas in India: need, potential and perspectives of Jatropha
plantations. Natl Resource Forum 29:12–24.
Ginwal HS, Rawat PS, Srivastava RL. 2004. Seed source variation in growth
performance and oil yield of Jatropha curcas Linn. in Central India. Silvae
Genet 53: 186–192.
Gour VK. 2006. Production practices including post- harvest management of J.
curcas. Di dalam: Singh B, Swaminathan R, Ponraj V, editor. Biodiesel Conference Toward Energy Independence-focus of Jatropha. New Delhi:
Rashtrapati Bhawan. hlm: 223–251.
Gunstone, F.D. 1994. The chemistry of oils and Fats: Sources, composition,
properties and uses. London: Blackwell Publishing Ltd. 1 page.
Gunstone, F.D. 2004. Rapeseed And Canola Oil: Production, Processing,
Gupta S, Srivastava M, Mishra GP, Naik PK, Chauhan RS, Tivari SK, Kumar M,
Singh R. 2008. Analogy of ISSR and RAPD markers for comparative
analysis of ge netic diversity among different Jatropha curcas genotypes.
Afr J Biotechnol 7: 4230-4243.
Hambali E, Suryani A, Dadang, Haryadi, Hanafi H, Reksowardojo IK, Rivai M,
Ihsanur M, Suryaarma P, Tjitrosemito S, Soerawidjaja TH, Prawitasari T,
Prakoso T, Purnama W. 2007. J. curcas, Tanaman Penghasil Biodiesel.
Jakarta: Penebar Swadaya. 4 hlm.
Hannum S, Suharsono, Widyastuti U, Hartana A. 2009. Kloning dan ekspresi gen
penyandi copper/zinc-Superoxida Dismutase pada Melastoma
malabathricum L. [Seminar Sekolah Pascasarjana]. Bogor: Institut
Pertanian Bogor.
Hasnam, Mahmud Z. 2006. Panduan Umum Perbenihan J. curcas (Jatropha
curcas L.). Bogor: Pusat Penelitian dan Pengembangan Perkebunan.
Departemen Pertanian. 2 hlm.
Hasegawa PM, Ray AB, Kang ZJ, Hans JB. 2000. Plant cellular and molecular
responses to high salinity. Plant Physiol Plant Mol Biol 51: 463–499.
Heller J. 1996. Physic Nuts: Jatropha curcas L. Rome: International Plant Genetic
Resources Institute. 1 page.
Imlay JA, Linn S. 1988. DNA damage and oxygen radical toxic