INTRODUKSI GEN Osdep1 KE DALAM TANAMAN PADI
VARIETAS CIHERANG, NIPPONBARE, DAN KASALATH
MELALUI PERANTARA Agrobacterium tumefaciens
RUTH MADUMA DEWININGSIH SIANTURI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Introduksi Gen Osdep1 ke dalam Tanaman Padi Varietas Ciherang, Nipponbare, dan Kasalath melalui Perantara
Agrobacterium tumefaciens adalah karya saya dengan komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau kutipan dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan tercantum dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Agustus 2012
Ruth Maduma Dewiningsih Sianturi
ABSTRACT
RUTH MADUMA DEWININGSIH SIANTURI. Introduction of Osdep1 Gene through Agrobacterium tumefaciens into Rice cv. Ciherang, Nipponbare, and Kasalath. Under direction of SUHARSONO and TRI JOKO SANTOSO.
Development of high yielding rice varieties can be performed through
Agrobacterium-mediated transformation techniques by inserting a gene that regulates the characters related to high yield. DEP1 gene (dense and erect panicle1) is a gene with single locus responsible for pleiotropy manner of three important traits i.e. dense panicle, grain number per panicle and erect panicle. The objective of this research was to introduce an Osdep1 gene into genome rice cv. Nipponbare, Ciherang, and Kasalath by using Agrobacterium-mediated transformation to obtain transgenic rice carrying the transgene. The vector used in this research was Agrobacterium tumefaciens strain LBA-4404. Concentration of higromycin antibiotic used for selecting agent was 50 mg/L, and acetosyringone compound was added to the media that is equal to 100 µM. In vitro
Agrobacterium tumefaciens (OD600 = 0.3)-mediated transformation through dropping the bacteria to rice immature embryo explants have been successfully performed and produced three transgenic plants of Nipponbare. Meanwhile, in planta transformation have produced two transgenic plants cv. Ciherang and three transgenic plants cv. Kasalath. Inheritance analysis of T1 generation Kasalath-Osdep1-4 dan Kasalath-Osdep1-8 lines showed that the transgenic lines were not chimeras. Molecular analysis should be performed to make sure that the T1 transgenic rice lines also carry the transgene.
RINGKASAN
RUTH MADUMA DEWININGSIH SIANTURI. Introduksi Gen Osdep1 ke dalam Tanaman Padi Varietas Ciherang, Nipponbare, dan Kasalath Melalui Perantara Agrobacterium tumefaciens. Dibimbing oleh SUHARSONO dan TRI JOKO SANTOSO.
Upaya peningkatan produksi padi harus tetap dilakukan untuk meningkatkan ketahanan pangan nasional sehingga tercipta swasembada pangan yang berkelanjutan. Usaha pengembangan varietas dengan produktifitas tinggi dapat dilakukan dengan teknik rekayasa genetika yaitu melalui transformasi dengan vektor Agrobacterium tumefaciens yang dilakukan dengan cara menyisipkan vektor plasmid yang mengandung gen yang meregulasi karakter produktifitas tinggi. Gen dense erect panicle 1 (dep1) bertanggung jawab secara pleiotropi terhadap tiga sifat penting yaitu malai rapat (dense panicle), jumlah biji per malai (grain number per panicle) dan malai tegak (erect panicle). Ekspresi berlebih atau over-ekspresi gen Osdep1 diharapkan dapat meningkatkan densitas panikula, jumlah bulir per panikula dan panikula yang tegak sehingga produktivitas tanaman padi meningkat.
Penelitian ini bertujuan untuk mengintroduksikan gen Osdep1 ke dalam tanaman padi varietas Ciherang, Nipponbare, dan Kasalath. Introduksi gen
Osdep1 dilakukan dengan 2 metode yaitu transformasi secara in planta
menggunakan eksplan skutelum (Supartana et al. 2005) dan transformasi secara in vitro menggunakan eksplan embrio muda (Hiei & Komari 2006). Analisis PCR dilakukan dengan menggunakan primer gen spesifik hpt (hygromycin phospho-transferase) yaitu primer forward (F): 5’-GATGCCTCCGCTCGAAGTAGCG-3’ dan primer reverse (R): 5’-GCATCTGCCGTGCACATG-3’. Elektroforesis hasil PCR dilakukan pada 1% gel agarose dan dijalankan pada 80 volt selama 35 menit. Pita-pita DNA hasil PCR di dalam gel agarosa divisualisasi dengan perangkat
Chemidoc gel system.
Hasil penelitian menunjukkan bahwa pada transformasi secara in vitro
padi japonica (Nipponbare) mempunyai efisiensi transformasi lebih tinggi daripada indica (Ciherang atau Kasalath). Eksplan yang berupa embrio muda dari varietas Nipponbare dapat membentuk kalus dan beregenerasi di media seleksi. Walaupun eksplan dapat membentuk kalus, tetapi kalus Ciherang dan Kasalath tidak mampu beregenerasi untuk membentuk tunas. Hal ini menunjukkan bahwa transformasi genetika pada padi indica masih mengalami kesulitan terutama dalam kemampuan regenerasinya dan ini juga memperkuat dugaan selama ini bahwa padi indica bersifat rekalsitran untuk ditransformasi. Transformasi dengan eksplan embrio muda ini telah berhasil mendapatkan 9 tanaman putatif transgenik Nipponbare, namun hanya 7 yang bertahan hidup dan 3 tanaman diantaranya adalah positif PCR untuk gen hpt dengan efisiensi transformasi sebesar 1.56%.
Ciherang, Nipponbare dan Kasalath. Analisis pewarisan transgen dilakukan pada galur padi transgenik generasi T1 Kasalath-Osdep1-4 dan Kasalath-Osdep1-8 yang ditanam pada media MS yang mengandung higromisin 40 mg/L dan 50 mg/L. Hasil uji pewarisan gen hpt melalui penanaman biji di media seleksi menunjukkan bahwa gen tersebut diwariskan kepada generasi T1. Hal ini menjadi bukti bahwa transgen hpt telah terintegrasi pada genom sel-sel meristem apikal (biasanya belum terdiferensiasi) yang berkembang menjadi sel-sel reproduksi yang selanjutnya diwariskan pada generasi berikutnya.
Kata kunci: Agrobacterium tumefaciens, gen Osdep1, padi (Oryza sativa),
© Hak cipta milik IPB, tahun 2012
Hak cipta dilindungi Undang-undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah
b. Pengutipan tersebut tidak merugikan kepentingan yang wajar dari IPB dan Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumber Daya Genetika Pertanian (BB-Biogen)
INTRODUKSI GEN Osdep1 KE DALAM TANAMAN PADI
VARIETAS CIHERANG, NIPPONBARE, DAN KASALATH
MELALUI PERANTARA Agrobacterium tumefaciens
RUTH MADUMA DEWININGSIH SIANTURI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Bioteknologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Introduksi Gen Osdep1 ke dalam Tanaman Padi Varietas Ciherang, Nipponbare, dan Kasalath melalui Perantara Agrobacterium tumefaciens
Nama : Ruth Maduma Dewiningsih Sianturi
NIM : P051090071
Disetujui
Komisi Pembimbing
Prof. Dr. Ir. Suharsono, DEA. Dr. Tri Joko Santoso, SP. MSi.
Ketua Anggota
Diketahui,
Ketua Program Studi/Mayor Dekan Sekolah Pasca Sarjana
Bioteknologi
Prof. Dr. Ir. Suharsono, DEA. Dr. Ir. Dahrul Syah, M.Sc Agr.
Tanggal Ujian: 24 Juli 2012
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah atas segala karunia-Nya
sehingga penulis dapat menyusun tesis dengan judul “Introduksi Gen Osdep1 ke dalam Tanaman Padi Varietas Ciherang, Nipponbare, dan Kasalath melalui Perantara
Agrobacterium tumefaciens”.
Terimakasih penulis ucapkan kepada Prof. Dr. Ir. Suharsono, DEA, dan Dr. Tri Joko Santoso, SP. M.Si, selaku komisi pembimbing yang telah mengarahkan dan membimbing penulis baik dalam proses penelitian maupun penulisan karya ilmiah ini. Ucapan terimakasih juga penulis ucapkan kepada seluruh peneliti dan staf Laboratorium Biologi Molekular BB-Biogen Cimanggu Bogor yang telah memberikan kesempatan kepada penulis untuk melaksanakan penelitian ini. Terimakasih kepada Ibu Atmitri, Ibu Aniversari, Ibu Nur, Pak Heri, Pak Umar, Pak Asep, dan seluruh BB-Biogen Family: Dewi Praptiwi, Falin Fakhrina, Ibu Sesanti, Happy, Fina, Taufan, Obosh, Reza, mba Ida, Anggun, Ade, Gitaw, Sekar, Rizki, Dina, Retno, Safia, Alifah yang telah memberikan semangat dan keceriaan pada penulis.
Penulis juga mengucapkan terimakasih untuk keluarga tercinta, Mama dan Papa atas kasih sayang, cinta, dukungan, nasihat, dan doa yang tak hentinya dicurahkan kepada penulis. Terimakasih disampaikan untuk ibu Ridho Kurniaty, Kak Ellya, teman-teman BTK 2009 dan 2010, teman-teman PBT 2008 dan 2009, teman-teman Fitopatologi 2009, serta teman-teman guru sekolah minggu dan cool
DM GBI Gd. Lautan, teman-teman Wisma Flora, teman-teman GSP (Gita Swara Pascasarjana) atas segala dukungan, ide, nasihat dan doanya. Semoga karya ilmiah ini bermanfaat.
Bogor, Agustus 2012
RIWAYAT HIDUP
Penulis dilahirkan di Cirebon tanggal 2 November 1986 dari orang tua terkasih pasangan bapak J. Sianturi S.AP dan ibu Linceria Sihombing S.Pd. Penulis menyelesaikan jenjang pendidikan menengah umum tahun 2004 di SMA Negeri 2 Cirebon dan pada tahun yang sama penulis melanjutkan jenjang pendidikan strata satu (S1) di program studi Pemuliaan Tanaman Fakultas Pertanian Universitas Jenderal Soedirman Purwokerto melalui PMDK. Selama
DAFTAR ISI
Perkembangan Transformasi Genetik pada Padi ... 6
Gen DEP1 ... 8
Analisis Amplifikasi Transgen pada Transforman ... 15
Isolasi DNA Genom Tanaman ... 15
Analisis PCR ... 16
Elektroforesis ... 16
Analisis Pewarisan Gen hpt pada Tanaman Transgenik ... 17
DAFTAR TABEL
Halaman 1. Data luas lahan, produksi dan produktivitas padi nasional
(2006-2011) ... 1
2. Perbedaan morfologi padi indica, japonica, javanica ... 5
3. Jumlah eksplan yang membentuk kalus beregenerasi dari embrio muda dari varietas padi Ciherang, Nipponbare, dan Kasalath
yang diinfeksi oleh A. tumefaciens ... 19
4. Hasil transformasi secara in planta pada varietas Ciherang (C),
Nipponbare (N), dan Kasalath (K) ... 25
5. Jumlah tanaman positif PCR dan efisiensi transformasi secara in
planta padi Ciherang, Nipponbare, dan Kasalath ... 25
6. Uji toleransi kecambah padi varietas Kasalath nontransgenik dan Kasalath-Osdep1 generasi T1 di media seleksi yang
mengandung higromisin 40 mg/L ... 26
7. Uji resistensi varietas Kasalath nontransgenik terhadap antibiotik
higromisin pada media yang mengandung 50 mg/L higromisin ... 27
8. Hasil skrining galur-galur tanaman transgenik Kasalath-Osdep1
DAFTAR GAMBAR
Halaman 1. Peta genetik DEP1 pada kromosom padi nomor 9 ... 2
2. Peta fisik daerah T-DNA dari plasmid pC1301-OsDep1 yang membawa gen Osdep1 dan gen ketahanan terhadap antibiotik
Higromisin (HPT II) ... 11
3. Embrio muda setelah diinfeksi Agrobacterium tumefaciens
dalam media ko-kultivasi ... 19
4. Kalus yang ditumbuhkan di media yang mengandung 50 mg/L
higromisin ... 20
5. Regenerasi tunas dari kalus ... 20
6. Tunas padi berakar ... 21
7. Analisis integrasi gen hpt di dalam tanaman transgenik putatif
dengan PCR ... 22
8. Analisis PCR menggunakan primer spesifik gen hpt terhadap
DAFTAR LAMPIRAN
1
PENDAHULUAN
Latar Belakang
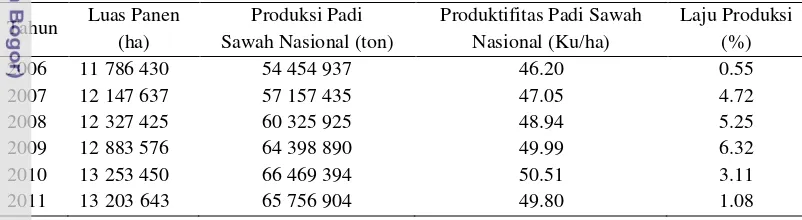
Beras merupakan bahan makanan pokok sebagian besar penduduk Indonesia. Peningkatan jumlah penduduk tiap tahunnya menuntut peningkatan ketersediaan beras. Produksi padi sawah Indonesia pada tahun 2009 meningkat mencapai 6.32% dari tahun sebelumnya, namun produksi pada tahun 2011 menurun mencapai 1.08% dari tahun 2010 (Tabel 1). Untuk itu, peningkatan
produksi padi harus tetap dilakukan untuk meningkatkan ketahanan pangan nasional dan mencapai swasembada pangan. Upaya yang perlu dilakukan untuk meningkatkan produksi padi nasional antara lain dengan melakukan pengembangan varietas tanaman padi yang memiliki produktifitas tinggi dengan ketahanan terhadap cekaman biotik dan abiotik. Peningkatan hasil produktifitas dapat dilakukan melalui peningkatan produksi bulir padi per malai.
Tabel 1 Data luas lahan, produksi, dan produktivitas padi nasional (2006–2011)
Tahun Luas Panen
Pengembangan varietas dengan hasil produksi yang tinggi dapat dilakukan dengan teknik pemuliaan tanaman konvensional dan teknik rekayasa genetika.
Teknik pemuliaan konvensional dilakukan dengan persilangan antara tetua jantan dan betina yang memiliki sifat yang diinginkan, yang disebut dengan hibridisasi
2
tanaman sehingga tanaman tersebut mengalami transformasi secara genetik, tanpa mengubah sifat-sifat unggul yang sudah ada.
Gen yang memiliki fungsi dalam meningkatkan produksi padi telah teridentifikasi diantaranya ialah gen Gn1a, EP2, dan DEP1 (Ashikari et al. 2005; Zhu et al. 2009; Huang et al. 2009). Huang et al. (2009) berhasil mengisolasi gen
DEP1 yang terdapat pada kromosom 9 padi (Gambar 1). Gen DEP1 berperan dalam menentukan kepadatan malai, jumlah bulir per panikula, dan ketegakan panikula. Jumlah bulir pada tanaman padi transgenik DEP1 mencapai 40.9% lebih banyak daripada tanaman padi kontrol (non-transgenik) (Huang et al. 2009).
Gambar 1 Peta genetik DEP1 pada kromosom padi nomor 9 (Huang et al. 2009).
Agrobacterium tumefaciens banyak digunakan untuk melakukan transformasi genetik pada berbagai tanaman, baik tanaman dikotil maupun monokotil. Kelebihan dari teknik A. tumefaciens dibandingkan dengan metode penembakan partikel adalah mampu memindahkan fragmen DNA berukuran besar, memerlukan biaya relatif murah, relatif mudah dalam pengerjaannya, dan ekspresi transgen di dalam tanaman transgenik lebih tinggi (Lee et al. 2010).
Proses introduksi gen dengan penembakan partikel seringkali menyebabkan
terjadinya kerusakan sel/jaringan yang ditembak sehingga terjadi peningkatan
kematian eksplan danmenurunkan daya regenerasi sel/jaringannya (Santoso et al.
2005).
Transformasi genetik pada tanaman padi melalui perantara A. tumefaciens
3
melalui perantara Agrobacterium tumefaciens menggunakan ekplan embrio muda. Kedua metode tersebut telah diketahui menunjukkan efisiensi transformasi yang cukup tinggi pada tanaman padi.
Tujuan Penelitian
Tujuan penelitian ini adalah mengintroduksi gen Osdep1 ke dalam genom tanaman padi varietas Ciherang, Nipponbare, dan Kasalath dengan bantuan A. tumefaciens strain LBA-4404 sehingga memperoleh tanaman padi transgenik yang membawa gen Osdep1.
Manfaat Penelitian
5
TINJAUAN PUSTAKA
Padi
Padi merupakan makanan pokok sebagian besar penduduk Indonesia. Tanaman padi berakar serabut, daun berbentuk lanset (sempit memanjang), urat daun sejajar, memiliki pelepah daun, bunga tersusun sebagai bunga majemuk, buah dan biji sulit dibedakan karena merupakan bulir (grain) (Hattori & Siwi 1986). Smith & Dilday (2002) menyatakan bahwa Oryza sativa terbagi menjadi tiga subspesies yaitu japonica, indica, dan javanica. Padi indica ditanam dan dikonsumsi secara luas di Indonesia. Padi subspesies indica umumnya memiliki masa dormansi beberapa minggu. Sifat ini cocok untuk daerah basah tropik karena suhu dan kelembaban sangat sesuai untuk perkecambahan (Yoshida 1981). Perbedaan morfologi antara padi subspesies indica, japonica, dan javanica dapat dilihat pada Tabel 2.
Tabel 2 Perbedaan morfologi padi indica, japonica, dan javanica
Karakteristik Indica Japonica Javanica
Daun Lebar hingga
6
berfungsi sebagai penopang tanaman, penyalur senyawa-senyawa kimia dan air dalam tanaman, serta e) bunga padi (malai).
Padi dapat tumbuh pada berbagai tipe tanah, dalam keadaan tergenang atau di lahan kering yang kelembabannya sesuai dengan kapasitas lapang. Suhu optimum untuk pertumbuhan padi ialah sekitar 27 oC. Padi adalah tanaman hari pendek (short day plant) dengan periodisitas cahaya optimal untuk pembungaan 10 jam. Penyinaran yang lama dapat memperlambat atau menghambat pembungaan. Periodisitas kritis berkisar antara 12-24 jam tergantung pada kultivar (Setiamihardja & Herawati 2000).
Tanaman padi subspesies japonica varietas Nipponbare sering digunakan sebagai model penelitian bagi tanaman monokotil. Beberapa alasan yang mendukung penggunaan tanaman tersebut antara lain ukuran genomnya relatif kecil (430 Mbp), mudah ditransformasi dan memiliki nilai ekonomi yang tinggi (Kolesnik et al. 2004). Genom padi diperkirakan mengandung 32 000 – 55 000 gen baik pada padi japonica (Nipponbare) maupun indica (Remelia 2008). Informasi tersebut dapat digunakan untuk penelitian selanjutnya yaitu identifikasi
fungsi gen-gen padi (Greco et al. 2003).
Perkembangan Transformasi Genetik pada Padi
Padi merupakan makanan pokok bagi hampir setengah dari penduduk dunia dan telah banyak digunakan sebagai sistem model tanaman untuk tanaman monokotil. Secara garis besar terdapat dua teknik transfer gen yang telah berhasil diterapkan, yaitu transfer gen secara langsung dan tidak langsung. Transfer gen
secara langsung misalnya dengan senyawa kimia polyethylene glycol (PEG), atau penembakan DNA. Transfer gen secara tidak langsung menggunakan bantuan
bakteri tanah A. tumefaciens (Slamet-Loedin 1994). Secara alami A. tumefaciens
hanya menginfeksi tanaman dikotil sehingga keberhasilan transformasi dengan A. tumefaciens pada awalnya hanya terbatas pada tanaman dikotil.
7
biasa LBA 4404, dan vektor biner p1G121Hm yang disisipkan ke dalam A. tumefaciens super virulen EHA101. Keberhasilan tersebut didukung dengan penggunaan kalus embriogenik, penambahan senyawa asetosiringon dan kondisi pH yang rendah untuk mengaktifkan gen-gen vir dari A. tumefaciens.
Penambahan asetosiringon dapat membantu keberhasilan transformasi menggunakan vektor Agrobacterium tumefaciens pada tanaman monokotil seperti tanaman padi. Senyawa ini diketahui berhasil menginduksi terekspresinya gen-gen
vir pada plasmid Ti (Hiei et al. 1994; Saharan et al. 2004; Rahmawati 2006). Penambahan asetosiringon dapat meningkatkan keberhasilan efisiensi transformasi tanaman monokotil seperti pada tanaman tebu (Fitranty et al. 2003; Wulandari 2005), tanaman jagung (Utomo 2005), dan tanaman Anggrek (Pambudi 2009). Penambahan asetosiringon sangat penting untuk transformasi tanaman padi karena tanaman padi yang termasuk monokotil yang tidak menghasilkan senyawa asetosiringon. Konsentrasi senyawa asetosiringon yang optimum dan umum digunakan untuk transformasi genetik pada tanaman monokotil menggunakan
Agrobacterium adalah 100 µM (Fitranty et al. 2003).
Terdapat dua kelompok besar tanaman padi budidaya yaitu subspesies indica dan japonica. Padi indica ditanam dan dikonsumsi secara luas di dunia termasuk di Indonesia. Oleh karena itu transfer gen pada tanaman padi tidak
hanya terbatas pada kelompok japonica tetapi juga untuk padi varietas elit kelompok indica. Informasi keberhasilan transformasi genetik pada padi indica masih terbatas. Padi indica sulit ditransformasi karena umumnya sensitif terhadap kultur jaringan dan kurang responsif jika ditransformasi (Maftuchah 2003; Lin & Zhang 2005; Purnamaningsih 2006; Mulyaningsih et al. 2010).
8
merupakan kumpulan sel meristem yang aktif membelah. Oleh karena itu, metode transformasi menggunakan eksplan embrio zigotik muda merupakan teknik transformasi yang baik untuk padi c(Mulyaningsih 2011). Transformasi secara in
planta menggunakan eksplan berupa skutelum benih yang dilakukan oleh Supartana et al. (2005) dapat menghasilkan tanaman transgenik dalam waktu yang singkat.
Saat ini berbagai kultivar tanaman padi telah berhasil ditransformasi menggunakan Agrobacterium. Ashikari et al. (2005) mengintroduksikan gen yang meregulasi sitokinin oksidase ke dalam padi indica varietas Habataki dan ke dalam padi japonica varietas Koshihikari. Supartana et al. (2005) melakukan transformasi secara in planta menggunakan Agrobacterium tumefaciens strain LBA-4404 pada padi Koshihikari. Mulyaningsih et al. (2010) berhasil mengintroduksikan gen regulator HD-Zip pada padi indica kultivar Batutegi dan Kasalath. Gen HD-Zip merupakan salah satu faktor transkripsi yang terkait dengan adaptasi perkembangan tanaman terhadap cekaman kekeringan. Gen isopentenyltransferase (ipt) berhasil diintroduksikan ke dalam genom padi kultivar Nipponbare (Wagiran et al. 2010). Isopentenyltransferase berperan sebagai katalisator dalam jalur biosintesis sitokinin tanaman padi, sehingga memberikan pengaruh terhadap tinggi tanaman, panjang malai, jumlah biji per malai pada
tanaman padi (Wagiran et al. 2010).
Gen DEP1
Peningkatan produksi tidak hanya dipengaruhi oleh tinggi tanaman dan waktu pembungaan. Arsitektur malai padi juga memegang peranan penting dalam peningkatan produksi, yaitu berpengaruh terhadap fotosintesis. Padi dengan malai tegak memberikan aerasi CO2 yang baik dan meningkatkan penerimaan cahaya
yang menyebabkan fotosintesis dapat berjalan lebih efektif sehingga pengisian bulir maksimal (Guo & Hong 2010; Piao et al. 2009).
9
Perbaikan arsitektur malai tersebut meliputi panjang malai, jumlah cabang primer per malai, ukuran bulir, rasio set biji, kepadatan malai, dan ketegakan malai.
Huang et al. (2009) berhasil mengklon gen DEP1 yang terdapat dalam lokus DEP1. Lokus DEP1 merupakan lokus yang bertanggungjawab terhadap tiga karakter tanaman padi, yaitu kepadatan malai, jumlah bulir per panikula, dan ketegakan panikula.
Penelitian terkait karakter malai yang tegak pada tanaman padi telah dilakukan, namun hasil yang diperoleh masih terbatas. Gen dominan dan resesif diketahui berpengaruh terhadap karakter malai padi yang tegak. Alel dominan yang terdapat pada lokus DEP1 merupakan mutasi gain-of-function yang menyebabkan pemotongan phosphatidylethanolamine-binding protein-like domain protein, suatu protein pengontrol pergantian morfologis antara pertumbuhan tunas dan struktur bunga pada tanaman. Efek alel tersebut menyebabkan reduksi panjang internodus inflorensia, dan peningkatan jumlah bulir per malai sehingga terjadi peningkatan hasil bulir padi. Dengan demikian DEP1 (Dense and Erect Panicle 1) bertanggung jawab terhadap tiga bentuk ekspresi yaitu densitas panikula, jumlah bulir per panikula yang tinggi dan panikula yang tegak (Huang et al. 2009).
Selain gen DEP1, gen yang diidentifikasi terkait dengan peningkatan jumlah bulir per malai dan sifat panikula yang tegak pada tanaman padi adalah gen Gn1a dan EP2. Ashikari et al. (2005) melaporkan bahwa gen Gn1a
merupakan gen yang mengaktifkan enzim cytokine oxidase yang berperan dalam mendegradasi fitohormon sitokinin sehingga merangsang pembentukan organ reproduksi (malai). Jumlah bulir pada tanaman padi transforman Gn1a mencapai 21% lebih banyak daripada jumlah bulir pada tanaman padi kontrol (nontransgenik).
11
BAHAN DAN METODE
Tempat dan Waktu
Penelitian ini dilakukan mulai bulan Januari 2011 sampai dengan Maret 2012 di Laboratorium Biologi Molekular, Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumberdaya Genetik Pertanian (BB BIOGEN).
Bahan
Biji padi varietas Nipponbare, Kasalath, dan Ciherang digunakan sebagai
tanaman sasaran untuk transformasi genetik. Agrobacterium tumefaciens LBA-4404 yang mengandung pC1301-Osdep1 (Santoso et al. 2010) digunakan untuk melakukan transformasi materi genetik padi. pC1301-Osdep1 mengandung gen
Osdep1 (Huang et al. 2009) dibawah kendali p35SCaMV (Gambar 2). Primer
forward (F): 5’-GATGCCTCCGCTCGAAGTAGCG-3’ dan primer reverse (R):
5’-GCATCTGCCGTGCACATG-3’ digunakan untuk mendeteksi gen hpt dengan PCR. Media kultur untuk proses transformasi padi disajikan pada lampiran 1, 2, 3, dan 4.
Gambar 2 Peta fisik daerah T-DNA dari plasmid pC1301-Osdep1 yang membawa gen Osdep1 dan gen ketahanan terhadap antibiotik higromisin (HPTII) (Santoso et al. 2010).
Metode
Penelitian ini menggunakan dua metode, yaitu (1) transformasi genetik secara in vitro, dan (2) transformasi genetik secara in planta.
1. Transformasi genetik secara in vitro
Transformasi genetik secara in vitro menggunakan bahan tanaman berupa NOS-pro HPTII (KanR) NOS-ter CaMV35s pro OsDep1 NOS-ter
HindIII Sal1 BamH1 EcoR1
RB LB
12
embrio muda dengan mengikuti prosedur Hiei dan Komari (2008). Transformasi genetik secara in vitro dilakukan secara bertahap melalui: a) penanaman padi sebagai sumber eksplan, b) Persiapan bakteri A. tumefaciens dan eksplan, c) induksi kalus embriogenik, d) regenerasi kalus dan induksi perakaran, e) aklimatisasi.
a. Penanaman padi sebagai sumber eksplan
Benih-benih padi dari tiga varietas Nipponbare, Kasalath, dan Ciherang dikecambahkan pada cawan petri yang dilapisi dengan kertas saring [Advantec Toyo] basah selama 2 minggu. Kecambah-kecambah padi kemudian dipindahkan ke bak berisi tanah selama 2 minggu dan selanjutnya dipindah ke ember berisi tanah dan dipelihara sampai menghasilkan biji belum masak yang akan digunakan sebagai eksplan untuk transformasi. Eksplan yang digunakan adalah embrio muda berumur 8-12 hari setelah penyerbukan (antesis).
b. Persiapan bakteri Agrobacterium tumefaciens dan eksplan
Satu koloni A. tumefaciens yang mengandung vektor pCambia1301-Osdep1 [CambiaLabs] ditumbuhkan pada media YEP cair terdiri dari 10 g
BactoTMpepton [Difco], 5 g NaCl [Merck], 10 g bacto yeast extract [Difco] yang mengandung antibiotik 75 mg/L karbenisilin [Sigma] dan 100 mg/L kanamisin [Sigma] selama semalam pada inkubator bergoyang pada kecepatan 200 rpm
[Labline Shaker Orbit] dengan suhu 28 oC. Selanjutnya 500 µL dari kultur tersebut ditumbuhkan pada media AB padat (0.5 g glukosa, 1.5 g BactoTMAgar [Difco], 5 mL AB buffer, 5 mL AB salt) yang mengandung antibiotik karbenisilin [Sigma] 75 mg/L dan kanamisin [Sigma] 100 mg/L, selama 3 hari pada suhu 28
o
C. Kultur Agrobacterium kemudian dilarutkan pada media ko-kultivasi cair, yaitu media dasar R2 (100 mL R2 makro 1, 100 mL R2 makro 2, 10 mL FeNaEDTA, 1 mL R2 mikro, 25 mL vitamin R2) dengan penambahan 2.5 mg/L 2.4-D [Merck], 10 g/L glukosa, dan 100 µM asetosiringon [Sigma], dengan pH 5.2. Kerapatan bakteri yang digunakan adalah 0.3 pada panjang gelombang 600 nm.
13
dikocok selama 5 menit dan larutannya dibuang. Biji dibilas dengan aquades steril sebanyak 5 kali, dan dikeringkan menggunakan kertas saring pada cawan petri. Padi steril dipencet menggunakan pinset untuk mengeluarkan embrionya, dan ditanam di media kokultivasi (media A201, yaitu media dasar NB dengan penambahan 2 mg/L 2.4D [Merck], 2 mg/L NAA [Sigma], 1 mg/L BAP [Sigma], dan 19.62 mg/1 asetosiringon [Sigma] dalam 1 mL DMSO [Sigma], pH 5.2) dengan skutela menghadap ke atas. Suspensi A. tumefaciens diteteskan pada masing-masing embrio yang belum masak. Embrio yang diinfeksi A. tumefaciens
diinkubasi selama 7 hari pada suhu 25 oC dalam kondisi gelap. c. Induksi kalus embriogenik
Setelah ko-kultivasi, tunas yang memanjang dibuang dari embrio dengan menggunakan skalpel. Embrio dibersihkan dari media ko-kultivasi menggunakan kertas saring steril yang ditempelkan pada Embrio. Embrio dipindahkan ke medium induksi kalus dan diinkubasi selama 5 hari. Media induksi kalus (A202) yang digunakan adalah media dasar NB dengan penambahan 1 mg/L 2.4D [Merck], 1 mg/L NAA [Sigma], 0.2 mg/L BAP [Sigma], 250 mg/L cefotaxim
[Duchefa], dan 100 mg/L vankomisin [Calbiochem] dengan pH 5.8. Kalus dipindahkan ke medium induksi kalus yang mengandung 50 mg/L higromisin [Higromisin B, Roche] dengan pH 5.8 (A203) dan diinkubasi selama 3 minggu.
Kalus-kalus tahan dipindahkan ke medium yang sama dan diinkubasi selama 10 hari. Kalus-kalus yang tahan dan menunjukkan tanda-tanda embriogenik dipindahkan ke media regenerasi dan dinkubasi selama 10 hari.
d. Regenerasi kalus dan induksi perakaran
14
higromisin [Higromisin B, Roche]. Inkubasi dalam media pengakaran dilakukan selama dua minggu atau sampai dengan terbentuk akar. Planlet yang bertahan hidup kemudian diaklimatisasi.
Efisiensi transformasi ditentukan berdasarkan perbandingan jumlah tanaman transgenik yang dihasilkan terhadap jumlah eksplan awal.
e. Aklimatisasi
Planlet-planlet dibersihkan dari agar dengan air mengalir sebelum diaklimatisasi. Aklimatisasi dilakukan secara bertahap dengan menanam planlet selama satu minggu dalam tabung reaksi berdiameter 1.5 cm dan tinggi 15 cm yang berisi 5 mL air dan selama dua minggu dalam bak plastik ukuran 44 cm x 34 cm x 15 cm yang berisi tanah sawah. Planlet yang berhasil bertahan hidup dalam periode aklimatisasi selanjutnya dipindahkan ke dalam pot plastik dengan volume 10 L yang berisi tanah sawah.
2. Transformasi genetik secara in planta
Transformasi genetik secara in planta menggunakan bahan tanam berupa skutelum dengan mengikuti prosedur Supartana et al. (2005). Transformasi genetik secara in planta dilakukan secara bertahap melalui: a) kultur bakteri
Agrobcaterium tumefaciens, b) perkecambahan benih padi untuk transformasi, c) inokulasi bakteri pada meristem apikal embrionik, d) pemeliharaan benih berkecambah setelah inokulasi.
a. Kultur bakteri Agrobacterium tumefaciens
Bakteri A. tumefaciens dikulturkan pada media LB cair yang mengandung antibiotik 100 mg/L kanamisin [Sigma] dan 75 mg/L karbenisilin [Sigma] dengan
digoyang pada kecepatan 200 rpm [Labline Shaker Orbit] pada suhu 28 oC selama 48 jam. Kultur bakteri kemudian dipanen dengan cara mengambil 1 mL suspensi
15
b. Perkecambahan benih padi untuk transformasi
Benih-benih padi dikuliti dan disterilisasi dengan 100 mL ethanol [Merck] 70% selama 1 menit dan 0.78% sodium hipoklorit [Bayclin] yang telah ditetesi tween 20 (1 tetes per 50 mL) selama 15 menit kemudian dibilas dengan air steril 2 kali. Setelah steril, benih-benih padi kemudian direndam dalam air steril selama 2 hari pada suhu 20 oC. Selama perendaman, air diganti satu kali. Setelah 2 hari perendaman, daerah sekitar embrio akan berwarna putih. Pada tahap ini, baik bakal tunas atau akar tidak terlihat.
c. Inokulasi bakteri pada meristem apikal embrionik
Untuk menginokulasi bakteri pada meristem apikal embrionik dari benih-benih yang telah direndam maka bagian embrio yang nanti akan muncul sebagai tunas ditusuk-tusuk dengan ujung jarum steril [General Care] yang sebelumnya telah dicelupkan pada suspensi bakteri. Benih-benih yang telah diinokulasi kemudian ditempatkan pada petridis [Pyrex] yang telah diberi kertas saring [Advantec Tayo] basah dan diinkubasi pada ruang gelap selama 2-3 hari.
d. Pemeliharaan benih berkecambah setelah inokulasi
Benih yang telah berkecambah dipindahkan ke botol kultur yang mengandung media ½ MS + 300 mg/L cefotaksim [Duchefa] ditambah agen seleksi higromisin [Higromisin B, Roche] dengan konsentrasi 0 mg/L, 10 mg/L,
20 mg/L, 30 mg/L, dan 40 mg/L. Setelah berumur 7-9 hari, kecambah diaklimatisasi ke media air selama 2 hari dan selanjutnya dipindah ke pot yang mengandung media campuran tanah dan pupuk kandang. Tanaman T0 dipelihara sampai dewasa dan menghasilkan benih. Selama pemeliharaan, tanaman transforman secara in planta dianalisis PCR untuk mendeteksi integrasi dari gen. Efisiensi transformasi dihitung berdasarkan perbandingan jumlah tanaman transgenik terhadap jumlah eksplan.
Analisis Amplifikasi Transgen pada Transforman
16
1000 µl bufer ekstraksi CTAB (Cetyl Trimethyl Ammonium Bromide). Campuran diinkubasi di dalam penangas air [Stuart Scientific] pada suhu 65 oC selama 15 menit. Selama inkubasi campuran dibolak-balik setiap 5 menit sekali agar homogen. Campuran ditambah dengan 100 µL Na-asetat dan 900 µL kloroform isoamilalkohol (24:1) [Merck] ke dalam tabung mikro [Axygen], kemudian dikocok hingga merata. Suspensi selanjutnya disentrifugasi dengan kecepatan 12 000 rpm (Himac CF 15R, suhu 4 oC) selama 5 menit. Lapisan paling atas dipindah ke tabung mikro [Axygen] baru sebanyak 350 µL kemudian ditambahkan 35 µ L Na-Asetat dan 256.6 µL isopropanol [Merck] (2/3 volume supertanatan) dicampur perlahan. Campuran disentrifugasi pada kecepatan 12 000 rpm [Himac CF 15R, suhu 4 oC] selama 5 menit. Supernatan dibuang. Endapan yang diperoleh ditambah dengan 200 µL etanol [Merck] 70%. Campuran disentrifugasi kembali selama 5 menit pada kecepatan 12 000 rpm [Himac CF 15R, suhu 4 oC]. Endapan selanjutnya dikeringkan di dalam oven [Heraeus] selama 10 menit. Endapan yang telah kering dilarutkan dalam larutan TE (Tris base-Ethylene Diamine Tetraacetic Acid) yang mengandung RNase [Invitrogen] sebanyak 50 µL dan diinkubasi [VWR Scientific] pada suhu 37 ˚C selama 30 menit.
Analisis PCR. Reaksi PCR [DNA Engine Tetrad 2] mempunyai total volume 20 µL menggunakan PCR kit FastStart [Roche Diagnostics GmBh] dengan konsentrasi akhir dari masing-masing komponen adalah sebagai berikut: 1x buffer PCR (100 mM Tris-HCl, 500 mM KCl, pH 8.3), 1.5 mM MgCl2 , 0.2
mM dNTP mix, 1 unit Taq DNA polymerase, 0.5 µM masing-masing primer hpt-F dan hpt-R [FirstBase] dan 50 ng DNA cetakan.
Program amplifikasi PCR [DNA Engine Tetrad 2] adalah: denaturasi awal pada suhu 94 ºC selama 5 menit sebanyak 1 siklus, dilanjutkan dengan 30 siklus yang terdiri atas: denaturasi pada suhu 94 ºC selama 30 detik, penempelan primer pada suhu 60 ºC selama 30 detik, pemanjangan primer pada suhu 72 oC selama 1 menit. Pemanjangan primer terakhir selama 5 menit pada suhu 72 oC.
17
pada 80 volt selama 35 menit [Biorad]. Gel direndam dengan Ethidium Bromida [Merck] (0.5 mg/L) selama 5 menit kemudian direndam di air selama 5 menit. Pita-pita DNA hasil elektroforesis divisualisasi dengan perangkat Chemidoc gel system [Biorad].
Analisis Pewarisan Gen hpt pada Tanaman Transgenik
Tanaman T0 ditumbuhkan di rumah kaca dan dibiarkan melakukan penyerbukan sendiri dengan menutup seluruh bunganya untuk menghindari penyerbukan silang. Biji dari tanaman T0 disterilisasi dengan perendaman 1 menit di dalam ethanol [Merck] 70% dan 15 menit di dalam 0.78% sodium hipoklorit [Bayclin] yang mengandung 1 tetes tween 20 untuk setiap 50 mL, kemudian dibilas 5 kali dengan air steril. Setelah dikeringkan di atas kertas saring [Advantec Toyo], biji ditanam di media MS0 padat yang mengandung 40 mg/L dan 50 mg/L higromisin [Higromisin B, Roche]. Tanaman atau kecambah yang tumbuh diamati pada 14 hari setelah tanam. Kecambah dikelompokkan menjadi dua yaitu kecambah yang resisten terhadap higromisin dapat hidup di media seleksi dan
19
HASIL DAN PEMBAHASAN
Transformasi Genetik secara In vitro
Transformasi genetik padi dengan vektor Agrobacterium tumefaciens
secara in vitro telah dilakukan pada tanaman padi varietas Ciherang, Nipponbare, Kasalath. Embrio muda yang diinfeksi dengan A. tumefaciens membentuk kalus dan tunas (berkecambah) dalam waktu 7 hari setelah ditanam pada media ko-kultivasi (Gambar 3). Untuk menginduksi terbentuknya kalus, dilakukan pemotongan tunas dari embrio yang berkecambah. Di dalam media induksi kalus, embrio muda dari semua varietas padi dapat menghasilkan kalus. Namun tidak semua kalus yang terbentuk ini dapat tumbuh pada media perbanyakan kalus yang mengandung 50 mg/L higromisin.
Gambar 3 Embrio muda setelah diinfeksi Agrobacterium tumefaciens dalam media ko-kultivasi.
Sebagian kalus dari varietas Ciherang dan Nipponbare dapat tumbuh di media perbanyakan kalus yang mengandung agen seleksi antibiotik higromisin. Namun, kalus yang lain khususnya dari varietas Kasalath mengalami kematian (Tabel 3).
20
Agen seleksi higromisin dalam konsentrasi tertentu mampu menekan pertumbuhan kalus padi nontransgenik. Antibiotik higromisin bekerja dengan cara menghambat sintesis protein melalui gangguan translokasi yang menyebabkan kesalahan translokasi pada ribosom 80s (Bashir et al. 2004). Kalus yang tahan akan tumbuh normal dan mampu berproliferasi pada media yang mengandung agen seleksi. Kalus yang dapat berproliferasi berwarna putih kekuningan, sedangkan kalus yang tidak tahan pada media seleksi berwarna cokelat kehitaman yang akhirnya mengalami kematian (Gambar 4).
Gambar 4 Kalus yang ditumbuhkan pada media yang mengandung 50 mg/L higromisin. (a) kalus yang tahan, (b) kalus yang tidak tahan.
Padi Nipponbare menghasilkan persentase kalus yang tahan higromisin paling tinggi (17.18%) dibandingkan dengan Ciherang (11.11%) dan Kasalath (0%) (Tabel 3). Kalus-kalus yang tahan tersebut kemudian dipindahkan ke dalam media regenerasi. Pada media regenerasi, kalus membentuk embrio somatik yang berbentuk struktur globular. Regenerasi dimulai dengan terbentuknya bintik-bintik hijau pada kalus (Gambar 5). Tidak semua kalus mampu membentuk bintik hijau.
Bintik hijau tersebut kemudian tumbuh menjadi tunas walaupun tidak semua bintik hijau tumbuh menjadi tunas.
Gambar 5 Regenerasi tunas dari kalus. (a) embrio somatik, (b) tunas hasil regenerasi dari embrio somatik.
(a) (b)
21
Tunas yang tumbuh dan berkembang dengan baik mampu membentuk akar pada media perakaran (Gambar 6). Tunas yang berakar telah berhasil diaklimatisasi. Aklimatisasi dilakukan secara bertahap yaitu dengan menanam tunas berakar pada media air selama 7 hari, kemudian dipindahkan ke media tanah di tempat teduh selama 2 minggu dan kemudian dipindahkan ke rumah kaca. Aklimatisasi dilakukan secara bertahap agar tanaman beradaptasi dengan lingkungannya.
Gambar 6 Tunas padi berakar.
Transformasi genetik dengan menggunakan vektor Agrobacterium pada padi japonika seperti Nipponbare sudah banyak dilaporkan dan memiliki efisiensi transformasi yang tinggi. Akan tetapi informasi keberhasilan transformasi pada padi indica seperti Ciherang dan Kasalath masih sangat terbatas. Padi indica sulit ditransformasi karena regenerasi dari sel atau jaringan sangat sulit (Maftuchah 2003; Saharan et al. 2004; Lin & Zhang 2005; Purnamaningsih 2006; Mulyaningsih et al. 2010).
Ge et al. (2006) menyatakan bahwa pembentukan kalus dan regenerasi jaringan padi sangat tergantung pada beberapa faktor seperti genotipe tanaman, tipe dan status fisiologi eksplan, komposisi dan konsentrasi garam, komponen organik dan hormon pertumbuhan dalam media. Hormon pertumbuhan memegang peranan penting pada tanaman monokotil termasuk serealia dalam kultur in vitro. Konsentrasi hormon pertumbuhan pada media regenerasi sangat mempengaruhi perkembangan kalus berdeferensiasi lanjut menjadi tunas (Mok et al. 1987; Cate
et al. 1988; Bhaskaran & Smith 1990).
Hasil penelitian ini mendukung penelitian yang sudah ada, bahwa
22
Dari tiga varietas yang diko-kultivasi dengan A. tumefaciens tidak satupun kalus dari padi indica yang beregenerasi membentuk tunas, walaupun varietas Ciherang menghasilkan jumlah kalus yang tahan higromisin sebesar 11.11% (Tabel 3). Hanya kalus dari padi japonica (Nipponbare) yang menghasilkan tunas transgenik putatif. Dari 11 tunas transgenik putatif yang berhasil diregenerasi, hanya 7 tunas yang mampu membentuk tanaman transgenik putatif.
Analisis PCR terhadap 7 tanaman transgenik putatif menunjukkan bahwa 3 tanaman adalah transgenik yang mengandung gen hpt, sedangkan 4 tanaman lainnya tidak mengandung transgen hpt (Gambar 7). Hasil PCR dengan primer gen hpt diketahui adanya tanaman transgenik putatif yang tidak membawa gen
hpt. Hal ini kemungkinan terjadi kalus escape, dimana kalus lolos pada media yang mengandung agen seleksi higromisin 50 mg/L tetapi tidak membawa gen
hpt. Lolosnya tanaman nontransgenik di media seleksi ini kemungkinan diduga akibat terjadinya degradasi antibiotik higromisin dalam media seleksi yang dipergunakan, dan tanaman terhindar dari agen seleksi karena tidak semua bagian kalus terbenam di dalam media. Berdasarkan tanaman transgenik yang membawa
gen hpt, efisiensi transformasi genetik pada padi varietas Nipponbare adalah 1.56%.
Gambar 7 Analisis integrasi gen hpt di dalam tanaman transgenik putatif dengan PCR. Lajur M = Penanda DNA Ladder 1 kb plus (Invitrogen), lajur 1-7 = DNA tanaman putatif transgenik, lajur 8 = air, lajur 9: DNA tanaman nontransgenik, dan lajur P = plasmid rekombinan
pCAMBIA-Osdep1.
Untuk mengidentifikasi tanaman transgenik pada tingkat awal, pada penelitian ini digunakan primer dari gen hpt untuk analisis PCR-nya. Primer yang digunakan untuk mengamplifikasi hpt bersifat spesifik karena primer tersebut
23
tidak dapat mengamplifikasi DNA dari tanaman nontransgenik dan secara indigenus tidak mempunyai homologi pada tanaman padi (Gambar 7). Primer yang dapat mengamplifikasi gen hpt banyak digunakan untuk mengidentifikasi tanaman transgenik (Zaidi et al. 2006; Rao & Rao 2007; Mulyaningsih et al. 2010; Aryani 2011).
Deteksi integrasi gen hpt di dalam genom adalah tahap awal dalam menyeleksi tanaman transgenik. Gen hpt dan gen Osdep1 berada pada daerah T-DNA dalam plasmid pCambia1301-Osdep1. Keberadaan gen hpt dapat merupakan indikasi keberadaan gen lain dalam satu T-DNA yang sama. Dengan demikian jika hasil PCR menunjukkan keberadaan gen hpt dalam genom maka gen sasaran Osdep1 juga telah terintegrasi dalam genom.
Untuk mengetahui pengaruh gen Osdep1 terhadap produksi biji maka tanaman transgenik harus mengandung transgen Osdep1. Untuk itu primer harus didesain berdasarkan urutan DNA pada promoter sebagai forward primer dan daerah penyandi Osdep1 sebagai reverse primer. Pasangan primer dengan promoter dan daerah penyandi Osdep1 hanya mengamplifikasi DNA tanaman transgenik tetapi tidak DNA tanaman nontransgenik. Karena transgen Osdep1
difusikan dengan gen hpt, maka tanaman transgenik yang mengandung gen hpt
diharapkan juga mengandung transgen Osdep1. Walaupun demikian, keberadaan transgen Osdep1 harus dideteksi pada tanaman transgenik.
Transformasi secara in vitro menggunakan eksplan embrio muda memiliki keunggulan. Keunggulan tersebut adalah transgen terintegrasi ke dalam genom tanaman. Apabila transgen telah terintegrasi pada genom tanaman maka transgen tersebut akan stabil diwariskan ke generasi berikutnya. Hiei dan Komari (1996) melaporkan bahwa transgen stabil diwariskan sampai generasi ke-4. Bahkan Wu
24
Transformasi Genetik secara In planta
Transformasi genetik secara in planta pada 100 eksplan yang berupa embrio dari biji padi untuk setiap varietas menghasilkan 2 tanaman transgenik pada varietas Ciherang dan 3 tanaman transgenik pada varietas Kasalath, dan tidak satupun tanaman transgenik dihasilkan dari varietas Nipponbare. Analisis tanaman transgenik ini didasarkan pada PCR menggunakan primer yang spesifik untuk gen hpt. Amplifikasi DNA tanaman transgenik dengan primer tersebut menghasilkan amplifikasi sebesar 500 pb, seperti tanaman transgenik varietas Ciherang (Gambar 8).
Gambar 8 Analisis PCR menggunakan primer spesifik gen hpt terhadap tanaman padi varietas Ciherang hasil transformasi in planta. Lajur 1-7 = DNA tanaman Ciherang pada media ½ MS, lajur 8 = DNA tanaman Ciherang pada media ½ MS+Higromisin 40 mg/L, lajur 9-10 = DNA Ciherang pada media ½ MS+Higromisin 30 mg/L, lajur 11 = air, lajur 12 = DNA tanaman Ciherang nontransgenik, lajur P = plasmid rekombinan pCAMBIA-Osdep1, dan lajur M = penanda DNA Ladder
1 kb plus (Invitrogen).
Tanaman transgenik terbanyak dihasilkan dari eksplan yang ditanam di media tanpa higromisin yaitu 1 tanaman transgenik varietas Ciherang dan 3 tanaman transgenik varietas Kasalath. Eksplan yang ditanam di media yang mengandung 10 mg/L, 20 mg/L, 30 mg/L higromisin tidak menghasilkan tanaman transgenik untuk ketiga varietas, sedangkan yang ditanam pada 40 mg/L higromisin menghasilkan 1 tanaman transgenik varietas Ciherang (Tabel 4).
25
Gen hpt menyandikan enzim hygromicin phosphotranfserase yang digunakan sebagai penanda untuk mengetahui terintegrasinya T-DNA
Agrobacterium ke dalam genom tanaman, sehingga hanya tanaman transgenik saja yang dapat hidup di media tumbuh yang mengandung antibiotik higromisin (Christou et al. 1991). Seleksi yang dilakukan terlalu dini terhadap kalus yang terbentuk menyebabkan terhambatnya regenerasi. Hasil ini menunjukkan bahwa higromisin menghambat regenerasi tanaman transgenik.
Efisiensi transformasi menggunakan metode in planta dalam media seleksi higromisin 40 mg/L adalah 2%, 0% dan 3% masing-masing untuk varietas Ciherang, Nipponbare dan Kasalath (Tabel 5). Transformasi secara in planta
memiliki kesamaan dengan infeksi oleh A. tumefaciens pada tanaman di alam (Kojima et al. 2000; Supartana et al. 2005).
Tabel 5 Jumlah tanaman positif PCR dan efisiensi transformasi secara in planta
padi Ciherang, Nipponbare, dan Kasalath
Transformasi secara in planta telah menghasilkan sejumlah transforman yang membawa gen penyeleksi hpt dan tanaman transgenik tersebut merupakan tanaman generasi pertama (T0). Untuk varietas Kasalath, transformasi in planta
menghasilkan 3 galur tanaman yaitu galur no. 2 (Kasalath-Osdep1-2), galur no. 4 (Kasalath-Osdep1-4) dan galur no. 8 (Kasalath-Osdep1-8). Sementara, untuk varietas Ciherang, dua galur transgenik telah diperoleh melalui transformasi in
26
planta ini yaitu galur no. 1 Osdep1-1) dan galur no. 2 (Ciherang-Osdep1-2). Salah satu kelemahan teknik transformasi secara in planta adalah terbentuknya tanaman khimera (Supartana et al. 2005). Oleh karena itu, untuk membuktikan bahwa tanaman-tanaman transgenik yang diperoleh melalui transformasi secara in planta adalah tanaman transgenik yang tidak khimera maka dilakukan analisis pewarisan transgen.
Analisis pewarisan transgen dilakukan pada galur padi transgenik generasi T1 Kasalath-Osdep1-4 dan Kasalath-Osdep1-8. Alasan digunakan dua galur ini adalah karena galur tersebut menghasilkan cukup banyak benih T1 sehingga memudahkan di dalam melakukan analisis pewarisan. Benih-benih T1 dari kedua galur tersebut ditumbuhkan pada media MS (Murashige-Skoog) yang mengandung higromisin 40 mg/L. Konsentrasi ini merupakan konsentrasi yang digunakan untuk penapisan awal pada transformasi secara in planta. Hasil uji resistensi kecambah padi varietas Kasalath nontransgenik dan populasi turunan dari Kasalath-Osdep1 terhadap higromisin disajikan pada tabel 6.
Tabel 6 Uji toleransi kecambah padi varietas Kasalath nontransgenik dan Kasalath-Osdep1 generasi T1 di media seleksi yang mengandung higromisin 40 mg/L
Keterangan: *) Tanaman padi Kasalath kontrol (non transgenik yang ditumbuhkan pada media MS yang mengandung higromisin 40 mg/L)
**) Tanaman padi Kasalath kontrol (non transgenik yang ditumbuhkan pada media MS yang tidak mengandung higromisin)
27
varietas Kasalath nontransgenik diuji di media yang mengandung higromisin 50 mg/L.
Semua tanaman Kasalath nontransgenik mati pada media seleksi higromisin 50 mg/L (Tabel 7). Oleh karena itu, uji toleransi tanaman varietas Kasalath keturunan dari tanaman Kasalath transgenik (generasi T1) dilakukan di media yang mengandung 50 mg/L higromisin.
Tabel 7 Uji resistensi varietas Kasalath nontransgenik terhadap antibiotik higromisin pada media yang mengandung 50 mg/L higromisin
Benih ∑ awal benih
Hasil uji resistensi terhadap higromisin pada populasi terhadap T1 dari Kasalath-Osdep1 pada media MS yang mengadung higromisin 50 mg/L menunjukkan bahwa hanya 9 tanaman T1 dari Kasalath-Osdep1-4 dan 1 tanaman T1 dari Kasalath-Osdep1-8 yang resisten terhadap higromisin (Tabel 8). Berdasarkan perbandingan tanaman yang resisten dan sensitif terhadap
higromisin, pewarisan gen hpt pada tanaman T1 tidak mengikuti hukum Mendel.
Tabel 8 Hasil skrining galur-galur tanaman transgenik Kasalath-Osdep1 pada media mengandung 50 mg/L higromisin
Diperolehnya tanaman-tanaman generasi T1 yang resisten terhadap higromisin merupakan bukti bahwa transgen hpt telah terintegrasi pada genom sel-sel meristem apikal (biasanya belum terdiferensiasi) yang berkembang menjadi sel-sel reproduksi yang selanjutnya diwariskan pada generasi berikutnya. Apabila transgen terintegrasi pada sel-sel yang telah terdiferensiasi maka hanya bagian tunas atau akar saja yang tertransformasi sehingga hanya sebagian organ saja yang transgenik (khimera) dan transgen tidak diwariskan kepada generasi
28
29
SIMPULAN
Gen hpt telah berhasil masuk ke dalam genom tanaman padi Nipponbare dengan metode in vitro menggunakan eksplan embrio muda. Selain transformasi secara in vitro, gen hpt telah berhasil masuk ke dalam genom padi varietas Kasalath melalui metode in planta walaupun dengan efisiensi yang rendah. Transgen hpt di dalam tanaman padi Kasalath transgenik telah diwariskan kepada generasi berikutnya walaupun tidak mengikuti hukum mendel.
SARAN
Analisis integrasi Osdep1 baik pada tanaman T0 maupun T1 perlu dilakukan untuk memastikan bahwa tanaman-tanaman tersebut telah membawa transgen.
31
DAFTAR PUSTAKA
Aryani AT. 2011. Transformasi gen Osdep1-Tc (Oryza sativa dense and erect panicle1-Truncated) ke kalus padi cv. Taipei 309 menggunakan
Agrobacterium tumefaciens [skripsi]. Depok: Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Indonesia.
Ashikari et al. 2005. Cytokinin oxidase regulates rice grain production. Science
309:741-745.
Bashir K, Rafiq M, Fatima T, Husnain T, Riazuddin S. 2004. Hygromicin based selection of transformants in a local inbred line of Zea mays (L). Pakistan J Biol Sci 7:318-323.
Bhaskaran S, Smith RH. 1990. Regeneration in cereal tissue culture a review.
Crop Sci 30:1328-1336.
[BPS] Badan Pusat Statistik. 2012. Luas Panen, Produktivitas, Produksi Tanaman Padi Provinsi Indonesia. http://www.bps.go.id/tnmn_pgn.php?eng=0. [15 Maret 2012].
Cate HT, Ennik E, Roest S, Ramulu KS, Dijkhuis P. 1988. Effect of in vitro differentiation of genetic stability in potato. Theor Appl Genet 75:452-459.
Christou P, Ford TL, Kofron M. 1991. Production of transgenic rice (Oryza sativa
L.) plants from agronomically important indica and japonica varieties via electric discharge particle acceleration of exogenous DNA into immature zygotic embryos. Biotechnology 9:957-966.
Doyle JJ, Doyle JL. 1991. Isolation of plant DNA from fresh tissue. Focus 12:13-15.
Fitranty N, Nurilmala F, Santoso D, Minarsih H. 2003. Efektivitas Agrobacterium
mentransfer gen P5CS ke dalam kalus tebu klon PS 851. Menara Perkebunan 71:16-27.
Ge X, Chu Z, Lin Y, Wang S. 2006. A tissue culture system for different germplasms of indica rice. Plant cell Rep 25:392-402.
Greco et al. 2003. Transpositional behavior of an Ac/Ds system for reverse genetics in rice. Theoritical and Applied Genetics 108:10-24.
Guo Y, Hong D. 2010. Novel pleiotropic loci controlling panicle architecture across environments in japonica rice (Oryza sativa L.). Science Direct
37:533-544.
32
Hiei Y, Komari T. 1996. Stable inheritance of transgenes in rice plants transformed by Agrobacterium tumefaciens. Proceedings of the Third Rice Genetic Symposium 16-20 October 1996. Manila Philippines. p. 131-142.
Hiei Y, Komari T. 2006. Improved protocols for transformation of indica rice mediated by Agrobacterium tumefaciens. Plant Cell Tissue and Organ Culture 85:271-283.
Hiei Y, Komari T. 2008. Agrobacterium-mediated transformation of rice using immature embryos or calli induced from mature seed. Nature 3:824-834.
Hiei Y, Ohta S, Komari T, Kumashiro T. 1994. Efficient transformation of rice
(Oryza sativa) mediated by Agrobacterium and sequence analysis of boundaries of the T-DNA. Plant Journal 6:271-282.
Huang et al. 2009. Natural variation at the DEP1 locus enhances grain yield in rice. Nature Genetic 41:494-497.
Kojima et al. 2000. Note development of a simple and efficient method for transformation of Buckwheat plant (Fagopyrum esculentum) using
Agrobacterium tumefaciens. Agrosci Biotechnol Biochem 64:845-847.
Kolesnik et al. 2004. Establishing an efficient Ac/Ds tagging system in rice: large scale analysis of Ds flanking sequences. The Plant Journal 37:301-314.
Lee et al. 2010. Genotypic variation of Agrobacterium-mediated transformation of Italian ryegrass. Electronic Journal of Biotechnol 13:1-10.
Lin YJ, Zhang Q. 2005. Optimising the tissue culture conditions for high efficiency transformation of indica rice. Plant Cell Rep 23:540-547.
Maftuchah. 2003. Transformasi genetik padi indika dengan gen cryIA(b) dan
cryIB menggunakan Agrobacterium tumefaciens untuk ketahanan terhadap hama penggerek batang kuning (Scirpophaga incertulas walker.). [disertasi]. Bogor: Sekolah Pascasarjana, Institut Pertanian Bogor.
Mok MC, Mok DWS, Tuner JE, Mujer CV. 1987. Biological and biochemical effects of cytokinin-active phenylurea derivative in tissue culture systems.
HortScience 22:1194-1197.
Mulyaningsih ES, Aswidinnoor H, Sopandie D, Ouwerkerk PBF, Slamet Loedin IH. 2010. Transformasi padi indika kultivar Batutegi dan Kasalath dengan gen regulator HD-Zip untuk perakitan varietas toleran kekeringan. J Agron Indonesia 38:1-7.
33
populasi padi mengandung marka genetik QTL12.1. [disertasi]. Bogor: Sekolah Pascasarjana, Institut Pertanian Bogor.
Nasir M. 2001. Pengantar Pemuliaan Tanaman. Departemen Pendidikan Nasional. Jakarta. hal:283-287.
Pambudi A. 2009. Teknik Transformasi genetik beberapa tanaman menggunakan
Agrobacterium tumefaciens. [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Piao et al. 2009. Map-based cloning of the ERECT PANICLE3 gene in rice.
Theory Application Genetic 119:1497-1506.
Purnamaningsih R. 2006. Induksi kalus dan optimasi regenerasi empat varietas padi melalui kultur in vitro. AgroBiogen 2:74-80.
Rahmawati S. 2006. Status perkembangan perbaikan sifat genetik padi menggunakan transformasi Agrobacterium. J AgroBiogen 2:36-44.
Ramesh M, Gupta AK, Murugiah V. 2009. Efficient in vitro plant regeneration via leaf base segment of indica rice (Oryza sativa L.). Indian J Exp Bio
47:68-74.
Rao MVR, Rao GJN. 2007. Agrobacterium-mediated transformation of indica rice under acetosyringone-free conditions. Plant Biotechnology 24:507-511.
Remelia M. 2008. Analisis insersi T-DNA pembawa transposon Ac/Ds pada T0 dan aktivitas Ds pada T1 tanaman padi (Oryza sativa L.) kultivar Nipponbare [skripsi]. Depok: Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Indonesia.
Saharan V, Yadav RC, Yadav NR, Ram K. 2004. Studies on improved
Agrobacterium-mediated transformation in two indica rice (Oryza sativa
L.). African J Biotechnol 3:572-575.
Santoso TJ, Sudarsono, Aswidinnoor H, Somantri IH. 2005. Catatan penelitian daya regenerasi padi indika cv. Bengawan Solo dalam dua tipe media regenerasi dengan penembakan mikroproyektil. Hayati 12:157-161.
Santoso TJ, Sustiprijatno, Setiawan D, Apriana A, Sisharmini A. 2010. Kloning gen depI untuk produktivitas dengan kontribusi >15% peningkatan hasil melalui teknik over-ekspresi dan informasi sekuen genom pada Padi.
34
Setiamihardja R, Herawati T. 2000. Pemuliaan Tanaman Lanjutan. Program Pengembangan Kemampuan Peneliti Tingkat S1 Non Pemuliaan Dalam Ilmu Dan Teknologi Pemuliaan. Universitas Padjadjaran. Bandung.
Slamet Loedin IHS. 1994. Transformasi genetik pada tanaman: beberapa teknik dan aspek penting. Hayati 1:66-67.
Smith CW, Dilday RH. 2002. Rice: origin, history, technology and production. Willey & Sons Inc. New Jersey. 627 hlm.
Smith RH, Hood EE. 1995. Review and interpretation, Agrobacterium tumefaciens transformation of monocotyledons. Crop Sci 35:301-309.
Supartana et al. 2005. Development of simple and efficient in planta
transformation method for rice (Oryza sativa L.) using Agrobacterium tumefaciens. J Biosci Bioeng 100:391-397.
Toki et al. 2006. Early infection of scutellum tissue with agrobacterium allows high-speed transformation of rice. Plant J 47:969-976.
Utomo SD. 2005. Pengaruh L-Sistein terhadap Efisiensi Transformasi Genetik jagung (Zea mays) menggunakan Agrobacterium. Bul Agron 33:7-16.
Wagiran A, Ismanizan I, Che Radziah CMZ, Ruslan A. 2010. Agrobacterium tumefaciens-mediated transformation of the isopentenyltransferase gene in japonica rice suspension cell culture. Australian J of Crop Scie 4:421-429.
Wu et al. 2002. Inheritanced and expression of the cryIAb gene in Bt (Bacillus thuringiensis) transgenic rice. Theor Appl Genet 104:727-734.
Wulandari I. 2005. Studi beberapa metode transformasi genetik tanaman tebu (Saccharum officinarum L.) dengan gen fitase melalui perantara
Agrobacterium tumefaciens GV 2260. [tesis]. Bogor. Sekolah Pascasarjana, Institut Pertanian Bogor.
Yoshida S. 1981. Foundamentals of Rice Crop Science. The International Rice Research Institute. Los Banos Philippines. 277 hlm.
Zaidi MA et al. 2006. Optimizing tissue culture media for efficient
transformation of different indica rice genotypes. Agronomy Res
4:563-575.
Zhu et al. 2009. Erect Panicle2 encodes a novel protein that regulates panicle
35
37
Lampiran 1 Stok dan komposisi media transformasi padi
39
Lampiran 2 Komposisi media A200 (1L)
40
Lampiran 3 Komposisi media A201, A202. A203
41
Lampiran 4 Komposisi media A204, A205
Komposisi A204 A205
MS1 20 ml 20 ml
MS2 10 ml 10 ml
MS3 10 ml 10 ml
MS4 10 ml 10 ml
Vitamin MS 5 ml 5 ml
B5 minor 1 10 ml 10 ml
Maltosa 30 g -
Sorbitol 20 g -
Sukrosa - 30 g
pH 5.8 5.8
Agarose type 1 10 g 3 g
Autoklaf 15’, 121 o
C. dinginkan sampai 50 oC
15’, 121 o
C. dinginkan sampai 50 oC
Kinetin 2 mg/L 2 mg/L
NAA 5 mg/L 1 mg/L
Cefotaxim 250 mg/L 250 mg/L
Vancomisin 100 mg/L 100 mg/L