EFEK PEMBERIAN TERIPANG PASIR (
Holothuria scabra
J) TERHADAP
PROFIL IMUNOHISTOKIMIA ANTIOKSIDAN SUPEROKSIDA
DISMUTASE (SOD) PADA PANKREAS TIKUS DIABETES
ANI KARMILA
FAKULTAS KEDOKTERAN HEWAN INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Efek Pemberian Teripang Pasir (Holothuria scabra J) terhadap Profil Imunohistokimia Antioksidan Superoksida Dismutase (SOD) pada Pankreas Tikus Diabates adalah benar karya saya dengan arahan dari pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
ANI KARMILA. Efek Pemberian Teripang Pasir (Holothuria scabra J) terhadap Profil Imunohistokimia Antioksidan Superoksida Dismutase (SOD) pada Pankreas Tikus Diabetes. Dibimbing oleh TUTIK WRESDIYATI.
Tujuan dari penelitian ini adalah untuk menganalisa pengaruh pemberian teripang pasir (Holothuria scabra J) terhadap profil imunohistokimia antioksidan copper,zinc-superoxide dismutase (Cu,Zn-SOD) pada pankreas tikus diabetes mellitus. Sebanyak 25 ekor tikus putih jantan (Sprague Dawley) digunakan dalam penelitian ini. Tikus dikelompokkan menjadi lima kelompok perlakuan; (1) kontrol negatif (KN), (2) kontrol positif, tikus dengan diabetes mellitus (KP), (3) tikus diabetes dengan perlakuan hidrolisat protein teripang pasir (HDL), (4) tikus diabetes dengan perlakuan konsentrat protein teripang pasir (KST), (5) tikus diabetes dengan perlakuan isolat protein teripang pasir (ISL). Kondisi diabetes didapat melalui injeksi aloksan dengan dosis 110 mg/kg bb. Sel β pankreas akan dirusak oleh aloksansehingga sekresi insulin akan menurun. Perlakuan dilakukan selama 28 hari. Jaringan pankreas disampling setelah perlakuan berakhir. Jaringan pankreas difiksasi dengan larutan Bouin dan kemudian diproses menjadi preparat histologi. Jaringan pankreas diwarnai dengan teknik pewarnaan imunohistokimia menggunakan antibodi monoklonal Cu,Zn-SOD. Hasil penelitian menunjukkan bahwa perlakuan HDL, KST, dan ISL teripang pasir (Holothuria scabra J) meningkatkan kandungan antioksidan Cu,Zn-SOD pada jaringan pankreas. Perlakuan HDL memberikan efek paling baik dalam peningkatan antioksidan Cu,Zn-SOD pada jaringan pankreas tikus diabetes.
Kata kunci: antioksidan Cu,Zn-SOD, diabetes mellitus, imunohistokimia, pankreas tikus, teripang pasir (Holothuria scabra J).
ABSTRACT
ANI KARMILA. The Effect of Sea Cucumber (Holothuria scabra J) on the Profile of Immunohistochemical Antioxidant Superoxide Dismutase (SOD) in the Pancreatic of Diabetic Rats. Under the supervision of TUTIK WRESDIYATI.
antibody of Cu,Zn-SOD. The results showed that treatment of HDL, KST, and ISL sea cucumber (Holothuria scabra J) increased content antioxidant Cu,Zn-SOD in pancreatic tissue. The HDL treatment gave the best effect in increasing the antioxidant content of Cu,Zn-SOD inpancreatic tissue of diabetic rats.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan
pada
Fakultas Kedokteran Hewan
EFEK PEMBERIAN TERIPANG PASIR (
Holothuria scabra
J) TERHADAP
PROFIL IMUNOHISTOKIMIA ANTIOKSIDAN SUPEROKSIDA
DISMUTASE (SOD) PADA PANKREAS TIKUS DIABETES
FAKULTAS KEDOKTERAN HEWAN INSTITUT PERTANIAN BOGOR
BOGOR 2013
Judul Skripsi : Efek Pemberian Teripang Pasir (Holothuria scabra J) terhadap Profil Imunohistokimia Antioksidan Dismutase (SOD) pada Pankreas Tikus Diabetes
Nama : Ani Karmila NIM : B04090049
Disetujui oleh
Prof Drh Tutik Wresdiyati, PhD, PAVet Pembimbing
Diketahui oleh
Drh Agus Setiyono, MS, PhD, APVet Wakil Dekan Fakultas Kedokteran Hewan
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala rahmat dan karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Judul yang dipilih dalam penelitian yang dilaksanakan sejak bulan Agustus 2012 ialah Efek Pemberian Teripang Pasir (Holothuria scabra J) terhadap Profil Imunohistokimia Antioksidan Superoksida Dismutase (SOD) pada Pankreas Tikus Diabetes.
Penelitian ini merupakan bagian dari proyek penelitian yang didanai oleh Direktoral Jendral Pendidikan Tinggi (DIKTI) Kementerian Pendidikan Nasional RI melalui program Hibah Bersaing atas nama Rahman Karnila.
Terima kasih yang tak terhingga penulis ucapkan kepada Ibu Prof drh Tutik Wresdiyati, PhD, PAVet selaku dosen pembimbing skripsi, yang telah banyak memberi ilmu, semangat, arahan, kritik, saran yang sangat membangun dan mendukung terselesaikannya skripsi ini.
Penulis mengucapkan terima kasih kepada Dr Drh Hj Gunanti, MS sebagai dosen pembimbing akademik yang telah memberikan bimbingan serta semangat kepada penulis selama penulis menjalani pendidikan di Fakultas Kedokteran Hewan IPB. Selanjutnya, ucapan terima kasih kepada teknisis laboratorium; Pak Iwan, Pak Maman, terima kasih atas bantuan dan bimbingan yang telah diberikan selama penelitian berlangsung.
Ungkapan rasa hormat dan sayang untuk ayahanda dan ibunda tercinta, terima kasih atas doa, perhatian, kasih sayang, semangat dan dorongannya kepada penulis, serta terima kasih kepada teman-temanku Indah, Smytha, Yuyun, dan Maya yang telah membantu dan memberikan semangat kepada penulis. Terima kasih kepada semua teman-teman Geochelone dan semua penghuni kosan Doi atas segala doa, bantuan dan semangatnya dalam penyelesaian skripsi ini.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR ISI viii
DAFTAR GAMBAR ix
DAFTAR LAMPIRAN ix
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
Manfaat Penelitian 2
Hipotesa 2
TINJAUAN PUSTAKA 2
Teripang Pasir (Holothuriascabra J) 2
Imunohistokimia 4
Copper,Zinc-Superoxide Dismutase (Cu,Zn-SOD) 5
Pankreas 6
Hewan Percobaan 7
Diabetes Mellitus 8
METODE 9
Waktu dan Tempat Penelitian 9
Alat dan Bahan 9
Prosedur Penelitian 9
Prosedur Analisis Data 12
HASIL DAN PEMBAHASAN 12
SIMPULAN DAN SARAN 16
Simpulan 16
Saran 17
DAFTAR PUSTAKA 17
LAMPIRAN 20
DAFTAR TABEL
1 Distribusi dan frekuensi enzim Cu,Zn-SOD pada jaringan pankreas tikus
percobaan 15
DAFTAR GAMBAR
1 Teripang pasir (Holothuria scabra J) 3
2 Struktur direct dan indirect teknik imunohistokimia 5
3 Prinsip teknik pewarnaan imunohistokimia 5
4 Reaksi SOD terhadap ion superoksida 6
5 Fotomikrograf pulau Langerhans jaringan pankreas tikus percobaan dengan pewarnaan imunohistokimia terhadap antioksidan
Cu,Zn-SOD 13
6 Fotomikrograf sel-sel asinar jaringan pankreas tikus percobaan dengan pewarnaan imunohistokimia terhadap antioksidan Cu,Zn-SOD 14
DAFTAR LAMPIRAN
1 Proses pengambilan organ dan preparasi jaringan 20
PENDAHULUAN
Latar Belakang
Negara Indonesia adalah negara kepulauan yang memiliki garis pantai terpanjang di dunia dengan panjang 81 000 km dengan luas perairan laut sekitar 5.8 juta km2 (Dewi et al. 2010). Oleh karena itu, Indonesia kaya akan hasil laut. Salah satu hasil laut Indonesia yang memiliki nilai ekonomi dan mulai banyak dikonsumsi masyarakat adalah teripang. Teripang mengandung banyak zat-zat aktif yang bermanfaat bagi kesehatan manusia. Teripang dimanfaatkan sebagai sumber bahan pangan, materi penyembuh barbagai penyakit, maupun sebagai bahan baku industri farmasi.
Teripang termasuk dalam kelas Holothuridae yang sering dikenal dengan ketimun laut. Salah satu jenis teripang yang dapat dijadikan bahan pangan adalah teripang pasir (Holothuria scabra J). Kandungan kimia daging teripang tersebut secara umum terdiri atas air 87.33 ± 1.09% bb, protein 72.93 ± 7.58% bk, abu 16.5
± 4.24% bk, lemak 3.54 ± 0.24% bk, dan karbohidrat 7.04 ± 4.23% bk (Karnila 2012). Teripang juga mengandung asam amino esensial, kolagen, vitamin E, fosfor, besi, iodium, natrium, vitamin A dan B (thiamin, riboflavin, dan niasin), serta kandungan asam lemak penting pada teripang adalah EPA dan DHA (Dewi 2008). Dilihat dari kandungan gizi dan bahan bioaktif yang terkandung dalam teripang, teripang dapat digunakan sebagai bahan pangan dan produk kesehatan alami salah satunya mengontrol glukosa darah, sehingga teripang diduga dapat mengatasi gangguan diabetes mellitus (Sendih dan Gunawan 2007).
Diabetes mellitus (DM) atau yang dikenal dengan penyakit kencing manis merupakan penyakit metabolik yang berkaitan dengan abnormalitas fungsi pankreas sebagai organ endokrin. Penyakit DM ditandai dengan tingginya kadar gula darah dari normal atau hiperglikemia akibat kerusakan sekresi insulin, kerja insulin, atau keduanya (ADA 2004; Holt dan Neil 2007). Insulin yang diproduksi oleh pankreas tidak cukup untuk mengikat gula darah, atau ketidakmampuan tubuh untuk menggunakan insulin yang diproduksi dengan efektif dapat menimbulkan penyakit DM (Karnila 2012).
Prevalensi penyakit DM terus meningkat seiring dengan perkembangan zaman. Hal ini terjadi karena adanya perubahan pola hidup dan makan pada masyarakat. Berdasarkan data World Health Organization (WHO) diperkirakan bahwa penduduk dunia meninggal akibat DM sekitar 3.2 juta jiwa. Pada tahun 2003 WHO memperkirakan 194 juta jiwa (5.1%) dari 3.8 miliar penduduk dunia yang berusia 20-79 tahun menderita DM dan akan meningkat menjadi 333 juta jiwa pada tahun 2025. Hasil survei WHO, prevalensi penyakit DM di Indonesia pada tahun 2000 adalah 8.4 juta jiwa dan pada tahun 2030 diperkirakan akan meningkat menjadi 21.3 juta jiwa jika tidak menerapkan pola hidup sehat dari sekarang dan jika tidak ditangani dengan baik (Depkes 2008).
2
ketidakseimbangan antara radikal bebas dengan antioksidan yang ada di dalam tubuh, hal ini terjadi pada penderita DM. Telah dilaporkan oleh Wresdiyati et al. (2008), pada pankreas tikus DM, terjadi penurunan enzim antioksidan copper,zinc-superoxide dismutase (Cu,Zn-SOD). Kandungan antioksidan Cu,Zn-SOD di hati Macaca fasicularis DM juga dilaporkan rendah (Wresdiyati et al. 2003). Dalam jangka panjang penyakit DM dapat menyebabkan gangguan atau kerusakan pada jantung, pembuluh darah, mata, ginjal, dan saraf (WHO 2010).
Tujuan Penelitian
Penelitian ini bertujuan menganalisa pengaruh pemberian teripang pasir (Holothuria scabra J) terhadap profil imunohistokimia antioksidan copper,zinc-superoxide dismutase (Cu,Zn-SOD) pada jaringan pankreas tikus DM.
Manfaat Penelitian
Hasil penelitian ini diharapkan dapat memberikan informasi terkait manfaat teripang pasir (Holothuria scabra J) terhadap kandungan antioksidan copper,zinc-superoxide dismutase (Cu,Zn-SOD) pada jaringan pankreas tikus DM.
Hipotesa
Ekstrak teripang dapat memperbaiki penurunan antioksidan Copper,Zinc-Superoxide Dismutase (Cu,Zn-SOD) pada pankreas tikus yang menderita DM.
TINJAUAN PUSTAKA
Teripang Pasir (Holothuriascabra J)
3
Gambar 1 Teripang pasir (Holothuria scabra J) (Karnila 2012) Menurut Martoyo et al. (2004) klasifikasi dari teripang pasir adalah :
Filum : Echinodermata Sub-filum : Echinozoa Kelas : Holothuroidea Sub-kelas : Aspidochirotda Ordo : Aspidochirota
: Dendrochirota Famili : Aspidochirotae
: Holothuridae
Genus : Holothuria, Stichopus, Thelonota, Actinopyga, Muelleria
Spesies : Holothuria scabra J, Holothuria nobilis J, Stichopus variegatus J, Thelonota ananas J, Actinopyga lecanora J, Actinopyga miliaris, Actinopyga echinites, Muelleria lecanora
Bahan bioaktif yang dikandung teripang berperan sebagai antioksidan yang membantu mengurangi kerusakan sel dan jaringan tubuh. Teripang juga diketahui memiliki efek antinosiseptif (penahan sakit) dan antiinflamasi yang berfungsi melawan radang dan mengurangi pembengkakan. Teripang mengandung bahan aktif yang sangat bermanfaat, seperti antioksidan yang bermanfaat dalam perbaikan sel-sel yang rusak. Selain itu, teripang juga kaya dengan nutrisi serta omega 3 yang terdiri dari kandungan asam eikosapentaenoat (EPA) dan asam dokosaheksaenoat (DHA) yang mempu menghambat proses penuaan dan menurunkan kolesterol jahat dalam tubuh (Arlyza 2009).
Teripang memiliki kadar peotein yang cukup tinggi, dari analisis kimia yang dilakukan Karnila (2012), diketahui kandungan protein daging teripang pasir (Holothuria scabra J) cukup tinggi yaitu 72.93% bk. Tingginya kadar protein pada teripang tersebut menunjukkan bahwa teripang memiliki nilai gizi yang baik sebagai bahan pangan. Selain itu, protein teripang juga memiliki asama amino yang lengkap.
4
teripang dalam bentuk tepung menggunakan enzim tripsin. Konsentrat protein teripang pasir merupakan produk pekatan protein. Konsentrat protein dibuat dengan cara menghilangkan komponen nonprotein seperti lemak, karbohidrat, mineral, dan air sehingga kandungan protein produk menjadi lebih tinggi dari bahan baku aslinya (Amoo et al. 2006). Konsentrat protein teripang pasir diperoleh dengan melakukan ekstraksi lemak dari bahan dasar daging teripang pasir dalam bentuk tepung menggunakan aseton. Isolat protein teripang dapat diperoleh dari komponen teripang lainnya. Isolat protein teripang pasir didapatkan melalui isolasi protein dari bahan dasar daging teripang pasir dalam bentuk tepung dengan melakukan pengaturan pH melalui penambahan NaOH 35% dan HCL.
Telah dilaporkan oleh Karnila (2012), hidrolisat protein teripang pasir mengandung protein yang paling tinggi dibandingkan konsentrat dan isolat teripang pasir. Selain itu, asam amino bebas penstimulasi insulin yang dapat meningkatkan kecepatan stimulasi sekresi insulin oleh sel β pankreas, sehingga mempercepat peningkatan plasma insulin yang berdampak pada peningkatan kecepatan penurunan glukosa darah.
Imunohistokimia
Imunohistokimia merupakan suatu teknik pewarnaan jaringan yang mampu mendeteksi komponen aktif (antigen) dalam jaringan, yang bertujuan untuk diagnosa dan penelitian. Konsep dasar dari imunohistokimia sangat sederhana dan merupakan gabungan dari tiga disiplin ilmu, yaitu imunologi yang berkaitan dengan prinsip ikatan antara antigen dan antibodi, histologi yang berhubungan dengan penggunaan sediaan dengan ketebalan mikro yang diamati dengan mikroskop cahaya, dan ilmu kimia yang berhubungan dengan reaksi kimia yang terjadi saat pewarnaan (Ramos-Vara 2005).
5
Gambar 2 Struktur direct (kiri) dan indirect (kanan) teknik imunohistokimia (Ramos-Vara 2005)
Gambar 3 Prinsip teknik pewarnaan imunohistokimia (Ramos-Vara 2005)
Copper,Zinc-Superoxide Dismutase (Cu,Zn-SOD)
Stres oksidatif merupakan konsekuensi alami dari metabolisme oksigen. Metabolisme oksigen menghasilkan suatu elemen yang reaktif seperti ion superoksida (O2-) dan ion hidroksil (OH-) yang disebut dengan radikal bebas. Radikal bebas, reactive oxygen species (ROS) atau reactive nitrogen species (RNS) merupakan senyawa yang memiliki elektron bebas yang tidak berpasangan dan sangat reaktif dengan molekul lain yang akhirnya membentuk reaksi berantai (chain reaction). Reaksi ini dapat membahayakan DNA, protein seluler yang penting, dan membran lemak (lipid peroxidation), yang dapat menyebabkan kematian sel (Menvielle-Bourg 2005).
6
radikal bebas adalah enzim superoksida dismutase (SOD). Tiga bentuk enzim SOD yang terdapat di dalam tubuh yaitu copper,zinc-superoxide dismutase (Cu,Zn-SOD), manganase superoxide dismutase (Mn-SOD), dan iron superoxide dismutase (Fe-SOD) (Valko et al. 2007). Lokasi enzim superoksida dismutase dalam tubuh mamalia antara lain Mn-SOD terdapat dalam mitokondria, SOD ekstraseluler, dan Cu,Zn-SOD terdapat pada sitosol dan inti sel (Yon et al. 2008). Antioksidan superoksida dismutase bekerja dengan menginaktivasi ion superoksida (O2-) menjadi hidrogen peroksida (H2O2), kemudian dikatalisasi dengan cepat oleh enzim katalase menjadi oksigen (O2) dan air (H2O). Secara sederhana reaksi tersebut dapat dilihat sebagai berikut:
Gambar 4 Reaksi SOD terhadap ion superoksida (Menvielle-Bourg 2005) Antioksidan Cu,Zn-SOD merupakan salah satu SOD yang paling stabil. Hal ini disebabkan oleh ikatan non-kovalen dan ikatan disulfida yang tergabung dalam setiap sub unit. Enzim ini mempunyai peranan penting dalam pertahanan tubuh untuk menetralisir radikal bebas (Wresdiyati et al. 2010).
Pankreas
Pankreas adalah organ yang memiliki fungsi eksokrin dan endokrin. Sebagai fungsi eksokrin pankreas menghasilkan enzim pencernaan, seperti enzim amilase, peptidase, dan lipase. Fungsi endokrin pankreas berperan dalam menghasilkan hormon metabolik yang terdiri dari insulin, glukagon, dan somatostatin.
Pulau Langerhans berperan dalam fungsi endokrin, ditemukan oleh Langerhans pada tahun 1869. Pada tikus dewasa, pankreas berisi 1-2% pulau-pulau Langerhans dengan diameter antara 100-200 µm (Boorman dan Beth 1999). Pulau Langerhans memiliki beberapa tipe sel yang masing-masing memiliki kemampuan sekresi hormon yang berbeda-beda, yaitu (1) sel β yaitu sel yang menghasilkan hormon insulin, sel ini memenuhi 80% dari volume pulau Langerhans, (2) sel alpha yang menghasilkan hormon glukagon yang merupakan sel terbanyak kedua yang ditemukan di pulau Langerhans setelah sel β, (3) sel delta yang menghasilkan somatostatin, (4) sel F menghasilkan pancreatic polypeptide, (5) sel gamma.
SOD
GPx
Catalase
2Oˉ2 + 2H+ H2O2 + O2
7 Kerja utama hormon insulin adalah meningkatkan pengambilan glukosa darah ke dalam jaringan (Squires 2003). Hormon ini menjaga kestabilan glukosa darah agar tidak terjadi hiperglikemia sewaktu terjadi pemasukan glukosa. Tingginya kadar glukosa dalam darah akan merangsang sel β pankreas untuk mensekresikan insulin. Pada penderita DM tipe 1 ditemukan perubahan pada pankreas berupa atrofi pankreas, atrofi kelenjar eksokrin pankreas, dan atrofi sel-sel asinar di sekitar pulau Langerhans yang mengalami degenerasi. Pada penderita DM tipe 2 yang terjadi adalah ketidakseimbangan dari sekresi eksokrin pankreas dan gangguan kontrol glukosa darah.
Hewan Percobaan
Hewan percobaan merupakan hewan yang digunakan sebagai hewan model dalam mempelajari dan mengembangkan berbagai bidang ilmu dalam tahap penelitian atau pengamatan laboratorium. Penggunaan hewan percobaan banyak digunakan dalam bidang ilmu fisiologi, farmakologi, biokimia, histopatologi, dan bidang ilmu lainnya.
Pemilihan hewan percobaan mempertimbangkan berbagai faktor, terutama tujuan dari penelitian, salah satu contohnya penggunaan kelinci sebagai hewan yang cocok dan paling sering digunakan untuk penelitian mengenai hiperkolesterolemia. Seringnya kelinci digunakan dalam penelitian mengenai hiperkolesterolemia karena kelinci memiliki cadangan lemak tubuh yang banyak (Sirois 2005) dan peka terhadap kolesterol (Muliasari 2009).
Hewan percobaan yang umum digunakan dalam penelitian ilmiah adalah tikus. Tikus memiliki daya adaptasi yang baik, sehingga tikus didomestikasi sebagai hewan laboratorium. Tikus yang didomestikasi sebagai hewan percobaan dan hewan peliharaan adalah tikus putih (Rattus norvegicus). Tikus ini adalah hewan percobaan yang paling sering digunakan dalam penelitian karena memiliki karakter fungsional yang baik sebagai model bagi hewan mamalia. Tikus dapat digunakan sebagai hewan coba penyakit DM (Nugroho 2006).
8
dalam penelitian ini adalah spesies Rattus norvegicus (Albino Norway Rats)galur Sprague Dawley jantan.
Diabetes Mellitus
Diabetes mellitus (DM) merupakan kelompok penyakit metabolisme kompleks dengan karakteristik tingginya kadar gula dalam darah (hiperglikemia) yang terjadi karena penurunan sekresi insulin secara progresif, gangguan kerja insulin atau keduanya (Karunakaran dan Park 2013). Standar untuk menentukan diagnosa DM menurut American Diabetes Association adalah berdasarkan konsentrasi glukosa darah sesaat, glukosa darah puasa, dan glukosa darah normal. Seseorang dikatakan DM apabila konsentrasi glukosa darah sesaat ≥ 200 mg/dL atau 11.1 mmol/L, glukosa darah puasa ≥ 126 mg/dL atau 7 mmol/L, dan glukosa darah normal ≥ 200 mg/L atau 11.1 mmol/L (Rimbawan dan Siagian 2004; Rubin 2004). Menurut ADA (2004) ada empat tipe DM, yaitu DM tipe 1, DM tipe 2, DM jenis lain, dan DM saat hamil.
DM tipe 1 atau Insulin Dependent Diabetes Mellitus (IDDM) merupakan tipe diabetes yang tergantung terhadap insulin (Rubenstein et al. 2003). DM tipe ini ditandai dengan penurunan kadar insulin yang dihasilkan oleh sel β pankreas. DM tipe 1 dapat menyerang semua umur dan kejadiannya bersifat akut. Menurut Nelson dan Cox (2004) gejala klinik dari penderita DM tipe 1 adalah polidipsia, sering poliuria, dan glukosuria, sedangkan menurut Carver dan Martin (2009) penderita DM tipe 1 dapat mengalami polipagia, kehilangan berat badan, penglihatan menjadi kabur, serta kepenatan.
DM tipe 2 atau Noninsulin Dependent Diabetes Mellitus (NIDDM) merupakan tipe DM yang tidak tergantung insulin. Insulin diproduksi secara normal atau mendekati normal oleh sel-sel β pankreas namun sel tubuh tidak mampu menggunakannya akibat defisiensi atau gangguan pada reseptor insulin. DM tipe ini dapat terjadi seiring dengan pertambahan usia, kegemukan, keturunan, atau kurangnya olahraga. Resistensi insulin dapat terjadi akibat kegemukan, hal ini memiliki korelasi yang tinggi terhadap gangguan metabolik (Takada 2008). Penyebab dari DM tipe 2 adalah kerusakan fungsi membran sel akibat kehadiran asam lemak. Konsumsi asam lemak dalam jumlah sedikit dan dalam jangka waktu yang lama mengakibatkan resiko DM (Risérus 2006). Komplikasi yang sering muncul pada penderita DM tipe 2 adalah penyakit makrovaskular dan mikrovaskular (Carver dan Martin 2009).
9 DM tipe lain disebabkan oleh berbagai faktor. Faktor tersebut tidak terbatas pada kelainan genetik fungsi sel β, kelainan genetik kerja insulin, penyakit pada kelenjer eksokrin sperti adanya cystic fibrosis. Selain itu, juga dapat disebabkan oleh obat-obatan, atau induksi bahan kimia seperti pengobatan AIDS, atau dapat pula disebabkan setelah tranplantasi organ (Carver dan Martin 2009).
METODE
Waktu dan Tempat Penelitian
Penelitian dilaksanakan pada bulan Agustus 2012 sampai bulan Juni 2013. Penelitian ini dilakukan di Laboratorium Histologi Departemen Anatomi Fisiologi dan Farmakologi Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Alat dan Bahan
Alat yang digunakan terdiri atas gunting, pinset, alas bedah, botol sampel, tissue basket, inkubator, cup untuk embedding, tissue embedding console, refrigerator, mikrotom putar, pisau mikrotom, gelas objek, cover glass, waterbath, rak gelas objek, ultrasonic cleaner, pipet tetes, pipet mohr, mikropipet, gelas piala, gelas ukur, tabung Erlenmeyer, tabung Eppendorf, vortex¸ mikroskop, dako pen, dan kamera Nikon (D5000).
Bahan yang digunakan pada penelitian ini adalah pankreas tikus putih Sprague Dawley jantan dengan berat tubuh 150-200 gram per ekor, larutan fiksatif Bouin (asam pikrat jenuh, formalin, dan asam asetat glasial dengan perbandingan 15:5:1), alkohol 70%, 80%, 90%, 95%, dan alkohol absolut (alkohol 100%), xylol, parafin, akuades, entelan, pewarna hematoksilin, metanol, H2O2, air bebas ion (MilliQ), neophren in toluene 0.2%, phosphate buffered saline (PBS), serum normal, biocare’s bacground sniper, antibodi primer/monoklonal Cu,Zn-SOD (SIGMA S2147), trekkie universal link, trek avidin-HRP, larutan kromogen diamino benzidine (DAB).
Prosedur Penelitian
Rancangan Percobaan
10
Tikus dibuat menjadi diabetes dengan pemberian aloksan dengan dosis tunggal pada awal percobaan. Sebelum diberi aloksan, tikus dipuasakan selama satu malam. Dosis aloksan yang diberikan adalah 110 mg/kg bb dengan cara pemberian melalui intraperitonial (Wresdiyati et al. 2008). Sel β pankreas akan rusak oleh aloksan sehingga fungsi pankreas menjadi abnormal, dimana pankreas tidak mampu untuk menghasilkan insulin, sehingga timbul gangguan metabolik berupa diabetes mellitus. Tikus dikatakan diabetes mellitus, jika kadar kadar glukosa darah sesaat di atas 200 mg/dl. Kelompok KN tidak diberi aloksan melainkan diberi natrium fisiologis dengan dosis 1 mg/kg bb. Masa perlakuan terhadap hewan percobaan adalah selama 28 hari. Selama percobaan kelompok HDL, KST, dan ISL diberi perlakuan setiap harinya sesuai kelompok, sedangkan kelompok KN dan KP tidak diberi hidrolisat, konsentrat, dan isolat teripang pasir melainkan hanya diberi ransum standar.
Setelah masa percobaan berakhir, maka selanjutnya dilakukan pengambilan organ pankreas tikus percobaan. Sebelum melalukan pengambilan organ pankreas, dilakukan eutanasi pada tikus percobaan. Eutanasi dilakukan dengan cara dislocatio cervicalis. Setelah tikus mati, dilakukan pembedahan pada abdominal tikus dan pengambilan pankreas, kemudian dicuci dengan NaCl fisiologis. Setelah itu, dimasukkan ke dalam larutan fiksasi yaitu larutan Bouin.
Pembuatan Preparat Histologi Jaringan Pankreas
Proses pembuatan preparat histologi meliputi pengambilan sampel jaringan (sampling), fiksasi, dehidrasi, penjernihan (clearing), infiltrasi parafin, embedding, pemotongan (sectioning), dan pewarnaan (staining). Pada proses sampling, organ pankreas tikus diambil kemudian dicuci dengan larutan NaCl fisiologis 0.9%, kemudian dimasukkan ke dalam larutan fiksatif Bouin yang telah disiapkan sebelumnya. Fiksasi dilakukan selama 24 jam.
Setelah terfiksasi, organ pankreas dipindahkan ke dalam alkohol 70% yang berperan sebagai stopping point dimana proses fiksasi dihentikan. Selanjutnya sampel organ pankreas di-triming menjadi bagian kecil-kecil seperti dadu dan dimasukkan ke dalam tissue basket serta diberi label. Sampel jaringan yang telah berada dalam tissue basket kemudian didehidrasi dengan alkohol bertingkat mulai dari alkohol 80%, 90%, dan 95% masing-masing selama 24 jam. Selanjutnya dilakukan dehidrasi dalam alkohol absolut (100%) I, II, III masing-masing selama 1 jam. Dehidrasi bertujuan untuk mengeluarkan air dari jaringan pankreas.
Setelah didehidrasi, kemudian dilakukan penjernihan dengan cara memindahkan tissue basket ke dalam xylol I, II, dan III masing-masing selama 1 jam. Tahapan ini bertujuan untuk menghilangkan sisa larutan alkohol dari proses dehidrasi. Perendaman pada xylolIII dilakukan 30 menit pada suhu kamar dan 30 menit pada suhu 60 oC. Setelah itu,dilanjutkan dengan infiltrasi dalam parafin cair I, II, III pada suhu 60 °C selama masing-masing 1 jam.
11 lebih 3 µm. Sebelum pemotongan dengan ketebalan kurang lebih 3 µm, terlebih dahulu dilakukan trimming dengan ketebalan 5-10 µm.
Pada tahapan pemotongan, hasil potongan yang diperoleh kemudian direndam dalam akuades. Sayatan yang bagus dimasukkan ke dalam akuades yang dipanaskan pada suhu 37 oC menggunakan waterbath. Setelah kurang lebih 2 menit di dalam waterbath kemudian diambil menggunakan gelas objek dan diberi label. Gelas objek untuk pewarnaan imunohistokimia dilengkapi dengan agen perekat neophren in toluene 0.2% yang berfungsi untuk merekatkan jaringan. Sediaan yang telah jadi, sebelum masuk ketahap pewarnaan diinkubasi terlebih dahulu dalam inkubator selama 24 jam.
Pewarnaan Imunohistokimia
Pewarnaan ini dilakukan untuk mengamati antioksidan pada jaringan pankreas tikus percobaan. Tahapan awal pewarnaan imunohistokimia adalah deparafinisasi dan rehidrasi. Proses deparafinisasi dilakukan dengan merendam sediaan yang telah ditempelkan pada gelas objek menggunakan basket slide ke dalam xylol III, II, I secara berurutan masing-masing selama 3 menit. Setelah itu, dilanjutkan denga proses rehidrasi, yaitu perendaman preparat ke dalam larutan alkohol bertingkat (alkohol absolut III, II, I, alkohol 95%, 90%, 80%, sampai alkohol 70%) masing-masing selama 3 menit. Setelah itu preparat direndam dengan MilliQ selama 10 menit sebagai stoppingpoint. Setelah deparafinisasi dan rehidrasi dilakukan, tahap selanjutnya adalah penghilangan enzim peroksidase endogen menggunakan substrat metanol sebanyak 30 ml yang ditambah dengan H2O2 sebanyak 0.3 ml (disiapkan sesaat sebelum gelas objek dimasukkan) kemudian preparat dicelupkan ke dalam larutan selama 15 menit dalam keadaan gelap. Kemudian dilakukan pencucian menggunakan MilliQ dan PBS masing-masing sebanyak 2 kali selama 5 menit. Permukaan sediaan disekitar jaringan pankreas dikeringkan menggunakan tisu, tetapi jaringan jangan sampai kering.
Sediaan preparat disusun berjejer dalam kotak preparat lembab, kemudian masing-masing preparat ditetesi dengan normal serum sebanyak 50-60 µl. Tujuan penetesan normal serum adalah untuk memblokir Ag nonspesifik yang terdapat di dalam sel agar tidak mengacaukan reaksi. Kotak preparat ditutup rapat dan diinkubasi di dalam inkubator suhu 37 °C selama 30-60 menit. Selanjutnya preparat dicuci menggunakan PBS sebanyak 3 kali masing-masing selama 5 menit dan dikeringkan. Jaringan kemudian dilingkari menggunakan dako pen, kemudian jaringan ditetesi dengan biocare`s background sniper yang berfungsi sebagai protein blocker dan diinkubasi kembali di dalam inkubator suhu 37 °C selama 15 menit.
12
Sediaan preparat selanjutnya ditetesi dengan larutan kromogen DAB dalam kondisi gelap dan ditutup dengan kain selama 3-5 menit pada suhu ruang. Tahap selanjutnya preparat dicuci dengan MilliQ dan dilakukan pengecekan dengan mikroskop cahaya. Adanya warna cokelat pada sediaan menunjukkan hasil positif. Proses selanjutnya adalah counterstain menggunakan pewarna hematoksilin untuk mewarnai sel yang tidak menghasilkan antioksidan Cu,Zn-SOD dan dilanjutkan dengan dehidrasi pada alkohol bertingkat 70%, 80%, 90%, 95%, absolut I, dan absolut II masing-masing beberapa detik serta absolut III selama 1 menit, dilanjutkan penjernihandengan xylol I dan II selama beberapa detik, serta xylol III selama 1 menit. Proses pewarnaan diakhiri dengan mounting (penutupan sediaan dengan cover glass) menggunakan entelan. Preparat yang telah selesai diwarnai kemudian diamati di bawah mikroskop cahaya dan didokumentasikan dengan kamera Nikon (D5000)
Prosedur Analisis Data
Hasil pewarnaan imunohistokimia terhadap antioksidan cupper,zinc-superoxide dismutase (Cu,Zn-SOD) diamati menggunakan mikroskop cahaya. Pengamatan dilakukan secara kualitatif dan dianalisa secara deskriptif. Distribusi dan frekuensi kandungan antioksidan Cu,Zn-SOD pada jaringan kelompok kontrol dibandingkan dengan kelompok perlakuan. Warna cokelat pada inti sel dan sitoplasma menunjukkan keberadaan antioksidan Cu,Zn-SOD, sedangkan sel-sel yang bewarna biru menunjukkan tidak terdapatnya antioksidan tersebut.
Pengamatan dilakukan terhadap keberadaan dan distribusi Cu,Zn-SOD pada sel asinar dan pulau Langerhans pankreas. Hasil pengamatan terhadap kandungan antioksidan Cu,Zn-SOD disajikan secara kualitatif mulai dari + sampai dengan +++++. Semakin banyak tanda + maka semakin banyak kandungan enzim tersebut. Tanda + menunjukkan kandungan paling sedikit, sedangkan tanda +++++ menunjukkan kandungan paling banyak.
HASIL DAN PEMBAHASAN
Enzim antioksidan Cu,Zn-SOD adalah salah satu enzim yang berperan sebagai scavengers radikal bebas. Scavengers radikal bebas adalah suatu molekul yang dapat bereaksi dengan radikal bebas atau menetralkan radikal bebas dalam tubuh. Selain enzim Cu,Zn-SOD, yang dapat berperan sebagai scavengers radikal bebas adalah glutation peroksidase (GPx) dan vitamin C (Girish et al 2011). Enzim antioksidan Cu,Zn-SOD terdapat di seluruh sel atau jaringan tubuh, termasuk pankreas. Antioksidan tersebut berfungsi untuk menetralkan radikal bebas yang terbentuk akibat paparan lingkungan dan hasil metabolisme oksigen secara alami.
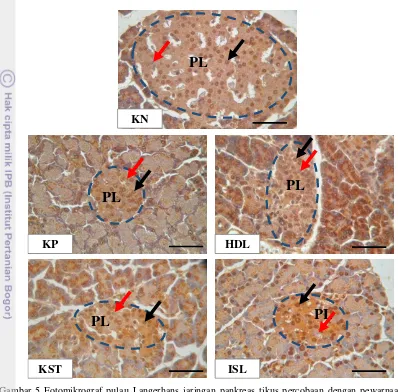
13 antioksidan Cu,Zn-SOD pada inti sel dan sitoplasma sel-sel pulau Langerhans maupun sel-sel asinar jaringan pankreas (Gambar 5 dan 6).
PL
PL
PL
PL
PL
KN
KP HDL
KST ISL
14
Pengamatan terhadap kandungan antioksidan Cu,Zn-SOD pada sel-sel pulau Langerhans dan sel-sel asinar jaringan pankreas tikus percobaan dilakukan dengan membandingkan distribusi serta intensitas warna cokelat pada inti sel dan sitoplasmanya. Distribusi dan frekuensi antioksidan Cu,Zn-SOD pada pulau Langerhans (PL) dan sel-sel asinar jaringan pankreas tikus percobaan dapat dilihat pada Tabel 1.
KN
KP HDL
KST ISL
15
Secara kualitatif, kandungan antioksidan Cu,Zn-SOD pada PL maupun sel-sel asinar jaringan pankreas kelompok kontrol negatif (KN) terlihat paling tinggi dibandingkan kelompok lainnya. Hal ini dikarenakan kelompok KN tidak diinjeksi aloksan sehingga tidak mengalami DM. Menurut Wresdiyati et al. (2008) tikus yang tidak diinjeksi aloksan memiliki kandungan antioksidan Cu,Zn-SOD lebih tinggi dibandingkan tikus DM.
Kandungan antioksidan Cu,Zn-SOD, baik pada PL maupun pada sel-sel asinar pankreas kelompok kontrol positif (KP) terlihat paling rendah dibandingkan dengan kelompok lainnya. Rendahnya kandungan antioksidan Cu,Zn-SOD pada kelompok KP dikarenakan kelompok KP diinjeksi aloksan sehingga mengalami kondisi DM. Wresdiyati et al. (2008) melaporkan kandungan antioksidan Cu,Zn-SOD pada jaringan pankreas tikus DM juga rendah. Demikian juga halnya pada jaringan hati dan ginjal tikus DM (Wresdiyati et al. 2010).
Tikus yang diinjeksi dengan aloksanakan mengalami kerusakan pada sel-sel β pulau Langerhans pankreas. Hal ini berdampak terhadap penurunan produksi insulin oleh sel β pulau Langerhans pankreas. Penurunan produksi insulin akan berdampak pada peningkatan kadar glukosa darah (hiperglikemia) yang kemudian menginduksi terjadinya kondisi DM pada tikus percobaan.
Kondisi hiperglikemia pada penderita DM terjadi karena pengangkutan glukosa ke dalam sel berkurang akibat gangguan produksi insulin, resistensi insulin, atau keduanya sehingga kadar glukosa di dalam darah menjadi tinggi. Rendahnya kadar glukosa yang masuk ke dalam sel akan membuat sel kekurangan energi, sehingga sel akan melakukan proses glikogenolisis (pemecahan glikogen) dan glukoneogenesis (pembentukan glukosa dari bahan selain karbohidrat), pemecahan asam lemak, dan katabolisme protein untuk memenuhi kebutuhan energinya (Wresdiyati et al. 2003). Semua proses ini menghasilkan produk sampingan berupa radikal bebas yang toksik bagi sel. Menurut Niedowicz dan Daleke (2005), oxidative phosphorylation, nicotinamide adenine dinucleotide phosphate oxidase (NADPH), xanthine oxidase, pelepasan lipoxygenase, monooksigenase sitokrom P450, dan autoksidasi glukosa akan memproduksi reactive oxygen species (ROS) atau radikal bebas.
Radikal bebas yang banyak dihasilkan pada kondisi diabetes akan dinetralkan oleh antioksidan tubuh antara lain Cu,Zn-SOD, yang berperan sebagai scavengers radikal bebas. Antioksidan Cu,Zn-SOD bekerja dengan menginaktivasi ion
Kelompok Kandungan Cu,Zn-SOD kandungan antioksidan Cu,Zn-SOD. Semakin banyak tanda + maka semakin banyak kandungan enzim tersebut. Tanda + menunjukkan kandungan paling sedikit, sedangkan tanda +++++ menunjukkan kandungan paling banyak.
16
superoksida (O2-) menjadi hydrogen peroksida (H2O2) yang kemudian dikatalisasi dengan cepat oleh enzim katalase dan glutation peroksidase (GPx) menjadi oksigen (O2) dan air (H2O) (Menvielle-Bourg 2005). Namun, akibat meningkatnya produksi radikal bebas pada tikus DM akan menguras pertahanan antioksidan, dimana antioksidan banyak digunakan untuk menetralkan radikal bebas. Hal ini menimbulkan stres oksidatif yang dapat menyebabkan kerusakan pada jaringan pankreas tikus. Stres oksidatif dapat menyebabkan kerusakan pada sel asinar, disfungsi sel β pulau Langerhans, dan menyebabkan degenerasi serta kematian pada sel (Karunakaran dan Park 2013). Oleh karena itu, kandungan antioksidan Cu,Zn-SOD pada kelompok KP pada penelitian ini sangat rendah akibat dari tingginya produksi radikal bebas.
Kandungan antioksidan Cu,Zn-SOD pada kelompok hidrolisat protein teripang pasir (HDL), konsentrat protein teripang pasir (KST), dan isolat protein teripang pasir (ISL) pada PL dan sel-sel asinar jaringan pankreas lebih tinggi dibandingkan kelompok KP. Hal ini menunjukkan pemberian HDL, KST, dan ISL teripang pasir (Holothuria scabra J) mampu mempertahankan kandungan antioksidan Cu,Zn-SOD pada tikus dalam kondisi DM. Kandungan antioksidan Cu,Zn-SOD kelompok HDL paling tinggi dari kelompok KST dan ISL. Hal ini menunjukkan hidrolisat teripang pasir (Holothuria scabra J) memiliki kemampuan paling baik dalam mempertahankan antioksidan Cu,Zn-SOD pada jaringan pankreas tikus DM.
Dari hasil penelitian Karnila (2012), hidrolisat protein teripang pasir (Holothuria scabra J) memiliki daya hipoglikemik yang paling baik dibandingkan dengan konsentrat dan isolat protein teripang pasir (Holothuria scabra J). Selain itu, hidrolisat teripang pasir (Holothuria scabra J) juga mengandung protein dan asam amino bebas yang paling tinggi dibandingkan dengan konsentrat dan isolat protein teripang pasir. Kandungan protein pada hidrolisat, konsentrat, dan isolat teripang pasir berturut-turut adalah adalah 89.57, 73.07, dan 82.17 %bk, serta kandungan kandungan asam amino bebas dari hidrolisat, konsentrat, dan isolat protein teripang pasir secara berturut-turut adalah 2.88, 0.22, dan 0.25 %bk.
Asam amino bebas mampu meregulasi sekresi insulin oleh sel β pankreas, meningkatkan produksi ATP melalui siklus asam trikarboksilat (TCA) (Newsholme et al. 2006; Liu et al. 2008). Melalui peningkatan sekresi insulin dan peningkatan energi mampu meningkatkan intake glukosa ke dalam sel sehingga hiperglikemia dan peningkatan radikal bebas tidak terjadi. Oleh karena itu, pada kelompok tikus diabetes mellitus yang diberi hidrolisat teripang pasir (Holothuria scabra J) mampu mempertahankan kandungan antioksidan Cu,Zn-SOD pada jaringan pankreas.
SIMPULAN DAN SARAN
Simpulan
17 mengandung asam amino paling tinggi, memiliki efektifitas paling baik dalam mempertahankan kandungan antioksidan Cu,Zn-SOD pada jaringan pankreas tikus DM.
Saran
Perlu dilanjutkan penelitian tentang khasiat teripang pasir sebagai obat diabetes pada manusia.
DAFTAR PUSTAKA
[ADA] American Diabetes Association. 2004. Diagnosis and Clasification of Diabetes mellitus. Diabetes Care. 27 (1):S5-S10.
Amoo IA, Adebayo OT, Oyeleye AO.2006. Chemical Evaluation of Winged Beans (Psophocarous tetragonolabus), Pitanga Cherries (Eugenia uniflora) and
Orchid Fruit (Orchid fruit myristica). African J Food Agr Nutr Development. 6(2):1-12
Arlyza IS. 2009. Teripang dan bahan aktifnya. Oseana XXXIV (1): ISSN 026-1877. Artunay Ö, Uslu E, Ünal M, Aydin S, Devranoğlu K, Bahçeçioğlu H. 2009. Role
of anti-oxidant system and lipid peroxidation in the development of age-related and diabeti cataract. Glo-Kat. 4:221-225.
Boorman GA, Beth WG. 1999. Pathology of the Mouse. USA: Cache River Press. pp191-193.
Carver C, Martin A. 2009. Diabetes mellitus overview. Educating Your Patien with Diabetes. New York (US): Human Press
[Depkes] Departemen Kesehatan RI. 2008. Pedoman Pengendalian Diabetes MellitusdanPenyakitMetabolik. Jakarta (ID): Depkes RI.
Dewi KH, Devi S. Laili S, Masturah M, Hajiral M. 2010. Ekstrak teripang pasir (Holothuria scabra) sebagai sumber testosteron pada berbagai kecepatan dan lama pengadukan. Di dalam Prosiding Seminar Nasional Teknik Kimia “Kejuangan”. Pengembangan Teknologi Kimia untuk Pengolahan Sumber Daya Alam Indonesia; 2010 Januari 26; Yogyakarta, Indonesia. Yogyakarta (ID): ISSN 1693-4393.
Dewi KH. 2008. Kajian ekstraksi steroid teripang pasir (Holothuria scabra J) sebagai sumber testosteron alami [disertasi]. Bogor (ID): Institut Pertanian Bogor.
Gerardi MH, Zimmerman MC. 2005. Wastewater Phatogens. Canada (US): John Wiley & Sons.Inc.Hoboken
Girish BN, Rajesh G, Vaidyanathan K, Balakrishnan V. 2011. Assessment of oxidative status in chronic pancreatitis and its relation with zinc status. Indian J Gastroenterol. 30(2): 84-88.doi:10.1007/s12664-011-0094-8. Holt RIG, Neil AH. 2007. Essential Endocrinology and Diabetes. Ed ke-5. USA
(US): Blackwell Publishing
18
Karunakaran U, Park KG. 2013. A systematic review of oxidative stress and safety of antioxidants in diabetes: focus on islets and their defense. Dmj. 37(2):106-112.
Liu Z, Jeppesen PB, Gregersen S, Chen X, Hermansen K. 2008. Dose- and glucose-dependent effects of amino acids on insulin secretion from isolated mouse islets and clonal INS-1E beta-cells. The rev diabet stud. 5(4):232-244. Martoyo J, Aji N, Winanto T. 2004. Budidaya Teripang. Jakarta (ID): Penebar
Swadaya.
Menvielle-Bourg FJ. 2005. Superoxide Dismutase (SOD), a powerful antioxidant, is now available orally. Phytothérapie. 3: 1-4.doi:10.1007/s10298-005. Muliasari A. 2009. Konsentrasi lipid peroksida hati kelinci hyperlipidemia yang
diberi senyawa hipolipidemik [skripsi]. Bogor (ID): Institut Pertanian Bogor. Nelson DL, Cox MM. 2004. Lehninger Principles Biochemistry Ed ke-4. USA
(US): Wisconsin Madison Publishing.
Newsholme P, Brennan L, Bender K. 2006. Amino acid metabolism, β-cell function, and diabetes. Diabetes. 55(2):39-47.
Niedowicz DM, Daleke DL. 2005. The role of oxidative stress in diabetic complications. Cell Biochemistry and Biophysics. 43:289-330
Nugorho AE. 2006. Hewan percobaan diabetes mellitus: patologi dan mekanisme aksi diabetogenik. Biodiversitas. 7(4):378-382.
Rahayu L, Damayanti R, Wikanta T. 2006. Gambaran histopatologipankreas tikus hiperglikemia setelah mengkonsumsi k-karagenan dan i-karagenan. J Ilmu Kefarmasian Indonesia. 4(2):96-101.
Ramos-Vara JA. 2005. Technical aspects of immunohistochemistry. Vet Pathol. 42:405-426.doi:10.1354/vp.42-4-405
Rimbawan, Siagian A. 2004. Indeks Glikemik Pangan. Jakarta: Penebar Swadaya. Risérus U. 2006. Trans fatty acids, insulin sensitivity and type 2 diabetes.
Scandinavian J of Food and Nutrition. 50(4):161- 165.
Rubenstein D, Wayne D, Bradley J. 2003. Lecture Notes On Clinical Medicine Ed ke-6. UK (GB) : Blackweel publishing.
Rubin AL. 2004. Diabetes for Dummies. Ed ke-2. Indiana (US): Willey.
Sendih S, Gunawan. 2007. Keajaiban Teripang Penyembuh Mujarab dari Laut. Jakarta (ID). AgroMedia Pustaka.
Sirois M. 2005. Laboratory Animal Medicine: Principle and Procedures. USA (US): Elsevier Inc.
Squires JG. 2003. Applied Animal Endocrinology. UK (GB) : CABI Publishing. Takada J. 2008. Metabolic recovery of adipose tissue is associated with
improvement in insulin resistance in a model of experimental diabetes. J of Endocrinology. 198:51-60
Valko M, Leibfritz D, Moncol J, Cronin MTD, Mazur M, Telser J. 2007. Free radicals and antioxidants in normal physiological functions and human disease. Int J Biochem Cell Biol. 39:44-84.
[WHO] World Health Organization. 2010. Diabetes. NMH Fact Sheet [Internet]. [diunduh 5 Juli 2013].Tersedia pada: http://www.who.int/nmh/publications/ fact_sheet_diabetes_en.pdf.
19 Wresdiyati T, Astawan M, Kesenja R, Lestari PA. 2008. Pengaruh pemberian tepung buah pare (Momordica charantia L) pada sel β dan SOD pankreas tikus diabetes mellitus. J Bahan Alam. 6(5):193-200.
Wresdiyati T, Sinulingga TS, Zulfanedi Y. 2010. Effect of Mamordica charantia L. powder on antioxidant superoxide dismutase in liver and kidneyof diabetic rats. Hayati J Bio. 17(2):53-57.
20
LAMPIRAN
Lampiran 1 Proses pengambilan organ dan preparasi jaringan
II.Alkohol 70%, 80%, 90%, & 95% @ 24 jam
II.Xylol I, II @ 1 jam Tikus dieutanasi Pembukaan
rongga abdomen
Pengambilan organ (pankreas)
Celupkan pada NaCl fisiologis Fiksasi dalam larutan
Bouin @ 24 jam
I. Alkohol absolut I, II,
III @ 1 jam Dehidrasi
Penjernihan (clearing) I. Xylol III
30’ suhu ruang
30’ suhu
60o
Infiltrasi paraffin I, II,
III @1jam
Embedding di dalam parafin
21 Lampiran 2 Tahapan pewarnaan imunohistokimia
Deparafinisasi Xylol III, II, & I (@ 3menit)
Rehidrasi alkohol 95%, 90%, 80%, & Alkohol absolut III, II, I, 70% (@ 3 menit)
Perendaman di dalam MilliQ 10
menit
Stoping point
Dicelupkan ke dalam 30 ml methanol + 0.3 ml H2O2 (15 menit dalam
kondisi gelap)
Pencucian preparat
MilliQ 2x (@ 5 menit)
PBS 2x (@ 5 menit)
Inkubasi dengan 50-60 μl normal serum (30-60 menit
pada suhu 37 oC)
Preparat dicuci dengan PBS 3x (@ 5 menit)
Inkubasi dengan 50-60 μl biocare’s background sniper (15 menit suhu 37 oC)
22
Inkubasi dengan 50-60 μl antibodi primer Cu,Zn-SOD (48 jam, suhu
4 oC)
Preparat dicuci dengan PBS 3x (@ 5 menit)
Inkubasi dengan 50-60 μl trekkie universal link (20 menit,
suhu 37 oC)
Inkubasi dengan 50-60 μl trekAvidin-HRP (10 menit, suhu 37
oC)
Ditetesi dengan larutan kromogen DAB (3-5 menit
dalam kondisi gelap) Preparat dicuci dengan PBS 3x (@
5 menit)
Preparat dicuci dengan PBS 3x (@ 5 menit)
Cek di bawah mikroskop
Celup ke dalam miliQ (stoping point)
Counterstain dengan pewarna hematoxilin
Dehidrasi
Alkohol 70%, 80%, 90%, 95%, alkohol absolut I, II (@ 3-5 ketukan) & alkohol absolut
III (1 menit)
Clearing Xylol I, II (@ 3-5 ketukan) & xylol III (1 menit)
23
RIWAYAT HIDUP
Penulis dilahirkan di Solok pada tanggal 4 April 1991 dari Bapak Jaskar dan Ibu Agusmitaria. Penulis merupakan putri pertama dari tiga bersaudara. Penulis lulus dari SMA Negeri 1 Solok pada tahun 2009 dan diterima di Institut Pertanian Bogor pada tahun yang sama melalui jalur Undangan Seleksi Masuk IPB (USMI) di Fakultas Kedokteran Hewan.