KANDUNGAN TEMBAGA (Cu) PADA AIR LAUT, SEDIMEN
DAN KERANG KAPAK (Pinna sp) DI WILAYAH JELENGAH,
SUMBAWA BARAT
SUHAIDI
SKRIPSI
DEPARTEMEN ILMU DAN TEKNOLOGI KELAUTAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
Dengan ini saya menyatakan bahwa Skripsi yang berjudul:
KANDUNGAN TEMBAGA (Cu) PADA AIR LAUT, SEDIMEN
DAN KERANG KAPAK (Pinna sp) DI WILAYAH JELENGAH,
SUMBAWA BARAT
adalah benar merupakan hasil karya sendiri dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi manapun. Semua sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka dibagian akhir Skripsi ini.
Bogor, Maret 2013
RINGKASAN
SUHAIDI. Kandungan Tembaga (Cu) pada Air Laut, Sedimen dan Kerang Kapak (Pinna sp) di Wilayah Jelengah, Sumbawa Barat. Dibimbing oleh Tri Prartono.
Logam Cu di lingkungan perairan laut dangkal bervariasi akibat dari berbagai proses seperti pengenceran, adsorpsi oleh partikel, terakumulasi dalam biota dan mengendap di sedimen. Dalam lingkungan perairan ada tiga media yang dapat dipakai sebagai indikator pencemaran logam berat, yaitu air, sedimen dan organisme hidup. Penelitian ini bertujuan menentukan kadar Cu di air, sedimen, dan kerang kapak (Pinna sp) yang hidup di wilayah perairan Jelengah, Sumbawa Barat.
Penelitian dilakukan pada bulan Januari-April 2012 yang terdiri dari kegiatan lapang dan analisis logam berat di laboratorium. Kegiatan lapang mencakup pengukuran kualitas air, pengambilan sampel air dan sedimen untuk analisis Cu dilakukan pada 9 stasiun yang menyebar pada arah barat, utara dan selatan dari timur perairan Jelengah serta pengambilan sampel kerang kapak. Sampel air, sedimen dan kerang tersebut di ekstrak kemudian dianalisis menggunakan Atomic Absorption Spectrometry (AAS) untuk mengukur konsentrasi Cu di air, sedimen dan biota, sedangkan fraksi sedimen menggunakan metode pengayakan dan metode pipet untuk mengukur komposisi fraksi lanau dan liat.
© Hak cipta milik Suhaidi, tahun 2013
Hak cipta dilindungi
KANDUNGAN TEMBAGA (Cu) PADA AIR LAUT, SEDIMEN
DAN KERANG KAPAK (Pinna sp) DI WILAYAH JELENGAH,
SUMBAWA BARAT
SUHAIDI
SKRIPSI
sebagai salah satu syarat untuk memperoleh gelar Sarjana Ilmu Kelautan pada
Departemen Ilmu dan Teknologi Kelautan
DEPARTEMEN ILMU DAN TEKNOLOGI KELAUTAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
Nama : Suhaidi
NRP : C54080016
Departemen : Ilmu dan Teknologi Kelautan
Menyetujui,
Dosen Pembimbing
Dr. Ir. Tri Prartono, M.Sc NIP 19600727 198603 1 006
Mengetahui,
Ketua Departemen Ilmu dan Teknologi Kelautan
Dr. Ir. I Wayan Nurjaya, M.Sc NIP. 19640801 198903 1 001
KATA PENGANTAR
Alhamdulillahi rabbilalamin, puji dan syukur hanyalah patut disanjungkan
kehadirat Allah SWT yang telah memberikan karunia, rahmat dan hidayah-Nya
sehingga penulis dapat menyelesaikan skripsi ini. Skripsi yang berjudul
Kandungan Tembaga (Cu) pada Air Laut, Sedimen dan Kerang Kapak
(Pinna sp) di Wilayah Jelengah, Sumbawa Barat sebagai salah satu syarat
untuk mendapatkan gelar Sarjana Ilmu dan Teknologi Kelautan pada Departemen
Ilmu dan Teknologi Kelautan.
Pada kesempatan ini penulis mengucapkan terima kasih dan penghargaan
yang sebesar-besarnya kepada:
1. Bapak dan Kakakku Ali Helmi, serta semua keluarga besar penulis yang tak
henti- hentinya memberikan motivasi, semangat, dan doa kepada penulis
selama menempuh pendidikan di Institut Pertanian Bogor.
2. Bapak Dr. Ir. Tri Prartono, M.Sc selaku dosen pembimbing yang telah banyak
memberikan arahan dan bimbingan selama proses penyusunan skripsi sehingga
skripsi ini dapat tersusun dengan baik.
3. Bapak Dr. Ir. Sigid Hariyadi, M.Sc dan Dr. Ir. Henry M. Manik, M.T sebagai
Penguji atas pemberian ilmu dan bantuannya selama penulis menyelesaikan
studi di Institut Pertanian Bogor.
3. Bapak Muhamad Salamuddin Yusuf, S.Si., M.Pd selaku pembimbing lapang
yang telah banyak memberikan arahan dan bimbingan selama proses
pengambilan sampel di lapang.
4. Bapak Windy Prayogo, S.Pi dan teman-teman di Departemen Lingkungan PT.
5. Yayasan Karya Salemba Empat dan Eka Tjipta Foundation yang telah
memberikan beasiswa selama studi di Intitut Pertanian Bogor.
6. Hidayanto Akbar, Saipul Rahman, Saifur Rohman, Achmad Hambali Bani
Nuh, Verlin Ayu Ibrani, Susilo dan teman-teman lainnya yang tidak bisa
disebutkan satu per satu atas bantuan dan motivasinya.
Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan sehingga
penulis sangat mengharapkan kritik dan saran demi kesempurnaan skripsi ini.
Semoga skripsi ini dapat bermanfaat bagi semua pihak.
Bogor, Maret 2013
x
5.1. Kesimpulan ... 30
5.2. Saran ... 30
DAFTAR PUSTAKA ... 31
LAMPIRAN ... 35
xi
DAFTAR TABEL
Halaman
1. Nilai toksisitas tembaga terhadap beberapa jenis organisme laut ... 9
2. Konsentrasi Cu (mg/kg) pada sedimen di beberapa perairan di Indonesia . 10
3. Klasifikasi sedimen berdasarkan Wentworth Scale ... 12
xii
Halaman
1. Anatomi kerang kapak (Pinna sp) ... 7
2. Peta stasiun penelitian di perairan Jelengah ... 13
3. Kandungan Cu pada contoh air laut ... 21
4. Kandungan Cu pada sedimen ... 21
5. Komposisi fraksi sedimen (%) di lokasi pengamatan perairan Jelengah ... 25
6. Sebaran spasial suhu (°C) di perairan Jelengah saat pengamatan ... 26
7. Sebaran spasial salinitas (‰) di perairan Jelengah saat pengamatan ... 27
8. Sebaran spasial derajat keasaman (pH) di perairan Jelengah saat pengamatan .. 28
xiii
DAFTAR LAMPIRAN
Halaman
1.
PENDAHULUAN
1.1. Latar Belakang
Sampai saat ini produksi perikanan laut di Indonesia termasuk kerang masih
didominasi oleh hasil tangkapan alam, baik sebagai komoditas pasar lokal
maupun ekspor. Mayoritas hasil tangkapan kerang dari alam masih digunakan
untuk konsumsi sendiri, misalnya kerang pasir (Donax feba), siput mata bulan
(Turbo chrysostomus), dan siput berukuran kecil lainnya. Hasil tangkapan alam
yang sebagian dijual untuk konsumsi lokal oleh masyarakat Sumbawa adalah
kerang darah (Anadara spp), kerang hijau (Perna viridis) dan kerang kapak
(Pinna sp). Seiring dengan permintaan pasar, kerang kapak hanya dijadikan
sumber komoditi kedua jika tidak terdapat kerang–kerang lainnya dan bukan
merupakan produk unggulan dibandingkan dengan kerang-kerang lainnya. Selain
sebagai salah satu sumber daya perikanan penting, kerang ini termasuk kerang
yang dominan terdapat pada daerah penelitian.
Kerang kapak (Pinna sp) merupakan organisme yang bersifat filter feeder
non selektif. Pinna sp dapat digunakan sebagai bioindikator pencemaran perairan
karena biota ini bersifat menetap, sifat bioakumulasi terhadap logam berat,
sebagian masa hidupnya menancap di subtrak perairan, penyebarannya luas dan
masih mampu hidup pada daerah tercemar tersebut.
Menurut Smith et al. (1980) pada prinsipnya penyebaran logam Cu dalam
ekosistem perairan dicirikan oleh adanya keberadaan kandungan logam Cu dalam
wilayah perairan tertentu, karena pengaruh kondisi perairan tersebut. Konsentrasi
2
percampuran berbagai bentuk senyawa, yang membuat kandungan toksik logam
berat terhadap organisme juga berbeda. Menurut Palar (2004), hal tersebut
ditentukan oleh faktor-faktor sebagai berikut : senyawa logam berat yang terdapat
di dalam air, adanya unsur logam berat lain, faktor lingkungan yang
mempengaruhi fisiologis organisme seperti DO, suhu, cahaya, umur atau stadia,
makanan, jenis kelamin dan adaptasi terhadap terhadap logam berat.
Penelitian logam berat di air, sedimen dan kerang telah banyak dilakukan
diantaranya Kandungan Logam Berat Hg, Pb dan Cr pada Air, Sedimen dan
Kerang Hijau (Perna viridis) di Perairan Kamal Muara Teluk Jakarta (Apriadi,
2004), Analisis Kadar Logam Berat Pb, Cd, Cu dan Zn pada Air Laut, Sedimen
dan Lokan (Geloina coaxans) di Perairan Pesisir Dumai, Provinsi Riau
(Anggraini, 2006), dan Konsentrasi Kadmium (Cd) dan Tembaga (Cu) dalam Air,
Seston, Kerang dan Fraksinasinya dalam Sedimen di Perairan Delta Berau
Kalimantan Timur (Afriansyah, 2008). Namun, pada perairan Jelengah Sumbawa
Barat penelitian mengenai logam berat masih sedikit sehingga diperlukan
informasi terbaru mengenai logam berat pada perairan tersebut. Disamping itu,
perairan Jelengah terletak di Selat Alas yang dipengaruhi oleh Samudera
Indonesia. Proses internal dinamika oseanografi yang terjadi di perairan dapat
mempengaruhi penyebaran, pengenceran, dan pelarutan yang secara tidak
langsung aktivitas pembuangan limbah industri yang terjadi di Selat Alas dan
1.2. Tujuan
Penelitian ini bertujuan menentukan tingkat kandungan tembaga (Cu) pada
air, sedimen dan Pinna sp yang hidup di wilayah perairan Jelengah, Sumbawa
4
2.
TINJAUAN PUSTAKA
2.1. Logam Berat
Secara sifat, logam berat dapat dibagi dalam dua jenis. Jenis pertama adalah
logam berat esensial, di mana keberadaannya dalam jumlah tertentu sangat
dibutuhkan oleh organisme hidup, namun dalam jumlah yang berlebihan dapat
menimbulkan efek racun. Contoh logam berat ini diantaranya Zn, Cu, Fe, Co, dan
Mn. Jenis kedua adalah logam berat tidak esensial atau beracun, di mana
keberadaanya dalam tubuh masih belum diketahui manfaatnya atau bahkan dapat
bersifat racun, seperti Hg, Cd, Pb, dan Cr (Palar, 2004)
Berbeda dengan logam biasa, logam berat adalah istilah yang digunakan
secara umum merupakan kelompok logam yang memilki densitas lebih besar dari
5 g/cm3 (Hutagalung, 1991). Dalam perairan, logam berat dapat ditemukan dalam
bentuk terlarut dan tersuspensi (terikat dengan zat padat tersuspensi). Kedua
bentuk terlarut dan tersuspensi ini dapat dipisahkan melalui penyaringan dengan
menggunakan kertas saring yang berukuran pori 0,45 µm.
Logam berat biasanya erat kaitannya dengan masalah pencemaran dan
toksisitas. Pencemaran yang dapat menghancurkan tatanan lingkungan hidup,
biasanya berasal dari limbah–limbah yang sangat berbahaya dalam arti memiliki
daya racun (toksisitas) yang tinggi. Limbah industri merupakan salah satu sumber
pencemaran logam berat yang potensial bagi perairan. Pembuangan limbah
industri secara terus menerus tidak hanya mencemari lingkungan perairan tetapi
menyababkan terkumpulnya logam berat dalam sedimen dan biota perairan.
pencemaran logam berat, yaitu air, sedimen dan organisme hidup (Hutagalung,
1991).
2.1.1. Tembaga (Cu) di lingkungan laut
Tembaga bersumber dari peristiwa pengikisan (erosi) dari batuan mineral,
debu, dan partikulat-partikulat Cu yang ada dalam lapisan udara yang dibawah
turun oleh hujan (Laws, 1993). Cu masuk ke dalam lingkungan akibat dari
aktivitas manusia seperti buangan limbah industri yang mengandung Cu,
campuran bahan pengawet,industri pengelolaan kayu, buangan rumah tangga, dan
sebagainya (Palar, 2004).
Keberadaan unsur tembaga di alam dapat ditemukan dalam bentuk logam
bebas, akan tetapi labih banyak ditemukan dalam bentuk persenyawaan atau
sebagai senyawa padat dalam bentuk mineral seperti kalkosit (Cu2S), kovelit
(CuS), kalkopirit (CuFeS2), bornit (Cu5FeS4) dan enargit (Cu3AsS4) (Widowati et
al., 2008). Di perairan alami tembaga (Cu) terdapat dalam bentuk partikulat,
koloid dan terlarut. Fase terlarut seperti Cu bebas ikatan kompleks, baik dengan
ligan dalam organik, terutama (CuOH , Cu2(OH)22+) maupun anorganik. Ikatan
Cu kompleks dengan ligan organik, terutama adalah oleh material humus. Ikatan
kompleks Cu yang terjadi dalam sedimen laut adalah yang paling stabil,
sementara yang terbentuk dalam kolom air laut stabilitasnya paling rendah (Moore
dan Ramamoorthy, 1984). Pada perairan alami, kadar tembaga biasanya < 0,02
mg/l. Air tanah dapat mengandung tembaga sekitar 12 mg/l sampai 0.005 mg/l
(Palar, 2004). Batas konsentrasi dari unsur ini yang mempengaruhi pada air
6
Tembaga termasuk logam berat essensial karena keberadaanya dalam tubuh
sangat sedikit namun diperlukan dalam proses fisiologis organisme. Walaupun
dibutuhkan tubuh dalam jumlah sedikit, bila kelebihan dapat menganggu
kesehatan atau mengakibatkan keracunan (Clark, 1989). Tembaga dimanfaatkan
dalam proses pertumbuhan, metabolisme, dan aktivitas enzim pada berbagai jenis
alga, cyanobakteria, dan organisme perairan lainnya. Namun jika konsentarsi Cu
pada suatu perairan tinggi, maka akan menyebabkan terhambatnya pertumbuhan
organisme perairan (Laing dan Helm, 1987 dalam Lestari, 2007).
2.2. Biologi Umum Kerang Kapak (Pinna sp)
2.2.1. Klasifikasi dan morfologi kerang kapak (pinna sp)
Kerang kapak (Lampiran 1) termasuk hewan lunak, mempunyai cangkang
yang berbentuk kapak dan tidak sama sisi. Namun, mereka sering diabaikan
karena kebanyakan kerang ini sering terkubur dengan hanya sekitar 2-3cm dari
cangkang mencuat dari sedimen (Tan, 2008).
Klasifikasi kerang kapak menurut Linnaeus (1758)
Filum : Mollusca
Kelas : Bivalvia
Famili : Pinnidae
Genus: Pinna sp
Spesies : Pinna sp
Pinna dicirikan dengan cangkang panjang, sangat rapuh, dan berbentuk
segitiga secara garis besarnya. Tepi posterior memotong. Skulptur dari radial ribs
dalam cangkang yang berlapis mutiara dibagi oleh alur tengah yang membujur.
Bekas perlektan aduktor posterior pada cuping memutiara dorsal, kadang–kadang
sebagian pada cuping memutiara vertikal. Umumnya berwarna coklat pucat
(Kusnadi at al., 2008).
Tipe posterior menganga, ligament panjang dan lurus. Gigi engsel absen
bekas perlekatan aduktor pada bagian anterior kecil dan terletak dekat dengan
ujung anterior, sedangkan bekas perlekatan aduktor pada bagian posterior besar
dan agak ke bagian tengah. Pinna sp umumnya bivalvia besar (30-48 cm), bentuk
segitiga, tipis, bentuk meruncing ke subtrak (Kusnadi et al., 2008). Anatomi
kerang kapak dapat dilihat pada Gambar 1.
8
2.2.2. Bioekologi kerang kapak (pinna sp)
Pinna sp secara luas didistribusikan di indo-Pasifik dari Afrika ke Tenggara
Malaysia dan Selandia Baru, Utara ke Jepang dan New South Wales Bir dan
Selandia Baru. Pinna sp juga ditemukan di Mediteranian dan perairan Amerika.
Pinna sp hidup dengan ujung tajam mereka tertanam dalam sedimen, terpasang
dengan baik. pada umumnya Pinna sp di temukan pada substrat berpasir padang
lamun (Posidonia oceanica, Enhalus acoroides, Cymodocea serrulata, Thalassia
hemprichii, Halophila sp dan Cymodocea nodosa), laguna dan daerah reruntuhan
karang (Kusnadi et al., 2008).
Menurut Butler (1987), Pinna sp termasuk spesies dengan pembuahan di luar
tubuh dan proses pembuahan tergantung pada kedekatan pemijahan individu
lainnya maupun faktor-faktor lain, termasuk gerakan air. Pinna sp mencapai
kematangan seksual pada panjang tubuh tidak kurang dari 15 cm. Siklus
reproduksi kerang Pinna sp tampaknya menjadi acara tahunan, betina melakukan
pemijahan pada awal musim dingin, dengan pemijahan kecil pada awal musim
panas, sementara induk jantan mengalami beberapa pemijahan dari awal musim
panas ke akhir musim gugur, dan selama pertengahan musim dingin.Larva yang
muncul dari telur berkembang di laut terbuka. Setelah fase planktonik,
pengembangan bentuk berkapur tipis membuat larva berat dan akhirnya jatuh ke
dasar laut dan menempel pada subtrak berpasir. Pada tahap ini berukuran sekitar 2
cm dan memiliki cangkang transparan dan rapuh, yang meninggalkan mangsa
hewan predator banyak, seperti gurita, laut bream, dll. Angka kematian pada tahap
Pada saat ini heterogenitas genetik analisis dan RDAP deteksi penanda telah
digunakan untuk mengidentifikasi kerang ini hingga tingkat spesies dan
Penurunan lamun memiliki implikasi serius bagi penggemar kerang yang sangat
terpengaruh oleh habitat padang lamun yang membuat metabolisme dan
reproduksi menjadi sulit (Kusnadi et al., 2008).
2.3. Cu dalam Organisme
Tembaga termasuk dalam kelompok logam esensial dan dalam kadar yang
rendah dibutuhkan oleh organisme sebagai ko-enzim dalam proses metabolisme
tubuh dan sifat racunnya baru muncul dalam kadar yang tinggi. Biota perairan
sangat peka terhadap kelebihan Cu dalam badan perairan tempat hidupnya
(Tarigan et al., 2003). Kadar Cu sebesar 2,5-3,0 ppm dalam perairan dapat
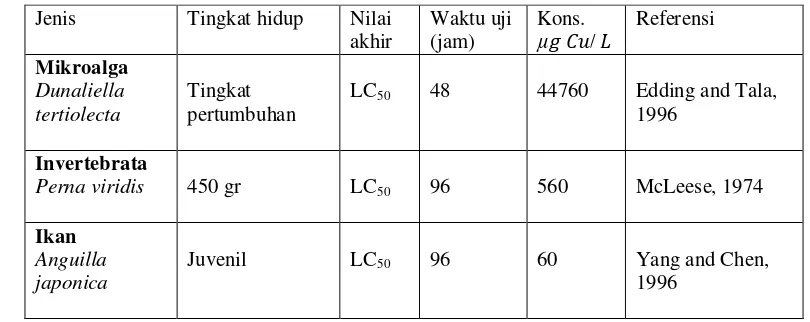
membunuh ikan-ikan (Bryan, 1976). Pada Tabel 2 ditunjukkan beberapa hasil uji
toksisitas tembaga terhadap organisme laut. Hasil uji toksisitas tersebut bervariasi
pada setiap jenis organisme dan lamanya waktu uji yang dilakukan.
Tabel 1. Nilai toksisitas tembaga terhadap beberapa jenis organisme laut
Jenis Tingkat hidup Nilai
10
2.4. Cu dalam Sedimen
Tembaga (Cu) merupakan unsur yang terdapat dalam bentuk partikulat,
koloid, dan terlarut di perairan alami. Cu yang mengendap bersamaan dengan
padatan tersuspensi akan mempengaruhi kualitas sedimen di dasar perairan.
Mekanisme yang terjadi dapat dianalisis dengan proses koagulasi (penggumpalan)
antara mineral anion dan kation pada air laut, selanjutnya diikuti dengan proses
sedimentasi (pengendapan).
Hal ini dapat terjadi karena massa jenis partikel akan lebih besar dari massa
jenis air laut. Sedimen merupakan bagian dari akumulasi material sepanjang
tahun, dan keberadaannya relatif tetap sehingga sedimen dapat dijadikan sebagai
indikator pencemaran lingkungan yang lebih baik dibandingkan sebarannya di
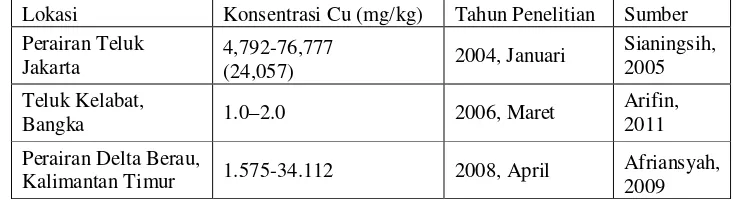
kolom air (Siantingsih, 2005). Tabel 2 memperlihatkan konsentrasi logam Cu di
sedimen yang pernah dilakukan di berbagai wilayah perairan Indonesia.
Berdasarkan hasil penelitian tersebut menunjukkan bahwa konsentrasi logam Cu
pada setiap wilayah berbeda tergantung aktivitas pada perairan tersebut.
Tabel 2. Konsentrasi Cu (mg/kg) pada sedimen di beberapa perairan di Indonesia
Lokasi Konsentrasi Cu (mg/kg) Tahun Penelitian Sumber
Perairan Teluk
Kalimantan Timur 1.575-34.112 2008, April
Afriansyah, 2009
Konsentrasi Cu di sedimen berada pada 35-90 mg/kg maka dikategorikan
maka dikategorikan sebagai tercemar sedang. Konsentrasi Cu antara 190-400
mg/kg maka perairan termasuk ke dalam kategori bahaya dan harus segera
dilakukan pembersihan sedimen (IADC/CEDA, 1997).
2.5. Fraksinasi Sedimen
Ukuran partikel sedimen (grain size) merupakan salah satu faktor yang
mempengaruhi konsentrasi dan proses adsorpsi logam berat dalam sedimen.
Fraksi sedimen halus memiliki area permukaan yang luas dan relatif tingginya
gaya elektrostatis dari permukaan partikel tersebut (Sudarso et al., 2005;
Hutabarat dan Evans, 2006; Situmorang et al., 2010). Menurut Haryanto et al.
(2005) konsentrasi logam berat tertinggi terdapat dalam sedimen yang berupa
lumpur, tanah liat, pasir berlumpur dan campuran dari ketiganya dibandingkan
dengan yang berupa pasir murni.
Kondisi perairan yang tenang akan memudahkan pengendapan sedimen
lumpur ke dasar perairan diikuti dengan pengendapan bahan organik. Kandungan
bahan organik memiliki hubungan yang positif dengan konsentrasi logam berat
dalam sedimen (Parera, 2004). Faktor lainnya yang mempengaruhi pengendapan
sedimen adalah mekanisme transport material sedimen yang akan menentukan
variasi pengendapan yang terjadi (Rachman, 2008).
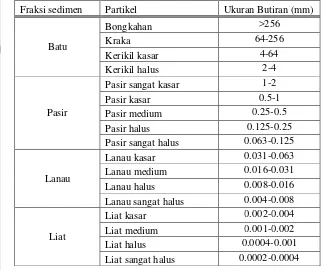
Menurut Seibold and Berger (1996) klasifikasi butiran sedimen berdasarkan
ukuran terbagi atas batu (stones), pasir (sand), lanau (silt), dan lempung (clay).
Sedimen terdiri atas batu jika butiran memiliki ukuran 2-256 mm, pasir 0.063-2
mm, lanau 0.004-0.0063 mm, dan lempung <0.004 mm. Ukuran partikel sedimen
12
Tabel 3 memperlihatkan klasifikasi fraksi sedimen berdasarkan ukuran.
Tabel 3. Klasifikasi sedimen berdasarkan Wentworth Scale (Wibisono, 2005)
Fraksi sedimen Partikel Ukuran Butiran (mm)
Batu
Pasir sangat halus 0.063-0.125
Lanau
Lanau kasar 0.031-0.063
Lanau medium 0.016-0.031
Lanau halus 0.008-0.016
Lanau sangat halus 0.004-0.008
Liat
Liat kasar 0.002-0.004
Liat medium 0.001-0.002
Liat halus 0.0004-0.001
Liat sangat halus 0.0002-0.0004
2.6. Kondisi Wilayah Perairan
Jelengah terletak disebelah barat daya Sumbawa yang banyak dipengaruhi
oleh Selat Alas dan Samudera Indonesia. Hamparan dataranya tidak rata, sebagian
datar dan sebagian lainnya agak dalam. Beberapa bagian dataran tidak terendam
air pada saat air surut. Perairan Jelenga dengan tipe substrat berpasir, pecahan
karang dan berbatu pada daerah tubir. Tipe substrat pada zona atas (pasang tinggi)
adalah pasir dan pecahan karang (rubble) sedangkan pada zona bawah substrat
3.
BAHAN DAN METODE
3.1. Lokasi dan Waktu Penelitian
Penelitian ini dilaksanakan pada bulan Januari hingga April 2012 yang terdiri
dari proses pengambilan sampel di wilayah perairan Jelengah, Sumbawa Barat di
daerah intertidal perairan tersebut (Gambar 2) dan analisis laboratorium.
Identifikasi kadar kandungan tembaga dilakukan di PT. Australian Laboratory
Services (ALS) Bogor, ekstraksi sampel air dan sedimen di Laboratorium
Produktivitas Lingkungan MSP FPIK IPB, analisis kadar Cu terlarut di
Laboratorium Kimia Terpadu FMIPA IPB dan analisis fraksi sedimen di
Laboratorium Lingkungan BDP FPIK IPB.
14
3.2. Alat dan Bahan
3.2.1. Alat dan bahan pengambilan sampel di lapang
Alat yang digunakan dalam pengambilan sampel di lapang adalah water
quality checker YSI model 63, cool box, meteran, papan berskala, kertas label,
kantong plastik, sekop, saringan, botol sampel, Global Positioning System (GPS),
dan kamera.
Bahan-bahan yang digunakan di lapangan adalah asam nitrat (HNO3) dan es
batu.
3.2.2. Alat dan bahan pada laboratorium
Alat yang digunakan di laboratorium meliputi corong pisah teflon, oven, hot
plate, labu takar, sendok plastik, pinset, gelas ukur, desikator, kertas saring 0.45
µm, seperangkat Spektroskopi Serapan Atom (SSA) tipe AA-7000 dengan
ketelitian alat >0,005 mg/l, dan ayakan bertingkat OSK 9996 ukuran 2 mm, 1 mm,
0.5 mm dan 0.25 mm.
Bahan-bahan yang digunakan meliputi: sampel kerang kapak, air laut,
sedimen, aquades, asam nitrat (HNO3), penahan acetis, APDC (Ammonium
Pyrrolidine Dithiocorbamate) 1%, MIBK (Methyl Isobutyl Keton), HCL dan
H2O2 30 %.
3.3. Pengambilan Data
3.3.1. Penentuan stasiun penelitian
Penentuan stasiun penelitian dilakukan pada saat di Jelengah dengan melihat
3.3.2. Pengambilan sampel
3.3.2.1. Pengambilan contoh
Sampel diambil dari setiap stasiun yang telah ditentukan. Pengambilan
sampel biota dan air laut, dilakukan pada saat air mulai surut. Sampel biota yang
dibutuhkan untuk analisis logam berat sebanyak 6 gram berat basah daging kerang
kapak (3-6 ekor). Jumlah sampel air yang diambil berjumlah ± 250 ml dan
dimasukkan ke dalam botol polietilen yang telah diberi label, selanjutnya sampel
disaring dengan menggunakan kertas saring nekleopor 0,45 µm. Tujuan
penyaringan adalah memisahkan zat padat terlarut dan zat padat tersuspensi.
Setelah penyaringan contoh air di awetkan dengan menggunakan HNO3 pekat
hingga nilai pH contoh air laut berada di bawah dua, kemudian disimpan dalam
pendingin (cool box). Sampel kerang di ambil dengan menggunakan tangan dan
sampel dimasukan ke dalam plastik yang telah diberi label, disimpan dalam
pendingin (cool box). Sampel sedimen diambil langsung dan dimasukkan ke
dalam botol sedimen selanjutnya disimpan dalam pendingin (cool box). Kemudian
sampel air sedimen dan kerang dibawah ke laboratorium untuk dianalisis.
3.3.2.2. Kualitas air
Data kualitas air diukur secara insitu dengan menggunakan water quality
checker. Alat tersebut mengukur kualitas air yang meliputi suhu, salinitas, dan
tingkat keasaman (pH). Water quality checker terdiri dari probe yang didalamnya
terdapat sensor untuk mendeteksi kualitas air, kemudian probe tersebut dimasukan
16
3.3.3. Metode analisis logam berat
3.3.3.1. Analisis air laut
Contoh air laut yang telah disaring sebanyak 250 ml, ditambahkan 5 ml
penahan acetis dan 5 ml Ammonium Pyrrolidine Dithiocorbamate (APDC) 1%
kemudian dikocok selama ± 1 menit. Contoh kemudian ditambahkan 10 ml
Methyl Isobutyl Keton (MIBK) dikocok selama ± 1 menit, kemudian didiamkan
sampai terdapat dua fase yaitu fase organik (bagian atas) dan fase anorganik
(bagian bawah), selanjutnya fase yang digunakan kembali adalah fase organik.
Contoh kemudian ditambahkan air suling 10 ml pada corong pisah yang
mengandung fase organik dikocok selama ± 1 menit, kemudian didiamkan sampai
terbentuk fase organik dan anorganik kembali dan yang digunakan kembali adalah
fase organik. Setelah itu contoh ditambahkan 1 ml HNO3 pekat lalu dikocok
selama ± 1 menit dan didiamkan selama 60 menit, contoh kemudian ditambahkan
19 ml air suling dan dikocok ± 1 menit. Setelah itu terdapat fase organik dan
anorganik kembali, selanjutnya fase anorganik disimpan dalam botol polyetilen
sebelum dilakukan pengukuran dengan menggunakan Atomic Absorption
Spectrophotometry (AAS) (Hutagalung et al., 1997).
3.3.3.2. Analisis sedimen
Analisi logam Cu pada sampel sedimen dilakukan di Laboratorium
Produktivitas Lingkungan MSP FPIK IPB. Tahapan awal analisis adalah sampel
sedimen dikeringkan pada suhu 105 °C selama 24 jam dan didinginkan pada
desikator, setelah itu sampel digerus sampai hancur, kemudian ditimbang seberat
masing-masing sebanyak 5 ml. Setelah itu dipanaskan kembali pada hot plate sampai
volumenya menurun hingga 1 ml. Sampel sedimen kemudian diencerkan dengan
aquades 100 ml dan diaduk. Kemudian sampel disaring dengan kertas saring 0.45
µm. Setelah disaring sampel dimasukkan ke dalam botol berukuran 100 ml untuk
dilakukan pengukuran dengan menggunakan AAS (Atomic Absorption
Spectrophotometry) (SNI, 2004).
3.3.3.3. Analisis kerang
Tahapan awal analisis adalah sampel kerang dikeringkan dalam oven pada
suhu 105 °C selama 24 jam setelah itu didinginkan dalam desikator. Kemudian
sampel ditimbang sebanyak 1 gram berat kering. Sampel selanjutnya ditambahkan
HNO3 dan HCL masing-masing sebanyak 5 ml, setelah itu dipanaskan kembali
pada hot plate sampai volumenya menurun hingga 1 ml. Sampel kemudian
diencerkan dengan menambahkan aquades 100 ml dan diaduk. Kemudian sampel
disaring dengan kertas saring 0.45 µm. Setelah disaring, sampel di masukkan ke
dalam botol berukuran 100 ml untuk dilakukan pengukuran dengan menggunakan
AAS (Atomic Absorption Spectrophotometry) (SNI, 2011).
3.3.4. Analisis fraksi sedimen
Analisi fraksi sedimen dilakukan di Laboratorium Lingkungan BDP FPIK
dengan menggunakan ayakan mekanik yang masing-masing memiliki ukuran
bukaan 2 mm, 1 mm, 0,5 mm, 0,25 mm dan saringan yang berukuran 0,05 mm
untuk memisahkan tahap akhir dari fraksi pasir, sedangkan untuk lanau dan liat
18
berdasarkan Wentworth Scale (Wibisono, 2005). Tahapan awal analisis ukuran
butiran sedimen ini adalah sampel sedimen dipindahkan dalam wadah untuk
dipanaskan.
Sedimen yang telah kering selanjutnya dituangkan ke dalam ayakan dan hasil
dari ayakan ini dipisahkan berdasarkan fraksi butiran yang berbeda yaitu kerikil
>2 mm, pasir sangat kasar 1-2 mm, pasir kasar 0,5-1 mm, pasir medium 0,25-0,5
mm, pasir halus 0,05-0.,25 mm, lanau <0.,005 mm dan liat <0,004 mm.
Sisa dari proses penyaringan ayakan, sedimen dipindahkan ke dalam gelas
ukur dan ditambahkan 25 ml H2O2 30 % dan dipanaskan pada hot plate sampai
mendidih kemudian didinginkan beberapa menit. Setelah itu sampel disaring
dengan saringan yang berukuran 0.05 mm. Pasir yang tersisa dalam saringan
dimasukkan ke dalam cawan yang sebelumnya cawan ini sudah di oven dan di
timbang berat kosongnya. Proses selanjutnya cawan yang telah berisi pasir di
oven kembali sampai kering, setelah itu cawan ditimbang kembali. Proses ini
merupakan proses tahap akhir dari fraksi pasir.
Sampel yang lolos dari saringan yang berukuran 0.05 mm masukkan ke
dalam gelas ukur berukuran 500 ml dan ditambahkan air sampai 400 ml. Sampel
kemudian dikocok 20 kali dan diamkan ± 20 detik. Setelah itu pipet 25 ml ke
dalam cawan yang sebelumnya cawan ini sudah di oven dan ditimbang berat
kosongnya. Selanjutnya cawan di oven kembali sampai kering. Setelah itu cawan
ditimbang untuk mengetahui berat dari fraksi lanau.
Sisa di dalam gelas ukur 500 ml kemudian didiamkan selama 4 jam untuk
dianalisis fraksi liat. Setelah itu pipet 25 ml dimasukkan ke dalam cawan yang
cawan di oven kembali sampai kering. Setelah itu cawan ditimbang untuk
mengetahui berat dari fraksi liat (Kurnia et al., 2006).
3.3.5. Analisis data
Pengolahan data terdiri dari dua tahapan yang mencakup pengolahan
informasi dengan menggunakan software Ms. Excel untuk (data*.txt) dan sebaran
spasial kualitas air menggunakan software ArcGIS 9.3 (hasil*.shp) dengan teknik
IDW (inverse distance weight), dan hasil analisis laboratorium dianalisis dengan
analisis deskriptif.
Bentuk umum dari persamaan Interpolasi IDW adalah :
( ) =
∑ ( )
∑ 1
Dimana :
f = Pembobotan nilai
P = Titik yang akan diestimasi nilainya
Qi = Nilai disekitar titik P
d = Jarak ke titik P
n = Jumlah data
k = 1,2,3,…
20
4.
HASIL DAN PEMBAHASAN
4.1. Kandungan Cu dalam Air Laut
Konsentrasi Cu di sekitar perairan Jelengah cukup bervariasi antara
0,006-0,011 mg/l, dan dibeberapa Stasiun (7, 8, dan 9) tidak terdeteksi (Gambar 3).
Variasi ini dapat disebabkan oleh berbagai macam proses, seperti adanya masukan
atau sumber materi mengandung Cu, dan proses inetrnal dinamika oseanografi
yang dapat mempengaruhi penyebaran, pengenceran, dan pelarutan.
Konsentrasi Cu dalam perairan pada beberapa penelitian di Perairan
Indonesia telah banyak dilakukan diantaranya Perairan Batu Ampar, P. Batam
dengan konsentrasi Cu 0,0005-0,0070 mg/l (Razak, 1990 dalam Afriansyah,
2009), Perairan Teluk Santong Pulau Sumbawa NTB dengan konsentrasi 0,02
mg/l (Edward, 2000), dan Perairan Laut Banda dengan konsentrasi Cu
0,0018-0,0105 mg/l (Hamzah, 2006). Beberapa contoh hasil pengamatan Cu ini
menunjukkan bahwa konsentrasi Cu di perairan umumnya bervariasi yang
bergantung pada kondisi wilayah dan aktivitas yang ada di sekitar.
Konsentrasi Cu terindikasi lebih tinggi jika dibandingkan dengan baku mutu
logam berat air laut, untuk kehidupan biota laut dari Kepmen LH No. 51 Tahun
2004 nilai ambang batas untuk Cu adalah 0,008 mg/l. Konsentrasi-konsentrasi
tersebut terdapat atau teramati pada Stasiun 1, 3, dan 4. Hal ini menunjukkan
bahwa terdapat potensi kondisi Cu dalam air yang dapat menurunkan nilai mutu
0
4.2. Kandungan Cu dalam Sedimen
Konsentrasi logam Cu pada sedimen juga menunjukkan nilai yang bervariasi
pada setiap stasiun pengambilan contoh. Konsentrasi Cu pada perairan Jelengah
berkisar antara 1,39-5,13 mg/kg. konsentrasi terendah ditemukan pada Stasiun 5
dan 6 yang berkisar antara 1,39-2,13 mg/kg (Gambar 4).
22
Variasi ini dapat disebabkan oleh berbagai macam proses, seperti
pengenceran, absorbsi oleh partikel, terakumulasi dalam biota dan mengendap di
sedimen. Sedimen pada umunya merupakan area akumulasi semua senyawa.
Berbagai macam proses yang dialami oleh logam berat dalam kolom air pada
akhirnya akan diendapkan dalam sedimen. Oleh karena itu sedimen dapat
dijadikan sebagai record kejadian senyawa terlarut logam berat yang terjadi dalam
kolom air dalam kurun waktu lama (Libes, 2009).
Secara umum konsentrasi Cu relatif lebih rendah bila dibandingkan dengan
kisaran alami yaitu 5-30 mg/kg (Reseau National d’Observation, 1981 dalam
Razak, 1986). Rendahnya konsentrasi diduga karena tekstur sedimen. Tekstur
sedimen liat memiliki kemampuan menahan logam berat lebih besar bila
dibandingkan lanau atau pasir. Hal ini sesuai dengan hasil penelitian Everaarts
(1989).
4.3. Kandungan Cu dalam Kerang Kapak (Pinna sp)
Walaupun dalam konsentrasi tertentu dapat membahanyakan, logam Cu
merupakan salah satu logam berat yang dibutuhkan dalam tubuh makhluk hidup
(logam esensial). Hasil analisis rata-rata konsentrasi logam Cu pada kerang kapak
di perairan Jelengah menunjukkan nilai konsentrasi rata-rata tertinggi terdapat
pada lokasi lebih dalam (1-2 m) yang bernilai 3,713 mg/kg dengan kisaran nilai
pengamatan 1,98 mg/kg sampai 3,713 mg/kg (Tabel 4).
Secara alamiah kandungan Cu pada kerang-kerangan umumnya sangat sedikit
misalnya pada jenis Mylitus edulis konsentrasinya 0.004 mg/kg (Gosling, 1992).
cukup tinggi kurang lebih 746 kali lipat. Penelitian kandungan logam Cu di dalam
kerang telah dilakukan sebelumnya misalnya pada tahun 2001 di Teluk Banten
didapatkan kandungan Cu pada kerang hijau berukuran besar, sedang, dan kecil
berkisar antara 1,702-8,636 mg/kg dengan rata-rata 4,165 mg/kg, 1,116-10,863
mg/kg dengan rata-rata 4,954 mg/kg dan 0,850-10,207 dengan rata-rata 5,256
mg/kg (Jumariyah, 2001), pada tahun 2005 di lingkungan wilayah tambang
(Sekongkang, Maluk dan Tua Nanga) Kabupaten Sumbawa Besar Nusa Tenggara
Barat didapatkan kandungan Cu dari enam jenis kerang berbeda yang berkisar
0,76-26,0 mg/kg dengan rata-rata 8,588 mg/kg (Inswiasri et al., 2005) dan pada
tahun 2006 di perairan pesisir Dumai, Provinsi Riau didapat kandungan Cu pada
kerang lokan berkisar antara 1,3-25,6 mg/kg dengan rata-rata 13,2 mg/kg
(Anggraini, 2006). Beberapa contoh hasil pengamatan Cu ini menunjukkan
konsentrasi Cu umumnya lebih besar bila dibandingkan dengan konsentrasi Cu
pada kerang kapak di wilayah Jelengah. Bervariasinya nilai Cu diduga karena
kondisi wilayah, ukuran kerang dan aktivitas yang ada di sekitar.
Tabel 4. Rata-rata Kandungan Cu pada Kerang kapak
Kedalaman Kisaran nilai Kandungan
Cu (mg/kg) Rata-rata Kandungan Cu (mg/kg)
0-0,5 m 1,52-2,44 1,98
0,5-1 m 2,7-4,02 3,263
1-2 m 0,69-6,66 3,713
Nilai Baku Mutu 20*
24
Keberadaan logam Cu dalam kerang kapak belum melebihi nilai maksimum
yang diperbolehkan yaitu 20 mg/kg (SK. Ditjen POM Depkes RI
No.03725/B/SK/1989 Untuk Biota Konsumsi). Namun, mengkonsumsi kerang
yang sudah tercemar oleh logam berat perlu diwaspadai mengingat sifat dari
logam yang dapat terakumulasi dalam organ tubuh jika dikonsumsi dalam jumlah
banyak dan relatif lama.
Kandungan Cu dalam kerang salah satunya berasal dari rantai makanan.
Seperti yang diketahui bahwa kerang bersifat panyaring plankton (filter feeder)
dan pemakan detritus (detrivora). Fitoplanton yang merupakan awal dari rantai
makanan mengabsorpsi ion-ion logam Cu yang terlarut dalam air, kemudian
fitoplankton dimakan oleh zooplankton, zooplankton dimakan oleh organisme
kecil dan selanjutnya dimakan oleh organisme yang lebih besar (Hutagalung,
1991).
4.4. Fraksinasi Ukuran Sedimen
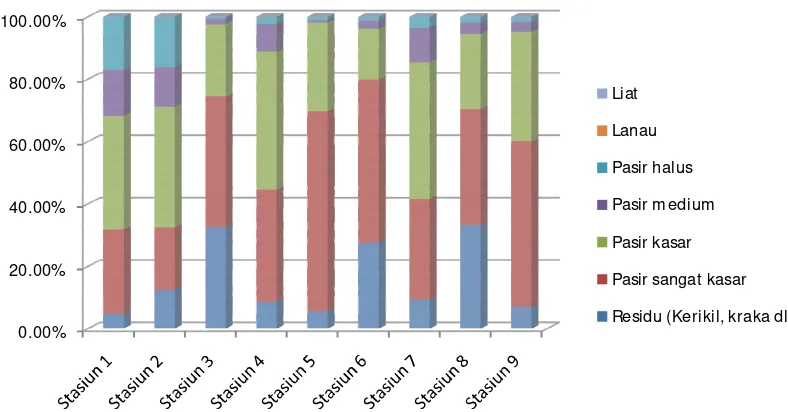
Presentase fraksi sedimen di semua lokasi stasiun penelitian didominasi oleh
fraksi pasir dan fraksi pasir sangat kasar. Komponen fraksi batu atau kerikil
memiliki kisaran nilai 4,68-33,17%, fraksi pasir sangat kasar 20,06-64,01%, fraksi
pasir kasar 16,23-44,23%, fraksi pasir medium 1,8-14,84%, fraksi pasir halus
0,59-16,87%, fraksi lanau 0,02-0,11%, dan fraksi liat 0,03-0,1% (Gambar 5).
Kondisi sedimen umumnya berwarna putih dengan bentuk bulat bercampur
dengan pecahan karang.
Ukuran butiran sedimen di lokasi penelitian diperkirakan berasal dari materi
0.00% Lithougenus yang merupakan komponen sedimen yang berasal dari daratan
seperti proses abrasi atau erosi dan juga dari laut berupa pecahan karang yang
terbawa oleh arus.
Gambar 5. Komposisi fraksi sedimen (%) di lokasi pengamatan perairan Jelengah
Faktor lain yang mempengaruhi ukuran butiran adalah mekanisme transport
material sedimen yang akan menentukan variasi pengendapan yang terjadi
(Rachman, 2008). Ukuran partikel sedimen yang kasar akan dengan mudah
diendapkan, tetapi untuk ukuran yang halus termasuk lanau dan liat lebih lama
terendapkan karena terbawa arus menjauh dari pantai. Penelitian ini didominasi
oleh pasir kasar pada Stasiun 1, 2, 4, dan 7 dan pasir sangat kasar pada Stasiun 3,
5, 6, 8 dan 9, yang mengindikasikan kondisi aliran relatif lebih dinamis, sehingga
kurang mampu mengendapkan komponen halus.
26
4.5. Kualitas Air Perairan Jelengah
Suhu perairan di wilayah pengamatan berkisar antara 27,1-29,8°C dengan
rata-rata 28,02°C. Suhu terendah ditemukan pada Stasiun 1, 2, 3 dan 6 yang
berkisar antara 27,1-27,6 °C, sedangkan suhu tertinggi ditemukan pada Stasiun 4
dan 8 yang berkisar antara 29,2-29,8 °C (Gambar 6).
Gambar 6. Sebaran spasial suhu (°C) di perairan Jelengah saat pengamatan
Kisaran suhu secara umum di Perairan Indonesia berkisar 28-31°C. Kisaran
suhu yang mampu ditoleransi suatu biota laut yaitu berkisar 20-35°C (Rahman,
2006). Berdasarkan baku mutu Kepmen LH No 51 tahun 2004 untuk biota laut
berkisar 28-30°C. Berdasarkan hal tersebut, kisaran suhu permukaan air perairan
Jelengah selama masa pengamatan masih pada kisaran normal dan dapat
Salinitas terendah di wilayah pengamatan ditemukan pada Stasiun 1, 7 dan 8
yang berkisar antara 31,5-32,0 ‰ dan tertinggi pada Stasiun 3 yang berkisar
antara 33,5-34,1 ‰ (Gambar 7). Berdasarkan kisaran salinitas tersebut perairan
Jelengah tergolong pada perairan yang memiliki kisaran salinitas normal. Menurut
Razak (1998) salinitas yang terukur masih berada dalam kisaran salinitas optimum
bagi pertumbuhan organisme laut yaitu 32-36 ‰.
Gambar 7. Sebaran spasial salinitas (‰) di perairan Jelengah saat pengamatan
Tingkat keasaman (pH) di wilayah pengamatan berkisar 7,31-8,17 (Gambar
8). Nilai pH terendah ditemukan pada Stasiun 4 dan 5 yang berkisar antara
7,31-7,48 dan tertinggi pada Stasiun 6, 8 dan 9 yang berkisar antara 7,99-8,17.
28
7-8,5. Berdasarkan hal tersebut, kisaran pH selama masa pengamatan masih pada
kisaran normal dan dapat ditoleransi oleh biota.
Gambar 8. Sebaran spasial derajat keasaman (pH) di perairan Jelengah saat pengamatan
Kekeruhan perairan di wilayah pengamatan berkisar antara 0,19-1,95 NTU.
Kadar terendah ditemukan pada Stasiun 3, 5 dan 6 yang berkisar antara 0,19-0,54
NTU (Gambar 9). Kekeruhan semakin meningkat menuju arah daratan (Stasiun 1,
4, dan 7) yang berkisar antara 0,89-1,95 NTU. Kekeruhan tertinggi ditemukan
pada Stasiun 1 dan 7 yang berkisar antara 1,59-1,95 NTU. Berdasarkan kriteria
baku mutu Kep-51/MENKLH/2004 untuk biota laut, nilai kekeruhan tidak
melebihi 30 NTU serta disarankan lebih kecil dari 5 NTU. Berdasarkan hal
tersebut, kisaran kekeruhan perairan Jelengah selama masa pengamatan masih
Gambar 9. Sebaran spasial kekeruhan (NTU) di perairan Jelengah saat pengamatan
Pengaruh meningkatnya kekeruhan adalah berkurangnya penetrasi cahaya ke
dalam kolom perairan sehingga dapat menyebabkan terjadinya penurunan
produktivitas primer seperti fitoplankton yang berperan sebagai sumber makanan
30
5.
KESIMPULAN DAN SARAN
5.1. Kesimpulan
Nilai konsentrasi logam Cu terlarut pada daerah penelitian mulai dari tidak
terdeteksi sampai 0,011 mg/l, konsetrasi Cu pada sedimen berkisar antara
1,39-5,13 mg/kg dan pada Pinna sp berkisar antara 1,98- 3,713 mg/kg. Beberapa
konsentrasi Cu pada air di beberapa stasiun terindikasi lebih tinggi jika
dibandingkan dengan baku mutu logam berat air laut, untuk kehidupan biota laut
dari Kepmen LH No. 51 Tahun 2004. Konsentrasi Cu pada sedimen dan kerang
berada di bawah nilai baku mutu yaitu sesuai dengan Reseau National
d’Observation (RNO) untuk sedimen dan SK. Ditjen POM Depkes RI
No.03725/B/SK/1989 Untuk Pinna sp. Fraksi sedimen pada wilayah tersebut
didominasi oleh fraksi pasir dan pengamatan terhadap kualitas perairan pada
stasiun pengamatan dari parameter suhu, salinitas, pH maupun kekeruhan masih
dapat dikatakan berada pada kondisi normal di alam.
5.2. Saran
Saran yang dapat diberikan penulis adalah diperlukannya contoh kerang per
stasiun pengamatan, karena pada penelitian ini tidak ditemukan kerang pada
setiap stasiun pengamatan sehingga dapat mengkorelasikan logam berat dalam
DAFTAR PUSTAKA
Afriansyah, A. 2009. Konsentrasi Kadmium (Cd) dan Tembaga (Cu)
dalam Air, Seston, Kerang dan Fraksinasinya dalam Sedimen di Perairan Delta Berau, Kalimantan Timur. [skripsi]. Bogor (ID): Institut Pertanian Bogor. 103 hlm.
Anggraini, D. 2007. Analisis Kadar Logam Berat Pb, Cd, Cu dan Zn pada Air Laut, Sedimen dan Lokan (Geloina coaxans) di Perairan Pesisir Dumai, Provinsi Riau. Bogor (ID): Institut Pertanian Bogor. 10 hlm.
Apriadi, D. 2005. Kandungan Logam Berat Hg, Pb dan Cr pada Air, Sedimen dan Kerang Hijau (Perna viridis) di Perairan Kamal Muara, Teluk Jakarta. [skripsi]. Bogor (ID): Institut Pertanian Bogor. 85 hlm.
Arifin, Z. 2011. Konsentrasi Logam Berat di Air, Sedimen, dan Biota di Teluk Kelabat, Pulau Bangka. Jurnal Ilmu dan Teknologi Kelautan Tropis. 3(1):104-114.
Bryan, G. W. 1976. Effects of Pollutants on Aquatic Organisms. Cambridge University Press. Cambridge.
Butler, A. J. 1987. Ecology of Pinna bicolor Gmelin (Mollusca: Bivalvia) in Gulf St Vincent, South Australia: density, reproductive cycle, recruitment, growth and mortality at three sites. Australian Journal of Marine and Freshwater Research. 38(6): 743-769.
Clark, R. B. 1989. Marine Pollution. Second Edition. Clarendon Press Oxford. 105 hlm.
Desratriyanti, R. 2009. Toksisitas Kadmium (Cd) dan Tembaga (Cu) terhadap Perkembangan Embrio-Larva Kerang Hijau (Perna viridis). [skripsi]. Bogor (ID): Institut Pertanian Bogor. 73 hlm.
Edding, M. and F. Tala. 1996. Copper Transfer and Influence on a Marine Food Chain. Bulletin of Environmental Contamination and Toxicologi.
57(4):617-624
Edward. 2001. Kandungan Logam Berat Cu dan Zn dalam Air Laut dan Sedimen di Perairan Teluk Santong, Pulau Sumbawa NTB. Jurnal Toksikologi Indonesia. 2(1):48-53.
32
Everaarts, J.M. 1989. Heavy metal (Cu, Zn, Pb, Cd) in Sediment of the Java Sea. Estuarine and Coastal areas of East Java and Some Deep Sea Areas. Netherland Journal of Sea Research. 23(4): 403-413.
Gosling, E. 1992. The Mussel Mytilus : Ecology, Physiologi, Genetis and Culture. Elsevier. London.
Hamzah, F. 2006. Pola Sebaran Menegak Konsentrasi Cd, Pb, Cu dan Zn Terlarut di Perairan Laut Banda. [skripsi]. Bogor (ID): Institut Pertanian Bogor. 87 hlm.
Haryanto, Purwanto, dan A. Hadiyarto. 2005. Penyerapan tembaga dalam Air Limbah dengan Beberapa Jenis Tanah pada Reaktor Batch. Jurnal Teknik. 16(1): 28-35.
Hutabarat, S dan Evans, S. M. 2006. Pengantar Oseanografi. Jakarta (ID): U Press. 159 hlm.
Hutagalung, H.P., D. Septiapermana, dan S. H. Riyono. 1997. Metode Analisis Air Laut, Sedimen dan Biota. Pusat Penelitian dan Pengembangan Oseanologi, Lembaga Ilmu Pengetahuan Indonesia. Jakarta.
Hutagalung, H.P. 1991. Pencemaran Laut oleh Logam Berat. Dalam Kunarso, H. D dan Ruyitno (Ed.), Status Pencemaran Laut di Indonesia dan Teknik Pemantauannya. P3O-LIPI. Jakarta.
Inswiasri, Sukar, dan Cahyorini. 2008. Kadar Logam Berat di Lingkungan
Wilayah Tambang, Nusa Tenggara Barat. Jurnal Ekologi Kesehatan. 7(1): 656-664.
[IADC/CEDA] International Association of Dredging Companies/Central
Dredging Association. 1997. Conventions, Codes, and Conditions: Marine disposal. Environmental aspects of dredging 2a. Netherlands (US): IADC. 71 hlm.
Jumariyah. 2001. Kandungan Logam Berat Kadmium (Cd), Timbal (Pb), dan Tembaga (Cu) Pada Kerang Hijau (Perna viridis) di Teluk Banten. [skripsi]. Bogor (ID): Institut Pertanian Bogor. 80 hlm.
Kurnia, U., F. Agus, A. Adimihardja, dan A. Dariah. 2006. Sifat Fisik Tanah dan Metode Analisisnya. Badan Penelitian dan Pengembangan Pertanian, Departemen Pertanian. Jakarta.
Kusnadi, A., U. E. Hernawan, dan T. Triandiza. 2008. Moluska Padang Lamun Kepulauan Kei Kecil. LIPI Press. Jakarta. 186 hlm.
Lestari, F. 2007. Pengaruh Tembaga terhadap Kandungan Klorofil-a dan Pertumbuhan Sel Mikroalga Isochrysis sp. [Skripsi]. Jakarta (ID): Universitas Nasional Jakarta.
Libes, S. M. 2009. Introduction to Marine Biogeochemistry. Second Edition. New York (US): Elsevier Science. 909 hlm.
Linnaeus, C. OBIS Indo-Pacific Molluscan Database
http://clade.ansp.org/obis/find_mollusk.html. [12 Desember 2011]
McLeese, D.W. 1974. Toxicity of Copper at Two Temperatures and Three Salinities to the American Lobster (Homarus americanus). Journal of the Fisheries Research Board of Canada. 31(12):1949-1952
[MENLH] Menteri Negara Lingkungan Hidup. 2004. Surat Keputusan Menteri Negara Lingkungan Hidup No. Kep. 51/MEN-LH/I/2004. Tentang Baku Mutu Air Laut untuk Biota Laut. Jakarta.
Moore, J. W. dan S. Ramamoorthy. 1984. Heavy Metals in Neutral Water. Springer Verlag. New York.
Palar, H. 2004. Pencemaran dan Toksikologi Logam Berat. Jakarta (ID): PT Rineka Cipta. 152 hlm.
Parera, P. 2004. Heavy Metal Concentrations in the Pacific Oyster; Crassostrea gigas. [Tesis]. Auckland(NZ): Auckland University of Technology. 116 hlm.
Rachman, A. A. 2008. Sebaran Menegak Konsentrasi Pb, Cu, Zn, Cd, dan Ni di Sedimen Pulau Pari Bagian Utara Kepulauan Seribu. [skripsi]. Bogor (ID): Institut Pertanian Bogor. 55 hlm.
Razak, H. 1986. Kandungan Logam Berat di Perairan Ujung Watu dan Jepara. Pusat Penelitian dan Pengembangan Oseanografi–LIPI. Jakarta. 20 hlm.
Razak, T.B. 1998. Struktur Komunitas Karang Berdasarkan Metode Transek Garis dan Transek Kuadrat di Pulau Menyawakan Taman Nasional Karimun Jawa Jateng. [Skripsi]. Bogor (ID): Institut Pertanian Bogor (tidak dipublikasikan). 56 hlm.
Scheltema, A. 1983. Pinna deltodes Menke newly described and differentiated from P. bicolor Gmelin (Bivalvia, Pterioida). Journal of the Malacological Society of Australia. 6(1-2): 37-52.
34
Siantingsih, A. 2005. Pendugaan Sebaran Spasial Logam Berat Cd, Cu, Zn, dan Ni dalam Air dan Sedimen di Perairan Teluk Jakarta. [skripsi]. Bogor (ID): Institut Pertanian Bogor. 73 hlm.
Situmorang, S. P, Sanusi, H. S, dan Arifin, Z. 2010. Geokimia Logam Berat (Pb, Cr, dan Cu) dalam Sedimen dan Potensi Ketersediaannya pada Biota Bentik di Perairan Delta Berau, Kalimantan Timur. Ilmu Kelautan. 1(Edisi khusus): 1-11.
Smith, J.D., C.V. Edward, B.B.A Grant, W.L. Gregory, N. Mills, and D.J. Milne. 1980. Distribution and Significance of Copper, Lead, Zine and Cadmium in Corio Bay Ecosystem, Australia Journal of Fresh-Water Research. 32 : 151.
[SNI] Standar Nasional Indonesia. 2004. Sedimen-Bagian 5: Cara Uji Tembaga (Cu) Secara Destruksi Asam dengan Spektrofotometer Serapan Atom (SSA). Badan Standardisasi Nasional. Jakarta.
[SNI] Standar Nasional Indonesia. 2011. Cara Uji Kimia-Bagian 5: Penentuan Kadar Logam Berat Timbal (Pb) dan Kadmium (Cd) pada Produk Perikanan. Badan Standardisasi Nasional. Jakarta.
Sudarso, Y, Yoga, G. P, dan Suryono, T. 2005. Kontaminasi Logam Berat di Sedimen: Studi Kasus Pada Waduk Saguling, Jawa Barat. Manusia dan Lingkungan. 12(1): 28-42.
Tan, R. 2008. Family Pinnidae
http://www.wildsingapore.com/wildfacts/mollusca/bivalvia/pinnidae/pinni dae.htm.
Tarigan, Z., Edward, dan A. Rozak. 2003. Kandungan Logam Berat Pb, Cd, Cu, Zn dan Ni dalam Air Laut dan Sedimen di Muara Sungai Membramo, Papua dalam Kaitannya dengan Kepentingan Budidaya Perikanan. Makara Seri Sains. 7(3): 119-124.
Wibisono, M. S. 2005. Pengantar Ilmu Kelautan. Jakarta (ID): PT. Grasindo. 224 hlm.
Widowati, W., A. Sastiono, dan R. Jusuf. 2008. Efek Toksik Logam: Pencegahan dan penanggulangan pencemaran. Andi Offset. Yogyakarta. 395 hlm.
36
Lampiran 1. Dokumentasi kegiatan saat penelitian
Proses pemantauan secara visual Water quality checker model 63
Penanganan kerang di laboratorium Proses penyaringan Air Laut
Sampel Sedimen Proses penyaringan sampel Sedimen
Corong pisah teflon Sedimen sebelum analisis fraksi
38
Penulis dilahirkan di Jakarta, 23 Oktober 1989
merupakan anak kedua dari dua bersaudara, dari pasangan
Ayah Sudaryo dan Ibu Moamenah.
Tahun 2005-2008 Penulis menyelesaikan pendidikan di
Sekolah Menengah Atas Negeri (SMAN) 92 Jl. Komplek
Pemadam Kebakaran, Semper Barat-Jakarta Utara. Pada Tahun 2008 penulis di
terima sebagai mahasiswa Institut Pertanan Bogor, Fakultas Perikanan dan Ilmu
Kelautan, Jurusan Ilmu dan Teknologi Kelautan, Program Studi Ilmu Kelautan
melalui jalur USMI (Ujian Seleksi Mahasiswa Baru).
Selama kuliah di Institut Pertanian Bogor penulis menjadi Pembina klub
Greda-C Asrama TPB IPB 2011-2012. Selain itu Penulis pernah mengikuti
beberapa seminar dan pelatihan di bidang sistem infomasi geografis, perikanan
dan kelautan yaitu Seminar Pembekalan Mahasiswa Ilmu dan Teknologi Kelautan
Laut dan Perubahan Iklim tahun 2010, Pelatihan Aplikasi GIS untuk Pemetaan
Sumberdaya Pertanian Lokal Potensial tahun 2012, dan Pelatihan One Star Scuba
Diver (A-1) POSSI tahun 2012. Disamping menjadi seorang mahasiswa, penulis
pun menjadi tentor pada mata pelajaran Matematika di lembaga Rumah Sahabat
(Rusa) pada tahun 2011-2012.
Untuk menyelesaikan studi di Fakultas Perikanan dan Ilmu Kelautan, penulis
melakukan penelitian dengan judul ”Kandungan Tembaga (Cu) pada Air Laut,