PENGARUH PERIODE NAUNGAN DAN PEMUPUKAN MgSO
4.H
2O
TERHADAP PERTUMBUHAN TANAMAN DAN PRODUKSI
ANTOSIANIN DAUN DEWA
(
Gynura pseudochina
(L) DC)
ELNI FITRANI
SEKOLAH PASCA SARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis “Pengaruh Periode Naungan dan Pemupukan MgSO4.H2O terhadap Pertumbuhan Tanaman dan Produksi Antosianin Daun Dewa (Gynura pseudochina (L) DC) adalah karya saya sendiri dengan arahan komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian Tesis ini.
Bogor, Maret 2010
ABSTRACT
Elni Fitrani. The effect of Shade Period and MgSO4
.
H2O on Plant Growth andAnthocyanin Production of Gynura pseudochina (L) DC. Under direction of MUNIF GHULAMAHDI and MAYA MELATI
Gynura pseudochina (L) DC is one of important medicinal plants because it contains anthocyanin which has been identified as a bioactive compound to treat tumor or cancer. Anthocyanin production is expected to be enhanced through the addition of light settings and Mg nutrients. Therefore, the purpose of this research was study the effect of shade period and MgSO4.H2O on anthocyanin production of Gynura
pseudochina (L) DC. The experiment was carried out from July to October 2007 at IPB Experimental station at Biofarmaka unit – Cikabayan Bogor. The experiment used Split Plot Design with shade treatment as the main plot and MgSO4.H2Ofertilizer dose as subplot. The main plot consists of five periods of 50% shade: 0, 1, 2, 3, 4 month, and subplot consists of five rates of MgSO4.H2O: 0, 1, 2, 3, 4 g MgSO4.H2O /kg soil.
Interaction of shade period and MgSO4.H2Osignificantly increased plant growth and production. The maximum plant growth and fresh weight of leaves was achieved by providing 3 months shading and 2.80 g MgSO4.H2O / kg soil. Shade period and MgSO4.H2O did not significantly increase chlorophyll a, b, and anthocyanin content, however, it significantly increased anthocyanin production. The maximum anthocyanin production was achieved by providing 3 months shading and 2.80 g MgSO4.H2O / kg soil.
RINGKASAN
Elni Fitrani. Pengaruh Periode Naungan dan Pemupukan MgSO4
.
H2O tehadap Pertumbuhan Tanaman dan Produksi Antosianin Daun Dewa (Gynura pseudochina (L) DC). Dibimbing oleh MUNIF GHULAMAHDI and MAYA MELATI.Daun dewa merupakan tanaman obat yang banyak manfaatnya karena mengandung senyawa bioaktif antara lain golongan flavonoid. Antosianin termasuk golongan flavonoid yang dapat berfungsi untuk mengobati beberapa jenis penyakit khususnya tumor atau kanker pada manusia. Tanaman daun dewa mengandung berbagai senyawa kimia, antara lain saponin, flavonoid, minyak atsiri, dan antikoagulan. Oleh karena itu daun dewa mempunyai banyak kegunaan dan salah satunya adalah untuk mengatasi stroke. Cahaya merupakan faktor penting bagi pertumbuhan dan perkembangan tanaman, karena selain berperan dominan pada proses fotosintesis, juga sebagai pengendali, pemicu dan modulator respon morfogenesis khususnya pada tahap awal pertumbuhan tanaman. Spektrum cahaya yang dibutuhkan tanaman berkisar antara panjang gelombang 400-700 nm, yang biasa disebut photosynthetically activeradiation (PAR). Disamping pengaturan intensitas cahaya (naungan) untuk mendukung pertumbuhan di lapang, pemberian unsur hara melalui pemupukan sangat penting untuk mekanisme produksi bioaktif (flavonoid/ antosianin) pada tanaman daun dewa. Magnesium dan sulfur yang merupakan unsur hara yang akan dicobakan pada penelitian ini memiliki peran spesifik pada mekanisme produksi senyawa flavonoid. Sulfur dalam bentuk SO42- merupakan elemen esensial dalam sintesis protein dan produksi senyawa-senyawa metabolit sekunder dalam tanaman seperti flavonoid dan terpenoid, sedangkan magnesium dapat membentuk senyawa cianidin Mg-compleks yang merupakan salah satu aglikon antosianin. Penambahan kandungan Mg dalam tanah dapat dilakukan dengan pemberian pupuk Mg yaitu kieserit (magnesium sulfate/ MgSO4.H2O) dengan kandungan 29% Mg dan 23% S. Penentuan dosis magnesium dan sulfur yang tepat untuk meningkatkan kandungan flavonoid daun dewa sangat penting untuk diketahui.
Penelitian ini bertujuan mengetahui pengaruh naungan terhadap pertumbuhan tanaman dan produksi antosianin daun dewa (Gynura pseudochina (L) DC), Mengetahui pengaruh dosis pupuk MgSO4.H2O terhadap pertumbuhan tanaman dan produksi antosianin tanaman daun dewa (Gynura pseudochina (L) DC), mengetahui pengaruh interaksi antara naungan dan dosis pemupukan MgSO4.H2O terhadap pertumbuhan dan produksi kandungan senyawa bioaktif tanaman daun dewa (Gynura pseudochina (L) DC). Adapun hipotesa penelitian yaitu : ada periode naungan terbaik yang menghasilkan pertumbuhan dan produksi senyawa bioaktif tanaman daun dewa (Gynura pseudochina (L) DC). Ada dosis pupuk MgSO4.H2O terbaik yang menghasilkan pertumbuhan dan produksi senyawa bioaktif tanaman daun dewa (Gynura pseudochina (L) DC). Ada interaksi terbaik naungan dan dosis pemupukan MgSO4.H2O terhadap pertumbuhan dan produksi senyawa bioaktif tanaman daun dewa
(Gynura pseudochina (L) DC).
Percobaan menggunakan rancangan petak terpisah (Split Plot Design), dengan perlakuan naungan sebagai petak utama dan dosis pemupukan sebagai anak petak. Petak utama terdiri atas lima periode naungan intensitas 50% : 0, 1, 2, 3 dan 4 bulan. Anak petak terdiri atas lima taraf dosis : 0, 1, 2, 3, 4 g MgSO4.H2O/ 6.5 kg tanah.
Interaksi periode naungan dan pemupukan MgSO4.H2O nyata meningkatkan pertumbuhan dan produksi tanaman. Pertumbuhan tanaman dan bobot basah daun tertinggi tercapai dengan perlakuan naungan 50% selama 3 bulan dan pemberian 2.80 g MgSO4.H2O / tanaman. Periode naungan dan pemupukan MgSO4.H2O tidak nyata meningkatkan klorofil a, b, dan kandungan antosianin, namun nyata meningkatkan produki antosianin. Produksi antosianin tertinggi tercapai dengan perlakuan naungan 50% selama 3 bulan dan dosis pupuk 2.80 g MgSO4.H2O / 6.5 kg tanah.
©Hak cipta milik IPB, tahun 2010 Hak cipta dilindungi Undang-undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah b. Pengutipan tidak merugikan kepentingan yang wajar IPB
PENGARUH PERIODE NAUNGAN DAN PEMUPUKAN
MgSO
4.H
2O TERHADAP PERTUMBUHAN TANAMAN DAN
PRODUKSI ANTOSIANIN DAUN DEWA
(
Gynura pseudochina
(L) DC)
ELNI FITRANI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Departemen Agronomi dan Hortikultura
SEKOLAH PASCA SARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Pengaruh Naungan dan Pemupukan MgSO4.H2O Terhadap Produksi Antosianin Daun Dewa (Gynura pseudochina (L.) DC) Nama : Elni Fitrani
NIM : A151060071
Disetujui Komisi Pembimbing
Dr. Ir. Munif Ghulamahdi, MS Dr. Ir. Maya Melati, MS. MSc Ketua Anggota
Diketahui
Ketua Program Studi Agronomi Dekan Sekolah Pascasarjana
Dr. Ir. Munif Ghulamahdi, MS Prof. Dr. Ir. Khairil A. Notodiputro, M.S.
PRAKATA
Puji syukur penulis panjatkan kepada Allah SWT atas segala rahmat-Nya, sehingga penulis dapat menyelesaikan penelitian dan penulisan tesis yang berjudul ”Pengaruh Periode Naungan dan Pemupukan MgSO4.H2O terhadap Pertumbuhan
Tanaman dan Produksi Antosianin Daun Dewa (Gynura pseudochina (L.) DC)”. Penelitian dan penulisan tesis ini dibawah bimbingan Dr. Ir. Munif Ghulamahdi, MS selaku ketua komisi dan ibu Dr. Ir. Maya Melati, MS. MSc selaku anggota komisi pembimbing. Pada kesempatan ini penulis menyampaikan ucapan terima kasih yang sebesar-besarnya atas waktu dan kesempatan yang telah diluangkan untuk membimbing penulis.
Penelitian dan penyelesainyan tesis ini didanai oleh Hibah Bersaing XIV tahun 2006, karena itu penulis mengucapkan terima kasih kepada Prof. Dr. Ir. Latifah K. Darusman, M.S. selaku Kepala Pusat Studi Biofarmaka IPB, Dr. Ir. Munif Ghulamahdi, MS., Dr. Ir. Sandra A. Aziz, MS sebagai Ketua dan Anggota Tim Peneliti Hibah Bersaing XIV.
Kepada Dr. Ir. Sandra Arifin Aziz, MS selaku penguji luar komisi, penulis mengucapkan terima kasih atas waktu yang telah diberikan untuk membaca dan menelaah kembali tesis ini. masukkan, cara pandang, dan pertanyaan-pertanyaan yang diajukan pada saat ujian akhir sangat penulis hargai.
Kepada Prof. Dr. Ir. Satryas Ilyas, MS selaku penguji luar komisi wakil dari IPB, penulis mengucapkan terima kasih atas waktu dan masukan yang diberikan selama ujian akhir tesis ini.
Penghargaan dan ucapan terima kasih penulis sampaikan juga kepada: 1. Dirjen DIKTI yang telah memberikan Beasiswa BPPS
2. Rektor Universitas Gajah Putih Takengon yang telah memberikan izin tugas belajar.
3. Dekan Fakultas Pertanian Universitas Gajah Putih Takengon yang telah mengizinkan penulis untuk melanjutkan studi dan memberikan sebagian dana penelitian.
5. Kepala beserta staf Laboratorium Ekofisilogi Tanaman dan Laboratorium RGCI atas kerjasama, kebersamaan dan bantuannya.
6. Mustika Tripatmasari, SP, MSi., Iwan Hasri, SPi., Maulidaini, SSi., Fahmi Wendra Setiostono, SP, MSi., Zulhermana, SP, MSi., Yossita Fiana, SP., Taufik, SP., Yohanis Amos Mustamu, SP., Haryo Tri Adjie, SPi, MSi., Wawan, SP., Karmanah, SP, MSi serta rekan-rekan Pascasarjana Agronomi angkatan 2006, atas dorongan, bantuan dan kebersamaannya.
7. Papa (Alrm) dr. Suhaterir dan Mama Juniarti yang telah banyak mengorbankan segalanya bagi penulis baik material maupun spiritual yang tiada henti – hentinya. 8. Kepada Mertua dr. Soetrima dan bunda Nadhirah, BA, kakak dr. Eka Novrida
Istiana, abang Ilham Dwi Istianto, ST atas dukungannya.
9. Kakak dan adik sekeluarga: Leny Sujanti, SKM., Ami Aristoni, SPPi, MSi., Lysni Suciani, S.Si., Yuliani Fitri, SE., Alwinta Aristoni, SPdi., Maulizan Ara Arisandi atas iringan do’a dan motivasinya.
10.Suami Tercinta Kiswah Tri Istiano, SP terima kasih atas dorongan, kesabaran, pengertian, pengorbanan, kasih sayang dan perhatiannya selama ini.
11.Anakku Tersayang Fitrah Muhammad Nazril yang memberi semangat dan belahan jiwa Umi.
12.Rekan-rekan di Universitas Gajah Putih Takengon, Ikatan Mahasiswa Aceh Pascasarjana IPB serta semua pihak yang telah memberikan dukungan dan bantuannya.
Penulis berharap semoga tesis ini dapat bermanfaat bagi kita semua. Amin.
Bogor, Maret 2010
RIWAYAT HIDUP
Penulis lahir di Aceh Tengah pada tanggal 6 Agustus 1979, merupakan putri ke tiga dari tujuh bersaudara dari ayah Suhaterir dan Juniarti. Penulis menikah dengan Kiswah Tri Istiano, SP dan telah dikaruniai 1 orang anak.
DAFTAR ISI
Halaman
DAFTAR TABEL... i
DAFTAR GAMBAR ... ii
DAFTAR LAMPIRAN ... iii
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan ... 2
Hipotesis ... 3
TINJAUAN PUSTAKA ... 4
Botani, Penyebaran dan Manfaat Daun Dewa ... 4
Senyawa Bioaktif Golongan Flavonoid ... 6
Pengaruh Naungan dan Pencahayaan terhadap Pertumbuhan Tanaman . 8 Pemupukan ... 10
BAHAN DAN METODE ... 12
Waktu dan Tempat ... 12
Bahan dan Alat ... 12
Metode Penelitian... 12
Pelaksanaan Penelitian ... 13
HASIL DAN PEMBAHASAN ... 17
Keadaan Umum Penelitian ... 17
Rekapitulasi Hasil Sidik Ragam Komponen Pertumbuhan ... 18
Rekapitulasi Hasil Sidik Ragam Komponen Produksi ... 21
Pengaruh Periode Naungan dan Pemupukan MgSO4.H2O terhadap Pertumbuhan Daun Dewa Pada Umur 1-16 MST ... 22
Pengaruh Periode Naungan dan Pemupukan MgSO4.H2O terhadap Pertumbuhan Daun Dewa Pada Umur 16 MST ... 23
Pengaruh Perlakuan terhadap Produksi Bobot Basah Daun Dewa ... 32
Kandungan Klorofil... 34
Kandungan Antosianin ... 35
Produksi Antosianin ... 36
SIMPULAN ... 41
Simpulan ... 41
DAFTAR PUSTAKA ... 42
DAFTAR TABEL
Halaman
1. Kandungan flavonoid (mg/g) pada kulit apel “janagold” yang dipengaruhi
posisi buah pada pohon ... 9
2. Rekapitulai hsasil sidik ragam pengaruh periode naungan dan pemupukan MgSO4.H2O terhadap pertumbuhan tanaman dan produksi antosianin daun dewa (Gynura pseudochina (L) DC) ... 18
3. Rekapitulasi hasil sidik ragam pengaruh periode naungan dan pemupukan MgSO4.H2O terhadap pertumbuhan tanaman dan produksi antosianin daun dewa (Gynura pseudochina (L) DC) ... 21
4. Pengaruh periode naungan terhadap tinggi tanaman daun dewa ... 24
5. Pengaruh dosis pupuk MgSO4.H2O terhadap tinggi tanaman daun dewa . 24 6. Pengaruh periode naungan terhadap jumlah daun dewa ... 25
7. Pengaruh dosis pupuk MgSO4.H2O terhadap jumlah daun dewa ... 25
8. Pengaruh periode naungan terhadap panjang daun dewa ... 26
9. Pengaruh dosis pupuk MgSO4.H2O terhadap panjang daun dewa ... 26
10.Pengaruh periode naungan terhadap lebar daun dewa ... 27
11.Pengaruh dosis pupuk MgSO4.H2O terhadap lebar daun dewa ... 27
12.Pengaruh periode naungan terhadap jumlah anakan daun dewa ... 28
13.Pengaruh dosis pupuk MgSO4.H2O terhadap jumlah anakan daun dewa. 28
14.Pengaruh periode naungan terhadap jumlah cabang daun dewa ... 29
15.Pengaruh dosis pupuk MgSO4.H2Oterhadap jumlah cabang daun dewa.. 29
16.Interaksi pengaruh periode naungan dan pemupukan MgSO4.H2O terhadap pertumbuhan daun dewa 16 MST ... 30
17.Pengaruh periode naungan dan pemupukan MgSO4.H2Oterhadap kandungan klorofil a, b dan rasio a/b daun dewa umur 16 MST ... 34
18.Pengaruh periode naungan dan pemupukan MgSO4.H2Oterhadap kandungan antosianin daun dewa umur 16 MST ... 35
DAFTAR GAMBAR
Halaman 1. Gynura pseoduchina (L) DC ... 4 2. Rumus bangun antosianin ... 7 3. Interaksi pengaruh periode naungan dan pemupukan MgSO4.H2Oterhadap produksi bobot basah daun dewa 16 MST ... 32 4. Hasil biomassa tanaman daun dewa pada berbagai perlakuan ... 33 5. Interaksi pengaruh periode naungan dan pemupukan MgSO4.H2Oterhadap produksi
DAFTAR LAMPIRAN
Halaman
1. Biosintesis antosianin ... 48
2. Metode analisis a dan b metode (Arnon 1949) ... 49
3. Metode analisis antosianin metode (Francis 1982) ... 50
4. Hasil analisis kesuburan tanah Cikabayan ... 51
PENDAHULUAN
Latar Belakang
Indonesia sebagai daerah tropis memiliki sekitar 90% dari 7000 spesies tumbuhan yang berkhasiat sebagai obat dan di antaranya adalah daun dewa (Badan POM 2001). Sebagian besar (hampir 80%) dari tumbuhan obat tersebut telah dipergunakan sebagai obat-obatan tradisional meskipun belum diuji secara klinis (Simanjuntak 1998). Negara-negara yang sudah maju banyak memanfaatkan sumber hayati dari daerah tropis untuk pengembangan ilmu biologi terapan seperti farmakologi dan bioteknologi dalam bidang rekayasa genetika (Posey dan Dutfield 1996), sehingga negara-negara berkembang di daerah tropis seperti Indonesia berpotensi menjadi konsumen bahan tanaman dan bahan baku obat dari negara-negara yang lain. Sebagai upaya untuk mengimbangi kemajuan teknologi di bidang tumbuhan obat pada negara-negara berkembang, maka perlu dilakukan penelitian dan uji klinis secara berkelanjutan.
Tanaman daun dewa mengandung berbagai unsur kimia, antara lain saponin, flavonoid, minyak atsiri, dan antikoagulan. Oleh karena itu daun dewa mempunyai banyak kegunaan dan salah satunya adalah untuk mengatasi stroke. Selain stroke, daun dan umbi tanaman daun dewa juga memiliki khasiat sebagai obat untuk: rematik, kencing manis, mencairkan darah yang membeku pada luka sekaligus menghentikan pendarahan dan pembengkakan payudara, membersihkan racun, mengatasi peradangan pada jaringan tubuh, seperti radang pankreas pada penderita diabetes militus dan infeksi herves (Hembing et al. 1996; Soedibyo 1998; Lemmens dan Bunyapraphatsara 2003; Kardinan dan Taryono 2003).
Cahaya merupakan faktor penting bagi pertumbuhan dan perkembangan tanaman, karena selain berperan dominan pada proses fotosintesis, juga sebagai pengendali, pemicu dan modulator respon morfogenesis khususnya pada tahap awal pertumbuhan tanaman (McNellis dan Deng 1995). Spektrum cahaya yang dibutuhkan tanaman berkisar antara panjang gelombang 400-700 nm, yang biasa disebut photosynthetically activeradiation (PAR).
naungan yang semakin tinggi dibanding dengan cahaya yang 100%. Kandungan enzim superoxide dismutase (SOD) mengalami peningkatan dengan semakin meningkatnya persentase naungan, sedangkan rasio klorofil a/b semakin rendah dan kloroplas mengalami pembengkakan (dilatasi). Struktur kloroplas antara 50 dan 25% naungan memiliki bentuk yang proposional. Naungan dan periode pencahayaan optimum yang menghasilkan antosianin, total flavonoid kasar (17.371%) dan kadar kuersetin tertinggi adalah naungan 50% dibandingkan dengan periode pencahayaan 25 dan 100%.
Disamping pengaturan intensitas cahaya (naungan) untuk mendukung pertumbuhan di lapang, pemberian unsur hara melalui pemupukan sangat penting untuk mekanisme produksi bioaktif (flavonoid/ antosianin) pada tanaman daun dewa. Magnesium dan sulfur yang merupakan unsur hara yang akan dicobakan pada penelitian ini memiliki peran spesifik pada mekanisme produksi senyawa flavonoid. Menurut Hornok (1992) sulfur dalam bentuk SO42- merupakan elemen esensial dalam sintesis protein dan produksi senyawa-senyawa metabolit sekunder dalam tanaman seperti flavonoid dan terpenoid, sedangkan magnesium dapat membentuk senyawa cianidin Mg-compleks yang merupakan salah satu aglikon antosianin (Vickery dan Vickery 1981). Penambahan kandungan Mg dalam tanah dapat dilakukan dengan pemberian pupuk Mg yaitu kieserit (magnesium sulfate/ MgSO4.H2O) dengan kandungan 29% Mg dan 23% S. Penentuan dosis magnesium dan sulfur yang tepat untuk meningkatkan kandungan flavonoid daun dewa sangat penting untuk diketahui.
Tujuan
(1)Mengetahui pengaruh naungan terhadap pertumbuhan tanaman dan produksi antosianin daun dewa (Gynura pseudochina (L) DC).
(2)Mengetahui pengaruh dosis pupuk MgSO4.H2O terhadap pertumbuhan tanaman dan produksi antosianin tanaman daun dewa (Gynura pseudochina (L) DC).
(3)Mengetahui pengaruh interaksi antara naungan dan dosis pemupukan MgSO4.H2O terhadap pertumbuhan dan produksi kandungan senyawa bioaktif tanaman daun dewa (Gynura pseudochina (L) DC).
Hipotesis
(1)Ada periode naungan terbaik yang menghasilkan pertumbuhan dan produksi senyawa bioaktif tanaman daun dewa (Gynura pseudochina (L) DC).
(3)Ada interaksi terbaik naungan dan dosis pemupukan MgSO4.H2O terhadap pertumbuhan dan produksi senyawa bioaktif tanaman daun dewa (Gynura pseudochina (L) DC).
TINJAUAN PUSTAKA
Botani, Penyebaran Dan Manfaat Daun Dewa
kedalam famili asteraceae, marga gynura, tinggi mencapai 40-75 cm dan tumbuh tegak, berbatang pendek dan lunak, berbentuk segi lima, penampang lonjong, berambut halus dan berwarna ungu kehijauan.
Gambar 1 Gynura pseudochina (L) DC
Daunnya termasuk tunggal, tersebar mengelilingi batang, bertangkai pendek, berbentuk bulat lonjong, berbulu halus, ujung lancip, tepi bertoreh, pangkal meruncing, pertulangan menyirip, berwarna hijau, panjang daun sekitar 20 cm dan lebar 10 cm. Bunganya termasuk bunga majemuk yang tumbuh di ujung batang, bentuk bongkol, berbulu, kelopak hijau berbentuk cawan, benang sari kuning dan berbentuk jarum. Akarnya merupakan akar serabut, berwarna kuning muda, membentuk umbi sebagai tempat cadangan makanan (Winarto 2003; Heyne 1987). Daerah pertumbuhan daun dewa tersebar mulai dataran rendah sampai dataran tinggi yang mencapai ketinggian 1-1200 m di atas permukaan laut (dpl), namun paling banyak ditemui pada ketinggian 500 m dpl. Daun dewa menghendaki iklim pertumbuhan berupa curah hujan dengan kisaran 1500-3500 mm/tahun (iklim sedang sampai basah), tanah agak lembab sampai lembab serta subur (Syukur dan Hermani 2001)
Daun dewa merupakan tanaman obat yang banyak dimanfaatkan karena banyak khasiatnya antara lain untuk menurunkan kadar gula dalam darah, obat kulit, menyembuhkan migraine, hepatitis B dan anti tumor atau anti kanker. Di samping itu air perasan daun dewa dapat digunakan sebagai penurun panas dan menghilangkan bengkak-bengkak. Secara tradisional daun dewa telah banyak digunakan sebagai obat anti kanker. Pembuktian pada penelitian skala laboratorium menunjukkan bahwa ekstrak daun dewa mampu menghambat pertumbuhan tumor pada mencit (tikus) (Suharmiati dan Maryani 2003). Pada habitat asalnya, tanaman ini digunakan sebagai sumber sayuran sehat, sedangkan di pulau Jawa digunakan sebagai sumber obat khususnya untuk penyakit ginjal (Heyne 1987). Daun dan umbi tanaman ini mengandung bahan aktif seperti flavonoid, terpenoid, saponin, tannin, alkaloid dan minyak atsiri (Ratnaningsih et al. 1985; Syamsuhidayat dan Hutapea 1991; Nugroho et al. 2000; Siregar dan Utami 2002). Hasil penelitian Soetarno et al. (2000) menunjukkan bahwa senyawa flavonoid yang terkandung dalam daun dewa termasuk golongan glikosida kuersetin. Pada penelitian ini juga ditemukan delapan asam fenolat di antaranya asam klorogenat, asam kafeat, asam p-kumarat, asam p-hidroksi benzoate dan asam vanilat, sedangkan tiga asam fenolat lainnya belum teridentifikasi. Hasil penelitian Agusta et al. (1998) menunjukkan bahwa daun dewa mengandung 0.05% minyak atsiri dari bagian daunnya yang terdiri atas 22 komponen senyawa yang didominasi oleh seskuiterpena.
Senyawa Bioaktif Golongan Flavonoid
Flavonoid merupakan salah satu golongan fenol alam terbesar yang banyak terdapat dalam tumbuh tumbuhan hijau. Diperkirakan 2% dari seluruh karbon yang digunakan dalam proses fotosintesis oleh tumbuhan diubah menjadi flavonoid atau senyawa yang berkaitan dengannya (Markham 1988). Flavonoid juga salah satu senyawa aromatik dalam tanaman yang memberikan pengaruh menguntungkan bagi manusia (Jaakola 2003).
menimbulkan kerusakan sel sel pada tubuh (Miller 1996; Nakamura et al. 2000; Liu dan Guo 2006). Senyawa flavonoid bersifat antibakteri, antiinflamasi, antialergi, antimutagen, antineoplastik dan anti trombosit (Miller 1996; Nakamura et al. 2000; Trouilas et al. 2006; Lin et al. 2006). Senyawa flavonoid juga dapat meningkatkan aktivitas enzim lipase (Darusman et al. 2001)
Antosianin merupakan zat pewarna alami yang tergolong kedalam turunan benzopiran. Struktur utama turunan benzopiran ditandai dengan adanya dua cincin aromatik benzena (C6H6) yang dihubungkan dengan tiga atom karbon membentuk cincin. Antosianin merupakan pigmen alami yang dapat menghasilkan warna biru, ungu, violet, magenta dan kuning. Pigmen ini larut dalam air yang terdapat pada bunga, buah dan daun tumbuhan (Moss 2002). Antosianin terdapat dalam vakuola sel bagian tanaman. Vakuola adalah organel sitoplasmik yang berisikan air, serta dibatasi oleh membran yang indentik dengan membran tanaman (Kimbal 1993). Secara kimia antosianin merupakan turunan garam flavilum atau benziflavilum. Antosianin merupakan satuan gugus glikosida yang terbentuk dari gugus aglikon dan glikon (Markakis 1982). Terdapat lima jenis gula yang ditemui pada molekul antosianin, yaitu: glukosa, rhamnosa, galaktosa, xilosa dan arabinosa. Sedangkan senyawa-senyawa bentuk lainnya sangat jarang ditemui (Francis 1985).
Antosianin merupakan produk metabolisme sekunder yang menyebabkan warna merah jambu, ungu dan biru. Antosianin dibentuk dari asam Phenylalanine melalui lintasan sikimat di sitoplasma dan ditimbun dalam vakuola sel parenkim dewasa. PAL (phenylalanine Ammonia Lyase ) merupakan enzim kunci dalam metabolisme, aktivitasnya meningkat seiring dengan umur daun dan berhubungan dengan proses penuaan (Noh dan Spalding 1998), Buchanan et al. 2000). Lintasan pembentukan antosianin disajikan pada Gambar 3.
(2001) melaporkan bahwa antosianin memiliki efek farmakologi dan telah digunakan dalam perawatan berbagai penyakit inflamasi serta dapat mengurangi resiko serangan jantung karena sifat antioksidannya.
Antosianin mampu menghambat pertumbuhan sel kanker diantaranya sel kanker perut, kanker usus besar, kanker payudara, dan kanker paru-paru (Zhang et al. 2005). Penelitian Katsuba et al. (2003) menyatakan bahwa antosianin khususnya delphinidin yang diekstrak dari bilberry mampu menghambat pertumbuhan sel kanker darah (leukimia) dan colon carcinoma secara in vitro. Suprapta (2004) juga melaporkan bahwa antosianin dapat berfungsi sebagai pencegah tumbuhnya bibit penyakit kanker.
Gamba r 2 Rumus bangun antosianin
Pengaruh Naungan dan Pencahayaan Terhadap Pertumbuhan Tanaman Tanaman daun dewa dalam proses pertumbuhannya di lapangan membutuhkan intensitas cahaya tertentu dan tergolong tanaman toleran naungan. Di daerah Aceh ditemukan bahwa daun dewa dapat tumbuh baik pada cahaya yang masuk berkisar 75-90%, dan di Sulawesi tengah 50-75% (Hidayat 2000). Pertumbuhan daun dewa akan lebih baik pada naungan 25%. Daun dewa tergolong tumbuhan lindung, karena dapat tumbuh dan tahan pada tempat dengan intensitas cahaya rendah, dan idealnya memperoleh 60% sinar matahari (Suharmiati dan Maryani 2003).
Hasil penelitian Sopandie et al. (2003a) pada tanaman padi gogo menyebutkan bahwa morfologi daun tanaman dan kandungan klorofil a, b serta nisbah klorofil a/b berbeda antara tanaman toleran dan peka terhadap naungan. Luas daun genotype padi gogo toleran naungan lebih tinggi dibandingkan dengan genotype yang peka, tetapi ketebalan daun, ketebalan mesofil dan kerapatan stomata rendah. Nisbah klorofil a/b pada genotipe toleran dan peka terjadi penurunan pada naungan 50% dibandingkan dengan control, namun penurunan yang tajam terjadi pada genotype peka.
Hidema et al. (1992) melaporkan bahwa intensitas cahaya rendah menurunkan nisbah klorofil a/b, yang disebabkan oleh peningkatan klorofil b pada tanaman yang ternaungi, yang berkaitan dengan peningkatan klorofil a/b pada Light Harvesting Complex II (LHC II). Membesarnya antena untuk fotosistem II ini akan meningkatkan efisiensi pemanenan cahaya. Efisiensi respirasi juga lebih tinggi pada tanaman toleran naungan. Menurut Sopandie et al. (2003b) pada tanaman padi gogo toleran naungan yang ditumbuhkan pada kondisi gelap memiliki efisiensi respirasi yang tinggi dengan kandungan pati dan karbohidrat yang lebih tinggi disbandingkan dengan tanaman yang peka kondisi gelap.
Adaptasi tanaman terhadap naungan menurut Levitt (1980) dilakukan melalui : 1) mekanisme penghindaran (avoidance) terhadap kekurangan cahaya, dan 2) mekanisme toleran terhadap kekurangan cahaya. Mekanisme penghindaran oleh tanaman dengan cara meningkatkan luas area penangkapan cahaya dan meningkatan penangkapan cahaya per unit luas fotosintesis, sedangkan pada mekanisme toleran, tanaman akan menurunkan titik kompensasi cahaya dan mengurangi laju respirasi di bawah titik kompensasi cahaya.
Cahaya sangat penting untuk fotosintesis, tetapi terdapat kemungkinan terjadinya stress oksidatif pada intensitas cahaya yang tinggi (tanpa naungan). Intensitas cahaya yang tinggi (tanpa naungan) menyebabkan proses fotosintesis akan mengalami penurunan karena penghambatan oleh cahaya yang tinggi (photoinhibition) yang memproduksi radikal bebas (O2) yang tinggi dapat menyebabkan kerusakan membran tylakoid pada kloroplas, kerusakan pada pusat reaksi dan penghambatan tranpor electron pada FS II (Hideg 1997).
klorofil a, klorofil b, dan karatenoid xantofil menyerap PAR terbaik pada panjang gelombang tertentu. Klorofil a menyerap cahaya tertinggi pada kisaran panjang gelombang 420 dan 660 nm. Klorofil a menyerap cahaya tertinggi pada kisaran panjang gelombang 420 dan 660 nm. Klorofil b menyerap cahaya paling efektif pada panjang gelombang 440 dan 640 nm, sedangkan karotenoid termasuk xanthofil mengabsorbsi cahaya pada panjang gelombang 425 dan 470 nm (Salisbury dan Ross 1992).
Salah satu enzim yang bekerja untuk menghambat kerusakan pusat reaksi pada proses photoinhibition adalah superoxide dismutase (SOD) (Ismail et al. 2001; Slooten 1995; Yu et al. 1999). Pengamatan pada aktivitas enzim ini akan membantu pembahasan pada respon tanaman pada lama pencahayaan.
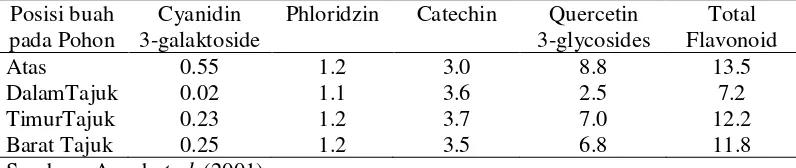
Intensitas cahaya juga berperan penting pada pembentukan senyawa metabolit sekunder dalam tanaman. Awad et al. (2001) melaporkan bahwa intensitas cahaya yang berbeda dapat menghasilkan kandungan flavonoid yang berbeda pada kulit buah apel kultivar “ janagold ” (Tabel 1).
Tabel 1 Kandungan flavonoid (mg/g) pada kulit apel “janagold” yang dipengaruhi posisi buah pada pohon
Posisi buah pada Pohon
Cyanidin 3-galaktoside
Phloridzin Catechin Quercetin 3-glycosides Total Flavonoid Atas DalamTajuk TimurTajuk Barat Tajuk 0.55 0.02 0.23 0.25 1.2 1.1 1.2 1.2 3.0 3.6 3.7 3.5 8.8 2.5 7.0 6.8 13.5 7.2 12.2 11.8 Sumber : Awad et al. (2001)
Kandungan triterpenoid, steroid, dan flavanoid dihasilkan cukup banyak oleh tanaman pegagan (Centalla asiatica L. (Urban)) jenis besar pada naungan 20%, sedangkan pada naungan 55-75% kandungan ketiga golongan metabolit sekunder tersebut mengalami penurunan (Rahmawaty 2004).
Pemupukan
melalui tanah. Pupuk ini baik untuk jenis tanah kecuali tanah masam sebaiknya dipakai dolomit agar menaikkan pH tanah (Tisdale et al. 1985). Penambahan pupuk magnesium (Mg) dan sulfur (S) pada tanaman daun dewa diharapkan dapat meningkatkan kapasitas fotosintesis dan hasil metabolisme sekunder tanaman (senyawa bioaktif).
Magnesium
Magnesium (Mg) adalah unsur hara makro esensial. Tanaman mengambil unsur ini dalam bentuk ion Mg2- melalui intersepsi dan aliran massa. Dibanding dengan N dan K, kebutuhan terhadap tanaman terhadap Mg relatif rendah, sehingga sering disebut unsur makro sekunder. Magnesium berperan sebagai penyusun klorofil, mengaktifkan enzim pada proses fosforilasi dan fotosintesis, serta translokasi karbohidrat (Marschner 1995). Magnesium diperlukan ebagai aktivator enzim pada metabolisme karbohidrat dan terutama dalam siklus asam sitrat yang penting dalam respirasi sel (Leiwakabessy 1988). Kekurangan Mg dapat menghambat fotosintesis karena hambatan pada transport fosfor (Frederick dan Linch 1985).
Penambahan kandungan Mg dalam tanah adalah dolomitic limestone (CaCO3 + MgCO3) dengan kandungan 6-12% Mg, Kieserite (magnisium sulfate) (MgSO4.H2O) dengan kandungan 18% Mg serta magnesium oxide (MgO) dengan kandungan 50-55% Mg (Jones 1998).
Sulfur
Sulfur (S) diperoleh melalui tanah dan udara yang masing-masing dalam bentuk anion sulfat (SO42-) dan sulfur dioksida (SO2). Sulfur dikenal sebagai faktor pembatas yang intakenya sebanding dengan kebutuhan fosfor pada daerah tropis. Sulfur merupakan elemen esensial yang berhubungan dengan sintesis protein. Sulfur dalam bentuk (SO42-) berperan pada produksi seyawa-senyawa metabolit sekunder dalam tanaman seperti flavonoid dan terpenoid (Hornok 1992). Gejala kekurangan unsur ini mirip dngan gejala kekurangan N yaitu tanaman berwarna pucat, terkadang berwarna coklat-kuning terang atau seperti warna jerami, dan pertumbuhannya terhenti (Ahn 1993). Kekurangan S menghambat sintesis protein (Marschner 1995) dan S dalam bentuk SO42- menghambat sintesis senyawa metabolit sekunder terutama pada golongan flavonoid (Vagujfalvi 1992).
HASIL DAN PEMBAHASAN
Keadaan Umum Penelitian
Hasil analisis tanah sebelum perlakuan dilakukan di laboratorium Departemen Ilmu Tanah Sumberdaya Lahan IPB. Lahan penelitian tergolong masam dengan pH H2O sebesar 4.50, dan bertekstur liat karena kandungan liatnya lebih dari 30%. KTK yang terdapat didalamnya tergolong rendah yaitu 10.88 me/100 g, sehingga kekuatan mengikat unsur hara sangat rendah (Lampiran 4).
Lingkungan sekitar lahan penelitian banyak ditumbuhi gulma dari jenis rumput seperti Cynodon dactylon, Axonopus compressus dan dari jenis gulma berdaun lebar Borreria alata, Mimosa sp dan Euphorbia hitra. Pembersihan gulma sering dilakukan secara manual. Tanaman juga mengalami serangan hama kupu-kupu belalang dan ulat. Ketiga hama ini menimbulkan kerusakan pada daun yang meninggalkan bekas gigitan. Usaha pencegahan yang dilakukan dengan menggunakan pestisida alami berupa larutan daun nimba dan menanami sekeliling lingkungan penelitian dengan jinten. Namun usaha ini masih belum bisa mengurangi serangan ulat dan belalang secara cepat. Meskipun demikian akibat yang ditimbulkan oleh hama ini tidak begitu mengganggu pertumbuhan dan perkembangan tanaman. Untuk itu dilakukan pencegahan dengan cara lain yaitu dengan menggunakan florbac dan decis EC dengan konsentrasi 1 cc/l.
Rekapitulasi Hasil Sidik Ragam Komponen Pertumbuhan
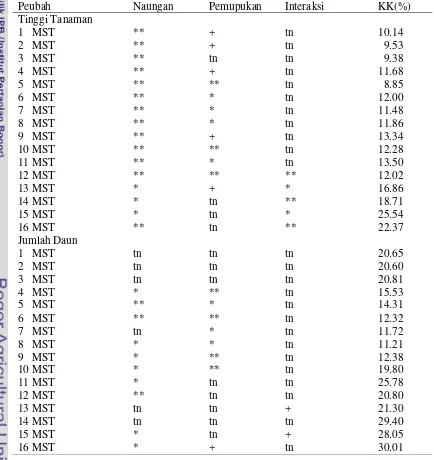
Rekapitulasi hasil sidik ragam komponen pertumuhan tanaman dapat dilihat pada Tabel 2.
Tabel 2 Rekaptulasi hasil sidik ragam pengaruh periode naungan dan pemupukan MgSO4.H2O terhadap pertumbuhan tanaman dan produksi antosianin daun dewa (Gynura pseudochina (L)DC)
Peubah Naungan Pemupukan Interaksi KK(%)
Tinggi Tanaman
1 MST ** + tn 10.14
2 MST ** + tn 9.53
3 MST ** tn tn 9.38
4 MST ** + tn 11.68
5 MST ** ** tn 8.85
6 MST ** * tn 12.00
7 MST ** * tn 11.48
8 MST ** * tn 11.86
9 MST ** + tn 13.34
10 MST ** ** tn 12.28
11 MST ** * tn 13.50
12 MST ** ** ** 12.02
13 MST * + * 16.86
14 MST * tn ** 18.71
15 MST * tn * 25.54
16 MST ** tn ** 22.37
Jumlah Daun
1 MST tn tn tn 20.65
2 MST tn tn tn 20.60
3 MST tn tn tn 20.81
4 MST * ** tn 15.53
5 MST ** * tn 14.31
6 MST ** ** tn 12.32
7 MST tn * tn 11.72
8 MST * * tn 11.21
9 MST * ** tn 12.38
10 MST * ** tn 19.80
11 MST * tn tn 25.78
12 MST ** tn tn 20.80
13 MST tn tn + 21.30
14 MST tn tn tn 29.40
15 MST * tn + 28.05
Peubah Naungan Pemupukan Interaksi KK (%) Panjang Daun
1 MST ** tn tn 9.11
2 MST ** tn tn 9.95
3 MST ** + tn 10.75
4 MST ** ** tn 8.75
5 MST ** tn tn 17.24
6 MST ** * tn 13.65
7 MST ** * tn 13.56
8 MST ** + tn 14.14
9 MST ** * tn 14.84
10 MST ** * tn 13.60
11 MST ** tn tn 15.84
12 MST ** + tn 14.81
13 MST ** tn tn 18.77
14 MST * tn tn 26.13
15 MST * tn tn 26.70
16 MST + tn tn 25.22
Lebar Daun
1 MST ** * tn 8.44
2 MST ** * tn 8.33
3 MST ** + tn 10.82
4 MST ** * tn 9.61
5 MST ** + tn 11.18
6 MST ** * tn 12.73
7 MST ** tn tn 20.34
8 MST ** tn tn 17.55
9 MST ** * tn 14.01
10 MST ** tn tn 28.46
11 MST ** tn tn 19.51
12 MST ** * tn 13.19
13 MST ** * tn 18.56
14 MST ** tn tn 26.38
15 MST tn tn tn 15.20
Peubah Naungan Pemupukan Interaksi KK (%) Jumlah Cabang
4 MST1) + tn tn 18.68
5 MST1) tn tn tn 26.97
6 MST1) tn tn tn 32.60
7 MST1) tn tn tn 21.93
8 MST tn tn tn 24.82
9 MST tn tn tn 23.49
10 MST tn * tn 22.38
11 MST tn tn tn 20.30
12 MST tn + tn 20.13
13 MST tn tn ** 20.00
14 MST tn tn ** 20.00
15 MST * + ** 24.64
16 MST tn tn tn 25.25
Jumlah Anakan
1 MST1) tn tn tn 18.13
2 MST1) tn tn tn 15.21
3 MST1) tn tn tn 17.79
4 MST * * + 25.07
5 MST tn + tn 19.27
6 MST tn * tn 18.81
7 MST tn tn * 16.83
8 MST * tn tn 17.88
9 MST * ** * 13.58
10 MST * tn tn 22.19
11 MST + tn tn 23.39
12 MST ** tn tn 22.91
13 MST * tn tn 23.18
14 MST * tn tn 30.69
15 MST * tn tn 19.30
16 MST ** * tn 30.62
Keterangan :
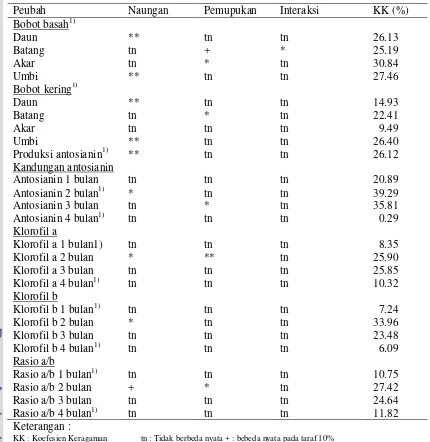
Rekapitulasi Hasil Sidik Ragam Komponen Produksi
[image:30.612.93.523.219.661.2]Rekapitulasi hasil sidik ragam komponen produksi dapat dilihat pada Tabel 3. Tabel 3 Rekaptulasi hasil sidik ragam pengaruh periode naungan dan pemupukan
MgSO4.H2O terhadap pertumbuhan tanaman dan produksi antosianin daun dewa (Gynura pseudochina (L) DC)
Peubah Naungan Pemupukan Interaksi KK (%)
Bobot basah1)
Daun ** tn tn 26.13
Batang tn + * 25.19
Akar tn * tn 30.84
Umbi ** tn tn 27.46
Bobot kering1)
Daun ** tn tn 14.93
Batang tn * tn 22.41
Akar tn tn tn 9.49
Umbi ** tn tn 26.40
Produksi antosianin1) ** tn tn 26.12
Kandungan antosianin
Antosianin 1 bulan tn tn tn 20.89
Antosianin 2 bulan1) * tn tn 39.29
Antosianin 3 bulan tn * tn 35.81
Antosianin 4 bulan1) tn tn tn 0.29
Klorofil a
Klorofil a 1 bulan1) tn tn tn 8.35
Klorofil a 2 bulan * ** tn 25.90
Klorofil a 3 bulan tn tn tn 25.85
Klorofil a 4 bulan1) tn tn tn 10.32
Klorofil b
Klorofil b 1 bulan1) tn tn tn 7.24
Klorofil b 2 bulan * tn tn 33.96
Klorofil b 3 bulan tn tn tn 23.48
Klorofil b 4 bulan1) tn tn tn 6.09
Rasio a/b
Rasio a/b 1 bulan1) tn tn tn 10.75
Rasio a/b 2 bulan + * tn 27.42
Rasio a/b 3 bulan tn tn tn 24.64
Rasio a/b 4 bulan1) tn tn tn 11.82
Keterangan :
KK : Koefesien Keragaman tn : Tidak berbeda nyata + : bebeda nyata pada taraf 10%
Pengaruh Periode Naungan dan Pemupukan MgSO4.H2O terhadap Pertumbuhan
Daun Dewa Pada Umur 1-16 MST
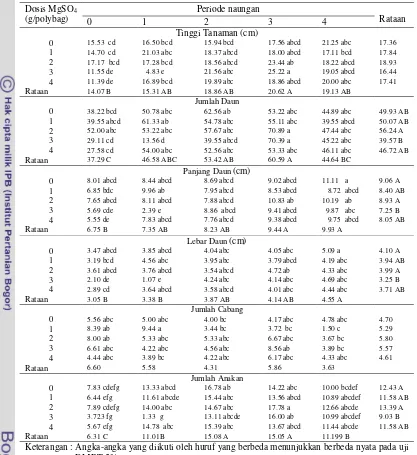
Pemberian MgSO4.H2O nyata meningkatkan semua peubah pertumbuhan tanaman kecuali jumlah cabang. Berdasarkan grafik pertumbuhan tinggi tanaman (Tabel 4) terlihat bahwa pertumbuhan puncak tinggi tanaman terjadi pada waktu 10-13 MST. Umur 14-16 MST keempat perlakuan mengalami penurunan tinggi tanaman akibat serangan belalang dan ulat, sehingga mengakibatkan hilangnya ujung daun tertinggi. Berdasarkan Tabel 6 jumlah daun naik mulai 8 MST, namun pada umur 14-16 MST terjadi penurunan jumlah daun.
Berdasarkan Tabel 8 pertumbuhan puncak tertinggi panjang daun terjadi pada waktu 8-10 MST, kemudian pada umur 11-16 MST terjadi penurunan panjang daun akibat kematian sel-sel dan jaringan daun. Kematian sel-sel dan jaringan daun terjadi akibat umur daun yang sudah tua dan dipengaruhi kondisi iklim yang kering. Tabel 10 menunjukkan bahwa pemberian pupuk MgSO4.H2O nyata meningkatkan lebar daun pada umur 10 MST kemudian setelah 11 MST semua perlakuan mengalami penurunan pada lebar daun.
Tanaman induk mengalami pertumbuhan (tinggi tanaman, jumlah daun, panjang dan lebar daun) maksimal pada 8 MST. Setyamijaya (1986) menyatakan bahwa nitrogen merupakan unsur yang dominan dibanding unsur yang lainnya dalam pertumbuhan vegetatif. Namun untuk mencapai pertumbuhan yang optimum harus didukung oleh kecukupan P dan K. (Tripatmasari 2008) menyatakan bahwa tinggi tanaman, jumlah daun, panjang dan lebar daun sampai 8 MST mengalami pertumbuhan maksimal dengan dua sink, yaitu cabang dan anakan. Setelah tanaman induk maksimal pertumbuhannya, kemudian terbentuk tiga sink yaitu pembentukan cabang, anakan dan umbi, sehingga terjadi pergeseran puncak grafik ke 11 dan 12 MST.
Pemberian pupuk MgSO4.H2O 2 g/polybag nyata meningkatkan pertumbuhan tinggi tanaman pada 13 MST dengan hasil tertinggi (19.84 cm), 12 MST jumlah daun terbanyak (69.73), 9 MST panjang daun tertinggi 13.37), 10 MST lebar daun tertinggi (6.57), 16 MST jumlah cabang terbanyak (5.80), dan 11 MST jumlah anakan terbanyak (17.26).
Pada tanaman daun dewa terjadi peningkatan komponen pertumbuhan pada umur 11-12 MST kemudian terjadi penurunan pertumbuhan umur 13-16 MST hal ini disebabkan karena pada umur 13-16 daun dewa mulai menguning juga membusuk dan secara visual pada umur 13 MST terjadinya pertumbuhan yang menurun dengan menguningnya daun serta rontoknya daun dari batang kemudian daun tanaman yang tumbuh lebih kecil dibandingkan daun utama, kemungkinan terjadi mobilisasi hara ke umbi.
Magnesium berperan sebagai sebagai penyusun klorofil, mengaktifkan enzim pada prose fosforilasi dan fotosintesis, serta translokasi karbohidrat (Mashcner 1995), sedangkan sulfur dalam bentuk SO42- berperan pada produksi senyawa-senyawa metabolit sekunder dalam tanaman seperti flavonoid dan terpenoid (Hornok 1992).
Pengaruh Periode Naungan dan Pemupukan MgSO4.H2O terhadap Pertumbuhan
Daun Dewa Pada Umur 16 MST
Tabel 16 Interaksi pengaruh periode naungan dan pemupukan MgSO4.H2O terhadap pertumbuhan daun dewa pada umur 16 MST
Dosis MgSO4
(g/polybag)
Periode naungan
Rataan
0 1 2 3 4
Tinggi Tanaman (cm)
0 15.53 cd 16.50 bcd 15.94 bcd 17.56 abcd 21.25 abc 17.36
1 14.70 cd 21.03 abc 18.37 abcd 18.00 abcd 17.11 bcd 17.84
2 17.17 bcd 17.28 bcd 18.56 abcd 23.44 ab 18.22 abcd 18.93
3 11.55 de 4.83 e 21.56 abc 25.22 a 19.05 abcd 16.44
4 11.39 de 16.89 bcd 19.89 abc 18.86 abcd 20.00 abc 17.41
Rataan 14.07 B 15.31 AB 18.86 AB 20.62 A 19.13 AB
Jumlah Daun
0 38.22 bcd 50.78 abc 62.56 ab 53.22 abc 44.89 abc 49.93 AB
1 39.55 abcd 61.33 ab 54.78 abc 55.11 abc 39.55 abcd 50.07 AB
2 52.00 abc 53.22 abc 57.67 abc 70.89 a 47.44 abc 56.24 A
3 29.11 cd 13.56 d 39.55 abcd 70.39 a 45.22 abc 39.57 B
4 27.58 cd 54.00 abc 52.56 abc 53.33 abc 46.11 abc 46.72 AB
Rataan 37.29 C 46.58 ABC 53.42 AB 60.59 A 44.64 BC
Panjang Daun (cm)
0 8.01 abcd 8.44 abcd 8.69 abcd 9.02 abcd 11.11 a 9.06 A
1 6.85 bdc 9.96 ab 7.95 abcd 8.53 abcd 8.72 abcd 8.40 AB
2 7.65 abcd 8.11 abcd 7.88 abcd 10.83 ab 10.19 ab 8.93 A
3 5.69 cde 2.39 e 8.86 abcd 9.41 abcd 9.87 abc 7.25 B
4 5.55 de 7.83 abcd 7.76 abcd 9.38 abcd 9.75 abcd 8.05 AB
Rataan 6.75 B 7.35 AB 8.23 AB 9.44 A 9.93 A
Lebar Daun (cm)
0 3.47 abcd 3.85 abcd 4.04 abc 4.05 abc 5.09 a 4.10 A
1 3.19 bcd 4.56 abc 3.95 abc 3.79 abcd 4.19 abc 3.94 AB
2 3.61 abcd 3.76 abcd 3.54 abcd 4.72 ab 4.33 abc 3.99 A
3 2.10 de 1.07 e 4.24 abc 4.14 abc 4.69 abc 3.25 B
4 2.89 cd 3.64 abcd 3.58 abcd 4.01 abc 4.44 abc 3.71 AB
Rataan 3.05 B 3.38 B 3.87 AB 4.14 AB 4.55 A
Jumlah Cabang
0 5.56 abc 5.00 abc 4.00 bc 4.17 abc 4.78 abc 4.70
1 8.39 ab 9.44 a 3.44 bc 3.72 bc 1.50 c 5.29
2 8.00 ab 5.33 abc 5.33 abc 6.67 abc 3.67 bc 5.80
3 6.61 abc 4.22 abc 4.56 abc 8.56 ab 3.89 bc 5.57
4 4.44 abc 3.89 bc 4.22 abc 6.17 abc 4.33 abc 4.61
Rataan 6.60 5.58 4.31 5.86 3.63
Jumlah Anakan
0 7.83 cdefg 13.33 abcd 16.78 ab 14.22 abc 10.00 bcdef 12.43 A
1 6.44 efg 11.61 abcde 15.44 abc 13.56 abcd 10.89 abcdef 11.58 AB
2 7.89 cdefg 14.00 abc 14.67 abc 17.78 a 12.66 abcde 13.39 A
3 3.723 fg 1.33 g 13.11 abcde 16.00 ab 10.99 abcdef 9.03 B
4 5.67 efg 14.78 abc 15.39 abc 13.67 abcd 11.44 abcde 11.58 AB
Rataan 6.31 C 11.01B 15.08 A 15.05 A 11.199 B
Keterangan : Angka-angka yang diikuti oleh huruf yang berbeda menunjukkan berbeda nyata pada uji DMRT 5%
[image:33.612.81.498.116.571.2]berpengaruh pada plastisitas dinding sel sehingga morfogenesis tanaman mengalami peningkatan. Tabel 16 juga memperlihatkan bahwa penambahan pupuk MgSO4.H2O tidak menyebabkan perbedaan yang nyata kecuali dengan pemberian 3 g MgSO4.H2O meningkatkan pertumbuhan tanaman dibandingkan tanpa pemupukan. Hal ini diduga karena semakin banyak pupuk yang ditambahkan akan memberikan hara yang cukup untuk tanaman, sehingga tanaman akan banyak melakukan metabolisme primer untuk menghasilkan biomassa.
Pengaruh Perlakuan terhadap Produksi Bobot Basah Daun Dewa
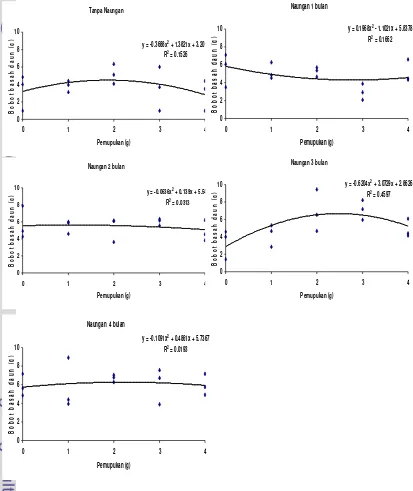
[image:35.612.80.493.172.663.2]Gambar 3 menunjukkan terjadi interaksi pengaruh periode naungan dan dosis pemupukan MgSO4.H2O dan nilai tertinggi untuk produksi bobot basah daun dewa tercapai dari perlakuan 3 bulan naungan dan dosis pupuk 3 g MgSO4.H2O /polybag.
Gambar 3 Interaksi pengaruh periode naungan dan pemupukan MgSO4.H2O terhadap produksi bobot basah daun dewa 16 MST
Tanpa Naungan
y = -0.3688x2 + 1.3821x + 3.2012
R2 = 0.1526
0 2 4 6 8 10
0 1 2 3 4
Pemupukan (g) B o b o t b a s a h d a u n ( g )
Naungan 1 bulan
y = 0.1968x2 - 1.1021x + 5.8378
R2 = 0.1662
0 2 4 6 8 10
0 1 2 3 4
Pemupukan (g) B o b o t b a s a h d a u n ( g )
Naungan 2 bulan
y = -0.0636x2 + 0.139x + 5.547
R2 = 0.0313
0 2 4 6 8 10
0 1 2 3 4
Pemupukan (g) B o b o t b a s a h d a u n ( g )
Naungan 3 bulan
y = -0.6204x2 + 3.0729x + 2.8626
R2 = 0.4597
0 2 4 6 8 10
0 1 2 3 4
Pemupukan (g) B o b o t b a s a h d a u n ( g )
Naungan 4 bulan
y = -0.1091x2 + 0.4861x + 5.7367 R2 = 0.0193
0 2 4 6 8 10
0 1 2 3 4
Terdapat perbedaan yang nyata antara yang tumbuh pada kondisi naungan dan pemupukan MgSO4.H2Otetapi bobot basah daun lebih tinggi pada naungan (Gambar 3). Pertambahan bobot basah daun tersebut disebabkan karena pertumbuhan tanaman pada kondisi naungan lebih pesat. Daun dewa telah dilaporkan dapat tumbuh baik pada kondisi ternaungi (Hidayat 2000, Januwati 1996, Suharmiati dan Maryani 2003). Daun dewa yang tumbuh di daerah ternaungi menghasilkan tanaman yag lebih tinggi dan daun yang lebih lebar (Suharmiati dan Maryani 2003). Faktor yang mempengaruhi bobot basah daun yaitu tinggi tanaman, jumlah daun, lebar daun, panjang daun. Semakin tinggi tanaman, maka semakin besar ukuran panjang dan lebar daun, sehingga bobot basah daun semakin besar. Penambahan pupuk akan meningkatkan pertumbuhan tanaman yang ditunjukkan oleh bobot basah daun.
Gambar 4 Hasil biomassa tanaman daun dewa pada berbagai perlakuan
Tanpa MgSO4.H2O 1 g MgSO4.H2O/polibag 2 g MgSO4.H2O /polibag
Kandungan Klorofil
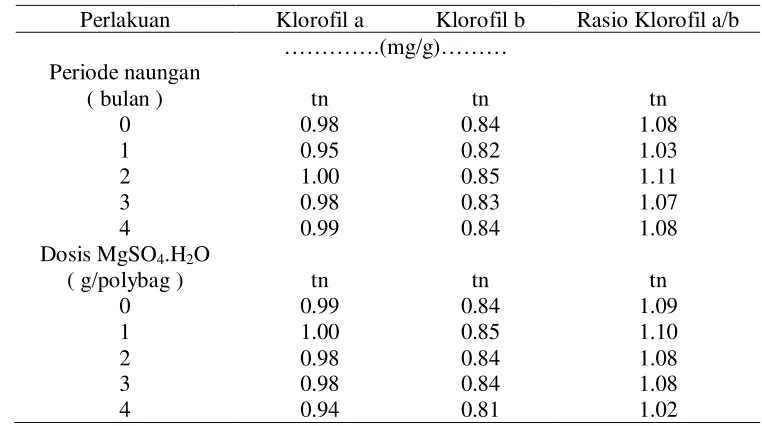
Tabel 17 memperlihatkan bahwa periode naungan dan pemupukan MgSO4.H2O tidak menyebabkan perbedaan yang nyata pada kandungan klorofil a,b dan rasio klorofil a/b .
Tabel 17 Pengaruh periode naungan dan pemupukan terhadap kandungan klorofil a, klorofil b, rasio klorofil a/b tanaman daun dewa umur 16 MST
Perlakuan Klorofil a Klorofil b Rasio Klorofil a/b ………….(mg/g)………
Periode naungan
( bulan ) tn tn tn
0 0.98 0.84 1.08
1 0.95 0.82 1.03
2 1.00 0.85 1.11
3 0.98 0.83 1.07
4 0.99 0.84 1.08
Dosis MgSO4.H2O
( g/polybag ) tn tn tn
0 0.99 0.84 1.09
1 1.00 0.85 1.10
2 0.98 0.84 1.08
3 0.98 0.84 1.08
4 0.94 0.81 1.02
[image:37.612.98.479.233.446.2]4 bulan (1.88 mg/g), sedangkan total klorofil tertinggi (0.53 mg/g) diperoleh pada naungan 50% selama 2 bulan meskipun tidak berbeda nyata dengan cahaya 100% selama 4 bulan.
Menurut Ghulamahdi et al. (2007), rasio klorofil a/b akan menunjukkan mekanisme adaptasi tanaman terhadap cekaman cahaya penuh khususnya untuk tanaman dewa. Daun dewa adalah tanaman yang hidup dan beradaptasi pada lingkungan dengan intensitas 50-60% atau lazimnya di bawah tegakan hutan. Rasio klorofil a/b pada naungan 50% lebih tinggi dari naungan 25%.
Kandungan Antosianin
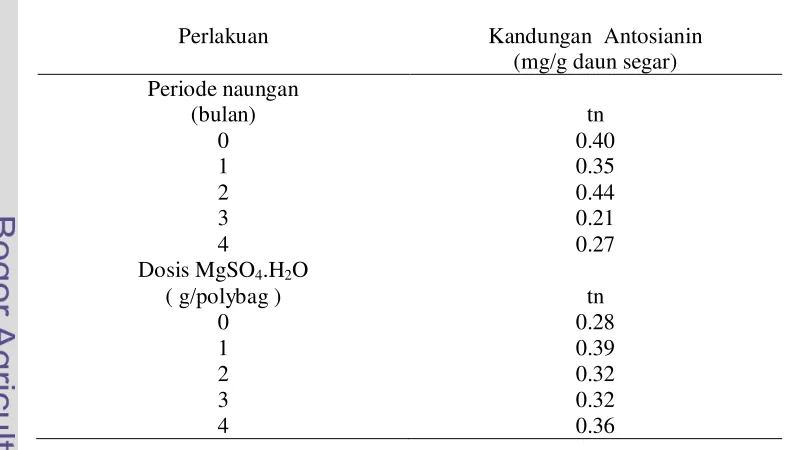
Periode naungan dan dosis MgSO4.H2O tidak menyebabkan perbedaan yang nyata pada kandungan antosianin. Kandungan antosianin pada berbagai naungan tercapai antara 0.21 – 0.44 mg/g daun segar. Kandungan antosianin pada berbagai pemupukan tercapai 0.28 – 0.39 mg/g daun segar (Tabel 18).
Tabel 18 Pengaruh periode naungan dan pemupukan MgSO4.H2O terhadap kandungan antosianin daun dewa umur 16 MST
Perlakuan Kandungan Antosianin
(mg/g daun segar) Periode naungan
(bulan) tn
0 0.40
1 0.35
2 0.44
3 0.21
4 0.27
Dosis MgSO4.H2O
( g/polybag ) tn
0 0.28
1 0.39
2 0.32
3 0.32
4 0.36
[image:38.612.87.485.439.664.2]pemberian naungan (0.40). Hal ini sejalan dengan penelitian Nirwan (2007) pada naungan 25% selama 3 bulan dan 1 bulan cahaya 100% dihasilkan kandungan antosianin tertinggi (0.157%) tetapi tidak berbeda nyata dengan kandungan antosianin pada naungan 50% selama 3 bulan dan 1 bulan cahaya 100% (0.156%) dan Tripatmasari (2008) bahwa pemupukan dan waktu panen tidak nyata meningkatkan kandungan antosianin pada perlakuan tanpa pupuk pada panen 7 bulan dengan kandungan antosianin tertinggi sebesar (0.696 mg/g daun segar). Untuk pengaruh naungan, beberapa penelitian lain sudah dilaporkan juga menunjukkan adanya pengaruh naungan terhadap kandungan antosianin. Pada tanaman kedelai, kandungan antosianin meningkat pada persentase naungan 50% (Lamuhuria et al. 2006), sedangkan pada beberapa klon daun dewa daun yang tumbuh pada kondisi naungan 100% cahaya menghasilkan kadar antosianin yang tidak berbeda nyata (Ghulamahdi et al. 2006). Kandungan antosianin tidak berbeda nyata karena salah satu bentuk adaptasi tanaman terhadap cahaya rendah sehingga kandungan antosianin tetap akan tetapi terjadi perubahan bentuk anatomi daun lebih lebar dan tipis sehingga mampu menangkap cahaya dan berpengaruh pada peningkatan bobot basah daun per tanaman dan akan mempengaruhi produksi antosianin.
Produksi Antosianin
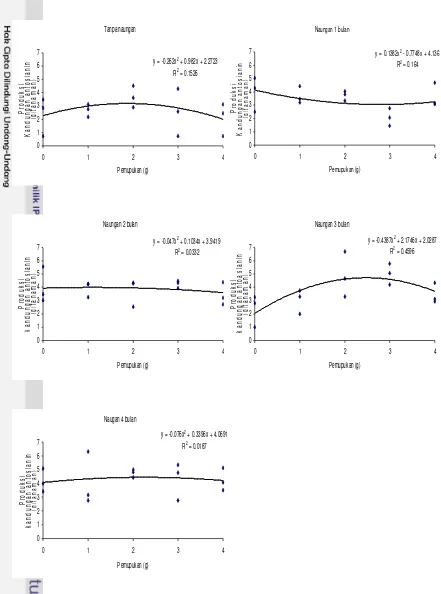
Gambar 5 Interaksi pengaruh periode naungan dan pemupukan MgSO4.H2O terhadap produksi antosianin daun dewa umur 16 MST.
Tanpa naungan
y = -0.262x2 + 0.982x + 2.2723
R2 = 0.1526
0 1 2 3 4 5 6 7
0 1 2 3 4
Pemupukan (g) P ro d u k s i K a n d u n g a n a n to s ia n in (g /t a n a m a n )
Naungan 2 bulan
y = -0.047x2 + 0.1034x + 3.9419
R2 = 0.0332
0 1 2 3 4 5 6 7
0 1 2 3 4
Pemupukan (g) P ro d u k s i k a n d u n g a n a n to s ia n in (g /t a n a m a n )
Naungan 3 bulan
y = -0.4387x2 + 2.1746x + 2.0287
R2 = 0.4596
0 1 2 3 4 5 6 7
0 1 2 3 4
Pemupukan (g) P ro d u k s i k a n d u n g a n a n to a s ia n in (g /t a n a m a n )
Naungan 1 bulan
y = 0.1382x2 - 0.7748x + 4.136 R2 = 0.164
0 1 2 3 4 5 6 7
0 1 2 3 4
Pemupukan (g) P ro d u k s i K a n d u n g a n a n to s ia n in (g /t a n a m a n )
Naugan 4 bulan
y = -0.076x2 + 0.3396x + 4.0691 R2 = 0.0187
0 1 2 3 4 5 6 7
0 1 2 3 4
[image:40.612.53.494.80.674.2]Hasil analisis regresi pada produksi daun dewa menunjukkan bahwa semakin banyak pupuk yang diberikan maka produksi antosianin daun dewa akan mengalami penurunan. Penurunan ini diakibatkan oleh daun baru yang tumbuh lebih kecil dibandingkan daun induk. Keadaan ini membuat produksi antosianin daun menurun dibanding awal percobaan, karena jumlah daun yang gugur akibat penuaan daun.
Penambahan pupuk akan meningkatkan pertumbuhan tanaman yang ditunjukkan oleh bobot basah daun dan faktor yang mempengaruhi bobot basah daun yaitu tinggi tanaman, jumlah daun, lebar daun dan panjang daun. Semakin tinggi tanaman, maka semakin besar ukuran panjang dan lebar daun, sehingga bobot basah daun akan semakin besar. Hal ini karena pada perhitungan sebelumnya yang merupakan nilai kandungan antosianin, sedangkan produksi antosianin adalah jumlah biomassanya dikalikan kandungan antosianin. Jadi kandungan antosianin yang tinggi belum tentu produksi antosianin juga tinggi, begitu juga sebaliknya jika kandungan antosianinnya rendah belum tentu produksinya juga rendah. Peningkatan bobot biomassa meningkatkan produksi antosianin per tananman.
Hasil penenelitian Nirwan (2007) menunjukkan bahwa produksi antosianin per tanaman tertinggi (0.172 g/tanaman) diperoleh pada naungan 25% selama 2 bulan sedangkan dosis pemupukan optimum yang menghasilkan produksi antosianin tertinggi (0.232 g/tanaman) adalah dosis pupuk kandang ayam 100g + SO4 0.8 g/tanaman yang merupakan dosis maksimum yang diberikan ke tanaman. Berdasarkan data kandungan antosianin untuk setiap gram bobot basah daun, kandungan antosianin tertinggi dihasilkan pada naungan 25% selama 3 bulan, tetapi bobot biomassa tanaman lebih rendah dibanding pada naungan 25% selama 2 bulan. Peningkatan bobot biomassa tersebut meningkatkan produki antosianin per tanaman. Tripatmasari (2008) menunjukkan bahwa pemberian pupuk kotoran sapi (20 ton/ha) meningkatkan produksi antosianin dan waktu panen 4 bulan dengan hasil tertinggi sebesar (13.41 mg/tanaman).
1995 dalam Whitehead 2000). Pemberian pupuk S pada daun dewa bertujuan untuk meningkatkan kandungan antosianin pada tanaman tersebut (Hornok 1992). Nirwan et al. (2007) menyatakan bahwa, untuk menghasilkan kadar SO4 jaringan daun dan total flavonoid daun dewa tertinggi, pemberian pupuk SO4 pada daun dewa dianjurkan sebanyak 0.8 g/tanaman.
BAHAN DAN METODE
Waktu dan Tempat
Penelitian dilakukan pada bulan Juli sampai Oktober 2007. Penelitian dilaksanakan di Instalasi Biofarmaka Darmaga (Unit Konservasi Budidaya Biofarmaka, Lembaga Penelitian Institut Pertanian Bogor), Cikabayan, Darmaga, Bogor. Kebun Percobaan terletak pada ketinggian 250 m di atas permukaan laut (dpl) dengan jenis tanah Latosol. Analisis bahan bioaktif dilaksanakan di Laboratorium RGCI Institut Pertanian Bogor.
Bahan dan Alat
Bahan tanaman yang akan digunakan pada penelitian ini adalah bahan tanaman hasil skrining pada perlakuan keragaman dari 9 klon yang diuji di lapangan. Satu klon terbaik asal Kalimantan Timur dari hasil penelitian sebelumnya tersebut akan dicobakan pada pemupukan MgSO4.H2O dan periode pencahayaan. Alat yang digunakan adalah
polybag ukuran 10 cm x 15 cm dan 35 cm x 30 cm, timbangan, Spektrofotometer, sentrifuse, oven, sprayer alat-alat penunjang laboratorium untuk analisis kandungan bioaktif secara kualitatif dan kuantitatif.
Metode Penelitian
2, 3 dan 4 bulan. Anak petak terdiri atas lima taraf dosis pemupukan MgSO4.H2O: 0, 1, 2, 3, 4 g MgSO4.H2O /tanaman.
Terdapat 25 kombinasi perlakuan. Setiap perlakuan diulang sebanyak 3 kali sehingga diperoleh 75 unit percobaan. Setiap unit percobaan terdiri dari 6 tanaman.
Model statistika untuk rancangan yang digunakan adalah: Yijk = µ + αi+ k+ ik+ βj+ (αβ)ij+ ijk
Keterangan:
Yijk : nilai pengamatan pada perlakuan petak utama ke-i, anak petak ke-j, ulangan ke-k
µ : rata-rata hasil pengamatan untuk setiap satuan percobaan.
αi : nilai tambah karena pengaruh naungan taraf ke-i
k : pengaruh ulangan ke-k ik : galat petak utama (naungan)
βj : pengaruh perlakuan dosis pemupukan taraf ke-j
(αβ)ij : interaksi antara perlakuan petak utama ke-i dengan anak petak ke-j
ijk : pengaruh galat anak petak (dosis pemupukan). i : untuk pengaruh naungan (1, 2, 3, 4, 5)
j : perlakuan dosis pemupukan (1, 2, 3, 4, 5) k : ulangan (1, 2, 3)
Hasil pengamatan dianalisis menggunakan analisis ragam (uji F) pada taraf α 5
%. Pada pengaruh nyata, uji dilanjutkan dengan uji jarak berganda Duncan (Duncan’s Multiple Range Test) pada taraf kesalahan α 5 %.
Pelaksanaan Penelitian Pembibitan
adalah tanah dan pupuk kandang dengan perbandingan 1 : 1. Periode pembibitan ini dilakukan dengan dua tahap. Tahap pertama pembibitan dilakukan pada wadah plastik. Bibit tanaman daun dewa ditumbuhkan sampai umur 1 (satu) minggu. Tahap berikutnya tanaman dipindahkan ke polybag ukuran 10 cm x 15 cm dan dibiarkan tumbuh sampai umur 4 minggu. Pemindahan ini dilakukan dengan tujuan agar perkembangan akar optimal yang akan mendukung pertumbuhan tanaman. Keseragaman bibit dilihat dari tinggi tanaman dan jumlah daun.
Penanaman
Penanaman dilakukan setelah tanaman berumur 4 minggu setelah pembibitan. Bibit tanaman dipindahtanamkan ke polybag dengan ukuran 35 cm x 30 cm yang diisi tanah sebanyak 6.5 kg/polybag, petak bedengan dengan ukuran 2 m x 5 m dengan jarak tanam 40 cm x 50 cm. Media tanah yang digunakan adalah tanah dengan menggunakan pupuk 2.7 g Urea/polybag, 3.9 g SP-36/polybag, 1.95 g KCl/polybag sebagai pupuk dasar.
Pemeliharaan
Pemeliharaan tanaman yang dilakukan meliputi penyiraman, penyiangan gulma, pemberantasan hama dan penyakit tanaman (secara manual atau menggunakan pestisida nabati). Selama masa pemeliharaan ini perlakuan diterapkan yaitu berupa pemotongan bunga dan pemupukan nitrogen.
Panen dan Pasca Panen
Pemanenan dilakukan setelah tanaman berumur 4 bulan. Untuk mendapatkan umbi daun dewa yang utuh, panen dilakukan dengan membongkar tanaman dalam tanah secara hati-hati. Umbi dibersihkan dari tanah yang melekat.
Pengamatan
Pengamatan meliputi pengamatan komponen pertumbuhan tanaman, komponen produksi dan komponen fisiologi tanaman. Sebagai data penunjang dilakukan analisa tanah dan analisa pupuk.
Komponen Pertumbuhan
1. Tinggi Tanaman (cm). Pengukuran tinggi tanaman dilakukan setiap minggu dengan cara mengukur dari pangkal sampai titik tumbuh yang terletak di ujung batang utama.
3. Panjang dan Lebar Daun. Pengukuran panjang dan lebar daun terbesar dilakukan setiap minggu.
4. Jumlah Cabang. Perhitungan jumlah cabang dilakukan setiap minggu dengan cara menghitung jumlah cabang yang keluar dari batang utama.
5. Jumlah Anakan. Perhitungan jumlah anakan dilakukan setiap minggu dengan cara menghitung jumlah anakan yang keluar dari batang utama.
Komponen produksi
1. Bobot basah tajuk, akar dan umbi tanaman. Pengukuran bobot seluruh bagian tanaman daun dewa dilakukan setelah panen dengan cara menimbang tajuk, akar dan umbi tanaman (g) persatuan tanaman yang dihasilkan.
2. Bobot kering tajuk, akar dan umbi tanaman. Pengukuran bobot seluruh bagian tanaman daun dewa dilakukan setelah panen dengan cara menimbang bobot kering tajuk, akar dan umbi (g) yang telah dioven pada suhu 105°C selama 2 hari.
3. Uji bahan bioaktif (analisis kuantitatif)
a. Analisis antosianinn daun (metode Francis 1982). Sampel daun yang digunakan adalah daun yang telah berbentuk sempurna dan daun yang terkena langsung matahari pada posisi daun ke3-5 dari arah pucuk. Metode kerja terdapat pada Lampiran 2.
b. Analisis klorofil (mg/g), dilakukan dengan metode Arnond (1949) yang telah dimodifikasi untuk menentukan rasio klorofil a/b (Lampiran 3).
Komponen fisiologi
Analisis klorofil. Analisis klorofil dilakukan satu bulan sekali selama empat bulan dengan mnggunakan metode Yosida et al. (1976) yang telah dimodifikasi. Sampel daun segar dihaluskan, ditambahkan 2 ml Aseton 80%, kemudian disentrifuse. Ekstraksi diulang lagi sampai tidak terbentuk warna, kemudian ditera sampai 10 ml. Spektrofotometer dilakukan pada panjang gelombang 645 dan 663 nm. Selanjutnya dilakukan penghitungan kandungan klorofil a dan b (mg/mg).
SIMPULAN
Simpulan
DAFTAR PUSTAKA
Agusta A, Jamal Y, Harapin M. 1998. Komponen minyak atsiri daun dewa (Gynura procumbens) dan kirinyu (Tithonia diversifolia). Laporan Tehnik. Proyek Penelitian, Pengembangan dan Pendayaan Biota Darat 1997/1998. Puslitbang Biologi-LIPI. Bogor .
Ahn PM. 1993. Tropical Soil and Fertilizer Use. Longman Group United Kingdom Limited. Malaysia.
Arnon DI. 1949. Cooper enzymes in isolated chloroplast, polyphenol oxidase in beta vulgaris. Plant Physiol. 24 : 1-15.
Awad MA, Wagenmakers PS, Jager AD. 2001. Effect of light on flavonoid and chorogenic acid levels in the skin of ”Jonagold” apples. Scentia Horticulture 88: 289-289.
Badan POM. 2001. Kebijakan Pengembangan Obat Alam / Herbal Medicine Indonesia. Badan POM. Jakarta.
Bartolene A, Mandap K, David KJ, Sevilla F III, Villanuev J a. 2005. SOS- red fluorescent protein (RFP) bioassay system for monitoring of antigenotoxic activity in plant extracts. Biosensors and Bioelectronics. 21 : 2114-2120
Burkill I H. 1953. A Dictionary of The Economic Products of The Malay Peninsula. Goverment of The Straits Settlements And Federated Malay State By The Crown Agents for The Colonies. Millbank. London.
Choung MG, Baek IY, Kang ST, Han WY, Shin DC, Moon HP, and Kang KH. 2001. Isolation and determination of anthocyanins in seed coats of black soybeans (Glycine max (L.)Merr.). J. Agric. Food Chem 49 : 5848-5851.
Darusman LK, Rohaeti E, Sulistiyani. 2001. Kajian senyawa golongan flavonoid asal tanaman bangle sebagai senyawa peluruh lemak melalui aktivitas lipase. Laporan Kegiatan. Pusat Studi Biofarmaka IPB. Bogor.
Delvin RM, Witham FH. 1983. Plant Physiology. (4 th edition). Quezon City: PWS Publisher. Pp 577.
DeMan JM. 1997. Kimia Makanan. Edisi Kedua. Bandung: Penerbit ITB.
Francis F. 1982. Analysis of Anthocyanin. Di dalam: P. Markakis (ed) Anthocyanin as Food Colors. New York: Academics Press.
Francis F. 1985. Pigmen and Other Colorations. Di dalam: Fennema, OR. Food Chemistry. New Yor: Marcel Dekker Inc.
Frederick TA, Linch RS. 1985. Physiology of abscission. Ann. Rev. Plant. Physiol. (6) : 216-217.
Ghulamahdi M, Aziz SA. 2007. Produksi senyawa bioaktif daun dewa (Gynura pseudochina (L) DC). Melalui studi agrobiofisik, studi keragaman, lama pencahayaan dan optimalisasi pemupukan. Laporan penelitian hibah bersaing. Bogor : Insitut Pertanian Bogor.
Hembing W, Setiawan D, Agustinus SW. 1996. Tanaman Obat Berkhasiat Obat di Indonesia. Penerbit Pustaka Kartini.
Heyne K. 1987. Tumbuhan Berguna Indonesia Jilid III. Badan Penelitian dan Pengembangan Kehutanan. Departemen Kehutanan, Jakarta.
Hoch WA, Singsaas EL, McCown BH. 2003. Resorption protection: Anthocyanin facititate nutrient recovery in auntumn by shielding leaves from potentially damaging light levels. Plant Physiol. 133:1296-1305.
Hidayat RS. 2000. Pengamatan habitat daun dewa. Warta Tumbuhan Obat Indonesia 6 : 14-15.
Hideg E. 1997. Free radical production in photosynthetis under stress conditions. In Hand Book of Photosynthetis. Pessarakli, M (Eds). Marcel Dekker, Inc., New York.
Hidema J, Markin A, Kurita Y, Mae T, Ohjima K. 1992. Changes in the level of chlorophyll and light harvesting chlorophyll a/b protein of ps ii in rice leaves agent under different irradiances from full expansion throught senescence. Plant Cell Physiol. 33 (8) : 1209-1214
Hornok L. 1992. Cultivation and Processing of Medicinal Plants. John Wiley and Sons New York.
Ismail BS, Chuah TS, Salmijah S, Khatijah HH. 2001. Role of superoxide dismutase and peroxidase activities in paraquat resistant redflower ragleaf (Crassocephalum crepidioides (Benth.) S. Moore). Aust. J. Agric. Res. 52: 583-586.
Jaakola L. 2003. Flavonoid Biosynthesis in Bilberry (Vaccinium myrtillus L.) Department of Biology University Of Oulu. Finland.
Januwati M. 1996. Cara perbanyakan tanaman daun dewa (Gynura procumbens (Lour) Merr.). Bogor: Prosiding Simposium Penelitian Tanaman Obat Alami VIII. 24-25 November. Hal 147-148.
Jones JB. 1998. Plant Nutrition Manual. CRC press. Boca Raton, Florida 33431.
Katsube N, Iwashita K, Tsushida T, Yamaki K, Kobori M. 2003. induction of apoptosis in cancer cells by bilberry (Vaccinium myrtillus) and the anthocyanin. J Agric Food Chem 51: 68-75.
Kimbal JW. 1993. Biologi. Jakarta: Penerbit Erlangga. HSS Tjitrosomo, N Sugiri, penerjemah.
Lamuhuria, Sopandie D, Khumaida N, Trikoesoemaningtyas, Darusman LK, June T. 2006. Mekanisme fisiologi pewarisan sifat toleransi kedelai (Glycine max (L.) Merill) terhadap intensitas cahaya rendah. Bogor: Makalah Seminar Sekolah Pascasarjana IPB.
Lemmens RHMJ, Bunyapraphatsara N. 2003. Plant resources of South East Asia: medicinal and poisonous plants 12 (3). Leiden: Backhuys Publishers.
Levitt J. 1980. Responses of Plant to Environmental Stresses. New York: Volume II 2nd Edition. Academic Press.
Leiwakabessy FM. 1988. Kesuburan Tanah. Jurusan Tanah Fakultas Pertanian Institute Pertanian Bogor. Bogor.
Lin XQ, He JB, Zha ZG. 2006. Simultaneous determination of quercetin and rutin at a multi-wall carbon-nanotube paste electrodes by reversing differential pulse voltammetry. Sensor And ActuatorsB. 119 : 608-614.
Markakis P. 1982. Anthocyanin as Food Colors. New York: Academis Press.
Marschner H. 1995. Mineral Nutrion of Higler Plants. (2nd edition). Academic press limited. London.
Markham KR. 1988. Cara Mengidentifikasi Flavonoid. Institut Teknologi Bandung. Bandung.
McNellis T, Deng XW. 1995. Light control of seedling morphogenic pattern. The Plant Cell 7 : 1749-1761.
Miller AL. 1996. Antioxidant flavonoids : structure, funtion and clinical usage. Alt. Med. Rev. 1 (2) : 103-111.
Moss BW. 2002. The Chemistry of Food Colour. Di dalam: D.B. MacDougall (ed). Colour in Food: Improving Quality. Washington: CRC Pres