PRODUKSI FLAVONOID DAUN DEWA (Gynura pseudochina (L.) DC)
ASAL KULTUR IN VITRO PADA KONDISI NAUNGAN
DAN PEMUPUKAN
NIRWAN
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa disertasi “ Produksi Flavonoid Daun Dewa (Gynura pseudochina (L.) DC Asal Kultur in Vitro pada Kondisi Naungan dan Pemupukan “ adalah karya saya sendiri dengan arahan Komisi Pembimbing dan belum diajukan dalam bentuk apapun kepada Perguruan Tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Bogor, Agustus 2007
NIRWAN. Produksi Flavonoid Daun Dewa (Gynura pseudochina (L.) DC) Asal Kultur in Vitro pada Kondisi Naungan dan Pemupukan. Dibimbing oleh Didy Sopandie, Latifah K. Darusman, Sandra A. Aziz dan Munif Ghulamahdi.
Daun dewa (Gynura pseudochina (L.) DC) adalah tumbuhan obat yang menghasilkan senyawa bioaktif berupa golongan senyawa flavonoid yang telah digunakan sebagai bahan obat tradisional alami untuk mengobati beberapa jenis penyakit khususnya tumor atau kanker pada manusia. Upaya untuk meningkatkan kadar senyawa bioaktif dalam tanaman dilakukan melalui perbaikan kualitas bahan tanam, optimalisasi pemanfaatan cahaya dan pemupukan. Untuk memenuhi hal tersebut, dilakukan percobaan dalam empat tahap masing-masing mempelajari : (1) multiplikasi tunas secara in vitro, (2) induksi akar dan antosianin secara in vitro, (3) pertumbuhan dan kandungan bioaktif bahan tanam asal in vitro dan setek pucuk pada berbagai periode pencahayaan dan (4) produksi flavonoid bahan tanam asal in vitro
pada berbagai periode pencahayaan dan pemupukan. Pada hasil studi in vitro
diperoleh komposisi media kultur terbaik yang menghasilkan plantlet dengan kandungan antosianin yang tinggi. Komposisi media MS dengan penambahan IAA 0.5 ppm dan sukrosa 30 g/l menghasilkan plantlet terbanyak (2.7) dan kandungan antosianin tertinggi (0.07%). Pada proses pertumbuhan di lapang yang menggunakan berbagai periode pencahayaan, bahan tanam asal kultur in vitro adalah bahan tanam terbaik yang menghasilkan pertumbuhan dan kandungan antosianin lebih tinggi (0.05%) dibanding setek pucuk (0.03%). Pada penelitian ini juga ditemukan periode pencahayaan yang menghasilkan pertumbuhan dan produksi flavonoid tertinggi, serta aspek mekanisme adaptasi fisiologi dan morfo-anatomi tanaman. Pada naungan 50% selama 3 bulan dan 1 bulan cahaya 100%, dihasilkan produksi total flavonoid (1.61g/tanaman) dan kuersetin (0.02g/tanaman) tertinggi, sedangkan produksi antosianin tertinggi (0.17%) diperoleh pada naungan 25% selama 2 bulan dan 2 bulan cahaya 100%. Adaptasi tanaman pada kondisi naungan juga menyebabkan peningkatan kandungan klorofil, aktivitas enzim SOD, tumpukan grana dan ukuran butir pati dari kloroplas serta penurunan jumlah stomata, trichoma dan ketebalan daun di akhir percobaan. Pada percobaan pemupukan diperoleh komposisi media tanam terbaik yang menghasilkan produksi flavonoid tertinggi. Perbaikan media tanam dengan pemupukan semakin meningkatkan pertumbuhan dan produksi flavonoid bahan tanam asal in vitro. Penggunaan dosis maksimum dari pupuk kandang ayam 100g + SO4 0.8g/tanaman menghasilkan produksi total flavonoid per tanaman (1.61g/tanaman) dan antosianin per tanaman (0.17g/tanaman) tertinggi, sedangkan produksi kuersetin per tanaman tertinggi (0.02g/tanaman) dihasilkan pada dosis pupuk kandang ayam 50g + SO4 0.4g/tanaman. Dari seluruh hasil penelitian yang diperoleh, bahan tanam daun dewa asal kultur in vitro menghasilkan pertumbuhan, produksi total flavonoid, antosianin dan kuersetin lebih tinggi pada kondisi naungan dan pemupukan dibanding cahaya 100% dan tanpa pemupukan.
NIRWAN. Flavonoids Production of in Vitro Gynura pseudochina (L.) DC in Shading Condition and Fertilizing. Under supervision of Didy Sopandie, Latifah K. Darusman, Sandra A. Aziz and Munif Ghulamahdi.
Gynura pseudochina (L.) DC is a medicinal plant that produce bioactives compound, such as flavonoids that are used for tumor or cancer medication for human. The content of bioactive compound can be increased through improving seedling quality, lighting periods and fertilizing. Four experiments have been carried out, they were : (1) in vitro shoot multiplications, (2) in vitro root and anthocyanins induction, (3) increasing growth and bioactives content of in vitro seedlings and shoot cuttings in different lighting periods, and (4) flavonoids production of in vitro
seedlings in different lighting periods and fertilizer. Results of in vitro studies, produced the best medium composition to produce plantlets with high anthocyanins content. Addition of IAA 0.5 ppm, sucrose 30g/l to MS medium produced higher number of plantlets (2.7) and anthocyanins content (0.07%). The field experiment using lighting periods showed that in vitro plantlets was better than shoot cuttings in the growth rate and anthocyanins content e.g: 0.05 and 0.03% respectively. From this research also found that lighting periods are produced the growth and highest flavonoids production, along with physiology and morpho-anatomycal adaptation mechanism. At the treatment of 50% shading up to three months and one month of full light, produced highest of total flavonoids (1.61g/plant) and quercetin content (0.02g/plant), while the highest of anthocyanins content (0.17g/plant) produced at the treatment of 25% shading up to two months and two months of full light. Plant adaptation to shading condition the increased total chlorophyll content, SOD enzymes activity, chloroplast size (stack granum and starch grain), while the number of stomata, trichome and the thickness of leaves were decreased at the end of the experiment. At the fertilizing experiment found that the best medium composition produced the highest flavonoids production. In vitro seedlings growth and flavonoids production were improved by the treatment of fertilizer. Maximum dosage of fertilizer was chicken manure 100g + SO4 0.8g/plant, which gave the highest of total flavonoids per plant (1.61g/plant) and anthocyanins per plant (0.17g/plant). While the quercetin productions per plant (0.02g/plant) produced at dosage of manure 50g + SO4 0.4g/plant. All results of experiments showed that the in vitro seedlings produced higher growth, total flavonoids production, anthocyanins and quercetin at shading condition and fertilizing compared to full light and without fertilizing.
© Hak cipta milik Institut Pertanian Bogor, tahun 2007
Hak cipta dilindungi
DAN PEMUPUKAN
NIRWAN
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Departemen Agronomi dan Hortikultura
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
DC) Asal Kultur in Vitro pada Kondisi Naungan dan Pemupukan
Nama Mahasiswa : Nirwan
Nomor Pokok : A 361030081
Disetujui Komisi Pembimbing,
Prof. Dr. Ir. Didy Sopandie, M.Agr. Prof. Dr. Ir. Latifah K. Darusman, M.S. Ketua Anggota
Dr. Ir. Sandra A. Aziz, M.S. Dr. Ir. Munif Ghulamahdi, M.S. Anggota Anggota
Diketahui,
Ketua Program Studi Agronomi Dekan Sekolah Pascasarjana
Dr. Ir. Satriyas Ilyas, M.S. Prof. Dr. Ir. Khairil A. Notodiputro, M.S.
Penulis lahir di Palu Sulawesi Tengah pada tanggal 20 Oktober 1966, merupakan putra kelima dari enam bersaudara dari Ayah Sahiri Rituntina (almarhum) dan Ibu Hj. Sohomi Lariua (almarhumah). Penulis menikah dengan Dra. Kusnaeni Ramadhani dan telah dikaruniai tiga orang anak.
Pada Juli 1985, diterima di Fakultas Pertanian Universitas Tadulako Palu jurusan Budidaya Pertanian program studi Agronomi dan menyelesaikan studi pada bulan Desember 1991. Bulan Juli 1996 mengikuti Program Pascasarjana S2 di Universitas Gadjah Mada Yogyakarta, Program Studi Agronomi dan menyelesaikan studi pada Maret 1999. Selanjutnya sejak Agustus 2003 mengikuti pendidikan S3 di Sekolah Pascasarjana Institut Pertanian Bogor Program Studi Agronomi. Sejak bulan Maret 1993 menjadi staf pengajar di Jurusan Budidaya Pertanian, Program Studi Agronomi Fakultas Pertanian Universitas Tadulako, Palu Sulawesi Tengah.
Syukur Alhamdulillah penulis panjatkan kehadirat Allah SWT atas hidayah dan rahmat-Nya sehingga penulis dapat menyelesaikan penelitian dan penulisan disertasi yang berjudul “ Produksi Flavonoid Daun Dewa (Gynura pseudochina (L.) DC) Asal Kultur in Vitro pada Kondisi Naungan dan Pemupukan “.
Penelitian dan penulisan disertasi ini berlangsung di bawah bimbingan Prof. Dr. Ir. Didy Sopandie, M. Agr, selaku Ketua Komisi Pembimbing, Prof. Dr. Ir. Latifah K. Darusman, M.S., Dr. Ir. Sandra A. Aziz, M.S., dan Dr. Ir. Munif Ghulamahdi, M.S. masing-masing sebagai Anggota Komisi Pembimbing. Pada kesempatan ini penulis menyampaikan banyak terima kasih dan penghargaan yang tulus atas waktu dan kesempatan yang telah diluangkan dalam mengarahkan dan membimbing penulis.
Penelitian dan penyelesaian disertasi ini sebagian didanai oleh Program Penelitian Payung yang diselenggarakan oleh Pusat Studi Biofarmaka Institut Pertanian Bogor dan Hibah Bersaing XIV tahun 2006, karena itu penulis menyampaikan banyak terima kasih kepada Prof. Dr. Ir. Latifah K. Darusman, M.S. selaku Kepala Pusat Studi Biofarmaka IPB, Dr. Ir. Munif Ghulamahdi, M.S., Dr. Ir. Sandra A. Aziz dan Irmanida Batubara, S.Si. M.Si., sebagai Ketua dan Anggota Tim Peneliti Hibah Bersaing XIV.
Penghargaan dan ucapan terima kasih yang tulus penulis sampaikan juga kepada:
1. Dirjen DIKTI yang telah memberikan Beasiswa BPPS.
2. Rektor Universitas Tadulako Palu yang telah memberikan izin tugas belajar dan sebagian bantuan dana penelitian.
3. Dekan Fakultas Pertanian Universitas Tadulako yang telah mengizinkan penulis untuk melanjutkan studi.
4. Rektor Institut Pertanian Bogor, Dekan Sekolah Pascasarjana dan Ketua Program Studi Agronomi yang telah menerima penulis untuk melanjutkan studi di Institut Pertanian Bogor.
5. Prof. Dr. Ir. Mappiratu, M.S., Prof. Dr. Ir. Fathurrahman, M.P. dan Prof. Dr. Ir. Abdul Main Labaso, M.S. yang telah memberikan rekomendasi kepada penulis untuk melanjutkan studi pada Program Studi Agronomi Sekolah Pascasarjana IPB. 6. Dr. Ir. Wahyu Q. Mugnisjah, M.Agr selaku Pembimbing Akademik saat penulis
perbaikan usulan penelitian dan pelaksanaan penelitian.
8. Dr. Ir. Nurul Khumaida, M.S selaku penguji luar komisi saat pelaksanaan ujian tertutup yang telah memberikan saran-saran dan koreksi untuk perbaikan disertasi. 9. Prof. Dr. Ir. Winiati Pudji Rahayu, M.S selaku penguji luar komisi saat
pelaksanaan ujian terbuka yang telah memberikan saran dan koreksi untuk
penyempurnaan tulisan ini. .
10.Prof. Dr. Ir. Slamet Susanto, M.Agr. selaku penguji luar komisi saat pelaksanaan ujian terbuka yang telah memberikan saran dan koreksi untuk penyempurnaan tulisan ini.
11.Kepala dan Staf Laboratorium Bioteknologi Tanaman Departemen Agronomi dan Hortikultura Fak. Pertanian IPB atas kerjasama, kebersamaan dan bantuannya. 12.Kepala dan Staf Instalasi Biofarmaka Cikabayan Pusat Studi Biofarmaka IPB atas
kerjasama, kebersamaan dan bantuannya.
13.Kepala beserta Staf Laboratorium Ekofisiologi Tanaman dan Laboratorium RGCI Fak. Pertanian IPB atas kerjasama, kebersamaan dan bantuannya.
14.Kepala dan Staf Laboratorium Histologi Seameo Biotrop Bogor atas kerjasama, kebersamaan dan bantuannya.
15.Kepala dan Staf Laboratorium Kimia Pusat Studi Biofarmaka IPB, Laboratorium Kimia Analitik Departemen Kimia FMIPA IPB dan PT. Biofarindo atas kerjasama, kebersamaan dan bantuannya.
16.Kepala dan Staf Laboratorium Ilmu Tanah Departemen Ilmu Tanah dan Sumberdaya Lahan Fakultas Pertanian Institut Pertanian Bogor atas kerjasama, kebersamaan dan bantuannya.
17.Kepala dan Staf Laboratorium Biologi Molekuler Institut Eijkman Jakarta atas kerjasama, kebersamaan dan bantuannya.
18.Kepala dan Staf Laboratorium Pasca Panen Cimanggu atas kerjasama, kebersamaan dan bantuannya.
19.Kepala dan Staf Stasion Klimatologi Darmaga atas bantuannya.
21.Ayahanda Sahiri Rituntina (alm) dan Ibunda Hj. Sohomi Lariua (alm) yang telah mendidik dan membesarkan serta selalu berpesan untuk menjadi orang yang taat beragama dan berbuat baik kepada sesama.
22.Ibu mertua M.N. Minten dan seluruh keluarga di Palu, Umi Mintarsih beserta seluruh keluarga di Bogor, Paman Yoli Lariua dan Paman Mayor (Pol) Asmu
Rituntina atas do’a, dorongan dan bantuannya.
23.Kakak, adik dan ponakan sekeluarga: Hj. Erni Sahiri, H. Awaluddin Runggo, Udin Sahiri, Rosmina Sahiri, Suwarni Sahiri, Marwan Karim, SE. M.Si., Mohammad Rizal Sahiri, Linda, SE. dan Hermawan, SE., atas iringan do’a dan motivasinya.
24.Istri tercinta Dra. Kusnaeni Ramadhani dan anak-anakku tersayang: Agrian Rizki Kuswanto, Ahmad Dwi Prasetya dan Ade Triyanto Hidayat atas do’a, dorongan, kesabaran, pengertian dan pengorbanannya.
25.Rekan-rekan di Fakultas Pertanian Universitas Tadulako, Himpunan Mahasiswa Pascasarjana asal Sulawesi Tengah di Bogor, Forum Mahasiswa Pascasarjana Program Studi Agronomi SPs. IPB dan Forum Mahasiswa Pascasarjana Sekolah Pascasarjana IPB (Forum Wacana), serta semua pihak yang telah memberikan dukungan dan bantuan.
Semoga karya ini bermanfaat bagi pengembangan teknologi dan ilmu pengetahuan khususnya di bidang pertanian. Amin.
Bogor, Agustus 2007
PENDAHULUAN... 1
Latar Belakang... 1
Rumusan Masalah... 3
Tujuan Penelitian... 4
Kerangka Pemikiran... 4
Hipotesis... 5
Ruang Lingkup Penelitian... 5
TINJAUAN PUSTAKA... 7
Botani, Penyebaran dan Manfaat Daun Dewa... 7
Senyawa Bioaktif Golongan Flavonoid... 9
Kultur In Vitro Tanaman Daun Dewa... 12
Pengaruh Naungan terhadap Pertumbuhan Tanaman... 14
Pupuk Organik dan An organik... 22
MULTIPLIKASI TUNAS DAUN DEWA(Gynura pseudochina (L.) DC) SECARA IN VITRO... 27
ABSTRAK... 27
ABSTRACT... 27
PENDAHULUAN... 28
Latar Belakang... 28
Tujuan... 29
BAHAN DAN METODE... 29
Waktu dan Tempat... 29
Bahan dan Alat... 29
Metode Penelitian... 29
HASIL DAN PEMBAHASAN... 33
Warna Daun... 33
Jumlah Tunas... 34
Jumlah Daun... 36
Tinggi Tunas... 37
Jumlah Akar... 39
Diameter Kalus dan Jumlah Plantlet... 41
SIMPULAN... 42
INDUKSI AKAR DAN ANTOSIANIN DAUN DEWA (Gynura pseudochina (L.) DC) SECARA IN VITRO... 43
ABSTRAK... 43
ABSTRACT... 43
PENDAHULUAN... 44
Latar Belakang... 44
Tujuan... 45
BAHAN DAN METODE... 45
Waktu dan Tempat... 45
Bahan dan Alat... 45
Jumlah Akar... 50
Tinggi Tunas dan Diameter Kalus... 51
Panjang Akar ... 53
Total Biomasa Plantlet, Jumlah Plantlet dan Total Antosianin 54 SIMPULAN... 56
PENGARUH PERIODE PENCAHAYAAN DAN SUMBER BAHAN TANAM TERHADAP PERTUMBUHAN DAN KANDUNGAN BIOAKTIF DAUN DEWA (Gynura pseudochina (L.) DC)... 57
ABSTRAK... 57
ABSTRACT... 57
PENDAHULUAN... 58
Latar Belakang... 58
Tujuan... 59
BAHAN DAN METODE... 60
Waktu dan Tempat... 60
Bahan dan Alat... 60
Metode Penelitian... 61
HASIL DAN PEMBAHASAN... 66
Pertumbuhan Tanaman... 66
Indeks Kehijauan Daun... 70
Indeks Luas Daun (ILD)... 72
Bobot Brangkasan, Bobot Basah Umbi dan Bobot Basah Tajuk... 74
Jumlah Stomata, Jumlah Trichoma dan Tebal Daun... 75
Laju Tumbuh Relatif (LTR), Nisbah Luas Daun (LAR) dan Laju Asimilasi Bersih (NAR)... 80
Kandungan Enzim Superoxide Dismutase (SOD) dan Klorofil Daun... 84
Kandungan Total Flavonoid dan Antosianin... 87
Analisis Korelasi Antara Peubah Pertumbuhan dan Anatomi Daun dengan Kandungan Antosianin... 90
SIMPULAN... 95
PENGARUH PERIODE PENCAHAYAAN DAN PEMUPUKAN TERHADAP PRODUKSI FLAVONOID DAUN DEWA (Gynura pseudochina (L.) DC) ASAL KULTUR IN VITRO... 96
ABSTRAK... 96
ABSTRACT... 96
PENDAHULUAN... 97
Latar Belakang... 97
Tujuan... 98
BAHAN DAN METODE... 99
Waktu dan Tempat... 99
Bahan dan Alat... 99
Metode Penelitian... 99
HASIL DAN PEMBAHASAN... 105
Bobot Basah Tajuk... 110
Laju Tumbuh Relatif (RGR), Nisbah Luas Daun (LAR) dan Laju Asimilasi Bersih (NAR)... 111
Indeks Kehijauan Daun dan Kandungan Klorofil Daun... 115
Struktur Kloroplas... 118
Kandungan N, P, K dan SO4 pada Jaringan Tanaman... 121
Kandungan Total Flavonoid, Antosianin dan Kuersetin... 123
Produksi Total Flavonoid, Antosianin dan Kuersetin Per Tanaman... 127
Analisis Korelasi Antara Peubah Pertumbuhan dengan Kandungan Antosianin... 130
SIMPULAN... 134
PEMBAHASAN UMUM... 135
SIMPULAN DAN SARAN... 143
Simpulan... 143
Saran... 144
DAFTAR PUSTAKA... 145
LAMPIRAN... 156
Nomor Halaman Teks
1. Kandungan flavonoid (mg/g) pada kulit apel ‘Jonagold’ yang
dipengaruhi posisi buah pada pohon... 21
2. Komposisi unsur hara kotoran ayam dan kotoran hewan lain... 22
3. Kombinasi perlakuan pemberian BAP dan IAA pada multiplikasi tunas daun dewa……….. 30
4. Pengaruh BAP terhadap warna daun tanaman daun dewa umur kultur 1-5 minggu setelah tanam (MST)……… 33
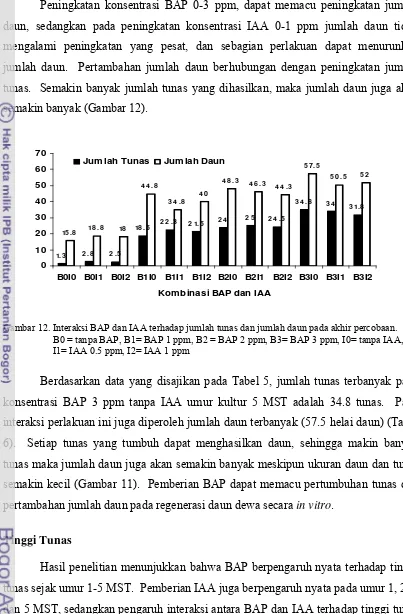
5. Interaksi BAP dan IAA terhadap jumlah tunas 1-5 MST……… 35
6. Interaksi BAP dan IAA terhadap jumlah daun 3-5 MST……… 36
7. Interaksi BAP dan IAA terhadap tinggi tunas 1-5 MST………. 38
8. Pengaruh BAP dan IAA terhadap jumlah akar 1-5 MST……… 39
9. Pengaruh BAP terhadap diameter kalus dan jumlah plantlet pada akhir percobaan... 41
10. Kombinasi perlakuan berbagai konsentrasi IAA dan sukrosa pada pembentukan plantlet daun dewa... 46
11. Interaksi IAA dan sukrosa terhadap jumlah tunas daun dewa umur kultur 1-8 MST... 48
12. Interaksi IAA dan sukrosa terhadap jumlah daun daun dewa umur kultur 1-8 MST... 49
13. Interaksi IAA dan sukrosa terhadap jumlah akar daun dewa umur kultur 1-8 MST... 50
14. Interaksi IAA dan sukrosa terhadap tinggi tunas dan diameter kalus daun dewa pada akhir percobaan... 51
15. Interaksi IAA dan sukrosa terhadap panjang akar plantlet daun dewa pada akhir percobaan... 53
16. Total Biomasa Plantlet, Jumlah plantlet dan total antosianin daun dewa pada akhir percobaan... 54
19. Panjang daun dan lebar daun pada berbagai periode pencahayaan
dan sumber bahan tanam daun dewa umur 16 MST... 68
20. Jumlah anakan dan jumlah cabang pada berbagai periode pencahayaan
dan sumber bahan tanam daun dewa umur 16 MST... 69
21. Pengaruh periode pencahayaan dan sumber bahan tanam terhadap
indeks kehijauan daun pada umur 2-16 MST... 71
22. Interaksi antara periode pencahayaan dan sumber bahan tanam
terhadap indeks kehijauan daun umur 4 MST... 72
23. Pengaruh periode pencahayaan dan sumber bahan tanam daun dewa
terhadap indeks luas daun (ILD) pada umur 0, 4, 12, dan 16 MST... 73
24. Interaksi antara periode pencahayaan dan sumber bahan tanam
terhadap ILD umur 8 MST...74
25. Pengaruh periode pencahayaan dan sumber bahan tanam daun dewa terhadap bobot brangkasan, bobot basah umbi dan bobot basah tajuk
pada saat panen (16 MST)... 75
26. Pengaruh periode pencahayaan dan sumber bahan tanam daun dewa terhadap jumlah stomata, jumlah trichoma dan tebal daun
pada saat panen (16 MST)... 76
27. Interaksi antara periode pencahayaan dan sumber bahan tanam
terhadap tebal daun (µm) umur 16 MST... 76
28. Pengaruh periode pencahayaan dan sumber bahan tanam daun dewa
terhadap RGR (g/g/hari) pada umur tanaman 0-4, 4-8, 12-16 MST ... 80
29. Interaksi antara periode pencahayaan dan sumber bahan tanam
terhadap RGR (g/g/hari) umur 8-12 MST... 81
30. Interaksi antara periode pencahayaan dan sumber bahan tanam
terhadap LAR (cm2/g) umur 12 MST... 82
31. Pengaruh periode pencahayaan dan sumber bahan tanam daun dewa
terhadap LAR (cm2/g) pada umur tanaman 0, 4, 8 dan 16 MST... 83
32. Pengaruh periode pencahayaan dan sumber bahan tanam daun dewa
terhadap NAR (g/cm2/hari) pada umur 0-4, 4-8 dan 12-16 MST... 83
33. Interaksi antara periode pencahayaan dan sumber bahan tanam
35. Pengaruh periode pencahayaan dan sumber bahan tanam terhadap kandungan klorofil a, klorofil b, rasio klorofil a/b dan total klorofil
umur 16 MST... 86
36. Interaksi antara periode pencahayaan dan sumber bahan tanam
terhadap kandungan antosianin (%) umur 16 MST... 88
37. Pengaruh periode pencahayaan dan bahan tanam daun dewa
terhadap kandungan total flavonoid umur 16 MST... 88
38. Koefisien korelasi antar peubah pertumbuhan, produksi, morfo- anatomi daun, kandungan enzim SOD, klorofil daun dan kandungan
antosianin... 91
39. Kombinasi perlakuan periode pencahayaan dan pemupukan...……... 100
40. Pengaruh periode pencahayaan dan pemupukan terhadap tinggi tanaman, jumlah daun, panjang daun, lebar daun, jumlah anakan dan
jumlah cabang daun dewa umur 16 MST ... 107
41. Pengaruh periode pencahayaan dan pemupukan daun dewa
terhadap indeks luas daun (ILD) pada umur 0, 4, 8 dan12 MST ... 109
42. Interaksi antara periode pencahayaan dan pemupukan terhadap
ILD umur 16 MST... 109
43. Pengaruh periode pencahayaan dan pemupukan daun dewa
terhadap bobot brangkasan, bobot basah umbi dan bobot basah tajuk
pada saat panen (16 MST) ... 110
44. Pengaruh periode pencahayaan dan pemupukan daun dewa. terhadap laju tumbuh relatif (RGR) (g/g/hari) pada umur tanaman
0-4, 4-8 dan 8-12 MST... 112
45. Interaksi antara periode pencahayaan dan pemupukan terhadap
RGR (g/g/hari) umur 12-16 MST... 112
46. Pengaruh periode pencahayaan dan pemupukan daun dewa terhadap nisbah luas daun (LAR) (cm2/g) pada umur tanaman
0, 4, 8 dan 16 MST ... 113
47. Interaksi antara periode pencahayaan dan pemupukan terhadap
LAR (cm2/g) umur 12 MST... 114
48. Interaksi antara periode pencahayaan dan pemupukan terhadap NAR
0-4, 8-12 dan 12-16 MST... 115
50. Interaksi antara periode pencahayaan dan pemupukan terhadap
indeks kehijauan daun umur 8 MST... 116
51. Pengaruh periode pencahayaan dan pemupukan terhadap indeks
kehijauan daun tanaman daun dewa umur 2-16 MST... 117
52. Pengaruh periode pencahayaan dan pemupukan daun dewa terhadap kandungan klorofil a, klorofil b, rasio klorofil a/b
dan total klorofil pada umur tanaman 16 MST... 118
53. Pengaruh periode pencahayaan dan pemupukan daun dewa
terhadap kandungan N, P, K dan SO4 pada jaringan tanaman... 122
54. Pengaruh periode pencahayaan dan pemupukan daun dewa terhadap
kadar antosianin umur 16 MST... 124
55. Koefisien korelasi antar peubah pertumbuhan, produksi, klorofil
Nomor Halaman Teks
1. Alur kegiatan penelitian... 6
2. Tanaman daun dewa : (a) tajuk tanaman, (b) tangkai dan mahkota
bunga, (c) akar tanaman dan (d) umbi akar... 7
3. Ring sistem dari senyawa flavonoid (a), struktur kimia kuersetin (b),
struktur kimia antosianin (c) (Vickery dan Vickery 1981)... 9
4. Biosintesis flavonoid (Vickery dan Vickery 1981) : a, b. pembentukan p-asam kumarat dari jalur asam sikimat, c. pembentukan malonil
CoA pada jalur asetat malonat... 10
5. Jalur reaksi pembentukan kalkon dan golongan flavonoid lainnya
(Jaakola 2003)... 11
6. Adaptasi tanaman melalui mekanisme penghindaran (avoidance)
pada intensitas cahaya rendah (Levitt 1980)... 15
7. Adaptasi tanaman melalui mekanisme toleran (tolerance) pada
intensitas cahaya rendah (Levitt 1980)... 17
8. Jalur biosintesis klorofil a dan b (Malkin dan Niyogi 2000)... 18
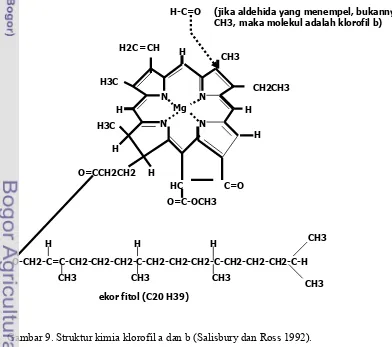
9. Struktur kimia klorofil a dan b (Salisbury dan Ross 1992)... 19
10. Warna daun plantlet daun dewa untuk penentuan skor warna daun.
(1) = hijau, (2) = hijau keunguan, (3) = merah keunguan... 34
11. Tunas mikro daun dewa pada konsentrasi BAP dan IAA... 35
12. Interaksi BAP dan IAA terhadap jumlah tunas dan jumlah daun pada
akhir percobaan... 37
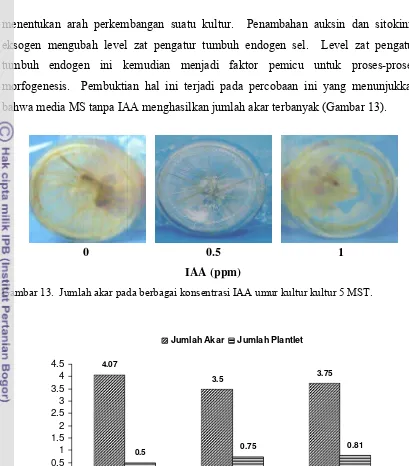
13.Jumlah akar pada berbagai konsentrasi IAA umur kultur kultur 5 MST. 40
14. Pengaruh konsentrasi IAA terhadap jumlah akar dan jumlah plantlet
daun dewa in vitro... 40
15. Diameter kalus, jumlah akar dan jumlah plantlet pada konsentrasi
BAP 0-3 ppm akhir percobaan... 41
16. Grafik pengaruh interaksi antara IAA dan sukrosa terhadap jumlah
dan konsentrasi IAA 0, 0.5 dan 1 ppm (b)... 51
18. Grafik pengaruh interaksi antara IAA dan sukrosa terhadap tinggi tunas
dan diameter kalus pada akhir percobaan... 52
19. Grafik korelasi antara tinggi tunas dan diameter kalus pada
interaksi antara IAA dan sukrosa pada akhir percobaan... 52
20. Hubungan antara konsentrasi IAA dan sukrosa terhadap panjang
akar plantlet daun dewa umur kultur 8 MST... 53
21. Plantlet yang dihasilkan pada konsentrasi sukrosa 30, 40, 50 dan 60 g/l
(a) dan konsentrasi IAA 0, 0.5 dan 1 ppm (b)... 54
22. Grafik hubungan antara konsentrasi sukrosa terhadap jumlah
plantlet (A) dan kadar antosianin (B) umur kultur 8 MST... 55
23. Perlakuan periode pencahayaan dan sumber bahan tanam... 61
24. Perbedaan pertumbuhan tanaman antara bahan tanam in vitro dan
setek pucuk... 66
25. Stomata (pembesaran 40x) pada berbagai periode pencahayaan... 77
26. Trichoma (pembesaran 40x) pada berbagai periode pencahayaan... 78
27. Ketebalan daun (pembesaran 100x) pada berbagai periode
pencahayaan... 79
28. Kandungan enzim SOD (µmol/g) dan total klorofil (mg/g) daun
bahan tanam daun dewa asal in vitro dan setek pucuk umur 16 MST... 85
29. Kandungan antosianin (a) dan total flavonoid (b) antara bahan tanam
in vitro dan setek pucuk umur 16 MST... 89
30. Perlakuan periode pencahayaan dan pemupukan... 100
31. Bahan tanam in vitro yang digunakan pada percobaan... 105
32. Tanaman daun dewa umur 16 MST perlakuan cahaya 100% (N0) dengan dosis pupuk P0, P1 dan P2(a), naungan 25% 4 bulan (N4) dengan dosis pupuk P0, P1 dan P2(b), naungan 50% 4 bulan (N8) dengan dosis pupuk P0, P1 dan P2(c). P0 = tanpa pemupukan, P1 = pupuk kandang ayam 50g +SO4 0.4g/tanaman, P2 = pupuk
kandang ayam 100g + SO4 0.8g/tanaman... 105
35. Struktur kloroplas daun dewa (TEM 10.000x) pada naungan 25% 3 bulan, 1 bulan cahaya 100% (D), naungan 50% 1 bulan, 3 bulan cahaya 100% (E) dan naungan 50% 3 bulan, 1 bulan cahaya 100%
(F) pada umur daun 16 MST... 120
36. Kandungan total flavonoid dan kuersetin pada berbagai periode pencahayaan (a dan b), dan kandungan total flavonoid, kadar SO4, antosianin dan kuersetin pada berbagai dosis pemupukan (c dan d)
umur 16 MST... 125
37. Produksi total flavonoid dan antosianin pada berbagai periode pencahayaan (a dan b), dan produksi total flavonoid dan antosianin
pada berbagai dosis pemupukan (c dan d) umur 16 MST... 128
38. Produksi kuersetin per tanaman pada berbagai periode pencahayaan
umur 16 MST... 129
39. Produksi kuersetin per tanaman pada berbagai dosis pemupukan
Nomor Halaman Teks
1. Denah percobaan “ multiplikasi tunas secara in vitro” ... 156
2. Denah percobaan “ induksi akar dan antosianin secara in vitro” ... 157
3. Denah percobaan “ pengaruh periode pencahayaan dan sumber
bahan tanam terhadap pertumbuhan dan kandungan flavonoid” ... 158
4. Denah percobaan “ pengaruh periode pencahayaan dan pemupukan terhadap produksi flavonoid” ... 159
5. Komposisi media MS yang digunakan pada kultur in vitro... 160
6. Hasil analisis kesuburan tanah pada lokasi penelitian tahap IV... 160
7. Hasil analisis kandungan hara pada pupuk kandang ayam untuk
penelitian tahap IV... 161
8. Hasil uji fitokimia daun dewa umur 16 MST... 161
9. Rata-rata intensitas cahaya dan persen naungan pada penelitian
tahap III dan IV... 162
10. Data iklim periode penelitian lapangan tahap III dan IV... 166
11. Rekapitulasi hasil sidik ragam penelitian tahap I... 168
12. Rekapitulasi hasil sidik ragam penelitian Tahap II... 169
13. Rekapitulasi hasil sidik ragam penelitian tahap III... 170
14. Rekapitulasi hasil sidik ragam penelitian Tahap IV... 172
15. Skema kerja pada multiplikasi tunas di laboratorium bioteknologi
tanaman... 174
16. Skema kerja pada induksi perakaran dan antosianin di laboratorium
bioteknologi tanaman... 175
17. Metode analisis klorofil a dan b... 176
18. Metode analisis enzim superoxide dismutase (SOD)... 177
19. Metode preparasi dan pengamatan jumlah stomata dan trichoma... 178
22. Metode analisis antosianin... 183
23. Metode analisis total crude flavonoid... 184
24. Metode analisis kadar kuersetin... 185
25. Metode preparasi dan pengamatan struktur kloroplas... 186
26. Prosedur analisis jaringan tanaman untuk penetapan kadar pospor (P),
kalium (K), dan sulfur (SO4)... 187
PENDAHULUAN
Latar Belakang
Indonesia sebagai daerah tropis merupakan salah satu negara yang memiliki keanekaragaman hayati yang tinggi terutama tumbuhan berkhasiat obat. Terdapat 1000 jenis dari 30.000 jenis tumbuhan di Indonesia telah diketahui dapat dimanfaatkan untuk pengobatan (Badan POM 2004), diantaranya adalah daun dewa. Daun dewa telah digunakan untuk menurunkan kadar gula dalam darah, obat kulit, menyembuhkan migraine, hepatitis B, anti tumor atau anti kanker, penurun panas, menghilangkan bengkak-bengkak, membersihkan racun dan mengatasi peradangan pada jaringan tubuh (Gati dan Purnamaningsih 1996, Suharmiati dan Maryani 2003, Lemmens 2003).
Daun dewa (Gynura pseudochina (L.) DC) memiliki bahan aktif berupa
flavonoid serta beberapa zat kimia lain seperti alkaloid, tanin, saponin, polifenol, minyak atsiri serta delapan asam fenolat (Ratnaningsih et al. 1985, Soetarno 2000). Senyawa flavonoid yang terkandung dalam daun dewa termasuk golongan glikosida kuersetin (Soetarno et al. 2000). Flavonoid merupakan senyawa antioksidan yang
mempunyai aktivitas antibakterial, anti inflamatori, anti alergik, anti mutagenik, anti viral, anti neoplastik, anti trombotik dan anti vasodilatori (Miller 1996), mengurangi resiko penyakit kardiovaskuler pada manusia (Yochum et al. 1999, Polagruto et al.
2003) dan sebagai peluruh lemak melalui aktivitas enzim lipase (Darusman et al. 2001). Antosianin dan kuersetin sebagai bagian dari golongan senyawa flavonoid telah dibuktikan dapat menghambat pertumbuhan sel-sel kanker pada manusia (Lamson et al. 2000, Katsube et al. 2003, Zhang et al. 2005).
glikosida antosianin yang berbeda dengan tanaman yang sama yang ditumbuhkan di lapang (Hosokawa et al. 1996).
Pada kondisi lapang, stimulasi bioaktif dapat ditingkatkan melalui naungan dengan periode pencahayaan yang berbeda. Pada tanaman kedelai, pigmentasi antosianin meningkat pada persen naungan yang semakin tinggi (Lamuhuria et al. 2006), sedangkan pada beberapa klon daun dewa yang tumbuh pada kondisi cahaya 100% menghasilkan kadar antosianin yang tidak berbeda nyata (Ghulamahdi et al.
2006). Tanaman daun jinten (Urnemi et al. 2002), kadar kumarat dan fanilat tertinggi terdapat pada naungan 75%. Taraf naungan 50 dan 75% meningkatkan respon tanaman daun jinten terhadap pemupukan. Pemberian pupuk fosfor 75 kg/ha tanpa pupuk herbal menghasilkan kadar kumarat dan vanilat tertinggi. Penggunaan sulfur diduga dapat menstimulasi peningkatan senyawa flavonoid dalam tanaman. Peran SO4 sangat penting pada biosintesis senyawa-senyawa golongan flavonoid (Hornok 1992). Sumber hara dalam tanah untuk pertumbuhan tanaman dapat berasal dari pemberian pupuk organik yang bersumber dari bahan organik, dan pupuk anorganik yang bersumber dari bahan-bahan anorganik, di samping kandungan hara asli tanah. Pupuk organik yang telah digunakan pada budidaya tanaman adalah pupuk kandang. Pupuk kandang dapat meningkatkan kandungan N, P, K, Ca, Mg, S, dan meningkatkan Kapasitas Tukar Kation (KTK) dalam tanah (Pujiyanto 2004). Di samping itu pupuk kandang sebagai sumber bahan organik tanah dapat mendorong agregasi atau dispersi agregat. Peningkatan agregasi akibat aplikasi pupuk kandang (pupuk organik) dapat terjadi melalui pengikatan oleh polisakarida dan mucilage yang dihasilkan oleh bakteri, hifa jamur maupun melalui akar tanaman (Oades 1984).
Kotoran ayam memiliki kelebihan kandungan hara dibandingkan dengan jenis kotoran hewan lainnya. Persentase kandungan N, P, dan Mg dalam kotoran ayam lebih tinggi jika dibandingkan dengan jenis kotoran hewan yang lain, sedangkan persentase K pada kotoran ayam masih lebih rendah dibandingkan dengan kotoran domba. Kandungan N mencapai 5-8 % dan lebih tinggi dibandingkan dengan kotoran sapi 2-8 %, kotoran babi 3-5 % dan kotoran domba 3-5 %. Kandungan P dan Mg
Rumusan Masalah
Daun dewa (Gynura pseudochina (L.) DC) memiliki kandungan bioaktif diantaranya adalah antosianin dan kuersetin sebagai golongan senyawa flavonoid yang telah digunakan sebagai anti kanker pada manusia. Untuk meningkatkan kandungan antosianin dan kuersetin pada daun dibutuhkan kualitas bahan tanam yang tinggi yang dapat dilakukan melalui studi in vitro dan optimalisasi pemanfaatan intensitas cahaya dan pemupukan di lapang.
Penyediaan bahan tanam daun dewa yang memiliki kemampuan pertumbuhan yang lebih baik, dapat tersedia dalam jumlah banyak dengan waktu relatif cepat dan pertumbuhannya seragam serta memiliki kandungan antosianin yang tinggi dapat dilakukan melalui teknik in vitro untuk pembentukan bahan tanam asal in vitro. Penggunaan sitokinin (BAP), auksin (IAA), sukrosa dan media MS yang mengandung unsur hara makro, mikro, vitamin dan asam amino mendukung pembentukan bahan tanam asal in vitro yang berkualitas tinggi.
Peningkatan kandungan antosianin dan kuersetin daun dapat ditingkatkan melalui penanaman bahan tanam asal in vitro pada kondisi lapang dengan menggunakan periode pencahayaan dan optimalisasi pemupukan. Pada kondisi lapang, bahan tanam asal in vitro akan mengalami peningkatan biomasa serta produksi antosianin dan kuersetin juga diharapkan akan mengalami peningkatan. Melalui periode pencahayaan yang berbeda akan mempengaruhi peningkatan biomasa, kandungan antosianin dan kuersetin daun. Periode pencahayaan berpengaruh terhadap perubahan morfo-anatomi daun, struktur kloroplas, kandungan klorofil daun,
akumulasi radikal bebas dalam daun dan hasil fotosintesis berupa bobot biomasa. Peningkatan bobot biomasa tanaman akan mempengaruhi peningkatan produksi bioaktif.
Tujuan Penelitian
Penelitian bertujuan untuk :
1. Menghasilkan bahan tanam asal in vitro yang memiliki kandungan antosianin yang tinggi melalui kultur in vitro yang menggunakan media MS, sukrosa, BAP dan IAA.
2. Meningkatkan produksi total flavonoid, antosianin dan kuersetin daun dari bahan tanam asal in vitro yang ditumbuhkan di lapang melalui periode pencahayaan dan
pemberian pupuk kandang ayam + SO4.
Kerangka Pemikiran
Peningkatan kandungan bioaktif dalam tanaman ditentukan oleh beberapa aspek diantaranya adalah kualitas bahan tanam, faktor cahaya dan pemberian unsur hara melalui pemupukan. Penelitian ini dilakukan untuk membuktikan kontribusi dari ketiga aspek tersebut dalam rangkaian percobaan yang dimulai dari peningkatan
kualitas bahan tanam melalui studi in vitro, penggunaan periode pencahayaan yang berbeda dan aplikasi pemupukan yang dilakukan pada kondisi lapang.
Studi in vitro daun dewa untuk menghasilkan plantlet dan studi pada tanaman lainnya untuk pigmentasi antosianin telah dilaporkan pada penelitian sebelumnya (Gati dan Purnamaningsih 1994, Mufa’adi et al. 2004, Hiratsuka et al. 2001, Hosokawa et al. 1996). Studi in vitro untuk pembentukan plantlet daun dewa berkandungan antosianin yang tinggi belum dilaporkan. Upaya peningkatan pigmentasi antosianin plantlet daun dewa dapat dilakukan melalui : (1) multiplikasi tunas mikro menggunakan komposisi media MS, BAP dan IAA, (2) pembentukan plantlet dan pigmentasi antosianin menggunakan komposisi media MS, IAA dan sukrosa.
pupuk kandang ayam pada daun dewa hasil kultur in vitro telah dilakukan oleh Rohmaliah (2003). Peningkatan pertumbuhan, adaptasi morfo-anatomi, fisiologis, kandungan bioaktif (antosianin dan kuersetin) serta serapan hara daun dewa pada berbagai periode pencahayaan dan komposisi pupuk kandang ayam + SO4 belum dilaporkan.
Hubungan antara pertumbuhan, morfo-anatomi dan fisiologis tanaman dalam proses peningkatan kandungan bioaktif penting untuk diketahui dalam rangkaian
penelitian ini.
Hipotesis
Hipotesis yang diajukan dalam penelitian ini adalah sebagai berikut :
1. Pemberian BAP dan IAA yang optimum dapat meningkatkan jumlah tunas daun dewa pada kultur in vitro.
2. Pemberian IAA dan sukrosa yang optimum dapat menginduksi perakaran, pigmentasi antosianin dan pembentukan plantlet daun dewa pada kultur in vitro.
3. Periode pencahayaan dapat meningkatkan kandungan senyawa flavonoid daun dewa asal kultur in vitro.
4. Pemberian pupuk kandang ayam + SO4 dan periode pencahayaan dapat meningkatkan produksi senyawa flavonoid daun dewa asal kultur in vitro.
Ruang Lingkup Penelitian
Berdasarkan uraian di atas, maka penelitian ini dirumuskan ke dalam tiga aspek: (1) studi in vitro untuk pembentukan plantlet berkandungan antosianin yang tinggi sebagai bahan tanam, (2) peningkatan senyawa flavonoid bahan tanam asal in vitro
pada berbagai periode pencahayaan di lapang, dan (3) produksi senyawa flavonoid (antosianin dan kuersetin) bahan tanam asal in vitro melalui aplikasi pupuk kandang ayam + SO4. Ketiga aspek tersebut dikelompokkan menjadi empat subjudul penelitian yang terdiri dari: (1) multiplikasi tunas secara in vitro, (2) induksi akar dan antosianin secara in vitro, (3) peningkatan pertumbuhan dan kandungan bioaktif bahan tanam asal in vitro pada berbagai periode pencahayaan, dan (4) produksi flavonoid bahan tanam asal in vitro pada berbagai periode pencahayaan dan pemupukan.
plantlet dan kandungan antosianin dipelajari dalam subjudul penelitian kedua. Peningkatan pertumbuhan, adaptasi morfo-anatomi, kandungan pigmen fotosintetik (klorofil a dan b), enzim penghambat radikal bebas (SOD) dan kandungan bioaktif daun dipelajari pada subjudul penelitian ketiga. Subjudul penelitian keempat akan mempelajari pertumbuhan, serapan hara jaringan tanaman, kandungan pigmen dan organ fotosintetik (klorofil a, klorofil b, struktur kloroplas), serta produksi flavonoid (antosianin dan kuersetin). Garis besar seluruh kegiatan penelitian disajikan dalam
Gambar 1.
Penelitian Tahap II Penelitian Tahap I Studi in Vitro
Multiplikasi Tunas Bahan
Tanam
Induksi Akar dan Pigmentasi Antosianin
Bahan Tanam Asal in Vitro
Penelitian Tahap-III Periode Pencahayaan dan
Sumber Bahan Tanam
Penelitian Tahap-IV
Periode Pencahayaan dan Pemupukan
Produksi Total Flavonoid Antosianin dan
Kuersetin
TINJAUAN PUSTAKA
Botani, Penyebaran dan Manfaat Daun Dewa
Daun dewa disebut Gynura procumbens (Back.) mempunyai nama sinonim
Gynura pseudochina (L.) DC, merupakan tanaman asli Birma dan Cina, yang tumbuh
menahun berupa terna dan termasuk ke dalam famili Asteraceae (Heyne 1987).
Daun dewa memiliki perakaran tunggang, umbi akar berwarna keabuan dengan
panjang 3-6 cm dan luas penampang sekitar 3 cm. Batang berbentuk bulat berdaging,
tumbuh tegak atau berbaring, tinggi mencapai 1,5 m (Ratnaningsih et al. 1985).
Menurut Wanohadi dan Palupi (2000), daun dewa memiliki daun tunggal tersebar
mengelilingi batang, helaian daun berwarna hijau keunguan, bentuk bulat telur,
berdaging, berbulu lebat, ujung tumpul, tepi bertoreh, pangkal meruncing, pertulangan
menyirip dan tangkai daun pendek. Bunga daun dewa merupakan bunga majemuk
berbentuk bonggol, berbulu, tangkai bunga memiliki panjang 20-30 cm, kelopak
berbentuk cawan dan benang sari berwarna kuning serta ukuran buah kecil berbentuk
garis dan berwarna coklat (Siregar dan Utami 2002, Dalimartha 2001).
Bagian-bagian tanaman secara lengkap disajikan pada Gambar 2 (Foto hasil penelitian).
(a) (b)
[image:30.595.93.445.436.732.2](c) (d)
Gambar 2.
Daerah pertumbuhan daun dewa tersebar mulai dari dataran rendah sampai
dataran tinggi yang mencapai ketinggian 1-1200 meter di atas permukaan laut (dpl),
namun paling banyak ditemui pada ketinggian 500 m dpl. Daun dewa menghendaki
iklim pertumbuhan berupa curah hujan dengan kisaran 1500-3500 mm/tahun (iklim
sedang sampai basah), tanah agak lembab sampai lembab serta subur (Syukur dan
Hermani 2001).
Menurut Heyne (1987) daun dewa merupakan tanaman asli dari Birma dan
Cina, dan di Indonesia dikenal dengan nama beluntas cina (nama lokal). Di pulau
Jawa (Burkill 1935) tanaman ini banyak digunakan sebagai tanaman berkhasiat obat.
Hasil pengamatan habitat daun dewa oleh Hidayat (2000) di daerah Aceh, tanaman ini
tumbuh secara liar pada daerah dengan kisaran suhu 22-260C, kelembaban 67-90 %,
pH tanah 6.6-7 dan cahaya yang masuk 75-90 %, sedangkan di daerah Sulawesi
Tengah daun dewa tumbuh di ketinggian 840-1250 m dpl, suhu 25-300C, kelembaban
75-85 % dan cahaya yang masuk 50-75 %. Daun dewa tergolong tumbuhan lindung,
karena dapat tumbuh dan tahan pada tempat dengan intensitas cahaya rendah.
Daun dewa merupakan tanaman obat yang banyak dimanfaatkan karena banyak
khasiatnya antara lain untuk menurunkan kadar gula dalam darah, obat kulit,
menyembuhkan migraine, hepatitis B dan anti tumor atau anti kanker. Di samping itu
air perasan daun dewa dapat digunakan sebagai penurun panas dan menghilangkan
bengkak-bengkak (Gati dan Purnamaningsih 1996).
Secara tradisional daun dewa telah banyak digunakan sebagai obat anti kanker.
Pembuktian pada penelitian skala laboratorium menunjukkan bahwa ekstrak daun
dewa mampu menghambat perumbuhan tumor pada mencit (tikus) (Suharmiati dan
Maryani 2003). Pada habitat asalnya, tanaman ini digunakan sebagai sumber sayuran
sehat, sedangkan di pulau Jawa digunakan sebagai obat khususnya untuk penyakit
ginjal (Heyne 1987). Daun dan umbi tanaman ini mengandung bahan aktif seperti
flavonoid, terpenoid, saponin, tanin, alkaloid dan minyak atsiri (Ratnaningsih et al.
1985, Syamsuhidayat dan Hutapea 1991, Windono 2000, Nugroho et al. 2000, Siregar
dan Utami 2000). Hasil penelitian Soetarno et al. (2000) menunjukkan bahwa
senyawa flavonoid yang terkandung dalam daun dewa termasuk golongan glikosida
kuersetin. Pada penelitian ini juga ditemukan delapan asam fenolat diantaranya asam
klorogenat, asam kafeat, asam p-kumarat, asam p-hidroksi benzoat dan asam vanilat,
al. (1998) menunjukkan bahwa daun dewa mengandung 0,05 % minyak atsiri dari
bagian daunnya yang terdiri atas 22 komponen senyawa yang didominasi oleh
Seskuiterpena.
Senyawa Bioaktif Golongan Flavonoid
Menurut perkiraan terdapat sekitar 2% (1 x 109 ton/tahun) dari seluruh karbon
yang difotosintesis diubah menjadi flavonoid yang merupakan salah satu golongan
fenol alam yang terbesar (Markham 1988). Flavonoid merupakan salah satu senyawa
aromatik dalam tanaman yang disintesis melalui biosintesis gabungan membentuk dua
ring sistem (Gambar 3a). Ring A berasal dari tiga unit asetat, sedangkan ring B dan
tiga karbon pada bagian tengah ring berasal dari asam sinamat. Dua lintasan
biosintesis yaitu lintasan asetat-malonat dan asam sikimat adalah lintasan yang
penting dalam proses biosintesis flavonoid (Vickery dan Vickery 1981). Antosianin
dan kuersetin adalah dua senyawa yang tergolong senyawa flavonoid (Gambar 3b dan
3c). Antosianin berasal dari glikosida antosianidin yang tidak stabil, sedangkan
kuersetin berasal dari turunan senyawa-senyawa flavonol.
O
O A
B
(a) Sistem cincin flavonoid
O
O HO
OH OH
OH OH
(c) Kuersetin
O
OH
O
OH
OH
(b) Antosianin
asal siklus asetat asal siklus asam sinamat
Gambar 3. Sistem cincin dari senyawa flavonoid (a), struktur kimia kuersetin (b), struktur kimia antosianin (c) (Vickery dan Vickery 1981).
Proses biosintesis flavonoid merupakan biosintesis gabungan dari jalur asam
pada jalur asam sikimat akan terbentuk fenilalanin yang merupakan salah satu
senyawa asam amino aromatik yang selanjutnya akan menghasilkan p-asam kumarat,
sedangkan pada jalur asetat malonat akan terbentuk asetil CoA yang akan
menghasilkan malonil CoA, setelah mengikat satu molekul CO2 (Gambar 4).
a. Eritrosa-4-Fosfat + PEP Asam sikimat
Fenilalanin (asam amino aromatik)
FAL
b. Fenilalanin Asam sinamat
p-Asam kumarat
+ CO2
c. G-6-P Asetil CoA Malonil CoA
Gambar 4. Biosintesis Flavonoid (Vickery dan Vickery 1981): a, b pembentukan p-asam kumarat dari jalur asam sikimat, c. pembentukan malonil CoA pada jalur asetat malonat.
Hasil penelitian Jaakola (2003) tentang biosintesis flavonoid pada Bilberry
(Vaccinium mirtryllus L.), ditemukan enzim-enzim yang berperan pada biosintesis
senyawa-senyawa flavonoid. Proses reaksi dimulai dari sintesis kalkon (derivasi
pertama flavonoid) yang berasal dari p-asam kumarat yang menghasilkan cincin A
dan malonil CoA yang menghasilkan cincin B. Fenilalanin amonia liase (FAL)
mengkatalisis perubahan fenilalanin menjadi sinamat. FAL juga berperan pada
perubahan tirosin ke p-kumarat, meskipun pada efisiensi yang rendah.
Sinamat 4-hidroksilase (S4H) mengkatilisis sintesis p-hidroksisinamat dari
sinamat dan 4-kumarat:CoA ligase (4KL), mengubah p-kumarat menjadi CoA ester,
mengaktifkan reaksi dengan malonil CoA. Jalur biosintesis flavonoid dimulai dengan
kondensasi satu molekul dari 4-kumaroksil-CoA dan tiga molekul dari malonil CoA,
menghasilkan naringenin kalkon. Reaksi ini dikatalisis oleh enzim kalkon sintase
(KS). Kalkon diisomerisasi menjadi flavonon oleh enzim kalkon flavonon isomerase
(KI). Dari pusat intermediet ini terjadi perbedaan jalur ke beberapa cabang jalur,
mengkatalisis stereospesifik 3β-hidroksilasi dari (2S)-flavonon menjadi
dihidroflavonol. Untuk biosintesis antosianin, dihidroflavonol reduktase (DFR)
mengkatalisis proses reduksi dari dihidroflavonol menjadi flavan-3,4-diol
(leukoantosianin), dan selanjutnya diubah menjadi antosianidin oleh antosianidin
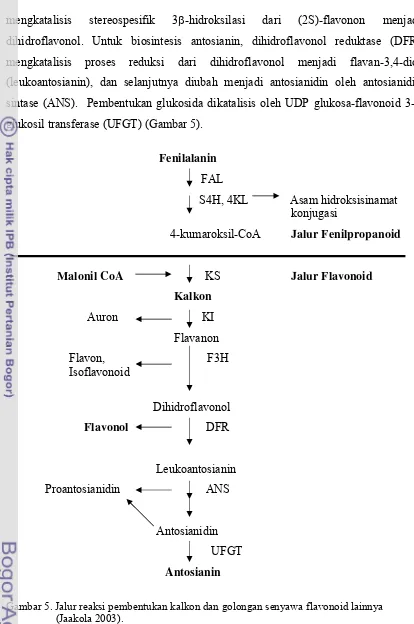
sintase (ANS). Pembentukan glukosida dikatalisis oleh UDP glukosa-flavonoid 3-0
glukosil transferase (UFGT) (Gambar 5).
Fenilalanin
FAL
S4H, 4KL Asam hidroksisinamat konjugasi
4-kumaroksil-CoA Jalur Fenilpropanoid
Malonil CoA KS Jalur Flavonoid
Kalkon
Auron KI
Flavanon
Flavon, F3H
Isoflavonoid
Dihidroflavonol
Flavonol DFR
Leukoantosianin
Proantosianidin ANS
Antosianidin
UFGT
[image:34.595.84.498.60.684.2]Antosianin
Gambar 5. Jalur reaksi pembentukan kalkon dan golongan senyawa flavonoid lainnya (Jaakola 2003).
Dari keseluruhan aglikon flavonoid, antosianin dapat diidentifikasi dengan baik
dan pada pengamatan visual tanaman menghasilkan warna biru, lembayung muda dan
antosianidin yang tidak stabil, senyawa-senyawa basa pada ion flavilium (Vickery
dan Vickery 1981). Pada Blueberries dimana terdapat sumber antosianin, diketahui
sangat menguntungkan bagi kesehatan (Kalt dan Dufour 1997, Smith et al. 2000).
Diketahui pula bahwa antosianin sebagai salah satu golongan senyawa flavonoid
dapat berfungsi sebagai obat anti kanker (Katsube et al. 2003).
Flavonoid merupakan salah satu senyawa antioksidan yang mempunyai
aktivitas antibakterial, anti-inflamatori, antialergi, antimutagenik, antiviral,
antineoplastik, anti-trombotik dan aktivitas vasodilatori (Miller 1996). Di samping
itu, flavonoid juga dapat mengurangi resiko penyakit kardiovaskuler pada manusia
(Yochum et al. 1999, Polagruto et al. 2003). Antosianin dan kuersetin sebagai bagian
dari golongan senyawa flavonoid telah dibuktikan dapat menghambat pertumbuhan
sel-sel kanker pada manusia (Lamson et al. 2000, Katsube et al. 2003, Zhang et al.
2005). Isolasi flavonoid dari tumbuhan telah banyak dilakukan diantaranya dari daun
teh hijau kering (Miller 1996), tanaman Bangle (Zingiber cassumunar) (Darusman et
al. 2001), dan bunga dari tanaman Vaccinium myrtillus L. (Jaakola 2003). Pada daun
dewa, flavonoid juga telah berhasil diisolasi (Ratnaningsih et al. 1985, Simanjuntak
1998, Nugroho et al. 2000, Zaini 2006).
Kultur in vitro Tanaman Daun Dewa
Kultur in vitro menurut Gunawan (1992) adalah suatu metode untuk mengisolasi
bagian dari tanaman seperti protoplasma, sel, sekelompok sel, jaringan dan organ,
serta menumbuhkannya dalam kondisi aseptik, sehingga bagian-bagian tersebut dapat
memperbanyak diri dan beregenerasi menjadi tanaman utuh kembali. Berawal dari
teori totipotensi sel, teknik kultur jaringan kemudian berkembang menjadi sarana
penelitian di bidang fisiologi tanaman dan aspek-aspek biokimia, dan selanjutnya
teknik ini telah dipergunakan dalam industri tanaman.
Menurut Djuwita (2003) penggunaan teknik kultur in vitro memiliki beberapa
keuntungan diantaranya faktor fisiko-kimiawi lingkungan dapat dikontrol,
karakterisasi dan homogenitas sampel dan ekonomis (sampel dapat diuji dalam
jumlah sedikit). Perbedaan perbanyakan vegetatif secara in vitro dengan metode
konvensional yang lain adalah : a) dalam teknik in vitro, bahan tanaman yang
dipergunakan lebih kecil, sehingga tidak merusak pohon induk, b) lingkungan tumbuh
kultur in vitro harus aseptik dan terkendali, c) kecepatan perbanyakan yang tinggi, d)
internal, dan e) membutuhkan tempat yang relatif kecil untuk menghasilkan jumlah
bibit yang besar (Gunawan 1992).
Dalam pelaksanaan teknik kultur in vitro dengan tujuan untuk perbanyakan
vegetatif tanaman diperlukan beberapa langkah-langkah umum seperti penyiapan
eksplan, sterilisasi baik alat-alat yang digunakan maupun eksplan, pembuatan media,
penanaman dan regenerasi tanaman menjadi plantlet (Gunawan 1992, Gamborg dan
Phillips 1995, Smith, 2000). Seluruh langkah-langkah dalam teknik kultur jaringan
harus dilakukan dalam kondisi aseptis, karena kontaminasi oleh mikroorganisme
merupakan permasalahan sangat penting yang harus dihindari dalam kultur jaringan
(Boediono 2003). Selanjutnya disebutkan bahwa metode aseptis pada penanganan
kultur jaringan adalah upaya untuk memberikan batas antara mikroorganisme yang
banyak terdapat dalam lingkungan bebas dan lingkungan kultur yang tidak
terkontaminasi. Oleh karena itu semua bahan atau alat yang akan berkontak langsung
dengan lingkungan kultur harus dalam kondisi steril.
Di samping beberapa aspek penting dalam kultur jaringan, media tanam
merupakan salah satu aspek yang menarik dalam menentukan keberhasilan tujuan
penggunaan teknik kultur jaringan. Keberhasilan dalam penggunaan metode kultur
jaringan, sangat bergantung pada media yang digunakan. Media kultur jaringan
tanaman menyediakan unsur hara makro dan mikro, tetapi juga karbohidrat yang pada
umumnya berupa gula untuk menggantikan karbon yang biasanya didapat dari
atmosfer melalui fotosintesis (Gunawan 1992). Di samping garam-garam inorganik,
penggunaan zat pengatur tumbuh, vitamin, asam-asam amino dan antibiotik juga
sangat penting dalam komposisi media (Smith 2000).
Diantara beberapa komponen media pada teknik kultur jaringan, peranan zat
pengatur tumbuh (ZPT) dalam proses regenerasi tanaman cukup penting. Zat
pengatur tumbuh digunakan untuk mendukung pertumbuhan awal, dan sangat penting
untuk mengarahkan respon pertumbuhan propagul (Hartman dan Kester 1983).
Auksin (IAA, NAA, 2,4-D, atau IBA) diserap oleh sel-sel tanaman untuk proses
pembelahan dan inisiasi akar. Pada konsentrasi yang tinggi, auksin dapat menekan
proses morfogenesis, sedangkan sitokinin (kinetin, BA, zeatin dan 2iP) berperan
dalam pembelahan sel, proliferasi pucuk dan morfogenesis pucuk (Smith 2000).
Secara fisiologis peranan auksin dalam tanaman adalah untuk mendukung proses
berperan penting pada proses pembelahan sel dan mendukung proses morfogenesis
(Taiz dan Zeiger 1991).
Penggunaan sukrosa pada media kultur dapat meningkatkan pigmentasi
antosianin dari plantlet. Hiratsuka et al. (2001) melaporkan penggunaan ABA 1 g/l
dan gula (fruktosa, sukrosa, glukosa dan ramnosa) 2.5 dan 10% dapat meningkatkan
pigmentasi antosianin pada kultur in vitro Vitis labruscana Bailey cv. Olympia.
Penggunaan GA3 1 mg/l dan sukrosa 30 g/l pada kultur in vitroHyacinthus orientalis
menghasilkan glikosida antosianin yang berbeda dengan tanaman yang sama yang
ditumbuhkan di lapang (Hosokawa et al. 1996).
Kultur jaringan daun dewa sebelumnya telah dilakukan oleh beberapa peneliti.
Gati dan Purnamaningsih (1996) menggunakan komposisi media yang terdiri dari BA
dan IAA untuk menginisiasi pertumbuhan tunas dan akar. Hasil penelitian ini
menunjukkan bahwa pemakaian BA 2 mg/l dapat menghasilkan rata-rata jumlah tunas
tertinggi yaitu 20.1 dan pemakaian IAA 0.5 mg/l menghasilkan rata-rata jumlah akar
tertinggi yaitu 12.8. Pada penelitian yang dilakukan oleh Mufa`adi et al. (2003)
menunjukkan bahwa interaksi antara BAP 3 ppm dan IAA 0.5 ppm menghasilkan
jumlah tunas terbanyak yaitu 85.4 tunas per botol. Pada perlakuan pengakaran yang
dilakukan Anggirasti (2002), menunjukkan bahwa media MS-0 + IAA 0.5 mg/l
menghasilkan jumlah akar yang terbanyak.
Pengaruh Naungan terhadap Pertumbuhan Tanaman
Tanaman daun dewa dalam proses pertumbuhannya di lapang membutuhkan
intensitas cahaya tertentu dan tergolong tanaman toleran naungan. Di daerah Aceh
ditemukan bahwa daun dewa dapat tumbuh baik pada cahaya yang masuk berkisar
75-90 %, dan di Sulawesi Tengah 50-75 % (Hidayat 2000). Menurut Januwati (1996)
pertumbuhan daun dewa akan lebih baik pada naungan 25 %. Daun dewa tergolong
tumbuhan lindung, karena dapat tumbuh dan tahan pada tempat dengan intensitas
cahaya rendah, dan idealnya memperoleh 60 % sinar matahari (Suharmiati dan
Maryani 2003).
Daun dewa yang tumbuh di daerah ternaungi menghasilkan daun yang lebih
lebar, renyah, warna lebih cerah dan halus sehingga rasanya lebih enak bila dimakan
segar, sedangkan daun dewa yang ditanam pada intensitas cahaya yang tinggi (tanpa
naungan) menghasilkan daun yang keras. Penipisan daun pada intensitas cahaya yang
Zeiger 1991). Tanaman daun dewa memiliki 1 lapis sel mesofil dan 1 lapis sel lapisan
palisade (Suharmiati dan Maryani 2003).
Mekanisme Adaptasi pada Intensitas Cahaya Rendah
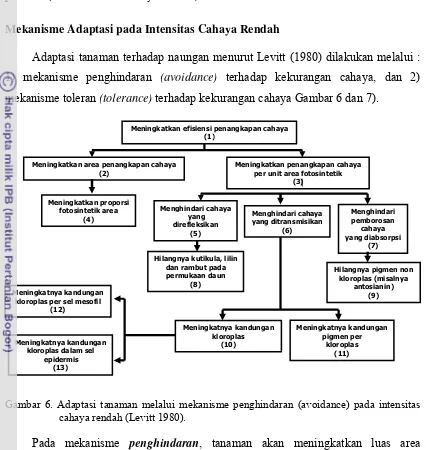
Adaptasi tanaman terhadap naungan menurut Levitt (1980) dilakukan melalui :
1) mekanisme penghindaran (avoidance) terhadap kekurangan cahaya, dan 2)
mekanisme toleran (tolerance) terhadap kekurangan cahaya Gambar 6 dan 7).
Meningkatkan efisiensi penangkapan cahaya (1)
Meningkatkan area penangkapan cahaya (2)
Meningkatkan penangkapan cahaya per unit area fotosintetik
(3)
Meningkatkan proporsi fotosintetik area
(4)
Menghindari cahaya yang direfleksikan
(5)
Menghindari cahaya yang ditransmisikan
(6)
Menghindari pemborosan
cahaya yang diabsorpsi
(7) Hilangnya kutikula, lilin
dan rambut pada permukaan daun
(8)
Hilangnya pigmen non kloroplas (misalnya
antosianin) (9)
Meningkatnya kandungan kloroplas
(10)
Meningkatnya kandungan pigmen per
kloroplas (11) Meningkatnya kandungan
kloroplas per sel mesofil (12)
Meningkatnya kandungan kloroplas dalam sel
[image:38.595.85.511.105.555.2]epidermis (13)
Gambar 6. Adaptasi tanaman melalui mekanisme penghindaran (avoidance) pada intensitas cahaya rendah (Levitt 1980).
Pada mekanisme penghindaran, tanaman akan meningkatkan luas area
penangkapan cahaya dan meningkatkan penangkapan cahaya per unit area
fotosintetik, melalui pengurangan cahaya yang ditransmisikan dan yang direfleksikan.
Beberapa hasil penelitian yang dapat membuktikan hipotesis Levitt (1980) tersebut
telah dilaporkan. Peningkatan area penangkapan cahaya melalui peningkatan luas
daun kedelai dan padi gogo pada intensitas cahaya rendah telah dilaporkan
(Khumaida 2002, Sopandie et al. 2003a dan Sopandie at al. 2003b). Peningkatan
penangkapan cahaya per unit luas area fotosintetik melalui peningkatan pigmen
fotosintesis dan volume kloroplas pada kedelai dan padi gogo serta menurunkan
jumlah trichoma pada kedelai juga telah dilaporkan (Khumaida 2002, Sopandie et al.
Pada kondisi naungan, tanaman akan mengalami perubahan adaptasi yang
ditunjukkan oleh perbedaan kandungan pigmen fotosintetik dan peningkatan luas
daun. Hasil penelitian Sopandie et al. (2003a) pada tanaman padi gogo menyebutkan
bahwa morfologi daun tanaman dan kandungan klorofil a, b serta nisbah klorofil a/b
berbeda antara tanaman toleran dan peka terhadap naungan. Luas daun genotipe padi
gogo toleran naungan lebih tinggi dibandingkan dengan genotipe yang peka, tetapi
ketebalan daun, ketebalan mesofil dan kerapatan stomata lebih rendah. Nisbah
klorofil a/b pada genotipe toleran dan peka terjadi penurunan pada naungan 50 %
dibandingkan dengan kontrol, namun penurunan yang tajam terjadi pada genotipe
peka.
Hidema et al. (1992) melaporkan bahwa intensitas cahaya rendah menurunkan
nisbah klorofil a/b, yang disebabkan oleh peningkatan klorofil b pada tanaman yang
ternaungi, yang berkaitan dengan peningkatan protein klorofil a/b pada Light
Harvesting Complex II (LHC II). Membesarnya antena untuk fotosistem II ini akan
meningkatkan efisiensi pemanenan cahaya. Efisiensi respirasi juga lebih tinggi pada
tanaman toleran naungan. Menurut Sopandie et al. (2003b) Pada tanaman padi gogo
toleran naungan yang ditumbuhkan pada kondisi gelap memiliki efisiensi respirasi
yang tinggi dengan kandungan pati dan karbohidrat yang lebih tinggi dibandingkan
dengan tanaman yang peka kondisi gelap.
Pengurangan jumlah cahaya yang sampai kepermukaan daun tanaman juga
dapat mempengaruhi struktur kloroplas. Ukuran kloroplas tanaman naungan pada
cahaya rendah umumnya lebih besar (Lee et al. 1985). Intensitas cahaya rendah juga
meningkatkan jumlah kloroplas per sel, volume kloroplas dan membran tilakoid serta
grana (stack granum), seperti pada Gusmania monostachia (Maxwell et al. 1999).
Khumaida (2002) juga melaporkan bahwa genotipe kedelai toleran naungan
Pangrango dan B613 mengalami peningkatan volume grana dan butir pati lebih
banyak pada kondisi naungan 50%. Peningkatan ukuran kloroplas dan tumpukan
grana akan meningkatkan penangkapan dan penyerapan cahaya (Chitchley 1997).
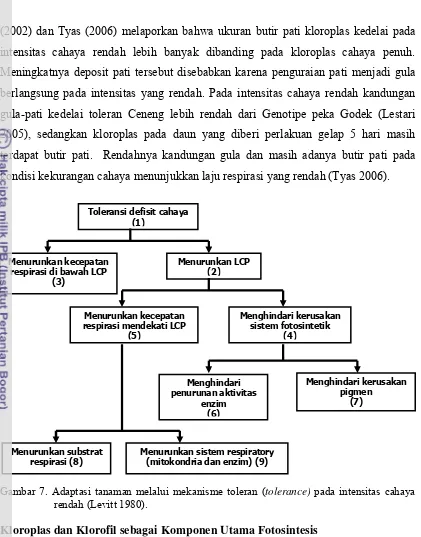
Pada mekanisme toleran, tanaman akan menurunkan titik kompensasi cahaya
dan mengurangi laju respirasi di bawah titik kompensasi cahaya. Tanaman naungan
beradaptasi dengan cara menurunkan titik kompensasi cahaya dan laju respirasi di
bawah titik kompensasi cahaya dimaksudkan untuk meningkatkan produk fotosintesis
pada intensitas cahaya yang rendah. Peningkatan ukuran butir pati kloroplas pada
(2002) dan Tyas (2006) melaporkan bahwa ukuran butir pati kloroplas kedelai pada
intensitas cahaya rendah lebih banyak dibanding pada kloroplas cahaya penuh.
Meningkatnya deposit pati tersebut disebabkan karena penguraian pati menjadi gula
berlangsung pada intensitas yang rendah. Pada intensitas cahaya rendah kandungan
gula-pati kedelai toleran Ceneng lebih rendah dari Genotipe peka Godek (Lestari
2005), sedangkan kloroplas pada daun yang diberi perlakuan gelap 5 hari masih
terdapat butir pati. Rendahnya kandungan gula dan masih adanya butir pati pada
kondisi kekurangan cahaya menunjukkan laju respirasi yang rendah (Tyas 2006).
Toleransi defisit cahaya (1)
Menurunkan LCP (2) Menurunkan kecepatan
respirasi di bawah LCP (3)
Menurunkan kecepatan respirasi mendekati LCP
(5)
Menghindari kerusakan sistem fotosintetik
(4)
Menghindari penurunan aktivitas
enzim (6)
Menghindari kerusakan pigmen
(7)
Menurunkan sistem respiratory (mitokondria dan enzim) (9) Menurunkan substrat
[image:40.595.90.511.48.585.2]respirasi (8)
Gambar 7. Adaptasi tanaman melalui mekanisme toleran (tolerance) pada intensitas cahaya rendah (Levitt 1980).
Kloroplas dan Klorofil sebagai Komponen Utama Fotosintesis
Kloroplas berasal dari proplastid kecil (plastid yang belum dewasa, kecil dan
hampir tidak berwarna dengan sedikit atau tanpa membran dalam). Proplastid
membelah pada saat embrio berkembang dan berkembang menjadi kloroplas ketika
daun dan batang terbentuk. Kloroplas muda juga aktif membelah, khususnya bila
organ yang mengandung kloroplas terpajan pada cahaya dan setiap sel daun dewasa
mengandung beberapa ratus kloroplas. Setiap kloroplas dikelilingi oleh sistem atau
selimut membran ganda yang mengatur lalulintas molekul keluar masuk kloroplas
Sel-sel tumbuhan mengandung berlimpah plastid dengan masing-masing tipe
dan setiap plastid dibatasi oleh membran ganda. Plastid yang mengandung pigmen
klorofil dan karotenoid disebut kloroplas yang merupakan tempat berlangsungnya
proses fotosintesis. Kloroplas terdiri dari stroma yang kaya enzim dan di dalam
stroma terdapat tilakoid yang mengandung pigmen. Disinilah energi cahaya
digunakan untuk mengoksidasi H2O membentuk ATP dan NADPH yang kaya energi,
yang diperlukan stroma untuk mengubah CO2 menjadi karbohidrat. Pada bagian
tertentu terdapat tumpukan tilakoid yang disebut grana (satu tumpukan disebut
granum). Daerah tempat satu tilakoid grana berhubungan dengan tilakoid grana
lainnya dinamakan daerah pinggir. Tilakoid stroma adalah tilakoid yang lebih
panjang yang menghubungkan satu grana dengan grana lainnya. Pada membran
tilakoid mengandung pigmen yang terdiri dari klorofil a dan b (Salisbury dan Ross
1992, Voet et al 1999, Dashek dan Harrison 2006).
Glutamat α-ketoglutarat
d-oksovalerat
Porfobilinogen Asam aminolaevulinik
Susinat + Glisin
Glutamat 1-
fosfat Glutamik semialdehid
Koporfirinogen
Protoporfirinogen Anporfirinogen
Protoporfirin Mg-protoporfirin
monometilester Protokloro
filid Protoklorofil
Klorofil a
Geranil-geranil pirofosfat
Klorofil b
-2H2O
-NH3
-4CO2
-6H Mg2+ - adenosilmetionin
H2O
-4H
Cahaya
-6H
[image:41.595.83.507.65.823.2]
Gambar 8. Jalur biosintesis klorofil a dan b (Malkin dan Niyogi 2000).
Prekursor utama dalam proses pembentukan klorofil adalah glutamat yang
Glutamat mengalami proses deaminasi membentuk α-ketoglutarat, kemudian
direduksi menjadi γ,δ-dioksovalerat dan mengalami transaminasi menjadi δ
-amino-laevulinik yang memerlukan ATP dan NADPH.
Pelepasan air dari dua molekul asam amino-laevulinik menghasilkan
porfobilinogen yang mengandung struktur cincin pirol. Reaksi selanjutnya adalah
pelepasan NH3 dan CO2 yang kemudian membentuk protoporfirinogen. Penambahan
Mg2+ dan adenosilmetionin pada protoporfirin menghasilkan Mg-protoporfirin
monometilester. Mg pada klorofil berfungsi sebagai pengatur absorpsi spektrum.
Mg-protoporfirin monometilester mengalami dehidrasi dan reduksi menghasilkan
protoklorofilid. Penambahan proton H+ akan menghasilkan klorofilid a. Adanya
cahaya yang diabsorpsi oleh protoklorofilid akan mereduksi klorofilid a menjadi
klorofil a (Malkin dan Niyogi 2000). Pembentukan klorofil a sangat dipengaruhi oleh
adanya cahaya (Lawlor 1987), dan perubahan klorofil a menjadi klorofil b disebabkan
karena substitusi pada gugus metil atau aldehida. Apabila gugus metil (CH3)
digantikan oleh gugus aldehida (CHO), maka akan terbentuk klorofil b (Gambar 9)
(Salisbury dan Ross 1992).
H3C
H3C
N
N
N
N Mg
H H
CH2CH3 CH3
H =CH H2C
H
H
H
HC C=O
H-C=O (jika aldehida yang menempel, bukannya CH3, maka molekul adalah klorofil b)
O=CCH2CH2
O=C-OCH3
O-CH2-C=C-CH2-CH2-CH2-C-CH2-CH2-CH2-C-CH2-CH2-CH2-C-H H
CH3
H
CH3
H
CH3
CH3
[image:42.595.83.475.421.768.2]CH3 ekor fitol (C20 H39)
Enzim SOD Sebagai Penghambat Stres Oksidatif
Cahaya sangat penting untuk fotosintesis, tetapi terdapat kemungkinan
terjadinya stres oksidatif pada intensitas cahaya yang tinggi. Pada intensitas cahaya
yang tinggi, proses fotosintesis akan mengalami penurunan karena penghambatan
oleh cahaya yang tinggi (photoinhibition) yang memproduksi radikal bebas dalam
bentuk superoksida (02-) pada fotosistem II (FS II). Produksi radikal bebas yang
tinggi dapat menyebabkan kerusakan membran tilakoid pada kloroplas, kerusakan
pada pusat reaksi dan penghambatan transpor elektron pada FS II (Hideg 1997).
Studi tentang photoinhibition telah banyak dilakukan, diantaranya mengetahui
aktivitas beberapa enzim yang berperan seperti enzim superoxide dismutase (SOD)
dan peroxidase (PER). Enzim SOD adalah salah satu enzim kunci yang menghambat
produksi 02- dalam penghambatan fotosintesis (Hideg 1997). Ketahanan tanaman
terhadap gangguan 02- pada kloroplas dipengaruhi oleh peningkatan kandungan enzim
SOD. Tanaman yang memiliki ketahanan yang tinggi terhadap aktivitas 02
-menghasilkan enzim SOD yang lebih tinggi dari tanaman yang peka (Ismail et al.
2001).
Pada percobaan pengujian Paraquat pada Crassocephalum crepidioides, untuk
tanaman resisten menghasilkan enzim SOD 138 U/mg protein dan lebih tinggi dari
tanaman peka yang menghasilkan 114 U/mg protein (Ismail et al. 2001). Pada
tanaman tembakau transgenik, kadar SOD yang tinggi lebih toleran pada intensitas
cahaya yang tinggi dibandingkan dengan tanaman kontrol. Aktivitas SOD pada
tanaman non transgenik rata-rata 50 unit/g bobot basah tergantung intensitas cahaya,
sedangkan pada tanaman transgenik terjadi peningkatan aktivitas SOD 40-60% lebih
tinggi (Slooten 1995).
Superoxide dismutase (SOD) dalam tanaman terdapat dalam beberapa bentuk
masing-masing MnSOD, FeSOD, CuSOD dan ZnSOD. Pada tembakau transgenik
yang toleran pada defisiensi Mn, luas daun tidak mengalami penurunan pada
kekurangan Mn, karena total MnSOD mengalami peningkatan. Pada tanaman non
transgenik terjadi penurunan terhadap luas daun (Yu et al. 1999).
Peningkatan Kandungan Flavonoid karena Pengaruh Cahaya
Pada pembentukan senyawa metabolit sekunder dalam tanaman, intensitas
Gambar

Dokumen terkait
Berdasarkan hasil penelitian dan pembahasan tentang hubungan antara pengetahuan dan sikap tentang pencegahan penularan filariasis dengan kondisi fisik lingkungan di
Laporan ini disusun bertujuan untuk memenuhi persyaratan laporan KKN-PPM Periode XIII tahun 2016, dimana Program Pendampingan Keluarga (PPK) adalah program unggulan
Segala puji bagi Tuhan Yang Maha Esa yang senantiasa memberikan rahmat, taufik, hidayah, serta inayah Nya, sehingga penulis dapat menyelesaikan skripsi yang berjudul “ANALISIS
Tidak terdapat perbedaan yang bermakna pada nilai VO 2 max siswi Sekolah Bola Voli Putri Tugu Muda Semarang usia 11-14 tahun saat menstruasi dan tidak menstruasi, dengan demikian
dilakukan sekolah lebih banyak pada kerja sama yang bersifat moril. Dukungan dana dalam bentuk kerja sama masih kurang, sehingga pendanaan sekolah terkadang
If money supply decrease, it will rises interest rate and decrease total output for any given price, so the aggregate demand curve will shift to the left..
Sifat fisika tanah yang baik akan berpengaruh baik terhadap pertumbuhan tanaman dan hasil panen, karena sifat fisika tanah berpengaruh nyata terhadap peredaran oksigen dan
Therefore, learning how to avoid nonproductive conflict and embrace productive conflict is critical when de- veloping creative work environments Part V concludes with the