PERANAN GULMA SEBAGAI INANG ALTERNATIF
GEMINIVIRUS DI PERTANAMAN CABAI DI JAWA
RIKA MELIANSYAH
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Peranan Gulma sebagai Inang Alternatif Geminivirus di Pertanaman Cabai di Jawa adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Februari 2010
ABSTRACT
RIKA MELIANSYAH. The Role of Weeds as Alternative Host for Geminivirus Infecting Chili Pepper in Java. Supervised by SRI HENDRASTUTI HIDAYAT and KIKIN HAMZAH MUTAQIN.
Geminivirus infection is one of the limiting factors in the production of chili pepper. The virus has a wide host range including cultivated plants and weeds. Infected weeds may play an important role in disease epidemic. Unfortunately, little is known about weeds species that may serve as alternative host for geminivirus. This research was conducted to determine weed species that may serve as alternative host for geminivirus and to identify geminivirus on weeds around chili pepper field. This study includes four activities; (1) weed collection and identification, conducted through field survey to chili pepper growing areas in West Java (Bandung, Cianjur, Sukabumi, Bogor, Garut), Central Java (Brebes and Magelang), Yogyakarta (Sleman) and East Java (Malang and Kediri), (2) detection of geminivirus from weed species showing symptom using PCR technique, (3) analysis of genetic diversity of geminivirus infecting weeds, (4) host range evaluation of geminivirus involving several weed species. Field surveys conducted in early 2009 reveals that the diversity and distribution of weed species in chili pepper field were determined among others by altitude, crop management and planting pattern. Weed in the family of Compositae and Euphorbiaceae are the most dominant weeds and has potential as an alternative host. Artificial inoculation of geminivirus (Begomovirus ‘Segunung’) using insect vector, Bemisia tabaci, was succesfully transmitted the virus and caused two types of symptoms i.e. netting (Ageratum conyzoides, Porophillum ruderale and Spilanthes iabadicensis) and leaf malformation (Synedrella nodiflora and Galinsoga parviflora). Geminivirus infection was detected using PCR technique from AgrBgr, AgrSkm, AgrMgl, AgrJgy, SplMgl, CtpMgl and PrlBgr.Virus isolates further genetic analysis showed that those geminivirus can be differentiated into two clusters, showing the possible genetic differences among them. They neither have a close relationship with other geminiviruses published earlier in the GenBank.
Keywords: Chili, Weeds, Geminivirus, alternative host, genetic diversity
RIKA MELIANSYAH. Peranan Gulma sebagai Inang Alternatif Geminivirus di Pertanaman Cabai di Jawa. Dibimbing oleh SRI HENDRASTUTI HIDAYAT dan KIKIN HAMZAH MUTAQIN.
Geminivirus merupakan salah satu faktor pembatas budidaya cabai. Virus tersebut memiliki kisaran inang yang luas pada tanaman budidaya maupun gulma. Peranan gulma di sekitar pertanaman cabai dalam perkembangan penyakit yang disebabkan geminivirus belum banyak diketahui, sehingga perlu dilakukan deteksi geminivirus dari gulma dengan tujuan untuk mengidentifikasi kelompok atau jenis gulma yang dapat menjadi inang geminivirus serta mengidentifikasi geminivirus pada gulma di pertanaman cabai. Selanjutnya peran gulma dalam penyebaran penyakit yang disebabkan oleh geminivirus dapat dievaluasi.
Kegiatan yang dilakukan untuk mengkaji peranan gulma sebagai inang alternatif geminivirus di pertanaman cabai di Jawa terdiri dari: 1) identifikasi jenis-jenis gulma yang berasal dari pertanaman cabai di Jawa Barat yang meliputi Bandung, Bogor, Cianjur, Sukabumi, dan Garut, di Jawa Tengah yang meliputi Brebes dan Magelang, di Daerah Istimewa Yogyakarta adalah Sleman, di Jawa Timur meliputi Malang dan Kediri; 2) deteksi geminivirus pada gulma menggunakan teknik polymerase chain reaction (PCR); 3) analisis keragaman genetik geminivirus asal gulma bergejala; 4) pengujian kisaran inang geminivirus pada kelompok gulma.
Berdasarkan hasil survei di pertanaman cabai di Jawa terdapat 27 spesies gulma dari 15 famili tumbuhan. Spesies gulma yang ditemukan pada setiap lokasi survei memiliki perbedaan baik jumlah maupun keragamannya. Famili gulma yang spesiesnya paling banyak ditemukan adalah Compositae dan Euphorbiaceae. Beberapa hal yang berpengaruh terhadap pertumbuhan dan penyebaran gulma adalah faktor lingkungan seperti jenis dan tingkat kesuburan tanah, ketinggian tempat, serta keadaan air tanah dan praktek budidaya seperti pengolahan tanah dan pengendalian gulma. Ditemukan enam spesies gulma yang diduga terinfeksi geminivirus di lapangan dengan gejala penguningan tulang daun sehingga menyerupai jala(netting).
Gulma yang diduga terinfeksi geminivirus dari lapangan berdasarkan gejala yang diamati kemudian dideteksi virusnya dengan teknik PCR. Fragmen DNA sasaran berukuran 760 bp berhasil teramplifikasi dari sembilan spesies gulma yang bergejala yaitu Ageratum conyzoides Bogor (AgrBgr), A. conyzoides Sukabumi (AgrSkm), A. conyzoides Magelang (AgrMgl), A. conyzoides Yogyakarta (AgrJgy), A. conyzoides Garut (AgrGrt),Centipeda minima Magelang (CtpMgl), Acalypha boehmeroides Yogyakarta (AclJgy), Porophyllum ruderale Bogor (PrlBgr), Spilanthes iabadicensis (SplMgl). Empat gulma bergejala lainnya (Galinsoga parviflora Garut, Eclipta prostrata Brebes, Ipomoea triloba Garut, dan Ludwigia peruviana Cianjur) memberikan hasil negatif dalam deteksi virus.
beberapa geminivirus yang ada di GenBank. Hasil analisis kekerabatan menunjukkan bahwa tujuh sampel geminivirus asal gulma dapat dibedakan dalam dua kelompok. Isolat geminivirus pada gulma yang berasal dari daerah yang sama atau berdekatan tergolong ke dalam kelompok yang sama. Kekerabatannya tidak terlalu dekat dengan geminivirus lain yang telah dipublikasikan di GenBank.
Infeksi alami geminivirus pada gulma umumnya menyebabkan gejala netting, sedang infeksi buatan melalui penularan dengan kutukebul Bemisia tabaci dapat menyebabkan gejala netting pada A. conyzoides, P. ruderale, S. iabadicensis atau malformasi daun dan keriting pada Synedrella nodiflora dan G. parviflora. Hasil pengujian kisaran inang pada gulma dideteksi kembali dengan PCR. Fragmen DNA hasil amplifikasi berhasil diperoleh dari tanaman yang menunjukkan gejala maupun yang tidak menunjukkan gejala. Sebaliknya, tanaman yang menunjukkan gejala tidak selalu menghasilkan fragmen DNA dalam teknik PCR. Keadaan tersebut menunjukkan bahwa gulma yang tidak menunjukkan gejala tidak selalu terinfeksi virus.
©Hak Cipta milik IPB, tahun 2010
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau
menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan,
penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau
tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang
wajar IPB
PERANAN GULMA SEBAGAI INANG ALTERNATIF
GEMINIVIRUS DI PERTANAMAN CABAI DI JAWA
RIKA MELIANSYAH
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Mayor Fitopatologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Disetujui Komisi Pembimbing
Dr. Ir. Sri Hendrastuti Hidayat, MSc. Ketua
Dr. Ir. Kikin Hamzah Mutaqin, MSi. Anggota
Diketahui
Ketua Mayor Fitopatologi
Dr. Ir. Sri Hendrastuti Hidayat, MSc.
Dekan Sekolah Pascasarjana
Prof. Dr. Ir. Khairil A Notodiputro, MS.
Tanggal Ujian: 19 Januari 2010 Tanggal Pengesahan
Judul Tesis : Peranan Gulma sebagai Inang Alternatif Geminivirus di Pertanaman Cabai di Jawa
Nama : Rika Meliansyah
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga penelitian dan penulisan tesis berjudul “Peranan Gulma sebagai Inang Alternatif Geminivirus di Pertanaman Cabai di Jawa” dapat diselesaikan. Penelitian ini merupakan bagian dari proyek kerjasama Australian Centre for International Agricultural Research (ACIAR) dan Asian Vegetable Research and Development Center (AVRDC) untuk mengendalikan penyakit kuning cabai di Indonesia melalui Dr. Ir. Sri Hendrastuti Hidayat, MSc.
Dalam penyelesaian tesis ini, penulis banyak mendapat bantuan dari berbagai pihak. Oleh karena itu, penulis menyampaikan ucapan terima kasih dan penghargaan yang setulusnya kepada:
1. Dr. Ir. Sri Hendrastuti Hidayat, MSc. dan Dr. Ir. Kikin Hamzah Mutaqin, MSi. selaku komisi pembimbing atas kesabarannya di dalam memberikan bimbingan, saran dan masukan selama penelitian hingga penulisan tesis ini. 2. Dr.Sri Sudarmiyati Tjitrosoedirdjo di SEAMEO BIOTROP selaku ahli gulma
yang telah membantu dalam mengidentifikasi gulma dan kesediaannya menjadi penguji luar komisi yang telah memberi saran dan masukan.
3. Dr. Sukamto di Balittro yang telah memberi masukan dalam pelaksanaan metode ekstraksi DNA.
4. Dr. Soedarsono Riswan beserta staf Herbarium Bogoriense yang telah memberikan motivasi dan membantu dalam mengidentifikasi gulma.
5. Pak Edi Supardi selaku Laboran dan teknisi Laboratorium Virologi Tumbuhan serta Pak Saefudin (Mput) yang telah membantu kelancaran pengerjaan penelitian di laboratorium dan Rumah Kaca Cikabayan.
6. Mba Tuti Legiastuti atas persaudaraan, kebersamaan dan bantuannya dalam proses penelitian di Laboratorium Virologi Tumbuhan. Rekan-rekan mahasiswa Mayor Fitopatologi angkatan 2007: Weni willia, Wartono, Heri Harti, Eva, Donna dan Bruce Ochieng Obura atas kebersamaannya selama di IPB; teman-teman di laboratorium Virologi Tumbuhan: Rita Noveriza, Dwi Wahyuni Ganefianti, Ifa Manzila, Irwan Lakani, Sat Rahayuwati, Eva Dwi Fitriasari, Donnarina Simanjuntak, Devi Agustina, Budi Sri Utami, Fitrianingrum Kurniawati, Rohana dan temen-teman mahasiswa S1; teman seperjuangan: Wawan Kurniawan, Hendrival dan Lindung Tripuspasari, atas kebersamaan, persahabatan serta semangat yang telah diberikan.
Ucapan terima kasih penulis haturkan kepada suami tercinta Abi Coky Irawan SP. atas izin, do’a, kasih sayang, cinta, fasilitas, dukungan, semangat dan pengorbanan yang telah diberikan. Terima kasih atas pengertian dan pengorbanan anak-anak tercinta: Ananda Nurul Fauziyah, Abdul Ghani Bahri, Ananda Nadia Husna dan Azka Muhamad Yusuf. Keceriaan, keluguan dan keberadaan kalian telah menjadi penyemangat dan sumber kekuatan sehingga penulis dapat menjalani dan menyelesaikan sekolah pascasarjana di IPB dengan penuh nuansa.
Penulis mendo’akan semoga Allah SWT memberikan limpahan rahmat dan karunia-Nya kepada semuanya. Akhirnya penulis berharap semoga tesis ini dapat memberikan manfaat bagi pengembangan ilmu pengetahuan di masa yang akan datang.
Bogor, Februari 2010
Penulis dilahirkan di Bandung, Jawa Barat, pada tanggal 26 Mei 1977 dari pasangan Bapak Kgs. Moch. Hasan Zaenudin dan Ibu Tintin Priyatni. Penulis merupakan putri terakhir dari tiga bersaudara. Pada Tahun 2001 menikah dengan Coky Irawan, SP dan dikaruniai empat orang putra dan putri, Ananda Nurul Fauziyah, Abdul Ghani Bahri, Ananda Nadia Husna, dan Azka Muhamad Yusuf.
Tahun 1996 penulis lulus dari SMA Negeri 4 Bandung dan pada tahun yang sama melanjutkan studi di Jurusan Hama dan Penyakit Tumbuhan, Fakultas Pertanian Universitas Padjadjaran. Pendidikan Sarjana diselesaikan oleh penulis pada bulan Mei 2001. Pada Tahun 2005, penulis diterima sebagai staf pengajar tetap di Jurusan Hama dan Penyakit Tumbuhan, Fakultas Pertanian, Universitas Padjadjaran. Tahun 2007 penulis melanjutkan studi di Sekolah Pascasarjana Institut Pertanian Bogor, Program Studi Entomologi-Fitopatologi mayor Fitopatologi dengan Beasiswa Pendidikan Pascasarjana dari DIKTI.
1
PENDAHULUAN
Latar Belakang
Geminivirus merupakan salah satu patogen pada beberapa tanaman budidaya seperti tomat, mentimun, singkong dan kacang-kacangan. Pada tanaman cabai virus ini dapat menyebabkan penyakit daun keriting kuning cabai yang menjadi salah satu faktor pembatas produksi. Serangan geminivirus pada tanaman cabai di Indonesia dilaporkan terjadi di daerah Jawa Barat sejak tahun 1999 (Hidayat et al. 2006). Selanjutnya dilaporkan bahwa serangan geminivirus pada pertanaman cabai di Daerah Istimewa Yogyakarta, Jawa Tengah dan Jawa Barat berturut-turut pada cabai rawit dan cabai besar mencapai 75 - 100% dan 10 - 35%. Kehilangan hasil akibat geminivirus dapat mencapai 20 - 100% (Sulandari et al. 2006). Epidemi penyakit telah terjadi di sentra produksi cabai di Indonesia terutama daerah Jawa pada tahun 2000 sampai 2003 dan sampai sekarang belum ditemukan teknik pengendalian yang tepat.
Epidemi penyakit tanaman dapat terjadi karena adanya inang yang rentan, patogen yang virulen, lingkungan yang mendukung perkembangan penyakit pada suatu populasi dalam waktu tertentu. Pengenalan sifat patogen, inang, lingkungan dan interaksi dengan faktor-faktor yang mempengaruhi perkembangan penyakit merupakan salah satu cara untuk merancang strategi pengendalian yang tepat. Menurut Harrison & Robinson (1999) geminivirus sebagai patogen pada tanaman memiliki sifat hanya ditularkan melalui serangga vektor Bemisia tabaci serta melalui penyambungan antara tanaman sakit dengan tanaman sehat, tetapitidak dapat ditularkan secara mekanik ataupun melalui benih. Geminivirus memiliki inang dari beberapa tanaman budidaya dan gulma. Gulma yang tumbuh di sekitar tanaman budidaya dapat berperan sebagai inang alternatif yang menjadi sumber inokulum untuk geminivirus.
(Wu et al. 2007). Sulandari et al. (2006) melaporkan Hyptis brevipes, Physalis floridana, Crotalaria juncea, Ageratum conyzoides bunga putih dan ungu rentan terhadap geminivirus isolat Segunung. Demikian pula Sukamto et al. (2005) melaporkan bahwa babadotan (A. Conyzoides) merupakan jenis gulma yang dapat terinfeksi geminivirus baik di daerah tropis maupun subtropis.
Beberapa penelitian menunjukkan adanya keragaman gejala geminivirus pada gulma (Roye 1997, Kashina et al. 2002, Rajeshwari et al. 2005, Chatterjee
et al. 2007). Gejala infeksi geminivirus pada A. conyzoides adalah penguningan tulang daun atau vein clearing (Sukamto et al. 2005), tulang daun menebal, daun melengkung ke bawah seperti mangkuk terbalik dan pertumbuhan tanaman terhambat (Haerani & Hidayat 2003). M. coromandelianum yang terinfeksi geminivirus di Cina menunjukkan gejala daun keriting, tulang daun menebal dan
pertumbuhan terhambat (Wu et al. 2007). Gejala infeksi geminivirus berupa
mosaik kuning pada tulang daun ditemukan pada gulma Croton bonplandianum, A. conyzoides, Urena lobata, Sida acuminata, S. rhombifolia, Eclipta alba, Abelmoschus esculentus di India Timur (Chatterjee et al. 2007). Gulma yang terinfeksi geminivirus menunjukkan gejala yang bervariasi tetapi gejala yang banyak ditemukan pada gulma adalah penguningan tulang daun (netting). Gejala infeksi geminivirus yang bervariasi pada tanaman dapat menjadi salah satu indikator adanya keragaman geminivirus.
3 Tujuan Penelitian
Penelitian ini bertujuan untuk mengidentifikasi kelompok atau jenis gulma yang dapat menjadi inang geminivirus dan mengidentifikasi geminivirus yang menginfeksi gulma pada pertanaman cabai. Selanjutnya peran gulma dalam penyebaran penyakit daun keriting kuning pada cabai yang disebabkan oleh geminivirus dapat dievaluasi.
Manfaat Penelitian
TINJAUAN PUSTAKA
Karakteristik Geminivirus
Morfologi, Taksonomi dan Molekuler
Geminivirus merupakan salah satu kelompok virus patogen tumbuhan
terbesar. Nama geminivirus berasal dari karakteristik morfologi partikel virus
berupa isometrik kembar yang selalu berpasangan (twinned-geminate) dengan
ukuran berkisar 20-30 nm. Secara genetik geminivirus memiliki genom berupa
DNA utas tunggal (ssDNA) yang berbentuk sirkuler (Harrison & Robinson 1999). Dhar & Singh (1996) dan Harison & Robinson (1999) menjelaskan bahwa
geminivirus diklasifikasikan ke dalam famili Geminiviridae yang dibagi ke dalam
tiga genus yaitu Mastrevirus, Curtovirus, dan Begomovirus yang didasarkan atas
perbedaan kisaran inang, serangga vektor dan genomnya. Mastrevirus adalah
geminivirus yang menginfeksi tanaman inang monokotil, ditularkan oleh serangga
vektor wereng daun dan memiliki struktur genom monopartit. Curtovirus,
menginfeksi tanaman dikotil dengan vektor dan struktur genom sama dengan
genus pertama. Begomovirus, menginfeksi tanaman dikotil dan ditularkan oleh
kutukebul (Bemisia tabaci) memiliki struktur genom monopartit atau bipartit.
Menurut Van Regenmortel (2000) selain ketiga genus tersebut, ada satu genus
lainnya yang termasuk kedalam famili Geminiviridae yaitu Topocuvirus yang
menginfeksi tanaman dikotil, ditularkan oleh wereng pohon dan memiliki genom
monopartit.
Diantara genus-genus tersebut diatas, Begomovirus merupakan genus
dengan jumlah anggota terbesar. Genus Begomovirus terdiri dari virus-virus
dengan genom bipartit atau monopartit. Sebagian besar anggota genus
Begomovirus memiliki genom bipartit yang terdiri dari dua molekul DNA utas tunggal sirkuler yang berbeda yaitu DNA A dan DNA B dengan masing-masing
berukuran 2,7-2,8 kb. Begomovirus dengan genom monopartit, semua gennya
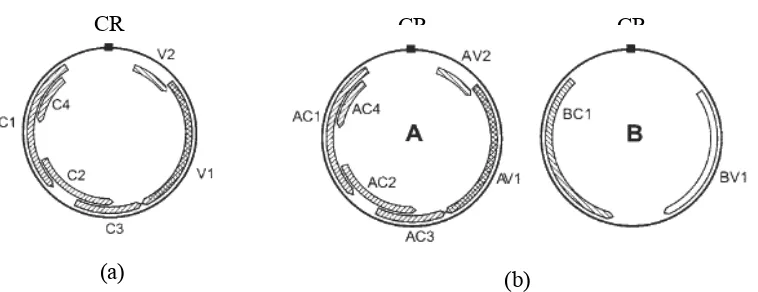
terletak pada satu DNA utas tunggal sirkuler yang berukuran 2,8 kb (Gambar 1).
Komponen DNA geminivirus baik monopartit maupun bipartit mengandung
gen-gen yang menyandikan protein dengan fungsi yang khusus (Tabel 1). Gen
5
runutan DNA dengan derajat kesamaan yang tinggi antara anggota geminivirus
dalam satu genus (Rojas et al. 1997). Tabel 1 Jenis dan fungsi gen Begomovirus
Monopartit Bipartit Protein dan fungsi
V1 AV1 Protein selubung virus (coat protein), berperan
dalam penyebaran virus, pergerakan virus di dalam inangnya dan berperan dalam penularan yaitu melindungi partikel virus dari degradasi pada saat
masuk sistem pencernaan kutukebul (Briddon et al.
1989; Morin et al. 2000; Hull 2002; Harrison &
Robinson 1999)
V2 AV2 Movement protein (MP), berperan dalam pergerakan
virus dalam tanaman terinfeksi (Hull 2002; Harrison & Robinson 1999)
C1 AC1 Replication-associated protein (Rep), berperan
dalam proses replikasi virus (Desbiez et al. 1995; Hull 2002)
C2 AC2 Transcriptional activator protein (TrAP), protein
yang terlibat dalam pengaktifan transkripsi dari promoter protein selubung. Protein ini ditemukan pada inti dan berperan dalam patogenisitas virus (van Wezel et al. 2001)
C3 AC3 Replication enhancer protein (REn), protein ini
berinteraksi dengan protein C1 dan meningkatkan
akumulasi DNA virus (Hanleybowdoin et al. 2000)
C4 AC4 Berinteraksi dengan C1 dan V2, berperan dalam
penentu gejala dan terlibat dalam inisiasi
pembelahan sel (Krake et al. 1998), pergerakan
DNA virus dari sel ke sel (Rojas et al. 2001),
mematahkan mekanisme pertahanan tanaman (van Wezel et al. 2002),
- BV1 Nuclear shuttle protein (NSP) dan menyandikan
virion DNA B (Hull 2002; Salati 2002)
- BC1 Movement protein (MP), berperan dalam pergerakan
virus di dalam tanaman terinfeksi (Hull 2002; Salati 2002).
Gambar 1 Organisasi genom Begomovirus: Genom monopartit (a), Genom bipartit
(b) (Hull 2002)
Daerah Penyebaran dan Kisaran Inang
Geminivirus memiliki daerah penyebaran yang sangat luas terutama di
daerah tropis dan subtropis yang dapat mendukung perkembangan kutukebul
dengan baik. Dilaporkan bahwa di Meksiko, Venezuela, Amerika Serikat
(Florida), dan beberapa negara di Amerika Tengah serta Karibia infeksi
geminivirus mengakibatkan hancurnya industri tomat (Polston & Anderson 1997).
Infeksi geminivirus isolat cabai di Texas dan tomato yellow leaf curl virus di
Israel menyebabkan kehilangan hasil 100% (Stenger et al. 1990; Pico et al. 1996). Di Indonesia geminivirus pertama kali diketahui menyerang tanaman tembakau di
Bojonegoro, Jawa Timur yang menyebabkan kerusakan sebesar 30%
(Trisusilowati 1990). Infeksi geminivirus juga telah terdeteksi pada tanaman cabai
di daerah Jawa Barat, Daerah Istimewa Yogyakarta dan Kalimantan Selatan
(Rusli et al. 2000; Sulandari et al. 2001). Geminivirus telah menyebabkan
epidemi penyakit di beberapa sentra produksi cabai di Indonesia terutama di Jawa
mulai tahun 2000 sampai 2003.
Geminivirus memiliki kisaran inang yang cukup luas baik pada tanaman
budidaya maupun gulma. Tomat, cabai, tembakau, mentimun, terung, ubikayu dan
kacang-kacangan adalah inang geminivirus dari tanaman budidaya. Babadotan
(A. conyzoides) merupakan gulma yang telah dilaporkan sebagai inang geminivirus di daerah tropis dan subtropis (Sukamto et al. 2005). Gulma lainnya
yang dapat menjadi inang geminivirus adalah Sida spp., Macroptilium
lathyroides, dan Wissadula amplissima yang ditemukan di Jamaica. Malvastrum
CR CR CR
7
coromandelianum merupakan gulma yang dapat menjadi inang geminivirus di
Guangdong, Cina (Wu et al. 2007). Achyranthes aspera, Euphorbia heterophylla, Nicandra physaloides, Commelina erecta, Amaranthus spinosus, Erigeron floribundus, A. conyzoides, Bidens pilosa, Sida acuta, Ipomoea batatas,
Amaranthus viridis, Portulaca oleracea, Cassia obtusifolia, Euphorbia hirta,
Calopogonium mucunoides, Clotalaria retusa, Trianthema portulacastrum,
Alternanthera sessilis, Celosia trigyna, Commelina diffusa, Chromolaena odorata, Eclipta prostrata, Synedrella nodiflora, Cassia occidentalis, Spigelia anthelmia, Boerhavia diffusa, Physalis angulata dan Acanthospermum hispidis
adalah 28 spesies gulma yang potensial sebagai sumber tomato yellow leaf curl geminivirus (TYLCV) di Tanzania. H. brevipes, P. floridana, C. juncea, A. conyzoides bunga putih dan ungu adalah gulma yang rentan terhadap geminivirus
isolat Segunung pada pengujian di rumah kaca (Sulandari et al. 2006). Demikian
pula Brown & Nelson (1988) melaporkan terdapat beberapa spesies tanaman
termasuk gulma, famili Solanaceae, Leguminosae, Malvaceae dan Asclepiadaceae
yang merupakan inang TYLCV di Meksiko.
Patogenesis dan Gejala Infeksi
Sumber inokulum geminivirus berada pada tanaman inang, sisa-sisa
tanaman dan inang alternatif. Secara alamiah geminivirus dapat sampai ke
tanaman atau berpindah dari satu tanaman ke tanaman lainnya apabila ada
serangga vektor kutukebul (B. tabaci Genn) karena virus ini tidak ditularkan
melalui biji ataupun secara mekanik. Setelah virus sampai pada inang yang sesuai
maka virus akan melepaskan selubung protein kemudian memanfaatkan DNA
tanaman untuk bereplikasi kemudian berpindah dari satu sel ke sel lainnya
mengikuti aliran nutrisi dan air tumbuhan sehingga gejala akan bersifat sistemik
(Hull 2002).
Gejala yang ditimbulkan geminivirus bervariasi tergantung pada strain
virus, jenis tanaman, fase pertumbuhan tanaman dan beberapa faktor lainnya.
Gejala infeksi virus pada cabai, berupa daun menggulung, penebalan tulang daun,
bercak-bercak klorotik pada daun, klorosis di antara tulang daun, malformasi
gejala awal yang ditimbulkan pada daun cabai rawit maupun cabai besar berupa
penjernihan tulang daun (vein clearing) yang kemudian berkembang menjadi
warna kuning, penebalan tulang daun, dan penggulungan daun (cupping). Infeksi
lanjut geminivirus menyebabkan daun-daun mengecil, berwarna kuning cerah dan
tanaman menjadi kerdil. A. conyzoides yang terinfeksi geminivirus menunjukkan
gejala vein clearing atau penjernihan tulang daun (Sukamto et al. 2005). Menurut Haerani & Hidayat (2003) infeksi geminivirus menghasilkan gejala yang beragam
pada studi penularan geminivirus asal A. conyzoides terhadap beberapa tanaman
Solanaceae (tomat, tembakau dan cabai rawit). Daun tanaman tomat yang
terinfeksi mengeriting ke arah bawah, tulang daun menebal, dan tangkai daun
melengkung ke bawah. Tanaman tembakau yang terinfeksi menunjukkan gejala
berupa daun yang menggulung terutama daun muda, tulang daun menebal dan
daun melengkung kearah bawah. Tanaman cabai rawit yang terinfeksi
menunjukkan gejala daun yang melepuh, tulang daun menebal dan daun
melengkung ke atas.
Gulma yang terinfeksi geminivirus menunjukkan gejala yang bervariasi
tetapi gejala yang banyak ditemukan pada gulma adalah penguningan tulang daun
(netting). Gejala infeksi geminivirus pada A. conyzoides adalah penjernihan tulang
daun atau vein clearing (Sukamto et al. 2005), tulang daun menebal, daun
melengkung ke bawah seperti mangkuk terbalik dan pertumbuhan tanaman
terhambat (Haerani & Hidayat 2003). M. coromandelianum yang terinfeksi
geminivirus di Cina menunjukkan gejala daun keriting, tulang daun menebal dan pertumbuhan terhambat (Wu et al. 2007). Gejala infeksi geminivirus berupa mosaik kuning pada tulang daun ditemukan pada gulma Croton bonplandianum,
A. conyzoides,U. lobata,S. acuminate, S. Rhombifolia, E. alba, A. esculentus di India Timur (Chatterjee et al. 2007).
Penularan Geminivirus
Kajian mengenai penularan geminivirus telah banyak dilakukan oleh para
peneliti. Hal ini disebabkan informasi tersebut sangat penting dalam epidemiologi
penyakit yang disebabkan oleh geminivirus sebagai salah satu patogen penting
yang telah menyebabkan epidemi pada tanaman cabai. Brown & Nelson (1988)
9
oleh geminivirus tidak dapat ditularkan secara mekanik dengan cairan perasan,
tetapi melalui serangga vektor. Hal ini didukung juga oleh Hull (2002) yang
menyatakan bahwa geminivirus tidak dapat menular secara mekanik atau pun
melalui benih, hanya dapat menular dengan cara penyambungan tanaman sakit
pada tanaman sehat serta melalui serangga vektor B. tabaci.
Penularan di alam secara alami diketahui hanya melalui vektor B. tabaci
sehingga perannya menjadi sangat penting dalam penyebaran geminivirus.
Berdasarkan hasil penelitian Rusli et al. (2000) geminivirus isolat Segunung yang ditularkan secara mekanik pada tanaman cabai besar dan cabai rawit tidak
menghasilkan gejala sedangkan penularan dengan cara penyambungan
menghasilkan gejala dengan kejadian penyakit sebesar 71,4% pada tanaman cabai
besar dan 57,1% pada cabai rawit. Keefektifan penularan tertinggi diperoleh pada
perlakuan penularan melalui serangga vektor yaitu mencapai 70-80%.
Hubungan antara B. tabaci dan geminivirus berdasarkan lamanya virus
bertahan pada vektor bersifat persisten sirkulatif non propagatif yaitu virus
tersebut berada dalam tubuh serangga untuk kemudian akan ditularkan pada
tanaman sehat melalui proses makan (Harrison & Robinson 1999). Efisiensi
penularan geminivirus dengan B. tabaci melalui proses makan sangat dipengaruhi
oleh lamanya masa akuisisi serangga tersebut, selain oleh jumlah serangga yang
menularkan geminivirus pada tanaman sehat (Rachmawati 2003). Periode akuisisi
minimum B. tabaci untuk menularkan TYLCV adalah selama 15 menit dan terus
meningkat hingga mencapai tingkat maksimum setelah akuisisi selama 24 jam
(Mehta et al.1994). Menurut Aidawati (2006) B. tabaci yang melalui periode
makan akuisisi (PMA) dan periode makan inokulasi (PMI) masing-masing selama
15 menit mampu menularkan geminivirus walaupun dengan efisiensi penularan
yang berbeda-beda untuk tiap kombinasi biotipe B. tabaci dan strain geminivirus yang berbeda. Pada PMA dan PMI tiga dan enam jam strain geminivirus isolat
Bogor menghasilkan efisiensi penularan 80 − 100% dengan masa inkubasi 9 hari.
B. tabaci termasuk ke dalam ordo Hemiptera dengan famili Aleyrodidae (Henneberry & Castle 2001). Serangga ini memiliki kisaran inang meliputi
berbagai tanaman budidaya dan gulma, dapat berkembang dengan baik di daerah
500 jenis tanaman yang dapat menjadi inang B. tabaci dengan preferensi yang berbeda. Salah satu faktor yang mempengaruhinya adalah permukaan daun,
serangga tersebut umumnya memiliki preferensi yang tinggi pada permukaan
daun yang berambut (hirsute) dibandingkan dengan daun yang permukaannya
tidak berambut (glabrous). Basu (1995) melaporkan ada 540 spesies dari 77 famili tanaman yang dapat menjadi inang B. tabaci. Sementara itu, Bezerra et al. (2004)
menyatakan bahwa Basu (1995) hanya melaporkan tanaman inang B. tabaci yang
bersifat komersial sehingga masih diperlukan penelitian terhadap tumbuhan non
komersial yaitu gulma. Menurut Bezerra et al. (2004) gulma Acanthospernum
hispidum paling banyak terinfestasi B. tabaci pada lahan tomat di daerah Brazil
dibandingkan dengan Amaranthus reflexus, Datura stramonium dan Euphorbia
heterophylla.
Deteksi dan Identifikasi Geminivirus
Deteksi geminivirus secara konvensional dapat dilakukan antara lain melalui
pengamatan gejala, uji penularan dengan vektor dan pengamatan partikel dengan
mikroskop elektron. Teknik deteksi terhadap virus semakin berkembang seiring
dengan berkembangnya metode biologi molekuler. Salah satu teknik tersebut
yaitu Polymerase chain reaction (PCR). Menurut Wahyudi (2000) PCR
merupakan cara yang sangat peka untuk melakukan deteksi dan identifikasi
patogen tanaman. Teknik ini memberikan beberapa kelebihan bila dibandingkan
cara konvensional, antara lain tidak diperlukan pembiakan patogen pada media.
Hal tersebut sangat menguntungkan untuk patogen yang belum dapat dibiakkan
secara in vitro seperti virus.
Teknik PCR banyak digunakan untuk mendeteksi geminivirus pada berbagai
tanaman budidaya dan juga gulma. Hidayat et al. (1999) telah berhasil mendeteksi geminivirus asal cabai dari beberapa daerah di Bogor melalui teknik PCR dan
restriction fragment length polymorphism (RFLP). Teknik ini juga digunakan
Sudiono et al. (2004) untuk mendeteksi geminivirus pada cabai asal Sumatera.
Sulandari et al. (2006) menggunakan teknik PCR untuk mendeteksi geminivirus
dari enam famili tumbuhan yang terdiri dari 30 jenis tanaman dan gulma. Hallan
11
bonpladianum, dan M. coromandelianum yang umumnya tumbuh di daerah pertanian Lucknow, India. Geminivirus pada gulma Sida spp, M. lathyroides dan
W. amplissima yang berasal dari Jamaica berhasil dideteksi dan diidentifikasi dengan menggunakan teknik PCR yang dikombinasikan dengan teknik RFLP.
Peran Gulma sebagai Sumber Infeksi
Ekologi Gulma
Gulma adalah tumbuhan selain yang dibudidayakan, kehadirannya tidak
diinginkan pada lahan pertanian karena dapat menurunkan hasil yang bisa dicapai
oleh tanaman budidaya. Batasan gulma bersifat teknis dan plastis. Teknis, karena
berkait dengan proses produksi suatu tanaman pertanian. Plastis, karena batasan
ini tidak mengikat suatu spesies tumbuhan dengan pengertian bahwa pada tingkat
tertentu tanaman budidaya dapat menjadi gulma sebaliknya tumbuhan yang
biasanya dianggap gulma dapat pula dianggap tidak mengganggu (Sastroutomo
1990).
Ekologi gulma dalam pertanian berkaitan dengan hubungan populasi
gulma dan tanaman budidaya. Perubahan populasi gulma di suatu tempat
dipengaruhi oleh beberapa faktor diantaranya, jasad pengganggu pada gulma,
karakteristik gulma, faktor lingkungan dan aktivitas manusia (Tjitrosoedirdjo
1984). Pada ekosistem pertanian aktivitas manusia sangat berpengaruh terhadap
jumlah dan keanekaragaman populasi gulma. Gulma juga dapat memberikan
pengaruh negatif terhadap tanaman budidaya walaupun di pihak lain gulma
merupakan suatu komponen yang dapat menjaga keseimbangan alami suatu
ekosistem.
Kehadiran gulma pada lahan pertanian sulit untuk dihindarkan.
Pertumbuhan gulma dan luas penyebarannya di suatu daerah sangat dipengaruhi
oleh keadaan lingkungan, teknik budidaya, dan jenis tanaman yang
dibudidayakan. Berdasarkan hasil survei Everaarts (1981) ditemukan ada 35 jenis
gulma yang terbagi kedalam 13 familia di sekitar pertanaman sayuran di wilayah
dataran tinggi di pulau Jawa, di antaranya adalah Amaranthaceae (Alternanthera
philoxeroides, Amaranthus lividus), Caryophyllaceae (Cerastium glomeratum,
Commelinaceae (C. diffusa), Compositae (A. conyzoides, A. houstonianum,
Artemisia vulgaris, G. parviflora, G. quadriradiata, Melampodium perfoliatum), Cruciferae (Capsella bursa-pastoris, Cardamine hirsuta), Fumariaceae (Fumaria rostellata), Oxalidaceae (Oxalis corniculata, O. corymbosa, O. latifolia), Polygonaceae (Polygonum longisetum, P. nepalense, P. persicaria), Portulacaceae (Portulaca oleracea), Rubiaceae (Borreria alata, Richardia brasiliensis),
Solanaceae (Datura stramonium, Nicandra physalodes), Cyperaceae (Cyperus
rotundus), dan Gramineae (Cynodon dactylon, Digitaria ciliaris,Eleusine indica,
Panicum repens, Paspalum paspaloides, Poa annua). Menurut Sembiring (2007)
gulma yang ditemukan pada pertanaman cabai di Bengkulu yaitu A. conyzoides,
Borreria alata, B. laevis, Cleome rutidosperma, Croton hirtus, Callopogonium muconoides, Mikania micrantha, Mimosa invisa, Oxalis barrelieli, Phyllanthus niruri, Physalis angulata, Stachytarpeta indica, Spigelia anthelmia, Synedrella nodiflora, Axonophus compressus, Eleusine indica, dan Eragnotis tenela.
Identifikasi Gulma
Identifikasi gulma berkaitan dengan pengenalan spesies-spesies gulma
berdasarkan sifat-sifat morfologi baik vegetatif maupun generatif. Identifikasi ini
dapat menjadi salah satu dasar dalam pengelompokan atau klasifikasi gulma.
Salah satu contoh pengelompokan berdasarkan morfologi yang berhubungan
dengan pengelolaan gulma adalah berdasarkan jenis daun yaitu berdaun sempit
dan berdaun lebar. Gulma berdaun sempit terdiri dari rumput-rumputan dan
teki-tekian sedangkan gulma berdaun lebar pada umumnya adalah tumbuhan
berkeping dua (dikotil) dan beberapa berkeping satu (monokotil) dengan daun
lebar. Ketiga kelompok gulma ini memiliki karakteristik tersendiri yang
memerlukan strategi khusus untuk mengendalikannya.
Menurut Everaarts (1981) dalam mengidentifikasi gulma dapat ditempuh
satu atau kombinasi dari sebagian atau seluruh cara-cara seperti, (1)
membandingkan gulma tersebut dengan material yang telah diidentifikasi di
herbarium, (2) konsultasi langsung dengan para ahli dibidang yang bersangkutan,
13
determinasi yang telah ada, dan (5) membandingkan dengan ilustrasi yang
tersedia.
Peranan Gulma sebagai Inang Alternatif Virus
Gulma sebagai salah satu komponen ekosistem pertanian memiliki
pengaruh negatif terhadap tanaman pertanian baik secara langsung maupun tidak
langsung. Adanya kompetisi merupakan pengaruh langsung dari keberadaan
gulma sedangkan pengaruh tidak langsung adalah peranannya sebagai inang
alternatif beberapa patogen (Satroutomo 1990).
Gulma dapat menjadi sumber inokulum penting dalam penyebaran
geminivirus terutama apabila ada kesesuaian interaksinya dengan B. tabaci
sebagai vektor. Dalam kaitannya dengan penyakit keriting kuning pada cabai,
beberapa jenis gulma telah ditemukan dapat menjadi inang alternatif geminivirus.
Berdasarkan hal tersebut maka salah satu pengendalian yang dapat dilakukan
adalah sanitasi lahan dari gulma dan tanaman volunteer dengan tujuan untuk
mengurangi sumber inokulum yang dikombinasikan dengan pengendalian
terhadap serangga vektor (Nakhla et al. 1998). Sanitasi gulma dari lahan pertanian juga tidak selamanya memberikan dampak positif terhadap tanaman budidaya,
bahkan dapat meningkatkan infeksi suatu penyakit tanaman. Menurut Eberwine
(1995) pengendalian gulma johnsongrass yang berperan sebagai inang alternatif
maize dwarf mosaic virus pada tanaman jagung baik secara mekanik maupun
kimiawi dapat meningkatkan keparahan penyakit maize dwarf mosaic.
Kelompok gulma berdaun lebar dari golongan dikotil sering ditemukan di
pertanaman budidaya. Gulma dari kelompok ini memiliki potensi sebagai sumber
inokulum geminivirus khususnya Begomovirus (Dhar & Singh 1996; Harison & Robinson 1999; Sukamto et al. 2005).
Pengendalian Penyakit yang Disebabkan Geminivirus
Sampai saat ini belum ditemukan bahan kimia atau cara fisik yang dapat
mematikan atau menginaktifkan geminivirus dalam tanaman tanpa mempengaruhi
kehidupan tanaman itu sendiri. Oleh karena itu, pengendalian penyakit ini bukan
mengutamakan pada pengelolaan ekosistem yang dapat mencegah dan
mengurangi terjadinya infeksi virus pada pertanaman lainnya. Secara alamiah
geminivirus tidak menular melalui benih tetapi hanya menular dengan bantuan
serangga vektor B. tabaci dari tanaman satu ke tanaman lainnya. Karena itu,
pengendalian serangga vektor dan inang alternatif merupakan kunci dalam
mengendalikan geminivirus. Inang alternatif dapat menjadi sumber inokulum
untuk perkembangan penyakit yang disebabkan oleh geminivirus (Nakhla et al.
1998). Gulma merupakan salah satu inang alternatif yang harus diwaspadai karena
15
BAHAN DAN METODE
Tempat dan Waktu
Kegiatan penelitian diawali dengan survei ke beberapa pertanaman cabai
di Jawa, dilanjutkan dengan kegiatan identifikasi dan deteksi di Laboratorium
Virologi Tumbuhan. Pengujian kisaran inang pada kelompok gulma dilaksanakan
di rumah kaca Cikabayan, Fakultas Pertanian, Institut Pertanian Bogor (IPB).
Penelitian dilaksanakan sejak Oktober 2008 sampai November 2009.
Metode Penelitian
Penelitian meliputi empat kegiatan, yaitu: 1) identifikasi jenis-jenis gulma
yang berasal dari pertanaman cabai; 2) deteksi geminivirus pada gulma
berdasarkan teknik polymerase chain reaction (PCR); 3) analisis keragaman
genetik geminivirus asal gulma bergejala; 4) pengujian kisaran inang geminivirus
pada kelompok gulma. Metode pelaksanaan kegiatan-kegiatan tersebut diuraikan
di bawah ini.
Identifikasi Jenis-jenis Gulma yang Berasal dari Pertanaman Cabai.
Berdasarkan informasi mengenai daerah sentra pertanaman cabai di Jawa
yang diperoleh dari Dinas Pertanian dan juga dari para petani lokal ditentukan
daerah survei di Jawa Barat yang meliputi Bandung, Bogor, Cianjur, Sukabumi,
dan Garut, di Jawa Tengah yang meliputi Brebes dan Magelang, di Daerah
Istimewa Yogyakarta adalah Sleman, di Jawa Timur meliputi Malang dan Kediri.
Koleksi gulma dilaksanakan dengan metode purposive sampling yaitu dengan
mengumpulkan gulma yang bergejala dan tidak bergejala. Identifikasi gulma hasil pengumpulan dari lapang dilakukan dengan cara membandingkan dengan ilustrasi
gulma yang telah tersedia (Everaarts 1981; Soerjani et al. 1987) dan berdasarkan kunci identifikasi tumbuhan (Backer & Van Den Brink 1963) serta konsultasi
dengan Dr. Sri S Tjitrosoedirdjo sebagai ahli gulma dari SEAMEO BIOTROP,
Bogor dan juga Dr. Soedarsono Riswan beserta staf ahli Botani Herbarium
Bogoriense, LIPI Cibinong. Gulma yang menunjukkan gejala diawetkan
menggunakan gel silika untuk selanjutnya digunakan sebagai bahan deteksi
hingga menghasilkan biji untuk selanjutnya digunakan sebagai bahan uji kisaran
inang.
Deteksi Geminivirus pada Gulma Berdasarkan Teknik Polymerase Chain Reaction (PCR).
Daun gulma yang bergejala dari lapangan dideteksi dengan menggunakan
teknik PCR dengan urutan sebagai berikut:
Ekstraksi DNA dari daun gulma bergejala mengikuti prosedur Kon et al., (2002)
yang dimodifikasi. Sampel daun gulma (±200 mg) digerus sampai halus, dibantu
dengan penambahan nitrogen cair. Serbuk hasil gerusan ditambahkan 600 µl bufer
ekstrak (0,1 M Tris-HCl pH 8, 0,05 M EDTA, 0,5 M NaCl) yang mengandung 1%
β-mercaptoethanol dan dimasukkan ke dalam tabung ependorf 1,5 ml. Tabung kemudian disentrifugasi pada kecepatan 12.000 rpm selama 5 menit pada suhu
4 oC. Supernatan diambil dan dimasukkan kedalam tabung ependorf 1,5 ml
kemudian ditambahkan 1% SDS dan diinkubasi pada suhu 65 oC selama 60 menit.
Hasil inkubasi tersebut ditambahkan ⅓ volume 5 M CH3COOK kemudian diaduk
dengan menggunakan vortek dan diinkubasi di kotak es selama 5 menit. Setelah
inkubasi kemudian disentrifugasi pada kecepatan 12.000 rpm selama 10 menit
pada suhu 4 oC. Supernatan diambil kemudian dipurifikasi dengan kloroform
(1:1v/v) dan disentrifugasi lagi pada kecepatan 12.000 rpm pada suhu 4 oC selama 5 menit. Supernatan dipresipitasi dengan 1X isopropilalkohol (isopropanol),
inkubasi -20 oC selama 10 menit atau satu malam. Setelah inkubasi supernatan
disentrifugasi pada kecepatan 12.000 rpm selama 10 menit pada suhu 4 oC,
kemudian pelet yang terbentuk dicuci dengan 70% etanol dan disentrifugasi pada
kecepatan 12.000 rpm selama 5 menit pada suhu 4 oC kemudian dikeringkan.
Setelah pelet kering ditambahkan 100 µl bufer TE sampai larut kemudian
ditambahkan 2 µl RNase A (1 µg/mg) dan diinkubasi pada suhu 37 oC selama 1
jam. Ke dalam tabung selanjutnya ditambahkan fenol:kloroform:isoamilalkohol
(25:24:1) kemudian sentrifugasi pada kecepatan 12.000 rpm selama 5 menit pada
suhu ruang. Supernatan diambil dan dilakukan presipitasi dengan menambahkan
100% etanol, inkubasi 20 oC selama 20 menit, sentrifugasi kembali dengan
17
peletnya dicuci dengan 70% etanol kemudian dikeringkan. Terakhir ditambahkan
100 µl bufer TE untuk melarutkan pelet.
DNA total geminivirus hasil isolasi dari gulma diamplifikasi dengan
teknik PCR mengikuti prosedur yang dikembangkan oleh Rojas et al. (1993).
Amplifikasi selubung protein dengan menggunakan primer spesifik gen AV1
(CPPROTEIN-V1 dan CPPROTEIN-C1), dengan ukuran hasil amplifikasi dari
gen AV1 adalah 780 bp. Runutan nukleotida untuk primer CPPROTEIN-V1
adalah 5’-TAATTCTAGATGTCGAAGCGACCCGCCGA-3’ sedangkan untuk
primer CPPROTEIN-C1 adalah 5’-GGCCGAATTTCTTAATTTTGAACAGA
ATCA-3’. Pasangan primer tersebut diperoleh dari Asian Vegetable Research and
Development Center (AVRDC), Taiwan (Santoso 2008). Reaksi amplifikasi dilakukan dengan total volume 25 µl terdiri atas 1-2 µl DNA cetakan, 0,5 µl
dNTPs 10 µM, masing-masing 1 µl primer V1 dan
CPPROTEIN-C1 dengan konsentrasi 0,5 uM, masing-masing 2,5 µl bufer PCR 10X dan
sukrosa, serta 0,3 µl Taq DNA polymerase 5 unit/µl. Reaksi amplifikasi dilakukan dengan mesin Gene Amp PCR system 9700 dengan program sebagai berikut:
denaturasi pada suhu 94 oC selama 1 menit, penempelan primer pada suhu 55 oC
selama 1 menit, sintesis DNA pada suhu 72 oC selama 2 menit dan 5 menit untuk
proses akhir sintesis DNA. Tahapan program PCR tersebut diulang sebanyak 30
siklus. Setelah proses PCR selesai, sampel disimpan di lemari pendingin dengan
suhu 4 oC atau langsung dianalisis dengan gel elektroforesis.
Visualisasi hasil PCR dengan gel elektroforesis yaitu dengan terlebih
dahulu memanaskan gel agarosa 1% dalam 0,5X bufer TBE (Tris-HCl 45 mM,
asam borat 45 mM, dan EDTA 1 mM) ± 1 menit, kemudian biarkan dalam suhu
ruang sampai suhunya mencapai ± 50 oC kemudian ditambahkan 0,5 µg/ml
etidium bromida (EtBr) kedalam cetakan. Setelah gel agarosa memadat
dimasukkan kedalam tangki elektroforesis yang berisi 0,5X bufer TBE. Sebanyak
7 µl hasil PCR masing-masing sampel diisikan kedalam sumuran-sumuran gel
agarosa dengan menggunakan pipet mikro dan sebagai penanda untuk mengetahui
ukuran DNA sampel digunakan penanda 1 kb DNA ladder. Elektroforesis
dilakukan dengan tegangan 50 V DC selama 45 menit. Setelah elektroforesis
transiluminator UV (sinar ultraviolet) pada panjang gelombang 256-300 nm,
kemudian didokumentasikan.
Analisis Keragaman Genetik Geminivirus Asal Gulma Bergejala.
Fragmen DNA geminivirus asal gulma hasil amplifikasi PCR digunakan
untuk perunutan asam nukleat (sekuensing). Sampel DNA dikirim ke Macrogen,
Korea Selatan untuk sekuensing. Hasil sekuensing dianalisis dengan Program
Bioedit dan PAUP 4.0b10 (Swofford 2002) dengan metode Kuantitatif Kladistik
maksimum parsimoni. Kladogram disusun menggunakan metode Heuristic.
Kladogram yang dipakai merupakan strict concensus dengan uji statistik bootstrap ulangan 100 kali. Analisis keragaman genetik juga akan menyertakan informasi
urutan asam nukleat geminivirus lain yang sudah dipublikasikan di GenBank
(www.ncbi.nlm. nih.gov/Genbank).
Pengujian Kisaran Inang Geminivirus pada Kelompok Gulma.
Tanaman uji yang akan digunakan adalah beberapa jenis gulma hasil
pengumpulan di lapangan yaitu gulma-gulma yang ada di pertanaman cabai di
Jawa. Koleksi gulma yang berasal dari pertanaman cabai dilakukan dengan cara
mengambil gulma secara utuh untuk ditumbuhkan kembali di rumah kaca,
mengambil biji-biji gulma yang ada di lapangan dan mengambil contoh tanah
disekitar pertanaman cabai. Gulma yang berasal dari lapangan ditumbuhkan
sampai menghasilkan biji yang nantinya akan digunakan untuk benih. Penyemaian
benih-benih gulma dilakukan dalam nampan plastik yang telah dilubangi pada
bagian bawahnya dan diisi tanah yang telah disterilkan. Setelah benih
berkecambah dan memiliki minimal tiga daun, gulma dipindahkan ke kantung
plastik hitam (ukuran 20 cm x 20 cm) yang telah diisi campuran tanah dan pupuk
kandang (2:1) yang sebelumnya telah disterilkan dengan otoklaf. Gulma uji
tersebut dipelihara dengan pemberian pupuk, penyiraman dan perlindungan
terhadap serangga maupun patogen yang sering berkembang di rumah kaca.
Jumlah tanaman uji untuk masing-masing jenis gulma adalah 30 tanaman yang
19
Pengujian kisaran inang geminivirus pada kelompok gulma dilakukan
melalui metode penularan dengan serangga vektor B. tabaci dan sumber inokulum
geminivirus isolat Segunung yang merupakan koleksi Laboratorium Virologi
Tumbuhan Departemen Proteksi Tanaman Institut Pertanian Bogor. B. tabaci
yang digunakan untuk penularan sebanyak 15 ekor/tanaman dengan waktu makan
akuisisi 24 jam dan makan inokulasi 48 jam. Setelah waktu makan inokulasi,
serangga dimusnahkan dan gulma uji dipelihara di rumah kaca untuk diamati
perkembangan gejala yang muncul. Jumlah B. tabaci dan perlakuan untuk gulma
kontrol sama dengan pada gulma uji tetapi periode makan akuisisi dilakukan pada
tanaman sehat yang tidak terinfeksi geminivirus. Pengamatan terhadap gulma uji
dan gulma kontrol dilakukan selama 30 hari setelah inokulasi (HSI). Peubah yang
diamati yaitu masa inkubasi, gejala dan kejadian penyakit yaitu jumlah gulma
yang menunjukkan gejala dibandingkan jumlah gulma yang diinokulasi
seluruhnya. Untuk mengkonfirmasi hasil penularan tersebut maka dari
masing-masing perlakuan gulma yang bergejala dan tidak bergejala dideteksi kembali
dengan menggunakan teknik PCR sesuai dengan tahapan yang telah diuraikan
sebelumnya.
HASIL DAN PEMBAHASAN
Identifikasi Jenis-jenis Gulma yang Berasal dari Pertanaman Cabai
Berdasarkan hasil survei di pertanaman cabai di Jawa terdapat 27 spesies gulma dari 15 familia tumbuhan (Lampiran 1). Spesies gulma yang ditemukan pada setiap lokasi survei memiliki perbedaan baik jumlah maupun keragamannya (Tabel 2). Jumlah spesies gulma yang ditemukan di Jawa Barat lebih banyak dibandingkan dengan gulma di Jawa Tengah, Daerah Istimewa Yogyakarta dan Jawa Timur. Ada 8 spesies gulma yang ditemukan di semua lokasi survei yaitu Althernantera philoxeroides, Amaranthus lividus, Drymaria cordata, Euphorbia
hirta, Hedyotis sp., Portulaca oleracea, Oxalis corniculata dan Synedrella nodiflora. Sementara itu ada spesies gulma yang hanya ditemukan di daerah tertentu saja yaitu Galinsoga parviflora, Emilia sonchifolia, Porophyllum ruderale, Ipomoea triloba, Ludwigia peruviana dan Solanum nigrum di Jawa Barat, Centipeda minima di Jawa Tengah, dan Spigelia anthelmia di DI Yogyakarta. Familia gulma yang spesiesnya paling banyak ditemukan adalah Compositae (33,33%) diikuti Euphorbiaceae (11,11%), Solanaceae dan Amaranthaceae (7,41%), dan 11 familia lainnya masing-masing 3,7%. Aldrich (1984) juga mengemukakan bahwa gulma familia Compositae merupakan salah satu familia yang banyak ditemukan di pertanaman pangan, hortikultura, dan juga perkebunan. Sutater (1988) juga melaporkan spesies-spesies gulma yang dominan tumbuh pada pertanaman cabai keriting adalah dari familia Compositae. Oleh karena itu gulma dari familia Compositae perlu mendapatkan perhatian dalam bidang penyakit tanaman, mengingat gulma tersebut memiliki potensi sebagai inang alternatif geminivirus pada pertanaman budidaya khususnya cabai.
21
penyakit daun keriting kuning cabai. Cabai dapat dibudidayakan di dataran rendah sampai dataran tinggi sehingga dengan metode purposive sampling menyebabkan lokasi survei memiliki kondisi lingkungan yang bervariasi. Sentra pertanaman cabai di Jawa pada saat survei banyak terdapat di dataran medium (300-700 m di atas permukaan laut) sampai dataran tinggi (> 700 m dpl) untuk Jawa Barat, DIY dan Jawa Tengah. Sedangkan di Jawa Timur, sentra tanaman cabai terdapat di dataran rendah (<300 m dpl) dan medium. Perbedaan kondisi lainnya adalah jenis tanah dan teknik budidaya seperti pola tanam, pengolahan tanah dan pengendalian gulma.
Perbedaaan jenis tanah berpengaruh terhadap tingkat kesuburan tanah. Salah satu indikator sederhana untuk melihat tingkat kesuburan tanah dapat dilihat dari warna dan struktur. Kondisi tanah pada pertanaman cabai di Jawa Barat (Bogor, Bandung, Cianjur, Sukabumi dan Garut) berwarna coklat kehitaman dan berstruktur remah. Kondisi tersebut berbeda dengan tanah yang terdapat di Jawa Tengah (Magelang dan Brebes), DIY (Sleman) dan Jawa Timur (Malang dan Kediri). Kondisi tanah di Jawa Tengah dan DIY berwarna coklat dengan struktur padat sedangkan di Jawa Timur berwarna coklat keabu-abuan dengan struktur berpasir. Pada umumnya tanah yang subur berwarna coklat kehitaman dan berstruktur remah.
Tabel 2 Jenis-jenis gulma yang ditemukan di pertanaman cabai di Jawa berdasarkan hasil survei lapangan (Juni 2008 – Juli 2009)
No Familia Jenis Gulma
Lokasi Pengambilan Contoh
Jawa Barat Jawa Tengah D I Yogyakarta Jawa Timur Bgr Bdg Cnj Skm Grt Mgl Brb Sleman Kdr Mlg 1 Amaranthaceae Alternanthera philoxeroides v v v v v v v v v v
Amaranthus lividus v v v v v v v v v v
2 Boraginaceae Heliotropium indicum v - - - v v v
3 Capparidaceae Cleome rutidosperma v v v v v v v v v v
4 Caryophyllaceae Drymaria cordata v v v v v v v v v v
5 Compositae Ageratum conyzoides + v v + + + - + * -
Artemisia vulgaris v v v - v - - - v v
Centipeda minima - - - + - - - -
Eclipta prostrata v v v - v v * - - -
Emilia sonchifolia v v v v v - - - - -
Galinsoga parviflora - v v v * - - - - -
Porophyllum ruderale + v v - v - - - - -
Spilanthes iabadicensis v v v - - + - v - -
Synedrella nodiflora v v v v v v v v v v
6 Comelinaceae Commelina diffusa v v - - - v v v v v
7 Convolvulaceae Ipomoea triloba - - - - * - - - - -
8 Euphorbiaceae Acalypha boehmeroides v v v v v - - + * -
Euphorbia hirta v v v v v v v v v v
Phyllanthus debilis v v - - - v v v v v
9 Fabaceae Mimosa sp v v - - v v v v v v
10 Loganiaceae Spigelia anthelmia - - - v - -
11 Onagraceae Ludwigia peruviana * v - - - -
12 Oxalidaceae Oxalis corniculata v v v v v v v v v v
13 Portulacaceae Portulaca oleracea v v v v v v v v v v
14 Rubiaceae Hedyotis sp v v v v v v v v v v
15 Solanaceae Physalis angulata - v - - - v - -
Solanum nigrum - v - - v - - - - -
23
Diantara faktor-faktor yang diuraikan diatas, teknik budidaya merupakan salah satu faktor yang sangat berpengaruh terhadap keragaman dan jumlah spesies gulma yang ditemukan di lapangan. Sembiring (2007) melaporkan pengendalian gulma yang dilakukan pada waktu dan frekuensi yang berbeda menyebabkan komposisi gulma menjadi tidak seragam baik dari jumlah maupun spesiesnya. Selain itu juga teknik budidaya berpengaruh terhadap perkembangan penyakit. Pola tanam monokultur dengan areal yang luas dan dilakukan terus menerus dalam jangka panjang sangat menguntungkan untuk perkembangan patogen. Apabila patogen, dalam hal ini geminivirus mendapatkan inang yang rentan dan kondisi lingkungan yang mendukung maka akan menyebabkan timbulnya penyakit secara cepat dan meluas. Rotasi tanaman cabai dengan tomat juga dapat mendukung perkembangan geminivirus karena tomat juga merupakan salah satu inang dari geminivirus.
Gulma yang diduga terinfeksi geminivirus di lapangan menunjukkan gejala berupa netting yaitu penguningan tulang daun sehingga menyerupai jala (Gambar 2). Gejala tersebut ditemukan pada gulma familia Compositae (A. conyzoides, C. minima, E. prostrata, P. ruderale, S. iabadicensis, G. parviflora, L. peruviana), Euphorbiaceae(A. boehmeroides), Convolvulaceae (I. triloba) dan Onagraceae(L. peruviana). Gejala tersebut sesuai dengan gejala geminivirus pada gulma A. conyzoides (Sukamto et al. 2005). Gejala yang sama juga ditemukan pada gulma C. bonplandianum, A. conyzoides, U. lobata, S. acuminata, S. rhombifolia, E. alba, A. esculentus di India Timur (Chatterjee et al. 2007). Infeksi geminivirus pada gulma M. coromandelianum di Cina menunjukkan gejala yang berbeda yaitu daun keriting, tulang daun menebal dan pertumbuhan terhambat
(Wu et al. 2007). Hal tersebut menunjukkan adanya variasi gejala geminivirus
pada kelompok gulma, tetapi gejala yang banyak ditemukan pada gulma adalah
pada daun cabai rawit maupun cabai besar berupa penjernihan tulang daun (vein clearing) yang kemudian berkembang menjadi warna kuning, penebalan tulang daun, dan penggulungan daun (cupping). Infeksi lanjut geminivirus menyebabkan daun-daun mengecil, berwarna kuning cerah dan tanaman menjadi kerdil. Variasi gejala geminivirus dipengaruhi oleh strain virus, jenis tanaman, fase pertumbuhan tanaman dan beberapa faktor lainnya. Strain virus yang berbeda akan menghasilkan gejala yang berbeda, virus strain lemah mungkin menghasilkan gejala yang ringan atau bahkan tidak menunjukkan adanya gejala. Jenis tanaman yang berbeda akan menghasilkan respon yang berbeda sehingga gejalanya bervariasi. Seperti dilaporkan oleh Haerani & Hidayat (2003) geminivirus yang berasal dari A. conyzoides yang ditularkan pada tanaman cabai, tembakau dan tomat menghasilkan gejala yang bervariasi. Tanaman pada fase vegetatif awal lebih rentan terhadap infeksi virus. Infeksi geminivirus pada fase awal tanaman dapat menyebabkan pertumbuhan tanaman menjadi terhambat.
25
Gambar 2 Gejala geminivirus pada gulma yang ditemukan di lapangan pada saat survei di pertanaman cabai di Jawa
Deteksi Geminivirus pada Gulma Berdasarkan Teknik PCR
primer yang sama menghasilkan fragmen DNA berukuran 780 bp (Santoso 2008). Empat gulma bergejala lainnya (G. parviflora Garut, E. prostrata Brebes, I. triloba Garut, dan L. peruviana Cianjur memberikan hasil negatif dalam deteksi virus (Gambar 3).
Gambar 3 Amplifikasi DNA geminivirus dari gulma hasil koleksi di lapangan dengan teknik PCR menggunakan pasangan primer CP Protein- V1 dan CP Protein-C1. M=1 kb DNA ladder , K=DNA geminivirus asal A. conyzoides , 1. AgrBgr, 2. AgrSkm, 3. AgrMgl, 4. AgrJgy, 5. AgrGrt, 6. SplMgl, 7. CtpMgl 8. E. prostrata Brebes, 9. G. parviflora Garut, 10. I. triloba Garut, 11. AcpJgy, 12. L. peruviana Cianjur, 13. PrlBgr
Beberapa kemungkinan yang menyebabkan keempat gulma bergejala tersebut tidak berhasil teramplifikasi, diantaranya yaitu tidak terdapat geminivirus pada gulma tersebut atau gejala tersebut disebabkan oleh jenis virus atau patogen lain. Adanya inhibitor pada gulma dapat menjadi penyebab kegagalan proses amplifikasi pada PCR. Kemungkinan lain yaitu primer yang digunakan tidak sesuai dengan geminivirus pada gulma tersebut sehingga proses amplifikasi terhambat.
[image:38.596.130.487.155.329.2]27
Kesulitan yang dihadapi dalam deteksi dengan PCR pada gulma terutama terjadi pada tahap ekstraksi DNA. Sampel tanaman dari lapang mudah sekali mengalami kerusakan bila tidak segera diproses. Kandungan senyawa inhibitor dan senyawa sekunder pada gulma dapat mempengaruhi keberhasilan ekstraksi DNA dan menghambat proses amplifikasi PCR. Torres-Pacheco et al (1996) telah mengemukakan beberapa faktor yang dapat mempengaruhi keberhasilan ekstraksi DNA geminivirus yaitu umur jaringan tanaman, lamanya infeksi virus pada tanaman, jenis tanaman dan prosedur ekstraksi yang digunakan. Umur jaringan tanaman yang muda dan masih segar, semakin lama virus menginfeksi tanaman, jenis tanaman budidaya dan prosedur ekstraksi yang sesuai dapat menunjang keberhasilan ektraksi.
Analisis Keragaman Genetik Geminivirus Asal Gulma Bergejala
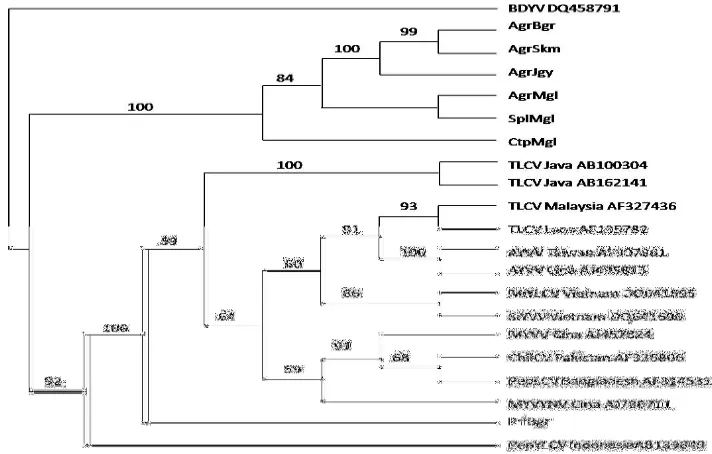
Hasil perunutan asam nukleat telah diperoleh untuk tujuh sampel DNA hasil amplifikasi dengan PCR (Lampiran 2). Hasil perunutan tersebut digunakan dalam analisis kekerabatan (filogenetik) dengan membandingkan sekuen gulma sampel dengan beberapa geminivirus yang ada di GenBank (Tabel 3). Hasil analisis kekerabatan menunjukkan bahwa tujuh sampel geminivirus pada gulma dapat dikelompokkan dalam dua kelompok besar (Gambar 4). Kelompok I terdiri atas geminivirus asal gulma contoh (AgrBgr, AgrSkm, AgrJgy, AgrMgl, SplMgl, dan CtpMgl) dengan nilai bootstrap 100. Kelompok II adalah PrlBgr dan geminivirus yang berasal dari GenBank dengan nilai bootstrap 92.
PrlBgr merupakan salah satu geminivirus yang menginfeksi gulma dan termasuk ke dalam kelompok kedua yang berbeda dengan geminivirus asal gulma lainnya. PrlBgr memiliki kekerabatan dengan PepYLCV Indonesia dan geminivirus asal GenBank lainnya dengan nilai bootstrap 92 dan 100 namun berbeda kelompok dengan geminivirus asal gulma dari daerah yang sama (AgrBgr).
Tabel 3 Daftar Geminivirus yang digunakan untuk Analisis Kekerabatan
Hubungan kekerabatan geminivirus yang menginfeksi gulma tidak terlalu dekat dengan geminivirus yang menginfeksi cabai di Jawa (PepYLCV Ina) maupun yang menginfeksi tomat di Jawa (TLCV Jawa). Hal ini sangat menarik untuk dikaji lebih dalam, yaitu untuk memastikan bahwa gulma merupakan sumber infeksi bagi tanaman cabai dan tomat. Hal tersebut terjadi pada hasil analisis hubungan kekerabatan Begomovirus penyebab penyakit keriting pada tomat, isolat yang berasal dari daerah yang berdekatan berada pada satu kelompok
Geminivirus Akronim Lokasi
Panjang Fragmen (bp)
29
seperti isolat Ketep (Magelang) dengan Boyolali dan isolat Malang dengan Blitar (Santoso 2008). Trisno et al.(2009) melaporkan terdapat keragaman genetik isolat geminivirus pada cabai di Sumatera Barat. Hasil analisis filogenetik menunjukkan bahwa sebelas isolat geminivirus asal Sumatera Barat terbagi menjadi tiga kelompok. Isolat yang yang berasal dari lokasi yang sama berada pada satu kelompok, hal sebaliknya juga terjadi di mana isolat-isolat yang berasal dari daerah yang sama berada pada kelompok yang berbeda. Selanjutnya isolat- isolat tersebut berbeda kelompok dengan geminivirus asal cabai di Indonesia dan yang telah dilaporkan sebelumnya.
31
Pengujian Kisaran Inang Geminivirus pada Kelompok Gulma
Pengujian kisaran inang geminivirus pada kelompok gulma dilakukan pada 10 spesies gulma yang berhasil dikoleksi dari lapangan (A. conyzoides, G. parviflora, P. ruderale, S. iabadicensis, S. nodiflora, L. peruviana, A. lividus, P.
[image:43.596.138.487.308.493.2]oleraceae, C. rutidosperma dan P. debilis) (Tabel 4). Gejala yang muncul pada empat spesies gulma (A. conyzoides, P. ruderale, S. iabadicensis, L. peruviana) berupa netting dengan kisaran masa inkubasi 7-20 hari setelah inokulasi. Gejala pada dua spesies lainnya (S. nodiflora dan G. parviflora) berupa daun mengkerut (keriting) dan ukurannya lebih kecil dari ukuran normal (malformasi) dengan kisaran masa inkubasi 13-17 hari setelah inokulasi.
Tabel 4 Masa inkubasi, kejadian penyakit, tipe gejala geminivirus pada beberapa jenis gulma uji di rumah kaca
No Jenis gulma Tipe Gejala
Masa Inkubasi (HSI)*
Kejadian Penyakit Konfirmasi PCR (%) TR/TK 1 2 3 1 Amaranthus lividus TB 0 0 0/20 - - - 2 Portulaca oleraceae TB 0 0 0/20 - - - 3 Phyllanthus debilis TB 0 0 0/20 - - - 4 Cleome rutidosperma TB 0 0 0/20 - - - 5 Ludwigia peruviana NT 7-10 100 20/20 - - - 6 Ageratum conyzoides NT 8-13 100 20/20 + - - 7 Spilanthes iabadicensis NT 11-15 100 20/20 + - - 8 Porophillum ruderale NT 18-20 55 11/20 + + - 9 Synedrella nodiflora Mf, Kr 13-15 10 2/20 + + - 10 Galinsoga parviflora Mf, Kr 14-17 15 3/20 - - - Keterangan: *Hari setelah inokulasi; TR = Jumlah tanaman terinfeksi; TK = Jumlah tanaman
yang diinokulasi; TB = Tidak bergejala, NT = Netting, Mf = Malformasi, Kr = Daun keriting, ukuran lebih kecil dari ukuran daun normal; 1 = Gulma bergejala; 2 = Gulma tidak bergejala; 3 = Kontrol; + = Terdeteksi positif geminivirus; - = Tidak terdeteksi geminivirus.
gejala infeksi virus pada cabai, berupa daun menggulung, penebalan tulang daun, bercak-bercak klorotik pada daun, klorosis diantara tulang daun, malformasi daun, belang dan menguning. Menurut Sulandari (2006) gejala awal yang ditimbulkan pada daun cabai rawit maupun cabai besar berupa penjernihan tulang daun (vein clearing) yang kemudian berkembang menjadi warna kuning, penebalan tulang daun, dan penggulungan daun (cupping). Infeksi lanjut geminivirus menyebabkan daun-daun mengecil, berwarna kuning cerah dan tanaman menjadi kerdil.
Pada pengujian penularan tersebut tidak semua gulma memperlihatkan gejala infeksi. Empat spesies gulma lainnya (A. lividus, P. oleraceae, C. rutidosperma dan, P. debilis) tidak menunjukkan gejala sampai dengan 30 hari setelah inokulasi. Hal tersebut dapat merupakan dua indikasi. Pertama, gulma tersebut tidak terinfeksi virus sehingga tidak menunjukkan adanya gejala. Hal tersebut dapat disebabkan gulma uji bukan inang geminivirus ataupun B. tabaci. Indikasi kedua, gulma tersebut terinfeksi geminivirus tetapi tidak menunjukkan gejala atau gejalanya terselubung. Hal tersebut dapat disebabkan oleh konsentrasi geminivirus pada tanaman yang rendah ataupun respon tanaman yang memiliki gen ketahanan. Untuk itu perlu dilakukan pengujian lebih lanjut terhadap gulma uji yang tidak menunjukkan gejala maupun yang menunjukkan gejala melalui deteksi PCR dengan tujuan mengkonfirmasi hasil pengujian penularan.
33
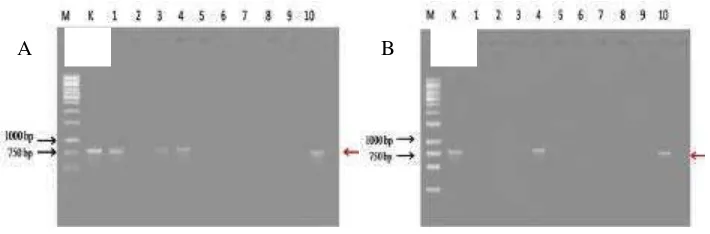
Gambar 5 Amplifikasi DNA geminivirus dari Gulma bergejala (A) dan tidak bergejala (B). 1. A. conyzoides, 2. G. parviflora, 3. S. iabadiencis, 4. S. nodiflora, 5. L. peruviana, 6. P. oleracea, 7. C. rutidosperma, 8. P. debilis, 9. A. lividus, 10. P. ruderale
Perbedaan gejala dan kisaran masa inkubasi diduga dipengaruhi oleh kesesuaian interaksi antara gulma dengan geminivirus yang menginfeksi. Hal ini berkaitan dengan sifat replikasi virus yang mutlak tergantung pada sel tanaman inang. Hull (2002) menyatakan bahwa setelah virus sampai pada inang yang sesuai maka virus akan melepaskan selubung protein kemudian memanfaatkan DNA tanaman untuk bereplikasi kemudian berpindah dari satu sel ke sel lainnya mengikuti aliran nutrisi dan air tumbuhan sehingga gejala akan bersifat sistemik (Hull 2002). Strain virus yang sama dapat menghasilkan gejala yang berbeda pada tanaman inang yang berbeda. Hal tersebut disebabkan adanya respon yang berbeda dari masing-masing spesies tanaman. Spesies tanaman yang sama ataupun berbeda dapat memberikan respon yang berbeda terhadap infeksi geminivirus, karena setiap tanaman dapat memiliki gen ketahanan yang berbeda.
Pengujian kisaran inang pada kelompok gulma menghasilkan kisaran masa inkubasi 7 - 20 hari. Tipe gejala netting memiliki kecenderungan masa inkubasi yang lebih cepat (7 - 20 hari) bila dibandingkan dengan gejala keriting dan malformasi (13 - 17 hari). Sulandari et al. (2006) melaporkan bahwa kisaran masa inkubasi hasil penularan geminivirus isolat Segunung pada berbagai jenis tanaman dan gulma adalah 5 - 35 hari dan tipe gejala keriting serta malformasi memiliki kecenderungan lebih cepat dibandingkan gejala netting. Tipe gejala netting hanya ditemukan pada gulma A. conyzoides bunga ungu dengan kisaran masa inkubasi 14 - 20 hari. Kisaran masa inkubasi pada tipe gejala keriting 5 - 20 hari dan tipe gejala malformasi 5 - 35 hari. Hubungan antara masa inkubasi dengan tipe gejala pada pengujian penularan ditentukan oleh kesesuaian interaksi antara inang
[image:45.596.135.490.76.193.2](tanaman uji) dengan geminivirus dan vektor B. tabaci. Geminivirus dapat ditularkan pada tanaman sehat oleh B. tabaci yang telah mengandung virus melalui proses makan. Pada proses tersebut B. tabaci membutuhkan waktu pengenalan terhadap inang sebelum proses makan dimulai. Hal tersebut berpengaruh terhadap waktu terjadinya infeksi sehingga waktu pemunculan gejala akan berbeda. Selain itu masa inkubasi dipengaruhi oleh respons ketahanan inang. Spesies inang yang sama ataupun berbeda dapat memiliki respon katahanan yang berbeda.
Kejadian penyakit pada pengujian kisaran inang kelompok gulma yang melibatkan sepuluh gulma uji berkisar 0 - 100%. Hasil tersebut tidak dapat menggambarkan hubungan geminivirus dengan gulma, karena adanya fenomena pada saat konfirmasi dengan menggunakan teknik PCR, yaitu gulma uji yang tidak bergejala terdeteksi mengandung geminivirus. Untuk itu perlu pengujian lebih lanjut, misalnya dengan melakukan inokulasi balik.
KESIMPULAN
Berdasarkan hasil survei dapat disimpulkan bahwa terdapat 27 spesies gulma dari 15 familia tumbuhan yang ada di pertanaman cabai di Jawa. Gulma dari famili Compositae dan Euphorbiaceae merupakan kelompok gulma yang paling dominan dan memiliki potensi sebagai inang alternatif geminivirus karena terbukti dapat terinfeksi geminivirus. Ditemukan 13 spesies gulma yang bergejala dan gejala tersebut terbukti berasosiasi dengan infeksi geminivirus. Infeksi alami geminivirus pada gulma umumnya menyebabkan gejala netting; sedang infeksi buatan melalui penularan dengan B. tabaci dapat menyebabkan gejala netting (A. conyzoides, P. ruderale, S. iabadicensis) atau malformasi daun dan keriting (S. nodiflora dan G. parviflora).Tujuh geminivirus yang teridentifikasi selanjutnya disebut isolat AgrBgr, AgrSkm, AgrMgl, AgrJgy, SplMgl, CtpMgl dan PrlBgr Berdasarkan analisis kekerabatan, tujuh isolat asal gulma tersebut dapat dibedakan atas dua kelompok dan tidak memiliki kedekatan dengan geminivirus lain yang telah dipublikasikan di GenBank.
SARAN
DAFTAR PUSTAKA
Aldrich RT. 1984. Weed-Crop Ecology: Principles in Weed Managemet. Tuassacheeseth: Breton Publ.
Aidawati N. 2006. Keanekaragaman begomovirus pada tomat dan serangga vektornya, Bemisia tabaci Gennadius (Hemyptera:Aleyrodidae), serta pengujian ketahanan genotype tomat terhadap strain Begomovirus. [disertasi]. Bogor: Fakultas Pertanian, Institut Pertanian Bogor.
Basu AN. 1995. Bemisia tabaci (Gennadius) : Crop Pest and a Principal Whitefly vector of Plant Viruses. New Delhi. Westview.
Baker CA, Van Den Brink RCB. 1963. Flora of Java (Spermatophytes Only). Volume ke-1. Netherlands: N.V.P. Noordhoff Groningen.
Bezerra MAS, Oliveira MRV, Vasconcelos SD. 2004. Does the presence of weeds affect Bemisia tabaci (Gennadius) (Hemiptera:Aleyrodidae) infestation on tomato plants in semi-arid agro-ecosystem. Neotropical Entomol 33(6): 769-775.
Briddon RW, Watts J, Markham PG, Stanley J. 1989. The coat protein of beet curly top virus is essential for infectivity. Virology 172:628-633.
Brown JK, Nelson MR. 1988. Transmission, host range and virus-vector Relationshi