SRI ANGGARINI RASYID
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2012
SRI ANGGARINI RASYID
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2012
SRI ANGGARINI RASYID
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Oligomer Hidrolisat Kitin yang Diproduksi Menggunakan Enzim Kitinase dari Isolat SSA2B4.1 (Bacillus cereus SW41) pada Sel Limfosit dan Sel Lestari Kanker merupakan karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan oleh penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka dibagian akhir tesis ini.
Bogor, Maret 2012
Produced Using Chitinase Enzymes from SSA2B4.1 (Bacillus cereus SW41) Isolate on Lymphocytes and Cancer Cells Lines. Under direction of MARIA BINTANG and BAMBANG PONTJO PRIOSOERYANTO.
Local chitin waste from crab industries can be used as a source for production of oligomer which has important biological activity. The aims of this research were to evaluate activities of oligomer produced by enzymatic hydrolysis upon proliferation of lymphocytes and cancer cells. the chitinase enzyme was obtained from thermophilic bacterium Bacillus cereus SW41 isolated from South Sulawesi. The medium for producing the enzyme contained 1% colloidal chitin and the enzyme was harvested after four days of incubation, the free cell supernatant were heated at 60oC for 20 minutes. The heat stable protein enzyme was coagulated with 30% saturated ammonium sulphate and purified using hydrophobic interaction chromatography with butyl sepharose gel. The enzyme of 0,005, and 0,0085 IU/mg chitinase were use on 1% chitin colloidal substrate. the reaction products were analyzed and fractionated using HPLC. Cytotoxic assay to determine the lethal concentration 50 (LC50) was done by BSLT method. The effect of oligomers hidrolyzate on lymphocyte proliferative activity and inhibition of cancer cells were conducted by MTT method. The oligomer hidrolyzate proceed by with or without lyophilization at concentration of 62,5 and 125 g/ml were able to increase lymphocytes proliferation (3-22%). Antiproliferation activity of oligomer chitin hydrolyzate was detected in all tested cancer cell lines with the highest activity occurred in MT2 cell ranging from 17-48% followed by Raji Cell (17-43%), and HeLa cell (5-33%). Based on cell mentioned above, we concluded that oligomer chitin hydrolyzate could be use as an anti cancer cell proliferation and farther study is needed to develop before commercially use. Keywords: chitinase enzyme, oligomer chitin hydrolyzate, cancer cell,
BINTANG dan BAMBANG PONTJO PRIOSOERYANTO.
Upaya pencegahan terhadap berbagai jenis penyakit termasuk penyakit kanker secara dini melalui pangan yang sehat meningkatkan konsumsi komponen bioaktif sebagai fungsional. Disamping itu penggunaan komponen bioaktif dari bahan-bahan alami dengan tujuan untuk pengobatan penyakit dalam bentuk nutraceuticals kini sudah banyak dijumpai, termasuk senyawa-senyawa kitooligomer yang berasal dari degradasi limbah bahan yang mengandung kitin saat ini mulai digunakan sebagai bahannutraceuticals.
Penggunaan enzim sebagai biokatalis dalam industri obat-obatan kosmetika, dan bioteknologi menjadi pilihan yang terbaik saat ini, karena bersifat ramah lingkungan, prosesnya mudah dikendalikan, dan produk akhirnya seragam. Penggunaan enzim termostabil dalam penelitian ini dimaksudkan karena sifat stabilitas enzim terhadap proses panas, selain itu enzim termostabil dari mikroba termofil lebih tahan terhadap berbagai senyawa atau keadaan penyebab denaturasi sehingga dapat lebih tahan disimpan.
Dalam penelitian ini dilakukan kajian produksi oligomer kitin yang bersifat bioaktif dengan menggunakan enzim kitinase yang dihasilkan oleh isolat SSA2B4.1(Bacillus cereus SW41) yang telah dikarakterisasi sebelumnya secara menyeluruh, dan uji bioaktivitas untuk mengamati aktivitas farmakologi suatu senyawa. Selanjutnya penelitian ini ditujukan untuk menghasilkan senyawa-senyawa oligomer kitin yang memiliki aktivitas bioaktif sebagai anti proliferasi sel-sel kanker, sehingga dapat memberikan informasi tentang alternatif peningkatan nilai dan daya guna limbah marine lokal menjadi produk yang diketahui memiliki nilai ekonomis tinggi, sehingga informasi yang diberikan dapat digunakan untuk usaha pengembangan industri, khususnya pangan dan nutraceuticalberbasis produkmarine, yang berpeluang menjadi produk eksport.
sebagai fase diam dan buffer ammonium sulfat sebagai fase gerak.
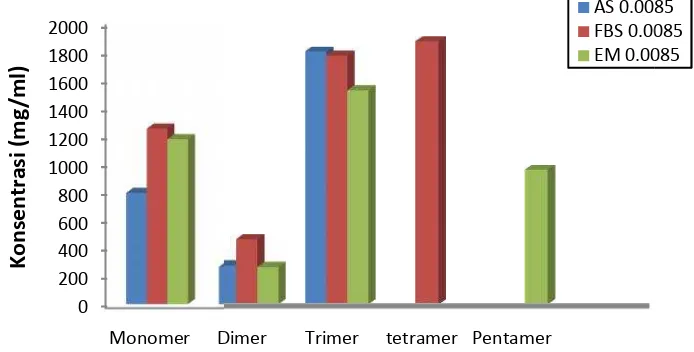
Berdasarkan deteksi kemurnian enzim, maka fraksi dengan aktivitas tertinggi diambil, kemudian diukur aktivitas dari fraksi tersebut sebagai dasar untuk digunakan dalam reaksi produksi senyawa-senyawa oligomer dengan konsentrasi enzim yang dituju sebesar 0,0085 unit permiligram kitin.
Senyawa-senyawa oligomer yang dihasilkan dari berbagai reaksi preparat enzim dan substrat dipantau dengan menganalisis komposisi dan konsentrasi senyawa-senyawa oligomer dalam hidrolisat dengan menggunakan teknik kromatografi dengan alat HPLC. Hidrolisat reaksi enzimatik yang digunakan adalah yang banyak mengandung tetramer (FBS 6 Jam) dan pentamer (EM 12 Jam) yang selanjutnya akan dibuktikan dengan uji lanjut bioaktivitas. Komposisi dan konsentrasi senyawa-senyawa oligomer yang berbeda-beda dapat menjawab terjadinya perbedaan respon uji hayati berbagai hidrolisat pada pengujian proliferasi terhadap kultur sel limfosit dan sel kanker.
Data hasil uji BSLT ekstrak hidrolisat oligomer kitin merupakan data mortalitas yang dianalisis dengan probit analysis method untuk mendapatkan nilai LC50 (lethal concentration 50%). Data menunjukkan LC50 ekstrak oligomer kitin yang dihasilkan dari perhitungan, masing-masing sebesar 153 g/ml, 199 g/ml dan 107 g/ml Nilai tersebut menunjukkan bahwa ekstrak oligomer kitin termasuk dalam kategori toksik karena LC50 < 1000 g/ml, yang memiliki potensi bioaktivitas.
Salah satu parameter untuk melihat aktivitas imunomodulator suatu komponen adalah kemampuan menstimulasi proliferasi sel limfosit. Peningkatan indeks stimulasi dari sampel oligomer kitin, sebesar 3-22%. Sampel oligomer FBS 1% 6 (enam) jam yang diliofilisasi pada konsentrasi sampel 125 µg/ml memiliki proliferasi limfosit yang tertinggi sebesar 121,51% atau mempunyai nilai indeks stimulasi (IS) 1,22 (peningkatan 22%) hampir setara dengan mitogen LPS yang mempunyai IS 1,28 (peningkatan 28%). Hasil ini memberi implikasi bahwa telah terjadi peningkatan jumlah sel sebesar 1,22 kali dari jumlah sel awal 1 x 106 sel/ml.
Aktivitas penghambatan sampel oligomer hidrolisat kitin pada sel kanker memperlihatkan perbedaan secara signifikan, dengan menghambat proliferasi sel kanker HeLa (5-33%), sel Raji (17-43%), dan sel kanker MT2 (17-48%). Hidrolisat enzimatik yang mengandung unit monomer dari oligomer kitin, akan lebih baik menghambat proliferasi sel epitel jenis HeLa dan sel suspensi jenis MT2 daripada unit tetramer dan pentamer kitin.
atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
SRI ANGGARINI RASYID
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Biokimia
cereusSW41) pada Sel Limfosit dan Sel Lestari Kanker.
Nama : Sri Anggarini Rasyid
NIM : G851100011
Disetujui, Komisi Pembimbing
Prof. Dr. Maria Bintang, MS Prof. drh. Bambang Pontjo.P,MS,Ph.D.,APVet
Ketua Anggota
Diketahui :
Ketua Program Studi Biokimia Dekan Sekolah Pascasarjana
Prof. Dr. Maria Bintang, MS. Dr.Ir. Dahrul Syah, M. Agr.Sc
penulisan tesis dengan judul Aktivitas Biologi Oligomer Hidrolisat Kitin yang Diproduksi Menggunakan Enzim Kitinase dari Isolat SSA2B4.1 (Bacillus cereus SW41) pada Sel Limfosit dan Sel Lestari Kanker dapat diselesaikan. Salawat dan salam semoga senantiasa tercurah kepada Nabi Muhammad SAW, pembawa cahaya dan petunjuk bagi kehidupan umat manusia hingga akhir zaman. Tesis ini dibuat sebagai salah satu syarat mahasiswa pascasarjana program S2 untuk meraih gelar Magister pada Sekolah Pascasarjana Institut Pertanian Bogor.
Banyak pengalaman dan ide yang penulis peroleh sejak penyusunan proposal,pelaksanaan penelitian, hingga penulisan tesis ini. Oleh karena itu melalui kesempatan ini penulis menyampaikan terimakasih kepada berbagai pihak atas bantuan intelektual dan teknisinya dalam penelitian ini. Ucapan terimakasih yang sebesar-besarnya penulis haturkan kepada :
1. Tim komisi pembimbing yang terdiri : (1) Ibu Prof. Dr. Maria Bintang, MS sebagai ketua komisi pembimbing yang telah banyak memberikan perhatian, bantuan, dan meluangkan waktu untuk membimbing, dan berdiskusi. (2) Bapak Prof. drh. Bambang Pontjo Prosoeryanto, MS, Ph.D., APVet, sebagai anggota komisi pembimbing yang telah meluangkan waktu di sela-sela kesibukan beliau dalam membimbing, memberikan saran dan koreksi yang sangat berarti.
2. Bapak Prof. drh. Dondin Sajuthi, MST, Ph.D yang telah meluangkan waktu dan berkenan menjadi penguji luar komisi serta memberi saran yang sangat bermanfaat bagi penulis.
keramahan dan kerjasama yang telah dijalin baik dalam bentuk bantuan sarana dan pengetahuan yang sangat penting bagi terlaksananya penelitian ini. 6. Ibu Silmi (teknisi laboratorium mikrobiologi dan imunologi, Pusat Studi Satwa Primata), penulis menghaturkan terimakasih yang sangat dalam atas segala keramahan dan bantuan sarana, keterampilan dasar dan pengetahuan teknis dalam pengujian kultur sel yang sangat penting bagi terlaksananya penelitian ini.
7. Teman seperjuangan menyelesaikan penelitian yang berhubungan dengan kultur sel in vitro, Ibu Dr. Yuszda K. Salimi, terimakasih atas bantuan yang tak kenal lelah dan saran yang sangat membantu dalam menyelesaikan penelitian ini.
8. Teman-teman Biokimia angkatan 2010, Lia, ibu Eliz, mba Martha, Izah, dan Boby serta teman-teman yang tidak sempat penulis sebutkan namanya satu persatu, Terimakasih atas persahabatan yang indah semasa menjadi mahasiswa Biokimia.
9. Pengelola Beasiswa Program Pascasarjana (BPPS) Direktorat Jenderal Pendidikan Tinggi, Departemen Pendidikan Nasional atas pemberian beasiswa kepada penulis untuk menjalani pendididkan S2.
10. Dekan Faperta Unilaki dan Rektor Universitas Lakidende, Ketua STIKES Mandala Waluya Kendari, atas izin yang diberikan kepada penulis untuk mengikuti pendidikan S2 di program studi Biokimia SPs IPB.
11. Dekan Sekolah Pascasarjana IPB beserta staf pegawai Pascasarjana IPB, Ketua PS Biokimia atas perkenaan menerima dan membantu penulis selama menjalani pendidikan S2 IPB.
12. Dosen-dosen IPB, terutama pada program studi Biokimia, Terimakasih atas sumbangan ilmu pengetahuan yang sangat bermanfaat bagi penulis.
Ibu Hasto Kirmani atas segala perhatian dan doanya, serta bantuan moril dan materil selama penulis menempuh pendidikan S2 ini.
15. Suami tercinta Ridwan Adi Surya, S.Si, M.Si dan Ananda tercinta Zahra Althafunnisa, yang telah banyak berkorban, membantu dan dengan setia mendampingi dengan penuh pengertian selama penulis mengikuti pendidikan S2 ini.
16. Kakak tersayang Mariyatni Rasyid, SKM, Kakak dan Adik ipar, kemenakan-kemenakanku atas segala doa dan dukungannya selama penulis mengikuti pendidikan Magister di IPB ini.
Akhirnya semua budi baik yang diberikan kepada penulis semoga diterima dan dibalas berlipat ganda oleh Allah SWT. Tak lupa permohonan maaf bila penulis melakukan kesalahan baik yang disengaja maupun tidak. Semoga tesis ini bermanfaat bagi khasanah ilmu pengetahuan. Amin.
anak ketiga dari tiga bersaudara dari pasangan Abdul Rasyid Latief, SKM (Alm) dan Hj. Dahriaty.
i
Mekanisme Anti Kanker pada Senyawa Alami dan Sintesis ...
BAHAN DAN METODE
Waktu dan Tempat Penelitian ..
Bahan dan Alat Metode Penelitian
1. Produksi Enzim kitinase
2. Produksi senyawa-senyawa oligomer hidrolisat kitin ... 3. Identifikasi dan fraksinasi komponen oligomer hidrolisat kitin
4. Uji Toksisitas ...
5. Pengujian aktivitas senyawa oligomer terhadap proliferasi sel
limfosit ...
6. Pemeliharaan kultur sel kanker ..
7. Pengujian aktivitas anti proliferasi sel kanker secara ...
8. Analisis dan interpretasi data .
HASIL DAN PEMBAHASAN
A. Produksi Senyawa Oligomer secara Enzimatik .. B. Fraksinasi Hidrolisat Senyawa-Senyawa Oligomer ...
C. Uji Toksisitas dengan Metode BSLT .
D. Aktivitas Senyawa-Senyawa Oligomer terhadap Proliferasi sel
ii
DAFTAR PUSTAKA .
LAMPIRAN
iii
87
97
:7
;7
<7
=7
>7
?7
G 3-30C / -A1C A 0 /5IA ,
0AC A531/D3-A
JK LMNN OPLQRQOP@S:677
T 0CA UAC31V/ V/- 3W 3W-/ W 3-3C/5IA, ...
Data hasil uji BSLT ekstrak hidrolisat oligomer kitin ..
Pengaruh oligomer kitin terhadap proliferasi sel limfosit limfa tikus pada 2 variasi konsentrasi... Beberapa hasil Penelitian Proliferasi sel Limfosit... Penghambatan proliferasi sel Hela... Penghambatan proliferasi sel Raji... Penghambatan proliferasi sel MT2...
6 10 41 53 57
iv
Jalur degradasi kitin oleh mikroba .
Mekanisme perlawanan terhadap antigen oleh limfosit...
Mekanisme reaksi Reduksi MTT menjadi MTT formazan oleh enzim suksinat dehidrogenase
Mekanisme kerja obat antikanker pada siklus sel ..
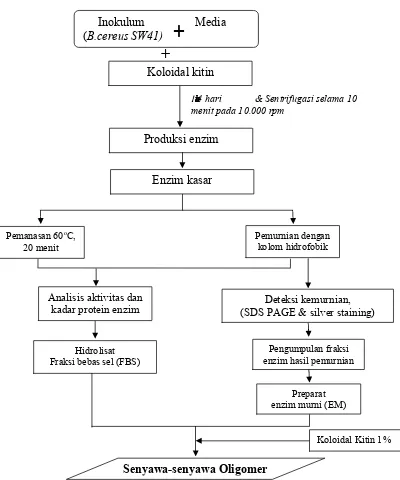
Diagram alir proses produksi senyawa-senyawa oligomer hidrolisat kitin
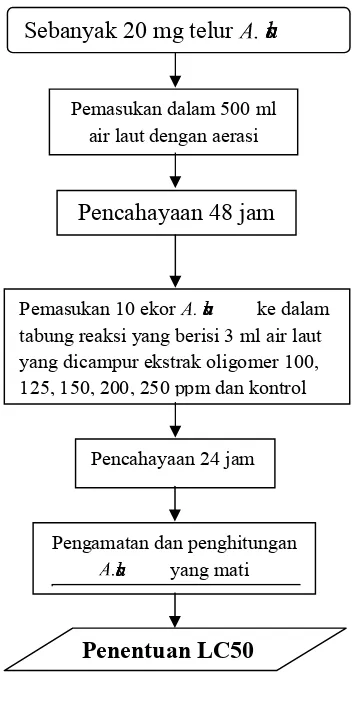
Diagram alir uji toksisitas dengan|}~ ...
Diagram alir aplikasi senyawa-senyawa oligomer hidrolisat
kitin ...
Hidrolisis kitin tanpa enzim ...
Hidrolisis preparat enzim FBS dan EM pada koloidal kitin 1%...
Hidrolisis preparat enzim FBSp dan AS pada koloidal kitin 0,5%...
Hidrolisis preparat enzim FBS dan FBSp 0,005 pada konsentrasi koloidal kitin 0,5% dan 1%...
Hidrolisis preparat enzim AS dan EM 0,005 pada konsentrasi koloidal kitin 0,5% dan 1%...
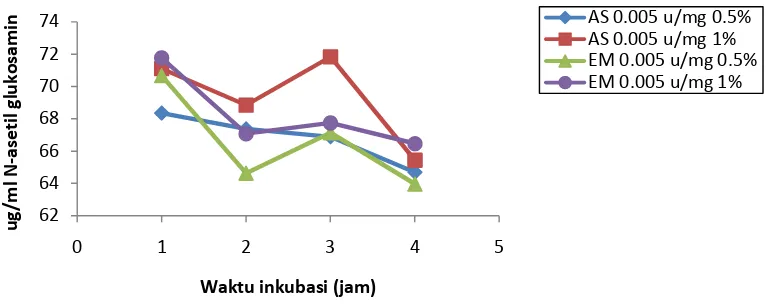
Konsentrasi N asetil glukosamin berbagai hidrolisat enzimatik
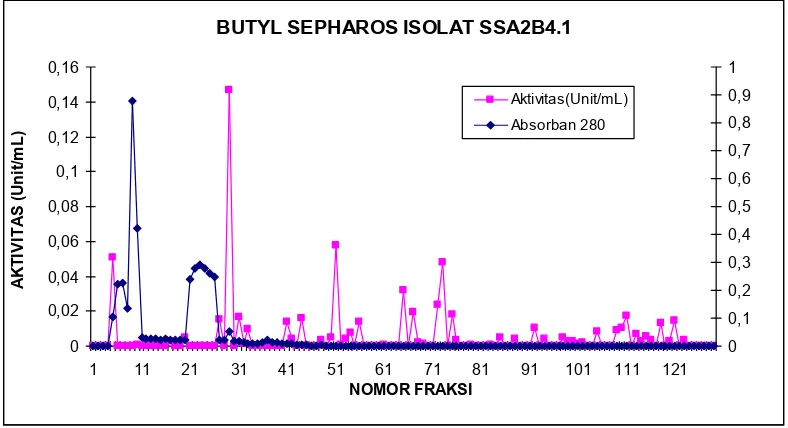
Hasil pemurnian enzim kitinase menggunakan kromatografi kolom interaksi hidrofobik (HIC)
v
Aktivitas senyawa-senyawa oligomer dalam hidrolisat enzimatik pada penghambatan proliferasi sel Hela...
Profil sel Hela pada perbesaran dengan lensa obyektif
¡¢£§¥ ¤§¨© ¡ ª¥¦«ª¦¬ §200 kali...
Aktivitas senyawa-senyawa oligomer dalam hidrolisat enzimatik pada penghambatan proliferasi sel Raji...
Profil sel Raji pada perbesaran dengan lensa obyektif
¡¢£§¥ ¤§¨© ¡ ª¥¦«ª¦¬ §100 kali...
Aktivitas senyawa-senyawa oligomer dalam hidrolisat enzimatik pada penghambatan proliferasi sel MT2...
Profil sel MT2 pada perbesaran dengan lensa obyektif
¡¢£§¥ ¤§¨© ¡ ª¥¦«ª¦¬ §100 kali...
Perbandingan pengujian penghambatan proliferasi sel-sel kanker oleh senyawa oligomer hidrolisat kitin...
vi
Contoh Perhitungan penentuan LC50 ..
Contoh Perhitungan Indeks Stimulasi Limfosit
Hasil Analisis sidik ragam (RAL) dan Uji Duncan pada
sel Limfosit ...
Hasil Analisis sidik ragam (RAL) dan Uji Duncan pada sel HeLa
Hasil Analisis sidik ragam (RAL) dan Uji Duncan pada
sel Raji ..
Hasil Analisis sidik ragam (RAL) dan Uji Duncan pada
ÜÝÞ ßà áâ ãâàÞ
àä ãatar Belakang
Masalah Food Security dan Food Safety di Indonesia memerlukan pemikiran dan usaha terintegrasi dalam memanfaatkan semua potensi sumber
daya lokal yang ada. Memperhatikan negara kita yang pada dasarnya merupakan
Negara Bahari, perlu dilakukan berbagai usaha penggalian potensi marine untuk menunjang perkembangan industri produk pangan / bahan tambahan pangan yang
berbasis bahan lokal, termasuk pemanfaatan limbah perikanan.
Pengolahan hasil-hasil perikanan yang ramah lingkungan dan
menghasilkan limbah dalam jumlah minimal adalah suatu impian dimasa depan.
Konsep ini sering dikenal dengan istilah zero waste system. Pada industri pengolahan (pembekuan) udang, bahan baku udang disortasi (diseleksi) dan
biasanya bagian udang yang berupa kepala dan kulit dibuang. Hewan invertebrata
laut berkulit keras (Crustacea) seperti udang, kepiting dan rajungan, kulitnya mengandung suatu senyawa yang dikenal dengan kitin. Kitin yang terkandung
dalam Crustacea berada dalam kadar yang cukup tinggi berkisar 20-60% tergantung spesies (Rochima, 2004).
Banyak komponen bioaktif pangan saat ini diketahui mempunyai efek
positif terhadap kesehatan, oleh karena itu penggunaan pangan yang diketahui
mengandung senyawa bioaktif atau pangan fungsional merupakan hal yang sangat
bermanfaat. (Elliot, 2002). Saat ini penggunaan pangan fungsional untuk
kesehatan telah berkembang pesat, salah satu faktor pendukungnya adalah
keinginan banyak orang untuk meningkatkan kesehatan dengan cara yang alami.
Hal tersebut dilatarbelakangi oleh berbagai efek samping yang merugikan dari
konsumsi obat-obatan kimiawi yang telah banyak terbukti, sehingga timbul
keinginan untuk menggunakan bahan-bahan dari alam untuk meningkatkan
kesehatan. Selain faktor tersebut, konsumsi makanan yang tidak seimbang juga
telah terbukti menjadi kunci dari faktor eksternal yang berpengaruh pada kejadian
penyakit-penyakit kronis, termasuk terjadinya penyakit-penyakit kanker. Upaya
melalui pangan yang sehat meningkatkan konsumsi komponen bioaktif sebagai
fungsional. Disamping itu penggunaan komponen bioaktif dari bahan-bahan alami
dengan tujuan untuk pengobatan penyakit dalam bentuknutraceuticals kini sudah banyak dijumpai, termasuk senyawa-senyawa kitooligomer yang berasal dari
degradasi limbah bahan yang mengandung kitin saat ini mulai digunakan sebagai
bahan nutraceuticals . Senyawa kitooligomer ini telah menarik perhatian industri karena berbagai manfaatnya untuk pangan dan medis, sehingga memiliki nilai
ekonomi cukup baik untuk dikembangkan saat ini, dengan harga jual dipasaran
internasional yang telah mencapai US$ 60.000 per ton (Sandford, 2003).
Banyak penelitian telah membuktikan bahwa senyawa-senyawa
kitooligomer yang berasal dari limbah berkitin memiliki potensi untuk
dikembangkan sebagai material anti kanker, antara lain senyawa heksa N-asetil
kitoheksaosa dan kitoheksaosa yang berasal dari degradasi kitin.
Senyawa-senyawa kitooligomer yang berasal dari degradasi kitosan telah dilaporkan
memiliki pengaruh menghambat pertumbuhan dan proliferasi sel tumor. Oleh
sebab itu kajian dalam penelitian ini dipandang sangat penting dilakukan untuk
usaha peningkatan nilai tambah limbah berkitin melalui usaha produksi senyawa
bioaktif kitooligomer yang dapat diaplikasikan sebagai pangan fungsional, sistem
imun dannutraceutical .
Penggunaan enzim sebagai biokatalis dalam industri obat-obatan
kosmetika, dan bioteknologi menjadi pilihan yang terbaik saat ini, karena bersifat
ramah lingkungan, prosesnya mudah dikendalikan, dan produk akhirnya seragam.
Penggunaan enzim termostabil dalam penelitian ini dimaksudkan karena sifat
stabilitas enzim terhadap proses panas, sebab sifat enzim yang stabil pada kondisi
panas diminati oleh kalangan industri karena memiliki nilai ekonomis yang lebih
tinggi, antara lain reaksi dapat berlangsung pada suhu tinggi sehingga mengurangi
kontaminasi bakteri mesofil dan laju reaksi lebih cepat sehingga mengurangi
biaya produksi. Selain itu enzim termostabil dari mikroba termofil lebih tahan
terhadap berbagai senyawa atau keadaan penyebab denaturasi sehingga dapat
lebih tahan disimpan. Sifat stabil yang dimiliki enzim termofil menekan peluang
teknolog dalam menangani proses produksi dan pemurniannya. Indonesia
merupakan Negara yang kaya diversitas sehingga peluang menemukan mikroba
termofil penghasil enzim yang unik cukup realistik.
Wahyuni et alå (2010) dalam penelitiannya tentang skrining bakteri
penghasil kitinase dari tempat pemeliharaan udang (tambak), penampungan
udang, limbah pengolahan udang dan tempat pembuangan limbah padat udang
yang terdapat di beberapa daerah industri perikanan di Sulawesi Selatan dan
Sulawesi Tenggara, berhasil memperoleh 28 isolat bakteri kitinolitik. Dari 28
isolat ini yang menghasilkan aktivitas kitinase tertinggi yaitu isolat SSF2D5.3;
SSF2.E5.2 (tumbuh baik pada 28oC) dengan aktivitas enzim kitinase
berturut-turut sebesar 0,448 Unit/ml enzim dan 0,444 Unit/ml enzim dan isolat SSA2B4.1;
SSD2A7.1 (tumbuh baik pada 37oC) dengan aktivitas enzim kitinase
berturut-turut sebesar 0,452 Unit/ml enzim dan 0,449 Unit/ml enzim. Namun dari keempat
isolat terdapat 2 isolat yang memiliki karakterisasi yang cukup baik yakni
memiliki pH optimum 4-6 untuk isolat SSA2B4.1 dan isolat SSD2A7.1 pada pH
6-8. Hal ini menunjukkan kitinase dari isolat ini dapat bekerja optimum
menghidrolisis substrat kitin pada pH asam dan pH alkali. Selain itu kitinase dari
isolat SSA2B4.1 dan SSD2A7.1 memiliki suhu optimum 70oC, dengan demikian
enzim kitinase yang diperoleh dari kedua isolat terpilih tersebut berpotensi untuk
dikembangkan sebagai enzim termostabil, namun dari hasil análisis HPLC, isolat
SSA2B4.1 memiliki hasil komposisi dan konsentrasi senyawa-senyawa oligomer
dalam hidrolisat yang berukuran mono sampai pentamer.
Berdasarkan latar belakang tersebut, maka dalam penelitian ini dilakukan
kajian produksi oligomer kitin yang bersifat bioaktif dengan menggunakan enzim
kitinase yang dihasilkan oleh isolat SSA2B4.1(æacillus cereus SW41)yang telah
dikarakterisasi sebelumnya secara menyeluruh, dan uji bioaktivitas untuk
mengamati aktivitas farmakologi suatu senyawa. Selanjutnya penelitian ini
ditujukan untuk menghasilkan senyawa-senyawa oligomer kitin yang memiliki
aktivitas bioaktif sebagai anti proliferasi sel-sel kanker, sehingga dapat
memberikan informasi tentang alternatif peningkatan nilai dan daya guna limbah
m a
sehingga informasi yang diberikan dapat digunakan untuk usaha pengembangan
industri, khususnya pangan dan nutraceutical berbasis produk marin e, yang berpeluang menjadi produk eksport.
B. Tujuan Penelitian
Penelitian ini bertujuan untuk menganalisis aktivitas biologi oligomer
hidrolisat kitin yang diproduksi menggunakan enzim kitinase dari isolat
SSA2B4.1 (çèéillus cereus SW41) pada sel limfosit dan sel kanker.
C. Manfaat Penelitian
Manfaat yang dapat diperoleh dengan terlaksananya penelitian ini adalah
dapat memberikan peningkatan nilai dan daya guna limbahmarin e lokal menjadi produk yang memiliki nilai ekonomis tinggi, sehingga informasi yang diberikan
dapat digunakan untuk usaha pengembangan industri, khususnya pangan dan
n u tra ceu tica
l berbasis produkmarin e, yang berpeluang menjadi produk eksport.
D. Hipotesis
Hipotesis dalam penelitian ini adalah :
1. Enzim kitinase dari çê scereu SW41 dapat digunakan untuk memproduksi
senyawa-senyawa oligomer hidrolisat kitin.
2. Senyawa-senyawa oligomer hidrolisat kitin tidak bersifat toksik terhadap sel
TINJAUAN PUSTAKA
A. Kitin
Kitin berasal dari bahasa Yunani yaitu chiton yang berarti lapisan kulit dan
ditemukan pertama kali oleh Bradconnot pada tahun 1811. Pada tahun 1823,
Odier menyebut kitin sebagai suatu zat yang sama seperti komponen di dalam
in
sect . Kitin mempunyai struktur kimia yang mirip dengan selulosa, yaitu suatu polisakarida yang disusun oleh molekul-molekul gula sederhana yang identik.
Kitin merupakan biopolimer rantai lurus yang disusun oleh monomer-monomer
N-asetil glukosamin yang dihubungkan oleh ikatan (1 4), seperti pada
gambar 1.
Gambar 1. Struktur molekul kitin (Liet al . 1997)
Kitin merupakan biopolimer alami yang berlimpah di alam, merupakan
biopolimer kedua terbanyak setelah selulosa dengan (1 4) berikatan dengan
glycan, tetapi disusun oleh 2-acetamido-2-deoxy- -D-glukosa
(N-asetilglukosamin), dan merupakan salah satu polisakarida yang paling berlimpah
diberi nama Poly (1 4)-2-acetamido-2-deoxy-D-glukosa. Kitosan adalah nama
yang digunakan untuk bentuk asetil yang tersubtitusi rendah pada kitin yang
penyusun utamanya adalah glukosamin, 2-amino-2-deoxy- -D-glukosa, yang
Pada saat ini aplikasi kitin dan turunannya mendapat banyak perhatian
pada bidang pangan dan farmasi. Kitosan mempunyai tiga jenis kelompok
fungsional reaktif. Modifikasi kimia pada kelompok ini jika dimanfaatkan
mempunyai banyak kegunaan material dalam mengaplikasikannya.
Kitin adalah komponen lapisan kulit dari avertebrata berkulit keras
(crustac eae ), serangga, kerang, dan dinding sel beberapa mikroorganisme. Kitin paling banyak terdapat pada kulit golongan crustaceae , dengan kandungan kitin mencapai 40-60% (Goosen, 1997).
Kitin terdistribusi diberbagai organisme dalam bentuk beragam. Kitin
selalu ditemukan terikat dengan komponen struktur lain seperti protein dan
mineral. Kitin yang dihasilkan dari berbagai sumber, mempunyai struktur yang
sama tetapi beragam dan berikatan dengan protein dan kalsium karbonat. Isolasi
kitin melalui tiga tahap preparasi, yaitu deproteinase, demineralisasi, dan
dekolorisasi. Deproteinase atau penghilangan protein dilakukan dengan
pemanasan kitin di dalam larutan alkali. Demineralisasi dilakukan dengan
penambahan HCl yang bertujuan untuk menghilangkan kalsium karbonat dan
proses dekolorisasi bertujuan untuk menghilangkan pigmen (Goosen, 1997).
Kitin tidak larut dalam air, asam anorganik tanpa liofilisasi, asam organik,
basa dengan liofilisasi dan pelarut organik. Kitin dapat larut dalam
N,N-dimetilasetamida yang mengandung litium klorida. Kitin juga larut dalam asam
dengan liofilisasi seperti H2SO4, HNO3, asam fosfat dan asam format anhidrida.
Adapun sifat dan kriteria mutu kitin dapat dilihat pada Tabel 1.
Tabel 1. Sifat dan mutu kitin
Sifat Nilai
Ukuran Partikel Butiran bubuk
Kadar air (% berat kering) 10%
Kitin dan turunannya, yaitu kitosan, oligomer kitin, dan oligomer kitosan
memiliki kemampuan mengkelat dan mampu membentuk kationik (polielektrolit),
yang diduga disebabkan oleh biofungsionalitas dari gugus amin dalam
strukturnya. Sifat-sifat ini membuat kitin dan turunannya banyak dimanfaatkan
dalam industri pangan dan nutraceutical , kesehatan, pertanian, dan bahkan industri kosmetik. Dalam industri pangan, kitin dan turunannya antara lain
dimanfaatkan sebagai penguat rasa dan tekstur, pengawet, penstabil warna,
pengemulsi dan penjernih minuman, bahkan sejak tahun 1992 Departemen
Kesehatan Jepang telah menetapkan kitin dan turunannya sebagai pangan
fungsional. Pemanfaatan kitin dalam industri medis dan obat-obatan antara lain
sebagai material untuk plester, lensa kontak membran dialisis darah, dan untuk
pengontrol kadar kolestrol darah. (Kolodzeiesjka et alë 2000, Curroto dan Aros
1993).
Berbagai penelitian telah dilakukan untuk mengetahui manfaat lain dari kitin
dan turunannya. Kitin mampu mempercepat penyembuhan luka pada hewan uji,
mengaktifkan makrofag, protein komplemen, dan sel limtosit T sitotoksik (Suzuki
et al .,1992), serta mampu melindungi hewan uji (mencit) dari infeksi bakteri patogen (Tokoroet al ., 1989; Kobayashiet al ., 1990; Suzukiet al ., 1992).
Oligomer kitin dan oligomer kitosan memiliki aplikasi yang lebih luas. Hal
ini disebabkan karena bobot molekulnya lebih rendah.Selama ini pemanfaatan
kitin dan kitosan secarain vivo terhambat oleh bobot molekul dan viskositas yang tinggi dari senyawa tersebut (Shahidi et al ., 1999). Oleh karena itu, untuk pemanfaatan lebih lanjut, kitin dan kitosan harus mengalami depolimerisasi
menjadi oligomer atau monomer. Oligomer kitin dan kitosan dapat diaplikasikan
sebagai pengatur kadar kolestrol, agen anti kanker, anti mikroba,
im
ci ng , serta dalam pengobatan penyakit osteoartritis dan gastritis. Hidrolitas kitin yang mengandung oligomer dengan derajat polimerisasi 1-6
mampu menginduksi proliferasi dan sekresi lgM dari sel hibridoma manusia
B. Enzim-Enzim Pendegradasi Kitin
Kitinase dihasilkan oleh sejumlah besar organisme. Pada bakteri kitinase
diperlukan untuk memenuhi kebutuhan nutrisinya, sementara pada tanaman
kitinase digunakan untuk melawan jamur patogen maupun parasit. Untuk
mendegradasi kitin menjadi monomer N-asetilglukosamin, diperlukan beberapa
enzim. Gambar 2 menjelaskan bagaimana mikroba mendegradasi kitin dan
berbagai enzim yang berperan dalam proses tersebut.
Keterangan : n = 2-5 monomer
Gambar 2. Jalur degradasi kitin oleh mikroba (Gooday, 1990)
Enzim kitinase (EC 3.2.1.14) adalah enzim yang memutuskan ikatan 1-4
pada kitin, atau enzim yang mampu menghidrolisis kitin menjadi monomernya
N-asetilglukosamin dan dapat dibedakan menjadi endo dan eksokitinase.
Endokitinase bekerja secara acak pada bagian tengah molekul kitin sehingga
dihasilkan oligomer N-asetilglukosamin, sedangkan enzim eksokitinase bekerja
secara berurutan dari ujung molekul, sehingga dihasilkan bentuk monomer dan
dimer.
Karena molekul kitin sulit di pecah, degradasi kitin biasanya melibatkan
lebih dari satu jenis enzim, dan terjadi dalam dua tahap, baik pada prokariot
maupun eukariot. Endokitinase (EC. 3.2.1.14) bekerja memotong kitin menjadi
kitooligomer, dan selanjutnya diubah menjadi monomer oleh eksokitinase (
-N-asetil glukosaminidase). Eksokitinase membuka molekul N--N-asetil glukosamin dari
ujung non pereduksi dan cenderung memilih substrat yang lebih kecil
produk berupa oligomer kitin, sedangkan tipe pemotongan eksokitinase
menghasilkan produk berupa monomer kitin (N-asetilglukosamin) dan oligomer
kitin. Sebagai konsekuensi dari sifat ini, laju keseluruhan dari hidrolisis kitin
dibatasi oleh kerja endokitinase, yang secara drastis meningkatkan konsentrasi
substrat efektif bagi N-asetilglukosaminidase.
Proses pengubahan kitin menjadi turunan oligosakarida secara kimiawi
oleh asam cenderung dihindari karena proses ini tidak dapat dikontrol,
menghasilkan lebih banyak monomer D-glukosamin dan lebih sedikit
kitooligomer, padahal yang memiliki aktivitas biologi penting adalah
senyawa-senyawa kitooligomernya (Kolodzeiesjkaet alì 2000, Curroto dan Aros 1993).
Aplikasi enzim yang menghasilkan oligomer dari kitin dengan ukuran
spesifik jauh lebih menguntungkan dibandingkan dengan hidrolisis kimia kitin
yang cenderung menghasilkan monomer, karena ukuran spesifik produk oligomer
(trimer sampai heksamer) berkaitan erat dengan sifat fisiologis dan bioaktifnya.
Aplikasi enzim-enzim pemodifikasi dan pengurai senyawa kitin dan turunannya
sangat diperlukan untuk menghasilkan senyawa kitooligosakarida. Ukuran
molekul produk akhir hidrolisis, yaitu senyawa oligomer kitin dan kitosan sangat
penting diperhatikan, karena sifat fungsional bergantung pada berat molekulnya
dan memiliki aktivitas biologi penting adalah senyawa oligomernya (Curroto dan
Aros 1993, Suzuki 1996, Kolodziejska et alì 2000). Berdasarkan hasil penelitian
Wahyuni (2006) oligomer kitosan yang diproduksi secara enzimatik
menggunakan enzim kitosanase dariíîïillus licheniformis MB2 yang berasal dari
sumber air panas Tompaso Manado, memiliki aktivitas imunostimulan dan
penghambat proliferasi beberapa jenis sel kanker HeLa, A549, K562, dan KR-4
secarain vitroyang lebih baik dibanding kitosannya sendiri. Agustine (2005) juga mendeteksi adanya kemampuan oligomer kitin yang dihasilkan dari Bacillus
licheniformisMB2 mengaktifkan proliferasi sel limfosit secarain vitro.
Depolimerisasi kitin menjadi oligomer kitin dapat dilakukan dengan asam
organik atau dengan hidrolisis enzimatik. Penggunaan asam nitrat, asam fosfat,
HCl, dan HF mampu memotong polimer kitin menjadi unit-unit yang lebih
produknya, selain itu lebih banyak monomer yang dihasilkan dibanding oligomer
(Defayeet alð 1989; Hasegawaet alð 1993). Sebaliknya hidrolisis kitin oleh enzim
sangat efisien karena prosesnya dapat dikontrol dengan tepat.
Biasanya bakteri menghasilkan beberapa kitinase untuk menghidrolisis
berbagai bentuk kitin yang terdapat di alam dan dimanfaatkan oleh mikroba
sebagai sumber karbon (Wang dan Chang, 1997; Yanai et alðñ 1992). Kitinase
dihasilkan oleh bakteri, insekta, kapang, tanaman dan hewan. (Gooday, 1990,
Patil et al . 2000). Diantara bakteri penghasil kitinase tercatat òóôillus ,
õö ÷øùóöñudom Vibrios, Actinomycetes, dan Clostridia (Ueda dan Arai 1992,
Wang dan Chang 1997, Sakai et al. 1998, Patil et al. 2000). Keuntungan menggunakan mikrob sebagai sumber enzim antara lain mikrob dapat tumbuh
relatif cepat, bahan baku relatif murah, mudah diisolasi, dan terbuka peluang
untuk meningkatkan mutu enzim melalui rekayasa genetika (Madiganet al. 2000). Informasi tentang mikroba penghasil enzim kitinase telah dilaporkan oleh
beberapa peneliti, antara lain kitinase dari Streptomyces cursanovii (37oC) telah dilaporkan oleh Ilyina et al. (2000). Kitinase yang berasal dari fungi dilaporkan oleh Kuranda dan Robin (1991), yang mengisolasi kitinase dari S.cerevisiae, M.
Rouxii oleh Meyer (1997), Benjaminiella poitrasii oleh Ghormade et al., (2000),
dan A. bisporus oleh Rast.,et al(2003)
Karakteristik enzim kitinase yang berasal dariBacillus cereus SW41dapat dilihat pada tabel 2.
Tabel 2. Karakteristik enzim kitinase dariBacillus cereusSW41
No Parameter Karakteristik
C. Larva Udang (Artemia salina)
Uji bioaktivitas adalah uji pendahuluan untuk mengamati aktivitas
senyawa bioaktif selalu bersifat toksik jika diberikan pada dosis yang tinggi dan
menjadi obat pada dosis rendah. Oleh karena itu daya bunuh in vivo dari senyawa dapat digunakan untuk menapis ekstrak tumbuhan yang mempunyai bioaktivitas.
Salah satu organisme yang sangat sesuai untuk uji tersebut adalah larva udang
atauúû üemia salina .
úû üemia merupakan kelompok udang-udangan dari phylumúû ühropoda .
Mereka berkerabat dekat dengan zooplankton lain seperti copepode dan daphnia
(kutu air). úûüemia hidup di danau-danau garam (berair asin) yang ada diseluruh
dunia. Udang ini toleran terhadap selang salinitas yang sangat luas, mulai dari
hampir tawar hingga jenuh garam. Secara alamiah salinitas danau dimana mereka
hidup sangat bervariasi, tergantung pada jumlah hujan dan penguapan yang
terjadi. Apabila konsentrasi garam kurang dari 6% telur úû üemia akan tenggelam
sehingga telur tidak bisa menetas, hal ini biasanya terjadi apabila air tawar banyak
masuk ke dalam danau dimusim penghujan. Sedangkan apabila konsentrasi garam
lebih dari 25% telur akan tetap berada dalam kondisi tersuspensi, sehingga dapat
menetas dengan normal.
Metode ujiý ûþne ÿ ûþmpLethality Test (Uji BSLT) ini menggunakan larva
Artemia salina. Kemampuan bioaktivitas diketahui berdasarkan jumlah kematian
larva udang akibat pemberian ekstrak. Ekstrak bersifat sitotoksik bila harga
LC50-nya < 1000 ppm (Meyer et al. 1982). Metode ini mempunyai beberapa keuntungan antara lain, waktu pelaksanaan cepat, biaya relatif murah, pengerjaan
sederhana, tidak memerlukan teknik aseptik, tidak memerlukan peralatan khusus,
menggunakan sampel dalam jumlah relatif sedikit dan tidak memerlukan serum
hewan seperti pada uji sitotoksik (Meyer, et al. 1982). Hasil bioassay terhadap senyawa-senyawa tersebut menggunakan udangArtemia salinamenunjukkan sifat sitotoksik yang tinggi (Ersam, et al. 2003). Artemia salina Leach merupakan hewan coba yang digunakan untuk praskrining aktivitas antikanker di National
Cancer Institute, Amerika Serikat (Meyer,et al. 1982).
D. Limfosit Dalam Sistem Imun
Limfosit adalah sel darah putih (leukosit) yang mampu menghasilkan
(leukosit) berukuran kecil, berbentuk bulat (diameter 7-15 m), banyaknya
20-25% dan fungsinya membunuh dan memakan bakteri yang masuk ke dalam
jaringan tubuh dan banyak terdapat pada organ limfoid seperti limpa, kelenjar
limfe dan timus. Terdapat dua kelas leukosit yaitu, yang mengandung granula
dalam sitoplasmanya (granulosit) dan agranulosit yang tidak mengandung granula
(Ganong, 1990). Limfosit merupakan sel kunci dalam proses respons imun
spesifik, mengenali antigen melalui reseptor antigen dan mampu membedakannya
dari komponen tubuhnya sendiri (Kuby, 1992).
Darah adalah suspensi yang terdiri dari elemen-elemen atau sel-sel, dan
plasma yaitu larutan yang mengandung berbagai molekul organik dan anorganik.
Ada tiga grup sel darah, yaitu sel darah merah (RBC) atau eritrosit, sel darah
putih (WBC) atau leukosit yang terdapat kurang dari 1% volume total darah, dan
butir pembeku (platelets) atau trombosit.
Sistem imun merupakan sistem interaktif kompleks dari beragam jenis sel
imunokompeten yang bekerjasama dalam proses identifikasi dan eliminasi
mikroorganisme patogen dan zat-zat berbahaya lainnya yang masuk ke dalam
tubuh. Sistem imun dibedakan dalam dua kelas yaitu sistem imun non spesifik dan
spesifik. Respon imun non spesifik timbul sebagai reaksi terhadap
mikroorganisme patogen dan zat asing lainnya melalui fagositosis dan monosit
(makrofag), barier kimia melalui sekresi internal dan eksternal, lisozim dalam
mukus jaringan, air mata, laktoperoksidase dalam saliva, protein darah, interferon,
sistem kinin dan komplemen, dan sel Natural Killer (NK) (Parslow dan Bainton,
1992). Sistem imun spesifik meliputi sistem imun seluler dan humoral. Sistem
imun seluler memberikan pertahanan terhadap serangan mikroorganisme intra dan
ekstraseluler melalui sekresi limfokin seperti interferon dan interleukin.
Sedangkan sistem imun humoral memberi pertahanan melalui produksi antibodi
terhadap antigen spesifik (Roitt dan Delves, 2001).
1. Sel Limfosit
Semua sel darah (limfosit, granulosit, eritrosit dan megakariosit) berasal
Dalam timus sel-sel limfosit ini akan mengalami semacam proses pematangan
menjadi sel limfosit yang nantinya akan berfungsi dalam reaksi imunitas seluler
(cellular immunity ). Sel limfosit yang telah diproses dalam kelenjar timus ini dinamakan sel limfosit T. Sel limfosit yang tidak mengalami proses pematangan
dalam kelenjar timus, mengalami proses pematangan dalam sumsum tulang dan
mungkin dalam kelenjar getah bening. Sel-sel yang disebut terakhir ini setelah
mengalami proses pematangan akan mempunyai kemampuan untuk membentuk
antibodi dalam reaksi imunitas. Sel ini dinamakan sel limfosit B. Sel lomfosit T
dan limfosit B yang baru terbentuk akan mengalir dalam pembuluh darah dan
pembuluh limfe. Sebagian besar dari sel limfosit (T dan B) akan masuk ke dalam
kelenjar getah bening dan menetap sementara di dalamnya, sedang sebagian lain
akan meninggalkan kelenjar getah bening dan masuk kembali dalam sirkulasi.
Begitu masuk ke dalam kelenjar getah bening sel limfosit ini akan langsung
menempati tempat-tempat yang telah ditentukan untuk masing-masing sel T dan
sel B. Limfosit B akan masuk ke dalam folikel sedang limfosit T menempati
daerah para - cortex dan medulla. Jika ada antigen masuk ke dalam tubuh kita
maka limfosit T juga akan bertransformasi menjadi imunoblast. Sedangkan pada
limfosit B, rangsangan antigen menyebabkan transformasi sel yang akhirnya
menghasilkan sel-sel plasma. Sel plasma inilah yang membentuk antibodi ("reaksi
immunitas humoral"). Sel plasma yang merupakan produk akhir dari limfosit B
tidak lagi memiliki imunoglobulin pada permukaan selnya. Sel-sel ini juga tidak
memiliki reseptor terhadap komplemen, namun sebaliknya ia memiliki
imunoglobulin intraseluler (tracytoplasmic iminglouonmbulin ).
Sel limfosit terdiri dari 2 tipe sel yang mampu membuat kekebalan yaitu
sel limfosit T, yang berfungsi dalam imunitas seluler, dan sel limfosit B yang
berfungsi dalam imunitas humoral (Bellanti, 1993). Sel limfosit B berasal dari
sumsum tulang belakang dan berdiferensiasi dalam jaringan ekivalen bursa.
Jumlah sel limfosit B dalam keadaan normal berkisar antara 10-15%. Setiap sel B
memiliki 105 cell ceptor (BCR), dan setiap BCR memiliki dua situs
pengikatan antigen yang identik. Antigen yang umum bagi sel B adalah protein
aslinya. Hal ini membedakan sel B dengan sel T, yang mengikat antigen yang
sudah terproses dalam sel (Kresno, 1996).
Sel B dan sel T sama-sama dihasilkan di sumsum tulang, tetapi pada
kelanjutannya kedua sel ini berdiferensiasi dan memiliki mekanisme
masing-masing dalam melawan antigen yang masuk ke dalam tubuh. Sel B bereaksi
terhadap antigen dengan cara berdiferensiasi menjadi sel plasma dan
memproduksi antibodi pada permukaan selnya, sehingga antigen terikat pada
antibodi tersebut dan terjadi opsonisasi antigen pada permukaan sel B. Berbeda
dengan sel B, beberapa sel T bereaksi terhadap antigen dengan berdiferensiasi
menjadi sel Th aktif yang menstimulasi produksi antibodi bebas serta
mengaktivasi makrofag. Antibodi yang dihasilkan sel T dapat bergerak bebas
menghampiri antigen dan mengikatnya. Mekanisme ini digambarkan pada
Gambar 3.
Gambar 3. Mekanisme perlawanan terhadap antigen oleh limfosit (Roitt dan Delves, 2001).
Penanda permukaan membran atau antigen cluster of differentiation (CD) adalah molekul yang digunakan untuk membedakan sel fungsional yang tidak
terdeteksi secara mikroskopis (Decker, 2001). CD ini dibedakan oleh
kemampuannya untuk mengikat antibodi yang mengenalinya. Penanda permukaan
ini terdapat pada sel limfosit yang sudah matang dan sudah mengalami
diferensiasi.
Sel limfosit dapat mengenali suatu antigen secara spesifik dan menerima
sinyal untuk berproliferasi. Setelah berikatan dengan antigen, limfosit B akan
mengalami proses perkembangan melalui 2 jalur, yaitu (a) berdiferensiasi menjadi
Limfosit B
Antigen
sel plasma yang menghasilkan immunoglobulin, dan (b) membelah lalu kembali
dalam keadaan istirahat sebagai sel limfosit B memori. Sel limfosit mampu
berproliferasi dan berdiferensiasi menjadi sebuah klon yang terdiri dari sel-sel
efektor dengan spesifisitas antigen yang sama (Decker, 2001).
Sel T merupakan bagian dari sel limfosit yang sebagian besar terdapat
dalam sirkulasi darah, yaitu sebanyak 65-85%. Sel T terdiri dari tiga subset yaitu
sel Tc atau sel sitotoksik, sel Th atau sel T helper dan sel Ts atau sel T yang terinfeksi patogen intraseluler, dan sel Th berperan dalam stimulasi sintesis
antibodi dan aktivasi makrofag dengan cara mensekresikan molekul sinyal yang
disebut sitokin. Sel Ts mampu menekan aktivitas sel imun. Sel T memiliki
molekul T ell igen ceptor (TCR) yang dapat mengenali epitop suatu
antigen melalui kerjasama dengan molekul protein permukaan pada igen
sentingells (APC). Sel T teraktivasi oleh antigen spesifik sehingga
terstimulasi untuk berproliferasi dan berdiferensiasi menjadi sel T memori dan
berbagai sel T efektor yang mensekresi berbagai limfokin. Limfokin tersebut
berpengaruh pada aktivasi sel B, Tc, dan sel-sel fagositik, sel NK dan sel lain
yang terlibat dalam sistem imun (Roitt dan Delves 2001).
Sel natural killer (sel NK) adalah sel limfosit granular yang berukuran besar. Pada manusia normal, sel NK terdapat dalam jumlah 5-15% dari jumlah
limfosit darah (Kresno, 1996). Sel ini merupakan garis depan pertahanan tubuh
terhadap sel yang terinfeksi virus dan sel tumor. Sel NK memiliki reseptor yang
menyerupai lektin, yaitu reseptor yang dapat berikatan dengan senyawa
karbohidrat pada sel sasaran sehingga menghasilkan pengiriman sinyal pada sel
NK untuk membunuh sel tersebut. Populasi sel (sel NK) dapat membunuh sel
sasaran secara spontan tanpa sensitisasi terlebih dahulu. Menurut Roitts dan
Delves (2001), ketika sel terinfeksi virus atau berubah bentuk menjadi sel yang
termutasi, molekul permukaanya berubah. Perubahan ini dikenali oleh sel NK,
lalu sel NK membunuh sel tersebut. Sel NK secara fenotip berbeda dengan sel
limfosit T maupun sel limfosit B, yaitu tidak memiliki CD3/TCR maupun ace
terinveksi virus menghasilkan interferon yang dapat member isyarat ke sel pada
jaringan yang berdekatan. Sel NK diduga dapat mengenali sel tumor atau sel yang
terinfeksi virus karena sel sasaran tersebut mengekspresikan molekul glikoprotein
pada permukaan sel yang membedakannya dari sel normal. Glikoprotein tersebut
kemudian bertindak sebagai lektin yang dapat mengikat sel NK melalui reseptor
yang terdapat pada permukaan sel NK sehingga terjadi rangsangan (Kresno,
1996). Sitolisis terhadap sel tumor dapat terjadi karena dilepaskannya faktor
sitotoksik, yaitu kondratin sulfat A, yang melindungi sel NK terhadap autolysis
oleh substansinya sendiri (Kresno, 1996).
2. Pengujian Proliferasi Limfosit
Proliferasi merupakan fungsi biologis mendasar pada sel limfosit, yaitu
meliputi proses diferensiasi dan pembelahan sel. Aktivitas proliferasi limfosit
merupakan salah satu parameter yang dapat digunakan untuk mengukur status
imunitas karena proses prolifersi menunjukkan kemampuan dasar dari sistem
imun (Roit dan Delves, 2001). Limfosit merupakan sel tunggal yang bertahan baik
saat di kultur dalam media sintetik lengkap. Respon proliferatif kultur limfosit
dalam media sintetik dapat digunakan untuk menggambarkan fungsi limfosit dan
status imun individu (Tejasari, 2000). Zakaria et al (1992) menyatakan bahwa kemampuan limfosit untuk berproliferasi atau membentuk klon menunjukkan
secara tidak langsung kemampuan respon imunologik atau tingkat kekebalan.
Pengujian terhadap kemampuan fungsional limfosit dapat dilihat dari
kemampuan memberikan respon terhadap mitogen (proliferasi sel), kemampuan
membentuk immunoglobulin atau limfokin, dan kemampuan sitotoksisitas sel NK
(Tejasari, 2000). Uji proliferasi limfosit dapat dilakukan melalui pengukuran
kemampuan sel limfosit yang ditumbuhkan dalam kultur sel jangka pendek yang
mengalami proliferasi klonal ketika dirangsang secara in vitro oleh antigen atau mitogen (Valentine dan Lederman, 2000). Bila sel dikultur dengan senyawa
mitogen, maka limfosit akan berproliferasi secara tidak spesifik. Begitupula, bila
limfosit dikultur dengan antigen spesifik maka limfosit akan berproliferasi secara
Metode yang lebih sederhana untuk penghitungan jumlah sel yang
berproliferasi adalah metode pewarnaan MTT
(3-(4,5-Dimethyl-2-thiazoly)-2,5-diphenyl-2H-tetrazolium bromide). Prinsip metode MTT adalah konversi MTT
menjadi senyawa formazan yang berwarna ungu oleh aktivitas enzim suksinat
dehidrogenase dari mitokondria sel hidup (Kubota et al . 2003). Reaksi yang terjadi digambarkan pada Gambar 4. Jumlah senyawa formazan yang terbentuk
adalah proporsional dengan jumlah sel limfosit yang hidup. Selain dengan metode
MTT, perhitungan sel dapat dilakukan dengan metode pewarna tripan biru, yang
hanya dapat mewarnai jika membran sel telah rusak, sehingga dapat digunakan
untuk membedakan sel hidup dan sel yang mati atau rusak. Sel yang hidup tidak
akan berwarna dan berbentuk bulat, sedangkan sel mati akan berwarna biru dan
mengkerut (Bird dan Forrester, 1981).
Gambar 4. Mekanisme reaksi Reduksi MTT menjadi MTT formazan oleh enzim suksinat dehidrogenase (Kubotaet al . 2003)
Beberapa senyawa yang telah diketahui mampu meningkatkan proliferasi
sel limfosit adalah : vitamin C dan E (Budiharto, 1997), ekstrak bawang putih
(Lastari, 1998), ekstrak tanaman cincau hijau (Pandoyo, 2000) ekstrak air kayu
secang (aesalpinia sappan Linn) (Puspaningrum, 2003), teh daun dan serbuk gel
cincau (yclea ) (Setiawati, 2003), bunga kumis kucing (Orthosimphon stamineus
benth) dan bunga knop (Gomphrena globosa L.) (Aquarini, 2005), dan
kitooligomer kitin (Agustine, 2005). Senyawa-senyawa tersebut bekerja melalui
3. Mitogen sebagai Senyawa Pemacu Proliferasi Sel Limfosit
Mitogen adalah sumber ligand polipeptida yang dapat berikatan dengan
reseptor yang terdapat pada permukaan sel. Beberapa mitogen merupakan factor
pertumbuhan yang mengaktivasi tirosin kinase. Aktivasi tersebut diawali oleh
mitogen yang mengakibatkan adanya urut-urutan sinyal yang berpengaruh
terhadap berbagai faktor transkripsi dan berpengaruh terhadap aktivitas gen di
dalam sel (Decker, 2001).
Beberapa molekul pada patogen mampu berikatan dengan molekul
permukaan limfosit yang bukan merupakan reseptor antigen. Jika pengikatan ini
mampu menginduksi limfosit untuk membelah (mitosis), maka molekul tersebut
disebut mitogen. Mitogen menginduksi proliferasi limfosit pada frekuensi tinggi
tanpa memerlukan adanya spesifisitas antigen, disebut dengan aktivasi poliklonal.
Beberapa mitogen hanya mampu menginduksi proliferasi sel B, beberapa hanya
berpengaruh pada sel T, dan ada juga yang mampu menginduksi keduanya.
Beberapa mitogen disebut antigen T-independen, karena mampu menginduksi sel
B untuk mensekresinantibodi tanpa ada bantuan dari sel Th (Decker, 2001).
Lektin pada umumnya adalah mitogen yang merupakan protein yang
berikatan dengan senyawa karbohidrat. Concavalin A (Con A) dan
Fitohemaglutinin (PHA) mempunyai struktur tetramer dengan setiap monomernya
memiliki satu situs pengikat karbohidrat, sehingga dapat mengikat glikoprotein
pada permukaan sel. Pokeweed (PWM) berasal dari tumbuhan pokeweed
(tolacca ericana ). PMW mampu berikatan dengan di-N-asetyl kitobiose
dan mampu menginduksi baik sel B dan sel T (Kuby 1992). Lektin Con A adalah
mitogen asal legum yang bersifat sebagai imunomodulator karena dapat
meransang proliferasi limfosit. Menurut Kresno (1996) sebanyak 50-60% sel
limfosit T mampu memberikan respon terhadap stimulasi dengan mitogen PHA
dan Con A. Lipopolisakarida (LPS) juga mampu berfungsi sebagai mitogen, tetapi
pengaruhnya hanya pada sel B (Kuby 1992). Respon terhadap mitogen tersebut
dianggap menyerupai respon limfosit terhadap antigen, sehingga uji transformasi
dengan ransangan mitogen tersebut banyak dipakai untuk menguji fungsi limfosit.
reaksi biokimia di dalam sel, diantaranya fosforilasi nukleoprotein, pembentukan
DNA dan RNA, peningkatan metabolisme lemak dan lain-lain (Letwin dan
Kuimby 1987).
Lektin dan fitohemaglutinin (PHA) adalah protein non enzimatik, berikatan
dengan karbohidrat secara reversibel. Fungsi biologis dari lektin adalah
kemampuan mengenal dan berikatan dengan struktur karbohidrat spesifik,
khususnya berikatan dengan oligosakarida. Lektin dapat berikatan dengan
berbagai sel yang memiliki molekul permukaan berupa glikoprotein atau
glikolipid. Beberapa gugus spesifik lektin telah didentifikasi seperti mannose,
galaktosa, asetiglukosamin, asetilgalaktosamin, L-fruktosa, dan asam
N-asetilneraminik. Sub unit lektin saling berhubungan satu dengan yang lain melaui
ikatan non kovalen atau ikatan-ikatan disulfida. Beberapa lektin membutuhkan
kation devalen seperti kalsium, magnesium dan mangan untuk berikatan dangan
karbohidrat. Lektin terdiri dari enam famili yang telah dikenal yaitu: lektin legum,
lektin sereal, lektin jenis P, C, S dan pentraxis (Letwin dan Quimby 1987).
E. Kultur Sel
Kultur secara in vitro merupakan suatu cara untuk mengembangbiakkan atau menumbuhkan sel di luar tubuh hewan atau manusia. Lingkungan atau bahan
makanan untuk pertumbuhan sel secara in vitro diusahakan menyerupai keadaan sel secara in vivo . Oleh karena itu, diperlukan suatu media pertumbuhan yang berisi asam-asam amino, vitamin, mineral, garam-garam anorganik, glukosa dan
serum. Peranan serum dalam medium biakan sangat penting yaitu sebagai nutrien
untuk pertumbuhan sel serta fungsinya dalam pelekatan sel. Serum memberikan
hormon-hormon penting, faktor penempel sel ke matriks tempat sel tumbuh,
protein, lipid serta mineral-mineral yang diperlukan sebagian besar jenis sel untuk
tumbuh dan berkembang. Sel yang dikultur dapat berupa suatu galur sel, yaitu
populasi sel yang berasal dari suatu sumber jaringan tertentu yang mengalami
pengkulturan lebih lanjut, hingga mencapai sub kultur.
Kultur sel dari jaringan sel kanker diperbanyak dibawah kondisi yang
sesuai sampai sel dapat menggunakan semua substrat, menjadi sangat padat
konfluen, sel harus dipindahkan ke dalam wadah yang baru dengan medium yang
baru untuk mendukung pertumbuhannya kembali, istilah ini disebut subkultur
(passage ). ell lines adalah sel yang berasal dari kultur primer yang telah
dibiakkan secara berkala, ditumbuhkembangkan, dipelihara, dan disimpan dalam
nitrogen cair. ell lines yang telah disubkultur umumnya mempunyai fraksi
pertumbuhan yang cukup tinggi (lebih dari 80%). Salah satu keistimewaan dari
ell lines ini adalah bersifat abadi (immortal ), sel ini masih dapat hidup dalam
kondisi media seminimal mungkin. ell line tertentu dapat mengalami
transformasi sehingga dapat berkembang secara immortal seperti sel tumor, ini disebut continous cell line ontinous cell line yang diklon dan dikarakterisasi
akan menurunkancontinous cell strain (Freshnay, 2005).
Ada dua jenis kultur galur sel kanker yaitu kultur yang melekat
membentuk selapis (monolayer) di atas substrat padat, atau sebagai suspensi di
media kultur. Kedua jenis sel ini mempunyai sifat yang berbeda, dimana sel
suspensi tidak memerlukan bahan pembantu untuk menempel, sebaliknya sel
selapis memerlukan bahan pembantu. Sel suspensi biasanya dari hemopoetik, sel
darah atau sel dari tumor malignant, sedangkan sel monolayer biasanya untuk
sel-sel yang berasal dari jaringan (Freshnay, 2005).
Kultur galur sel kanker yang berasal dari manusia, seperti kultur sel Raji
s leukemia ) merupakan jenis sel suspensi, sel HeLa (epithel carcinoma cervix), dan sel HCT 116 (kanker kolon) merupakan jenis sel selapis (jaringan),
dapat digunakan untuk menguji kemampuan bioaktivitas suatu senyawa sebagai
anti kanker terhadap galur-galur sel kanker tersebut. Galur sel dapat dibentuk dari
kultur sel langsung (primer) yang kemudian dikultur kembali (subkultur). Sel
yang dikultur ini dipelihara terus-menerus sampai immortal (tidak bisa mati). Pembentukan sub kultur dapat menghasilkan sel-sel yang homogen dan tidak
memiliki sifat-sifat diferensiasi. Menurut Freshney (2005) galur sel yang
dihasilkan dari kultur sel primer akan mengalami perubahan antara lain :
morfologi (sel lebih kecil, lebih bulat, kurang erat melekat, perbandingan inti dan
tumbuh menjadi lebih pendek, ketergantungan terhadap serum berkurang, dan
mampu berproliferasi. Berikut ini beberapa deskripsi dari galur sel lestari yang
digunakan dalam berbagai penelitian yang berasal dari erican type cell cultu re
(ATCC), dan diperoleh dariemell ancer nstitute Jakarta :
a). Sel Raji (ATCC CCL 86)
Sel Raji adalah sel yang berasal dari kultur cell line lymphoblastoid yang diturunkan dari lymphoma ! "itt , namun memiliki kerusakan pada down stream
kaspase-3 yang menyebabkan sel tersebut tidak menunjukkan gambaran
fragmentasi DNA. Burkitt merupakan sejenis kanker yang terdapat pada sistem
limpa khususnya pada limfosit B. Sel raji telah ditemukan sejak tahun 1963 yang
diperoleh dari rahang kiri anak lelaki dari Afrika yang saat itu mempunyai
ietic cell line . Selanjutnya, sel limfoma ini sangat diperlukan untuk penelitian haemotological limfoma, dan leukemia. Sel Raji ini memiliki banyak reseptor untuk beberapa komponen komplemen dan cocok digunakan untuk
mendeteksi kompleks imun. Sel ini mengekspresikan beberapa reseptor
komplemen tertentu serta reseptor untuk Fc imunogloblin G. Sel Raji dikultur
pada media RPMI 1640 dengan 2mM L-glutamin dan dipanen saat mencapai fase
log (http://www.abcam.com/Raji-cell-line-ab30127.html)
b). Sel MT2 (NIH AIDS Reagent Repository)
Sel MT2 (T-limfoma) adalah sel T manusia yang diisolasi dari stem cell
menyerupai epithelial. Sel HeLa secara morfologi merupakan sel epitelial yang
F. Antikanker Pada Siklus Sel
Siklus sel adalah suatu proses pertumbuhan sel yang teratur untuk
berduplikasi (menggandakan diri) dan menurunkan informasi genetik dari satu
generasi sel ke generasi sel yang berikutnya. Selama proses ini berjalan, DNA
harus digandakan secara tepat dan salinan kromosom harus dibagikan tepat sama
jumlah pada kedua sel anak yang terbentuk. Bagian yang penting dari siklus sel
adalah enzimcyclin -dependent kinases(Cdk). Ketika Cdk ini diaktifkan maka sel berpindah fase dari satu fase ke berikutnya dalam siklus sel (G1 ke S atau G2 ke
M) (Schwartz 2005). Siklus sel normal dikendalikan oleh protein siklin, protein
siklin ini adalah kinase yang bekerja mengkatalisis transfer gugus fosfat dari ATP
kepada protein target. Aktivasi kebalikannya atau defosforilasi merupakan
mekanisme umum untuk mengatur aktivitas protein. Mekanisme inilah yang
digunakan berulang kali untuk mengatur siklus sel (Becker et al. 2000). Cdk dalam siklus sel berperan penting dalam mengontrol siklus sel. Perubahan dalam
pengontrolan terhadap proses siklus sel ditemukan pada mayoritas kanker ganas,
oleh karena itu Cdk menjadi target yang menjanjikan untuk terapi anti kanker
(Pennati, 2005).
Ketika sel distimulasi untuk tumbuh, mereka meninggalkan keadaan
diamnya (resting state) dan memasuki satu fase siklus sel yang disebut fase G1 (fase sintesis komponen seluler). Sel berada dalam fase ini kurang lebih 8 jam.
Setelah itu, sel memasuki fase S (fase sintesis DNA), di dalam fase ini replikasi
DNA dimulai dan terus berlangsung sampai terbentuk dua DNA baru. Sintesis
DNA berlangsung lebuh kurang 6 jam. Fase selanjutnya adalah fase G2 yang
berlansung selama 4-5 jam. Fase ini merupakan fase persiapan sebelum sel
membelah. Periode pembelahan disebut fase M atau mitosis, yang berlangsung
selama 1-5 jam dan menghasilkan dua sel baru. Sel-sel kanker pada umumnya
tumbuh secara eksponensial lebih cepat dari sel normal (Slingerland dan Tannock,
1998).
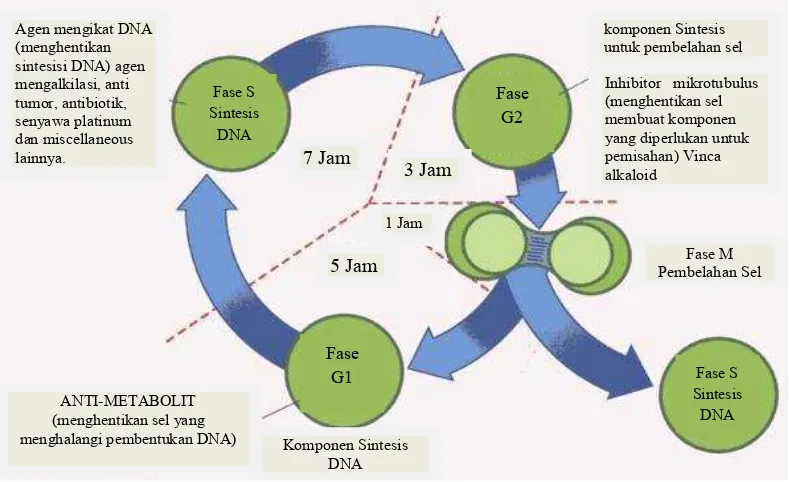
Obat-obat antikanker yang berperan sebagai antipertumbuhan dibagi
menjadi beberapa kelompok berdasarkan targetnya, yaitu : Obat-obat antikanker
yang mempengaruhi siklus sel spesifik, kerja dari obat golongan ini hanya
membunuh atau menghambat terjadinya siklus sel tertentu dan pada fase tertentu
saja. Obat-obat yang termausk golongan ini adalah: antimetabolit, alkaloid, dan
m iscella n eo u
s agents , 2) Sitostatika yang mempengaruhi siklus sel non-spesifik. Obat golongan ini tidak hanya bekerja pada satu fase saja. Kerjanya adalah
membunuh sel yang terlibat dalam siklus sel juga sel-sel di luar siklus sel dengan
cara mengikat DNA dan merusaknya. Obat yang termasuk golongan ini adalah :
a lkila tin g
agents , antibiotik. Tahapan kerja obat antikanker pada siklus sel ditampilkan pada gambar 5 berikut :
Gambar 5. Mekanisme kerja obat antikanker pada siklus sel (http://habib.blog.ugm.ac.id/files/2010/05/8)
Kanker berasal dari kata carcinos (Yunani), cancer (Inggris) atau kanker
(Belanda). Jaringan kanker atau neoplasma adalah suatu gangguan pertumbuhan
dengan karakteristik sel yang berlebihan, abnormal dan merupakan proliferasi
yang tidak terkontrol dari jaringan yang mengalami transformasi atau perubahan
pada satu atau lebih tempat utama dalam tubuh inang dan umumnya disertai
dengan metastasis atau penyebaran pada bagian lain tubuh inang (Priosoeryanto,
Kanker merupakan penyakit sel yang dicirikan dengan perubahan
mekanisme yang mengatur proliferasi (pembelahan) dan diferensiasi sel, sehingga
sel tersebut mengalami kelainan kromosom (mutasi) yang menyebabkan siklus sel
berlangsung terus menerus (sel terus berproliferasi namun tidak berdiferensiasi).
Kanker merupakan penyakit yang berawal dari kerusakan materi genetika atau
DNA sel. Satu sel yang mengalami kerusakan genetika sudah cukup untuk
menghasilkan jaringan kanker atau neoplasma, sehingga kanker disebut juga
penyakit seluler. Perubahan pada materi genetika atau disebut juga mutasi gen
dapat terjadi melalui berbagai mekanisme. Pertama disebabkan oleh kesalahan
replikasi yang terjadi pada saat sel-sel yang aus digantikan oleh sel-sel baru. Pada
saat pergantian satu sel, terjadi kopi DNA baru yang melibatkan 6 x 109pasangan
basa, yang memberikan peluang kesalahan replikasi. Penyebab kedua adalah
mutasi pada galur sel yang mengalami kesalahan genetika yang diturunkan dari
gen orang tua, sehingga menghasilkan gen yang termutasi. Mekanisme kerusakan
materi genetika sel yang ketiga disebabkan oleh adanya faktor dari luar, atau
faktor eksternal yang dapat mengubah struktur DNA, yaitu virus, infeksi
berkelanjutan, polusi udara, radiasi dan bahan-bahan kimia asing yang tidak
diperlukan oleh tubuh (Zakaria, 2001). Beberapa karsinogen kimia, radiasi, virus
dan hormon menginduksi terjadinya kanker, karena faktor-faktor tersebut dapat
menyebabkan perubahan struktur DNA atau mutasi gen yang dapat menghasilkan
sel kanker (Dalimartha, 1999)
Kanker dapat terjadi karena mutasi pada gen spesifik molekul DNA yang
disebut sebagai onkogen. Onkogen terdiri atas dua kelompok yaitu gen yang
mengontrol pertumbuhan dan gen yang menekan pertumbuhan tumor. Kelompok
yang pertama bekerja untuk mengontrol pembelahan sel (perkembangan sel), yang
kedua mempunyai kemampuan untuk menghentikan sel-sel kanker. Kanker terjadi
ketika kedua jenis gen di atas mengalami mutasi dan tidak berfungsi dengan benar
(Michael dan Doherty, 2005). Mekanisme yang mengatur pertumbuhan,
diferensial dan kematian sel adalah fosforilasi protein. Proses fosforilasi protein
diatur oleh golongan enzim kinase. Mutasi pada kinase yang disandikan dalam
Kinase dan fosfatase merupakan menjadi senyawa yang penting pada jalur
metabolisme. Perubahan aktivitas enzim kinase yang tidak terkontrol berperan
penting pada terbentuknya tumor (Michael dan Doherty, 2005).
Setiap sel tumor dilengkapi dangan molekul permukaan yang aktif,
berfungsi antara lain sebagai reseptor berbagai ligan, misalnya reseptor faktor
pertumbuhan, reseptor sitokin, dan molekul adhesi sel (Zeromski, 2002). Hasil
interaksi logam dan reseptor tersebut menghasilkan perubahan pada pertumbuhan
sel tumor dan penyebarannya. Reseptor ini bertindak sebagai komponen kimia
yang diketahui sebagai faktor pertumbuhan dan keberadaannya menyebabkan
pembelahan sel. Gen yang termutasi akan menghasilkan banyak reseptor-reseptor
dan membran sel yang menyebabkan faktor pertumbuhan semakin banyak,kondisi
tersebut dapat menyebabkan terjadinya pembelahan sel lebih cepat (Zeromski
2002).
Menurut Miller (2011), tahap-tahap penting pembentukan sel kanker
adalah : a) inisiasi, yaitu terjadinya perubahan pada DNA atau mutasi gen yang di
sebabkan oleh berbagai faktor, b) promosi yang meliputi perkembangan sel dan
perubahan menjadi sel tumor premalignant, c) progresi dan invasi (penyusupan
kejaringan sekitar), d) metastasis yaitu penyebaran melalui pembulu darah dan
pembulu getah bening. Tahap penyebaran sel kanker dimulai ketika sel-sel
individu dari lokasi asal memisah dan memasuki aliran darah untuk menemukan
tempat baru untuk berkembang di dalam tubuh.
Zeromski (2002) mengemukakan bahwa pertumbuhan yang malignant
ditentukan oleh enam perubahan dalam fisiologi sel yang perkembangannya
menghasilkan perubahan genotip sel, antara lain: a) sel kekurangan sinyal-sinyal
untuk mengontrol pertumbuhan, b) sel tidak sensitif terhadap sinyal-sinyal
penghambatan pertumbuhan, c) sel menghindari program kematian sel
(apoptosis), d) potensi replikasi yang tidak terbatas, e) angiogenesis yang
berkesinambingan, dan f) invasi jaringan dan metastasis.
Pada sel normal, sel hanya akan membelah diri bila tubuh
membutuhkannya, seperti mengganti sel-sel yang rusak atau mati. Sebaliknya sel