FRAKSI AKTIF EKSTRAK DAU
Prain SEBAGAI PE GHAMBAT
PERTUMBUHA SEL LESTARI HeLa
URLAILA
DEPARTEME KIMIA
FAKULTAS MATEMATIKA DA ILMU PE GETAHUA ALAM
I STITUT PERTA IA BOGOR
ABSTRAK
NURLAILA
.
Fraksi Aktif Ekstrak Daun
Sansevieria trifasciata
Prain
Sebagai
Penghambat Pertumbuhan Sel Lestari HeLa. Dibimbing oleh
DONDIN SAJUTHI
dan
IRMA HERAWATI SUPARTO.
Lidah mertua
(
Sansevieria trifasciata
Prain) merupakan tanaman hias yang
juga bermanfaat sebagai antibakteri dan antioksidan. Penelitian tentang tumbuhan
ini sebagai antikanker belum pernah dilaporkan. Oleh karena itu, tujuan penelitian
ini adalah mengisolasi senyawa bioaktif dari daun lidah mertua yang dapat
menghambat pertumbuhan sel lestari HeLa secara
in vitro
. Teknik ekstraksi yang
digunakan ialah maserasi dalam metanol 96% lalu maserat dipekatkan
menggunakan penguap putar. Ekstrak kasar yang diperoleh kemudian difraksinasi
menggunakan kromatografi kolom dengan fase diam silika gel dan fase gerak
kloroform0etil asetat secara bergradien. Uji fitokimia dan uji penghambatan
pertumbuhan sel lestari HeLa dengan metode MTT (30(4,50dimetiltiazol020il)02,50
difeniltetrazolium bromida) dilakukan terhadap ekstrak kasar dan hasil fraksinasi
pada konsentrasi 200010000 ppm. Hasil uji fitokimia ekstrak kasar positif
menunjukkan flavonoid, alkaloid, dan steroid, akan tetapi ekstrak kasar tersebut
tidak dapat menghambat pertumbuhan sel. Dari hasil fraksinasi kromatografi
diperoleh 10 fraksi dan hanya 1 fraksi teraktif dengan nilai inhibisinya sebesar
87,52% pada konsentrasi 10000 ppm. Golongan senyawa yang terdapat dalam
fraksi tersebut ialah flavonoid dan alkaloid.
ABSTRACT
NURLAILA. Active Fraction in Extract of
Sansevieria trifasciata
Prain Leaves as
Proliferation Inhibitor of HeLa Cell Line. Supervised by of DONDIN SAJUTHI
and IRMA HERAWATI SUPARTO.
Sansevieria trifasciata
Prain
is an ornamental plant which is also useful as a
source of antibacterial and antioxidant agent. Studies of
S. trifasciata
Prain as
anticancer have not been reported. Therefore, the objective of this study is to
isolate bioactive compounds of
S. trifasciata
Prain leaves that shows
in vitro
FRAKSI AKTIF EKSTRAK DAU
Prain SEBAGAI PE GHAMBAT
PERTUMBUHA SEL LESTARI HeLa
URLAILA
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Kimia
DEPARTEME KIMIA
FAKULTAS MATEMATIKA DA ILMU PE GETAHUA ALAM
I STITUT PERTA IA BOGOR
Judul
: Fraksi Aktif Ekstrak Daun
Sansevieria trifasciata
Prain Sebagai
Penghambat Pertumbuhan Sel Lestari HeLa
Nama
: Nurlaila
NIM
: G44060817
Menyetujui
Pembimbing I,
Pembimbing II,
Prof. drh. Dondin Sajuthi, MST, PhD
NIP 19541027 197603 1 001
Dr. dr. Irma H. Suparto, MS
NIP 19581123 198603 2 002
Mengetahui
Ketua Departemen,
Prof. Dr. Ir. Tun Tedja Irawadi, MS
NIP 19501227 197603 2002
PRAKATA
Segala puji bagi Allah SWT yang telah melimpahkan segala rahmat0Nya,
sehingga penulis mampu menyelesaikan karya ilmiah ini yang dilaksanakan sejak
bulan Februari hingga Oktober 2010 di Laboratorium Kimia Anorganik
Departemen Kimia dan Pusat Studi Satwa Primata Institut Pertanian Bogor (IPB).
Judul karya ilmiah ini adalah “ Fraksi Aktif Daun
Sanseviria trifasciata
Prain
Sebagai Penghambat Pertumbuhan Sel Lestari HeLa”
Selama penelitian sampai penulisan karya ilmiah ini, penulis mendapatkan
banyak bimbingan dan dorongan dari berbagai pihak. Oleh karena itu, penulis
ingin mengucapkan terima kasih kepada Prof. drh. Dondin Sajuthi, MST, PhD.
dan Dr. dr. Irma H. Suparto, MS.
selaku pembimbing penelitian ini. Ungkapan
terima kasih juga disampaikan kepada kedua orang tua, keluarga, seluruh staf
laboratorium Kimia Anorganik dan Pusat Studi Satwa Primata IPB khususnya kak
Willy Praira, serta teman0teman seperjuangan angkatan 43 (Gita, Rania, Agnes,
Chandra, Atha, Irma, Nisa, Shaq, Indri, Erica, dan Nonop) yang selalu
memberikan dorongan dan doa. Terima kasih atas bantuan dan semangat yang
diberikan, semoga mendapat balasan pahala dari Allah SWT.
Semoga laporan ini bermanfaat.
Bogor, Oktober 2011
urlaila
RIWAYAT HIDUP
Penulis dilahirkan di Garut pada tanggal 26 Mei 1988 dari pasangan Abubakar
Kahar dan Zahra Azis. Penulis merupakan anak kedua dari tiga bersaudara.
DAFTAR ISI
Halaman
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... viii
PENDAHULUAN ... 1
TINJAUAN PUSTAKA
Sansevieria trifasciata
Prain ... 1
Kanker ... 2
Antikanker ... 2
Ekstraksi dan Fraksinasi Senyawa Metabolit Sekunder ... 3
MTT (30(4,50Dimetiltiazol020yl)02,50difeniltetrazolium bromida) ... 3
BAHAN DAN METODE
Bahan dan Alat ... 4
Lingkup Kerja ... 4
HASIL DAN PEMBAHASAN
Kadar Air ... 5
Ekstraksi ... 6
Uji Fitokimia ... 6
Uji Penghambatan Proliferasi Sel Lestari HeLa oleh Ekstrak Kasar ... 6
Fraksinasi ... 7
Uji Penghambatan Proliferasi Sel Lestari HeLa oleh Fraksi Daun ... 8
SIMPULAN DAN SARAN
Simpulan ... 8
Saran ... 9
DAFTAR PUSTAKA ... 9
DAFTAR TABEL
Halaman
1 Uji fitokimia ekstrak kasar daun
S. trifasciata
Prain ... 6
2 Rendemen fraksi hasil pemisahan dengan kromatografi kolom ... 7
DAFTAR GAMBAR
Halaman
1
S. trifasciata
Prain ... 2
2 Eksperimen dasar dari kromatografi kolom ... 3
3 Kromatografi lapis tipis (KLT) ... 3
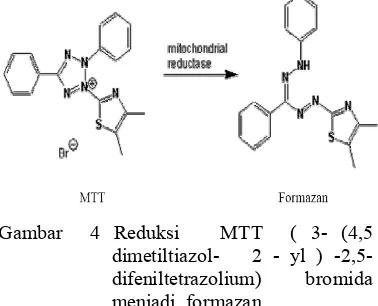
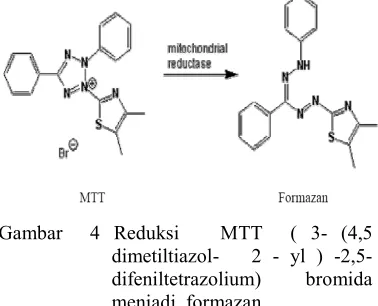
4 Reduksi MTT menjadi formazan ... 3
5 Profil KLT eluen terbaik. ... 7
6 Inhibisi proliferasi sel lestari HeLa dari fraksi 2 pada berbagai konsentrasi 8
DAFTAR LAMPIRA
Halaman
1 Diagram alir penelitian ... 12
2 Rendemen fraksi daun
S. trifasciata
Prain ... 13
3 Pola KLT hasil fraksinasi ekstrak
S. trifasciata
Prain ... 14
4 Hasil ui penghambatan fraksi daun
S. trifasciata
Prain ... 15
PE DAHULUA
Kanker atau tumor ganas merupakan penyakit paling mematikan di dunia setelah jantung koroner. Lebih dari 10 juta orang didiagnosa mengidap penyakit kanker tiap tahunnya, bahkan penyakit ini menyebabkan kematian hingga 12% per tahun dari populasi dunia (WHO 2004). Salah satu kanker yang banyak meyebabkan kematian di seluruh dunia, yaitu kanker serviks (mulut rahim). Kanker ini merupakan kanker nomor dua yang paling sering menyerang wanita di seluruh dunia. Tiap tahunnya sekitar seperempat juta wanita meninggal karena penyakit ini (Simajuntak 2008)
Teknik pengobatan kanker yang saat ini berkembang di antaranya adalah radioterapi, kemoterapi, immunoterapi, gen terapi, dan pembedahan. Meskipun saat ini pengobatan tersebut merupakan pengobatan utama kanker, tetapi terapi ini membutuhkan biaya yang sangat mahal dan timbul efek samping dalam pengobatan, seperti mual, pusing, diare, penurunan sel darah putih, terjadinya malnutrisi, dan kebotakan. Hal ini menyebabkan banyak penderita kanker cenderung mencari alternatif pengobatan lain, yaitu dengan penggunaan tanaman obat. Penggunaan tanaman obat untuk kanker meningkat karena murah dan dianggap efek sampingnya rendah. Oleh karena itu, perlu dilakukan pengkajian potensi antikanker dari tanaman0tanaman yang diketahui berpotensi dalam mengobati kanker. Salah satu tanaman obat yang memiliki potensi antikanker, yaitu tanaman lidah mertua.
Lidah mertua (Sansevieria sp) merupakan jenis tanaman yang telah lama dikenal oleh banyak orang dan mulai dibudidayakan sebagai tanaman hias mulai abad ke019. Selain bermanfaat sebagai tanaman hias, lidah mertua juga dapat digunakan sebagai bahan baku tekstil dengan cara diambil seratnya, yang banyak digunakan di Cina dan New Zealand (Purwanto 2006). Di Afrika, getah dari tanaman tersebut dapat digunakan sebagai antiracun ular dan serangga.
Beberapa penelitian telah dilakukan untuk menggali potensi tanaman ini. Menurut Afolayan et al. (2008). S. hyacinthoides
mengandung senyawa fenol, proantosianidin, dan flavonoid yang berpotensi terhadap antibakteri dan antioksidan. Adanya zat0zat alami pada daun lidah metua yang bekerja sebagai antioksidan, diharapkan dapat menaggulangi perkembangan sel kanker. Daun S. ehrenbergii mengandung saponin
yang dapat menghambat pertumbuhan sel kanker (Pettit et al. 2005). Meskipun lidah mertua berpotensi untuk dijadikan sebagai antikanker, tetapi pemanfaatannya masih sangat terbatas sebagai tanaman hias dan belum terdapat penelitian terhadap S. trifasciata Prain sebagai antikanker.
Penelitian ini bertujuan untuk mengisolasi senyawa bioaktif dari daun S. trifasciata Prain yang dapat menghambat pertumbuhan sel lestari HeLa secara in vitro. Hasil penelitian ini diharapkan dapat memberikan informasi bahwa fraksi aktif dari ekstrak metanol daun
S. trifasciata Prain dapat menghambat aktivitas pertumbuhan sel lestari HeLa.
TI JAUA PUSTAKA
Prain
Century plant, lucky plant, mother in law’s tongue (lidah mertua) atau snake plant
(tanaman ular) merupakan nama lain dari tanaman Sansevieria. Tanaman ini sangat dikenal sebagai obat tradisional yang secara empiris digunakan untuk mengobati berbagai penyakit. S. trifasciata Prain termasuk dalam divisi Mognoliophyta, kelas Liliopsida, ordo Liliales, famili Agavaceae, genus Sansevieria, dan spesies S. trifasciata Prain.
Daerah tropis kering dan mempunyai iklim gurun yang panas atau pegunungan yang curah hujannya rendah merupakan habitat asli Sansevieria, sehingga Sansevieria termasuk golongan tanaman daerah kering (zerophytic) (Purwanto 2006). Akan tetapi di negara yang memiliki empat musim pun tanaman ini dapat bertahan hidup, sehingga banyak mengalami penyimpangan bentuk, corak, dan warna. Secara morfologinya Sansevieria berakar serabut, batang berada di dalam tanah, pendek, dan beruas. Batang inilah yang kadang disebut sebagai rhizome atau rimpang. Daunnya berbentuk pipih, bagian ujungnya meruncing, lebar 409 cm dan panjang 150150 cm dengan warna hijau bernoda putih atau kuning dengan tekstur rata dan halus (Gambar 1). Lingga (2005) menyatakan bahwa mahkota bunga jantan dan betina Sansevieria berwarna putih kekuningan. Bunganya bertipe malai dan menurut Purwanto (2006) bunga Sansevieria termasuk bunga uniseksual.
rimpang S. trifasciata yang telah dilaporkan adalah vitamin C, tanin, glukogalin, asam galat, asam elegat, korilagin, terchebin, chebulagic acid, chebulinic acid, 3,60 digaloilglukosa, mucid acid, phylembic acid, dan emblikol (Hariana 2007). Selain itu, dalam uji fitokimia yang dilakukan oleh Yoshihiro et al. tanaman ini mengandung karbohidrat, saponin, glikosida (1996), dan steroid (1997).
Gambar 1 Sansevieria trifasciata Prain
Kanker
Kanker adalah suatu penyakit sel dengan ciri0ciri kegagalan mekanisme pengatur multiplikasi dan fungsi homeostatis lain pada organisme multiseluler. Sel0sel kanker akan terus membelah diri, terlepas dari pengendalian pertumbuhan dan tidak menuruti hukum0hukum pembiakan. Sel kanker akan terus berkembang tumbuh menyusup ke jaringan sekitarnya (invasif), lalu membuat anak sebar (metastasis) ke tempat yang lebih jauh melalui pembuluh darah dan pembuluh getah bening. Sel kanker tersebut akan timbul menjadi kanker baru di tempat lain sampai akhirnya menyebabkan kematian penderitanya (Nafrialdi & Gan 2000).
Ada beberapa jenis kanker seperti karsinoma, sarkoma, leukemia, dan limfoma. Karsinoma, yaitu kanker yang tumbuh dari sel epitel. Sarkoma, yaitu kanker yang tumbuh dari jaringan penunjang tubuh. Leukemia, yaitu kanker yang tumbuh pada jaringan yang menghasilkan darah. Limfoma, yaitu kanker yang tumbuh pada daerah limfa. Penyebab kanker belum diketahui dengan pasti, akan tetapi ada bahan0bahan yang diduga dapat menjadi penyebab kanker, yaitu senyawa kimia, faktor fisika, virus, dan hormon. Buah dan sayur, terutama yang banyak mengandung
serat, dapat menurunkan resiko kanker terutama pada saluran pencernaan (Greenwald 1991).
Antikanker
Antikanker adalah agen yang memiliki sifat sitostatik (dapat menghambat pertumbuhan sel kanker) dan atau sitosidal (dapat mematikan sel kanker). Beberapa metabolit sekunder memiliki aktivitas sebagai agen antikanker. Oleh karena itu, akhir0akhir ini banyak dikembangkan penelitian untuk mencari senyawa metabolit sekunder yang memiliki bioaktivitas sebagai senyawa antikanker yang kemudian akan dikembangkan dalam kemometri untuk pengobatan kanker (Boik 1996).
Untuk pemeriksaan suatu senyawa agen antikanker dari tanaman obat, National Cancer Institute (NCI) Amerika Serikat pada tahun 1980, menentukan prosedur penapisan, yaitu preparasi, pra penapisan, penapisan, pemantauan, dan uji klinik. Preparasi yang dilakukan berupa pengumpulan tanaman dan ekstraksi. Uji pra penapisan dilakukan dengan uji in vitro atau in vivo secara sederhana untuk mengidentifikasi ekstrak yang berpotensi antikanker. Ekstrak yang aktif kemudian ditapis melawan sel yang lebih banyak secara
in vivo. Ekstrak yang berhasil ditapis akan dilakukan tahap pemantauan, yaitu difraksinasi untuk memperoleh senyawa aktif yang murni. Senyawa yang murni ini kemudian diuji secara in vivo. Senyawa yang berhasil menunjukkan aktivitas antikanker lalu dilakukan uji klinik. (Hartati & Hanafi 2001).
Ekstraksi dan Fraksinasi Senyawa
Metabolit Sekunder dari Tumbuhan
Ekstraksi senyawa aktif dari tanaman obat adalah suatu proses yang secara selektif mengambil zat terlarut yang terkandung dalam suatu campuran dengan bantuan pelarut. Metode ekstraksi yang digunakan pada penelitian ini, yaitu metode maserasi dengan menggunakan metanol sebagai larutan pengekstrak (Pittaya et al. 2003). Metode ekstraksi maserasi digunakan untuk mengekstrak suatu komponen kimia yang tidak tahan panas, kekurangan dari metode ini, yaitu diperlukan waktu yang lama dan banyak menggunakan larutan pengekstrak. Hal0hal yang perlu diperhatikan dalam pemilihan pelarut adalah selektivitas, kepolaran, sifat racun, dan kemudahan untuk diuapkan.
Fraksinasi adalah proses pemisahan komponen dalam suatu ekstrak menjadi kelompok0kelompok senyawa yang memiliki kemiripan karakteristik secara kimia (Houghton & Raman 1998). Kromatografi kolom merupakan teknik analisis, dalam penentuan jumlah komponen dalam suatu campuran senyawa, dan juga untuk pemisahan dan pemurnian komponen senyawa tertentu dari campurannya. Dalam pemisahan kromatografi kolom ini, suatu pelarut pengelusi dialirkan secara kontinu melalui kolom dan komponen demi komponen dari campuran yang pada akhirnya keluar dari kolom dapat dikumpulkan dan difraksinasi (Rouessac & Rouessac 1994).
Gambar 2 Eksperimen dasar kromatografi kolom (a) bahan yang dibutuhkan (C, kolom; SP, fase stasioner; MP, fase mobil; dan S, sampel); (b) sampel dimasukkan; (c) proses elusi dimulai; (d) hasil separasi diperoleh; (Rouessac & Rouessac 1994).
Kromatografi lapis tipis (KLT) merupakan jenis kromatografi partisi menggunakan sebuah lapis tipis silika atau alumina yang seragam pada sebuah lempeng gelas atau logam yang keras. Fase diam untuk kromatografi lapis tipis seringkali juga mengandung substansi yang dapat berpendar dalam sinar ultra violet. Fase gerak merupakan pelarut atau campuran pelarut yang sesuai (Furniss et al. 1989). Teknik kromatografi lapis tipis pergerakan zat relatif terhadap garis depan pelarut dalam sistem kromatografi tertentu dapat didefinisikan sebagai nilai Rf adalah perbandingan jarak tempuh zat dengan jarak tempuh garis depan pelarut.
(a) (b)
Gambar 3 Kromatografi lapis tipis, (a)
chamber, tempat pengembangan pelat KLT; (b) plat KLT dalam penentuan Rf (Furniss et al. 1989).
MTT (3/(4,5/Dimetiltiazol/2/yl)/2,5/
difeniltetrazolium bromida)
Senyawa MTT, merupakan suatu garam monotetrazolium yang digunakan untuk menilai poliferasi sel dengan cara menghitung jumlah sel.
MTT akan mengalami reaksi reduksi oleh enzim mitokondrial reduktase yang terdapat dalam mitokondria sel hidup yang bersifat aktif, sehingga menghasilkan biru0formazan (Gambar 4). Kadar dari fornazan ditetapkan secara spektrofotometrik dengan panjang gelombang 595 nm. Intensitas warna biru yang terbentuk berbanding lurus dengan jumlah sel yang aktif melakukan metabolisme (Wang et al. 2009).
BAHA DA METODE
Bahan dan Alat
Bahan0bahan yang digunakan dalam penelitian ini adalah S. trifasciata Prain yang diperoleh dari kebun percobaan kampus Lodaya IPB, sel lestari HeLa, DMEM (Dulbeco’s Minimum Essential Medium), penisilin sterptomisin, PBS (phosphate bovine serum), glass wool, dan silika gel G60F254.
Alat0alat yang digunakan dalam penelitian ini adalah lempeng KLT analitik G60F254, kolom kromatografi, sumuran (96 well plate), sentrifuse Flexpin merk Tomy dengan tipe LC.200, mikroskop (Nikon), hemositometer, inkubator, spektrofotometer microplate, lampu UV,dan alat0alat gelas.
Lingkup Kerja
Persiapan Sampel
Sampel yang digunakan adalah daun S. trifasciata Prain. Daun tersebut dicuci, dipotong0potong, lalu dikeringkan dalam oven selama 3×24 jam pada suhu 50°C. Diagram alir penelitian dapat dilihat pada Lampiran 1.
Penentuan Kadar Air (AOAC 2006)
Cawan porselin dikeringkan pada suhu 105ºC selama 30 menit lalu didinginkan dalam eksikator dan ditimbang. Sebanyak 1 g daun ditimbang dan dimasukkan ke dalam cawan yang telah diketahui bobotnya, kemudian dipanaskan di dalam oven bersuhu 105ºC selama 24 jam. Cawan didinginkan di dalam eksikator selama 30 menit dan bobotnya ditimbang. Pemanasan dan penimbangan diulang sampai didapat bobot tetap. Kadar air dihitung dengan rumus
Kadar air (%) = × 100% dengan
a adalah bobot sampel (g)
b adalah bobot sampel setelah dikeringkan (g)
Ekstraksi
Sebanyak 20 g sampel daun direndam dengan menggunakan 200 ml metanol 96%. Ekstraksi dilakukan dengan menggunakan alat pengocok pada suhu kamar selama 3×24 jam dan dilakukan penyaringan. Selanjutnya ekstrak metanol dipekatkan dengan menggunakan rotavapor pada suhu 40°C sehingga diperoleh ekstrak kasar yang bebas pelarut.
Rendemen ekstrak (%) = × 100% dengan
a adalah bobot ekstrak (g) b adalah bobot sampel kering (g) ka adalah kadar air
Uji Fitokimia (Harborne 1987)
Saponin, Tanin. Sebanyak 0,1 g ekstrak dilarutkan dengan 10 ml akuadestilata kemudian didihkan selama 5 menit. Campuran disaring dan filtrat dibagi ke dalam dua tabung reaksi. Bagian pertama, uji saponin, filtrat didiamkan sampai agak dingin dan kemudian dikocok kuat sampai timbul busa. Bila busa stabil dalam 10 menit, maka filtrat positif mengandung saponin. Bagian kedua, uji tanin, filtrat ditambahkan FeCl3 1%, bila dihasilkan warna hijau, biru, atau hitam maka filtrat positif mengandung tanin.
Steroid/ Triterpenoid. Sebanyak 0,1 g ekstrak dilarutkan dengan 25 ml etanol panas (50ºC), kemudian disaring ke dalam pinggan porselen dan diuapkan sampai kering. Residu dilarutkan dalam eter dan dipindahkan ke dalam tabung reaksi lalu ditambahkan Lieberman0Burchard (3 tetes anhidrida asam asetat dan 1 tetes H2SO4 pekat). Terbentuknya warna merah atau ungu menunjukkan adanya kandungan triterpenoid, sedangkan jika terbentuk warna hijau atau biru menunjukan adanya steroid.
Flavonoid. Sebanyak 0,1 g ekstrak ditambahkan 10 ml air panas lalu dipanaskan selama 5 menit dan disaring. Sebanyak 5 ml filtrat ditambahkan 0,05 g serbuk Mg dan 1 ml HCl pekat dan 1 ml amil alohol kemudian dikocok. Adanya flavonoid ditunjukkan dengan terbentuknya warna merah/ jingga/kuning pada lapisan amil alkohol.
Pemilihan Eluen Terbaik
Pelat KLT yang digunakan adalah pelat alumunium jenis silika gel G60F254. Ekstrak pekat teraktif dari sampel ditotolkan pada pelat KLT. Setelah kering langsung dielusi dalam ruang elusi yang telah dijenuhkan oleh uap eluen pengembang. Eluen yang digunakan, yaitu kloroform:etil aseatat (9:1, 6:1, 3:1, 2:1, 1:1, 1:9, 1:6, 1:3, 1:2). Noda hasil elusi diamati di bawah lampu UV pada panjang gelombang 254 dan 366 nm.
Fraksinasi
Ekstrak metanol sampel daun dilarutkan dalam kloroform dan kemudian dipisahkan komponen0komponennya menggunakan kromatografi kolom. Kromatografi ini menggunakan elusi dengan eluen kloroform:etil asetat yang semakin meningkat kepolarannya (10:0, 9:1, 6:1, 3:1, 2:1, 1:1, 1:9, 1:6, 1:3, 1:2, dan 0:10). Sebanyak 5 ml eluat ditampung dalam tiap tabung reaksi yang telah diberi nomor, kemudian diuji dengan KLT. Eluat yang memiliki Rf dan pola KLT yang sama digabungkan sebagai satu fraksi kemudian diuji kembali aktivitas antikankernya untuk mendapatkan fraksi yang paling aktif.
Kultur Sel Lestari
Sel lestari yang telah tumbuh menjadi
monolayer (berlapis satu) diremajakan kembali dengan membuang medianya. Selanjutnya ditambahkan PBS 5 ml untuk membersihkan botol kultur dari sisa media. Sebanyak 2,5 ml tripsin ditambahkan ke dalam botol kultur, lalu diinkubasi pada 37ºC selama 5 menit. Sel yang telah lepas ditambahkan DMEM 5 ml lalu dimasukkan ke dalam tabung sentrifus 15 ml, kemudian disentrifus selama 5 menit, 700 g, dan supernatan dibuang. Sebanyak 3 ml DMEM ditambahkan pada tabung sentrifus tersebut lalu 50 µl larutan diambil dan ditambahkan dengan 50 µl tripan biru. Viabilitas sel dihitung dengan hemositometer. Sel yang hidup tidak berwarna, sedangkan sel yang mati akan berwarna biru.
Uji Penghambatan Pertumbuhan
Sel Lestari HeLa
Sel ditumbuhkan menggunakan pelat biakan 96 sumur sebanyak 100 µl/sumur dengan jumlah 3×105 sel/sumur diinkubasi pada 37ºC selama 24 jam. Media kultur yang mengandung sampel dibuang, setelah itu ditambahkan sampel uji sebanyak 100 µl/sumur dengan tiga kali pengulangan. Sampel yang diujikan, yaitu ekstrak S. trifasciata Prain dengan konsentrasi 200, 400, 600, 800, 1000, 1500, 2000 ppm dan fraksi hasi kolom dengan konsentrasi 2500, 5000, 7500, dan 10000 ppm. Lalu diinkubasi kembali pada 37ºC selama 48 jam, setelah itu tambahkan reagen MTT sebanyak 10 µl/sumur dan inkubasi kembali pada suhu 37ºC selama 4 jam hingga terbentuk formazan berwarna biru ungu pada sel hidup. Ditambahkan HCl isopropanol 0,1 N sebanyak 100 µl/sumur kemudian digojog selama 10 menit dan dibaca serapannya dengan menggunakan spektrofotometer pada panjang gelombang 595 nm. Hasil uji berupa serapan kemudian dikonversikan dalam bentuk persen penghambatan dengan rumus: %penghambatan:
serapan kontrol0serapan sampel x 100% serapan kontrol
HASIL DA PEMBAHASA
Kadar Air
Sampel yang digunakan pada penelitian ini adalah daun S. trifasciata Prain. Penentuan kadar air dilakukan untuk mengetahui kandungan air yang terkandung di dalam sampel tersebut. Selain itu, juga dengan mengetahui kadar air suatu sampel dapat diperkirakan jumlah sampel yang dibutuhkan jika ingin mengekstrak sampel langsung dalam keadaan basah. Kadar air yang diperoleh dari daun segar sebesar 90,60%, sedangkan dari daun kering kadar airnya, yaitu 7,40% .
kelembaban, perlakuan terhadap sampel, dan besarnya penguapan. Kandungan air dihilangkan dengan pemanasan pada suhu 105ºC. Menurut Harjadi (1993), air yang terikat secara fisik dapat dihilangkan dengan pemanasan pada suhu 1000105ºC.
Ekstraksi
Metode ekstraksi yang digunakan adalah maserasi. Ekstraksi dilakukan menggunakan pelarut metanol 96% dengan nisbah antara sampel dan pelarutnya adalah sebesar 1:10. Ekstrak yang diperoleh selanjutnya dipekatkan dengan menggunakan rotavapor pada suhu 40ºC. Rendemen ekstrak kasar dengan pelarut metanol 96% sebesar 15,50%.
Metode maserasi meskipun memerlukan waktu yang lama dan membutuhkan banyak pelarut. Keuntungan teknik ini, yaitu sampel yang diekstrak dapat langsung dikerjakan dalam jumlah banyak dan dapat menjaga agar kandungan senyawa dalam sampel yang tidak tahan panas tidak rusak (Harborne 1987). Metanol 96% digunakan karena tidak hanya senyawa polar yang dapat terekstrak tetapi senyawa non polar juga dapat terekstrak. Semakin besar nisbah pelarut dibandingkan sampel maka kemampuan melarutkan sampel juga akan semakin lebih besar dan efektif.
Uji Fitokimia
Uji fitokimia merupakan uji yang dilakukan untuk mengetahui kandungan senyawa metabolit sekunder yang terdapat di dalam sampel. Hasil uji fitokimia dari ekstrak kasar daun S. trifasciata Prain (Tabel 1), menunjukkan positif terhadap golongan alkaloid, flavonoid, dan steroid.
Tabel 1 Uji fitokimia ekstrak kasar daun S. trifasciata Prain
Senyawa Hail Uji
Alkaloid + Flavonoid + Saponin 0 Tanin 0 Triterpenoid 0 Steroid +
Keterangan: (0): tidak terdeteksi; (+): terdeteksi
Hasil dari uji steroid yang dilakukan sesuai dengan hasil uji fitokimia yang telah dilaporkan oleh Yoshihiro et al. (1997) yang
menyatakan bahwa ekstrak daun S. trifasciata
positif adanya steroid. Perbedaan pada uji fitokimia terdapat pada uji flavonoid dan alkaloid. Uji flavonoid dan alkaloid yang dilaporkan sebelumnya memberikan hasil negatif, sedangkan uji fitokimia yang dilakukan pada penelitian ini menunjukkan hasil yang positif. Hal ini dapat disebabkan karena perbedaan pelarut yang digunakan, perbedaan habitat tanama, dan jumlah unsur hara yang terkandung dalam tanah (Ersam 2001).
Uji Penghambatan Proliferasi Sel
Lestari HeLa oleh Ekstrak Kasar
Uji aktivitas antikanker ekstrak kasar daun S. trifasciata Prain terhadap sel lestari HeLa dilakukan pada konsentrasi 200, 400, 600, 800, 1000, 1500, dan 2000 ppm. Konsentrasi yang digunakan dipilih berdasarkan uji antikanker yang telah dilakukan sebelumnya oleh Pettit et al. (2005) dengan menggunakan S. ehrenbergii, yaitu berkisar antara 250 hingga 1000 ppm. Oleh karena itu, dalam penelitian ini menggunakan konsentrasi di bawah dan di atas 1000ppm. Berdasarkan hasil yang diperoleh, nilai % penghambatan yang diperoleh ekstrak kasar daun S. trifasciata Prain dengan konsentrasi 200 sampai dengan 2000 ppm, yaitu 0%.
Penambahan MTT pada sumur uji menghasilkan warna biru tua yang menunjukkan terdapatnya aktivitas sel yang masih hidup. Sel yang hidup memilki enzim mitokondrial reduktase yang dapat mereduksi MTT menjadi kristal formazan berwarna biru, sehingga apabila diukur serapannya pada panjang gelombang 595 nm maka akan menunjukkan nilai yang cukup tinggi. Nilai absorbansi sebanding dengan jumlah sel yang hidup. Semakin tinggi nilai absorbansi berarti semakin banyak juga jumlah sel lestari HeLa yang hidup. Jadi dapat dikatakan bahwa ekstrak kasar daun S. trifasciata Prain tidak menghambat pertumbuhan sel lestari HeLa.
trifasciata Prain terhadap potensinya dalam penghambat proliferasi sel lestari HeLa.
Fraksinasi
Untuk meningkatkan kemurnian senyawa yang terekstrak oleh metanol, maka sebanyak 2,5010 g ekstrak etil asetat difraksinasi pada kolom. Fase diam yang digunakan adalah silika gel dan fase geraknya adalah kloroform dan etil asetat (eluen terbaik) secara gradien kepolaran. Hal ini bertujuan agar dengan peningkatan polaritas sistem eluen, semua komponen akan terbawa lebih cepat (Harvey 2000). Elusi diawali dengan pelarut kloroform, kemudian diikuti kloroform:etil asetat dengan perbandingan 9:1, 6:1, 3:1, 2:1, 1:1, 1:9, 1:6, 1:3, 1:2, dan diakhiri dengan pelarut etil asetat. Hasil pengoloman dimonitor dengan kromatografi lapis tipis (KLT) dengan fase gerak eluen terbaik kloroform:etil asetat (1:6). Pemisahan dengan KLT dan kolom didasarkan pada interaksi antara fase gerak, fase diam, dan analat.
Gambar 5 Profil KLT eluen terbaik kloroform:etil asetat (1:6).
Pergerakan suatu senyawa pada bidang adsorban tergantung pada kepolaran antara eluen dengan senyawa tersebut. Fraksinasi ini menggunakan adsorban silika gel. Sifat dari silika gel adalah polar sehingga silika gel akan mengikat senyawa yang bersifat polar juga. Hubungannya dengan eluen, yaitu senyawa yang polar akan cepat bergerak jika menggunakan pelarut yang polar begitu juga sebaliknya (Harvey 2000). Senyawa yang kurang polar akan keluar terlebih dahulu dari kolom dengan eluen kloroform dan dilanjutkan dengan senyawa semi polar dengan campuran kloroform:etil asetat dan terakhir senyawa polar dengan eluen etil asetat.
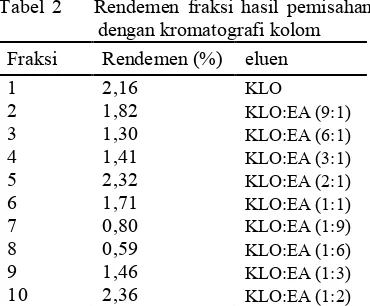
Spot yang terbentuk dapat dideteksi dengan sinar UV pada panjang gelombang 254 nm dan 366 nm. Pada panjang gelombang ini, adanya senyawa yang berfloresens jika disinari dengan sinar ultra lembayung sehingga spot akan terlihat. Eluen dalam tabung reaksi yang memiliki pola dan Rf yang sama dijadikan satu fraksi. Oleh karena itu, hasil fraksinasi ekstrak metanol daun S. trifasciata Prain diperoleh 10 fraksi (Lampiran 3). Setiap fraksi dikeringkan lalu bobotnya ditimbang dan dihitung rendemennya. Fraksi 5 memiliki rendemen yang paling besar, yaitu 2,32%, sedangkan fraksi 8 memilki rendemen yang paling rendah, yaitu 0,59% (Tabel 2).
Tabel 2 Rendemen fraksi hasil pemisahan dengan kromatografi kolom Fraksi Rendemen (%) eluen 1 2,16 KLO
2 1,82 KLO:EA (9:1)
3 1,30 KLO:EA (6:1)
4 1,41 KLO:EA (3:1)
5 2,32 KLO:EA (2:1)
6 1,71 KLO:EA (1:1)
7 0,80 KLO:EA (1:9)
8 0,59 KLO:EA (1:6)
9 1,46 KLO:EA (1:3)
10 2,36 KLO:EA (1:2)
Keterangan: KLO: Kloroform; EA: Etil Asetat
Uji Penghambatan Proliferasi Sel
Lestari HeLa oleh Fraksi Daun
Pengujian aktivitas antikanker dilakukan terhadap 10 fraksi hasil fraksinasi dengan konsentrasi yang digunakan, yaitu 2500, 5000, 7500, dan 10000 ppm. Konsentrasi yang digunakan dipilih di atas 2500 ppm karena pada uji ekstrak kasar, konsentrasi di bawah 2500 ppm tidak memberikan hasil yang positif terhadap daya hambat pertumbuhan sel HeLa sehingga diharapkan dengan bertambahnya konsentrasi akan memberikan hasil yang positif.
Metode MTT digunakan karena relatif cepat, sensitif, akurat, dapat digunakan untuk mengukur sampel dalam jumlah banyakr dan hasilnya bisa untuk memprediksi sifat sitotoksik suatu bahan (Freshney 2005). Metode ini juga mempunyai kelemahan, yaitu tidak dapat menggambarkan morfologi sel, sehingga apabila terdapat kelainan morfologi akan tetap dihitung sebagai sel hidup, walaupun perubahan morfologi dari suatu sel dapat dikategorikan sebagai akibat dari toksisitas suatu bahan (Doyle & Griffiths 2000).
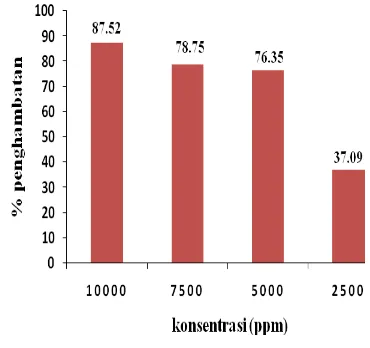
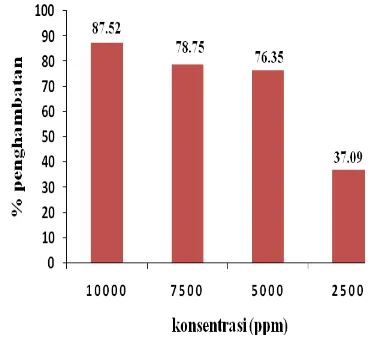
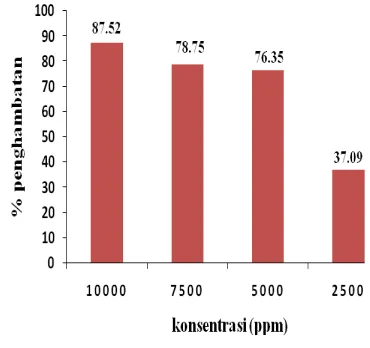
Hasil pengujian aktivitas antikanker (Lampiran 4) menunjukkan bahwa fraksi 1 sampai dengan fraksi 10 memiliki aktivitas dalam penghambatan antikanker. Fraksi yang merupakan fraksi teraktif adalah fraksi 2 karena memiliki nilai penghambatan yang paling besar, yaitu sebesar 87,52% pada konsentrasi 10000 ppm, dan dengan konsentrasi terendah pun fraksi 2 masih dapat menghambat pertumbuhan sel lestari HeLa, yaitu dengan persen penghambatannya sebesar 37,09% (Gambar 6). Hasil uji fitokimia yang dilakukan pada fraksi 2 memberikan hasil bahwa fraksi 2 mengandung senyawa flavonoid dan alkaloid dengan eluen untuk fraksinasi, yaitu kloroform: etil asetat (9:1).
Gabungan dari senyawa alkaloid dan flavonoid dalam satu fraksi memberikan hasil penghambatan yang cukup baik bila dibandingkan dengan keberadaan alkaloid sendiri. Hal ini dapat dilihat pada nilai % penghambatan yang diperoleh fraksi 1 yang mengandung steroid dan alkaloid, fraksi 3 sampai dengan 9 yang hanya memilki kandungan senyawa alkaloid saja. Nilai % penghambatan yang diperoleh fraksi0fraksi tersebut tidak melebihi nilai % penghambatan fraksi 2 dan fraksi 10 (Lampiran 4) yang mengandung senyawa alkaloid dan flavonoid. Keberadaan senyawa alkaloid dan flavonoid yang dimiliki oleh fraksi daun S. trifasciata
Prain diduga memiliki sifat yang sinergis apabila kedua senyawa tersebut berada dalam fraksi yang sama.
Hasil pengujian terhadap fraksi menunjukkan perbedaan dengan hasil uji ekstrak kasar. Hasil uji ekstrak kasar tidak menunjukkam adanya penghambatan terhadap sel lestari HeLa, sedangkan setelah fraksinasi hasil uji memberikan aktivitas penghambatan. Hal ini dapat dilihat dari persen penghambatan yang diperoleh. Perbedaan ini dapat disebabkan karena adanya perbedaan konsentrasi yang digunakan. Konsentrasi
maksimum ekstrak kasar adalah 2000 ppm sedangkan konsentrasi maksimum fraksi adalah 10000 ppm. Penambahan jumlah konsentrasi akan menambahkan jumlah senyawa sehingga dihasilkan penambahan daya hambat.
Efek farmakologi dari senyawa golongan alkaloid terhadap kanker telah dilaporkan, yaitu alkaloid vinkristin dan vinblastin dari tanaman Vinca yang menghentikan pembelahan sel pada tahap metaphase sehingga sel kanker dapat dihambat pertumbuhannya (Noogrady 1992). Berdasarkan hasil penelitian yang telah ada, senyawa flavonoid diketahui mampu menginduksi terjadinya apoptosis melalui beberapa mekanisme antara lain penghambatan aktivitas DNA topoisomerase I/II, modulasi signaling pathways, penurunan ekspresi gen Bcl02 dan Bcl0XL, peningkatan ekspresi gen Bax dan Bak serta aktivitas endonuklease (Ren et al. 2003).
Gambar 6 Inhibisi proliferasi sel lestari HeLa dari fraksi 2 pada berbagai konsentrasi
SIMPULA DA SARA
Simpulan
Ekstrak kasar metanol daun S. trifasciata
Saran
Perlu dilakukan pemisahan lebih lanjut pada fraksi 2 untuk mendapatkan senyawa lebih murni yang bersifat aktif. Selain itu perlu dilakukan penelitian lebih lanjut mengenai mekanisme penghambatan pertumbuhan sel kanker serta pengujian sitotoksik terhadap sel normal.
DAFTAR PUSTAKA
[AOAC]Association of Official Analytical Chemists. 2006. Official Methods of Analysis of AOAC International. 5th Revision. Volume 2. Cunnif P, editor. Maryland: AOAC International.
Afolayan AJ, Jimoh FO, Aliero AA. 2008. Antioxidant and antibacterial properties of Sansevieria hyacinthoides. IJPAS 2(3):103010.
Boik J. 1996. Cancer and atural Medicine: A Textbook of Basic Science and Clinical Research. New York: Oregon Medical Pr.
Doyle A, Griffiths B. 2000. Cell and tissue culture for medical research. New York: John Wiley and Sons Inc.
Ersam T. 2001. Senyawa kimia makromolekul beberapa tumbuhan Artocarpus hutan tropika Sumatra Barat [disertasi]. Bandung: Departemen Kimia FMIPA ITB, Institut Teknologi Bandung.
Freshney RI. 2005. Cultur of animal cell: A manual of basic techniques 5th ed. London:John Wiley and Sons Inc.
Furniss BS. et al. 1989. Vogel’s Textbook of Practical Organic Chemistry 4th. New York: John Wiley & Sons, Ltd.
Greenwald P. 1991. The Future of Nutrition Research in Cancer Prevention. Di dalam: Laidlaw SA, Swendseid ME, editor.
Vitamins and Cancer Prevention. Philadelphia: Wiley0Liss. hlm. 111–127.
Goodwi EC, DiMaio D. 2000. Repression of human papillomavirus oncogenes in Hela cervical carcinoma cells causes the orderly reactivation of dormant tumor suppressor pathways. Biochemistry 97(23).
Harborne JB. 1987. Metode Fitokimia: Penuntun Cara Modern Menganalisis Tumbuhan. Padmawinata, I Sudiro, penerjemah. Bandung: Institut Teknologi Bandung. Terjemahan dari: Phytochemical Method.
Hariana A. 2007. Tumbuhan Obat dan Khasiat. Jakarta: Penebar Swadaya.
Harjadi W. 1993. Ilmu Kimia Analitik Dasar. Jakarta: Gramedia.
Hartati S, Hanafi M. 2001. Reduksi esterifikasi dan uji aktifitas biologinya. Di dalam: Kimia dalam Industri dan Lingkungan. Jakarta:Pusat Penelitian Kimia Tanggerang. hlm:85404778.
Harvey D. 2000. Modern Analytical Chemistry. New York: The McGraw0Hill Companies, Inc.
Houghton J, Raman. 1998. Laboratory handbook for the Fractionation of atural Ekstract. London: Chapman & Hall.
Lingga L. 2005. Panduan Budi Daya Sansevieria. Depok: Agromedia Pustaka.
Nafrialdi, Gan S. 2000. Antikanker. Di dalam:
Farmakologi dan Terapi. Jakarta: Fakultas Kedokteran Universitas Indonesia. hlm. 686–701.
Noogrady T. 1992. Kimia Medisinal. Rasyid R, Musadad A, penerjemah; Niksolihin SM, editor. Bandung ITB Pr. Terjemahan dari: Medicinal Chemistry.
Pittaya T et al. 2007. Sulfur0containing compounds from Clinacanthus siamensis
[Abstrak]. Pharm Soc Jpn 51:1423–1425.
Pettit GR et al. 2005. Antineoplastic agents. 534. from the African Sansevieria ehrenbergii. J at Prod 68(5):729033.
Purwanto A. 2006. Sansevieria Flora Cantik Penyerap Racun. Yogyakarta: Kanisius.
Rouessac F, Rouessac A. 1994. Chemical Analysis Modren Instrumentation Methods and Techniques 2nd. USA: John Wiley & Sons, Ltd.
agents. Medicinal Research Reviews
23(4):5190534.
Restasari A et al. 2005. Isolasi dan identifikasi fraksi teraktif daun ketapang [skripsi]. Semarang: Departemen Kimia FMIPA UNDIP, Universitas Diponegoro.
Simanjuntak L. 2008. Kanker serviks. [terhubung berkala]. http://www. chem is try. org/ artikel_kimia/ berita/ antikanker dan kanker serviks/. [ 26 Jan 2010].
Wang Y, Hong C, Zhou C, Xu D, Qu H, Cheng Y. 2009. Screening antitumor compounds psoralen amd isopsoralen from
psorala corylifolia L. Seeds Departmnent of Chinese Medicine Science and Engineering, Collage of Pharmaceutical
Science, Zhejiang Univercsity, Hang zhou. China.
WHO. 2004. Cancer . [terhubung berkala].
http://www.who.int/cancer/. [25 Jan 2010].
Winarno FG. 1997. Kimia Pangan dan Gizi. Jakarta: Gramedia Pustaka Utama.
Yoshihiro M, Tomoshiro I, Minpei K, Yutaka S. 1996. Steroidal saponin from Sansevieria trifasciata.
Phytochemistry 43(6):1325–1331.
Yoshihiro M, Tomoshiro I, Minpei K, Yutaka S. 1997. Pregnane glycosides from Sansevieria trifasciata.
Lampiran 1 Diagram alir penelitian
0
Uji fitokimia
0 Uji antikanker
(200, 400, 600, 800,
1000, 1500, 2000 ppm)
Ekstrak metanol
Maserasi metanol
(3x24 jam)
Pemisahan
dengan KLT
F01
F02
F03
F04
F05
F0n
Uji antikanker
(10000,7500,500,2500 ppm)
Fraksi aktif
Daun
S. trifasciata
Prain
Uji fitokimia
Golongan senyawa
Lampiran 2 Rendemen fraksi daun
S. trifasciata
Prain
Ulangan
Bobot fraksi (g)
Bobot sampel ekstrak (g)
Rendemen (%)
1
0,0501
25,010
2,16
2
0,0421
25,010
1,82
3
0,0302
25,010
1,30
4
0,0326
25,010
1,41
5
0,0538
25,010
2,32
6
0,0396
25,010
1,71
7
0,0186
25,010
0,80
8
0,0138
25,010
0,59
9
0,0338
25,010
1,46
10
0,0548
25,010
2,36
Contoh perhitungan :
2,16%
%
100
2,5010gram
x
0.074)
0
(1
gram
0501
,
0
%
100
)
ekstrak
(Bobot
x
air)
kadar
0
(1
Lampiran 3 Pola KLT hasil fraksinasi ekstrak
S. trifasciat
dengan eluen
kloroform:etil asetat (1:6)
Lampiran 4 Hasil uji penghambatan fraksi daun
S.
trifasciata
Prain pada sel
lestari HeLa
Fraksi
Konsentrasi
(ppm)
Serapan I
Serapan II
%
penghambatan
Rerata
I
2500
0,2910
0,5920
0,4415
0
5000
0,1260
0,2680
0,1970
52,7
7500
0,1360
0,1930
0,1645
60,5
10000
0,2630
0,0810
0,1720
58,7
II
2500
0,2340
0,2900
0,2620
37,09
5000
0,0810
0,1160
0,0985
76,35
7500
0,0690
0,1080
0,0885
78,75
10000
0,0580
0,0460
0,0520
87,52
III
2500
0,2930
0,2820
0,2875
30.97
5000
0,2380
0,2100
0,2240
46,23
7500
0,1950
0,2160
0,2055
50,66
10000
0,1760
0,2280
0,2020
51,5
IV
2500
0,2700
0,3050
0,2875
30,97
5000
0,1390
0,1870
0,1630
60,86
7500
0,1360
0,2220
0,1790
57,02
10000
0,1630
0,1430
0,1530
63,27
V
2500
12,610
0,8210
10,410
0
5000
0,1600
0,1990
0,1795
56,9
7500
0,1720
0,2860
0,2290
45,02
10000
0,2080
0,1640
0,1860
55,34
VI
2500
0,1870
0,2450
0,2160
48,14
5000
0,2030
0,1910
0,1970
52,7
7500
0,2530
0,2020
0,2275
45,38
10000
0,2110
0,2520
0,2315
44,42
VII
2500
0,2130
0,2550
0,2340
43,82
5000
0,1970
0,2160
0,2065
50,42
7500
0,2150
0,2260
0,2205
47,06
10000
0,3070
0,2300
0,2685
35,53
VIII
2500
0,2090
0,2320
0,2205
47,06
5000
0,2430
0,2780
0,2605
37,45
7500
0,2780
0,2400
0,2590
37,82
10000
0,2710
0,2790
0,2750
33,97
IX
2500
0,8280
0,7540
0,7910
0
5000
0,1640
0,1500
0,1570
62,3
7500
0,1670
0,1530
0,1600
61,58
10000
0,1940
0,1560
0,1750
57,98
X
2500
0,2360
0,2350
0,2355
43,46
5000
0,1560
0,1410
0,1485
64,35
7500
0,1440
0,1400
0,1420
65,91
10000
0,1370
0,1500
0,1435
65,55
Contoh perhitungan :
%penghambatan = serapan kontrol0serapan sampel x 100%
serapan kontrol
= 0,416500,1720 x 100%
0,4165
=58,70%
Lampiran 5 Hasil uji fitokimia fraksi daun
S. trifasciata
Prain
Fraksi
Uji Fitokimia
FV*
SP*
TN*
ST*
TR*
AL*
1
0
0
0
+
0
+
2
+
0
0
0
0
+
3
0
0
0
0
0
+
4
0
0
0
0
0
+
5
0
0
0
0
0
+
6
0
0
0
0
0
+
7
0
0
0
0
0
+
8
0
0
0
0
0
+
9
0
0
0
0
0
+
10
+
0
0
0
0
+
FRAKSI AKTIF EKSTRAK DAU
Prain SEBAGAI PE GHAMBAT
PERTUMBUHA SEL LESTARI HeLa
URLAILA
DEPARTEME KIMIA
FAKULTAS MATEMATIKA DA ILMU PE GETAHUA ALAM
I STITUT PERTA IA BOGOR
ABSTRAK
NURLAILA
.
Fraksi Aktif Ekstrak Daun
Sansevieria trifasciata
Prain
Sebagai
Penghambat Pertumbuhan Sel Lestari HeLa. Dibimbing oleh
DONDIN SAJUTHI
dan
IRMA HERAWATI SUPARTO.
Lidah mertua
(
Sansevieria trifasciata
Prain) merupakan tanaman hias yang
juga bermanfaat sebagai antibakteri dan antioksidan. Penelitian tentang tumbuhan
ini sebagai antikanker belum pernah dilaporkan. Oleh karena itu, tujuan penelitian
ini adalah mengisolasi senyawa bioaktif dari daun lidah mertua yang dapat
menghambat pertumbuhan sel lestari HeLa secara
in vitro
. Teknik ekstraksi yang
digunakan ialah maserasi dalam metanol 96% lalu maserat dipekatkan
menggunakan penguap putar. Ekstrak kasar yang diperoleh kemudian difraksinasi
menggunakan kromatografi kolom dengan fase diam silika gel dan fase gerak
kloroform0etil asetat secara bergradien. Uji fitokimia dan uji penghambatan
pertumbuhan sel lestari HeLa dengan metode MTT (30(4,50dimetiltiazol020il)02,50
difeniltetrazolium bromida) dilakukan terhadap ekstrak kasar dan hasil fraksinasi
pada konsentrasi 200010000 ppm. Hasil uji fitokimia ekstrak kasar positif
menunjukkan flavonoid, alkaloid, dan steroid, akan tetapi ekstrak kasar tersebut
tidak dapat menghambat pertumbuhan sel. Dari hasil fraksinasi kromatografi
diperoleh 10 fraksi dan hanya 1 fraksi teraktif dengan nilai inhibisinya sebesar
87,52% pada konsentrasi 10000 ppm. Golongan senyawa yang terdapat dalam
fraksi tersebut ialah flavonoid dan alkaloid.
ABSTRACT
NURLAILA. Active Fraction in Extract of
Sansevieria trifasciata
Prain Leaves as
Proliferation Inhibitor of HeLa Cell Line. Supervised by of DONDIN SAJUTHI
and IRMA HERAWATI SUPARTO.
Sansevieria trifasciata
Prain
is an ornamental plant which is also useful as a
source of antibacterial and antioxidant agent. Studies of
S. trifasciata
Prain as
anticancer have not been reported. Therefore, the objective of this study is to
isolate bioactive compounds of
S. trifasciata
Prain leaves that shows
in vitro
PE DAHULUA
Kanker atau tumor ganas merupakan penyakit paling mematikan di dunia setelah jantung koroner. Lebih dari 10 juta orang didiagnosa mengidap penyakit kanker tiap tahunnya, bahkan penyakit ini menyebabkan kematian hingga 12% per tahun dari populasi dunia (WHO 2004). Salah satu kanker yang banyak meyebabkan kematian di seluruh dunia, yaitu kanker serviks (mulut rahim). Kanker ini merupakan kanker nomor dua yang paling sering menyerang wanita di seluruh dunia. Tiap tahunnya sekitar seperempat juta wanita meninggal karena penyakit ini (Simajuntak 2008)
Teknik pengobatan kanker yang saat ini berkembang di antaranya adalah radioterapi, kemoterapi, immunoterapi, gen terapi, dan pembedahan. Meskipun saat ini pengobatan tersebut merupakan pengobatan utama kanker, tetapi terapi ini membutuhkan biaya yang sangat mahal dan timbul efek samping dalam pengobatan, seperti mual, pusing, diare, penurunan sel darah putih, terjadinya malnutrisi, dan kebotakan. Hal ini menyebabkan banyak penderita kanker cenderung mencari alternatif pengobatan lain, yaitu dengan penggunaan tanaman obat. Penggunaan tanaman obat untuk kanker meningkat karena murah dan dianggap efek sampingnya rendah. Oleh karena itu, perlu dilakukan pengkajian potensi antikanker dari tanaman0tanaman yang diketahui berpotensi dalam mengobati kanker. Salah satu tanaman obat yang memiliki potensi antikanker, yaitu tanaman lidah mertua.
Lidah mertua (Sansevieria sp) merupakan jenis tanaman yang telah lama dikenal oleh banyak orang dan mulai dibudidayakan sebagai tanaman hias mulai abad ke019. Selain bermanfaat sebagai tanaman hias, lidah mertua juga dapat digunakan sebagai bahan baku tekstil dengan cara diambil seratnya, yang banyak digunakan di Cina dan New Zealand (Purwanto 2006). Di Afrika, getah dari tanaman tersebut dapat digunakan sebagai antiracun ular dan serangga.
Beberapa penelitian telah dilakukan untuk menggali potensi tanaman ini. Menurut Afolayan et al. (2008). S. hyacinthoides
mengandung senyawa fenol, proantosianidin, dan flavonoid yang berpotensi terhadap antibakteri dan antioksidan. Adanya zat0zat alami pada daun lidah metua yang bekerja sebagai antioksidan, diharapkan dapat menaggulangi perkembangan sel kanker. Daun S. ehrenbergii mengandung saponin
yang dapat menghambat pertumbuhan sel kanker (Pettit et al. 2005). Meskipun lidah mertua berpotensi untuk dijadikan sebagai antikanker, tetapi pemanfaatannya masih sangat terbatas sebagai tanaman hias dan belum terdapat penelitian terhadap S. trifasciata Prain sebagai antikanker.
Penelitian ini bertujuan untuk mengisolasi senyawa bioaktif dari daun S. trifasciata Prain yang dapat menghambat pertumbuhan sel lestari HeLa secara in vitro. Hasil penelitian ini diharapkan dapat memberikan informasi bahwa fraksi aktif dari ekstrak metanol daun
S. trifasciata Prain dapat menghambat aktivitas pertumbuhan sel lestari HeLa.
TI JAUA PUSTAKA
Prain
Century plant, lucky plant, mother in law’s tongue (lidah mertua) atau snake plant
(tanaman ular) merupakan nama lain dari tanaman Sansevieria. Tanaman ini sangat dikenal sebagai obat tradisional yang secara empiris digunakan untuk mengobati berbagai penyakit. S. trifasciata Prain termasuk dalam divisi Mognoliophyta, kelas Liliopsida, ordo Liliales, famili Agavaceae, genus Sansevieria, dan spesies S. trifasciata Prain.
Daerah tropis kering dan mempunyai iklim gurun yang panas atau pegunungan yang curah hujannya rendah merupakan habitat asli Sansevieria, sehingga Sansevieria termasuk golongan tanaman daerah kering (zerophytic) (Purwanto 2006). Akan tetapi di negara yang memiliki empat musim pun tanaman ini dapat bertahan hidup, sehingga banyak mengalami penyimpangan bentuk, corak, dan warna. Secara morfologinya Sansevieria berakar serabut, batang berada di dalam tanah, pendek, dan beruas. Batang inilah yang kadang disebut sebagai rhizome atau rimpang. Daunnya berbentuk pipih, bagian ujungnya meruncing, lebar 409 cm dan panjang 150150 cm dengan warna hijau bernoda putih atau kuning dengan tekstur rata dan halus (Gambar 1). Lingga (2005) menyatakan bahwa mahkota bunga jantan dan betina Sansevieria berwarna putih kekuningan. Bunganya bertipe malai dan menurut Purwanto (2006) bunga Sansevieria termasuk bunga uniseksual.
rimpang S. trifasciata yang telah dilaporkan adalah vitamin C, tanin, glukogalin, asam galat, asam elegat, korilagin, terchebin, chebulagic acid, chebulinic acid, 3,60 digaloilglukosa, mucid acid, phylembic acid, dan emblikol (Hariana 2007). Selain itu, dalam uji fitokimia yang dilakukan oleh Yoshihiro et al. tanaman ini mengandung karbohidrat, saponin, glikosida (1996), dan steroid (1997).
Gambar 1 Sansevieria trifasciata Prain
Kanker
Kanker adalah suatu penyakit sel dengan ciri0ciri kegagalan mekanisme pengatur multiplikasi dan fungsi homeostatis lain pada organisme multiseluler. Sel0sel kanker akan terus membelah diri, terlepas dari pengendalian pertumbuhan dan tidak menuruti hukum0hukum pembiakan. Sel kanker akan terus berkembang tumbuh menyusup ke jaringan sekitarnya (invasif), lalu membuat anak sebar (metastasis) ke tempat yang lebih jauh melalui pembuluh darah dan pembuluh getah bening. Sel kanker tersebut akan timbul menjadi kanker baru di tempat lain sampai akhirnya menyebabkan kematian penderitanya (Nafrialdi & Gan 2000).
Ada beberapa jenis kanker seperti karsinoma, sarkoma, leukemia, dan limfoma. Karsinoma, yaitu kanker yang tumbuh dari sel epitel. Sarkoma, yaitu kanker yang tumbuh dari jaringan penunjang tubuh. Leukemia, yaitu kanker yang tumbuh pada jaringan yang menghasilkan darah. Limfoma, yaitu kanker yang tumbuh pada daerah limfa. Penyebab kanker belum diketahui dengan pasti, akan tetapi ada bahan0bahan yang diduga dapat menjadi penyebab kanker, yaitu senyawa kimia, faktor fisika, virus, dan hormon. Buah dan sayur, terutama yang banyak mengandung
serat, dapat menurunkan resiko kanker terutama pada saluran pencernaan (Greenwald 1991).
Antikanker
Antikanker adalah agen yang memiliki sifat sitostatik (dapat menghambat pertumbuhan sel kanker) dan atau sitosidal (dapat mematikan sel kanker). Beberapa metabolit sekunder memiliki aktivitas sebagai agen antikanker. Oleh karena itu, akhir0akhir ini banyak dikembangkan penelitian untuk mencari senyawa metabolit sekunder yang memiliki bioaktivitas sebagai senyawa antikanker yang kemudian akan dikembangkan dalam kemometri untuk pengobatan kanker (Boik 1996).
Untuk pemeriksaan suatu senyawa agen antikanker dari tanaman obat, National Cancer Institute (NCI) Amerika Serikat pada tahun 1980, menentukan prosedur penapisan, yaitu preparasi, pra penapisan, penapisan, pemantauan, dan uji klinik. Preparasi yang dilakukan berupa pengumpulan tanaman dan ekstraksi. Uji pra penapisan dilakukan dengan uji in vitro atau in vivo secara sederhana untuk mengidentifikasi ekstrak yang berpotensi antikanker. Ekstrak yang aktif kemudian ditapis melawan sel yang lebih banyak secara
in vivo. Ekstrak yang berhasil ditapis akan dilakukan tahap pemantauan, yaitu difraksinasi untuk memperoleh senyawa aktif yang murni. Senyawa yang murni ini kemudian diuji secara in vivo. Senyawa yang berhasil menunjukkan aktivitas antikanker lalu dilakukan uji klinik. (Hartati & Hanafi 2001).
Ekstraksi dan Fraksinasi Senyawa
Metabolit Sekunder dari Tumbuhan
Ekstraksi senyawa aktif dari tanaman obat adalah suatu proses yang secara selektif mengambil zat terlarut yang terkandung dalam suatu campuran dengan bantuan pelarut. Metode ekstraksi yang digunakan pada penelitian ini, yaitu metode maserasi dengan menggunakan metanol sebagai larutan pengekstrak (Pittaya et al. 2003). Metode ekstraksi maserasi digunakan untuk mengekstrak suatu komponen kimia yang tidak tahan panas, kekurangan dari metode ini, yaitu diperlukan waktu yang lama dan banyak menggunakan larutan pengekstrak. Hal0hal yang perlu diperhatikan dalam pemilihan pelarut adalah selektivitas, kepolaran, sifat racun, dan kemudahan untuk diuapkan.
Fraksinasi adalah proses pemisahan komponen dalam suatu ekstrak menjadi kelompok0kelompok senyawa yang memiliki kemiripan karakteristik secara kimia (Houghton & Raman 1998). Kromatografi kolom merupakan teknik analisis, dalam penentuan jumlah komponen dalam suatu campuran senyawa, dan juga untuk pemisahan dan pemurnian komponen senyawa tertentu dari campurannya. Dalam pemisahan kromatografi kolom ini, suatu pelarut pengelusi dialirkan secara kontinu melalui kolom dan komponen demi komponen dari campuran yang pada akhirnya keluar dari kolom dapat dikumpulkan dan difraksinasi (Rouessac & Rouessac 1994).
Gambar 2 Eksperimen dasar kromatografi kolom (a) bahan yang dibutuhkan (C, kolom; SP, fase stasioner; MP, fase mobil; dan S, sampel); (b) sampel dimasukkan; (c) proses elusi dimulai; (d) hasil separasi diperoleh; (Rouessac & Rouessac 1994).
Kromatografi lapis tipis (KLT) merupakan jenis kromatografi partisi menggunakan sebuah lapis tipis silika atau alumina yang seragam pada sebuah lempeng gelas atau logam yang keras. Fase diam untuk kromatografi lapis tipis seringkali juga mengandung substansi yang dapat berpendar dalam sinar ultra violet. Fase gerak merupakan pelarut atau campuran pelarut yang sesuai (Furniss et al. 1989). Teknik kromatografi lapis tipis pergerakan zat relatif terhadap garis depan pelarut dalam sistem kromatografi tertentu dapat didefinisikan sebagai nilai Rf adalah perbandingan jarak tempuh zat dengan jarak tempuh garis depan pelarut.
(a) (b)
Gambar 3 Kromatografi lapis tipis, (a)
chamber, tempat pengembangan pelat KLT; (b) plat KLT dalam penentuan Rf (Furniss et al. 1989).
MTT (3/(4,5/Dimetiltiazol/2/yl)/2,5/
difeniltetrazolium bromida)
Senyawa MTT, merupakan suatu garam monotetrazolium yang digunakan untuk menilai poliferasi sel dengan cara menghitung jumlah sel.
MTT akan mengalami reaksi reduksi oleh enzim mitokondrial reduktase yang terdapat dalam mitokondria sel hidup yang bersifat aktif, sehingga menghasilkan biru0formazan (Gambar 4). Kadar dari fornazan ditetapkan secara spektrofotometrik dengan panjang gelombang 595 nm. Intensitas warna biru yang terbentuk berbanding lurus dengan jumlah sel yang aktif melakukan metabolisme (Wang et al. 2009).
BAHA DA METODE
Bahan dan Alat
Bahan0bahan yang digunakan dalam penelitian ini adalah S. trifasciata Prain yang diperoleh dari kebun percobaan kampus Lodaya IPB, sel lestari HeLa, DMEM (Dulbeco’s Minimum Essential Medium), penisilin sterptomisin, PBS (phosphate bovine serum), glass wool, dan silika gel G60F254.
Alat0alat yang digunakan dalam penelitian ini adalah lempeng KLT analitik G60F254, kolom kromatografi, sumuran (96 well plate), sentrifuse Flexpin merk Tomy dengan tipe LC.200, mikroskop (Nikon), hemositometer, inkubator, spektrofotometer microplate, lampu UV,dan alat0alat gelas.
Lingkup Kerja
Persiapan Sampel
Sampel yang digunakan adalah daun S. trifasciata Prain. Daun tersebut dicuci, dipotong0potong, lalu dikeringkan dalam oven selama 3×24 jam pada suhu 50°C. Diagram alir penelitian dapat dilihat pada Lampiran 1.
Penentuan Kadar Air (AOAC 2006)
Cawan porselin dikeringkan pada suhu 105ºC selama 30 menit lalu didinginkan dalam eksikator dan ditimbang. Sebanyak 1 g daun ditimbang dan dimasukkan ke dalam cawan yang telah diketahui bobotnya, kemudian dipanaskan di dalam oven bersuhu 105ºC selama 24 jam. Cawan didinginkan di dalam eksikator selama 30 menit dan bobotnya ditimbang. Pemanasan dan penimbangan diulang sampai didapat bobot tetap. Kadar air dihitung dengan rumus
Kadar air (%) = × 100% dengan
a adalah bobot sampel (g)
b adalah bobot sampel setelah dikeringkan (g)
Ekstraksi
Sebanyak 20 g sampel daun direndam dengan menggunakan 200 ml metanol 96%. Ekstraksi dilakukan dengan menggunakan alat pengocok pada suhu kamar selama 3×24 jam dan dilakukan penyaringan. Selanjutnya ekstrak metanol dipekatkan dengan menggunakan rotavapor pada suhu 40°C sehingga diperoleh ekstrak kasar yang bebas pelarut.
Rendemen ekstrak (%) = × 100% dengan
a adalah bobot ekstrak (g) b adalah bobot sampel kering (g) ka adalah kadar air
Uji Fitokimia (Harborne 1987)
Saponin, Tanin. Sebanyak 0,1 g ekstrak dilarutkan dengan 10 ml akuadestilata kemudian didihkan selama 5 menit. Campuran disaring dan filtrat dibagi ke dalam dua tabung reaksi. Bagian pertama, uji saponin, filtrat didiamkan sampai agak dingin dan kemudian dikocok kuat sampai timbul busa. Bila busa stabil dalam 10 menit, maka filtrat positif mengandung saponin. Bagian kedua, uji tanin, filtrat ditambahkan FeCl3 1%, bila dihasilkan warna hijau, biru, atau hitam maka filtrat positif mengandung tanin.
Steroid/ Triterpenoid. Sebanyak 0,1 g ekstrak dilarutkan dengan 25 ml etanol panas (50ºC), kemudian disaring ke dalam pinggan porselen dan diuapkan sampai kering. Residu dilarutkan dalam eter dan dipindahkan ke dalam tabung reaksi lalu ditambahkan Lieberman0Burchard (3 tetes anhidrida asam asetat dan 1 tetes H2SO4 pekat). Terbentuknya warna merah atau ungu menunjukkan adanya kandungan triterpenoid, sedangkan jika terbentuk warna hijau atau biru menunjukan adanya steroid.
MTT akan mengalami reaksi reduksi oleh enzim mitokondrial reduktase yang terdapat dalam mitokondria sel hidup yang bersifat aktif, sehingga menghasilkan biru0formazan (Gambar 4). Kadar dari fornazan ditetapkan secara spektrofotometrik dengan panjang gelombang 595 nm. Intensitas warna biru yang terbentuk berbanding lurus dengan jumlah sel yang aktif melakukan metabolisme (Wang et al. 2009).
BAHA DA METODE
Bahan dan Alat
Bahan0bahan yang digunakan dalam penelitian ini adalah S. trifasciata Prain yang diperoleh dari kebun percobaan kampus Lodaya IPB, sel lestari HeLa, DMEM (Dulbeco’s Minimum Essential Medium), penisilin sterptomisin, PBS (phosphate bovine serum), glass wool, dan silika gel G60F254.
Alat0alat yang digunakan dalam penelitian ini adalah lempeng KLT analitik G60F254, kolom kromatografi, sumuran (96 well plate), sentrifuse Flexpin merk Tomy dengan tipe LC.200, mikroskop (Nikon), hemositometer, inkubator, spektrofotometer microplate, lampu UV,dan alat0alat gelas.
Lingkup Kerja
Persiapan Sampel
Sampel yang digunakan adalah daun S. trifasciata Prain. Daun tersebut dicuci, dipotong0potong, lalu dikeringkan dalam oven selama 3×24 jam pada suhu 50°C. Diagram alir penelitian dapat dilihat pada Lampiran 1.
Penentuan Kadar Air (AOAC 2006)
Cawan porselin dikeringkan pada suhu 105ºC selama 30 menit lalu didinginkan dalam eksikator dan ditimbang. Sebanyak 1 g daun ditimbang dan dimasukkan ke dalam cawan yang telah diketahui bobotnya, kemudian dipanaskan di dalam oven bersuhu 105ºC selama 24 jam. Cawan didinginkan di dalam eksikator selama 30 menit dan bobotnya ditimbang. Pemanasan dan penimbangan diulang sampai didapat bobot tetap. Kadar air dihitung dengan rumus
Kadar air (%) = × 100% dengan
a adalah bobot sampel (g)
b adalah bobot sampel setelah dikeringkan (g)
Ekstraksi
Sebanyak 20 g sampel daun direndam dengan menggunakan 200 ml metanol 96%. Ekstraksi dilakukan dengan menggunakan alat pengocok pada suhu kamar selama 3×24 jam dan dilakukan penyaringan. Selanjutnya ekstrak metanol dipekatkan dengan menggunakan rotavapor pada suhu 40°C sehingga diperoleh ekstrak kasar yang bebas pelarut.
Rendemen ekstrak (%) = × 100% dengan
a adalah bobot ekstrak (g) b adalah bobot sampel kering (g) ka adalah kadar air
Uji Fitokimia (Harborne 1987)
Saponin, Tanin. Sebanyak 0,1 g ekstrak dilarutkan dengan 10 ml akuadestilata kemudian didihkan selama 5 menit. Campuran disaring dan filtrat dibagi ke dalam dua tabung reaksi. Bagian pertama, uji saponin, filtrat didiamkan sampai agak dingin dan kemudian dikocok kuat sampai timbul busa. Bila busa stabil dalam 10 menit, maka filtrat positif mengandung saponin. Bagian kedua, uji tanin, filtrat ditambahkan FeCl3 1%, bila dihasilkan warna hijau, biru, atau hitam maka filtrat positif mengandung tanin.
Steroid/ Triterpenoid. Sebanyak 0,1 g ekstrak dilarutkan dengan 25 ml etanol panas (50ºC), kemudian disaring ke dalam pinggan porselen dan diuapkan sampai kering. Residu dilarutkan dalam eter dan dipindahkan ke dalam tabung reaksi lalu ditambahkan Lieberman0Burchard (3 tetes anhidrida asam asetat dan 1 tetes H2SO4 pekat). Terbentuknya warna merah atau ungu menunjukkan adanya kandungan triterpenoid, sedangkan jika terbentuk warna hijau atau biru menunjukan adanya steroid.
Flavonoid. Sebanyak 0,1 g ekstrak ditambahkan 10 ml air panas lalu dipanaskan selama 5 menit dan disaring. Sebanyak 5 ml filtrat ditambahkan 0,05 g serbuk Mg dan 1 ml HCl pekat dan 1 ml amil alohol kemudian dikocok. Adanya flavonoid ditunjukkan dengan terbentuknya warna merah/ jingga/kuning pada lapisan amil alkohol.
Pemilihan Eluen Terbaik
Pelat KLT yang digunakan adalah pelat alumunium jenis silika gel G60F254. Ekstrak pekat teraktif dari sampel ditotolkan pada pelat KLT. Setelah kering langsung dielusi dalam ruang elusi yang telah dijenuhkan oleh uap eluen pengembang. Eluen yang digunakan, yaitu kloroform:etil aseatat (9:1, 6:1, 3:1, 2:1, 1:1, 1:9, 1:6, 1:3, 1:2). Noda hasil elusi diamati di bawah lampu UV pada panjang gelombang 254 dan 366 nm.
Fraksinasi
Ekstrak metanol sampel daun dilarutkan dalam kloroform dan kemudian dipisahkan komponen0komponennya menggunakan kromatografi kolom. Kromatografi ini menggunakan elusi dengan eluen kloroform:etil asetat yang semakin meningkat kepolarannya (10:0, 9:1, 6:1, 3:1, 2:1, 1:1, 1:9, 1:6, 1:3, 1:2, dan 0:10). Sebanyak 5 ml eluat ditampung dalam tiap tabung reaksi yang telah diberi nomor, kemudian diuji dengan KLT. Eluat yang memiliki Rf dan pola KLT yang sama digabungkan sebagai satu fraksi kemudian diuji kembali aktivitas antikankernya untuk mendapatkan fraksi yang paling aktif.
Kultur Sel Lestari
Sel lestari yang telah tumbuh menjadi
monolayer (berlapis satu) diremajakan kembali dengan membuang medianya. Selanjutnya ditambahkan PBS 5 ml untuk membersihkan botol kultur dari sisa media. Sebanyak 2,5 ml tripsin ditambahkan ke dalam botol kultur, lalu diinkubasi pada 37ºC selama 5 menit. Sel yang telah lepas ditambahkan DMEM 5 ml lalu dimasukkan ke dalam tabung sentrifus 15 ml, kemudian disentrifus selama 5 menit, 700 g, dan supernatan dibuang. Sebanyak 3 ml DMEM ditambahkan pada tabung sentrifus tersebut lalu 50 µl larutan diambil dan ditambahkan dengan 50 µl tripan biru. Viabilitas sel dihitung dengan hemositometer. Sel yang hidup tidak berwarna, sedangkan sel yang mati akan berwarna biru.
Uji Penghambatan Pertumbuhan
Sel Lestari HeLa
Sel ditumbuhkan menggunakan pelat biakan 96 sumur sebanyak 100 µl/sumur dengan jumlah 3×105 sel/sumur diinkubasi pada 37ºC selama 24 jam. Media kultur yang mengandung sampel dibuang, setelah itu ditambahkan sampel uji sebanyak 100 µl/sumur dengan tiga kali pengulangan. Sampel yang diujikan, yaitu ekstrak S. trifasciata Prain dengan konsentrasi 200, 400, 600, 800, 1000, 1500, 2000 ppm dan fraksi hasi kolom dengan konsentrasi 2500, 5000, 7500, dan 10000 ppm. Lalu diinkubasi kembali pada 37ºC selama 48 jam, setelah itu tambahkan reagen MTT sebanyak 10 µl/sumur dan inkubasi kembali pada suhu 37ºC selama 4 jam hingga terbentuk formazan berwarna biru ungu pada sel hidup. Ditambahkan HCl isopropanol 0,1 N sebanyak 100 µl/sumur kemudian digojog selama 10 menit dan dibaca serapannya dengan menggunakan spektrofotometer pada panjang gelombang 595 nm. Hasil uji berupa serapan kemudian dikonversikan dalam bentuk persen penghambatan dengan rumus: %penghambatan:
serapan kontrol0serapan sampel x 100% serapan kontrol
HASIL DA PEMBAHASA
Kadar Air
Sampel yang digunakan pada penelitia