PEMURNIAN PROTEASE DARI DAUN
MENGKUDU (
Morinda citrifolia
L.)
ELFI
SEKOLAH PASCASARJANA
INSITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS
DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis yang berjudul : “Pemurnian
Protease dari Daun Mengkudu (Morinda citrifolia L.)”, adalah benar
merupakan karya saya sendiri dengan arahan dari komisi pembimbing dan belum
pernah diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber
informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak
diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam
daftar pustaka di bagian akhir tesis ini.
Bogor, Maret 2011
ABSTRACT
ELFI. Purification of Proteases from Noni (Morinda citrifolia L.) Leaves. Under guidance of NURI ANDARWULAN and DAHRUL SYAH
It has been proved that protease could tenderize meat and octopuses. One of the protease sources is noni (Morinda citrifolias L.) leaves. Yet, the study of proteases in noni leaves has not been reported. The research was aimed to characterize physic and chemistry of noni leaves and purify the protease of noni leaves both from base and shoot part.
The physic and chemistry characterization of noni leaves was done by observation and proximate analysis, respectively. The purification of noni leaves proteases was conducted by several steps consisting of extraction, centrifugation, precipitation using saturated ammonium sulfate (100%), dialysis and electrophoresis also zymography.
The noni leaves used in this research have facing position, large and thick size, single, flat edge, pinnate veins, green-shiny color, and hairless. Base leaves are dark green dan shoot leaves are light green. The proximate analysis showed that the protein content of base noni leaves (2.92%dry base) was lower than shoot leaves (2.98% dry base). Purification of noni leaves proteases showed that the crude extract of base leaves had higher enzyme specific activity (0.46U/mg protein) than the crude extract of shoot leaves (0.43U/mg protein). Protein content of base leaves (11.29%) was lower than the other (11.47%). Noni leaves purification steps decreased protease specific activity. SDS-PAGE of shoot and base leaves dialysates showed the polypeptides molecular weights were 58-61.5kDa and 70kDa respectively; whereas zymogram showed the molecular weight of the enzymes are 39kDa and 50kDa.
RINGKASAN
ELFI. Pemurnian Protease dari Daun Mengkudu (Morinda citrifolia L.). Dibimbing oleh NURI ANDARWULAN dan DAHRUL SYAH.
Daun mengkudu telah digunakan secara tradisional untuk mengempukkan daging dan gurita. Sama halnya dengan penggunaan daun papaya untuk mengempukkan daging. Penelitian telah membuktikan bahwa aktifitas pengempukan daging berkaitan dengan aktifitas enzim protease. Selama ini penelitian protease pada daun mengkudu belum pernah dilaporkan. Penelitian ini bertujuan untuk memurnikan protease dari daun mengkudu dari dua tingkat ketuaan yang berbeda yaitu daun pangkal yang berwarna hijau tua dan daun pucuk yang berwarna hijau agak muda, mengetahui aktifitas protease dan kadar protein serta bobot molekul enzim protease yang dimurnikan.
Tahap pertama adalah mengkarakterisasi daun mengkudu baik sifat fisik (pengamatan) maupun kimia (analisa proksimat). Hasil pengamatan menunjukkan bahwa daun mengkudu terletak berhadapan, ukuran daun besar, tebal dan tunggal, tepi daun rata, urat daun menyirip dan warna hijau mengkilap serta tidak berbulu. Hasil analisa proksimat menunjukkan bahwa kadar protein daun pucuk sebesar 2.98% (db) lebih besar dari kadar protein daun pangkal sebesar 2.92% (db).
Tahap kedua adalah memurnikan protease pada daun mengkudu. Pemurnian protease daun mengkudu dilakukan dengan cara ekstraksi, sentrifugasi, pengendapan protein (enzim) dan elektroforesis (SDS-PAGE) dan Zymografi. Setiap tahap pemurnian dilakukan pada suhu dingin (4-6oC). Ekstraksi daun mengkudu dilakukan menggunakan blender dengan penambahan buffer asetat yang mengandung EDTA, polivinilpirolidon (PVP K30), β-merkaptoetanol dan gliserol. Ekstrak daun mengkudu kemudian disaring dan disentrifus sehingga didapatkan ekstrak kasar. Ekstrak kasar ditambah silika 1.4% dan disentrifus sehingga didapatkan ekstrak silika. Ekstrak silika yang diperoleh diendapkan menggunakan ammonium sulfat 100% jenuh dan dilanjutkan dengan dialisis menggunakan membran selulosa ber-MWCO 12kDa. Dialisat protein dipisahkan dengan SDS-PAGE dan diwarnai dengan comassie brilliant blue dan protease dipisahkan dengan zimografi (SDS-PAGE dengan kasein sebagai substrat enzim) dan juga diwarnai dengan comassie brilliant blue. Analisa kadar protein dan aktiftas proteolitik enzim dilakukan pada setiap tahap pemurnian.
Analisis SDS-PAGE pada dialisat daun mengkudu (daun pangkal dan daun pucuk) menunjukkan beberapa pita protein berukuran 58-61.5 kDa dan 70 kDa dan analisis zimogram pada dialisat (daun pangkal dan daun pucuk) menunjukkan beberapa pita enzim berberat molekul 29 kDa dan 50 kDa.
Kemiripan penggunaan papain (daun papaya) dan daun mengkudu sebagai pengempuk daging dan penyembuh luka, diduga protease daun mengkudu sama dengan papain dan bromelain yaitu termasuk protease sistein.
©
Hak Cipta Milik IPB, tahun 2011
Hak Cipta dilindungi Undang-Undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa
mencantumkan atau menyebutkan sumbernya,
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan
karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu
masalah.
b. Pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
2. Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya
PEMURNIAN PROTEASE DARI DAUN
MENGKUDU (
Morinda citrifolia
L.)
ELFI
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program studi Ilmu Pangan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul : Pemurnian Protease dari Daun Mengkudu (Morinda citrifoliaL.)
Nama : Elfi
NRP : F251070221
Disetujui,
Komisi Pembimbing
Dr. Ir. Nuri Andarwulan, M. Si. Ketua
Dr. Ir. Dahrul Syah, M.Sc. Anggota
Diketahui,
Ketua Program Studi Ilmu Pangan
Dr. Ir. Ratih Dewanti Hariyadi, M.Sc.
Dekan Sekolah Pascasarjana
Dr. Ir. Dahrul Syah, M.Sc.
PRAKATA
Puji syukur penulis panjatkan kehadirat Allah SWT atas berkat rahmat-Nya
sehingga penulis dapatmenyelesaikan tesis yang berjudul “Pemurnian Protease
dari Daun Mengkudu (Morinda citrifolia L.)”. Pada kesempatan ini, penulis
ingin mengucapkan terima kasih yang sebesar-besarnya kepada :
1. Suami: Jimmi Anka, anak-anak, Apa, Amak(alm), mertua (alm) dan
adik-adik serta seluruh keluarga besar untuk segala doa, dukungan materil dan
immaterial yang tiada henti.
2. Dr. Ir. Nuri Andarwulan M.Si. dan Dr. Ir. Darul Syah M.Sc. selaku komisi
pembimbing atas waktu, perhatian, pikiran, dan motivasi yang diberikan
selama pembimbingan dalam menyelesaikan program magister di IPB.
3. Dr. Didah Nur Faridah, STP. MSi. atas kesediaannya sebagai dosen penguji
luar komisi.
4. Bapak Sawaludin atas hibah PVPP untuk penelitian
5. SEAFAST CENTRE IPB atas bantuan dana penelitian dan fasilitas untuk
melakukan penelitian
6. Dwi Ishartani sebagai teman seperjuangan baik suka maupun duka selama
penyusunan proposal, penelitian maupun penyusunan tesis
7. Abah (Tubagus B) atas pinjaman pH meter, Mba Iceu, Diah, Dian, Rita, Fidi,
Desti dan teman-teman IPN angkatan 2007 atas masukan dan kebersamaan
8. Dila dan “ tahu ranger” (Dita, Viktor dan Yogi) selama di Laboratorarium
Bioteknologi SEAFAST serta segenap teman dan kerabat yang tidak dapat
penulis sebutkan satu per satu.
Penulis berharap semoga karya tulis ilmiah ini dapat memberikan manfaat
yang sebesar-besarnya bagi semua pihak yang memerlukan.
Bogor, Maret 2011
RIWAYAT HIDUP
Penulis dilahirkan di Bukittinggi Sumatera Barat pada tanggal 25
September 1975 sebagai putri tertua dari 5 bersaudara dari pasangan Syafri dan
Asniarti (Alm). Tahun 2001 penulis menikah dengan Jimmi Anka dan mempunyai
tiga orang putra (Haritsah S. Y, Ahmad Dzikri F. dan Naufal Khalid S.).
Penulis menyelesaikan pendidikan Srata 1 dari Jurusan Teknologi Pangan
dan Gizi, Fakultas Teknologi Pertanian IPB pada tahun 1999. Tahun 2001-2003
penulis berkesempatan menjadi dosen honorer di jurusan Teknologi Pangan dan
Gizi IPB sebagai Penanggung Jawab Praktikum. Pada tahun 2007 penulis
melanjutkan pendidikan Srata 2 pada Program Studi Ilmu Pangan, Sekolah
Pascasarjana IPB dengan dukungan dana dari suami tercinta. Sebagai syarat
untuk memperoleh gelar Magister Sains pada program Ilmu Pangan IPB, penulis
menyelesaikan tesis dengan judul Pemurnian Protease dari Daun Mengkudu
DAFTAR ISI
Halaman
DAFTAR ISI... i
DAFTAR TABEL ... iii
DAFTAR GAMBAR... v
DAFTAR LAMPIRAN ... vii
PENDAHULUAN ... 1
Latar Belakang... 1
Tujuan Penelitian ... 2
TINJAUAN PUSTAKA... 5
Mengkudu (Morinda citrifoliaL.)... 5
Protease Tumbuhan... 7
Klasifikasi Protease... 8
Pemurnian Enzim... 12
Ekstraksi Enzim ... 12
Pemekatan Enzim... 12
Fraksinasi Enzim... 13
Aplikasi Protease ... 14
Pembuatan keju ... 14
Pengempuk daging ... 15
Penjernih Bir ... 16
Pembuatan Hidrolisa Protein Kedele ... 16
Penyembuh Luka... 16
Terapi untuk Pencernaan dan Kanker ... 16
Terapi Inflamasi danBlood Clotting(Pembekan Darah)... 17
BAHAN DAN METODE ... 19
Waktu dan Tempat Penelitian ... 19
Bahan dan Alat ... 19
Metode Penelitian ... 19
Karakterisasi Sifat Fisik dan Kimia Daun Mengkudu ... 20
Pengamatan... 23
Pendugaan Kelas Protease Mengkudu ... 31
HASIL DAN PEMBAHASAN ... 33
Karakterisasi Daun Mengkudu ... 33
Pemurnian Protease Daun Mengkudu... 34
Penentuan Berat Molekul Protease ... 40
Pendugaan Kelas Protease Daun Mengkudu... 41
SIMPULAN dan SARAN... 45
DAFTAR PUSTAKA... 47
DAFTAR TABEL
Tabel 1. Komposisi Kimia Daun Mengkudu (mentah) ... 7
Tabel 2. Beberapa Sistein Protease Tanaman ... 10
Tabel 3. Berbagai Serin Protease dari Tumbuhan ... 11
Tabel 4. Pengujian Aktivitas Enzim Metode Bergmeyer dan Grassl (1983).... 27
Tabel 5. Komposisi Gel Pemisah dan Gel Penahan ... 28
Tabel 6. Kadar Proksimat Daun Mengkudu... 33
Tabel 7. Pemurnian Protease pada Daun Mengkudu... 38
DAFTAR GAMBAR
Gambar 1. Pohon Mengkudu... 6
Gambar 2. Daun Pucuk dan Daun Pangkal ... 20
Gambar 3. Garis Besar Kerja Penelitian... 21
Gambar 4. Diagram Neraca Massa selama Tahapan Pemurnian... 24
Gambar 5. Hasil SDS-PAGE Dialisat Daun Mengkudu... 41
DAFTAR LAMPIRAN
Lampiran 1. Pembuatan pereaksi Aktivitas enzim ... 53
Lampiran 2. Pembuatan Pereaksi Bradford ... 54
Lampiran 3. Aktivitas Protease Daun Pucuk Selama Tahapan Pemurnian ... 55
Lampiran 4. Aktivitas Protease Daun Pangkal Selama Tahapan Pemurnian .. 56
Lampiran 5a. Standar BSA untuk Ekstraksi dan Pengendapan Daun Pucuk .... 57
Lampiran 5b. Standar BSA untuk Dialisat Protein Daun Pucuk ... 57
Lampiran 5c. Kadar Protein Daun Pucuk Selama Tahapan Pemurnian... 58
Lampiran 6a. Standar BSA untuk Ekstraksi dan Pengendapan Daun Pangkal . 59
Lampiran 6b. Standar BSA untuk Dialisat Daun Pangkal ... 59
Lampiran 6c. Kadar Protein Daun Pangkal Selama Tahapan Pemurnian ... 60
Lampiran 7. Larutan-Larutan untuk SDS-PAGE dan Zimogram ... 61
Lampiran 8a. Kurva Standar Marker untuk SDS-PAGE... 63
Lampiran 8b. Penentuan Bobot Molekul Protein Daun Pucuk dan Pangkal ... 63
Lampiran 9a. Kurva Standar Marker Zimogram ... 63
Lampiran 9b. Penentuan Bobot Molekul Protease Daun Pucuk dan Pangkal ... 63
Lampiran 10. Pewarnaan Silver Metode Vorum ... 64
Lampiran 11. Neraca Massa Daun Pucuk Selama Tahap Pemurnian ... 65
Lampiran 12. Neraca Massa Daun Pangkal Selama Tahap Pemurnian ... 66
PENDAHULUAN
Latar Belakang
Makhluk hidup termasuk tumbuhan membutuhkan reaksi biokimia seluler
yang melibatkan enzim untuk menjaga kelangsungan hidupnya. Salah satu enzim
yang terlibat adalah protease. Pada tanaman protease tidak hanya diperlukan
untuk degradasi protein, tetapi juga untuk pertahanan tubuh, perkembangan dan
pematangan buah, aktifasi proenzim, penguraian simpanan protein dalam biji
yang sedang berkecambah dan lain sebagainya.
Beberapa enzim dari tumbuhan, mikroba dan binatang seperti lipase,
karbohidrase dan protease sudah diisolasi, dimurnikan dan diaplikasikan pada
berbagai industri. Menurut Aehle (2007) enzim banyak diaplikasikan untuk
keperluan medis, industri pangan, industri kosmetik, industri farmasi dan lain
sebagainya. Dalam industri pangan khususnya, enzim lipase, karbohidrase dan
protease merupakan enzim yang banyak digunakan.
Perdagangan protease mencapai 60% dari total penjualan enzim dunia yang
mencapai dua milliar US$ dengan peningkatan nilai jual mencapai enam hingga
tujuh persen pertahun, sedangkan dari kuantitasnya meningkat sebesar 10 hingga
15% pertahun (Suhartono, 2000). Impor enzim Indonesia pun juga terus
meningkat dari 124,1 juta US$ pada tahun 2000 (BPS, 2000) menjadi 127.4 juta
US$ pada tahun 2001 (BPS, 2001).
Mengkudu (Morinda citrifolia L.) termasuk tumbuhan keluarga kopi-kopian
(Rubiaceae), yang pada mulanya berasal dari wilayah daratan Asia Tenggara dan
kemudian menyebar sampai ke Cina, India, Filipina, Hawai, Tahiti, Afrika,
Australia, Karibia, Haiti, Fiji, Florida dan Kuba. Secara keseluruhan mengkudu
merupakan bahan makanan yang bergizi lengkap.
Mengkudu banyak terdapat di Indonesia. Produksi mengkudu pun di
Indonesia meningkat setiap tahun. Pada tahun 2003 produksi mengkudu
mencapai 1,9 ton meningkat pesat pada tahun 2007 menjadi 14 ton (Departemen
Pertanian Republik Indonesia, 2008).
Sebagian besar adat budaya Polinesia pada masa lampau maupun sekarang,
Pasifik Selatan mengkonsumsi buah mengkudu untuk dapat bertahan hidup pada
waktu kelaparan. Para prajurit yang menetap di kepulauan Polinesia selama
perang dunia II dianjurkan untuk mengkonsumsi buah mengkudu untuk
menambah kekuatan dan tenaga. Zat-zat nutrisi yang dibutuhkan tubuh antara
lain: karbohidrat, protein, vitamin, dan mineral-mineral esensial juga tersedia
dalam buah maupun daun mengkudu (Nelson, 2006).
Hasil penelitian Heinicke seperti yang dikutip oleh Wang et al. (2002)
menunjukkan bahwa mengkudu mengandung prekursor alami xeronine
(proxeronin). Proxeronine diubah menjadi xeronine di dalam tubuh oleh enzim
proxeroninase. Xeronine merupakan sejenis alkaloid yang mampu memodifikasi
struktur molekul protein. Jika protein mengalami kerusakan maka xeronine akan
berinteraksi dengan protein dan mengembalikan konformasinya ke bentuk yang
sesuai sehingga dapat berfungsi kembali. Senyawa ini juga banyak terdapat pada
bromelain (nenas). Bangun dan Sarwono (2002) juga menyebutkan bahwa dalam
jus buah mengkudu terdapat berbagai senyawa kimia dan enzim yang diduga
mampu bekerja sama secara sinergistik dalam menyembuhkan penyakit.
Daun mengkudu di Tonga digunakan sebagai pengempuk daging (Walter et
al., 2002), mirip dengan penggunaan daun papaya yang juga digunakan untuk
pengempuk daging. Penelitian pada papaya telah membuktikan protease (papain)
yang bertanggung jawab untuk pengempukkan daging. Protease pada daun
mengkudu sejauh ini belum ada yang melaporkan.
Selain hal tersebut diatas, perdagangan protease yang terus meningkat
setiap tahun ikut melatarbelakangi penelitian tentang pemurnian protease dari
daun mengkudu. Oleh karena itu pencarian sumber enzim merupakan potensi
usaha yang sangat potensial.
Tujuan Penelitian
Penelitian ini bertujuan :
1. Mengkarakterisasi sifat fisik dan kimia daun mengkudu pada dua tingkat
ketuaan yang berbeda.
2. Memurnikan protease dari daun mengkudu pada dua tingkat ketuaan yang
3. Menentukan bobot molekul protease dari mengkudu pada dua tingkat ketuaan
TINJAUAN PUSTAKA
Mengkudu (Morinda citrifoliaL.)
Mengkudu (Morinda citrifolia L.) dikenal secara komersial dengan sebutan
noni, banyak ditemukan di sepanjang Kepulauan Pasifik. Mengkudu pada
mulanya berasal dari wilayah daratan Asia Tenggara dan kemudian menyebar
sampai ke Cina, India, Filipina, Hawaii, Tahiti, Afrika, Australia, Karibia, Haiti,
Fiji dan Florida. Mengkudu dikenal dengan berbagai nama yaitu mengkudu,
pace, kemudu, kudu (Jawa), cangkudu (Sunda), kodhuk (Madura), wengkudu
(Bali), noni (Hawaii), nono (Tahiti), nonu (Tonga), ungcoikan (Myanmar) dan
ach (Hindi), indian mulberry (Inggris), kikiri di pulau Solomon, kura di Fiji dan
lain-lain (Nelson, 2006).
Pengklasifikasian mengkudu adalah :
Filum : Angiospermae
Sub filum : Dycotiledones
Divisi : Lignosae
Famili : Rubiaceae
Genus :Morinda
Spesies :citrifolia
Mengkudu merupakan tanaman perdu atau pohon kecil yang tumbuh agak
membengkok dengan tinggi 3-8m, banyak bercabang dengan ranting persegi
empat. Letak daun berhadapan secara bersilang, bertangkai, bentuknya bulat telur
sampai berbentuk oval, panjang 10-40cm dengan lebar 5-17cm, tebal mengkilap,
tepi rata, ujung runcing, bagian pangkal menyempit, tulang daun menyirip dan
bewarna hijau tua (Wijayakusuma, 1998). Pohon mengkudu dapat dilihat pada
Gambar 1.
Mengkudu dapat tumbuh dalam lingkungan yang kurang subur, tanah yang
asam dan basa baik tanah kering maupun basah. Semua bagian tanaman
mengkudu mempunyai manfaat dibidang kesehatan maupun industri. Akar dan
kulit pohon digunakan untuk pewarna dan obat, batang untuk kayu bakar dan
membuat peralatan, serta daun dan buah yang dijadikan sebagai makanan dan
serta triptofan (EFSA, 2008). Hal yang sama juga dinyatakan oleh Wijayakusuma
(1998) bahwa daun mengkudu mengandung protein, zat kapur, zat besi, karoten
dan askorbat, selain itu juga mengandung asam kapron dan kaprilat yang mudah
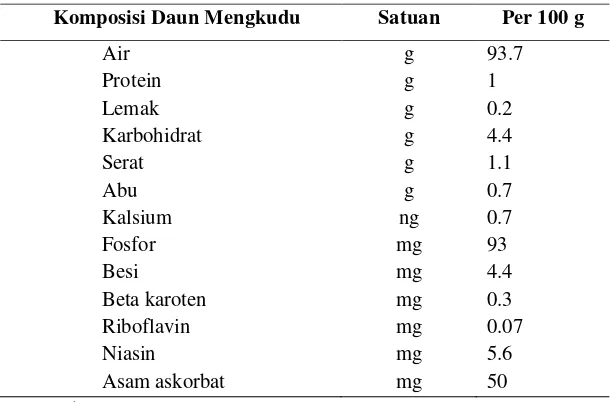
[image:32.612.133.438.187.388.2]menguap. Komposisi kimia daun mengkudu dapat dilihat pada Tabel 1.
Tabel 1. Komposisi Kimia Daun Mengkudu (mentah)
Komposisi Daun Mengkudu Satuan Per 100 g
Air g 93.7
Protein g 1
Lemak g 0.2
Karbohidrat g 4.4
Serat g 1.1
Abu g 0.7
Kalsium ng 0.7
Fosfor mg 93
Besi mg 4.4
Beta karoten mg 0.3 Riboflavin mg 0.07 Niasin mg 5.6 Asam askorbat mg 50 Sumber : EFSA (2008)
Protease Tumbuhan
Semua sel tumbuhan mengandung lebih dari 10.000 protein. Beberapa dari
protein ini mungkin tidak dibutuhkan lagi karena sudah tidak berfungsi. Beberapa
yang lain mungkin rusak selama sintesis atau karena kelebihan panas atau karena
stress lainnya. Lainnya beberapa enzim didisain berumur pendek karena hanya
dibutuhkan pada awal reaksi dan protein yang mengalamimisfolding. Alasan ini
membuat protein merupakan subjek untuk didegradasi oleh enzim proteolitik yang
disebut protease (Hopkin dan Norman (2004).
Degradasi protein adalah bentuk kegiatan menjaga sel atau pemeliharaan sel
dimana protein yang tidak diinginkan atau rusak diurai menjadi asam amino dan
dapat digunakan kembali. Biasanya hampir separuh protein penyusun sel diganti
setiap 4-7 hari. Protein didegradasi di beberapa bagian sel seperti kloroplas,
nukleus, mitokhondria, vakuola serta sitosol (Hopkin dan Norman, 2004).
Selama proses pelayuan tumbuhan, kadar total protein menurun seiring
Degradasi protein dan remobilisasi dari asam amino ke jaringan yang
berkembang merupakan proses metabolisme yang utama dalam proses pelayuan
(Nooden, 2004).
Klasifikasi Protease
Naz (2002) mengklasifikasikan protease menjadi beberapa subklas.
Diantaranya yaitu serin (EC. 3.4.21) memiliki residu ser pada sisi aktif, sistein
(EC.3.4.22) yang memiliki residu cys pada sisi aktif, aspartat (EC.3.4.23)
tergantung residu Asp pada aktifitas katalitiknya dan metalloprotease (EC.3.4.24)
yang menggunakan ion metal pada mekanisme katalitiknya.
Protease sistein menghidrolisa ikatan peptida protein dan dapat dihambat
oleh peraksi sulfidril. Protease sistein yang diambil dari tumbuhan diantaranya
papain dari pepaya (EC.3.4.4.10), fisin dari fig (EC.3.4.4.12), dan bromelain dari
nenas (EC.3.4.4.24). Protease sistein dipercaya sebagai protease utama yang
terlibat dalam hidrolisis protein. Protease sistein telah diidentifikasi dari pelayuan
daun, pelayuan bunga dan pematangan buah (Nooden, 2004).
Protease sistein atauthiol proteasememegang peranan penting dalam respon
tanaman menghadapi ransangan. Ransangan seperti protein rusak dan misfolded,
pathogen, suhu lingkungan seperti panas atau dingin, kekurangan air dan
lainnya. Protein rusak atau protein yang mengalamimisfolded harus dihilangkan
dengan degradasi protein dan digantikan oleh protein yang baru. Peristiwa
degradasi atau rusaknya protein selalu diikuti oleh penyusunan protein yang baru
(Grudkowska dan Zagdanska, 2004) .
Protease sistein muncul pada daun gandum sebagai respon menghadapi
kekurangan air seperti yang dilaporkan oleh Simova-Stoilova et al. (2010).
Forsthoefelet al. (1998) juga mengidentifikasi protease sistein yang muncul pada
daun Mesembryanthemum crystallinum dalam menghadapi tekanan lingkungan
yaitu salinitas yang tinggi.
Protease sistein juga terlibat dalam degradasi protein. Pada saat germinasi
biji barley, 42 protease terlibat dan 27 diantaranya adalah protease sistein (Zhang
Larkins, 1990) dan gandum (Bottari et al., 1996), 90% protease yang terlibat
dalam degradasi prolamin (protein utama sereal) adalah protease sistein.
Programmed cell death (PCD) adalah salah satu mekanisme pertahanan
tanaman menghadapi serangan patogen (Grudkowska dan Zagdanska, 2004).
Caspase-like proteinase merupakan protease sistein yang terlibat dalam PCD yang
ditemukan pada tembakau yang terinfeksi tobacco mosaic virus (Del Pozo dan
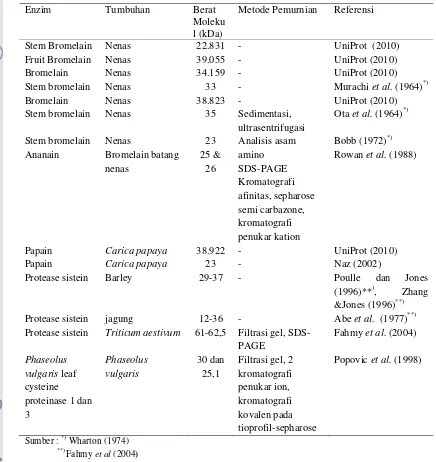
Lam, 1998). Di bawah ini (Tabel 2) adalah beberapa protease sistein yang telah
dikenal masyarakat.
Kelas protease yang lain adalah protease serin. Protease serin pun telah
diisolasi dan dimurnikan dari berbagai tanaman dan organ tanaman. Protease
serin ada di biji, buah bahkan getah tanaman. Protease serin yang berasal dari
biji diantaranya biji barley (Hordeum vulgare L cv Morex), kacang kedele
(Glycine max L. Merr) dan padi (Oryza sativa L). Protease serin yang diisolasi
dari getah diantaranya : Euphorbia supina, dandelion (Taraxacum officinale
Webb. SI.), dan nangka (Artocarpus heterophyllusL) (Antao dan Malcata, 2005).
Di bawah ini (Tabel 3) adalah beberapa protease serin yang telah diisolasi dari
berbagai tumbuhan.
Protease serin sangat berperanan dalam perkembangan dan pertumbuhan
tanaman. Fungsi protease serin pada tanaman diantaranya adalah respon tanaman
terhadap serangan pathogen yang mengakibatkan nekrosis dan kematian sel
sehingga pertumbuhan pathogen terganggu, pembelahan sel jaringan pada
tanaman, proses pelayuan, mikrosporogenesis dan sebagainya (Antao dan
Malcata, 2005).
Protease aspartat adalah kelas protease yang lain. Pepsin dan renin adalah enzim
yang tergolong ke dalam kelas protease aspartat. Pepsin mempunyai berat
molekul 35kDa dan disusun oleh rantai polipeptida tunggal yang terdiri dari 321
asam amino. Penggunaan renin dalam pembuatan keju telah dikenal luas (Naz,
2002).
Kelas protease yang lain adalah metaloprotease. Salah satu contoh
metaloprotease adalah termolisin. Termolisin diproduksi oleh Bacillus
stearothermophilus yang aktif dengan adanya ion Ca. Termolisin dan juga
dan fosfat yang sering digunakan dalam bahan tambahan pangan. Termolisin
[image:35.612.82.518.147.609.2]mempunyai berat molekul 34kDa (Naz, 2002).
Tabel 2. Beberapa Protease sistein Tanaman
Enzim Tumbuhan Berat Moleku l (kDa)
Metode Pemurnian Referensi
Stem Bromelain Fruit Bromelain Bromelain Stem bromelain Bromelain Stem bromelain Stem bromelain Ananain Papain Papain Protease sistein Protease sistein Protease sistein Phaseolus vulgarisleaf cysteine
proteinase 1 dan 3 Nenas Nenas Nenas Nenas Nenas Nenas Nenas Bromelain batang nenas Carica papaya Carica papaya Barley jagung Triticum aestivum Phaseolus vulgaris 22.831 39.055 34.159 33 38.823 35 23 25 & 26 38.922 23 29-37 12-36 61-62,5 30 dan 25,1 -Sedimentasi, ultrasentrifugasi Analisis asam amino SDS-PAGE Kromatografi afinitas, sepharose semi carbazone, kromatografi penukar kation
-Filtrasi gel, SDS-PAGE
Filtrasi gel, 2 kromatografi penukar ion, kromatografi kovalen pada tioprofil-sepharose UniProt (2010) UniProt (2010) UniProt (2010) Murachiet al.(1964)*) UniProt (2010) Otaet al.(1964)*)
Bobb (1972)*) Rowanet al.(1988)
UniProt (2010) Naz (2002)
Poulle dan Jones (1996)**), Zhang &Jones (1996)**) Abeet al. (1977)**)
Fahmyet al.(2004)
Popovicet al.(1998)
Sumber :*)Wharton (1974)
**)Fahmy
Tabel 3. Berbagai Protease serin dari Tumbuhan
Enzim Tumbuhan Metode Pemurnian Berat
Molekul (kDa) Referensi Plantagolisis Protease serin Cucumisin (EC 3.4.21.25) Protease serin Kiwano protease Protease B Protease serin Plantago maior C.melo L.
C. melo L.var.Prince
Cucurbita ficifolia
Cucumis metuliferus
E. supine
Triticum aestivumcv. Pro INTA Isla Verde
Amm sulfat, kromatografi afinitas pada bacitrasin-sepharose, kromatografi penukar ion pada mono-Q Amm sulfat, filtrasi gel, kromatografi penukar ion Kromatografi penukar ion pada CM-selulosa, filtrasi gel sephadex G-75
Amm. Sulfat, filtrasi gel pada sephacryl S-300, kromatografi penukar ion pada CM sepharose Amm sulfat, kromatografi penukar ion pada CM-sepharose
Kromatografi penukar ion pada DEAE-sepharose, filtrasi gel pada sepharil S-300
Amm sulfat, filtrasi gel pada sepharil S-200, kromatografi penukaranion pada kolom Q
19 26 54 60 78 80 110
Bogacheva (2001)*)
Nodaet al.(1994)*) Kaneda dan Tominaga (1975)*), Yamagata et al.(1989)*)
Curottoet al. (1989)*)
Uchikobaet al.(2001)*)
Arimaet al.(2000)*)
Robertset al.(2003)*)
Pemurnian Enzim
Pemurnian enzim bertujuan untuk memisahkan enzim yang diinginkan
dari senyawa lain yang tidak dikehendaki. Tahap-tahap pemurnian bergantung
pada tujuan akhir yaitu tujuan komersial atau penelitian. Enzim kasar atau yang
dimurnikan sebagian masih dapat digunakan untuk komersial, sedangkan enzim
murni atau hampir murni dikehendaki dalam penelitian atau dipakai dalam
produk analitik.Harris (1989) menyebutkan, minimal ada tiga strategi dalam
pemurnian enzim yang harus diperhatikan yaitu (1) kualitas; perlu tindakan untuk
mempertahankan aktifitas protein dengan cara mengurangi proteolisis dan
denaturasi, (2) kuantitas; pemakaian akhir dari protein murni akan menentukan
kuntitas enzim yang diperlukan, (3) ekonomis; merupakan hal penting bila akan
digunakan di industri atau diterapkan dalam skala laboratorium. Secara umum
pemurnian enzim dapat dibagi menjadi ekstraksi, pemekatan dan fraksinasi.
Ekstraksi Enzim
Ekstraksi bertujuan untuk memisahkan enzim dari sumbernya, yaitu
tanaman, hewan maupun mikroba. Adapun kelebihan enzim dari tanaman
diantaranya adalah terjaganya ketersediaan yaitu bisa dipanen berulang-ulang.
Menurut Bollag dan Edelstein (1991) metode yang bisa dipilih dalam ekstraksi
tanaman adalah blade homogenization atau blender maupun grinding
(penggerusan).
Buffer digunakan dalam proses ekstraksi enzim untuk menjaga pH
lingkungan sehingga diharapkan mampu meminimalkan denaturasi dan inaktivasi
enzim. Buffer ekstraksi dapat ditambah beberapa bahan kimia dengan tujuan
untuk mencegah kerusakan enzim. Bahan kimia yang bisa ditambahkan
diantaranya EDTA, gliserol dan lain-lain (Harris, 1989).
Pemekatan Enzim
Pemekatan enzim dilakukan untuk memisahkan konsentrat protein dari
komponen biomolekul lainnya diantaranya karbohidrat, lemak dan asam nukleat.
Metode analitik menggunakan pengendapan asam (misalnya asam trikloroasetat),
pengendapan organik (misalnya aseton atau etanol), dan imunopresipitasi yang
dapat menyebabkan denaturasi protein. Metode preparatif bertujuan untuk tetap
mempertahankan aktifitas enzim, misalnya menggunakan garam, pelarut organik,
polimer organik, ultrafiltrasi dan liofilisasi (Bollag dan Edelstein, 1991).
Prinsip presipitasi dengan garam adalah mengendapkan protein sehingga
protein terpisah dari komponen terlarut lainnya. Garam yang dapat digunakan
untuk presipitasi diantaranya ammonium sulfat dan sodium sulfat. Ammonium
sulfat lebih disukai karena solubilitasnya tinggi, harga murah, non toksik dan
tidak mempengaruhi struktur protein (Suhartono, 1989).
Sisa garam dari proses presipitasi enzim dihilangkan dengan cara dialisis
menggunakan kantong selofan dan ultrafiltrasi. Dengan demikian, konsentrat
enzim bebas garam dapat dimurnikan lebih lanjut dengan fraksinasi enzim (Bollag
dan Edelstein, 1991).
Fraksinasi enzim
Fraksinasi merupakan tahap akhir dalam pemurnian enzim, yang bertujuan
untuk memisahkan enzim dari protein non enzim lainnya. Metode fraksinasi
umum untuk pemurnian enzim, meliputi kromatografi kolom dan elektroforesis.
Elektroforesis adalah suatu teknik untuk memisahkan molekul-molekul
berdasarkan muatan dan berat molekul.
Elektroforesis gel poliakrilamid (PAGE = Poly Acrylamide Gel
Electrophoresis) merupakan metode yang sering digunakan dalam analisis sampel
biologis karena kemampuannya dalam memisahkan campuran protein yang
kompleks dengan baik dan resolusi yang tinggi (Bollag dan Edelstein, 1991).
Elektroforesis pada gel poliakrilamida adalah metode yang paling sering
digunakan untuk karakterisasi protein dan campuran protein, karena prosedur ini
relatif cepat dan sensitif.
Elektroforesis didefnisikan sebagai perpindahan partikel-partikel bermuatan
karena pengaruh muatan medan listrik. Mekanisme pada elektroforesis gel
poliakrilamida sodium dodesil sulfat (SDS-PAGE) adalah protein akan bereaksi
dengan SDS. Kompleks protein yang bermuatan negatif ini kemudian akan
terpisahkan berdasarkan muatan dan ukurannya secara elektroforesis di dalam
matriks gel. Berat molekul protein dapat diukur menggunakan protein standar
yang telah diketahui berat molekulnya dengan cara membandingkan nilai
mobilitas relatifnya (Rf) (Bollag dan Edelstein 1991).
Zimografi adalah teknik elektroforesis untuk menetapkan aktifitas enzim
secara in situ. Berbeda dengan SDS-PAGE, gel pemisah zimografi mengandung
substrat enzim yang akan dihidrolisis oleh enzim selama masa inkubasi. Enzim
dipisahkan dalam gel denaturasi (SDS), namun dalam kondisi tidak tereduksi.
Penambahan deterjen Triton X-100 akan melepaskan SDS sehingga protein
kembali melipat (renaturasi). Gel selanjutnya diwarnai sehingga molekul protein
yang memiliki aktifitas tampak sebagai pita bening. Metode zimografi bersifat
mudah, sensitif dan kualitatif dalam menganalisis aktifitas enzim. Adapun substrat
yang bisa digunakan untuk zimogram diantaranya kasein, gelatin dan lain-lain
(Leber dan Balkwill 1997).
Aplikasi Protease
Keunggulan utama penggunaan enzim pada proses industri adalah (a)
kespesifikan enzim terhadap substrat sehingga mampu menghasilkan produk
dalam jumlah maksimal dengan produk samping yang minimal, (b) enzim mampu
mereduksi konsumsi energi yang akan menurunkan Greenhouse Gas Emission
(GGE), (c) enzim juga mampu mereduksi konsumsi air dan produk limbah selama
proses industri berlangsung. Keunggulan enzim tersebut akan meminimalkan
resiko dan dampak proses indutri bagi kehidupan manusia dan lingkungan.
Enzim protease dimanfaatkan diantaranya untuk pembuatan keju, pengempuk
daging, penjernih bir, pembuatan hidrolisa protein kedele, penyembuh luka serta
terapi untuk tumor, pembengkakan dan penggumpalan darah.
Pembuatan keju
Contoh klasik penggunaan protease adalah untuk pembuatan keju (Naz,
2002). Pengolahan susu menjadi keju menggunakan enzim protease. Contoh
Renin bisa diperoleh dari lambung anak sapi dan mikroba. Aktifitas
penggumpalan kasein susu oleh renin berlangsung dengan hasil optimum
dibandingkan dengan protease lain seperti pepsin.
Kasein merupakan kompleks fosfoprotein yang membentuk suspensi koloid
yang terdiri dari α, β, γ dan kapa kasein. Renin menghidrolisa kapa kasein
hingga menimbulkan destabilisasi struktur koloid dan menimbulkan proses
penggumpalan α dan β kasein bila terdapat kalsium dan fosfat pada lingkungan.
Gumpalan ini merupakan jalinan molekul para kapa kasein dan makropeptida, air,
laktosa, mineral, globula lemak, vitamin dan sejumlah senyawa terlarut lainnya di
dalam gumpalan tersebut (Suhartono, 1989) dan (Naz, 2002). Enzim renin
mempunyai berat molekul sebesar 31kDa. Renin paling menonjol dalam
menggumpalkan kasein dibandingkan dengan protease lain (Suhartono, 1989).
Pengempuk daging
Penggunaan potease untuk pengempuk daging telah dilakukan dari zaman
dulu, yaitu menggunakan daun pepaya untuk mengempukkan daging. Setelah
diisolasi dan diteliti diketahui bahwa enzim yang berperanan dalam menguraikan
protein daging adalah protease. Protease yang diisolasi dari pepaya dikenal
dengan papain. Papain terdiri dari 102 asam amino berberat molekul 21kDa
dengan sisi aktif yang melibatkan histidin 159 dan sistein 25 (Suhartono, 1989).
Papain cocok digunakan untuk pengempuk daging karena aktif pada pH
daging. Enzim ini memotong protein daging pada sisi karboksil valin, lisin dan
arginin. Komponen yang paling aktif dari getah pepaya adalah kimopapain yang
aktif dalam lingkungan asam, optimum kimopapain adalah pH 5 dan sesuai
dengan pH daging.
Enzim protease yang diisolasi dari tanaman lain pun dapat juga digunakan
untuk melunakkan daging. Penelitian yang dilakukan oleh Naveenaet al. (2004)
yang memanfaatkan protease dari Cucumis trigonus Roxb (kachri) danZingiber
Penjernih bir
Pada proses pembuatan bir, papain diperlukan untuk menghilangkan protein
penyebab kekeruhan pada bir. Kekeruhan ini disebabkan oleh komplek yang
dibentuk oleh protein dan tanin (Naz, 2002).
Pembuatan Hidrolisa Protein Kedele
Penggunaan hidrolisa protein kedele di industri pangan telah meluas,
walaupun demikian sifat fungsional protein tersebut tidak selalu diinginkan.
Modifikasi enzimatis digunakan untuk menghasilkan protein dengan sifat
fungsional yang diinginkan (Naz, 2002). Hidrolisa protein kedele oleh protease
meningkatkan iso-electric solubilitydari 5% menjadi 42%, kapasitas emulsi dari
100mL/g menjadi 280mL/g danwhipping expansion dari 20% menjadi 200% bila
dibandingkan dengan protein kedele sebelum dihidrolisa (Naz, 2002).
Penyembuh Luka
Protease dibidang kesehatan pun telah populer digunakan. Bromelain
banyak digunakan dalam bidang kesehatan karena dapat bertindak sebagai
penyembuh luka (Maurer, 2001). Menurut Suhartono (1989) proteolitik berfungsi
untuk mengurangi cairan luka, nanah dan jaringan nekrosa yang timbul pada luka
bakar, luka operasi maupun luka lainnya. Substrat enzim ini adalah jaringan
fibrin, mukoprotein, kolagen dan sebagainya. Enzim menguraikan jaringan ini
sehingga bekas luka menjadi bersih dan licin. Biasanya tripsin diberikan
bersama-sama dengan antibiotika dalam bentuk salep.
Terapi untuk Pencernaan dan Kanker
Pada sebagian orang, enzim pencernaan tidak diproduksi atau dikeluarkan
dalam jumlah yang cukup sehingga mengganggu pencernaan makanan. Oleh
karena itu dilakukan pemberian tambahan enzim dari luar untuk membantu
masalah pencernaan tersebut. Enzim yang biasa digunakan untuk mengatasi
Bromelain dapat diserap oleh usus dan tidak kehilangan aktifitas biologinya.
Castell et al. (1997) membuktikan bahwa bromelain masih ada dalam plasma
darah setelah beberapa saat terapioral bromelain. Bromelain diambil dari batang
nenas dan diberikan secara oral pada laki-laki sehat sebanyak 3g per hari dan
dengan menggunakan immunoassay ditemukan 5.000pg bromelain dalam plasma
setelah 48 jam dan masih mempunyai aktifitas proteolitik. Oleh karena itu
bromelain dapat dikonsumsi secaraoralsaat terapi enzim.
Bromelain dapat dijadikan sebagai alternatif pengobatan kanker. Bromelain
sebagai obat anti kanker bermula pada pengalaman masyarakat Asia Tenggara
dalam menyembukan kanker. Maurer (2001) menyebutkan bahwa aktifitas anti
kanker bromelain tergantung pada aktifitas proteolitiknya.
Chobotova et al. (2010) menyatakan bahwa bromelain mempunyai aktifitas
sebagai anti kanker. Hasil penelitian Mantovani et al. (2008) dan Chen et al.
2008) seperti dikutip oleh Chobotova et al. (2010) menunjukkan bahwa
bromelain yang diuji secara in vitro pada sel tumor manusia (leukimia) dapat
menghambat aktifitas NF-kβ (neutrofil factor kappa β, sejenis darah putih).
Adapun target NF-kβ adalah cyclooxygenase (Cox-2) yang terlibat dalam sintesa
prostaglandin (PEG-2). Prostaglandin ini dapat memacu terjadinya kanker.
Bromelain dapat menghambat kanker, walaupun mekanisme detilnya belum
diketahui dengan jelas.
Terapi Inflamasi danBlood Clotting(Pembekuan Darah)
Suhartono (1989) menyebutkan bahwa proses inflamasi (peradangan/
pembengkakan) melibatkan senyawa biogenik amin seperti histamin dan serotonin
dari sel yang mengalami kerusakan. Senyawa biogenik amin menimbulkan
pembengkakan pembuluh darah kapiler. Enzim-enzim yang dibebaskan oleh sel
yang rusak akan mengaktifkan kinin sehingga pembuluh darah tetap membesar
dan permeabilitasnya meningkat, hal ini mengakibatkan terjadinya kebocoran
cairan sehingga terjadi odema. Keadaan odema ini dipertahankan oleh senyawa
fibrin dari peredaran darah. Jadi, proses pembengkakan melibatkan jaringan
Penelitian Netti et al. (1978), Smyth et al. (1962) dan Uhlig dan Seifert
(1981) seperti dikutip oleh Maurer (2001) menunjukkan bahwa bromelain paling
ampuh untuk pengobatan odema bila dibandingkan dengan pemberian obat-obatan
seperti indometasin, asam asetilsalisilat dan aescin.. Pemberian bromelain
dilakukan secara oral pada hewan percobaan. Bromelain menyebabkan
fibrinolisis dan merangsang penyerapan kembali cairan oleh darah.
Blood clotting atau proses penggumpalan darah atau pembekuan darah
adalah proses normal ketika kulit terluka sehingga tidak terrjadi pendarahan. Saat
kulit terluka, trombosit pecah dan menghasilkan trombokinase. Enzim
trombokinase akan merubah protrombin menjadi thrombin dengan adanya ion Ca
dan K. Trombin yang terbentuk akan merangsang fibrinogen membentuk
benang-benang fibrin. Adanya benang-benang fibrin menghambat sel-sel darah. Penyakit
trombosis atau penggumpalan darah (di luar keadaan normal) telah meningkatkan
mortalitas yang nyata di negara-negara Barat (Suhartono, 1989).
Pengobatan dapat dilakukan dengan obat anti koagulan dan pemberian
enzim protease. Pemberian enzim protease memanfaatkan daya proteolitiknya.
Bromelain yang diberikan secara oral pada tikus percobaan terbukti meningkatkan
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian dilaksanakan di Laboratorium Bioteknologi SEAFAST Centre,
Laboratorium Biokimia Pangan dan Laboratorium Kimia Pangan Departemen
Ilmu dan Teknologi Pangan, IPB pada bulan Februari hingga Juli 2010.
Bahan dan Alat
Bahan yang digunakan pada penelitian ini adalah daun mengkudu (Morinda
citrifoliaL.) dengan 2 tingkat ketuaan yaitu daun pangkal berwarna hijau tua dan
daun pucuk yang berwarna hijau agak muda (Gambar 1). Bahan kimia diantaranya
Na asetat (Merck), asam asetat (Merck), EDTA (Amersham Biosciences), gliserol
(Bio Basic Inc), polivinilpirolidon (PVP K 30), , β-mercaptoetanol (Bio Basic
Inc), es batu, akuades, akuabides (Ikapharmindo Putramas), silika gel 60 H
(Merck), ammonium sulfat (Merck), etanol (Merck), asam fosfat (Merck), asam
borat (Amersham Biosciences), boraks (Merck), kasein (Merck), NaOH (Merck),
HCl (Merck), tirosin (Merck), TCA (Merck), Na sulfit (Merck), asam sulfat
(Merck), CaCl2 (Merck), Na2CO3 (Merck), pereaksi folin ciocalteau (Sigma
Aldrich), marker BM rendah (Fermentas SM-0431), yaitu beta galaktosidase
116kDa, bovin serum albumin 66.2kDa, ovalbumin 45kda, laktat dehidrogenase
35kDa, RE ase Bsp 25kDa, beta laktoglobulin 18.4kDa dan lisozim 14.4kDa,
akrilamid (Applichem), buffer tris-HCL (Amersham Biosciences-Merck), SDS
(Bio Basic Inc), TEMED (N,N,N,N-tetrametilenetilen-diamina), APS (ammonium
persulfat), bromophenol blue, BSA serta kasein Hammerstein (Merck),
bromophenol blue(Bio Basic Inc), Coomassie Brilliant Blue R-250 (Applichem),
Coomassie Brilliant Blue G-250 (Bio Basic Inc).
Peralatan yang digunakan adalah hand blender Aletta A746, sentrifus
Hermle Z383K, oven, neraca analitik, seperangkat alat elektroforesis gel mini
protean 3 sel (Biorad), kantong dialisis Sigma D9652, freezer, spektrofotometer
UV-Vis, Shimadzu seri UV-2450,Quantity one(Biorad), penangas air, pengaduk
Daun mengkudu ↓
Penyortasian ↓
Pengering-anginan→ analisa proksimat ↓
Penambahan buffer sodium asetat pH 5 ( 5mM EDTA, 14mM 2-mercaptoetanol, 10% PVPP dan 10% gliserol (daun :buffer = 1:5 ; berat daun
10g) ↓
Penggilingan menggunakan blender (4 kali @ 15detik pada kecepatan tinggi) ↓
Penyaringan→Ampas ↓
Sentrifugasi filtrat pada 3775g (4oC), 30 menit→Ampas ↓
Supernatan (Ekstrak enzim kasar) * ↓
Penambahan silika gel 60 H 1.4%, divorteks 5 menit ↓
Sentrifugasi 3775g (4oC), 15 menit→Ampas ↓
Supernatan(Ekstrak Silika) * ↓
Penambahan ammonium sulfat 100% jenuh,diaduk denganmagnetic stirrer,30 menit
↓
Sentrifugasi 1972g (4oC), 30 menit →Supernatan* ↓
Endapan* ↓
Pelarutan dalam jumlah pelarut minimal ↓
Dialisis ↓ Dialisat*
↓
Elektroforesis SDS-PAGE, Zimogram ↓
[image:46.612.131.498.78.656.2]Pendugaan Kelas Protease
Gambar 3. Garis besar kerja penelitian
Ket: *Analisa kadar protein (Bradford, 1976) ) dan aktifitas protease (Bergmeyer dan Grassl,
Pemurnian Enzim
Tahap pemurnian enzim meliputi ekstraksi enzim kasar, penambahan silika,
pemekatan menggunakan garam ammonium sulfat jenuh, dialisis serta fraksinasi
enzim menggunakan Sodium Dodecil Sulfat Polyacrylamide Gel Electrophoresis
(SDS-PAGE) dan zimogram untuk mengetahui bobot molekul enzim protease.
Penelitian ini menggunakan buffer asetat pH 5, dicampur dengan EDTA
5mM, Polyvinyl pyrrolydone (PVP K 30) 10%, gliserol 10% dan β
-merkaptoethanol 14mM. Buffer yang diperlukan untuk ekstraksi disiapkan pada
hari yang sama dengan hari ekstraksi.
Sampel daun (10g) dipotong-potong dan ditambah buffer ekstraksi bersuhu
4oC (daun : buffer ekstraksi = 1 : 5), kemudian diblender dengan kecepatan tinggi
(4 x 15 detik) dengan wadah yang dikelilingi oleh es batu, selanjutnya disaring
menggunakan kain saring (2 lapis) dan filtrat disentrifus dingin 4oC 3775g (5900
rpm) selama 30 menit sehingga dihasilkan supernatan ekstrak enzim kasar.
Supernatan yang didapat ditambah dengan silika 1,4% dan divorteks selama 5
menit dan disentrifus 4oC pada 3775g (5900 rpm) selama 15 menit. Supernatan
yang dihasilkan adalah ekstrak hasil penambahan silika (ekstrak silika).
Supernatan yang didapat selanjutnya diendapkan menggunakan ammonium
sulfat 100% jenuh. Ammonium sulfat yang ditambahkan 100% dengan tujuan
untuk mengendapkan semua protein yang ada. Endapan enzim dipisahkan
menggunakan sentrifus dingin 4oC 1972,2g (3500 rpm). Endapan enzim
selanjutnya didialisis menggunakan kantung dialisis atau membran selulosa
Sigma seri D9652 dengan diameter 21mm, panjang 10cm.
Sebelum melakukan dialisis, kantung selulosa dipersiapkan terlebih dahulu.
Sepanjang 10cm kantung dialisis dicuci dengan air mengalir selama 3-4 jam,
kemudian direndam dalam larutan Na sulfit 0.3% selama 1 menit pada suhu 80oC.
Kantung dialisis dicuci menggunakan air bersuhu 60oC selama 2 menit dan
diasamkan dengan larutan asam sulfat 0,2%. Sisa asam dihilangkan dengan cara
membilas kantung dialisis menggunakan air bersuhu 60oC. Dialisis endapan
enzim dilakukan selama 5 jam dengan wadah dikelilingi dengan es batu. Setiap 1
zimogram untuk mengetahui bobot molekul protease (Bollag dan Edestein,
1991).
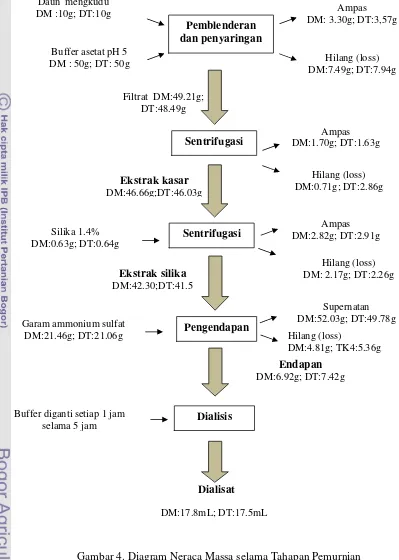
Setiap tahap pemurnian diukur massa yang masuk dan massa keluar dan
massa yang hilang (Gambar 4). Kehilangan massa terbesar terjadi pada saat
pemblenderan dan penyaringan karena ampas tertinggal di dalam blender dan
kertas saring.
Pengamatan
Kadar Air (AOAC, 1999)
Sejumlah sampel (1-2g) dimasukkan ke dalam cawan yang telah diketahui
beratnya. Kemudian cawan dimasukkan ke dalam oven bersuhu 105oC hingga
diperoleh berat yang konstan. Perhitungan kadar air dilakukan berdasarkan berat
basah dengan menggunakan rumus :
Kadar air ( %b/ b) = a − b
c × 100%
Dimana :
a = berat cawan dan sampel awal (g)
b = berat cawan dan sampel akhir (g)
c = berat sampel awal (g)
Kadar Protein (AOAC, 1999)
Sejumlah sampel (100-250mg) ditimbang ke dalam labu Kjeldahl. Kemudian
ditambahkan 1.9 ± 0.1g K2SO4, 40 ± 10mg HgO dan 2 ± 0.1ml H2SO4. Sampel
dididihkan selama 1-1.5 jam dengan kenaikan suhu secara bertahap sampai cairan
menjadi jernih, lalu didinginkan. Sejumlah kecil akuades diteteskan secara
perlahan lewat dinding labu kemudian labu digoyang pelan agar kristal yang
terbentuk larut kembali. Isi labu kemudian dipindahkan ke dalam alat destilasi
dan labu dibilas 5-6 kali dengan 1-2ml akuades. Selanjutnya ditambahkan 8-10ml
larutan 60% NaOH-5% Na2S2O3ke dalam alat destilasi. Erlenmeyer yang berisi
5ml H3BO3 dan 2 tetes indikator metilen red-metilen blue diletakkan di bawah
Gambar 4. Diagram Neraca Massa selama Tahapan Pemurnian (DM : daun pucuk, DT : daun pangkal)
Pemblenderan dan penyaringan
Sentrifugasi
Pengendapan
Daun mengkudu DM :10g; DT:10g
Buffer asetat pH 5 DM : 50g; DT: 50g
Ampas DM: 3.30g; DT:3,57g
Filtrat DM:49.21g; DT:48.49g
Ampas DM:1.70g; DT:1.63g
Garam ammonium sulfat DM:21.46g; DT:21.06g Dialisis Dialisat Ekstrak kasar DM:46.66g;DT:46.03g Endapan DM:6.92g; DT:7.42g Hilang (loss) DM:7.49g; DT:7.94g Hilang (loss) DM:0.71g; DT:2.86g Hilang (loss) DM:4.81g; TK4:5.36g
Sentrifugasi DM:2.82g; DT:2.91gAmpas
Hilang (loss) DM: 2.17g; DT:2.26g
Ekstrak silika DM:42.30;DT:41.5 DM:17.8mL; DT:17.5mL Silika 1.4% DM:0.63g; DT:0.64g Supernatan DM:52.03g; DT:49.78g
Destilasi dilakukan hingga diperoleh destilat sebanyak ±15ml. Destilat yang
diperoleh selanjutnya diencerkan hingga ± 50ml dan dititrasi dengan HCl
terstandar sampai terjadi perubahan warna menjadi abu-abu. Perhitungan kadar
protein dilakukan dengan rumus :
%N = [(ml HCl-ml blanko)
mg sampel × N HCl ×14.007 × 100
Kadar protein g protein
100g bahan basah = %N × 6.25
Kadar Abu (AOAC, 1999)
Sampel ditimbang 3.0g dalam cawan pengabuan, sampel diarangkan sampai
tidak berasap di oven. Sampel yang sudah menjadi arang dimasukkan pada tanur
600oC. Sampel yang sudah menjadi abu didinginkan dalam desikator dan
ditimbang.
Kadar abu ( %b b) =
berat abu
berat sampel × 100
Kadar Lemak (AOAC, 1999)
Labu lemak dikeringkan dengan oven, didinginkan dalam desikator dan
ditimbang sebelum digunakan. Sampel ditimbang 3.0g, dibungkus dengan kertas
saring dan diekstraksi soxhlet menggunakan pelarut heksan selama 6 jam. Labu
lemak hasil ekstraksi dioven, didinginkan dalam desikator dan ditimbang sampai
tercapai berat konstan.
Kadar lemak ( %b b) =
berat lemak
berat sampel×100
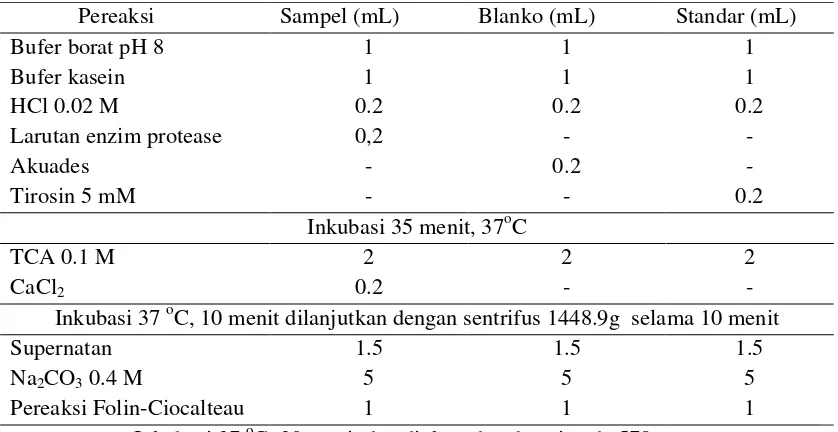
Aktifitas Enzim (Bergmeyer dan Grassl, 1983)
Aktifitas protease diukur mengikuti prosedur seperti pada Tabel 4. Pereaksi
disiapkan terlebih dahulu. Supernatan yang sudah diwarnai diukur absorbansinya
pada 578nm. Aktifitas protease dihitung berdasarkan rumus :
Aktiitas protease ( U mL) =
A sampel − Ablanko)
Dimana : A : absorbansi
T : waktu inkubasi (35 menit) FP: faktor pengenceran
Satu unit aktifitas protease didefinisikan sebagai jumlah enzim yang dapat
menghasilkan 1µmol produk tirosin per menit pada kondisi pengukuran.
Specific Activity(Harris dan Angal, 1989)
Specific activityatau aktifitas spesifik dihitung berdasarkan persamaan :
Speciic activity ( U mg) =
Aktiitas enzim ( U) total protein ( mg)
Recovery(%)(Harrris, 1989)
Recovery(%) dihitung berdasarkan persamaan :
Recover y % = total aktiitas enzim tahap ( n) total aktiitas enzim tahap ( n − 1)
Purification fold(Harris, 1989)
Purification folddihitung berdasarkan persamaan berikut :
Pur ii cat i on fold = speciic activity tahap ( n) speciic activity tahap ( n − 1)
Neraca Massa(Toledo, 1991)
Neraca massa dihitung berdasarkan prinsip jumlah massa yang masuk sama
dengan jumlah massa yang keluar. Neraca massa dihitung berdasarkan persamaan
berikut :
Tabel 4. Pengujian Aktifitas Enzim Metode Bergmeyer dan Grassl (1983)
Pereaksi Sampel (mL) Blanko (mL) Standar (mL)
Bufer borat pH 8 Bufer kasein HCl 0.02 M
Larutan enzim protease Akuades
Tirosin 5 mM
1 1 0.2 0,2 -1 1 0.2 -0.2 -1 1 0.2 -0.2 Inkubasi 35 menit, 37oC
TCA 0.1 M CaCl2 2 0.2 2 -2 -Inkubasi 37oC, 10 menit dilanjutkan dengan sentrifus 1448.9g selama 10 menit Supernatan
Na2CO30.4 M
Pereaksi Folin-Ciocalteau 1.5 5 1 1.5 5 1 1.5 5 1 Inkubasi 37oC, 20 menit dan diukur absorbansi pada 578 nm
Kadar Protein ( Bradford, 1976)
Sebelum mengukur absorbansi sampel, terlebih dahulu dipersiapkan blanko dan
standar sehingga dapat dibuat kurva standar yang digunakan untuk menghitung
konsentrasi protein sampel. Standar yang digunakan adalah BSA.
Untuk blanko, sebanyak 100ul akuades ditambahkan 5ml pereaksi Bradford
dan diukur absorbansinya pada 595nm. Pembuatan standar BSA untuk pembuatan
kurva standar adalah sebanyak 100ul larutan BSA (100-1000ug/ml) dipipet ke
dalam tabung reaksi berukuran 1.2 x 10cm. Kemudian ditambahkan 5ml pereaksi
Bradford. Larutan divorteks dan diukur secara spektrofotometri pada λ= 595nm
setelah 5 menit. Kurva standar yang diperoleh digunakan untuk mengukur
konsentrasi sampel daun pucuk dan daun pangkal.
Sampel yang akan dianalisa diambil sebanyak 100µL ditambah 5mL pereaksi
bradford, divortek dan didiamkan selama 5 menit, kemudian diukur absorbansi
Elektroforesis Gel dan Zimogram
SDS-PAGE
Untuk mengetahui bobot molekul protein yang terdapat pada endapan enzim
maka digunakan elektroforesis SDS-PAGE (Sodium Dodecil Sulfate
Polyacrylamide Gel Electrophoresis). Komposisi gel untuk SDS-PAGE dan
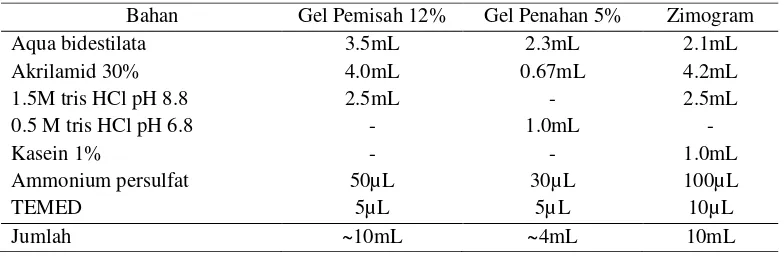
[image:53.612.106.498.249.378.2]zimogram dapat dilihat pada Tabel 5.
Tabel 5. Komposisi Gel Pemisah dan Gel Penahan SDS-PAGE dan Zimogram
Bahan Gel Pemisah 12% Gel Penahan 5% Zimogram Aqua bidestilata 3.5mL 2.3mL 2.1mL Akrilamid 30% 4.0mL 0.67mL 4.2mL 1.5M tris HCl pH 8.8 2.5mL - 2.5mL 0.5 M tris HCl pH 6.8 - 1.0mL
-Kasein 1% - - 1.0mL
Ammonium persulfat 50µL 30µL 100µL
TEMED 5µL 5µL 10µL
Jumlah ~10mL ~4mL 10mL
Pembuatan Gel
Disiapkan sepasang gel elektroforesis, yang terdiri dari gel pemisah
(separating gel) dan gel penahan (stacking gel). Bahan kimia yang diperlukan
untuk gel pemisah
disiapkan, dicampur, diaduk dengan pengaduk magnet, dan dengan cepat diisikan
ke dalam plat pembentuk gel. Gel akan terbentuk setelah 30-45
menit.Larutan-larutan untuk gel penahan disiapkan, dicampur dan diaduk dengan pengaduk
magnet dan diisikan pada plat pembentuk gel, di atas gel pemisah. Sisir disiapkan
pada larutan gel penahan yang akan mengalami polimerisasi untuk membentuk
sumur-sumur elektroforesis. Gel terbentuk setelah 15-30 menit.
Penyiapan Larutan Sampel dan Protein Marker
Protein sampel dan protein penanda masing-masing 40µL dicampur dengan
buffer sampel sebanyak 10µL dimasukkan dalam tabung eppendorf dan
diinjeksikan sebanyak 10µL dan 7µL untuk protein penanda.Protein sampel dan
penanda dimasukkan ke dalam sumur elektroforesis menggunakan Syringe
Hamilton.
RunningElektroforesis
Gel yang diisi dengan larutan sampel dan protein penanda dipasang pada
piranti elektroforesis. Sebanyak 400mL buffer elektroforesis dituangkan pada
tempatnya, sehingga permukaan gel terendam sedalam kira-kira 2cm.
Elektroforesis dijalankan dengan mengalirkan arus listrik 70V untuk dua gel.
Elektroforesis dihentikan setelah warna biru BPB mencapai kira-kira 0.5cm dari
batas bawah gel pemisah. Gel hasil elektroforesis dilepas dari plat menggunakan
spatula dan siap dilakukan pewarnaan protein.
Pewarnaan ProteinComassie Blue
Gel pemisah hasil elektroforesis direndam dalam larutan pewarna gel selama
20 menit sambil digoyang konstan pada mesin penggoyang. Kelebihan warna
dihilangkan dengan larutan peluntur warna sampai diperoleh pita-pita protein
berwarna biru dengan latar belakang jernih. Bobot molekul (BM) protein-protein
dalam sampel ditentukan dengan menghitung nilai Rf dari masing-masing pita
yang nampak, kemudian diplotkan pada kurva standar log BM terhadap Rf protein
penanda.
Pewarnaan dengan Silver Stain(Moertzet al. 2001)
Pewarnaan silver disebutkan 20-200 kali lebih sensitif dibanding pewarnaan
dengan comassie (CBB). Pewarnaan ini bisa mendeteksi 0.05-0.1ng/mm2 gel
protein (Harris dan Angal, 1989).
Zimogram
Pembuatan Gel
Disiapkan sepasang gel elektroforesis, yang terdiri dari gel pemisah dan gel
kimia yang diperlukan untuk gel pemisah disiapkan, dicampur, diaduk dengan
pengaduk magnet, dan dengan cepat diisikan ke dalam plat pembentuk gel. Gel
akan terbentuk setelah 30-45 menit.
Larutan-larutan untuk gel penahan disiapkan, dicampur dan diaduk dengan
pengaduk magnet dan diisikan pada plat pembentuk gel, di atas gel pemisah. Sisir
disiapkan pada larutan gel penahan yang akan mengalami polimerisasi untuk
membentuk sumur-sumur elektroforesis. Gel terbentuk setelah 15-30 menit.
Penyiapan Larutan Sampel dan Protein Marker
Protein sampel dan protein penanda masing-masing 40µl dicampur dengan
buffer sampel sebanyak 10µl dimasukkan dalam tabung eppendorf. Protein
sampel yang diinjeksikan sebanyak 18µL dan 15µL untuk protein penanda.Protein
sampel dan penanda dimasukkan ke dalam sumur elektroforesis menggunakan
Syringe Hamilton.
RunningElektroforesis
Gel yang diisi dengan larutan sampel dan protein penanda dipasang pada
piranti elektroforesis. Sebanyak 400mL buffer elektroforesis dituangkan pada
tempatnya, sehingga permukaan gel terendam sedalam kira-kira 2cm.
Elektroforesis dijalankan dengan mengalirkan arus listrik 70V untuk dua gel.
Elektroforesis dihentikan setelah warna biru BPB mencapai kira-kira 0.5cm dari
batas bawah gel pemisah. Gel hasil elektroforesis dilepas dari plat menggunakan
spatula dan siap dilakukan pewarnaan protein.
Inkubasi
Gel pemisah hasil elektroforesis direndam dalam larutan Triton X-100
2.5% selama 1 jam sambil digoyang pada mesin penggoyang. Setelah itu gel
direndam didalam larutan buffer asetat pH 5 dan diinkubasikan selama 1 jam dan
Pewarnaan ProteinComassie Blue
Gel pemisah hasil elektroforesis direndam dalam larutan pewarna gel selama
20 menit sambil digoyang konstan pada mesin penggoyang. Kelebihan warna
dihilangkan dengan larutan peluntur warna sampai diperoleh pita-pita protein
berwarna biru dengan latar belakang jernih. Bobot molekul (BM) protein-protein
dalam sampel ditentukan dengan menghitung nilai Rf dari masing-masing pita
yang nampak, kemudian diplotkan pada kurva standar log BM terhadap Rf protein
penanda.
Pendugaan Kelas Protease Daun Mengkudu
Tahap ini dilakukan untuk menduga kelas protease dari daun mengkudu.
Pendugaan dilakukan menggunakan literatur, studi pustaka dan bank data yang
HASIL DAN PEMBAHASAN
Karakteristik Daun Mengkudu
Pengamatan secara fisik pada daun mengkudu menunjukkan daun
mengkudu terlihat mengkilap. Daun pucuk berwarna hijau agak muda dan daun
pangkal (tua) berwarna hijau tua. Daun mengkudu terletak berhadapan satu sama
lain. Ukuran daun besar, tebal dan tunggal, tepi daun rata, urat daun menyirip dan
warna hijau mengkilap serta tidak berbulu.
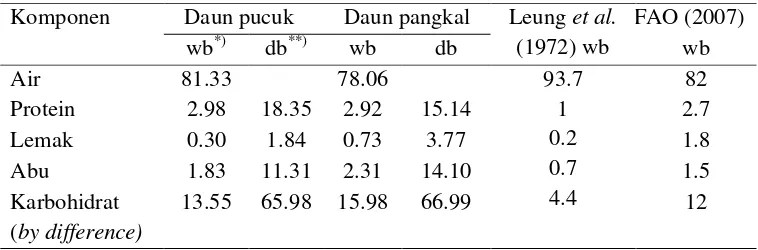
Hasil analisa komposisi kimia diperlihatkan pada Tabel 6. Perbedaan
komposisi daun mengkudu bila dibandingkan dengan hasil penelitian FAO
(2007) dan Leung et al. (1972) dapat terjadi karena perkembangan dan
pertumbuhan tanaman sangat dipengaruhi oleh faktor pertumbuhan dan
lingkungan tanam tanaman mengkudu (Rost et al., 2006) seperti air, unsur
[image:58.612.133.512.388.513.2]hara/tanah suhu, kelembaban dan lain-lain (Parker, 2004).
Tabel 6. Kadar Proksimat Daun Mengkudu (g/100g)
Komponen Daun pucuk Daun pangkal Leunget al. (1972) wb
FAO (2007)
wb*) db**) wb db wb
Air 81.33 78.06 93.7
1 0.2 0.7 4.4
82
Protein 2.98 18.35 2.92 15.14 2.7
Lemak 0.30 1.84 0.73 3.77 1.8
Abu 1.83 11.31 2.31 14.10 1.5
Karbohidrat (by difference)
13.55 65.98 15.98 66.99 12
Ket : *): basis basah **): basis kering
Kadar protein yang terukur pada daun pucuk dan daun pangkal mengkudu
memperlihatkan adanya perbedaan. Kadar protein daun pucuk sebesar 2.98
(%wb) sedikit lebih besar bila dibandingkan dengan daun pangkal yaitu 2.92
(%wb). Gan (2007) menyebutkan bahwa protein tanaman pada saat pelayuan akan
berkurang karena terjadinya degradasi protein seiring dengan meningkatnya
aktifitas enzim proteolitik. Degradasi protein adalah bentuk kegiatan menjaga sel
menjadi asam amino dan dapat digunakan kembali. Biasanya separuh protein
penyusun sel diganti setiap 4-7 hari (Hopkin dan Norman, 2004).
Degradasi protein dan remobilisasi dari asam amino ke jaringan yang
berkembang merupakan proses metabolisme yang utama dalam proses pelayuan.
Protease sistein dipercaya sebagai protease utama yang terlibat dalam hidrolisis
protein. Protease sistein telah diidentifikasi dari pelayuan daun, pelayuan bunga
dan pematangan buah (Nooden, 2004).
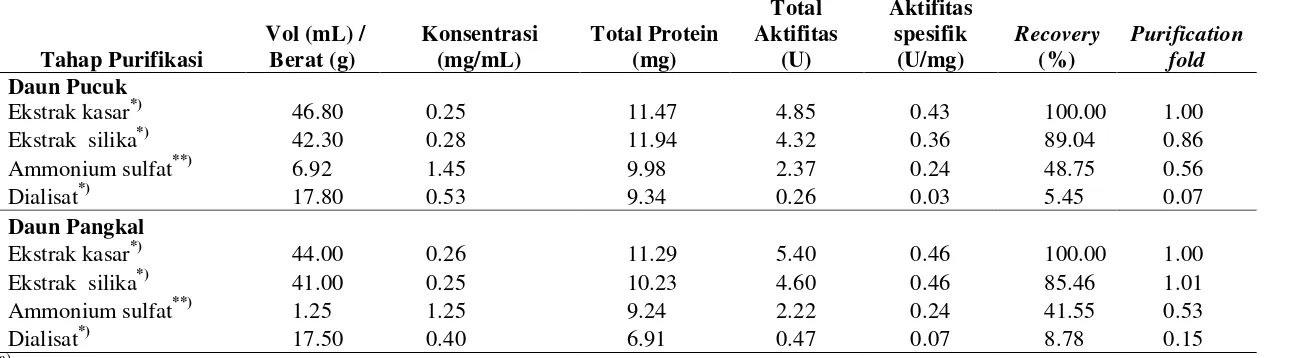
Pemurnian Protease pada Daun Mengkudu
Penelitian pemurnian protease dari daun mengkudu belum pernah
dilaporkan, oleh karena itu dalam penelitian ini ekstraksi dan tahapan pemurnian
protease merujuk pada penelitian yang hampir serupa yang pernah dilakukan pada
tanaman lain yaitu berdasarkan metode Piero and Petrone (1999) yang
mengekstrak protease serin dari daun selada dan metode Thomas et al. (2009)
yang mengekstrak enzim proteolitik dari pepaya (Carica papayacv Maradol) dan
dilakukan beberapa modifikasi menurut Bollag dan Edelstein (1991).
Harris (1989) menyebutkan bahwa pemurnian enzim dilakukan pada suhu
rendah (4-6oC)untuk meminimalkan terjadinya proteolisis. Buffer dan peralatan
sebelum digunakan didinginkan terlebih dahulu jika memungkinkan.
Daun mengkudu diekstrak menggunakan buffer asetat pH 5. Penggunaan
buffer asetat (pH 5) ini didapat berdasarkan hasil percobaan pada penelitian
pendahuluan. Pengukuran pH dilakukan pada perbandingan terbaik antara air :
daun mengkudu sehingga dapat diblender (1:5). Buffer yang digunakan ditambah
dengan gliserol, β-merkaptoetanol, EDTA dan Polivinilpirolidon (PVPP).
EDTA termasukk senyawa pengkelat yang ditambahkan dengan tujuan untuk
mengikat ion metal yang terdapat pada buffer (Bollag dan Edelstein, 1991).
EDTA (ethylene diamine tetraacetic acid) yang bisa ditambahkan adalah 0.1-5mM
(Scopes, 1982).
Senyawa pereduksi ditambahkan dengan tujuan untuk mencegah terjadinya
oksidasi protein apabila sel tersebut dipecah dan berhubungan dengan oksigen.
Scopes (1987) menyebutkan bahwa senyawa pereduksi yang bisa ditambahkan
bahan, dalam penelitian ini digunakan merkaptoetanol 14mM. Konsentrasi
2-merkaptoetanol yang bisa digunakan adalah 5-20 mM (Harris, 1989).
Gliserol sering ditambahkan dalam tahap purifikasi untuk meminimalkan
kehilangan aktifitas enzim (Harris, 1989). Selain itu gliserol juga berfungsi untuk
menstabilkan protein selama penyimpanan (Scopes, 1987). Gliserol mereduksi
aktifitas air dalam larutan sehingga mereduksi denaturasi protein. Penambahan
gliserol bisa mencapai 10-50%. Pada penelitian ini gliserol yang ditambahkan
10% (v/v). Penyimpanan dengan penambahan gliserol membuat protein tidak
mengalami pembekuan walaupun disimpan pada suhu rendah (Bollag dan
Edelstein, 1991).
Polivinilpirolidon ditambahkan dalam buffer dimaksudkan untuk mengikat
senyawa polifenol yang menyebabkan warna coklat pada ekstrak daun mengkudu.
Bila sel dipecahkan senyawa fenol yang ada di vakuola daun akan berinteraksi
dengan polifenol oksidase dan akan membentuk senyawa kuinon. Senyawa ini
juga akan menghambat aktifitas enzim. Menurut Hartley (1989) PVPP dapat
berikatan dengan tanin yang merupakan salah satu senyawa fenol. Hasil penelitian
Zinet al.(2006) menunjukkan daun mengkudu mempunyai kandungan total fenol
tinggi yaitu ± 8342µg/g daun, sedangan buah mengandung total fenol 119.9µg/g
buah dan akar sebesar 285µg/g akar.
Ekstraksi daun mengkudu dilakukan dengan blender. Saat destruksi daun
mengkudu menggunakan blender menghasilkan buih. Terjadinya buih tidak dapat
dihindari. Setelah diekstrak menggunakan blender, cairan ekstrak enzim disaring
menggunakan kain saring dan didapatkan filtrat hasil penyaringan berwarna
coklat kehijauan. Warna hijau disebabkan oleh klorofil daun.
Setelah disentrifus selama setengah jam, klorofil daun terpisah dalam
endapan berwarna hijau. Hal ini diakibatkan oleh pengikatan ion logam Mg yang
ada pada klorofil daun oleh EDTA sehingga klorofil terdegradasi. Supernatan
yang dihasilkan berwarna coklat. Pada tahap ini ekstrak kasar diukur kadar
protein dan aktifitas enzim. Nilai absorbansi untuk kadar protein pada saat
pengukuran bernilai negatif. Diduga warna coklat yang terbentuk menghambat
Warna coklat pada ekstrak kasar daun mengkudu diduga diakibatkan oleh
polifenol yang masih tinggi terdapat dalam ekstrak kasar. Hartley (1989)
menyebutkan bahwa kontaknya senyawa fenolik yang ada di vakuola dengan
polifenoloksidase akibat dirusaknya sel daun oleh homogenisasi akan
terbentuknya warna coklat oleh melanin dan merupakan inhibitor bagi enzim.
Menurut Vedralova et al.(1987) melanin yang terbentuk akibat pencoklatan bisa
mempengaruhi pembacaan absorbansi hingga 40%.
Penambahan silika dimaksudkan untuk mengikat polifenol yang masih
ada. Silika gel adalah senyawa polar yang digunakan untuk memisahkan
komponen yang dapat dipolarkan seperti hidrokarbon aromatik dan campuran
solut yang kurang polar seperti fenol, ester dan eter alifatik (Adnan, 1991).
Penambahan silika dilakukan pada dua tingkat konsentrasi yaitu 1.4%(w/v) dan
4.1%(w/v). Pengamatan secara kasat mata memperlihatkan bahwa warna ekstrak
kasar dari daun pangkal dan daun pucuk yang coklat menjadi coklat muda.
Perbedaan juga terlihat pada nilai kadar protein dan aktifitas protease yang diukur.
Ekstrak kasar enzim dengan penambahan silika 1.4% dan 4.1% memberikan nilai
aktifitas protease yang sama tetapi kadar protein untuk silika 1.4% lebih kecil
dibandingkan penambahan silika 4.1% sehingga konsentrasi silika yang dipilih
adalah 1.4%.
Pengendapan protein dilakukan untuk fraksinasi protein. Pengendapan
protein biasanya tidak mendenaturasi atau merusak aktifitas enzim dan akan
kembali aktif bila dilarutkan. Garam yang ditambahkan bisa menstabilisasi
protein sehingga tidak rusak atau terjadi proteolisis. Pengendapan protein ini
dilakukan pada suhu rendah dengan tujuan untuk mengurangi inaktivasi (Harris,
1989). Konsentrasi ammonium sulfat dinyatakan dengan persentase kejenuhan
karena diasumsikan kelarutan ammonium sulfat pada ekstrak sama dengan
kelarutannya pada air murni.
Pada penelitian ini ammonium sulfat digunakan 100% jenuh dengan tujuan