ABSTRAK
RISA SWANDARI WIJIHASTUTI. Optimasi Lingkungan Tumbuh Mikroalga dari Kawah Ratu Sukabumi yang Berpotensi sebagai Sumber Biodiesel. Dibimbing oleh TATIK CHIKMAWATI. dan MIFTAHUDIN.
Mikroalga berpotensi sebagai bahan baku biodiesel dan dapat dikulturkan dalam skala besar. Tujuan dari penelitian ini adalah untuk melakukan optimasi lingkungan tumbuh (konsentrasi nitrogen pada media dan intensitas cahaya) mikroalga asal Kawah Ratu Sukabumi yang berpotensi sebagai sumber biodiesel. Mikroalga yang telah diisolasi dan dikulturkan sebelumnya, diidentifikasi dan diperiksa kandungan lipidnya dengan menggunakan metode Nile Red. Mikroalga ini kemudian ditumbuhkan dalam media yang memiliki konsentrasi nitrogen yang berbeda (0, 187,5, 325 dan 750 ppm) dan intensitas cahaya yang berbeda (70, 105, 140 dan 175 µmol foton/m2/detik) selama 16 hari. Kandungan lipid diukur pada hari ke 16. Hasil percobaan menunjukkan bahwa hanya Chlorella sp. yang berhasil diisolasi dari Kawah Ratu yang berpotensi menjadi bahan baku biodiesel karena memiliki kandungan lipid yang cukup tinggi. Chlorella sp. dapat tumbuh maksimal pada media BG11 dengan konsentrasi penambahan nitrogen 750 ppm dan intensitas cahaya 70 µmol foton/m2 /detik dan produktivitas lipid tertinggi diproduksi (10,8 mg/l/hari) bila ditumbuhkan pada media BG11 yang juga memiliki intensitas cahaya 70 µmol foton/m2 /detik.
ABSTRACT
RISA SWANDARI WIJIHASTUTI. Optimization Growing Environment for Microalgae from Kawah Ratu Sukabumi that was Potential as a Source of Biodiesel. Supervised by TATIK CHIKMAWATI and MIFTAHUDIN.
1
PENDAHULUAN
Latar Belakang
Mikroalga merupakan alga yang berukuran mikroskopis, yang menyusun sebagian besar jenis dari alga. Di alam, selain dapat dimanfaatkan sebagai sumber makanan mikroalga juga mengambil peranan yang penting sebagai akumulator logam berat, eliminator CO2, dan juga berasosiasi dengan bakteri untuk mengikat nitrogen (Sheehan et al.
1998). Mikroalga juga memiliki potensi sebagai penghasil bahan baku biodiesel. Bahan bakar petrolium yang semakin menipis menyebabkan diperlukannya bahan bakar alternatif, salah satunya adalah biodiesel. Biodiesel telah menerima banyak perhatian pada beberapa tahun terakhir karena dapat terdekomposisi oleh dekomposer, dapat diperbaharui dan merupakan bahan bakar yang tidak beracun (Widjaja 2009). Bahan bakar ini juga memberikan lebih sedikit polusi dibandingkan bahan bakar petroleum dan dapat diperoleh dari hasil transesterifikasi dari minyak tumbuhan yang dalam hal ini dapat berasal dari mikroalga. Menggunakan mikroalga untuk memproduksi biodiesel tidak akan membahayakan ketersediaan bahan pangan, pakan hewan ternak dan produk lain yang berasal dari tanaman pangan (Chisti 2007).
Berdasarkan beberapa penelitian sebelumnya, mikroalga memiliki pertumbuhan yang cepat dan kemampuan yang sangat besar untuk menghasilkan minyak alami (lipid) sampai dengan 60% dari berat keringnya (NREL 1998). Mikroalga dapat tumbuh jauh lebih cepat dengan hanya membutuhkan lahan tumbuh yang lebih sedikit dibandingkan dengan tumbuhan tinggi (Widjaja 2009). Mikroalga biasanya menggandakan dirinya sekitar 24 jam sekali, namun pada fase eksponensial biasanya lebih singkat yaitu hanya 3,5 jam sekali (Chisti 2007). Mikroalga dapat tumbuh di tempat ekstrim seperti di air yang memiliki suhu tinggi dan pH rendah serta tahan terhadap cendawan dan bakteri (Griffith & Harrison 2008; Yani 2003). Karakter ini memungkinkan mikroalga untuk dikulturkan dalam skala besar sebagai bahan baku biodiesel.
Organisme ini dapat dijumpai di mana saja yang tersedia cukup cahaya, kelembaban dan unsur hara sederhana untuk memperpanjang hidupnya (Pelczar & Chan 1986). Cahaya merupakan faktor pembatas bagi organisme yang melakukan fotosintesis seperti mikroalga
(Campbell et al. 2002). Elemen penting dari unsur hara mikroalga diantaranya adalah fosfat yang merupakan komponen penting fosfolipid dan untuk sintesis asam nukleat dan nitrogen yang penting untuk sintesis asam amino dan protein (Ferrão-Filho et al. 2003). Sel mikroalga tumbuh pada suspensi cair, sehingga lebih efisien dalam mengakses air, CO2 dan unsur hara (Widjaja 2009).
Indonesia memiliki banyak sumber air panas, beberapa diantaranya terdapat di Jawa Barat seperti Kawah Ratu. Sumber-sumber air panas ini dapat menjadi sumber keanekaragaman hayati bagi mikroalga. Pada penelitian sebelumnya dengan menggunakan berbagai jenis mikroalga dari beberapa sumber air panas di Jawa Barat didapatkan pada umumnya mikroalga-mikroalga tersebut dapat menghasilkan lipid dengan baik pada taraf intensitas cahaya yang tertinggi yaitu 140 µmol foton/m2 /detik dan dengan taraf konsentrasi nitrogen terendah dari percobaan yaitu 750 ppm (Gunawan 2010). Pada penelitian tersebut juga telah dilakukan isolasi dan seleksi media untuk pertumbuhan mikroalga dari Kawah Ratu, namun belum dilakukan identifikasi jenis mikroalga dan percobaan modifikasi lingkungan tumbuh. Hal tersebut penting dilakukan untuk mengetahui jenis- jenis dan kebutuhan lingkungan tumbuh mikroalga yang akan dijadikan sebagai sumber biodiesel. Laporan ini menyajikan hasil identifikasi jenis mikroalga dan percobaan modifikasi lingkungan tumbuh mikroalga Chlorella asal Kawah Ratu, Sukabumi.
Tujuan
Penelitian ini bertujuan untuk mengidentifikasi dan melakukan optimasi lingkungan tumbuh dengan mengatur konsentrasi nitrogen pada media dan intensitas cahaya pada mikroalga asal Kawah Ratu, Sukabumi yang berpotensi sebagai sumber biodiesel.
BAHAN DAN METODE
Waktu dan Tempat
1
PENDAHULUAN
Latar Belakang
Mikroalga merupakan alga yang berukuran mikroskopis, yang menyusun sebagian besar jenis dari alga. Di alam, selain dapat dimanfaatkan sebagai sumber makanan mikroalga juga mengambil peranan yang penting sebagai akumulator logam berat, eliminator CO2, dan juga berasosiasi dengan bakteri untuk mengikat nitrogen (Sheehan et al.
1998). Mikroalga juga memiliki potensi sebagai penghasil bahan baku biodiesel. Bahan bakar petrolium yang semakin menipis menyebabkan diperlukannya bahan bakar alternatif, salah satunya adalah biodiesel. Biodiesel telah menerima banyak perhatian pada beberapa tahun terakhir karena dapat terdekomposisi oleh dekomposer, dapat diperbaharui dan merupakan bahan bakar yang tidak beracun (Widjaja 2009). Bahan bakar ini juga memberikan lebih sedikit polusi dibandingkan bahan bakar petroleum dan dapat diperoleh dari hasil transesterifikasi dari minyak tumbuhan yang dalam hal ini dapat berasal dari mikroalga. Menggunakan mikroalga untuk memproduksi biodiesel tidak akan membahayakan ketersediaan bahan pangan, pakan hewan ternak dan produk lain yang berasal dari tanaman pangan (Chisti 2007).
Berdasarkan beberapa penelitian sebelumnya, mikroalga memiliki pertumbuhan yang cepat dan kemampuan yang sangat besar untuk menghasilkan minyak alami (lipid) sampai dengan 60% dari berat keringnya (NREL 1998). Mikroalga dapat tumbuh jauh lebih cepat dengan hanya membutuhkan lahan tumbuh yang lebih sedikit dibandingkan dengan tumbuhan tinggi (Widjaja 2009). Mikroalga biasanya menggandakan dirinya sekitar 24 jam sekali, namun pada fase eksponensial biasanya lebih singkat yaitu hanya 3,5 jam sekali (Chisti 2007). Mikroalga dapat tumbuh di tempat ekstrim seperti di air yang memiliki suhu tinggi dan pH rendah serta tahan terhadap cendawan dan bakteri (Griffith & Harrison 2008; Yani 2003). Karakter ini memungkinkan mikroalga untuk dikulturkan dalam skala besar sebagai bahan baku biodiesel.
Organisme ini dapat dijumpai di mana saja yang tersedia cukup cahaya, kelembaban dan unsur hara sederhana untuk memperpanjang hidupnya (Pelczar & Chan 1986). Cahaya merupakan faktor pembatas bagi organisme yang melakukan fotosintesis seperti mikroalga
(Campbell et al. 2002). Elemen penting dari unsur hara mikroalga diantaranya adalah fosfat yang merupakan komponen penting fosfolipid dan untuk sintesis asam nukleat dan nitrogen yang penting untuk sintesis asam amino dan protein (Ferrão-Filho et al. 2003). Sel mikroalga tumbuh pada suspensi cair, sehingga lebih efisien dalam mengakses air, CO2 dan unsur hara (Widjaja 2009).
Indonesia memiliki banyak sumber air panas, beberapa diantaranya terdapat di Jawa Barat seperti Kawah Ratu. Sumber-sumber air panas ini dapat menjadi sumber keanekaragaman hayati bagi mikroalga. Pada penelitian sebelumnya dengan menggunakan berbagai jenis mikroalga dari beberapa sumber air panas di Jawa Barat didapatkan pada umumnya mikroalga-mikroalga tersebut dapat menghasilkan lipid dengan baik pada taraf intensitas cahaya yang tertinggi yaitu 140 µmol foton/m2 /detik dan dengan taraf konsentrasi nitrogen terendah dari percobaan yaitu 750 ppm (Gunawan 2010). Pada penelitian tersebut juga telah dilakukan isolasi dan seleksi media untuk pertumbuhan mikroalga dari Kawah Ratu, namun belum dilakukan identifikasi jenis mikroalga dan percobaan modifikasi lingkungan tumbuh. Hal tersebut penting dilakukan untuk mengetahui jenis- jenis dan kebutuhan lingkungan tumbuh mikroalga yang akan dijadikan sebagai sumber biodiesel. Laporan ini menyajikan hasil identifikasi jenis mikroalga dan percobaan modifikasi lingkungan tumbuh mikroalga Chlorella asal Kawah Ratu, Sukabumi.
Tujuan
Penelitian ini bertujuan untuk mengidentifikasi dan melakukan optimasi lingkungan tumbuh dengan mengatur konsentrasi nitrogen pada media dan intensitas cahaya pada mikroalga asal Kawah Ratu, Sukabumi yang berpotensi sebagai sumber biodiesel.
BAHAN DAN METODE
Waktu dan Tempat
2
Bahan Penelitian
Bahan yang digunakan dalam penelitian ini antara lain sampel mikroalga yang berasal dari Kawah Ratu Sukabumi yang telah melewati tahap isolasi dan seleksi media tumbuh serta telah dikulturkan, air dari kawah ratu-Sukabumi, media BG 11 (Lampiran 1), minyak Nile Red (9-diethylamino-5H-benzo {a} phenoxazine-5-one), metanol, khloroform dan air destilata bebas ion.
Metode
Pengujian Keseragaman Jenis dan Analisis Kualitatif Kandungan Lipid Mikroalga. Kultur stok mikroalga yang digunakan sebelumnya sudah melalui tahapan isolasi dan seleksi media tumbuh. Keseragaman diamati kembali untuk memastikan mikroalga masih sejenis. Beberapa preparat segar dibuat dari kultur stok mikroalga kemudian diamati di bawah mikroskop cahaya. Ada tidaknya kandungan lipid pada mikroalga diketahui melalui pembuatan preparat segar dari 1 ml sampel mikroalga yang diwarnai dengan 10 µl larutan stok Nile Red (1mg/ml) (Cooksey et al. 1987). Setelah 20-30 menit mikroalga yang telah terwarnai dapat diamati dibawah mikroskop flourescense dengan filter blue violet pada panjang gelombang 400-440 nm.
Identifikasi Sampel Mikroalga. Sampel mikroalga diidentifikasi dengan mengamati preparat segar di bawah mikroskop cahaya dengan perbesaran 1000x. Proses identifikasi dilakukan dengan bantuan buku kunci identifikasi yang berjudul “The Freshwater
Algae” karangan Prescott (1978) dan
“Introduction to The Algae” karangan Bold dan Wynne (1985).
Optimasi Lingkungan Tumbuh.
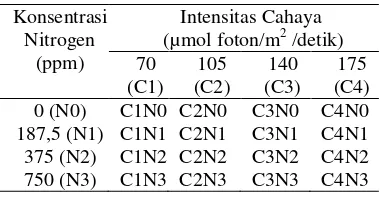
Percobaan ini merupakan percobaan faktorial yang disusun berdasarkan rancangan split plot dengan rancangan acak kelompok sebagai rancangan lingkungannya dengan dua ulangan. Terdapat dua faktor dalam percobaan yaitu intensitas cahaya (dengan empat taraf yaitu 70, 105, 140 dan 175 µmol foton/m2 /detik) sebagai petak utama dan konsentrasi Nitrogen (dengan empat taraf yaitu 0, 187,5 , 375, dan 750 ppm) sebagai anak petak. Kombinasi perlakuan disajikan pada Tabel 1.
Tabel 1 Kombinasi perlakuan faktorial 4 x 4 dari empat taraf konsentrasi nitrogen dan empat taraf intensitas cahaya.
Konsentrasi Nitrogen
(ppm)
Intensitas Cahaya (µmol foton/m2 /detik) 70 (C1) 105 (C2) 140 (C3) 175 (C4) 0 (N0) C1N0 C2N0 C3N0 C4N0 187,5 (N1) C1N1 C2N1 C3N1 C4N1 375 (N2) C1N2 C2N2 C3N2 C4N2 750 (N3) C1N3 C2N3 C3N3 C4N3
Masing-masing perlakuan ditumbuhkan pada botol serum 500 ml yang berisi 400 ml campuran air kawah dan media BG11 dengan komposisi sesuai dengan perlakuan nitrogen yang diberikan (Lampiran 2) dan 50 ml kultur stok alga yang kepadatan selnya sudah disamakan sebelumnya (Lampiran 3). Air yang berasal dari Kawah Ratu dianalisis untuk mengetahui kandungan mineralnya (Lampiran 4).
Peubah yang Diamati. Peubah yang diamati dibagi menjadi dua kelompok yaitu pertumbuhan dan kandungan lipid. Peubah pertumbuhan yang diamati adalah Optical Density (OD) dan bobot kering. Pengukuran OD mikroalga dilakukan pada panjang
gelombang (λ) 680 nm setiap dua hari sekali
selama 16 hari masa pengkulturan. Kandungan lipid mikroalga yang sudah ditumbuhkan dianalisis dengan metode ekstraksi seperti yang sudah dilakukan oleh peneliti sebelumnya (Gunawan 2010) dengan melakukan beberapa modifikasi yaitu perbedaan dalam jumlah kultur mikroalga yang diekstraksi, kecepatan dan lamanya waktu sentrifuse, serta jumlah pelarut kimia yang diberikan. Perbandingan warna kultur mikroalga dalam percobaan ini juga diamati untuk mendukung hasil percobaan (Lampiran 5).
Analisis Kandungan Lipid. Ekstraksi lipid dilakukan pada hari ke 16 dengan cara mengambil 100 ml kultur mikroalga dan disentrifuse dengan kecepatan 4000 rpm selama 25 menit pada suhu ruang. Pelet dikeringkan dengan oven selama 24 jam pada suhu 80°C, dan ditimbang sebagai bobot kering. Pelet kering disuspensikan dengan pelarut kimia yang terdiri dari 2 ml air destilata bebas ion, 5 ml methanol dan 2,5 ml khloroform lalu dihomogenkan dengan bantuan
3
khloroform kemudian dilakukan sentrifuse dengan kecepatan 4000 rpm selama 25 menit. Campuran lipid dan khloroform terbentuk dipisahkan dari bahan lainnya kemudian dipanaskan agar khloroform dapat menguap sehingga didapatkan lipid kering dan ditimbang sebagai bobot lipid. Persentase lipid dapat dihitung dengan rumus:
% lipid = bobot lipid x 100 Bobot kering mikroalga
Sedangkan produktivitas lipid dapat dihitung dengan rumus:
Produktivitas (g/ l/ hari) = (bobot lipid x 10) 16
Analisis Data. Data yang diperoleh dianalisis dengan analisis sidik ragam pada tingkat kepercayaan 95%. Apabila hasil analisis sidik ragam berpengaruh nyata maka akan dilanjutkan dengan uji Duncan.
HASIL
Tingkat Keseragaman Jenis, Analisis Kualitatif Kandungan Lipid dan Identitas Mikroalga
Pengujian keseragaman jenis pada kultur stok mikroalga penting dilakukan untuk memastikan mikroalga masih dalam keadaan satu jenis dan juga untuk menentukan metode yang kemudian akan dilakukan. Hasil pengujian keseragaman jenis menunjukkan bahwa mikroalga pada kultur stok dalam keadaan satu jenis (Gambar 1), maka tidak perlu dilakukan pengisolasian kembali dan dapat dilanjutkan dengan pengujian kandungan lipid.
Analisis kualitatif kandungan lipid pada mikroalga menentukan digunakan atau tidaknya mikroalga ini pada proses selanjutnya. Mikroalga yang berpendar karena memiliki kandungan lipid yang banyak (Gambar 1), berpotensi untuk dijadikan bahan baku pembuatan biodiesel. Dari hasil proses identifikasi, mikroalga yang berhasil diisolasi dari Kawah Ratu Sukabumi adalah Chlorella
sp.
(A) (B)
Gambar 1 Mikroalga dalam stok masih dalam keadaan seragam (Perbesaran 1000x) (A) Mikroalga terwarnai oleh Nile Red (perbesaran 100x) (B).
Kepadatan Sel Mikroalga
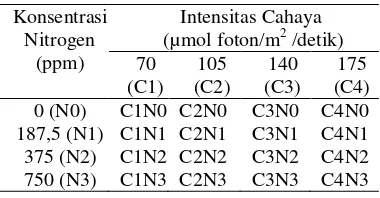
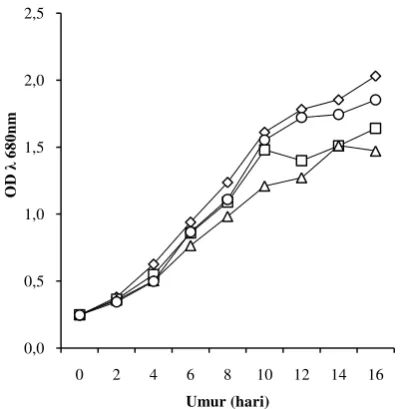
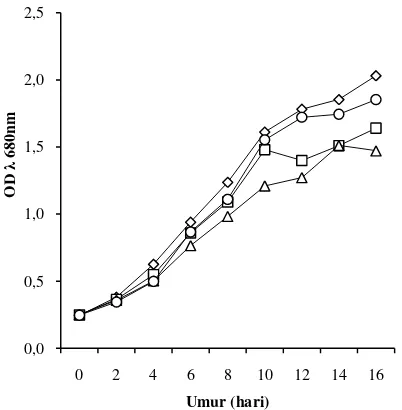
Pertumbuhan mikroalga dapat diamati dengan mengukur kepadatan sel nya (OD) menggunakan spektrofotometer pada panjang gelombang (λ) 680 nm. Pertumbuhan sel mikroalga selama 16 hari masa pengkulturan tinggi pada intensitas cahaya yang rendah (Gambar 2). Pertumbuhan mikroalga pada intensitas cahaya 105 µmol foton/m2 /detik memasuki fase statis lebih awal dibandingkan dengan mikroalga pada intensitas cahaya lainnya (Gambar 2).
Gambar 2 Pola pertumbuhan mikroalga pada berbagai intensitas cahaya, 70 µmol foton/m2 /detik, 105 µmol foton/m2 /detik, 140 µmol foton/m2 /detik, 175 µmol foton/m2 /detik 0,0 0,5 1,0 1,5 2,0 2,5
0 2 4 6 8 10 12 14 16
OD λ 6 8 0 n m Umur (hari)
3
khloroform kemudian dilakukan sentrifuse dengan kecepatan 4000 rpm selama 25 menit. Campuran lipid dan khloroform terbentuk dipisahkan dari bahan lainnya kemudian dipanaskan agar khloroform dapat menguap sehingga didapatkan lipid kering dan ditimbang sebagai bobot lipid. Persentase lipid dapat dihitung dengan rumus:
% lipid = bobot lipid x 100 Bobot kering mikroalga
Sedangkan produktivitas lipid dapat dihitung dengan rumus:
Produktivitas (g/ l/ hari) = (bobot lipid x 10) 16
Analisis Data. Data yang diperoleh dianalisis dengan analisis sidik ragam pada tingkat kepercayaan 95%. Apabila hasil analisis sidik ragam berpengaruh nyata maka akan dilanjutkan dengan uji Duncan.
HASIL
Tingkat Keseragaman Jenis, Analisis Kualitatif Kandungan Lipid dan Identitas Mikroalga
Pengujian keseragaman jenis pada kultur stok mikroalga penting dilakukan untuk memastikan mikroalga masih dalam keadaan satu jenis dan juga untuk menentukan metode yang kemudian akan dilakukan. Hasil pengujian keseragaman jenis menunjukkan bahwa mikroalga pada kultur stok dalam keadaan satu jenis (Gambar 1), maka tidak perlu dilakukan pengisolasian kembali dan dapat dilanjutkan dengan pengujian kandungan lipid.
Analisis kualitatif kandungan lipid pada mikroalga menentukan digunakan atau tidaknya mikroalga ini pada proses selanjutnya. Mikroalga yang berpendar karena memiliki kandungan lipid yang banyak (Gambar 1), berpotensi untuk dijadikan bahan baku pembuatan biodiesel. Dari hasil proses identifikasi, mikroalga yang berhasil diisolasi dari Kawah Ratu Sukabumi adalah Chlorella
sp.
(A) (B)
Gambar 1 Mikroalga dalam stok masih dalam keadaan seragam (Perbesaran 1000x) (A) Mikroalga terwarnai oleh Nile Red (perbesaran 100x) (B).
Kepadatan Sel Mikroalga
Pertumbuhan mikroalga dapat diamati dengan mengukur kepadatan sel nya (OD) menggunakan spektrofotometer pada panjang gelombang (λ) 680 nm. Pertumbuhan sel mikroalga selama 16 hari masa pengkulturan tinggi pada intensitas cahaya yang rendah (Gambar 2). Pertumbuhan mikroalga pada intensitas cahaya 105 µmol foton/m2 /detik memasuki fase statis lebih awal dibandingkan dengan mikroalga pada intensitas cahaya lainnya (Gambar 2).
Gambar 2 Pola pertumbuhan mikroalga pada berbagai intensitas cahaya, 70 µmol foton/m2 /detik, 105 µmol foton/m2 /detik, 140 µmol foton/m2 /detik, 175 µmol foton/m2 /detik 0,0 0,5 1,0 1,5 2,0 2,5
0 2 4 6 8 10 12 14 16
OD λ 6 8 0 n m Umur (hari)
4
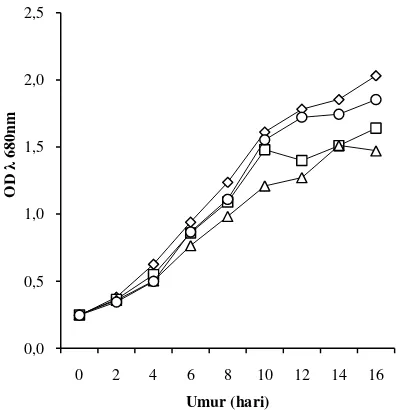
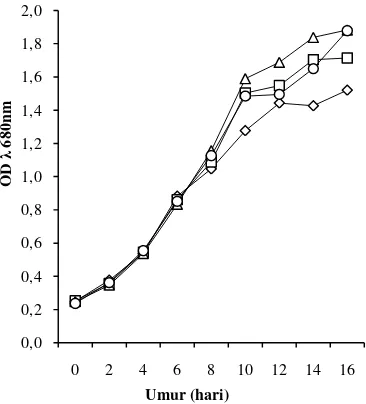
Kepadatan sel mikroalga cenderung lebih tinggi pada konsentrasi nitrogen yang tinggi, dan sebaliknya pertumbuhan mikroalga melambat pada konsentrasi nitrogen yang rendah (Gambar 3). Dari Gambar 3 juga dapat terlihat bahwa mikroalga pada konsentrasi nitrogen 0 ppm sudah mulai memasuki fase statis pada hari ke-12 walaupun air kawah tersebut mengandung beberapa unsur hara makro dan mikro (Lampiran 4), namun hal tersebut tidak terjadi pada mikroalga dengan konsentrasi nitrogen lainnya.
Gambar 3 Pola pertumbuhan mikroalga pada berbagai konsentrasi nitrogen, 0 ppm, 187,5 ppm, 375 ppm, 750 ppm.
Berdasarkan hasil analisis sidik ragam terhadap respon kepadatan sel pada hari ke 16, intensitas cahaya berpengaruh nyata pada kepadatan sel mikroalga (P = 0,024) (Lampiran 6). Mikroalga memiliki kepadatan sel yang tertinggi pada intensitas cahaya 70 µmol foton/m2 /detik (Tabel 2). Analisis sidik ragam juga menunjukkan bahwa konsentrasi nitrogen juga berpengaruh nyata pada kepadatan sel mikroalga (P = 0,043) (Lampiran 6). Mikroalga dapat tumbuh optimal pada konsentrasi nitrogen yang tinggi yaitu 375 dan750 ppm (Tabel 3), akan tetapi interaksi antara konsentrasi nitrogen dan intensitas cahaya tidak berpengaruh nyata terhadap kepadatan sel mikroalga (P = 0,485).
Perlakuan dari nitrogen dan intensitas cahaya juga berpengaruh pada warna dari kultur mikroalga. Warna pada kultur mikroalga dengan intensitas cahaya yang
rendah dan konsenrasi nitrogen yang tinggi cenderung berwarna lebih hijau dibandingkan dengan kultur mikroalga dengan intensitas cahaya dan konsentrasi nitrogen yang lainnya (Lampiran 5).
Tabel 2 Kepadatan sel, bobot kering dan produktivitas lipid mikroalga pada hari ke 16 pada intensitas cahaya yang berbeda.
Cahaya
(µmol foton/m2
/detik) Rata-rata Kepadatan Sel Bobot Kering (g/l) Produktivitas Lipid (mg/l/hari)
70 2,03c 0,98b 9,90b
105 1,64ab 0,77a 8,90ab
140 1,47a 0,67a 7,50a
175 1,85bc 1,04b 9,00ab
Keterangan : Angka yang diikuti huruf yang sama pada kolom yang sama tidak berbeda nyata pada uji
Duncan dengan taraf uji α =
0,05.
Tabel 3 Kepadaan sel pada hari ke 16 pada konsentrasi nitrogen yang berbeda.
Perlakuan Nitrogen (ppm)
Rata-rata Kepadatan Sel
0 1,52a
1,71ab 1,88b 1,88b 187,5 375 750
Keterangan : Angka yang diikuti huruf yang sama tidak berbeda nyata pada
uji Duncan dengan taraf uji α =
0,05.
Bobot Kering Mikroalga
Bobot kering dari mikroalga diukur pada waktu proses pengekstraksian lipid. Pengukuran ini penting dilakukan karena untuk mengukur persentase lipid pada mikroalga diperlukan data bobot kering. Berdasarkan analisis sidik ragam hanya intensitas cahaya (P = 0,004) saja yang mempengaruhi bobot kering mikroalga secara nyata sedangkan konsentrasi nitrogen (P = 0,222) dan interaksi antara intensitas cahaya dan konsentrasi nitrogen (P = 0,375) tidak menunjukkan pengaruh yang nyata terhadap bobot kering mikroalga (Lampiran 7). Bobot kering mikroalga tertinggi dihasilkan 0,0 0,2 0,4 0,6 0,8 1,0 1,2 1,4 1,6 1,8 2,0
0 2 4 6 8 10 12 14 16
5
pada intensitas cahaya 175 µmol foton/m2 /detik (Tabel 2).
Persentase Lipid Mikroalga
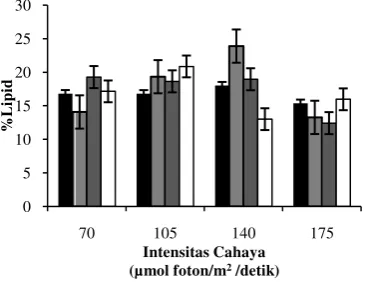
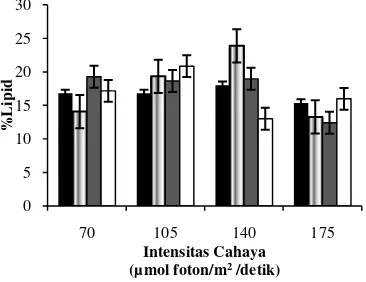
Mikroalga yang telah ditumbuhkan diukur persentase lipidnya pada hari ke 16. Analisis sidik ragam menunjukkan bahwa baik intensitas cahaya (P = 0,066) maupun konsentrasi nitrogen (P = 0,816) tidak mempengaruhi persentase lipid secara nyata. Namun interaksi antara keduanya mempengaruhi persentase lipid (P = 0,005) (Lampiran 8). Persentase lipid tertinggi dihasilkan pada konsentrasi nitrogen 187,5 ppm dan intensitas cahaya 140 µmol foton/m2 /detik (Gambar 4). Kisaran Presentasi lipid yang dihasilkan oleh mikroalga ini adalah 12,42% - 23,89%.
Gambar 4 Pengaruh interaksi konsentrasi nitrogen dan intersitas cahaya pada persentase lipid pada mikroalga pada hari ke 16. 0 ppm, 187,5 ppm, 375 ppm, 750 ppm.
Produktivitas Lipid Mikroalga
Produktivitas lipid merupakan jumlah rata-rata lipid yang dihasilkan mikroalga setiap harinya. Berdasarkan analisis sidik ragam hanya intensitas cahaya (P = 0,010) saja yang berpengaruh nyata terhadap produktivitas lipid (Lampiran 9). Produktivitas lipid tertinggi dihasilkan pada intensitas cahaya 70 µmol foton/m2 /detik (Tabel 2). Kisaran produktivitas lipid yang dihasilkan oleh mikroalga ini adalah 5,6 – 10,8 mg/l/hari.
PEMBAHASAN
Pada pengujian keseragaman jenis dan analisis kualitatif kandungan lipid serta
identifikasi jenis mikroalga diperoleh bahwa mikroalga dalam kultur masih dalam keadaan sejenis yaitu Chlorella sp. serta mempunyai kandungan lipid yang cukup tinggi. Sel
Chlorella merupakan sel berukuran kecil (2-12 µm), berbentuk bola atau elipsodial dan umumnya terisolasi secara individual (Bold & Wynne 1985). Chlorella sp. termasuk ke dalam divisi Chlorophyta yang merupakan divisi pendominasi perairan air tawar (Pelczar&Chan 1986). Kandungan lipid
Chlorella sp. cukup tinggi disebabkan karena mikroalga tersebut menyimpan cadangan makanan tidak hanya dalam bentuk pati tetapi juga dalam bentuk minyak (Pelczar&Chan 1986).
Kepadatan sel mikroalga yang tertinggi dihasilkan pada intensitas cahaya terendah yaitu 70 µmol foton/m2 /detik. Pada beberapa penelitian yang telah dilakukan intensitas cahaya terendah yang digunakan juga menghasilkan kepadatan sel yang lebih tinggi seperti pada penelitian Imamoglu et al. (2007) dengan mikroalga Haematococcus pluvialis
pada intensitas cahaya 50 µmol foton/m2 /detik dan pada penelitian Ghezelbash et al. (2008) dengan mikroalga Tetraselmis chuii pada intensitas cahaya 63 µmol foton/m2 /detik. Adapun pada penelitian Sorokin & Kraus (1958) dengan jenis Chlorella pyrenoidosa, Chlorella vulgaris, Scenedesmus obliquus,dan
Chlamydomonas reinhardti, kepadatan sel mikroalga tertinggi dihasilkan pada intensitas cahaya 500 footcandle atau hampir setara dengan 70 µmol foton/m2 /detik. Intensitas cahaya yang terlalu tinggi bisa saja menyebabkan terjadinya fotoinhibisi pada mikroalga (Imamoglu et al. 2007). Penghambatan fotosintesis oleh cahaya (fotoinhibisi) dapat diartikan sebagai penurunan kemampuan fotosintesis suatu organisme karena terlalu banyak menerima pencahayaan (Adir et al. 2003). Fotoinhibisi bisa terjadi karena organisme yang mengalaminya memiliki titik kompensasi cahaya yang rendah sehingga respon fotosintesisnya mencapai jenuh pada tingkat yang rendah pula, penghambatan fotosintesis ini dapat diikuti dengan rusaknya pigmen fotosintesis (Salisbury & Ross 1995).
Pada percobaan terlihat bahwa pertumbuhan mikroalga yang diteliti mengalami peningkatan seiring dengan meningkatnya konsentrasi nitrogen. Hasil ini sesuai dengan penelitian Gunawan (2010) dengan mikroalga jenis lain. Kepadatan sel tertinggi dihasilkan pada taraf konsentrasi nitrogen tertinggi. Nitrogen merupakan bahan 0 5 10 15 20 25 30
70 105 140 175
%
L
ip
id
6
penting penyusun asam amino, amida dan nukleoprotein, serta esensial untuk pembelahan sel dan pembesaran sel, dengan kata lain unsur ini penting untuk pertumbuhan (Gardner et al.
1991; Bold & Wynne 1985). Mikroalga yang kekurangan nitrogen (0 ppm), selain kepadatan selnya rendah juga memiliki warna yang kurang hijau dibandingkan dengan mikroalga dengan konsentrasi nitrogen lainnya (Lampiran 4). Hal ini mungkin disebabkan karena sel mengakumulasi dalam jumlah besar molekul-molekul klorofil ketika sumber nitrogen masih tersedia melimpah, kemudian ketika sumber nitrogen ekstraselular habis, sel akan mulai menggunakan klorofil sebagai sumber nitrogen intraselular yang berakibat klorofil yang ada di dalam sel akan berkurang (Li et al. 2008).
Klorofil mengandung nitrogen dan magnesium, bila persediaan unsur-unsur tersebut terbatas, klorofil mungkin tidak terbentuk (Gardner et al. 1991). Berkurangnya klorofil mengakibatkan organisme yang berfotosintesis seperti mikroalga kesulitan melakukan fotosintesis sehingga pertumbuhannya terganggu. Pada taraf konsentrasi nitrogen 0 ppm, mikroalga masih dapat tumbuh karena pada air Kawah Ratu yang digunakan untuk mencampur media juga mengandung nitrogen (Lampiran 5) sehingga mikroalga masih dapat tumbuh.
Mikroalga pada percobaan ini menghasilkan bobot kering yang tinggi pada intensitas cahaya yang tinggi, yaitu 175 µmol foton/m2 /detik. Ketika penetrasi cahaya baik, maka individu sel akan terpapar energi cahaya dalam jumlah yang besar sehingga menghasilkan senyawa metabolik lebih dari fotosintesis dan menjadi suatu akumulasi pada satu unit basis biomassa (Li et al. 2008).
Presentase lipid yang tinggi dihasilkan pada intensitas cahaya 175 µmol foton/m2 /detik dan konsentrasi nitrogen 187,5 ppm. Menurut Li et al. (2008) penerimaan energi cahaya dalam jumlah besar akan mengakibatkan adanya akumulasi metabolik di dalam sel yang dapat berupa lipid. Pada mikroalga akumulasi lipid merupakan penyimpanan energi. Salisbury dan Ross (1995) juga menyebutkan bahwa banyaknya cahaya yang diterima akan merangsang pembentukan lipid, karena proses ini memerlukan energi yang tinggi seperti energi cahaya. Pembatasan unsur hara, seperti nitrogen atau silika, diketahui dengan baik dapat meningkatkan kandungan lipid pada alga (Griffith & Harrison 2008). Pada proses penggunaan nitrogen, komponen sel yang mengandung nitrogen seperti klorofil dan protein akan menurun jumlahnya sedangkan
kandungan karbohidrat akan meningkat diikuti dengan meningkatnya kandungan lipid (Richardson et al. 1969). Sheehan et al. (1998) juga menyebutkan bahwa pada kondisi cekaman produksi semua komponen sel menurun, namun produksi minyak tetap tinggi sehingga terjadi pengakumulasian minyak dalam sel. Hasil ini juga sesuai dengan penelitian yang dilakukan oleh Li et al. (2008), dimana kandungan lipid yang dihasilkan mikroalga pada percobaan yang menggunakan
Neochloris oleoabundans lebih tinggi jika ditumbuhkan pada media yang memiliki konsentrasi nitrogen lebih rendah.
Produktivitas lipid tertinggi dihasilkan pada intensitas cahaya 70 µmol foton/m2 /detik. Walaupun persentase lipid tertinggi yang dihasilkan selama 16 hari masa pengkulturan adalah pada intensitas cahaya yang cukup tinggi (140 µmol foton/m2 /detik), produktivitas lipid tinggi justru dihasilkan pada taraf intensitas cahaya terendah, namun diikuti dengan pertumbuhan alga yang tinggi. Produktivitas lipid ini berkorelasi positif dengan kepadatan sel (r = 0,68) dan bobot kering (r = 0,68). Hubungan antara produktivitas lipid dengan pertumbuhan juga dapat terlihat pada penelitian sebelumnya oleh Widjaja (2009) dengan mikroalga jenis
Chlorella vulgaris produktivitas lipid yang tinggi pada awal pengkulturan diikuti dengan pertumbuhan yang tinggi, kemudian ketika pertumbuhan mikroalga tersebut menurun produktivitas lipid juga menurun.
Kepadatan sel yang dihasilkan pada intensitas cahaya 70 µmol foton/m2 /detik merupakan kepadatan sel yang tertinggi. Kepadatan sel yang tinggi ini diikuti dengan produktivitas lipid yang tinggi. Pada intensitas cahaya 70 µmol foton/m2 /detik bobot kering yang dihasilkan juga tinggi. Hal ini mungkin disebabkan karena jumlah sel dan produksi lipid yang juga tinggi. Fenomena tersebut tampaknya menjadi penyebab produksi lipid berkaitan erat dengan pertumbuhan.
SIMPULAN
6
penting penyusun asam amino, amida dan nukleoprotein, serta esensial untuk pembelahan sel dan pembesaran sel, dengan kata lain unsur ini penting untuk pertumbuhan (Gardner et al.
1991; Bold & Wynne 1985). Mikroalga yang kekurangan nitrogen (0 ppm), selain kepadatan selnya rendah juga memiliki warna yang kurang hijau dibandingkan dengan mikroalga dengan konsentrasi nitrogen lainnya (Lampiran 4). Hal ini mungkin disebabkan karena sel mengakumulasi dalam jumlah besar molekul-molekul klorofil ketika sumber nitrogen masih tersedia melimpah, kemudian ketika sumber nitrogen ekstraselular habis, sel akan mulai menggunakan klorofil sebagai sumber nitrogen intraselular yang berakibat klorofil yang ada di dalam sel akan berkurang (Li et al. 2008).
Klorofil mengandung nitrogen dan magnesium, bila persediaan unsur-unsur tersebut terbatas, klorofil mungkin tidak terbentuk (Gardner et al. 1991). Berkurangnya klorofil mengakibatkan organisme yang berfotosintesis seperti mikroalga kesulitan melakukan fotosintesis sehingga pertumbuhannya terganggu. Pada taraf konsentrasi nitrogen 0 ppm, mikroalga masih dapat tumbuh karena pada air Kawah Ratu yang digunakan untuk mencampur media juga mengandung nitrogen (Lampiran 5) sehingga mikroalga masih dapat tumbuh.
Mikroalga pada percobaan ini menghasilkan bobot kering yang tinggi pada intensitas cahaya yang tinggi, yaitu 175 µmol foton/m2 /detik. Ketika penetrasi cahaya baik, maka individu sel akan terpapar energi cahaya dalam jumlah yang besar sehingga menghasilkan senyawa metabolik lebih dari fotosintesis dan menjadi suatu akumulasi pada satu unit basis biomassa (Li et al. 2008).
Presentase lipid yang tinggi dihasilkan pada intensitas cahaya 175 µmol foton/m2 /detik dan konsentrasi nitrogen 187,5 ppm. Menurut Li et al. (2008) penerimaan energi cahaya dalam jumlah besar akan mengakibatkan adanya akumulasi metabolik di dalam sel yang dapat berupa lipid. Pada mikroalga akumulasi lipid merupakan penyimpanan energi. Salisbury dan Ross (1995) juga menyebutkan bahwa banyaknya cahaya yang diterima akan merangsang pembentukan lipid, karena proses ini memerlukan energi yang tinggi seperti energi cahaya. Pembatasan unsur hara, seperti nitrogen atau silika, diketahui dengan baik dapat meningkatkan kandungan lipid pada alga (Griffith & Harrison 2008). Pada proses penggunaan nitrogen, komponen sel yang mengandung nitrogen seperti klorofil dan protein akan menurun jumlahnya sedangkan
kandungan karbohidrat akan meningkat diikuti dengan meningkatnya kandungan lipid (Richardson et al. 1969). Sheehan et al. (1998) juga menyebutkan bahwa pada kondisi cekaman produksi semua komponen sel menurun, namun produksi minyak tetap tinggi sehingga terjadi pengakumulasian minyak dalam sel. Hasil ini juga sesuai dengan penelitian yang dilakukan oleh Li et al. (2008), dimana kandungan lipid yang dihasilkan mikroalga pada percobaan yang menggunakan
Neochloris oleoabundans lebih tinggi jika ditumbuhkan pada media yang memiliki konsentrasi nitrogen lebih rendah.
Produktivitas lipid tertinggi dihasilkan pada intensitas cahaya 70 µmol foton/m2 /detik. Walaupun persentase lipid tertinggi yang dihasilkan selama 16 hari masa pengkulturan adalah pada intensitas cahaya yang cukup tinggi (140 µmol foton/m2 /detik), produktivitas lipid tinggi justru dihasilkan pada taraf intensitas cahaya terendah, namun diikuti dengan pertumbuhan alga yang tinggi. Produktivitas lipid ini berkorelasi positif dengan kepadatan sel (r = 0,68) dan bobot kering (r = 0,68). Hubungan antara produktivitas lipid dengan pertumbuhan juga dapat terlihat pada penelitian sebelumnya oleh Widjaja (2009) dengan mikroalga jenis
Chlorella vulgaris produktivitas lipid yang tinggi pada awal pengkulturan diikuti dengan pertumbuhan yang tinggi, kemudian ketika pertumbuhan mikroalga tersebut menurun produktivitas lipid juga menurun.
Kepadatan sel yang dihasilkan pada intensitas cahaya 70 µmol foton/m2 /detik merupakan kepadatan sel yang tertinggi. Kepadatan sel yang tinggi ini diikuti dengan produktivitas lipid yang tinggi. Pada intensitas cahaya 70 µmol foton/m2 /detik bobot kering yang dihasilkan juga tinggi. Hal ini mungkin disebabkan karena jumlah sel dan produksi lipid yang juga tinggi. Fenomena tersebut tampaknya menjadi penyebab produksi lipid berkaitan erat dengan pertumbuhan.
SIMPULAN
7
tinggi pada media yang memiliki konsentrasi nitrogen 375 ppm. Konsentrasi Nitrogen dan Intensitas cahaya dapat cukup berpengaruh pada pertumbuhan dan produksi lipid mikroalga ini.
SARAN
Penelitian lebih lanjut akan lebih baik bila dilakukan dengan menggunakan air destilata sebagai bahan pencampuran media kultur sehingga tidak diperlukannya lagi air asal kawah agar pengkulturan secara masal dapat dilakukan dengan lebih mudah. Identifikasi sampai tingkat jenis dengan teknik molekular menggunakan gen 18S rDNA di perlukan untuk mengetahui spesies mikroalga. Penambahan kombinasi nitrogen dan fosfat dapat dilakukan pada penelitian lebih lanjut untuk mendapatkan hasil yang lebih baik.
DAFTAR PUSTAKA
Adir N, Zer H, Shochat S, Ohad I.2003. Photoinhibition – a historical perspective.
J Photosynthesis Research 76: 343–370. Bold HC, Wynne MJ. 1985. Introduction to the
algae. Structure and Reproduction. 2nd ed. New Jersey: Prentice-Hall Inc. Englewood Cliffs.
Campbell NA, Reece JB, Mitchell LG. 2002.
Biologi. Ed ke-5. Jilid ke-1. Lestari R, Adil EIM, Anita N, Andri, Wibowo WF, Manalu D, penerjemah; Safitri A, Simarmata L, Hardani HW, editor. Jakarta : Penerbit Erlangga. Terjemahan dari :
Biology-Fifth Edition.
Chisti Y. 2007. Research review paper biodiesel from microalgae. J Biotechnology Advances 25 : 294–306 Cooksey KE, Guckert JB, Williams SA,
Collis PR. 1987. Fluorometric determination of the neutral lipid content of microalgal cells using nile red. JMicrobiol Methods 6:333-345. Ferrão-Filho AS, Fileto C, Lopes NP, Arcifa
MS. 2003. Effects of essential fatty acids and N and P-limited algae on the growth rate of tropical cladocerans. J Freshwater Biol 48: 759–767
Gardner FP, Pearce RB, Mitchell RL. 1991.
Fisiologi Tanaman Budidaya. Susilo H, penerjemah; Jakarta: UI Pr. Terjemahan dari : Physiology of Crop Plants.
Ghezelbash F, Farboodnia T, Heidari R, Agh N. 2008. Effects of different salinities and luminance on growth rate of the green
microalgae Tetraselmis chuii. J Biol Sci
3(3) : 311-314
Griffiths JM, Harrison TLS. 2008. Lipid productivity as a key characteristic for choosing algal species for biodiesel production. J Appl Phycol 21(5) 493-507. Gunawan. 2010. Keragaman dan karakterisasi
mikroalga dari sumber air panas yang berpotensi sebagai sumber biodiesel [tesis]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Imamoglu E, Sukan FV, Dalay MC. 2007. Effect of Different Culture Media and Light Intensities on Growth of
Haematococcus pluvialis. J Natural Eng Sci 1 (3): 05-09
Li Y, Horsman M, Wang B, Wu N. 2008. Effect of nitrogen sources on cell growth and lipid accumulation of green alga
Neochloris oleoabundans. J Appl Microbiol Biotechnol. doi : 10.1007/s00253-008-1681-1
[NREL] National Renewable Energy Laboratory. 1998. A Look Back at the
U.S. Department of Energy’s Aquatic Species Program—Biodiesel from Algae. Colorado:NREL; (NREL Report).
Pelczar MJJr, Chan ECS. 1986. Dasar-Dasar Mikrobiologi. Volume ke-1. Hadioetomo RS, Imas T, Tjitrosomo SS, Angka SL, penerjemah; Jakarta: UI Pr. Terjemahan dari: Elements of Microbiology.
Presscot GW. 1978. How to Know the Freshwater Algae. 3rd edition. Iowa : Brown Company.
Richardson B, Orcutt, DM, Schwertner HA, Martinez CL, Wickline HE. 1969. Effects of nitrogen limitation on the growth and composition of unicellular algae in continuous culture. J Appl Microbiol 18(2) : 245-250
Salisbury FB, Ross CW. 1995. Fisiologi Tumbuhan. Jilid 1. Lukman DR, Sumaryono, penerjemah. Bandung: Penerbit ITB. Terjemahan dari: Plant Physiology.
Sheehan J, Dunahay T, Benemann J, Roessler P. 1998. A Look Back at the U.S. Department of Energy’s Aquatic Species Program—Biodiesel from Algae. The National Renewable Energy Laboratory, A national laboratory of the U.S. Department of Energy.
OPTIMASI LINGKUNGAN TUMBUH MIKROALGA DARI KAWAH
RATU SUKABUMI YANG BERPOTENSI SEBAGAI
SUMBER BIODIESEL
RISA SWANDARI WIJIHASTUTI
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
7
tinggi pada media yang memiliki konsentrasi nitrogen 375 ppm. Konsentrasi Nitrogen dan Intensitas cahaya dapat cukup berpengaruh pada pertumbuhan dan produksi lipid mikroalga ini.
SARAN
Penelitian lebih lanjut akan lebih baik bila dilakukan dengan menggunakan air destilata sebagai bahan pencampuran media kultur sehingga tidak diperlukannya lagi air asal kawah agar pengkulturan secara masal dapat dilakukan dengan lebih mudah. Identifikasi sampai tingkat jenis dengan teknik molekular menggunakan gen 18S rDNA di perlukan untuk mengetahui spesies mikroalga. Penambahan kombinasi nitrogen dan fosfat dapat dilakukan pada penelitian lebih lanjut untuk mendapatkan hasil yang lebih baik.
DAFTAR PUSTAKA
Adir N, Zer H, Shochat S, Ohad I.2003. Photoinhibition – a historical perspective.
J Photosynthesis Research 76: 343–370. Bold HC, Wynne MJ. 1985. Introduction to the
algae. Structure and Reproduction. 2nd ed. New Jersey: Prentice-Hall Inc. Englewood Cliffs.
Campbell NA, Reece JB, Mitchell LG. 2002.
Biologi. Ed ke-5. Jilid ke-1. Lestari R, Adil EIM, Anita N, Andri, Wibowo WF, Manalu D, penerjemah; Safitri A, Simarmata L, Hardani HW, editor. Jakarta : Penerbit Erlangga. Terjemahan dari :
Biology-Fifth Edition.
Chisti Y. 2007. Research review paper biodiesel from microalgae. J Biotechnology Advances 25 : 294–306 Cooksey KE, Guckert JB, Williams SA,
Collis PR. 1987. Fluorometric determination of the neutral lipid content of microalgal cells using nile red. JMicrobiol Methods 6:333-345. Ferrão-Filho AS, Fileto C, Lopes NP, Arcifa
MS. 2003. Effects of essential fatty acids and N and P-limited algae on the growth rate of tropical cladocerans. J Freshwater Biol 48: 759–767
Gardner FP, Pearce RB, Mitchell RL. 1991.
Fisiologi Tanaman Budidaya. Susilo H, penerjemah; Jakarta: UI Pr. Terjemahan dari : Physiology of Crop Plants.
Ghezelbash F, Farboodnia T, Heidari R, Agh N. 2008. Effects of different salinities and luminance on growth rate of the green
microalgae Tetraselmis chuii. J Biol Sci
3(3) : 311-314
Griffiths JM, Harrison TLS. 2008. Lipid productivity as a key characteristic for choosing algal species for biodiesel production. J Appl Phycol 21(5) 493-507. Gunawan. 2010. Keragaman dan karakterisasi
mikroalga dari sumber air panas yang berpotensi sebagai sumber biodiesel [tesis]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Imamoglu E, Sukan FV, Dalay MC. 2007. Effect of Different Culture Media and Light Intensities on Growth of
Haematococcus pluvialis. J Natural Eng Sci 1 (3): 05-09
Li Y, Horsman M, Wang B, Wu N. 2008. Effect of nitrogen sources on cell growth and lipid accumulation of green alga
Neochloris oleoabundans. J Appl Microbiol Biotechnol. doi : 10.1007/s00253-008-1681-1
[NREL] National Renewable Energy Laboratory. 1998. A Look Back at the
U.S. Department of Energy’s Aquatic Species Program—Biodiesel from Algae. Colorado:NREL; (NREL Report).
Pelczar MJJr, Chan ECS. 1986. Dasar-Dasar Mikrobiologi. Volume ke-1. Hadioetomo RS, Imas T, Tjitrosomo SS, Angka SL, penerjemah; Jakarta: UI Pr. Terjemahan dari: Elements of Microbiology.
Presscot GW. 1978. How to Know the Freshwater Algae. 3rd edition. Iowa : Brown Company.
Richardson B, Orcutt, DM, Schwertner HA, Martinez CL, Wickline HE. 1969. Effects of nitrogen limitation on the growth and composition of unicellular algae in continuous culture. J Appl Microbiol 18(2) : 245-250
Salisbury FB, Ross CW. 1995. Fisiologi Tumbuhan. Jilid 1. Lukman DR, Sumaryono, penerjemah. Bandung: Penerbit ITB. Terjemahan dari: Plant Physiology.
Sheehan J, Dunahay T, Benemann J, Roessler P. 1998. A Look Back at the U.S. Department of Energy’s Aquatic Species Program—Biodiesel from Algae. The National Renewable Energy Laboratory, A national laboratory of the U.S. Department of Energy.
8
green algae. J Plant Physiol 33 (2) : 109-113.
Widjaja A. 2009. Lipid production from microalgae as a promising candidate for biodiesel production. J Makara-Teknologi 13(1):47-51.
Yani AP. 2003. Identifikasi jenis-jenis mikroalga di sumber air panas sungai air putih zona penyanggah taman nasional kerinci seblat di kecamatan lebong utara propinsi Bengkulu. J Penelitian UNIB
OPTIMASI LINGKUNGAN TUMBUH MIKROALGA DARI KAWAH
RATU SUKABUMI YANG BERPOTENSI SEBAGAI
SUMBER BIODIESEL
RISA SWANDARI WIJIHASTUTI
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
RISA SWANDARI WIJIHASTUTI. Optimasi Lingkungan Tumbuh Mikroalga dari Kawah Ratu Sukabumi yang Berpotensi sebagai Sumber Biodiesel. Dibimbing oleh TATIK CHIKMAWATI. dan MIFTAHUDIN.
Mikroalga berpotensi sebagai bahan baku biodiesel dan dapat dikulturkan dalam skala besar. Tujuan dari penelitian ini adalah untuk melakukan optimasi lingkungan tumbuh (konsentrasi nitrogen pada media dan intensitas cahaya) mikroalga asal Kawah Ratu Sukabumi yang berpotensi sebagai sumber biodiesel. Mikroalga yang telah diisolasi dan dikulturkan sebelumnya, diidentifikasi dan diperiksa kandungan lipidnya dengan menggunakan metode Nile Red. Mikroalga ini kemudian ditumbuhkan dalam media yang memiliki konsentrasi nitrogen yang berbeda (0, 187,5, 325 dan 750 ppm) dan intensitas cahaya yang berbeda (70, 105, 140 dan 175 µmol foton/m2/detik) selama 16 hari. Kandungan lipid diukur pada hari ke 16. Hasil percobaan menunjukkan bahwa hanya Chlorella sp. yang berhasil diisolasi dari Kawah Ratu yang berpotensi menjadi bahan baku biodiesel karena memiliki kandungan lipid yang cukup tinggi. Chlorella sp. dapat tumbuh maksimal pada media BG11 dengan konsentrasi penambahan nitrogen 750 ppm dan intensitas cahaya 70 µmol foton/m2 /detik dan produktivitas lipid tertinggi diproduksi (10,8 mg/l/hari) bila ditumbuhkan pada media BG11 yang juga memiliki intensitas cahaya 70 µmol foton/m2 /detik.
ABSTRACT
RISA SWANDARI WIJIHASTUTI. Optimization Growing Environment for Microalgae from Kawah Ratu Sukabumi that was Potential as a Source of Biodiesel. Supervised by TATIK CHIKMAWATI and MIFTAHUDIN.
OPTIMASI LINGKUNGAN TUMBUH MIKROALGA DARI KAWAH
RATU SUKABUMI YANG BERPOTENSI SEBAGAI
SUMBER BIODIESEL
RISA SWANDARI WIJIHASTUTI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biologi
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul
: Optimasi Lingkungan Tumbuh Mikroalga dari Kawah Ratu
Sukabumi yang Berpotensi sebagai Sumber Biodiesel
Nama
: Risa Swandari Wijihastuti
NIM
: G34062569
Disetujui:
Pembimbing I
Pembimbing II
Dr. Ir. Tatik Chikmawati, M.Si. Dr. Ir. Miftahudin, M.Si.
NIP. 19640306 199002 2 001 NIP. 19620419 198903 1 001
Diketahui:
Kepala Departemen Biologi
Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Dr. Ir. Ence Darmo Jaya Supena, M.Si.
NIP. 19641002 198903 1 002
PRAKATA
Puji dan syukur penulis panjatkan ke-khadirat Allah SWT atas segala
rahmat dan hidayah-Nya sehingga karya ilmiah ini berhasil diselesaikan.
Penelitian yang dilaksanakan sejak bulan Februari hingga Oktober 2010 ini
berjudul Optimasi Lingkungan Tumbuh Mikroalga dari Kawah Ratu Sukabumi
yang Berpotensi sebagai Sumber Biodiesel. Penelitian ini sebagian besar didanai
oleh penelitian fundamental melalui DIPA IPB dengan nomor kontrak
90/13.24.4/SPK/BG-PD/2009 atas nama Dr. Ir. Tatik Chikmawati, M.Si.
Penulis mengucapkan terimakasih kepada Dr. Ir. Tatik Chikmawati, M.Si
dan Dr. Ir. Miftahudin, M. Si yang telah meluangkan waktu serta fikiran dalam
membimbing serta mengarahkan penulis hingga karya ilmiah ini selesai, kepada
Dr. Ir. Iman Rusmana, M.Si selaku dosen penguji yang telah memberikan saran
dan perbaikan untuk kesempurnaan karya ilmiah ini, serta seluruh staf Biologi
yang telah memberikan bantuan fasilitas dalam pelaksanaan penelitian.
Ungkapan terimakasih juga penulis sampaikan untuk Bapa, Ibu, Ndaru,
Issafalano atas segala do’a, pengertian serta kasih sayang yang selal
u tercurah
untuk penulis. Penulis juga mengucapkan terimakasih kepada seluruh
teman-teman Biologi, teman-teman-teman-teman di Pondok Mona, dan semua teman-teman maupun kerabat
yang saya tidak dapat sebutkan satu-persatu atas semua dukungan dan semangat
yang telah diberikan.
Penulis menyadari karya ilmiah ini masih jauh dari sempurna. Oleh karena
itu saran dan kritik yang membangun sangat penulis harapkan. Semoga karya
ilmiah ini bermanfaat.
Bogor, Februari 2011
RIWAYAT HIDUP
Penulis dilahirkan di Bandung pada tanggal 9 Oktober 1988 dari ayah
yang bernama Ir. Bambang Harijanto, MM dan ibu Dra. Aat Solihat. Penulis
merupakan putri pertama dari dua bersaudara.
Tahun 2006 penulis lulus dari SMA Negeri 67 Jakarta dan pada tahun
yang sama penulis lulus seleksi masuk IPB melalui jalur Undangan Seleksi Masuk
IPB. Penulis memilih program studi Biologi, Departemen Biologi, Fakultas
Matematika dan Ilmu Pengetahuan Alam.
DAFTAR ISI
Halaman
DAFTAR TABEL ...viii
DAFTAR GAMBAR ...viii
DAFTAR LAMPIRAN ... i
x
PENDAHULUAN... 1Latar Belakang ... 1
Tujuan... 1
BAHAN DAN METODE ... 1
Waktu dan Tempat ... 1
Bahan Penelitian ... 2
Pujian Keseragaman Jenis dan Analisis Kualitatif Kandungan Lipid Mikroalga ... 2
Identifikasi Sampel Mikroalga ... 2
Optimasi Lingkungan Tumbuh ... 2
Peubah yang Diamati ... 2
Analisis Kandungan Lipid ... 2
Analisis Data ... 3
HASIL ... 3
Pengecekan Keseragaman, Kandungan Lipid dan Identifikasi Sampel Mikroalga ... 3
Kepadatan Sel Mikroalga ... 3
Bobot Kering Mikroalga... 4
Persentase Lipid Mikroalga ... 5
Produktivitas Lipid Mikroalga ... 5
PEMBAHASAN ... 5
SIMPULAN ... 6
SARAN ... 7
DAFTAR PUSTAKA ... 7
DAFTAR TABEL
Halaman
1. Kombinasi perlakuan faktorial 4 x 4 dari empat taraf konsentrasi nitrogen dan empat taraf intensitas cahaya ………... 2
2. Kepadatan sel, bobot kering dan produktivitas lipid mikroalga pada hari ke 16 pada intensitas cahaya yang berbeda... 4
3. Kepadatan sel mikroalga pada hari ke 16 pada konsentrasi nitrogen yang berbeda 4
DAFTAR GAMBAR
Halaman
1. Mikroalga dalam stok masih dalam keadaan seragam (Perbesaran 1000x) Mikroalga terwarnai oleh Nile Red (perbesaran 100x) ... 3
2. Pola pertumbuhan mikroalga pada berbagai intensitas cahaya... 3
3. Pola pertumbuhan mikroalga pada berbagai konsentrasi nitrogen... 4
4. Pengaruh interaksi konsentrasi penambahan nitrogen dan intersitas cahaya pada
DAFTAR LAMPIRAN
Halaman
1. Komposisi Media BG11………... 10
2. Komposisi Campuran Media BG 11 dan Air Kawah Ratu ………. 11
3. Gambar Instalasi Kultur Mikroalga Pada Percobaan..………..….. 12
4. Hasil Analisis Air Kawah Ratu Sukabumi ………...……... 13
5. Perbandingan Kondisi Warna Kultur pada Konsentrasi Nitrogen dan Intensitas Cahaya yang Berbeda Hasil Analisis Air Kawah Ratu Sukabumi ………..
14
1
PENDAHULUAN
Latar Belakang
Mikroalga merupakan alga yang berukuran mikroskopis, yang menyusun sebagian besar jenis dari alga. Di alam, selain dapat dimanfaatkan sebagai sumber makanan mikroalga juga mengambil peranan yang penting sebagai akumulator logam berat, eliminator CO2, dan juga berasosiasi dengan bakteri untuk mengikat nitrogen (Sheehan et al.
1998). Mikroalga juga memiliki potensi sebagai penghasil bahan baku biodiesel. Bahan bakar petrolium yang semakin menipis menyebabkan diperlukannya bahan bakar alternatif, salah satunya adalah biodiesel. Biodiesel telah menerima banyak perhatian pada beberapa tahun terakhir karena dapat terdekomposisi oleh dekomposer, dapat diperbaharui dan merupakan bahan bakar yang tidak beracun (Widjaja 2009). Bahan bakar ini juga memberikan lebih sedikit polusi dibandingkan bahan bakar petroleum dan dapat diperoleh dari hasil transesterifikasi dari minyak tumbuhan yang dalam hal ini dapat berasal dari mikroalga. Menggunakan mikroalga untuk memproduksi biodiesel tidak akan membahayakan ketersediaan bahan pangan, pakan hewan ternak dan produk lain yang berasal dari tanaman pangan (Chisti 2007).
Berdasarkan beberapa penelitian sebelumnya, mikroalga memiliki pertumbuhan yang cepat dan kemampuan yang sangat besar untuk menghasilkan minyak alami (lipid) sampai dengan 60% dari berat keringnya (NREL 1998). Mikroalga dapat tumbuh jauh lebih cepat dengan hanya membutuhkan lahan tumbuh yang lebih sedikit dibandingkan dengan tumbuhan tinggi (Widjaja 2009). Mikroalga biasanya menggandakan dirinya sekitar 24 jam sekali, namun pada fase eksponensial biasanya lebih singkat yaitu hanya 3,5 jam sekali (Chisti 2007). Mikroalga dapat tumbuh di tempat ekstrim seperti di air yang memiliki suhu tinggi dan pH rendah serta tahan terhadap cendawan dan bakteri (Griffith & Harrison 2008; Yani 2003). Karakter ini memungkinkan mikroalga untuk dikulturkan dalam skala besar sebagai bahan baku biodiesel.
Organisme ini dapat dijumpai di mana saja yang tersedia cukup cahaya, kelembaban dan unsur hara sederhana untuk memperpanjang hidupnya (Pelczar & Chan 1986). Cahaya merupakan faktor pembatas bagi organisme yang melakukan fotosintesis seperti mikroalga
(Campbell et al. 2002). Elemen penting dari unsur hara mikroalga diantaranya adalah fosfat yang merupakan komponen penting fosfolipid dan untuk sintesis asam nukleat dan nitrogen yang penting untuk sintesis asam amino dan protein (Ferrão-Filho et al. 2003). Sel mikroalga tumbuh pada suspensi cair, sehingga lebih efisien dalam mengakses air, CO2 dan unsur hara (Widjaja 2009).
Indonesia memiliki banyak sumber air panas, beberapa diantaranya terdapat di Jawa Barat seperti Kawah Ratu. Sumber-sumber air panas ini dapat menjadi sumber keanekaragaman hayati bagi mikroalga. Pada penelitian sebelumnya dengan menggunakan berbagai jenis mikroalga dari beberapa sumber air panas di Jawa Barat didapatkan pada umumnya mikroalga-mikroalga tersebut dapat menghasilkan lipid dengan baik pada taraf intensitas cahaya yang tertinggi yaitu 140 µmol foton/m2 /detik dan dengan taraf konsentrasi nitrogen terendah dari percobaan yaitu 750 ppm (Gunawan 2010). Pada penelitian tersebut juga telah dilakukan isolasi dan seleksi media untuk pertumbuhan mikroalga dari Kawah Ratu, namun belum dilakukan identifikasi jenis mikroalga dan percobaan modifikasi lingkungan tumbuh. Hal tersebut penting dilakukan untuk mengetahui jenis- jenis dan kebutuhan lingkungan tumbuh mikroalga yang akan dijadikan sebagai sumber biodiesel. Laporan ini menyajikan hasil identifikasi jenis mikroalga dan percobaan modifikasi lingkungan tumbuh mikroalga Chlorella asal Kawah Ratu, Sukabumi.
Tujuan
Penelitian ini bertujuan untuk mengidentifikasi dan melakukan optimasi lingkungan tumbuh dengan mengatur konsentrasi nitrogen pada media dan intensitas cahaya pada mikroalga asal Kawah Ratu, Sukabumi yang berpotensi sebagai sumber biodiesel.
BAHAN DAN METODE
Waktu dan Tempat
2
Bahan Penelitian
Bahan yang digunakan dalam penelitian ini antara lain sampel mikroalga yang berasal dari Kawah Ratu Sukabumi yang telah melewati tahap isolasi dan seleksi media tumbuh serta telah dikulturkan, air dari kawah ratu-Sukabumi, media BG 11 (Lampiran 1), minyak Nile Red (9-diethylamino-5H-benzo {a} phenoxazine-5-one), metanol, khloroform dan air destilata bebas ion.
Metode
Pengujian Keseragaman Jenis dan Analisis Kualitatif Kandungan Lipid Mikroalga. Kultur stok mikroalga yang digunakan sebelumnya sudah melalui tahapan isolasi dan seleksi media tumbuh. Keseragaman diamati kembali untuk memastikan mikroalga masih sejenis. Beberapa preparat segar dibuat dari kultur stok mikroalga kemudian diamati di bawah mikroskop cahaya. Ada tidaknya kandungan lipid pada mikroalga diketahui melalui pembuatan preparat segar dari 1 ml sampel mikroalga yang diwarnai dengan 10 µl larutan stok Nile Red (1mg/ml) (Cooksey et al. 1987). Setelah 20-30 menit mikroalga yang telah terwarnai dapat diamati dibawah mikroskop flourescense dengan filter blue violet pada panjang gelombang 400-440 nm.
Identifikasi Sampel Mikroalga. Sampel mikroalga diidentifikasi dengan mengamati preparat segar di bawah mikroskop cahaya dengan perbesaran 1000x. Proses identifikasi dilakukan dengan bantuan buku kunci identifikasi yang berjudul “The Freshwater
Algae” karangan Prescott (1978) dan
“Introduction to The Algae” karangan Bold dan Wynne (1985).
Optimasi Lingkungan Tumbuh.
Percobaan ini merupakan percobaan faktorial yang disusun berdasarkan rancangan split plot dengan rancangan acak kelompok sebagai rancangan lingkungannya dengan dua ulangan. Terdapat dua faktor dalam percobaan yaitu intensitas cahaya (dengan empat taraf yaitu 70, 105, 140 dan 175 µmol foton/m2 /detik) sebagai petak utama dan konsentrasi Nitrogen (dengan empat taraf yaitu 0, 187,5 , 375, dan 750 ppm) sebagai anak petak. Kombinasi perlakuan disajikan pada Tabel 1.
Tabel 1 Kombinasi perlakuan faktorial 4 x 4 dari empat taraf konsentrasi nitrogen dan empat taraf intensitas cahaya.
Konsentrasi Nitrogen
(ppm)
Intensitas Cahaya (µmol foton/m2 /detik) 70 (C1) 105 (C2) 140 (C3) 175 (C4) 0 (N0) C1N0 C2N0 C3N0 C4N0 187,5 (N1) C1N1 C2N1 C3N1 C4N1 375 (N2) C1N2 C2N2 C3N2 C4N2 750 (N3) C1N3 C2N3 C3N3 C4N3
Masing-masing perlakuan ditumbuhkan pada botol serum 500 ml yang berisi 400 ml campuran air kawah dan media BG11 dengan komposisi sesuai dengan perlakuan nitrogen yang diberikan (Lampiran 2) dan 50 ml kultur stok alga yang kepadatan selnya sudah disamakan sebelumnya (Lampiran 3). Air yang berasal dari Kawah Ratu dianalisis untuk mengetahui kandungan mineralnya (Lampiran 4).
Peubah yang Diamati. Peubah yang diamati dibagi menjadi dua kelompok yaitu pertumbuhan dan kandungan lipid. Peubah pertumbuhan yang diamati adalah Optical Density (OD) dan bobot kering. Pengukuran OD mikroalga dilakukan pada panjang
gelombang (λ) 680 nm setiap dua hari sekali
selama 16 hari masa pengkulturan. Kandungan lipid mikroalga yang sudah ditumbuhkan dianalisis dengan metode ekstraksi seperti yang sudah dilakukan oleh peneliti sebelumnya (Gunawan 2010) dengan melakukan beberapa modifikasi yaitu perbedaan dalam jumlah kultur mikroalga yang diekstraksi, kecepatan dan lamanya waktu sentrifuse, serta jumlah pelarut kimia yang diberikan. Perbandingan warna kultur mikroalga dalam percobaan ini juga diamati untuk mendukung hasil percobaan (Lampiran 5).
Analisis Kandungan Lipid. Ekstraksi lipid dilakukan pada hari ke 16 dengan cara mengambil 100 ml kultur mikroalga dan disentrifuse dengan kecepatan 4000 rpm selama 25 menit pada suhu ruang. Pelet dikeringkan dengan oven selama 24 jam pada suhu 80°C, dan ditimbang sebagai bobot kering. Pelet kering disuspensikan dengan pelarut kimia yang terdiri dari 2 ml air destilata bebas ion, 5 ml methanol dan 2,5 ml khloroform lalu dihomogenkan dengan bantuan
3
khloroform kemudian dilakukan sentrifuse dengan kecepatan 4000 rpm selama 25 menit. Campuran lipid dan khloroform terbentuk dipisahkan dari bahan lainnya kemudian dipanaskan agar khloroform dapat menguap sehingga didapatkan lipid kering dan ditimbang sebagai bobot lipid. Persentase lipid dapat dihitung dengan rumus:
% lipid = bobot lipid x 100 Bobot kering mikroalga
Sedangkan produktivitas lipid dapat dihitung dengan rumus:
Produktivitas (g/ l/ hari) = (bobot lipid x 10) 16
Analisis Data. Data yang diperoleh dianalisis dengan analisis sidik ragam pada tingkat kepercayaan 95%. Apabila hasil analisis sidik ragam berpengaruh nyata maka akan dilanjutkan dengan uji Duncan.
HASIL
Tingkat Keseragaman Jenis, Analisis Kualitatif Kandungan Lipid dan Identitas Mikroalga
Pengujian keseragaman jenis pada kultur stok mikroalga penting dilakukan untuk memastikan mikroalga masih dalam keadaan satu jenis dan juga untuk menentukan metode yang kemudian akan dilakukan. Hasil pengujian keseragaman jenis menunjukkan bahwa mikroalga pada kultur stok dalam keadaan satu jenis (Gambar 1), maka tidak perlu dilakukan pengisolasian kembali dan dapat dilanjutkan dengan pengujian kandungan lipid.
Analisis kualitatif kandungan lipid pada mikroalga menentukan digunakan atau tidaknya mikroalga ini pada proses selanjutnya. Mikroalga yang berpendar karena memiliki kandungan lipid yang banyak (Gambar 1), berpotensi untuk dijadikan bahan baku pembuatan biodiesel. Dari hasil proses identifikasi, mikroalga yang berhasil diisolasi dari Kawah Ratu Sukabumi adalah Chlorella
sp.
(A) (B)
Gambar 1 Mikroalga dalam stok masih dalam keadaan seragam (Perbesaran 1000x) (A) Mikroalga terwarnai oleh Nile Red (perbesaran 100x) (B).
Kepadatan Sel Mikroalga
Pertumbuhan mikroalga dapat diamati dengan mengukur kepadatan sel nya (OD) menggunakan spektrofotometer pada panjang gelombang (λ) 680 nm. Pertumbuhan sel mikroalga selama 16 hari masa pengkulturan tinggi pada intensitas cahaya yang rendah (Gambar 2). Pertumbuhan mikroalga pada intensitas cahaya 105 µmol foton/m2 /detik memasuki fase statis lebih awal dibandingkan dengan mikroalga pada intensitas cahaya lainnya (Gambar 2).
Gambar 2 Pola pertumbuhan mikroalga pada berbagai intensitas cahaya, 70 µmol foton/m2 /detik, 105 µmol foton/m2 /detik, 140 µmol foton/m2 /detik, 175 µmol foton/m2 /detik 0,0 0,5 1,0 1,5 2,0 2,5
0 2 4 6 8 10 12 14 16
OD λ 6 8 0 n m Umur (hari)
4
Kepadatan sel mikroalga cenderung lebih tinggi pada konsentrasi nitrogen yang tinggi, dan sebaliknya pertumbuhan mikroalga melambat pada konsentrasi nitrogen yang rendah (Gambar 3). Dari Gambar 3 juga dapat terlihat bahwa mikroalga pada konsentrasi nitrogen 0 ppm sudah mulai memasuki fase statis pada hari ke-12 walaupun air kawah tersebut mengandung beberapa unsur hara makro dan mikro (Lampiran 4), namun hal tersebut tidak terjadi pada mikroalga dengan konsentrasi nitrogen lainnya.
Gambar 3 Pola pertumbuhan mikroalga pada berbagai konsentrasi nitrogen, 0 ppm, 187,5 ppm, 375 ppm, 750 ppm.
Berdasarkan hasil analisis sidik ragam terhadap respon kepadatan sel pada hari ke 16, intensitas cahaya berpengaruh nyata pada kepadatan sel mikroalga (P = 0,024) (Lampiran 6). Mikroalga memiliki kepadatan sel yang tertinggi pada intensitas cahaya 70 µmol foton/m2 /detik (Tabel 2). Analisis sidik ragam juga menunjukkan bahwa konsentrasi nitrogen juga berpengaruh nyata pada kepadatan sel mikroalga (P = 0,043) (Lampiran 6). Mikroalga dapat tumbuh optimal pada konsentrasi nitrogen yang tinggi yaitu 375 dan750 ppm (Tabel 3), akan tetapi interaksi antara konsentrasi nitrogen dan intensitas cahaya tidak berpengaruh nyata terhadap kepadatan sel mikroalga (P = 0,485).
Perlakuan dari nitrogen dan intensitas cahaya juga berpengaruh pada warna dari kultur mikroalga. Warna pada kultur mikroalga dengan intensitas cahaya yang
rendah dan konsenrasi nitrogen yang tinggi cenderung berwarna lebih hijau dibandingkan dengan kultur mikroalga dengan intensitas cahaya dan konsentrasi nitrogen yang lainnya (Lampiran 5).
Tabel 2 Kepadatan sel, bobot kering dan produktivitas lipid mikroalga pada hari ke 16 pada intensitas cahaya yang berbeda.
Cahaya
(µmol foton/m2
/detik) Rata-rata Kepadatan Sel Bobot Kering (g/l) Produktivitas Lipid (mg/l/hari)
70 2,03c 0,98b 9,90b
105 1,64ab 0,77a 8,90ab
140 1,47a 0,67a 7,50a
175 1,85bc 1,04b 9,00ab
Keterangan : Angka yang diikuti huruf yang sama pada kolom yang sama tidak berbeda nyata pada uji
Duncan dengan taraf uji α =
0,05.
Tabel 3 Kepadaan sel pada hari ke 16 pada konsentrasi nitrogen yang berbeda.
Perlakuan Nitrogen (ppm)
Rata-rata Kepadatan Sel
0 1,52a
1,71ab 1,88b 1,88b 187,5 375 750
Keterangan : Angka yang diikuti huruf yang sama tidak berbeda nyata pada
uji Duncan dengan taraf uji α =
0,05.
Bobot Kering Mikroalga
Bobot kering dari mikroalga diukur pada waktu proses pengekstraksian lipid. Pengukuran ini penting dilakukan karena untuk mengukur persentase lipid pada mikroalga diperlukan data bobot kering. Berdasarkan analisis sidik ragam hanya intensitas cahaya (P = 0,004) saja yang mempengaruhi bobot kering mikroalga secara nyata sedangkan konsentrasi nitrogen (P = 0,222) dan interaksi antara intensitas cahaya dan konsentrasi nitrogen (P = 0,375) tidak menunjukkan pengaruh yang nyata terhadap bobot kering mikroalga (Lampiran 7). Bobot kering mikroalga tertinggi dihasilkan 0,0 0,2 0,4 0,6 0,8 1,0 1,2 1,4 1,6 1,8 2,0
0 2 4 6 8 10 12 14 16
5
pada intensitas cahaya 175 µmol foton/m2 /detik (Tabel 2).
Persentase Lipid Mikroalga
Mikroalga yang telah ditumbuhkan diukur persentase lipidnya pada hari ke 16. Analisis sidik ragam menunjukkan bahwa baik intensitas cahaya (P = 0,066) maupun konsentrasi nitrogen (P = 0,816) tidak mempengaruhi persentase lipid secara nyata. Namun interaksi antara keduanya mempengaruhi persentase lipid (P = 0,005) (Lampiran 8). Persentase lipid tertinggi dihasilkan pada konsentrasi nitrogen 187,5 ppm dan intensitas cahaya 140 µmol foton/m2 /detik (Gambar 4). Kisaran Presentasi lipid yang dihasilkan oleh mikroalga ini adalah 12,42% - 23,89%.
Gambar 4 Pengaruh interaksi konsentrasi nitrogen dan intersitas cahaya pada persentase lipid pada mikroalga pada hari ke 16. 0 ppm, 187,5 ppm, 375 ppm, 750 ppm.
Produktivitas Lipid Mikroalga
Produktivitas lipid merupakan jumlah rata-rata lipid yang dihasilkan mikroalga setiap harinya. Berdasarkan analisis sidik ragam hanya intensitas cahaya (P = 0,010) saja yang berpengaruh nyata terhadap produktivitas lipid (Lampiran 9). Produktivitas lipid tertinggi dihasilkan pada intensitas cahaya 70 µmol foton/m2 /detik (Tabel 2). Kisaran produktivitas lipid yang dihasilkan oleh mikroalga ini adalah 5,6 – 10,8 mg/l/hari.
PEMBAHASAN
Pada pengujian keseragaman jenis dan analisis kualitatif kandungan lipid serta
identifikasi jenis mikroalga diperoleh bahwa mikroalga dalam kultur masih dalam keadaan sejenis yaitu Chlorella sp. serta mempunyai kandungan lipid yang cukup tinggi. Sel
Chlorella merupakan sel berukuran kecil (2-12 µm), berbentuk bola atau elipsodial dan umumnya terisolasi secara individual (Bold & Wynne 1985). Chlorella sp. termasuk ke dalam divisi Chlorophyta yang merupakan divisi pendominasi perairan air tawar (Pelczar&Chan 1986). Kandungan lipid
Chlorella sp. cukup tinggi disebabkan karena mikroalga tersebut menyimpan cadangan makanan tidak hanya dalam bentuk pati tetapi juga dalam bentuk minyak (Pelczar&Chan 1986).
Kepadatan sel mikroalga yang tertinggi dihasilkan pada intensitas cahaya terendah yaitu 70 µmol foton/m2 /detik. Pada beberapa penelitian yang telah dilakukan intensitas cahaya terendah yang digunakan juga menghasilkan kepadatan sel yang lebih tinggi seperti pada penelitian Imamoglu et al. (2007) dengan mikroalga Haematococcus pluvialis
pada intensitas cahaya 50 µmol foton/m2 /detik dan pada penelitian Ghezelbash et al. (2008) dengan mikroalga Tetraselmis chuii pada intensitas cahaya 63 µmol foton/m2 /detik. Adapun pada penelitian Sorokin & Kraus (1958) dengan jenis Chlorella pyrenoidosa, Chlorella vulgaris, Scenedesmus obliquus,dan
Chlamydomonas reinhardti, kepadatan sel mikroalga tertinggi dihasilkan pada intensitas cahaya 500 footcandle atau hampir setara dengan 70 µmol foton/m2 /detik. Intensitas cahaya yang terla