HELIKASE VIRUS HEPATITIS C
AKSAR CHAIR LAGES
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
BOGOR
AKSAR CHAIR LAGES. C34080078. Optimasi Pemurnian Polisakarida dari Mikroalga BTM 11 sebagai Inhibitor RNA Helikase Virus Hepatitis C. Dibimbing oleh IRIANI SETYANINGSIH dan APON ZAENAL MUSTOPA.
Infeksi virus Hepatitis C (HCV) merupakan penyebab utama penyakit hati kronis di seluruh dunia. Pengobatan yang dilakukan terhadap penderita hepatitis C selama ini adalah melalui terapi dengan pemberian interferon yang dikombinasikan dengan ribavirin. Pengobatan ini masih belum optimal, memerlukan biaya yang mahal dan dapat memberikan efek samping.Usaha dalam menemukan obat HCV terus dilakukan dengan mencari unsur antiviral yang melawan virus dengan cara menghambat enzim yang berperan dalam proses replikasi virus HCV, yaitu RNA helikase. Inhibitor enzim RNA helikase dapat diperoleh dari hasil metabolit mikroalga, salah satunya adalah polisakarida. Mikroalga BTM 11 yang diekstraksi menggunakan metanol 80% memiliki aktivitas penghambatan terhadap RNA helikase HCV sebesar 80% (dilusi 5x). Namun, diperlukan teknik pemurnian polisakarida yang terbaik dalam menghasilkan aktivitas inhibisi yang maksimal. Oleh karena itu, perlu adanya optimasi dalam pemurnian polisakarida mikroalga BTM 11.
Penelitian ini bertujuan (1) mengetahui teknik pemurnian terbaik dari polisakarida mikroalga BTM 11 sebagai inhibitor RNA helikase virus hepatitis C, (2) mengetahui kandungan gula dari polisakarida inhibitor termurnikan, dan (3) mengetahui profil senyawa polisakarida inhibitor yang paling aktif. Tahap satu yaitu preparasi RNA helikase HCV yang meliputi (1) ekspresi RNA helikase dengan cara menumbuhkan bakteri E.coli BL21 (DE3) pLysS yang membawa gen NS3 RNA helikase HCV dalam plasmid pET 21b, (2) pemurnian RNA helikase yang telah terekspresi pada sel bakteri menggunakan kromatografi afinitas. Tahap dua meliputi (1) kultivasi mikroalga BTM 11 dalam media IMK-Sea Water pada suhu ruang dengan pencahayaan 4800 lux, (2) ekstraksi polisakarida dari biomassa mikroalga BTM 11. Penelitian tahap tiga meliputi (1) pemurnian ekstrak polisakarida menggunakan teknik kromatografi gel filtrasi dan kromatografi ion-exchange, (2) penentuan profil senyawa polisakarida inhibitor yang paling aktif menggunakan kromatografi lapis tipis dan kromatografi cair kinerja tinggi.
HELIKASE VIRUS HEPATITIS C
AKSAR CHAIR LAGES
C34080078
SKRIPSI
Sebagai salah satu syarat memperoleh gelar Sarjana Perikanan pada Fakultas Perikanan dan Ilmu Kelautan
Institut Pertanian Bogor
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
BOGOR
Nama : Aksar Chair Lages
NRP : C34080078
Departemen : Teknologi Hasil Perairan
Menyetujui,
Pembimbing I Pembimbing II
Dr. Ir. Iriani Setyaningsih, MS A. Zaenal Mustopa, M.Si NIP.19600925 198601 2 001 NIP. 19770412 200502 1 001
Mengetahui:
Ketua Departemen Teknologi Hasil Perairan
Dr. Ir. RuddySuwandi, MS, MPhil. NIP. 19580511 198503 1 002
Dengan ini saya menyatakan bahwa skripsi dengan judul “Optimasi
Pemurnian Polisakarida dari Mikroalga BTM 11 Sebagai Inhibitor RNA Helikase Virus Hepatitis C” adalah karya saya sendiri dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir skripsi ini.
Bogor , September 2012
Penulis dilahirkan di Jakarta pada tanggal 27April 1989. Penulis merupakan anak pertama dari dua bersaudara pasangan Abdul Chair Husain dan Linda Riau Rita.
Penulis memulai jenjang pendidikan formal di SD Hang Tuah 5 Jakarta Utara (1995-2001), selanjutnya meneruskan pendidikan di SMP Negeri 1 Ternate (2001-2004). Pendidikan menengah atas ditempuh penulis di SMA Negeri 6 Bekasi (2004-2007). Tahun 2008, penulis diterima di Institut Pertanian Bogor, pada Fakultas Perikanan Ilmu Kelautan, Departemen Teknologi Hasil Perairan melalui jalur SNMPTN (Seleksi Nasional Masuk Perguruan Tinggi Negeri).
Penulis aktif dalam berbagai organisasi kemahasiswaan seperti Dewan Perwakilan Mahasiswa (DPM) FPIK sebagai staf Komisi Internal periode 2009-2010, dan staf Komisi Advokasiperiode 2010-2011, staf Badan Pekerja Bidang Konstitusi Majelis Permusyawaratan Mahasiswa Keluarga Mahasiswa Institut Pertanian Bogor (MPM KM IPB) periode 2010-2011. Penulis juga aktif menjadi panitia dalam berbagai kegiatan kemahasiswaan di Institut Pertanian Bogor. Prestasi yang pernah diraih penulis diantaranya adalah menjadi delegasi dalam Pekan Ilmiah Nasional (PIMNAS) XXIV (2011) di Makassar dalam Program Kreativitas Mahasiswa (PKM) bidang Penelitian.
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Fakultas Perikanan dan Ilmu Kelautan, penulis melakukan penelitian dan penyusunan skripsi dengan judul “Optimasi Pemurnian Polisakarida dari Mikroalga BTM 11 Sebagai Inhibitor RNA Helikase Virus Hepatitis C”
Ucapan syukur penulis panjatkan ke hadirat ALLAH SWT, atas karunia-Nya yang berlimpah, yang membuat penulis sanggup menyelesaikan skripsi yang berjudul “Optimasi Pemurnian Polisakarida dari Mikroalga BTM 11 Sebagai Inhibitor RNA Helikase Virus Hepatitis C”. Skripsi ini merupakan salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Fakultas Perikanan dan Ilmu Kelautan.
Penulis mengucapkan terima kasih yang sebesar-besarnya kepada semua pihak yang telah membantu dalam menyelesaikan skripsi ini, terutama kepada: 1 Dr. Ir. IrianiSetyaningsih, MS dan Apon Zaenal Mustopa, M.Si. selaku
komisi pembimbing yang telah banyak membimbing dan memberikan saran sehingga penelitian dan penulisan skripsi dapat berjalan dengan baik.
2 Dr. Tati Nurhayati, S.Pi, M.Si selaku dosen penguji atas segala saran, kritik, arahan, perbaikan dan motivasinya, serta ilmu yang telah diberikan.
3 Keluarga besar Laboratorium Bakteriologi dan Virologi Molekuler (mas Ridwan, S.Farm, mba Linda, M.Eng, mba Rifqiyah, MS, bang Adyos, S.Si, Meita, S.Pt, Anggun, S.Si, Neng, Bia, Krisna dan Haryono) yang telah banyak membantu penulis dalam melakukan penelitian.
4 Kedua orang tua tercinta, untuk dukungan yang diberikan baik dukungan moral maupun materil yang telah diberikan pada penulis tanpa batas.
5 Teman-teman THP’45 dan semua pihak yang tidak dapat disebutkan satu persatu, yang telah memberikan bantuan dan dukungan moril dalam penelitian dan penyusunan skripsi ini.
Akhirnya penulis berharap semoga tulisan ini bermanfaat dan memberikan kontribusi yang nyata terhadap perkembangan ilmu pengetahuan.
Bogor , September 2012
Halaman
3.3.5 Profil kemurnian fraksi aktif polisakarida inhibitor RNA helikase ... 23
3.4 Prosedur Analisis ... 24
3.4.1 Analisis enzim RNA helikase dengan SDS-PAGE ... 24
3.4.2 Uji aktivitas ATPase RNA helikase HCV ... 25
v
Halaman
4 HASIL DAN PEMBAHASAN ... 28
4.1 RNA Helikase Virus Hepatitis C ... 28
4.2 Kultivasi Mikroalga BTM 11 ... 32
4.3 Ekstrak Polisakarida Mikroalga BTM 11 ... 34
4.4 Pemurnian Polisakarida Inhibitor RNA Helikase ... 36
4.5 Analisis Kandungan Gula ... 38
4.6 Analisis Kemurnian Fraksi Aktif Polisakarida Inhibitor ... 39
5 SIMPULAN DAN SARAN ... 43
5.1 Simpulan ... 43
5.2 Saran ... 43
DAFTAR PUSTAKA ... 44
Nomor Halaman
1 Morfologi mikroalga ... 4
2 Tahap perkembangan kerusakan hati pada penderita hepatitis C ... 7
3 Struktur virus hepatitis C (HCV) ... 8
4 Peta genomik HCV ... 9
5 Mekanisme kerja RNA helikase HCV ... 10
6 Polisakarida Porphyridium cruentum ... 11
7 Kromatografi gel filtrasi ... 12
8 Kromatografi ion-exchange ... 14
9 Kromatografi lapis tipis... 15
10 Skematik komponen HPLC... 16
11 Diagram alir prosedur kerja penelitian ... 20
12 Pengikatan resin TALON (A) dengan 6xHis-tag (B) ... 30
13 Analisis SDS-PAGE pemurnian RNA helikase HCV ... 31
14 Kondisi kultivasi mikroalga BTM 11 ... 32
15 Mikroalga BTM 11 dengan perbesaran 1000x... 33
16 Kurva pertumbuhan mikroalga BTM 11 ... 33
17 Inhibisi polisakarida fraksi gel filtrasi terhadap aktivitas ATPase RNA helikase HCV ... 37
18 Inhibisi polisakarida fraksi ion-exchange terhadap aktivitas ATPase RNA helikase HCV ... 38
19 Kromatogram KLT dengan deteksi sinar UV 254 nm ... 40
Nomor Halaman
1 Komposisi kimia protein, karbohidrat, lipid dan asam nukleat
dalam % dari bobot kering mikroalga ... 5
2 Sistem reaksi enzim untuk satu sampel dengan volume total 175 µ L ... 26
3 Aktivitas inhibisi dari ekstrak polisakarida ... 35
4 Analisis kandungan gula ... 38
DAFTAR LAMPIRAN
Nomor Halaman
1 Komposisi media IMK-SW... 51
2 Komposisi larutan yang digunakan dalam SDS-PAGE ... 52
3 Kurva standar fosfat (Uji ATPase) ... 53
4 Tabulasi data hasil fraksinasi kromatografi gel filtrasi ... 54
5 Tabulasi data hasil fraksinasi kromatografi ion-exchange ... 55
1 PENDAHULUAN
1.1 Latar Belakang
Infeksi virus hepatitis C (HCV) merupakan penyebab utama penyakit hati kronis di seluruh dunia. Dampak yang ditimbulkannya sangat bervariasi, mulai dari hepatitis kronis, fibrosis, sirosis hingga kanker hati (hepatocellular carcinoma). Jumlah penderita kronis di seluruh dunia hampir mencapai 200 juta jiwa (EASL 2011).Data yang dikeluarkan Kementerian Kesehatan menyebutkan bahwa pada tahun 2010 jumlah penderita hepatitis C di Indonesia mencapai7 juta jiwa (Kementerian Kesehatan Republik Indonesia 2010).
Pengobatan yang dilakukan terhadap penderita hepatitis C selama ini adalah terapi dengan pemberian interferon yang dikombinasikan dengan ribavirin. Akan tetapi terapi ini memiliki tingkat efektivitas yang tidak lebih dari 50% terhadap infeksi HCV genotip 1 dan 4, dan tidak lebih dari 80% terhadap genotip 2 dan 3. Terapi ini juga dapat menimbulkan efek samping berupa flu, depresi dan anemia (Clercq 2004), oleh karena itu diperlukan suatu obat baru yang dapat mengatasi infeksi virus hepatitis C.
Upaya dalam menemukan obat HCV terus dilakukan dengan mencari unsur antiviral yang melawan virus dengan cara menghambat enzim yang penting bagi HCV, salah satunya adalah ribonucleid acid (RNA) helikase. Borowski et al. (2008) menjelaskan bahwa enzim RNA helikase berperan dalam proses replikasi virus HCV, yaitu membuka ikatan dupleks RNA virus agar dapat direplikasikan.Utama et al. (2000) menjelaskan bahwa apabila proses pembukaan ikatan dupleks RNA virus sebagai induk (template) genetik tidak dapat dilakukan, maka proses translasi informasi genetik tidak dapat berjalan sehingga siklus hidup HCV terhenti.
penghambatan terhadap aktivitas enzim RNA helikase dianggap lebih potensial sebagai target obat hepatitis C.
Inhibitor enzim RNA helikase dapat diperoleh dari senyawa metabolit, misalnya metabolit dari mikroalga. Ye et al. (2008) menjelaskan bahwa mikroalga memiliki banyak komponen bioaktif yang sangat berpotensi sebagai obat anti-inflamasi, antitumor, antimikroba dan antivirus. Sanchez et al. (2007) menjelaskan bahwa biomassa mikroalga mengandung beberapa komposisi kimia yang potensial, misalnya protein, karbohidrat, pigmen (klorofil dan karotenoid), asam amino, lipid dan hidrokarbon. Karbohidrat yang dihasilkan dapat ditemukan dalam bentuk pati, glukosa, gula dan polisakarida lainnya. Umumnya objek yang dijadikan target penemuan obat adalah senyawa kimia. Sebaliknya, jarang yang memfokuskan pada polisakarida sebagai antivirus hepatitis C.
Hasil-hasil penelitian sebelumnya juga telah menjelaskan potensi polisakarida dari mikroalga dalam aktivitasnya sebagai antivirus. Salah satunya adalah Huleihel et al. (2001) yang menunjukkan bahwa terdapat beberapa polisakarida mikroalga yang diketahui memiliki aktivitas antivirus dalam melawan berbagai jenis virus pada hewan. Polisakarida ini tidak berpengaruh terhadap penetrasi atau infeksi virus ke dalam sel inang, akan tetapi menghambat sintesis protein virus di dalam sel.
1.2 Tujuan
Tujuan dari penelitian ini adalah :
1) Mempelajari teknik pemurnian terbaik dari polisakarida mikroalga BTM 11 sebagai inhibitor RNA helikase virus hepatitis C;
2 TINJAUAN PUSTAKA
2.1 Mikroalga
Mikroalga merupakan mikroorganisme fotosintetik yang dapat ditemukan di perairan tawar dan laut. Mekanisme fotosintesis mikroalga mirip dengan tumbuhan darat, dikarenakan kesamaan pada struktur selulosa yang dimilikinya.Bila dibandingkan dengan organisme fotosintetik lainnya, mikroalga paling efisien dalam menangkap dan memanfaatkan energi matahari dan CO2 untuk keperluan fotosintesis karena organisme ini mengandung klorofil serta pigmen-pigmen lain untuk mengkonversi fotosintesis menjadi biomassa dan akumulasi pati. Mikroalga hidup secara planktonik di perairan, namun juga dapat hidup secara epifit dan bentik di dasar perairan yang memiliki intensitas cahaya yang cukup (Rodjaroen et al. 2007; Gouveia 2011; Barsanti & Gualtieri 2005). Mikroalga juga memiliki bentuk yang bervariasi seperti filamen, spiral dan bulat. Berbagai macam morfologi mikroalga dapat dilihat pada Gambar 1.
Gambar 1 Morfologi mikroalga A: Pterosperma, B: Nephroselmis, C:Tetraselmis D: Chlorella, E: Oocytis, F: Haematococcus, G: Pediastrum, H: Bulbochaete, I: Chaetophora dan J: Ulothrix (Leliaert et al. 2012). Mikroalga dapat dibagi ke dalam empat kelompok utama (NREL 2003): 1) Diatom (Bacillariophyceae).
terpolimerisasi dalam dinding sel. Karbon disimpan dalam bentuk minyak nabati maupun polimer karbohidrat yang disebut chrysolaminarin.
2) Alga hijau (Chlorophyceae).
Mikroalga yang memiliki kelimpahan tinggi terutama di perairan tawar dan hidup dalam bentuk soliter maupun koloni. Karbon disimpan dalam bentuk pati. 3) Alga hijau biru (Cyanophyceae).
Mikroalga kelompok ini memiliki struktur yang lebih menyerupai bakteri dan berperan dalam fiksasi nitrogen. Sekitar 2000 jenis mikroalga yang termasuk dalam kelompok ini tersebar dalam berbagai habitat.
4) Ganggang emas (Chrysophyceae).
Kelompok alga ini menyerupai diatom, namun memiliki pigmen yang lebih rumit, dan nampak berwarna kuning, jingga atau cokelat.
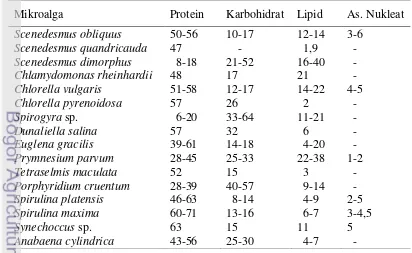
Mikroalga telah sejak lama dimanfaatkan sebagai sumber bahan makanan, terutama sebagai sumber vitamin, antioksidan, pewarna atau bahan aditif yang aman, serta digunakan pula dalam industri farmakologi dalam skala besar. Hal ini tidak lepas dari komposisi kimia yang terkandung dalam mikroalga, dapat dilihat pada Tabel 1.
Tabel 1 Komposisi kimia protein, karbohidrat, lipid dan asam nukleat dalam % dari bobot kering mikroalga.
Mikroalga Protein Karbohidrat Lipid As. Nukleat
2.2 Pemanfaatan Mikroalga di Bidang Kesehatan
Mikroalga dapat dimanfaatkan sebagai bahan baku industri farmasi dan kosmetika, karena adanya kandungan berbagai senyawa kimia yang dapat dimanfaatkan sebagai bahan dasar untuk pengobatan dan pencegahan berbagai macam penyakit. Yuan dan Walsh (2006) menjelaskan bahwa konsumsi alga laut berkorelasi dengan rendahnya tingkat penderita kanker payudara di Asia Timur. Sebagai contoh, prevalensi kasus penderita kanker payudara dalam 1 tahun per 100.000 penduduk di Jepang dan Cina masing-masing adalah 42,2 dan 13,1, dibandingkan dengan kasus di Amerika Utara dan Eropa yang masing-masing sebesar 125,9 dan 106,2. Teas et al. (2004) juga menjelaskan bahwa sebagian besar kelompok masyarakat di Chad mengkonsumsi Spirulina rata-rata sebanyak 1-2 sendok makan (3-13 g) per harinya, hal ini diyakini dapat mencegah infeksi virus HIV.
Hasil-hasil riset menjelaskan bahwa terdapat komponen aktif mikroalga yang menunjukkan aktivitas biologis sebagai antivirus. Talyshinsky et al. (2002) menjelaskan bahwa dekstran sulfat dan polisakarida yang dihasilkan mikroalga berpotensi menghambat HIV tipe 1 dan 2 dengan cara menghambat induksi sitopatogenetik dan ekspresi antigen dari virus HIV. Sulfat polisakarida yang dihasilkan juga dapat menghambat aktivitas reversetranscriptase dan RNAse pada proses replikasi retrovirus. Hasil riset Shih et al. (2003) menjelaskan bahwa allophycocyanin yang dihasilkan oleh Spirulina platensis dapat menetralisir efek sitopatik dari enterovirus pada sel manusia secara in vitro.
2.3 Hepatitis C
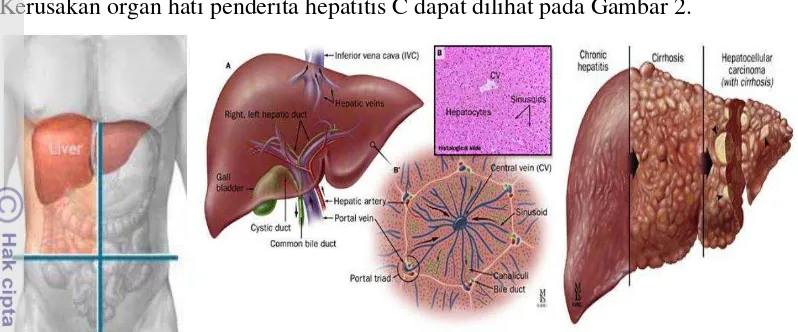
terinfeksi virus hepatitis C (HCV) ketika berada pada tahap yang lebih kritis. Kerusakan organ hati penderita hepatitis C dapat dilihat pada Gambar 2.
Gambar 2 Tahap perkembangan kerusakan hati pada penderita hepatitis C (Solga et al. 2007).
Kerusakan hati dapat ditandai dengan adanya konsentrasi enzim alanin aminotransferase (ALT) yang lebih tinggi dari normal. Pada penyakit hepatitis C, setelah terjadinya infeksi (tahap infeksi akut), 15-40% penderita akan sembuh dengan sendirinya dalam waktu 6 bulan dan tidak beresiko menderita penyakit hati melalui hepatitis C serta tidak menularkan kepada yang lainnya. Pada tahap ini, hati dapat melawan patogen dan mengembalikan fungsinya yang terganggu dengan membentuk fibrosis (luka kecil atau parut). Namun, sekitar 60-80% penderita hepatitis C akut ini tidak dapat sembuh dan berkembang menjadi hepatitis kronis. Pada tahap ini, penderita akan rentan terhadap sirosis hati, kegagalan fungsi hati, dan kanker hati (hepatocellular carcinoma), tetapi untungnya, perkembangan ini terjadi sangat lambat. Hanya 10 hingga 15% penderita kronis yang mengalami sirosis hati dalam jangka waktu 20 tahun (Shiffman 2006).
Terapi hepatitis C pada umumnya dengan pemberian interferon seminggu sekali yang dimasukkan ke tubuh melalui injeksi. Pemberian interferon tersebut dikombinasikan dengan ribavirin. Mekanisme terapi untuk hepatitis C dari kedua bahan tersebut masih belum banyak diketahui. Selain itu, terapi tersebut kurang efektif karena menimbulkan efek samping, seperti mual, anemia, depresi, dan harganya relatif mahal. Manfaat terapi kedua bahan tersebut berbeda hasilnya di
2.4 Virus Hepatitis C
Virus Hepatitis C (HCV) merupakan anggota dari famili Flaviviridae dengan genus Hepacivirus. Virus ini merupakan virus RNA positif. Virus berbentuk bulat dengan diameter partikelnya 55-65 nm, dan memiliki selubung glikoprotein. Selain itu, terdapat inti (core) dan di dalamnya terdapat viral RNA. Virus hepatitis C dibagi menjadi enam genotipe yang disandikan dengan angka, yaitu genotipe satu sampai enam (Worman & Lin 2000). Bentuk dari virus hepatitis C dapat dilihat pada Gambar 3.
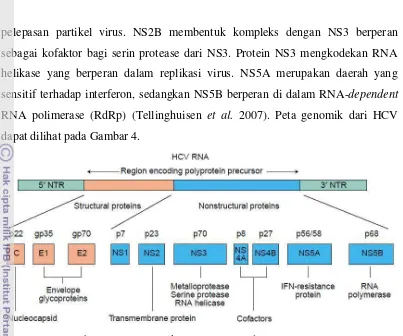
Gambar 3 Struktur virus hepatitis C (HCV) (Moradpour et al. 2007). Genom HCV berukuran 9,6 kilobasa yang mengkodekan sekitar 3011 asam amino. Poliproteinnya dipotong setelah proses translasi dan dibagi menjadi protein struktural dan nonstruktural. Protein struktural terdiri dari sebuah nukleokapsid inti, protein p7, dan dua glikoprotein selubung virusnya (E1 dan E2). Dua daerah pada E2 merupakan daerah hipervariabel 1 dan 2. Daerah tersebut menunjukkan hipermutasi dari selubung sehingga sangat spesifik terhadap antibodi. Daerah E2 juga terdapat sisi pengikatan terhadap cluster of differentiation 81 (CD81), reseptor virus pada hepatosit dan sel limfosit B (Tellinghuisen et al. 2007).
pelepasan partikel virus. NS2B membentuk kompleks dengan NS3 berperan sebagai kofaktor bagi serin protease dari NS3. Protein NS3 mengkodekan RNA helikase yang berperan dalam replikasi virus. NS5A merupakan daerah yang sensitif terhadap interferon, sedangkan NS5B berperan di dalam RNA-dependent RNA polimerase (RdRp) (Tellinghuisen et al. 2007). Peta genomik dari HCV dapat dilihat pada Gambar 4.
Gambar 4 Peta genomik HCV (Anzola dan Burgos 2003).
2.5 Ribonucleid Acid (RNA) Helikase
Helikase berasal dari kata “helix” yang berarti struktur pasangan DNA “double helix” dan “ase” yang berarti enzim, sehingga helikase berarti enzim yang memisahkan pasangan rantai DNA (DNA helikase) atau RNA (RNA helikase). Helikase pertama kali ditemukan dalam proses replikasi DNA bakteri Eschericia coli. RNA helikase ditemukan pada bakteri, khamir, dan virus. Pada virus hepatitis C, enzim ini dikodekan oleh protein NS3 RNA helikase (Kadare & Haenni 1997).
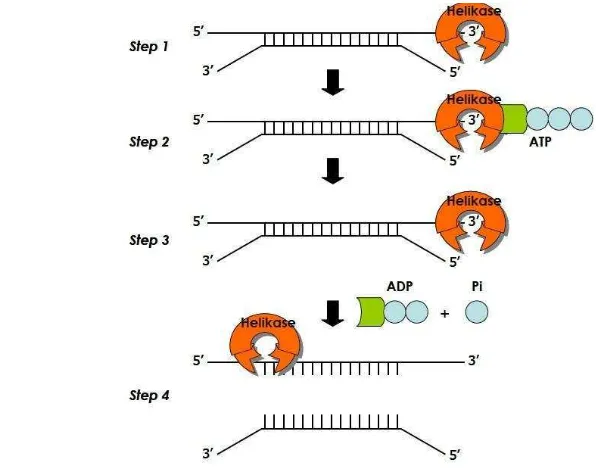
Mekanisme kerja RNA helikase HCV secara umum adalah pertama-tama helikase akan berikatan pada ujung 3’ RNA utas ganda. Tahap kedua, ATP akan berikatan pada sisi aktif RNA helikase dan dihidrolisis pada gugus fosfat terluar menghasilkan ADP dan fosfat anorganik (Pi). Pada proses hidrolisis ATP ini mengeluarkan energi yang cukup besar dan digunakan untuk memisahkan RNA utas ganda menjadi utas tunggal. Pemisahan RNA utas ganda dilakukan dengan
(Utama et al. 2005). Mekanisme kerja RNA helikase HCV dapat dilihat pada Gambar 5.
Gambar 5 Mekanisme kerja RNA helikase HCV (Hairany 2010).
Berdasarkan mekanisme kerja tersebut, selain memiliki aktivitas untuk memisahkan utas ganda RNA, RNA helikase juga memiliki aktivitas untuk menghidrolisis ATP (ATPase) dan aktivitas pengikatan RNA (RNA-binding). Ketiga aktivitas ini saling berpengaruh satu dengan lainnya. Oleh karena itu, helikase menjadi target yang potensial untuk penemuan obat antivirus. Obat antivirus ini dapat dikembangkan dengan suatu senyawa yang dapat menghambat (inhibitor) aktivitas helikase.
2.6 Polisakarida
penyusunnya, sehingga glukosa homopolisakarida dapat disebut “glukan”, sama halnya dengan mannosa homopolisakarida yang dapat disebut “mannan” (d’Ayala et al. 2008).
Polisakarida telah digunakan sebagai pengental, flokulan dan minyak pelumas. Beberapa polisakarida dari mikroalga berpotensi sebagai antivirus (Huleihel et al. 2001). Salah satu jenis mikroalga merah, Porphyridium cruentum merupakan salah satu penghasil polisakarida ekstraseluler dalam jumlah besar. Sel-sel mikroalga dibungkus oleh polisakarida sulfat dalam bentuk gel. Selama pertumbuhan dalam media cair, viskositas medium meningkat karena pengeluaran polisakarida dari permukaan sel ke dalam media (polisakarida larut air). Kapsul polisakarida paling tipis selama fase pertumbuhan dan tebal selama fase stasioner (Arad & Richmond 2004). Menurut Laurienzo (2010) bahwa mikroalga diketahui memanfaatkan polisakarida yang disintesisnya untuk bertahan hidup pada kondisi lingkungan yang ekstrim. Letak polisakarida pada sel mikroalga dapat dilihat pada Gambar 6.
2.7 Kromatografi
Kromatografi merupakan suatu proses migrasi diferensial, komponen-komponen senyawa yang dibawa oleh fasa gerak, dan ditahan secara selektif oleh fasa diam. Peristiwa tersebut terjadi di dalam kolom kromatografi. Adanya peristiwa yang komplek pada metode kromatografi, menjadikan kromatografi dapat digunakan untuk menganalisis senyawa sampai sedetail mungkin. Prinsip kromatografi adalah penggunaan dua fase yang berbeda yaitu fasa tetap dan fasa bergerak. Proses pemisahan tergantung pada gerakan relatif dari dua fasa tersebut (Al Baarri 2003). Penelitian ini menggunakan 4 teknik kromatografi, yaitu kromatografi gel filtrasi, kromatografi penukar ion (ion-exchange), kromatografi lapis tipis dan kromatografi cair kinerja tinggi.
2.7.1 Kromatografi gel filtrasi
Kromatografi gel filtrasiatau sering disebut filtrasi gel merupakan salah satu metode yang digunakan untuk memisahkan senyawa menurut ukuran dan bentuk. Sampel kemudian dimasukan pada ujung atas kolom dan elusi dilakukan dengan memberikan larutan bufer melalui kolom. Larutan bufer ini memiliki prinsip tidak boleh lebih polar dibandingkan dengan fase diam atau yang disebut juga kolom. Besar molekul akan terbagi menjadi 3 bagian yang ditunjukkan oleh berbagai warna pada Gambar 7.
Gambar 7 Kromatografi gel filtrasi (Koolman 2005).
molekul kecil akan tertahan oleh kolom lebih lama (Koolman 2005). Batas pemisahan dari sebuah ukuran merupakan indikasi bobot molekul untuk tipe polimer (Hagel 1998).
Keuntungan dari metode ini adalah dapat memisahkan dengan baik molekul besar dari molekul kecil serta dapat menggunakan berbagai pelarut tanpa harus mengganggu proses pemisahan. Penggunaan kromatografi gel filtrasi ini akan didapatkan pemisahan yang baik, sensitifitas yang baik, dan waktu yang diperlukan untuk pemisahan cepat. Selain itu tidak ada sampel yang tertinggal karena pelarut tidak berinteraksi dengan fase diam (Skoog 2006). Namun Kehilangan molekul dapat terjadi selama proses pemurnian dengan menggunakan teknik kromatografi gel filtrasi karena autolisis (Scopes 1987).
Prinsip dasar kromatografi gel filtrasi adalah partikel dengan ukuran yang berbeda akan dielusi melalui fase stasioner pada tingkat yang berbeda. Hal ini menyebabkan pemisahan partikel berdasarkan ukuran. Setiap kolom memiliki jangkauan berat molekul yang dapat dipisahkan. Molekul besar tidak dapat terjebak dalam matriks fase diam sehingga akan terlebih dahulu terlewati kolom. Bobot molekul menengah dan kecil terjebak dalam matriks sehingga akan lebih lama untuk terlewati fase diam (Skoog 2006).
2.7.2 Kromatografi ion-exchange
Kromatografi penukaran ion (ion-exchange chromatography) biasa digunakan untuk pemurnian materi biologis. Purwadaria (1999) menjelaskan bahwa pada sistem kromatografi ini, molekul senyawa dipisahkan berdasarkan perbedaan afinitas terhadap penukar ion. Afinitas molekul dengan penukar ion dapat dilepaskan dengan mengubah kadar garam atau pH larutan eluen. Selain itu sistem pengaturan perubahan kadar garam atau pH eluen baik dengan gradasi linier ataupun gradasi bertingkat dapat pula mempengaruhi jumlah molekul yang terpisah.
Gambar 8 Kromatografi ion-exchange (Harper 2005).
Muatan-muatan molekul akan memiliki sifat ketika muatan molekul yang sama dengan kolom, maka molekul tersebut akan terelusi, namun muatan pada molekul tidak sama dengan kolom, maka molekul tersebut akan membentuk ikatan ionik dengan kolom (Carrier 1997). Prinsip dasar yang digunakan adalah molekul dengan muatan positif bersih pada pH tertentu akan berikatan dengan gugus fungsional bermuatan negatif seperti carboxylates atau sulfat (penukar kation). Demikian pula, molekul bermuatan negatif bersih berikatan dengan molekul bermuatan positif pada gugus fungsional, biasanya tersier atau kuaterner amina (penukar anion).
2.7.3 Kromatografi lapis tipis
Kromatografi Lapis Tipis (KLT) dikembangkan oleh Izmailoff dan Schraiber pada tahun 1938. KLT merupakan bentuk kromatografi planar, selain kromatografi kertas dan elektroforesis. Berbeda dengan kromatografi kolom yang mana fase diamnya diisikan atau dikemas di dalamnya, pada kromatografi lapis tipis, fase diamnya berupa lapisan yang seragam (uniform) pada permukaan bidang datar yang didukung oleh lempeng kaca, pelat aluminium atau pelat plastik (Gandjar & Rohman 2007). Teknik ini biasa digunakan untuk memisahkan komponen dari suatu campuran senyawa organik alam, sintetis, dan campuran kompleks anorganik. Fase gerak yang digunakan tergantung dari senyawa yang ingin dipisahkan (Harjadi 1976).
Selanjutnya dibuat pula sebuah garis akhir menggunakan pensil. Jarak antara garis awal dengan garis akhir biasanya 5 cm. Plat yang telah ditotol dengan sampel dimasukkan ke dalam bejana pengembang yang telah terdapat eluen hasil proses penjenuhan yang dilakukan selama 20 menit. Penjenuhan berfungsi agar eluen lebih efektif dalam memisahkan komponen tersebut. Eluen akan memisahkan komponen hingga garis akhir yang telah didesain. Semakin dekat kepolaran antara sampel dengan eluen maka sampel akan semakin terbawa oleh fase gerak tersebut (Wilson & Walker 1994). Hal tersebut dapat dilihat pada Gambar 9.
Gambar 9 Kromatografi lapis tipis (Tissue 1996).
Tahapan selanjutnya adalah visualisasi atau deteksi. Deteksi atau visualisasi sampel yang tidak berwarna dapat menggunakan dua cara, yaitu penyinaran dengan sinar UV (254 nm dan 356 nm) dan pereaksi kimia (ninhidrin, FeSO4, Dragendroff, dan anilin). Pada saat disinari dengan sinar UV, komponen yang terpisahkan akan terlihat seperti spot atau bidang kecil yang berwarna gelap. Deteksi komponen juga dapat dilakukan dengan menempatkan kromatogram pada bejana tertutup yang telah dijenuhkan dengan kristal iod. Uap kristal iod bereaksi dengan komponen yang terpisahkan dan terlihat seperti bercak-bercak kecoklatan. Aplikasi dari teknik ini dapat digunakan untuk analisis kuantitatif (membandingkan retardation factor (Rf) senyawa murni dengan komponen, pola sidik jari, dan menentukan jumlah komponen) dan preparatif (untuk memperoleh senyawa murni). Nilai Rf yang akan dihasilkan dari suatu senyawa bernilai sama meskipun jarak plat yang digunakan berbeda (Wilson & Walker 1994).
2.7.4 Kromatografi cair kinerja tinggi
menguap. Pemisahan dengan HPLC mempunyai beberapa keuntungan dibandingkan dengan metode konvensional seperti waktu analisis yang cepat, biaya yang rendah dan kemungkinan untuk menganalisis sampel yang tidak stabil (Nurhamidah 2005). Komponen penyusun HPLC secara skematik dapat dilihat pada Gambar 9.
Gambar 10 Skematik komponen HPLC (LC Resources Inc. 2001)
Mardiana dan Ramdani (2008) menjelaskan komponen HPLC yang terdiri dari :
1) Tandon (Reservoir)
Reservoir terbuat dari gelas atau stainless stell. Jumlahnya bisa satu, dua atau lebih. Reservoir yang baik disertai degassing system yang berfungsi untuk menghilangkan gas-gas yang terlarut dalam solven. Gas terlarut tersebut antara lain adalah oksigen. Degassing dilakukan dengan mengalirkan gas inert dengan kelarutan yang sangat kecil.
2) Pompa
Fungsi pompa adalah untuk memompa fase gerak (solvent) ke dalam kolom dengan aliran yang konstan dan reproducible.
3) Katup injektor
Bagian ini merupakan tempat dimana sampel diinjeksikan untuk selanjutnya dibawa oleh fase gerak ke dalam kolom.
4) Kolom
Kolom dapat dibagi menjadi dua kelompok yaitu kolom analitik dan kolom preparatif.
5) Detektor
Suatu detektor dibutuhkan untuk mendeteksi adanya komponen sampel di dalam kolom (analisis kualitatif) dan menghitung kadarnya (analisis kuantitatif). 6) Recorder
Hasil pembacaan detektor kemudian diolah oleh suatu processor kemudian dikirim ke recorder. Recorder akan membuat suatu tampilan kromatogram. Untuk HPLC dilengkapi seperangkat software yang dapat menghitung luas kromatogram dan bahkan sekaligus menghitung kadarnya.
2.8 Uji Kolorimetri ATPase
Penentuan aktivitas penghambatan RNA helikase HCV menggunakan uji kolorimetri ATPase (Utama et al. 2000). Pengujian ini mengukur besar penghambatan terhadap RNA helikase pada salah satu aktivitas enzimatiknya, yaitu ATPase (RNA-stimulated ATPase). Penghambatan terhadap aktivitas ATPase, secara tidak langsung juga menghambat aktivitas RNA helikase secara keseluruhan, karena helikase membutuhkan energi yang dihasilkan dari hidrolisis ATP untuk memisahkan untai ganda RNA (Hairany 2010).
3 METODE
3.1 Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Januari hingga April 2012, dan bertempat di Laboratorium Bakteriologi dan Virologi Molekuler, Laboratorium Biorekayasa Lingkungan, Pusat Penelitian Bioteknologi LIPI Cibinong, Bogor dan Laboratorium Analisis Kimia, Badan Pengkajian dan Penerapan Teknologi, PUSPIPTEK Serpong, Tangerang.
3.2 Bahan dan Alat
Bahan-bahan yang digunakan untuk ekspresi dan pemurnian enzim RNA helikase meliputi bakteri Escherichia coli BL21 (DE3) pLysS yang membawa gen NS3 RNA helikase virus hepatitis C dalam plasmid pET 21b (koleksi Andi Utama, Puslit Bioteknologi LIPI), media Luria Bertani (LB), akuades, ampisilin, isopropil β-D-thiogalaktopiranosidase (IPTG) 0,3 M; bufer B (Tris HCl 10 mM pH 8,5; NaCl 100 mM, dan Tween 20 0,25%), resin TALON, dan bufer elusi (400 mM imidazola dalam bufer B).
Bahan-bahan yang digunakan untuk menganalisis bobot molekul protein RNA helikase meliputi akuabides; Tris-HCl 1,5 M pH 8,8; akrilamid 30%, sodium dedosil sulfat (SDS) 10%, TEMED, amonium persulfat (APS) 10%, comassie blue, dan loading dye.
Bahan-bahan yang digunakan untuk ekstraksi dan pemurnian polisakarida dari mikroalga BTM 11 adalah isolat BTM 11 (koleksi Dwi Susilaningsih, Laboratorium Biorekayasa Lingkungan, Pusat Penelitian Bioteknologi LIPI), trichloroacetic acid (TCA), etanol, metanol, tris HCl 10 mM pH 8, glukosa 1 mg/mL, fenol, asam sulfat, sepharose 4B, media IMK-Seawater; adenosin trifosfat (ATP) 0,1 mM; 4-asam morfolinopropana sulfonat (MOPS) 0,1 mM; MgCl2 1 mM, larutan hijau malakit, polivinil alkohol 2,3%; amonium molibdat, natrium sitrat, dan akuades.
kolom kromatografi, SDS-PAGE, tabung vial, hot plate magnetic stirer, dan timbangan digital.
3.3 Metode Penelitian
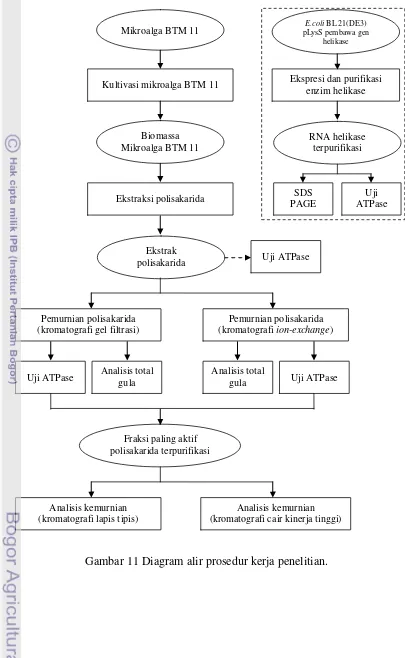
Penelitian ini dilakukan dalam beberapa tahap. Tahap satu yaitu preparasi RNA helikase HCV yang meliputi (1) ekspresi RNA helikase dengan cara menumbuhkan bakteri E. coli BL21 (DE3) pLysS yang membawa gen NS3 RNA helikase HCV dalam plasmid pET 21b (Utama et al. 2000), (2) pemurnian RNA helikase yang telah terekspresi pada sel bakteri menggunakan kromatografi afinitas (Utama et al. 2000). Tahap dua meliputi (1) kultivasi mikroalga BTM 11 dalam media IMK-Sea Water pada suhu ruang dengan pencahayaan 4800 lux, (2) ekstraksi polisakarida dari biomassa mikroalga BTM 11 (Wang et al. 2004). Tahap tiga meliputi (1) pemurnian ekstrak polisakarida menggunakan teknik kromatografi gel filtrasi dan kromatografi ion-exchange, (2) penentuan profil senyawa polisakarida inhibitor yang paling aktif menggunakan kromatografi lapis tipis dan kromatografi cair kinerja tinggi. Diagram alir prosedur kerja penelitian dapat dilihat pada Gambar 11.
3.3.1 Ekspresi dan purifikasi RNA helikase HCV (Utama et al. 2000)
Ekspresi RNA helikase protein NS3 HCV dilakukan berdasarkan metode Utama et al. (2000). Ekspresi dilakukan pada skala 400 mL. Sebanyak 10 µ L stok gliserol bakteri E. coli BL21 (DE3) pLysS yang membawa vektor ekspresi pET-21b/HCV NS3 helikase diinokulasi ke dalam 10 mL medium LB cair yang mengandung 1 µg/mL ampisilin, kemudian dikultur selama satu malam dalam inkubator goyang (shaker incubator) pada suhu 37 °C dengan kecepatan 150 rpm.
Hasil kultur disentrifugasi pada suhu 4 °C dengan kecepatan 4000 rpm selama 10 menit. Pelet diresuspensi dengan sisa medium LB cair, kemudian disentrifugasi kembali. Pelet yang diperoleh disimpan pada suhu -20 °C.
Pelet E. coli BL21 (DE3) pLysS dipecah dengan metode freeze & thaw sebanyak 3 kali ulangan yaitu dengan membekukan pelet pada suhu -20 °C selama 30 menit, lalu dicairkan pada suhu ruang selama 30 menit. Pelet kemudiian
diresuspensi dengan 20 mL larutan bufer B (Tris HCl 10 mM pH 8,5; NaCl 100 mM, Tween 20 0,25%). Tahap kedua pemecahan sel dilakukan dengan
metode sonikasi (Amplitudo 40; siklus 0,5; waktu 3x15 detik; interval waktu 1 menit). Suspensi sel disentrifugasi pada suhu 4 °C dengan kecepatan 10.000 rpm selama 20 menit. Supernatan diambil untuk tahapan selanjutnya, sedangkan pelet disimpan untuk analisis SDS-PAGE.
Enzim RNA helikase yang diduga berada dalam supernatan dipurifikasi menggunakan metode kromatografi afinitas. Supernatan ditambahkan dengan 300 µ L resin TALON, kemudian dilakukan tahap pengikatan (binding) menggunakan rotator selama 3 jam dalam ruang pendingin (4 °C). Sampel selanjutnya disentrifugasi pada suhu 4 °C dengan kecepatan 3.500 rpm selama 7 menit. Supernatan (inner volume) disimpan pada suhu 4 °C untuk analisis SDS-PAGE. Pelet (resin binding) diresuspensi dengan 10 mL larutan bufer B dan disentrifugasi pada suhu 4 °C dengan kecepatan 3.500 rpm selama 5 menit. Tahapan ini dilakukan sebanyak 2 kali sehingga diperoleh 2 larutan supernatan (washing 1 & washing 2) yang disimpan pada suhu 4 °C dan digunakan untuk analisis SDS-PAGE.
disentrifugasi sehingga diperoleh supernatan (E2). Supernatan (E1 dan E2) disimpan pada suhu 4 °C dan digunakan untuk analisis ATPase dan SDS-PAGE.
3.3.2 Kultivasi dan pemanenan mikroalga BTM 11
Kultivasi BTM 11 dilakukan dengan media IMK-SW. Namun sebelum dikultivasi, inokulum disegarkan terlebih dahulu dengan media IMK. Media IMK-SW digunakan untuk membuat suatu kondisi yang sama dengan media awal pertumbuhan mikroalga tersebut. Penyegaran stok mikroalga dilakukan dalam keadaan aseptik pada erlenmeyer 500 mL dengan penyinaran lampu 4800 lux, dan diberi aerasi. Mikroalga dikultur selama 14 hari sebelum dipindahkan ke kultur dengan skala yang lebih besar. Komposisi media IMK-SW dapat dilihat pada Lampiran 1. Pemanenan dilakukan dengan teknik filtrasi, yaitu hasil kultur disaring menggunakan kain filtrasi sehingga didapatkan biomassa basah. Biomassa basah tersebut dikeringkan menggunakan oven pada suhu 60 °C selama 2 hari. Biomassa kering yang didapatkan kemudian dilakukan pengecilan ukuran menjadi bentuk serbuk dengan menggunakan mortar.
3.3.3 Ekstraksi polisakarida BTM 11 (modifikasi Wang et al.2004)
3.3.4 Pemurnian polisakarida dari mikroalga BTM 11
1) Kromatografi gel filtrasi (Amersham 1999)
Matriks gel Sepharose 4B dimasukkan secara perlahan ke dalam kolom kromatografi. Ekstrak kasar polisakarida BTM 11 dilarukan dalam buffer (Tris HCl 10mM pH 8) dan sebanyak 5% dari volume kolom dimasukkan ke kolom gel filtrasi. Sampel dielusi dengan eluen etanol 30%, dengan laju alir 1 mL/menit tiap fraksi. Masing-masing fraksi hasil pemurnian diuji aktivitas penghambatannya terhadap RNA helikase virus hepatitis C dengan uji ATPase. 2) Kromatografi ion-exchange(modifikasi Baumgartner dan Chrispeels 1976)
Kolom kromatografi dibilas dengan menggunakan kation-anion exchange. Setelah itu, sebanyak 1 mL sampel polisakarida inhibitor diinjeksikan ke dalam kolom kromatografi. Eluen yang digunakan adalah NaCl 0,1-1 M. Hasil elusi ditampung dalam tabung vial dengan volume masing-masing 1 mL. Masing-masing fraksi diuji aktivitas inhibisinya dengan uji ATPase.
3.3.5 Profil kemurnian fraksi aktif polisakarida inhibitor RNA helikase
Fraksi yang memiliki aktivitas paling tinggi dari masing-masing teknik pemurnian dibandingkan dan dipilih fraksi paling aktif untuk dilihat profil kemurniannya menggunakan kromatografi lapis tipis, dan diperjelas kembali menggunakan kromatografi cair kinerja tinggi.
1) Kromatografi lapis tipis (modifikasi Putri 2011)
Plat silika F254 disiapkan dan diatur jarak antara garis penotolan dengan garis akhir. Bejana (chamber) KLT diisi dengan eluen asetonitril : etanol dengan perbandingan 3:7 dan diinkubasi selama beberapa menit hingga jenuh. Plat yang telah ditotol dengan sampel hasil pemurnian yang memiliki aktivitas inhibisi tertinggi dikembangkan dalam bejana sampai eluen mencapai garis akhir. Hasil KLT kemudian divisualisasi menggunakan sinar UV dengan panjang gelombang 254 nm, setelah itu disemprot dengan penampak bercak serium sulfat dan dipanaskan hingga terlihat spot hasil kromatografi.
2) Kromatografi cair kinerja tinggi (KCKT) / HPLC
a. Fase Gerak : H2SO4 0,008 N
b. Kolom : Aminex® HPX-87H, 300 mm x 7.8 mm c. Detektor : Refractive Index
d. Flow rate : 1 mL/min e. Suhu kolom : 35 ºC f. Back Pressure : 1553 psi
3.4 Prosedur Analisis
Analisis yang dilakukan dalam penelitian ini meliputi (1) penentuan bobot molekul RNA helikase murni menggunakan SDS-PAGE, (2) uji aktivitas penghambatan RNA helikase HCV terhadap ekstrak polisakarida dan fraksi polisakarida termurnikan, (3) penentuan kandungan gula pada fraksi polisakarida murni yang memiliki aktivitas penghambatan yang tinggi terhadap RNA helikase HCV.
3.4.1 Analisis enzim RNA helikase dengan SDS-PAGE (Speicher 1997)
Analisis menggunakan alat SDS-PAGE. Glass plate sandwich (short plate & spacer plate) dibersihkan dengan etanol. Short plate ditempatkan di depan kaca spacer plate. Kedua kaca kemudian dimasukkan ke dalam casting frame dengan posisi bagian bawah kedua kaca sama rata lalu dikunci dengan menekan cams. Casting frame dipasang pada casting stand. Setelah peralatan siap, larutan gel separating dibuat sesuai dengan prosedur (Lampiran 2a). Larutan tersebut dimasukkan di antara celah short plate & spacer plate sampai duapertiga bagian lalu ditambah akuades sampai dengan batas atas kaca, ditunggu ±20 menit sampai terbentuk gel. Selama menunggu 20 menit, larutan gel stacking dibuat sesuai dengan prosedur (Lampiran 2b). Sebelum larutan gel stacking dimasukkan, air yang ada pada gel separating dibuang. Larutan gel stacking dituang sampai batas atas kaca, comb dimasukan, ditunggu ±20 menit sampai gel terbentuk.
dimasukan ke dalam tank elektroforesis lalu diisi dengan working solution (Buffer Elektroforesis SDS 1X pH 8,3).
Masing-masing sampel diambil 4 µ L lalu dicampur dengan 2 µ L loading dye (Lampiran 2c). Campuran didenaturasi pada suhu 95 °C selama 15 menit. Marker protein (BIORAD®) sebanyak 4 µ L/gel dimasukkan ke dalam well. Masing-masing sampel yang sudah dicampur dengan loading dye, dimasukkan ke dalam well sebanyak 5 µ L/well.Gel dielektroforesis selama 90 menit dengan arus 40 mA. Gel diangkat lalu direndam dalam Commasie Blue G-250 staining solution (Lampiran 2d) selama 1 jam sambil digoyang-goyang di atas rocker. Gel dibilas dengan Commasie Blue G-250 destaining solution (Lampiran 2e) ±20 menit, dilakukan dua kali. Gel dibilas dengan H2O sampai bau asamnya hilang dan disimpan pada suhu 4 °C.
Gel menunjukkan elektroforegram dari RNA helikase HCV berupa pita protein dengan bobot molekul 54 kDa. Perhitungan bobot molekul (BM) dilakukan terlebih dahulu dengan menghitung retardation factor (Rf) dari masing-masing pita protein marker dan pita protein target menggunakan rumus :
Nilai Rf pada pita-pita protein marker digunakan untuk memperoleh kurva standar terhadap log standar BM dari marker. Bobot molekul dihitung melalui persamaan regresi linier kurva standar yang diperoleh, yaitu y = ax + b. Nilai “x” yang dimasukkan merupakan nilai Rfdari pita protein target, sedangkan nilai “y” merupakan nilai log BM dari pita protein target. Nilai bobot molekul diperoleh dari antilog BM pita protein target.
3.4.2 Uji aktivitas ATPase RNA helikase HCV (Utama et al. 2000)
Pengujian aktivitas inhibisi enzim helikase virus hepatitis C dengan sampel hasil pemurnian polisakarida BTM 11 menggunakan uji ATPase kolorimetri (Utama et al. 2000), yaitu dengan mengukur jumlah fosfat yang dilepaskan dari hidrolisis senyawa ATP menjadi ADP dan fosfat anorganik (Pi). Konsentrasi akhir reaksi adalah sebesar 175 µ L/sumur.Sistem reaksi enzim selengkapnya untuk satu sampel dengan volume total 175 µ L dapat dilihat pada Tabel 2.
Rf =Jarak dari titik awal elektroforesis ke pita protein
Tabel 2 Sistem reaksi enzim untuk satu sampel dengan volume total 175 µ L Inkubasi pada suhu ruang selama 45 menit
Dye solution* 100 100 100 100 Inkubasi pada suhu ruang selama 5 menit
Na-sitrat 25 25 25 25 Pembacaan pada λ 620 nm dengan referensi 405 nm (Abs. 620 nm – 405 nm) *H2O : hijau malakit : polivinil alkohol : amonium molibdat (2 : 2 : 1 : 1)
Persentase aktivitas penghambatan senyawa inhibitor terhadap RNA helikase ditentukan dengan rumus:
Keterangan :
A = Absorbansi RNA helikase tanpa senyawa inhibitor
I = Absorbansi RNA helikase dengan adanya senyawa inhibitor
3.4.3 Analisis kandungan gula fraksi polisakarida BTM 11 (Dubois et al.
1956)
Analisis ini bertujuan untuk memastikan bahwa fraksi aktif dari kromatografi gel filtrasi dan ion-exchange terdapat kandungan polisakarida dengan cara mendeteksi komponen gula penyusunnya menggunakan metode fenol-asam sulfat. Langkah awal yaitu membuat kurva standar dengan glukosa (1 mg/mL) sebagai standar dari konsentrasi tertinggi hingga terendah. Sebanyak 0; 0,1; 0,3; 0,5; 0,8; dan 1 mg/mL glukosa dimasukkan ke dalam tabung reaksi dan ditambahkan akuades hingga mencapai volume 100 µ L. Sebanyak 0,5 mL larutan fenol 5%; 2,5 mL H2SO4 pekat dicampurkan ke dalam tabung tersebut dan dicampur rata. Standar glukosa diganti dengan akuades untuk blanko, sedangkan untuk analisis sampel, standar diganti dengan (polisakarida 1%). Setelah itu campuran diinkubasi selama 15 menit di ruang asam. Lalu tabung berisi campuran diinkubasi dalam waterbath (40 °C) selama 15-30 menit, dan diamati perubahan warna yang terjadi. Absorbansi dibaca pada panjang gelombang 490 nm. Kandungan gula dihitung melalui persamaan regresi linier kurva standar yang
% Inhibisi = A−I
4 HASIL DAN PEMBAHASAN
4.1 Ekspresi dan Pemurnian RNA Helikase Virus Hepatitis C
Ekspresi dan pemurnian RNA helikase HCV dilakukan untuk memperoleh RNA helikase HCV murni yang dapat digunakan dalam pengujian aktivitas polisakarida inhibitor terhadap aktivitas ATPase. Ekspresi RNA helikase HCV dilakukan pada bakteri Escherichia coli BL21 (DE3) pLysS dalam plasmid pET 21b. Sambrook & Russell (2001) menjelaskan bahwa E. coli BL21 (DE3) pLysS merupakan sel kompeten yang bersifat resisten terhadap antibiotik kloramfenikol dan berperan sebagai sel inang pada ekspresi gen, sedangkan pET 21b pada ekspresi gen berperan sebagai vektor ekspresiyang memiliki sifat resisten terhadap antibiotik ampisilin.
Ekspresi RNA helikase diawali dengan penumbuhan bakteri E. coli BL21 (DE3) pLysS yang membawa gen NS3 RNA helikase virus hepatitis C dalam plasmid pET 21b ke dalam 10 mL media Luria-Bertani (LB) yang sudah ditambahkan ampisilin. Penggunaan media ini dipilih karena media LB merupakan media yang cocok bagi pertumbuhan bakteri, termasuk E.coli
dikarenakan pertumbuhan yang relatif cepat dan rendemen yang lebih baik (Sezonov et al. 2007). Penambahan ampisilin bertujuan sebagai penanda seleksi
untuk membedakan E. coli rekombinan yang membawa gen NS3 helikase HCV dengan bakteri lain yang tidak membawa gen NS3 helikase HCV. Tahap ini merupakan pembuatan prekultur yang bertujuan untuk menyegarkan kembali stok biakan bakteri ke dalam media baru sehingga dapat tumbuh dengan optimal ketika dikultur ke skala yang lebih besar. Prekultur diinkubasi selama satu malam di inkubator berpenggoyang dengan suhu 37 °C pada kecepatan 150 rpm. Warna kultur yang berubah menjadi kuning keruh menunjukkan bahwa bakteri E.coli BL21 (DE3) pLysS berhasil ditumbuhkan.
bakteri E. coli yang ditumbuhkan pada media LB memasuki fase pertumbuhan eksponensial pada saat nilai OD600 sebesar 0,2 atau 0,3; dan mengakhiri fase tersebut ketika nilai OD600 sebesar 0,6 hingga 1.
Pembelahan sel E. coli yang mengekspresikan RNA helikase pada fase logaritmik terjadi sangat cepat, sehingga diperlukan penambahan isopropil β -D-thiogalaktopiranosidase (IPTG) yang akan menginduksi gen NS3 RNA helikase HCV agar terjadi ekspresi berlebih. Utama et al. (2000) menjelaskan bahwa ekspresi berlebih pada gen NS3 menyebabkan pembentukan enzim RNA helikase dalam jumlah yang lebih banyak dari fase logaritmik hingga fase awal stasioner.
Koleksi sel E. coli menggunakan sentrifugasi dilakukan setelah nilai OD600 mencapai ±1 (±3 jam), yang menunjukkan bahwa kultur sudah memasuki fase awal stasioner. Sentrifugasi dilakukan pada suhu rendah untuk menghindari protein mengalami denaturasi. Sentrifugasi akan memisahkan E. coli dengan media LB. Bakteri E. coli akan mengendap sebagai pelet, dan disimpan pada suhu -20 °C untuk menjaga stabilitas sel bakteri.
Enzim RNA helikase HCV terekspresi secara intraseluler pada sel E.coli BL21 (DE3) pLysS, sehingga untuk memurnikannya harus dilakukan pemecahan dinding sel agar komponen intraseluler termasuk RNA helikase HCV dapat keluar dari dalam sel E. coli. Pemecahan sel dilakukan dengan metode freeze-thaw dan sonikasi. Proses freeze-thaw dilakukan dengan mengkondisikan sel E. coli selama ±30 menit secara bergantian di suhu ruang dan suhu beku (-20 °C) sebanyak tiga kali ulangan. Hal ini dapat menyebabkan terjadinya pembentukan kristal es pada sel E. coli, sehingga sel akan lebih mudah untuk dipecah. Pemecahan sel selanjutnya adalah dengan sonikasi. Pada tahap sonikasi, sel E. coli dilarutkan dalam bufer B, dengan komponen penyusunnya yaitu Tween 20, NaCl dan Tris HCl.
dengan RNA helikase (Vanz et al. 2008), sedangkan Tris HCl berfungsi sebagai larutan penyangga.
Hasil pemecahan sel bakteri (cell lysate) diduga telah mengandung enzim RNA helikase HCV, sehingga harus dimurnikan menggunakan kromatografi afinitas. Metode ini didasarkan pada pengikatan spesifik logam Ni2+ atau Co2+ yang dimiliki resin TALON dengan label 6xHis-tag (tag protein dengan enam histidin) yang terdapat pada ujung RNA helikase. Petty (1996) menjelaskan bahwa histidin akan berikatan secara selektif ke logam Co2+ resin TALON meskipun dalam resin tersebut terdapat ion metal bebas lainnya. BD Bioscience Clontech (2003) menjelaskan bahwa resin TALON menggunakan tetradentate metal chelator untuk purifikasi protein rekombinan polyhistidine-tagged. Chelator tersebut mengikat kuat logam elektropositif pada kantung elektronegatif yang ideal untuk pengikatan ion logam seperti kobalt. Kantung pengikatan tersebut adalah sebuah struktur oktahedral yaitu 4 dari 6 situs logam kobalt berikatan dengan ligan resin TALON, sedangkan dua situs yang bebas akan berikatan dengan 6xHis-tag. Tetradendate metal berarti tidak ada logam yang tidak berikatan selama purifikasi protein dalam berbagai kondisi. Pengikatan resin TALON dengan 6xHis-tag dapat dilihat pada Gambar 12.
Gambar 12 Pengikatan resin TALON (A) dengan 6xHis-tag (B) (BD Bioscience Clontech 2003).
Analisis kemurnian protein target menggunakan pengukuran bobot molekul dengan SDS-PAGE. Hasil pelisisan sel, pencucian dari hasil pengikatan dengan resin TALON dan hasil elusi dengan imidazol dilihat kemurniannya berdasarkan ada atau tidaknya protein target pada masing-masing tahapan tersebut. Elektroforesis dilakukan menggunakan gel akrilamid dengan konsentrasi 8%. Hal ini dikarenakan protein target (enzim) memiliki bobot molekul yang besar, sehingga dibutuhkan gel akrilamid dengan konsentrasi rendah agar terjadi pemisahan pita protein yang optimal. Elektroforegram SDS-PAGE dapat dilihat pada Gambar 13.
Gambar 13 Analisis SDS-PAGE pemurnian RNA helikase HCV. P: pelet sel, S: supernatan hasil lisis, IV: inner volume (supernatan binding), W1: pencucian pertama, W2: pencucian kedua, E1&E2: RNA helikase HCV, M: marker protein.
4.2 Kultivasi Mikroalga BTM 11
Mikroalga BTM 11 merupakan salah satu ganggang atau fitoplankton yang diisolasi dari perairan laut Batam, dengan lokasi spesifik yaitu pada titik/stasiun ke-11 di area pengamatan. Kultur mikroalga BTM 11 dilakukan dengan media IMK-SW. Penggunaan media ini disesuaikan dengan kebutuhan nutrisi mikroalga BTM 11 yang mengacu kepada habitat asal isolat mikroalga tersebut. Kultur tersebut berwarna hijau pekat. Warna ini berhubungan dengan pigmen yang dimiliki oleh BTM 11. Warna kultur semakin pekat seiring dengan lamanya waktu kultur. Kepekatan warna yang terjadi menunjukkan kepadatan biomasa pada kultur tersebut. Kondisi kultur mikroalga BTM 11 dapat dilihat pada Gambar 14.
Gambar 14 Kondisi kultivasi mikroalga BTM 11.(A: prekultur pada galon, B: Scale-up kultur, C: Hasil panen).
Pertumbuhan BTM 11 diketahui dengan mengukur kepadatan sel menggunakan spektrofotometer. Hal ini dikarenakan morfologi sel dari BTM 11 yang berbentuk filamen, sehingga tidak memungkinkan untuk dihitung secara manual menggunakan hemasitometer. Kepadatan sel diukur pada serapan panjang gelombang 630 nm dikarenakan mikroalga BTM 11 memiliki serapan optimum pada panjang gelombang tersebut. Andersen (2005) menjelaskan bahwa besarnya serapan gelombang cahaya monokromatik pada pengukuran kepadatan sel kultur mikroalga didasari oleh warna yang dihasilkan oleh mikroalga tersebut.
Gambar 15 Mikroalga BTM 11 dengan perbesaran 1000x. (Dokumentasi Laboratorium Biorekayasa Lingkungan 2010).
Biomassa hasil panen mikroalga BTM 11 diperoleh dari Laboratorium Biorekayasa Lingkungan, Pusat Penelitian Bioteknologi LIPI dengan umur panen 14 hari. Kultur mikroalga BTM 11 sebanyak 30 liter menghasilkan biomassa basah hasil panen sebesar 338 g (kering 38 g). Kurva pertumbuhan mikroalga BTM 11 dapat dilihat pada Gambar 16.
Gambar 16 Kurva pertumbuhan mikroalga BTM 11.
Mikroalga BTM 11 dipanen sebelum mencapai fase stasioner (fase pertumbuhan) (Gambar 16). Hal ini berdasarkan pada waktu pembentukan
makromolekul polisakarida dalam sel mikroalga. Arad et al. (1985) menjelaskan bahwa aktivitas optimum pembentukan polisakarida terjadi pada fase stasioner. Namun pada fase stasioner, pembentukan optimal polisakarida bersamaan dengan sekresi polisakarida tersebut oleh mikroalga ke media tumbuh yang dapat dilihat dari peningkatan viskositas media tumbuh mikroalga. Hasil penelitian Putri (2011) menunjukkan bahwa biomassa mikroalga BTM 11 yang dipanen pada akhir fase pertumbuhan eksponensial (umur 50 hari pada media yang berbeda)
0 0,5 1 1,5 2 2,5 3
1 2 4 6 8 10 12 14
Ab
sor
b
an
si
Hari
ke-Fase lag
memiliki aktivitas penghambatan yang optimum terhadap RNA helikase HCV, yaitu sebesar 81,2%.
4.3 Ekstrak Polisakarida Mikroalga BTM 11
Teknik ekstraksi polisakarida yang digunakan mengacu kepada metode Wang et al. (2004). Ekstraksi bertujuan untuk memisahkan satu atau lebih senyawa yang diinginkan dalam suatu larutan atau padatan yang mengandung campuran senyawa-senyawa tersebut. Ekstraksi dilakukan terhadap BTM 11 yang sudah dalam bentuk serbuk, dengan tujuan untuk mempermudah kontak antara sampel dengan pelarut. Ekstraksi polisakarida dilakukan dengan cara maserasi pada suhu ruang, sehingga dapat dihindari terjadinya penguraian zat aktif yang terkandung dalam sampel oleh pemanasan. Maserasi dilakukan secara bertingkat dengan menggunakan pelarut yang berbeda tingkat kepolaran secara bergantian (polar dan semi polar). Pelarut yang digunakan secara berurutan adalah etanol, aseton dan air garam.
Penggunaan etanol dapat melarutkan senyawa-senyawa selain polisakarida yang memiliki tingkat kepolaran sama dengan etanol. Polisakarida cenderung tidak larut terhadap etanol, dikarenakan terjadinya interaksi secara kovalen antar monomer penyusunnya yang menyebabkan terbentuknya konformasi ikatan yang lebih rigid dan kompleks sehingga pada beberapa kasus, polisakarida akan mengendap sebagai presipitat (Varki et al. 1999; Shi et al. 2007). Penggunaan aseton pada tingkat ekstraksi selanjutnya akan melarutkan senyawa selain polisakarida yang pada proses sebelumnya tidak larut terhadap etanol dikarenakan tingkat kepolaran yang berbeda. Rianudo (2006) menjelaskan bahwa penggunaan larutan garam (0,9% NaCl) akan melarutkan polisakarida dikarenakan penambahan garam tidak jenuh dengan konsentrasi rendah menyebabkan molekul polisakarida menjadi bermuatan sehingga terjadi interaksi ionik antara molekul polisakarida dengan garam.
dikarenakan proses berlangsung pada suhu rendah. Hasil ekstraksi dari 2 g biomassa kering menghasilkan 50 mg ekstrak polisakarida. Ekstrak kasar polisakarida inhibitor kemudian diuji aktivitas penghambatannya menggunakan uji ATPase. Hasil pengujian menunjukkan ekstrak kasar polisakarida BTM 11 dapat menghambat aktivitas ATPase dari RNA helikase HCV sebesar 64,65%. Nilai ini menunjukkan bahwa inhibitor menghambat sebesar 64,65% aktivitas enzim per 1 molekul RNA helikase dalam menghidrolisis ATP menjadi ADP dan fosfat anorganik. Aktivitas inhibisi dari ekstrak kasar polisakarida BTM 11 dapat dilihat pada Tabel 3.
Tabel 3Aktivitas inhibisi dari ekstrak polisakarida
No. Tahapan Aktivitas inhibisi (%)
1
Aktivitas inhibisi (Tabel 2) fluktuatif selama proses ekstraksi polisakarida. Hasil maserasi tahap akhir oleh NaCl 0,9% memiliki aktivitas penghambatan terhadap RNA helikase lebih besar dari 100%, hal ini dikarenakan masih terdapatnya banyak senyawa yang dalam aktivitasnya secara in vitro dapat menghambat aktivitas RNA helikase. Pada tahap selanjutnya, yaitu deproteinasi menggunakan TCA 10% menunjukkan aktivitas penghambatan yang lebih rendah dari sebelumnya, hal ini dapat terjadi karena sebagian senyawa terendapkan oleh TCA sehingga filtrat hasil presipitasi tersebut memiliki aktivitas yang rendah. Ye et al. (2008) menjelaskan bahwa penambahan TCA dapat menghilangkan protein yang terkandung dalam sampel.
Ekstrak kasar polisakarida yang dihasilkan memiliki aktivitas inhibisi yang lebih rendah dari penelitian sebelumnya. Mustopa et al. (2010) menjelaskan bahwa ekstrak kasar mikroalga BTM 11 memiliki aktivitas penghambatan terhadap RNA helikase sebesar 80% (dilusi 5x). Perbedaan ini karena penggunaan metode ekstraksi bertingkat pada penelitian ini menyebabkan banyak senyawa yang dapat berperan sebagai inhibitor ikut hilang selama proses ekstraksi. Namun ekstrak kasar polisakarida yang dihasilkan pada penelitian ini memiliki aktivitas inhibisi yang lebih tinggi dari mikroalga jenis lain. Mustopa et al. (2010) juga menjelaskan bahwa beberapa jenis mikroalga yang diisolasi dari perairan Ciater (Jawa Barat) memiliki aktivitas penghambatan terhadap RNA helikase HCV kurang dari 50%.
4.4 Pemurnian Polisakarida Inhibitor RNA Helikase
1) Kromatografi gel filtrasi
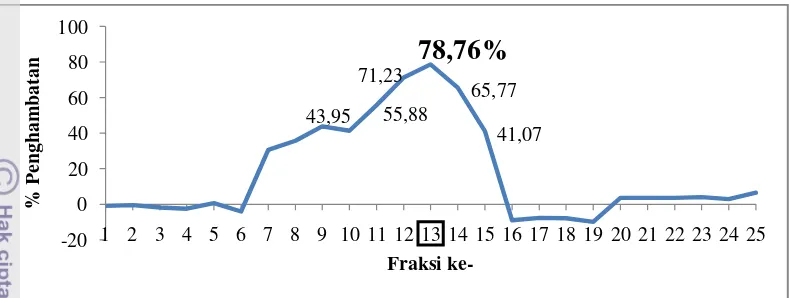
penghambatan RNA helikase HCV oleh hasil fraksinasi kromatografi gel filtrasi dapat dilihat pada Gambar 17.
Gambar 17 Inhibisi polisakarida fraksi gel filtrasi terhadap aktivitas ATPase RNA helikase HCV.
Hasil fraksinasi dengan aktivitas penghambatan tertinggi yang diperoleh tergolong cukup efektif, dan lebih tinggi jika dibandingkan dengan hasil penelitian sebelumnya. Mori et al. (2012) melaporkan bahwa polisakarida yang diisolasi darimakroalga Cladosiphon okamuranus memiliki aktivitas penghambatan terhadap replikasi HCV sebesar 60%. Perbedaan ini karena penggunaan metode ekstraksi dan pemurnian yang digunakan berbeda, sehingga kandungan polisakarida yang aktif menghambat virus hepatitis C juga berbeda.
Beberapa bahan aktif dari produk alam jenis lain juga diketahui dapat menghambat aktivitas RNA helikase HCV. Hasil pemurnian ekstrak buah tanaman mangrove (Avicennia marina) dapat menghambat aktivitas ATPase enzim RNA helikase HCV sebesar 76,7% (Kusumawati 2011). Selain itu terdapat pula hasil pemurnian ekstrak rimpang temulawak (Curcuma zanthorrhiza) yang dapat aktivitas ATPase dari enzim RNA helikase HCV sebesar 73,6% (Setianingsih 2011).
2) Kromatografi ion-exchange
Pemurnian ini menggunakan sistem elusi gradien, senyawa dihilangkan dari kolom dengan mengubah kondisi elusi yang tidak cocok untuk ikatan ion molekul terlarut. Perubahan kondisi elusi dilakukan dengan cara meningkatkan gradien konsentrasi garam. Eluen yang dipakai adalah NaCl dengan konsentrasi dimulai dari 0,1-1 M. Profil aktivitas penghambatan RNA helikase HCV oleh hasil fraksinasi kromatografi ion-exchange dapat dilihat pada Gambar 18.
Gambar 18 Inhibisi polisakarida fraksi ion-exchange terhadap aktivitas ATPase RNA helikase HCV.
Aktivitas penghambatan tertinggi adalah sebesar 74,6% dengan konsentrasi 0,7205 mM pada fraksi ke-10. Nilai ini merupakan nilai murni aktivitas penghambatan karena sudah dikurangi dengan kontrol negatif yaitu NaCl 0,25 M. Aktivitas penghambatan ini lebih rendah dari hasil kromatografi gel filtrasi. Hal ini diduga karena interaksi yang lebih kuat antara eluen dengan polisakarida inhibitor pada kromatografi gel filtrasi, sehingga zat aktif akan lebih mudah terelusi oleh fase gerak. Rinaudo (2006) menjelaskan polisakarida berikatan kuat dengan molekul polar dengan cara membentuk ikatan hidrogen dari gugus –OH yang dimilikinya. Tabulasi data aktivitas penghambatan dari hasil fraksinasi kromatografi ion-exchange dapat dilihat pada Lampiran 5.
4.5 Analisis Kandungan Gula
Fraksi aktif dalam penghambatan terhadap RNA helikase HCV pada tiap teknik kromatografi dianalisis untuk menentukan konsentrasi gula penyusun polisakarida pada sampel. Gula penyusun polisakarida yang dianalisis dalam penelitian ini adalah glukosa. Penentuan konsentrasi gula mengacu pada kurva standar glukosa (Lampiran 6). Hasil analisis gula dapat dilihat pada Tabel 4.
Tabel 4 Analisis kandungan gula
Hasil pada Tabel 4 menunjukkan bahwa fraksi 13 kromatografi gel filtrasi dengan nilai aktivitas penghambatan tertinggi terhadap RNA helikase HCV memiliki konsentrasi gula sebesar 2,97 mg/mL, sedangkan fraksi 10 kromatografi ion-exchange memiliki konsentrasi gula sebesar 3,21 mg/mL. Hal ini menunjukkan bahwa kandungan gula tidak selalu berkorelasi dengan aktivitas penghambatan dari polisakarida inhibitor, dikarenakan analisis hanya dilakukan terhadap glukosa yang merupakan salah satu penyusun polisakarida. Sehingga dalam aktivitas menghambat RNA helikase HCV, tidak tertutup kemungkinan bahwa glukosa berikatan dengan senyawa lain.
Penelitian ini menggunakan metode fenol-asam sulfat. Dubois et al. (1956) menjelaskan bahwa prinsip metode fenol-asam sulfat adalah gula sederhana, oligosakarida, polisakarida dan turunannya, termasuk metil eter akan membentuk warna kuning ketika direaksikan dengan fenol yang terkonsentrasi pada asam sulfat. Metode ini mengukur besarnya kandungan gula di dalam sampel, baik yang dalam kondisi berikatan maupun senyawa bebas.
Bennet dan Steitz (1978) menjelaskan bahwa senyawa glukosa dalam keadaan terikat/terkonjugasi dapat menghambat aktivitas ATPase dengan cara mengubah konformasi bentuk enzim heksokinase. Hal ini menunjukkan bahwa senyawa glukosa juga dapat menghambat aktivitas ATPase dari enzim RNA helikase. Utama et al. (2000) menjelaskan bahwa enzim RNA helikase memperoleh energi untuk membuka ikatan dupleks RNA virus hepatitis C dari aktivitasnya sebagai ATPase dalam menghidrolisis ATP menjadi ADP dan fosfat anorganik (Pi). Mukherjee et al. (2012) menyebutkan bahwa terdapat beberapa senyawa lain yang berperan sebagai inhibitor RNA helikase HCV yaitu triphenylmethane, acridone, amidinoanthracycline, tropolone, symmetrical benzimidazole, dan turunan senyawa primuline.
4.6 Analisis Kemurnian Fraksi Aktif Polisakarida Inhibitor
1) Kromatografi lapis tipis (KLT)
senyawa aktif pada plat KLT. Eluen (fase gerak) yang digunakan adalah asetonitril:metanol (6:4),sedangkan adsorben atau fase diam yang digunakan adalah silika gel. Menurut Bintang (2010), silika gel umumnya digunakan pada KLT untuk memisahkan senyawa asam amino, alkaloid, gula, asam lemak, lipid, minyak esensial, anion dan kation anorganik, steroid dan terpenoid. Tiap spot yang terdeteksi merupakan gambaran suatu senyawa. Hasil kromatogram dan retardation factor (Rf) yang dihasilkan dapat dilihat padaGambar 19dan Tabel 5.
Gambar 19 Kromatogram KLT dengan deteksi sinar UV 254 nm.(kiri: fraksi 13 kromatografi gel filtrasi, kanan: standar glukosa 1 mg/mL).
Tabel 5 Nilai Rfsenyawa aktif polisakarida
Sampel Rf
Fraksi 13 kromatografi gel filtrasi Standar glukosa
0,832 0,834
berikatan lebih kuat dengan fase diam akan terpisah paling akhir dikarenakan daya serap adsorben dengan komponen-komponen senyawa tidak sama sehingga senyawa tersebut akan bergerak dengan kecepatan yang berbeda berdasarkan tingkat kepolarannya.
2) Kromatografi cair kinerja tinggi (KCKT/HPLC)
Fraksi dengan aktivitas tertinggi (fraksi 13) dari hasil fraksinasi gel filtrasi dianalisis kemurniannya menggunakan teknik kromatografi cair kinerja tinggi (KCKT/HPLC). Tingkat kemurnian akan terlihat dari banyaknya peak atau puncak yang terdeteksi yang menunjukkan banyaknya senyawa yang terdeteksi dalam sampel. Tingkat kemurnian paling tinggi diperoleh jika hanya terdapat satu peak yang terdeteksi. Kromatogram yang ditunjukkan oleh fraksi 13 dan hasil analisisnya dapat dilihat pada Gambar 20.
Gambar 20Kromatogram KCKT fraksi 13.
5 SIMPULAN DAN SARAN
5.1 Simpulan
Enzim RNA helikase berhasil dipurifikasi dengan bobot molekul sebesar 54 kDa. Kultur mikroalga BTM 11 dapat tumbuh pada media IMK-Sea Water dengan menghasilkan biomassa basah sebesar 338 g pada umur panen 14 hari. Polisakarida yang memiliki aktivitas inhibisi tertinggi terhadap RNA helikase HCV diperoleh melalui pemurnian menggunakan kromatografi gel filtrasi, dengan aktivitas sebesar 78,76% dan kandungan gula sebesar 2,97 mg/mL. Hasil pemurnian lanjutan menggunakan kromatografi lapis tipis menghasilkan satu spot senyawa aktif dengan nilai Rf sebesar 0,832. Hasil analisis fraksi aktif dengan menggunakan KCKT diperoleh 3 puncak senyawa yang menandakan bahwa hasil fraksi polisakarida belum murni.
5.2 Saran