Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Judul Skripsi
: Isolasi dan Pemurnian Bahan Aktif dari Mikroalga
Sebagai Inhibitor RNA Helikase Virus
Hepatitis C
Nama
: Prabawati Hyunita Putri
NIM
: G84063232
Disetujui
Komisi Pembimbing
Prof. Dr. drh. Maria Bintang, M.S A. Zaenal Mustopa, M.Si
Ketua
Anggota
Diketahui
Dr. Ir. I Made Artika, M.App.Sc.
Ketua Departemen Biokimia
PRABAWATI HYUNITA PUTRI. Isolasi dan Pemurnian Bahan Aktif dari
Mikroalga
Sebagai Inhibitor RNA Helikase Virus Hepatitis C. Dibimbing
oleh MARIA BINTANG dan A. ZAENAL MUSTOPA.
PRABAWATI HYUNITA PUTRI. Isolation and Purification Active Compound
from Microalgae
As Inhibitor RNA Helicase Hepatitis C Viruses. Under
the direction of MARIA BINTANG and A. ZAENAL MUSTOPA.
Puji dan syukur penulis panjatkan kepada Allah SWT, yang telah melimpahkan
karunia-Nya sehingga terselesaikannya skripsi ini. Skripsi ini berjudul Isolasi dan
Pemurnian Bahan Aktif dari Mikroalga
Sebagai Inhibitor RNA Helikase
Virus Hepatitis C. Penelitian ini didanai oleh Indonesia Toray Science Foundation
atas nama A. Zaenal Mustopa dengan judul Isolation and Identification of RNA
helicase Inhibitor from Indonesia Microalgae. Penelitian ini dilangsungkan di
Laboratorium Virologi dan Bakteriologi Molekuler, Puslit Bioteknologi LIPI
Cibinong.
Penulis mengucapkan terima kasih kepada Prof. Dr. drh. Maria Bintang, M.S.
selaku pembimbing utama serta A. Zaenal Mustopa, M.Si sebagai pembimbing
kedua, Dr. Laksmi Ambarsari, M.S serta Dr. Dwi Susilaningsih, M.Pharm.
Ucapan terima kasih juga disampaikan kepada Bapak, Ibuk, Ervian Hadi Ramdani
serta semua keluarga atas dukungannya. Penulis juga mengucapkan terima kasih
kepada Mas Ridwan, Mas Melky, Mas Erik, Mas kukun dan Mbak Hilda. Tidak
lupa penulis ucapkan terima kasih kepada Penulis juga mengucapkan terima kasih
untuk teman-teman di laboratorium (Skoti, Ika, Tya, Marcel, Sholeh, dan Bu
Emi), Biokimia 43 (Tiwi, Nestri, Mike, Iyaz, Umul, Marsu, Onta, Adju, dan
Himajaman), Seroja (Vivi, Lina, Lastri, Maria), D’Sabars (Diki, Dedi, Soleh,
Imam, dan Rido), dan Bahtiyar serta Khasin atas dukungan serta semangatnya.
Akhir kata, penulis mengharapkan kritik dan saran yang membangun atas
ketidaksempurnaan dari laporan ini sehingga tulisan ini dapat berguna bagi
penulis sendiri maupun semua pihak yang membutuhkan demi kemajuan ilmu
pengetahuan.
Prabawati Hyunita Putri dilahirkan di Banyuwangi pada tanggal 19 Juni 1988
dari ayah Kusnanto dan ibu Sriyani. Penulis merupakan anak pertama dari dua
bersaudara.
Penulis menyelesaikan sekolah menengah atas di SMA Negeri I Genteng
Kabupaten Banyuwangi pada tahun 2006. Pada tahun yang sama, penulis diterima
di Institut Pertanian Bogor melalui jalur Undangan Seleksi Masuk IPB (USMI).
Tahun 2007 penulis diterima sebagai mahasiswa Departemen Biokimia, Fakultas
Matematika dan Ilmu Pengetahuan Alam.
Selama mengikuti perkuliahan, penulis pernah menjadi asisten mata kuliah
Biokimia Umum pada tahun 2009/2010 dan mata kuliah Struktur dan Fungsi
Biomolekul pada tahun yang 2010/2011. Penulis melakukan praktek kerja lapang
di Laboratorium Kultur Jaringan dan Transformasi, Balai Penelitian Bioteknologi
Perkebunan Indonesia (BPBPI) dari bulan Juli sampai Agustus 2009 dengan judul
laporan praktek lapang, yaitu Transformasi Gen
Pada Kelapa
Sawit (
Jacq.) Melalui
Galur AGL0.
Penulis juga aktif di OMDA Lare Blambangan sebagai Sekretaris pada tahun
2008/2009 dan pada tahun yang sama penulis menjadi staf khusus Departemen
Sosial Lingkungan BEM FMIPA IPB. Pada tahun 2009/2010 penulis aktif di
Himpunan Profesi (Himpro) CREBs (
DAFTAR GAMBAR ... ii
DAFTAR LAMPIRAN ... ii
PENDAHULUAN ... 1
TINJAUAN PUSTAKA
Mikroalga ... 2
Hepatitis C ... 2
Virus Hepatitis C ... 3
RNA Helikase ... 4
Kromatografi Lapis Tipis (KLT) ... 4
Kromatografi Gel Filtrasi ... 4
Kromatografi Cair Kinerja Tinggi (KCKT) ... 5
BAHAN DAN METODE PERCOBAAN
Bahan dan Alat ... 6
Metode ... 7
HASIL DAN PEMBAHASAN
Kultur sel
pET BL21 (DE3) pLysS ... 9
Enzim RNA Helikase Virus Hepatitis C ... 9
Kultur Mikroalga
10
Ekstrak Mikroalga
11
Hasil Uji Fitokimia ... 11
Hasil Pemurnian dan Aktivitas Penghambatan Terhadap RNA Helikase
11
Profil Kimiawi Fraksi yang Mempunyai Aktivitas Penghambatan Tertinggi13
Kromatogram Fraksi yang Mempunyai Aktivitas Penghambatan Tertinggi 13
SIMPULAN DAN SARAN
Simpulan ... 14
Saran ... 14
DAFTAR PUSTAKA ... 15
1 Mikroalga
... 2
2 Struktur virus hepaitis C ... 3
3 Peta genomik Virus Hepatitis C ... 4
4 Kromatografi gel filtrasi ... 5
5 Elektroforegram SDS-PAGE RNA helikase HCV... 10
6 Kultur mikroalga
... 10
7 Kurva pertumbuhan mikroalga
... 10
8 Aktivitas penghambatan fraksi kromatografi gel filtrasi ... 12
9 Kromatogram KLT fraksi 2, 3, 4 ... 13
10 Kromatogram KCKT fraksi 3 ... 14
1 Rancangan penelitian ... 18
2 Perhitungan bobot molekul relatif RNA helikase ... 20
3 Kurva standar fosfat uji ATPase ... 21
4 Nilai penghambatan terhadap RNA helikase ... 22
5 Serapan puncak pada waktu retensi 12.483 ... 25
Virus Hepatitis C (HCV) menginfeksi hampir 170 juta orang diseluruh dunia. Virus ini menyebabkan penyakit hepatitis C yaitu peradangan pada hati yang mengakibatkan sirosis hati (Lauer & Walker 2001). Berdasarkan data Kementrian Kesehatan Republik Indonesia, pada tahun 2010 jumlah penderita hepatitis C di Indonesia cukup tinggi yaitu sebesar 30 juta jiwa orang (Kementrian Kesehatan 2010). Tingginya jumlah penderita dikarenakan penyebaran virus yang sangat cepat. Virus dapat menghasilkan sekitar 1 milyar virion (partikel virus baru) tiap jamnya pada tubuh penderita (Sy & Jamal 2006).
Sebagian besar kasus hepatitis C belum dapat dideteksi oleh tenaga kesehatan pada substansi terendah. Hal itu disebabkan masih minimnya peralatan yang digunakan untuk deteksi hepatitis C. Penyakit ini menular melalui transfusi darah, penggunaan jarum suntik yang tidak steril, dan hemodialisis. Selain itu, penyakit ini baru terdeteksi setelah memasuki fase akut (Moradpour 2007). Deteksi penyakit yang lambat menyebabkan hanya sebagian kecil penderita yang memperoleh terapi pengobatan.
Obat terhadap penyakit hepatitis C belum ditemukan. Terapi pengobatan hepatitis C pada umumnya dengan pemberian interferon alfa (PEG-IFN α) yang dikombinasikan dengan ribavirin yang diberikan selama 12-72 minggu. Namun, terapi ini hanya berhasil pada penderita yang terinfeksi hepatitis C dengan genotip tertentu saja. Pada pasien yang terinfeksi hepatitis C genotip satu dan empat dapat menghambat pertumbuhan virus baru sebesar 50%-80%, sedangkan pada pasien yang terinfeksi HCV genotipe dua dan tiga dapat menghambat pertumbuhan virus kurang dari 80%. Selain itu, terapi ini menimbulkan efek samping seperti depresi, anemia, dan mual (Moradpour 2007). Untuk itulah diperlukan pencarian obat baru untuk terapi penyakit hepatitis C.
Beberapa upaya pencarian obat terhadap hepatitis C telah dilakukan, salah satunya melalui terapi target molekuler. Terapi target molekuler dikembangkan dengan pencarian inhibitor enzim yang berperan dalam replikasi HCV. Enzim yang berperan dalam replikasi HCV adalah serin protease, RNA polimerase, dan RNA helikase (Soriano 2009).
Penghambatan terhadap enzim RNA helikase dianggap lebih potensial sebagai
target pengobatan HCV. Hal tersebut dikarenakan RNA helikase selain membuka ikatan dupleks RNA juga dapat menghidrolisis adenosin trifosfat (ATP) menghasilkan fosfat bebas yang berfungsi sebagai donor energi. Penghambatan terhadap kerja RNA helikase secara tidak langsung berpengaruh terhadap replikasi HCV. Penghambatan terhadap aktivitas ATPase lebih mungkin dijadikan sebagai target obat karena tidak memerlukan substrat RNA virus yang bersifat tidak stabil dan tidak membutuhkan pelabelan radioaktif (Borowski
2002).
Inhibitor enzim RNA helikase HCV dapat diperoleh dari hasil metabolit sekunder dari tumbuhan yang dihasilkan secara alami, misalnya dari mikroalga. Mikroalga merupakan fitoplankton yang hidup di air tawar maupun air laut. Kandungan senyawa kimianya banyak dimanfaatkan sebagai antibakteri, kosmetik, sumber makanan baru, pewarna makanan alami, antivirus, dan bahan bakar nabati. Beberapa penelitian tentang mikroalga sebagai antivirus adalah antivirus terhadap virus herpes simpleks (HSV) yang diperoleh dari isolat ! "
(Ohta 1998), antienterovirus dari isolat " " (Shih 2003), dan antiretrovirus dari isolat " sp (Talyshinsky 2002).
Laboratorium Bakteriologi dan Virologi Molekuler, Puslit Bioteknologi, LIPI Cibinong telah melakukan penapisan terhadap 30 isolat mikroalga dengan pelarut aseton dan metanol. Hasil yang diperoleh menyebutkan bahwa ekstrak kasar
metanol 80% memiliki aktivitas penghambatan tertinggi terhadap RNA helikase HCV dan bersifat stabil dibandingkan dengan isolat yang lain (Mustopa 2009). Penelitian ini bertujuan mengisolasi bahan aktif dari mikroalga yang memiliki aktivitas inhibisi terhadap RNA helikase HCV. Rumusan masalah penelitian ini adalah belum ditemukannya obat hepatitis C yang efektif dan isolasi serta pemurnian bahan aktif dari mikroalga sebagai antihepatitis C belum banyak dilakukan. Hipotesis penelitian ini adalah bahan aktif dari mikroalga
!"# $
Mikroalga merupakan mikroorganisme fotosintetik yang ditemukan pada perairan darat maupun laut. Berukuran mikroskopis dengan diameter antara 3-30 µm serta tidak mempunyai akar, batang, dan daun. Biasanya ditemukan hidup secara individual ataupun berkelompok. Mikroalga bergerak secara pasif dengan mengikuti arus air. Morfologi selnya sangat bervariasi, baik bersel tunggal maupun bersel banyak, Mikroalga juga memiliki bentuk yang bervariasi seperti filamen atau lembaran, spiral, dan bulat (Kabinawa 2001). Penelitian ini menggunakan mikroalga isolat
(Gambar 1).
Taksonomi mikroalga selama ini lebih banyak menggunakan karakteristik morfologi berdasarkan bentuk, warna, ukuran sel dan lain-lain. Berdasarkan warna pigmen dibagi menjadi lima kelompok, yaitu Chlorophyceae (alga hijau), Phaeophyceaae (alga coklat), Chrysophyceae (alga kuning keemasan), Rhodophyceae (alga merah), dan Pyrrophyceae (dinoflagellata). Namun secara garis besar, mikroalga dibagi menjadi 4 kelompok, yaitu Diatom (Bacillariophyceae), ganggang hijau (Chlorophyceae), ganggang emas (Chrysophyceae), dan ganggang biru (Cyanophyceae) (Borowitzka & Borowitzka 1988).
Biomassa mikroalga mengandung komponen kimia yang potensial, misalnya protein, karbohidrat, pigmen (klorofil dan karetenoid), asam amino, lipid, dan hidrokarbon. Mikroalga mempunyai kemampuan untuk mensintesis semua asam amino, baik esensial maupun nonesensial. Karbohidrat yang dihasilkan dapat ditemukan dalam bentuk pati, glukosa, gula, dan polisakarida lainnya. Kandungan lipid dari mikroalga sangat bervariasi berkisar antara 1%-2%. Lemak mikroalga pada umumnya terdiri atas asam lemak tidak jenuh, seperti linoleat, asam eikosapentanoat# dan asam dokosaheksanoat. Mikroalga mengandung lemak dalam jumlah yang besar terutama asam arakidonat dan sejumlah asam eikosapentaenoat. Selain itu, lemak mikroalga juga kaya akan asam lemak tidak jenuh dengan empat atau lebih ikatan rangkap. Mikroalga juga menghasilkan beberapa vitamin penting, seperti: A, B1, B2, B6, B12, C, E, nikotinamida, biotin, asam folat, dan asam pantotenat. Pigmen yang dihasilkan
meliputi klorofil, karotenoid, dan fikobiliprotein (Borowitzka & Borowitzka 1988).
Kandungan senyawa kimia dari mikroalga tergantung pada spesies dan kondisi kultur. Pertumbuhan dari mikrolaga dipengaruhi oleh beberapa faktor, seperti salinitas, cahaya, suhu, derajat keasamaan, nitrogen, karbondioksida, dan nutrien. Kisaran suhu 25oC-30oC merupakan kondisi umum bagi pertumbuhan mikroalga. Derajat salinitas bergantung pada tiap spesies mikroalga. Cahaya diperlukan bagi pertumbuhan mikroalga dan berperan dalam proses metabolisme sel seperti kemampuan berfotosintesis. Kisaran derajat keasaman (pH) juga sangat bervariasi mulai dari pH 6-8. Nitrogen dan karbondioksida diperlukan dalam metabolisme sel (Borowitzka & Borowitzka 1988).
Gambar 1 Mikroalga dengan
perbesaran 1000x (dokumentasi Laboratorium Biorekayasa Lingkungan, Dwi Susilaningsih 2010).
%& ' ' (
Hepatitis C merupakan penyakit yang menyerang hati dan menyebabkan peradangan. Penyakit ini disebabkan oleh virus hepatitis C. Pertama kali diidentifikasi pada tahun 1989 sebagai hepatitis Non-A dan Non-B. Hepatitis C menginfeksi hampir 170 milyar orang di seluruh dunia. Penyakit ini dalam jangka panjang dapat menimbulkan kanker hati yang berujung pada sirosis hati (Worman & Lin 2000).
kadang-kadang timbul $ (kekuningan) pada tubuh. Hepatitis C biasanya terdeteksi apabila sudah mencapai tingkat akut sekitar 30%-80% infeksi (Jawaid & Khuwaja 2008).
Terdapat dua cara dalam mendeteksi penyakit ini, yaitu tes serologi dan tes secara molekuler untuk partikel virusnya. Keduanya menggunakan darah penderita sebagai analit. Tes serologi menggunakan antibodi atau anti HCV (virus hepatitis C), apabila terinfeksi maka antibodi penderita menurun drastis. Tes secara molekuler menggunakan %
" " (RT
PCR). Tes secara nonspesifik diperoleh dari pengukuran jumlah enzim alanin transferase dalam tubuh. Tes ini dapat digunakan untuk mengidentifikasi penyakit hepatitis C maupun untuk mengontrol keefektifan terapi pengobatan penyakit tersebut. Jumlah alanin transferase yang meningkat mengindikasikan bahwa kinerja hati menurun (Lauer & Walker 2001).
Terapi hepatitis C pada umumnya dengan pemberian interferon seminggu sekali yang dimasukkan ke tubuh melalui injeksi subkutan. Pemberian interferon tersebut dikombinasikan dengan ribavirin. Mekanisme terapi untuk hepatitis C dari kedua bahan tersebut masih belum banyak diketahui. Selain itu, terapi tersebut kurang efektif karena menimbulkan efek samping, seperti mual, anemia, depresi, dan harganya relatif mahal. Manfaat terapi kedua bahan tersebut berbeda hasilnya ditiap individu tergantung pada genotip dari virus hepatitis C (Jawaid & Kuwaja 2008).
")( %& ' ' ( * +
Virus hepatitis C pertama kali diidentifikasi pada tahun 1989 dan disebut sebagai virus Non-A dan Non-B. Virus ini menyerang hepatosit dan sel limfosit B. Selain itu, virus hepatitis C terdiri atas satu "
(ORF) dan dua daerah tidak
tertranslasi atau (UTRs)
(Wardell 1999).
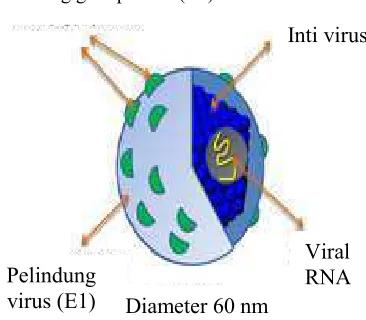
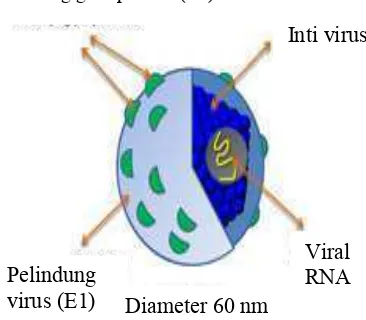
Secara taksonomi virus ini termasuk dalam famili & % % dengan genus " % Virus ini merupakan virus RNA positif. Seperti yang terlihat pada Gambar 2, virus berbentuk bulat dengan diameter partikelnya berkisar antara 55-65 nm, dan mempunyai selubung protein atau amplop glikoprotein ( % " " ). Selain itu, terdapat inti ( ) dan di dalamnya terdapat viral RNA. Virus hepatitis C dibagi menjadi enam genotipe yang disandikan
dengan angka, yaitu genotipe satu sampai enam (Worman & Lin 2000).
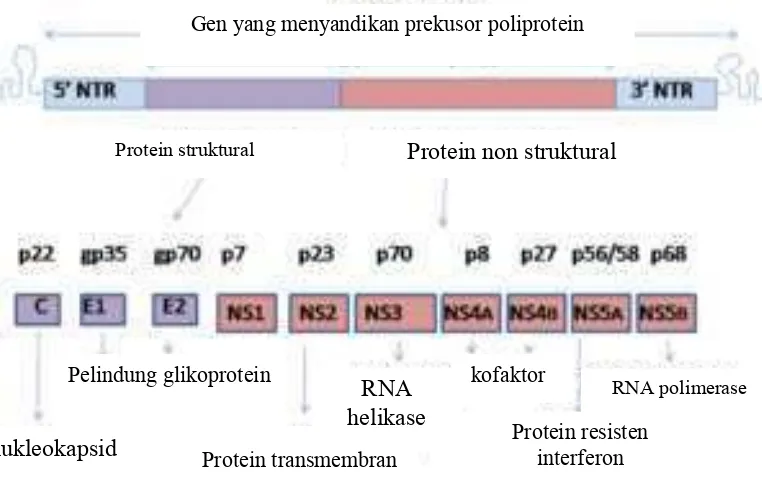
Genom HCV berukuran 9.6 kilobasa yang mengkodekan sekitar 3011 asam amino. Poliproteinnya dipotong setelah proses translasi dan dibagi menjadi peptida struktural dan peptida nonstruktural ( atau NS) (Gambar 3). Peptida struktural terdiri dari sebuah nukleokapsid inti, p7, dan dua glikoprotein selubung virusnya (E1 dan E2) (Gambar 2). Dua daerah pada E2 merupakan daerah hipervariabel 1 dan 2 (HVR 1 dan HVR 2). Daerah tersebut menunjukkan hipermutasi dari selubung virus sehingga sangat spesifik terhadap antibodi. Daerah E2 juga terdapat sisi pengikatan terhadap
81 (CD81), reseptor virus pada hepatosit dan sel limfosit B (Tellinghuisen 2007).
Peptida nonstruktural terbagi menjadi empat macam, yaitu NS1, NS2, NS3, NS4 (NS4A dan NS4B), dan NS5 (NS55A dan NS5B). Protein nonstruktural tersebut berfungsi dalam reaksi enzimatis yang berperan dalam replikasi virus. NS1 berinteraksi dengan NS4A dibutuhkan untuk replikasi RNA. NS2A bersifat hidrofobik berfungsi dalam perakitan virion (partikel virus baru) dan pelepasan partikel virus. NS2B membentuk kompleks dengan NS3 berperan sebagai kofaktor bagi serin protease dari NS3. Protein NS3 mengkodekan RNA helikase yang berperan dalam replikasi virus. NS5A merupakan daerah yang sensitif terhadap interferon, sedangkan NS5B berperan didalam aktivitas RNA- " RNA polimerase (RdRp) (Tellinghuisen 2007).
Gambar 2 Struktur virus hepatitis C (HCV) (Moradpour 2007). Pelindung glikoprotein (E2)
Viral
RNA
Inti virus
Pelindung
Gambar 3 Peta Genomik Virus Hepatitis C (Tellinghuisen 2007)
Virus hepatitis C memiliki tingkat replikasi yang sangat tinggi. Sekitar satu miliar partikel dihasilkan setiap hari pada individu yang terinfeksi. Replikasi dari virus tersebut membutuhkan lingkungan yang tepat. Pertama, virus menginfeksi hepatosit atau sel limfosit B. Daerah pada E2 virus dikenali oleh
CD81 ataupun % B1
(SR-B1) yang merupakan reseptor dari virus hepatitis C. Setelah terjadi pengikatan virus ke sel, partikel virus masuk ke dalam sel dan mengalami lisis. Utas tunggal positif RNA membentuk negatifnya dengan bantuan RNA polimerase. Rantai negatif RNA tersebut berfungsi sebagai cetakan untuk membentuk rantai positif RNA. RNA helikase membuka ikatan ganda antara rantai dan dan akhirnya membentuk duplikat dari rantai positif RNA. Rantai RNA hasil translasi dilepaskan dan berasosiasi dengan membran. Selanjutnya, terjadi morfogenesis virion (pengemasan partikel virion baru) dan pematangan. Setelah proses pematangan selesai, kompleks virion yang lengkap dilepaskan keluar sel untuk selanjutnya menginfeksi sel yang lain (Moradpour 2007).
% ! (%
RNA helikase ditemukan pada bakteri, khamir, dan virus. Pertama kali ditemukan pada bakteri Pada virus hepatitis C, enzim ini dikodekan oleh protein NS3 RNA helikase (Kadare & Haenni 1997).
Enzim ini diperlukan dalam replikasi virus hepatitis C (HCV). RNA helikase HCV memiliki tiga aktivitas, yaitu mengikat rantai RNA, menghidrolisis NTP (nukleotida trifosfat), dan membuka ikatan dupleks RNA. Enzim ini berperan dalam membuka ikatan dupleks antar rantai RNA dari 3’-5’. RNA helikase merusak ikatan hidrogen antara rantai RNA yang berpasangan. Reaksi enzimatis tersebut memerlukan energi yang diperoleh dari hidrolisis NTP menjadi NDP dan P dan juga kation divalen, seperti Mg2+ (Kadare & Haenni 1997).
"# '#$" , & ( & ( * +
Kromatografi lapis tipis (KLT) merupakan teknik kromatografi yang menggunakan plat silika atau alumina sebagai fase diamnya. Fase diam yang digunakan dapat juga memakai bahan yang berpendar dalam sinar ultra violet (UV). Teknik ini biasa digunakan untuk memisahkan komponen dari suatu campuran senyawa organik alam, sintetis, dan campuran kompleks anorganik. Fase gerak yang digunakan tergantung dari senyawa yang ingin dipisahkan (Harjadi 1976). Pemisahan komponen yang akan dipisahkan ditotolkan pada plat silika yang telah didesain. Plat silika pada bagian bawah diberi sebuah garis untuk menandakan posisi awal penotolan. Selanjutnya dibuat pula sebuah garis akhir menggunakan pensil. Jarak antara garis awal dengan garis akhir biasanya 5 cm. Plat yang telah ditotol dengan sampel dimasukkan
Gen yang menyandikan prekusor poliprotein
Protein struktural
Protein non struktural
nukleokapsid
RNA polimerase
Protein transmembran
Pelindung glikoprotein
kofaktor
Protein resisten
interferon
kedalam bejana pengembang yang berisi eluen yang telah dijenuhkan. Proses penjenuhan berlangsung sekitar 20 menit. Penjenuhan berfungsi agar eluen lebih efektif dalam memisahkan komponen tersebut. Eluen akan memisahkan komponen hingga garis akhir yang telah didesain. Semakin dekat kepolaran antara sampel dengan eluen maka sampel akan semakin terbawa oleh fase gerak tersebut (Wilson & Walker 1994).
Tahapan selanjutnya adalah visualisasi atau deteksi. Deteksi atau visualisasi sampel yang tidak berwarna dapat menggunakan dua cara, yaitu penyinaran dengan sinar UV (254 nm dan 366 nm) dan pereaksi kimia (ninhidrin, FeSO4, dragendroff, dan anilin). Pada saat disinari dengan sinar UV, komponen yang terpisahkan akan terlihat seperti spot atau bidang kecil yang berwarna gelap. Deteksi komponen juga dapat dilakukan dengan menempatkan kromatogram pada bejana tertututp yang telah dijenuhkan dengan kristal iod. Uap kristal iod bereaksi dengan komponen yang terpisahkan dan terlihat seperti noda-noda kecoklatan (Walker & Wilson 1994).
Aplikasi dari teknik ini dapat digunakan
untuk mengukur nilai ( )
atau jarak relatif pemisahan suatu senyawa pada kromatogram. Nilai dari suatu senyawa bernilai sama meskipun jarak plat yang digunakan berbeda (Wilson & Walker 1994). Pengukuran ini berdasarkan pada jarak yang ditempuh oleh pelarut dan jarak yang tempuh oleh noda warna masing-masing. Nilai dari suatu komponen dihitung sebagai berikut:
= jarak yang ditempuh oleh komponen jarak yang ditempuh oleh pelarut
"# '#$" , % '" (
Kromatografi gel filtrasi merupakan salah satu contoh jenis kromatografi padat-cair. Kromatografi ini (Gambar 4) merupakan teknik pemisahan komponen berdasarkan bentuk dan ukuran molekulnya. Teknik ini melibatkan fase diam berupa matriks gel atau matriks berpori, sedangkan fase geraknya berupa cairan atau eluen dengan perbandingan tertentu sesuai dengan sampel yang ingin dipisahkan. Teknik ini sangat baik memisahkan molekul yang berukuran besar dengan yang berukuran kecil tanpa mengganggu jalannya pemisahan. Selain itu, teknik ini mudah dan menghasilkan hasil pemisahan yang baik (Wilson & Walker 1994).
Matriks gel atau matriks berpori yang bertindak sebagai fase diam disesuaikan dengan komponen yang akan dipisahkan. Matriks gel yang digunakan bermacam-macam jenisnya tergantung dari komponen yang ingin dipisahkan, contohnya: silika gel, sephadex, sepharosa, dan superdex. Penelitian ini menggunakan matriks silika gel F60. Pada prinsipnya, komponen yang dipisahkan akan terjerap sesuai dengan ukuran pori matriks yang digunakan. Komponen yang memiliki ukuran molekul yang sama akan terelusi bersama-sama. Komponen yang berukuran besar daripada matriks gel akan terelusi terlebih dahulu oleh eluen dengan laju yang tinggi, sedangkan komponen yang berukuran lebih kecil akan terdistribusi pada fase diam dan terelusi lebih akhir (Hagel 1993).
Fase diam atau matriks berpori yang akan digunakan untuk pemisahan terlebih dahulu harus diseimbangkan dengan pelarut pengembang. Penyesuaian kolom dilakukan dengan mencuci kolom dengan larutan pengembang. Untuk mendapatkan resolusi pemisahan yang baik, sampel yang dipisahkan sebaiknya bervolume sekitar 1-5% dari volume matriks gel (Hagel 1993).
Gambar 4 Kromatografi gel filtrasi (dokumentasi Laboratorium Bakteriologi dan Virologi Molekuler 2010).
"# '#$" , " %"- $$ * +
Kromatografi cair kinerja tinggi (KCKT) merupakan kromatografi partisi dengan fase gerak dan fase diamnya berupa cairan (Adnan 1997). Menurut Nur (1992) teknik analisis dengan KCKT prinsipnya adalah interaksi antara molekul dengan fase gerak dan fase diam akan memisahkan beberapa komponen dari senyawa tersebut sesuai
Fase gerak
dengan tingkat kepolarannya. Molekul polar akan lebih kuat berinteraksi dengan eluen polar sehingga mudah terelusi, begitu juga sebaliknya dengan molekul nonpolar. Komponen utama KCKT adalah tempat untuk fase gerak, pompa, injektor, kolom, detektor, dan rekorder (Adnan 1997).
Pelarut yang dipakai untuk analisis sampel pada KCKT memiliki polaritas yang berbeda-beda tergantung pada senyawa yang akan dianalisis. Hal terpenting yang harus diperhatikan adalah tempat pelarut yang digunakan harus memungkinkan untuk terjadinya proses penghilangan gas atau udara yang ada dalam pelarut tersebut. Cara yang dapat dipakai bemacam-macam, seperti pemanasan, perlakuan vakum, atau dengan mengalirkan gas yang bersifat lembam (Adnan 1997).
Penggunaan pompa juga sangat berpengaruh terhadap kerja KCKT. Pompa diperlukan untuk mengalirkan pelarut sebagai fase gerak dengan kecepatan dan tekanan yang tetap. Gangguan pada pompa biasanya disebabkan oleh perawatannya yang kurang teratur, adanya gangguan pelarut yang tidak difiltrasi dengan baik, adanya elektrolit yang mengandung kadar klorida tinggi pada pH rendah, dan terjadinya endapan dalam pompa (Adnan 1997).
Tekanan yang diperlukan tergantung pada ukuran kolom dan viskositas dari pelarut. Kolom yang memilki diameter lebih kecil memiliki kecepatan alir yang lebih kecil juga. Sebaliknya kolom yang lebih lebar memilki kecepatan alir yang lebih besar pula. Pompa yang baik dapat mengatur kecepatan aliran 10-20 µl/meni (Adnan 1997).
Kolom yang digunakan pada KCKT juga harus memenuhi kriteria tertentu. Ukuran kolom yang umum dipakai memiliki panjang 10-25 cm dan berdiameter 4.5-5.0 mm. Efisiensi kolom tergantung pada besarnya partikel fase diam. Kolom yang pendek dan efisien akan menyebabkan pemisahan berjalan lebih cepat (Adnan 1997).
Komponen yang tidak kalah penting dari komponen-komponen yang sebelumnya disebutkan adalah detektor. Detektor yang digunakan harus memenuhi persyaratan, yaitu memiliki sensitivitas yang tinggi, bersifat linier untuk jangka konsentrasi tertentu, dan dapat mendeteksi eluen tanpa mempengaruhi reolusi kromatogram. Detektor harus tidak peka terhadap perubahan berbagai parameter terutama suhu dan tekanan. Detektor yang digunakan pada penelitian ini adalah "
(PDA) (Adnan 1997).
Waktu yang dibutuhkan oleh senyawa untuk bergerak melalui kolom menuju detektor disebut sebagai waktu retensi. Waktu retensi diukur ketika sampel diinjeksikan sampai sampel menunjukkan ketinggian puncak yang maksimum dari senyawa itu. Senyawa-senyawa yang berbeda memiliki waktu retensi yang berbeda pula. Waktu retensi ini tergantung pada tekanan yang digunakan karena berpengaruh pada laju alir dari pelarut, kondisi dari fase diam, komposisi yang tepat dari eluen, dan temperatur pada kolom (Hostettmann 1986).
Keuntungan penggunaan KCKT adalah mampu memisahkan molekul-molekul dari campuran, sampel yang digunakan sedikit, kecepatan analisis dan kepekaan yang tinggi, dapat dihindari terjadinya dekomposisi atau kerusakan bahan yang dianalisis, resolusi yang baik, dapat digunakan bermacam-macam detektor, dan kolom dapat digunakan kembali (Hostettmann 1986).
. / '
Bahan-bahan yang digunakan untuk isolasi dan pemurnian enzim RNA Helikase meliputi bakteri pET BL21 (DE3) pLysS yang membawa gen NS3 RNA helikase virus hepatitis C dalam plasmid 21b (koleksi Andi Utama, Puslit Bioteknologi LIPI), media Luria Bertani (LB), akuades, ampisilin, isopropil β-D-thiogalaktopiranosidase (IPTG) 0.3 M, bufer B (10 mM Tris HCl pH 8.5, 100 mM NaCl, dan 0.25% Tween 20), resin TALON, dan bufer elusi (400 mM imidazola dalam bufer B).
Bahan-bahan yang digunakan untuk isolasi dan pemurnian bahan aktif dari mikroalga adalah isolat (koleksi Dwi Susilaningsih, Puslit Bioteknologi LIPI), metanol 80%, media
(MBM SW), 0.1 mM adenosin trifosfat (ATP), 0.1 mM 4-asam morfolinopropana sulfonat (MOPS), 1 mM MgCl2, larutan hijau malakit, 2.3% polivinil alkohol, amonium molibdat, natrium sitrat, kloroform, gel silika (0.063 mm-0.200 mm), plat silika gel F254, dan akuades.
" (Nalge Nunc), pipet mikro, tabung ulir, evaporator, neraca analitik, peralatan gelas, pipa kapiler, "
(Multiscan EX Thermo), bejana KLT (CAMAG), transiluminator UV, pemanas plat, kolom KCKT kolom 4.6 x 150 mm Eurospher 100-5C-18 diameter 5 µm, kolom gel filtrasi, tabung falcon, dan vial.
%'#/%
(# ( / % )" % ! (% ")( %& ' ' ( * ' +
) ')" & * 0+ & 1(
1 $ % 2 3 % 0 % ! (%
. Sebanyak 10 mL prekultur yang membawa gen NS3 RNA helikase HCV ditumbuhkan dalam media LB. Sebelumnya, media LB ditambahkan ampisilin 100 µg/mL, dan diletakkan dalam inkubator pada suhu 37oC dengan kecepatan 200 rpm selama 30 menit. Setelah 30 menit, kultur tersebut diukur nilai absorbansinya pada panjang gelombang 600 nm. Apabila telah mencapai nilai absorbansi ± 0.3, maka ditambahkan 0.3 M IPTG ke dalam kultur tersebut. Selanjutnya, diinkubasi pada inkubator berpenggoyang dengan kecepatan 200 rpm selama 3 jam pada suhu 37oC sampai nilai OD pada panjang gelombang 600 nm ± 1. Kemudian, disentrifugasi pada suhu 4oC dengan kecepatan 7000 g selama 10 menit. Pelet yang dihasilkan disimpan pada suhu -20oC (Lampiran 1).
(# ( / % )" % ! (% ")( %& ' ' ( . Pelet hasil sentrifugasi dikeringbekukan ( ' ) selama tiga kali pengulangan. Selanjutnya, ditambahkan bufer B sebanyak 20 mL kemudian disonikasi (amplitudo 40; siklus 0.5; waktu 3 x 15 detik; interval waktu 1 menit). Hasil sonikasi disentrifugasi dengan kecepatan 7000 g selama 10 menit pada suhu 4oC. Supernatan selanjutnya ditambahkan resin Talon. Dan diinkubasi pada rotator dalam ruang dingin ( ) selama 3 jam. Hasil inkubasi kemudian disentrifugasi selama 10 menit dengan kecepaatan 5000 g pada suhu 4oC. Supernatan diambil 50 µL untuk di SDS-PAGE (IV) dan sisanya dibuang. Pelet ditambahkan bufer B sebanyak 15 ml, dan disentrifus kembali pada kecepatan 5000 g selama 7 menit. Supernatan diambil 50 µL untuk diuji dengan SDS-PAGE (W1) dan sisanya dibuang. Selanjutnya, pelet ditambah bufer B sebanyak 15 ml dan disentrifugasi selama 5 menit pada kecepatan 5000 g. Supernatannya diambil 50 µL untuk dianalisis
dengan SDS-PAGE (W2), sedangkan peletnya ditambahkan bufer elusi (imidazola dalam bufer B) dan diinkubasi semalam pada rotator yang ditempatkan pada suhu 4oC. Setelah itu, supernatan diambil (E) dan dipisahkan dari pelet. Supernatan ditentukan bobot molekulnya dengan metode SDS-PAGE. Supenatan merupakan enzim RNA helikase yang telah dimurnikan (Lampiran 1).
( ( #2#' # %!) "#'%
% ! (% 4 Analisis bobot molekul menggunakan teknik
" " (SDS
PAGE) bertujuan mengetahui kemurnian enzim yang berhasil diisolasi. Gel yang digunakan sebagai media pemisahan komposisinya sebesar 12% akrilamid. Gel kemudian dielektroforesis pada 30 mA selama 60 menit dalam bufer elektroforesis (24% gliserol, 8% SDS, 100 mM Tris). Setelah itu, gel tersebut diwarnai dengan pewarnaan
.
) ')" / !('" !( !"# $ * #/ , ! ( )( 1 ' 5 $)(' 6+
Isolat mikroalga dikulturkan selama 2 bulan pada MBM SW. Setiap 2 hari sekali dihitung nilai OD ((" ! ) pada panjang gelombang 630 nm untuk mengetahui kurva pertumbuhan. Setelah diketahui fase pertumbuhannya,
dipanen sebanyak 500 mL dan disentrifugasi selama 10 menit dengan kecepatan 8500 g. Pelet diambil dan dipindahkan pada tabung ulir kemudian ditambahkan dengan metanol 80%. Larutan selanjutnya disonikasi selama 1 menit dan 2 menit istirahat, sonikasi dilakukan sebanyak empat kali ulangan. Hasil sonikasi dievaporasi pada suhu 60˚C dalam keadaan vakum. Sampel (ekstrak kasar) hasil evaporasi dipipet dan dimasukkan pada tabung ulir kecil.
- '#! * " (3#'. 766+
- 8# # / / % 1 3 % # !4
Sebanyak 2 g bahan ditambahkan 100 ml air panas dan dididihkan selama 5 menit kemudian disaring. Sebanyak 5 ml filtrat ditambahkan serbuk Mg dan 1 ml HCl pekat. Selanjutnya ditambah 5 ml amilalkohol dan dikocok hingga kuat. Terbentuknya warna dalam amilakohol menunjukkan adanya senyawa flavonoid.
reaksi kemudian diambil larutan bagian atasnya (larutan B). Larutan A diteteskan pada kertas saring dan disemprot dengan pereaksi Dragendorff Dagendorf, Meyer, dan Wagner. Adanya alkaloid ditandai dengan terbentuknya endapan merah oleh pereaksi Dagendorf, endapan putih oleh pereaksi Meyer, dan endapan coklat oleh pereaksi Wagner.
- 4 Sebanyak 2 g serbuk bahan ditambah 100 mL akuades kemudian dididihkan selama 15 menit. Setelah dingin, campuran disaring dan filtratnya ditambah FeCl3 1% (b/v). Warna biru tua atau hitam menunjukkan adanya tanin.
- &# 4 Ekstrak sampel sebanyak 0.1 g ditambah air secukupnya dan dipanaskan selama 5 menit. Larutan tersebut didinginkan kemudian dikocok. Timbulnya busa selama ± 10 menit menunjukkan adanya saponin.
- " '%"&% # /. Ekstrak sampel sebanyak 1 g dimaserasi dengan 20 ml eter selama 2 jam kemudian disaring dan diambil filtratnya. Filtrat sebanyak 5 ml diuapkan hingga diperoleh residu. Residu kemudian ditambahkan dengan pereaksi Lieberman Buchard (3 tetes asam asetat anhidrida dan 1 tetes H2S04 pekat). Warna merah atau ungu menunjukkan adanya triterpenoid dan warna hijau menunjukkan adanya triterpenoid.
% )" . !' , / " !"# $ %2 $ . 2 '#" % ! (% * .' 779+4
"# '#$" , % '" ( 4 Silika gel dimasukkan secara perlahan ke dalam kolom kromatografi. Ekstrak kasar mikroalga
dilusi 1:1 (ekstrak kasar : metanol 80%) sebanyak 5% dari volume kolom dimasukkan ke kolom gel filtrasi. Sampel dielusi dengan eluen 1% metanol dalam kloroform, dengan laju alir 1 mL/menit tiap fraksi. Masing-masing fraksi hasil pemisahan diuji aktivitas penghambatannya terhadap RNA helikase virus hepatitis C dengan uji ATPase. Fraksi yang mempunyai aktivitas penghambatan tertinggi dilihat profilnya dengan KLT.
"# '#$" , & ( & ( * +4
Disiapkan plat silika F254 dan diatur jarak antara garis penotolan dengan garis akhir. Bejana KLT diisi dengan eluen kloroform:metanol dengan perbandingan (9:2) dan dijenuhkan. Kemudian, plat yang telah ditotol dikembangkan dalam bejana sampai eluen mencapai garis akhir. Hasil KLT kemudian divisualisasi menggunakan sinar UV dengan panjang gelombang 254 nm.
Setelah itu, disemprot dengan serium sulfat dan dipanaskan.
( ( . !' , / " !"# $ %2 $ . 2 '#" % ! (% ")( %& ' ' ( * #/ , ! ( .' 779+4
"# '#$" , " %"- $$ * +4 Tahapan ini bertujuan mengetahui bahan aktif yang terdapat pada fraksi hasil kromatografi kolom gel filtrasi yang mempunyai aktivitas inhibisi tertinggi. Instrumen yang digunakan adalah KCKT KNAUER menggunakan kolom 4.6 x 150 mm Eurospher 100-5C-18 diameter 5µm. Fase gerak menggunakan metanol (A) : air (B) dengan berbagai perbandingan. Perbandingan yang digunakan adalah 0% A pada 0 menit, 100% A pada 22 menit, 100% A pada 30 menit, 0% A pada 33 menit, dan 0% A pada 40 menit. Volume yang diinjeksikan sebanyak 20 µL dan laju alir sebesar 1 mL/menit. Detektor yang digunakan adalah "
(PDA) panjang gelombang 254 nm.
- !' 8 ' ( % $. 2 ' % ! (% /% $ # #" %'" (% * '
+4
Sebanyak 50 µL campuran pereaksi ( )) tiap sumur pada " mengandung 5 µL 10 mM bufer MOPS (pH 6.5), 1 mM ATP, 0.5 µL 1 mM MgCl2, 38.5 µL H2O. Blanko yang digunakan merupakan campuran pereaksi tanpa enzim. Kontrol negatif merupakan campuran larutan blanko yang ditambah enzim dan 5 µL metanol 80%.
Tiap sumur yang telah diisi dengan campuran pereaksi ditambah dengan 5 µL fraksi hasil kromatografi gel filtrasi. Selanjutnya, digoyang dengan Multiscan EX Thermo dan diinkubasi selama 45 menit pada suhu ruang. Reaksi selanjutnya ditambahkan pereaksi warna sebesar 100 µL (akuades: larutan hijau malakit: amonium molibdat: polivinil alkohol = 2:2:1:1, v/v), dan diinkubasi kembali selama 5 menit pada suhu ruang. Setelah itu, reaksi warna dihentikan dengan penambahan natrium sitrat sebanyak 25 µL/sumur. Selanjutnya, dibaca absorbansinya pada panjang gelombang 620 nm dan 405 nm.
) ')" & * 0+ & 1(
ditunjukkan dengan terbentuknya suspensi berwarna kuning keruh. Media *
(LB) merupakan media kompleks yang mempunyai komposisi media yang lengkap (tripton, ekstrak khamir, dan NaCl) dan cocok untuk pertumbuhan bakteri. Media LB ditambahkan dengan ampisilin. Penambahan ini bertujuan sebagai marka seleksi supaya bakteri lain selain bakteri yang membawa gen NS3 helikase HCV tidak dapat tumbuh. Kultur bakteri diinkubasi pada suhu 37oC dan digojok dengan kecepatan 200 rpm. Menurut Pelzar & Chan (1986), kondisi tersebut merupakan kondisi optimum untuk pertumbuhan bakteri . Pengukuran fase pertumbuhan pada panjang gelombang 600 nm karena kultur mempunyai serapan optimum pada panjang gelombang tersebut. Isopropil β-D-thiogalaktopiranosida (IPTG) ditambahkan pada saat nilai OD600 kultur sel mencapai 0.3 karena pada nilai tersebut kultur bakteri mencapai fase pertumbuhan logaritmik. Pada fase tersebut bakteri rekombinan mulai mengekspresikan enzim RNA helikase. Penambahan IPTG bertujuan menginduksi gen NS3 RNA helikase virus hepatitis C agar terjadi ekspresi berlebih. Ekspresi berlebih pada gen NS3 menyebabkan pembentukan enzim RNA helikase dalam jumlah yang lebih banyak dari fase logaritmik hingga fase stasioner awal (Utama . 2000)
Bakteri yang membawa gen NS3 RNA helikase HCV dipanen dengan sentrifugasi bertingkat sebanyak dua tahap. Sentrifugasi bertingkat bertujuan memisahkan
dengan media LB. Bakteri
mengendap sebagai pelet sedangkan media LB akan terpisah sebagai supernatan. Pelet atau bakteri yang terendapkan disimpan pada suhu -20oC untuk menghindari kerusakan pada sel bakteri dan menjaga stabilitas enzim RNA helikase virus hepatitis C (Schawen & Melling 1985).
: % ! (% ")( %& ' ' (
Enzim diisolasi dengan pemecahan sel terlebih dahulu. Pemecahan sel berlangsung secara mekanik, yaitu dengan cara
pengeringbekuan ( ' ) dan
sonikasi. Pengeringbekuan ( ' + menyebabkan pembentukan kristal es pada sel
yang membawa gen NS3 helikase HCV. Kristal es terbentuk akibat pengeringbekuan yang berlangsung berulang terhadap cairan intraseluler dan cairan ekstraseluler. Proses tersebut akan
memudahkan pemecahan sel (Schawen & Melling 1985). Pemecahan sel selanjutnya dengan sonikasi yang bertujuan memecah dinding sel. Sonikasi juga menyebabkan organel dalam sel keluar namun tidak merusak integritas fungsionalnya. Pada saat sonikasi ditambahkan bufer B yang mengandung 10 mM Tris HCl pH 8.5, 100 mM NaCl, dan 0.25% Tween 20. Larutan 10 mM tris HCl pH 8.5 berfungsi mempertahankan aktivitas enzim selama proses isolasi dan pemurnian enzim. Tween 20 yang terdapat dalam bufer digunakan untuk menghancurkan lipid bipolar pada membran sel. Lipid bipolar berasosiasi dengan virus hepatitis C membentuk kompleks replikasi sehingga enzim RNA helikase melekat pada membran (metabolit intraseluler). Rusaknya lipid bipolar akan menyebabkan disosiasi bagian hidrofobik enzim RNA helikase dengan membran sel. NaCl (natrium klorida) pada larutan bufer ini berfungsi menghilangkan asam nukleat dan kontaminan lainnya yang berikatan tidak spesifik dengan RNA helikase HCV dengan cara interaksi ionik (Vanz 2008).
Hasil sonikasi selanjutnya disentrifugasi dan diambil supernatannya. Supernatan berisi metabolit intraseluler yang perlu dimurnikan. Pemurnian menggunakan kromatografi afinitas metal amobilisasi. Metode pemurnian ini menggunakan resin TALON afinitas logam ( ) yang secara spesifik dapat mengikat RNA helikase yang terlabeli dengan 6xHis-Tag pada N terminalnya. Pengikatan residu His dilakukan oleh logam Co2+ yang terdapat dalam resin TALON. Pelabelan RNA helikase dilabeli dengan ujung His pada saat penyisipan gen ke dalam pET BL21 (DE3) pLysS. RNA helikase yang telah diikat oleh resin TALON dipisahkan dengan metabolit intraseluler lainnya melalui sentrifugasi. Bufer elusi (imidazola dalam bufer B) ditambahkan untuk menghilangkan protein selain enzim RNA helikase. Imidazola yang terdapat dalam bufer elusi dapat memutuskan ikatan antara RNA helikase dengan resin TALON afinitas logam. Imidazola berperan sebagai analog residu His yang terdapat pada enzim yang telah diikat oleh logam Co2+. Sentrifugasi pada kecepatan 5000 g selama 1 menit digunakan untuk memisahkan imidazola dengan enzim yang telah murni. Penggunaan kecepatan tersebut untuk menghindari kerusakan enzim dan mencegah penurunan aktivitasnya (Sambrook & Russel 2001).
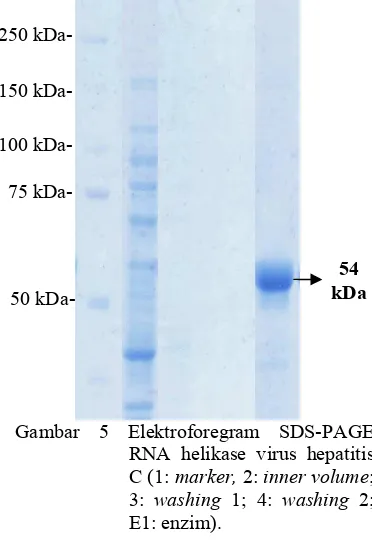
dengan metode SDS PAGE. Analisis ini bertujuan mengetahui kemurnian enzim. Elektroforegram SDS PAGE (Gambar 5) menunjukkan lajur 1 berupa , yang digunakan. Lajur 2 adalah supernatan hasil sentrifugasi yang terdapat banyak pita protein yang belum dimurnikan. Lajur 3 dan 4 merupakan supernatan hasil pencucian. Pada lajur W1 dan W2 tidak terdapat pita protein karena supernatan hanya berisi bufer B. Enzim RNA helikase berhasil diisolasi yang ditunjukkan dengan hasil SDS-PAGE pada lajur 5 berupa pita protein (E) dengan bobot molekul 54 kDa (Gambar 5) (Lampiran 2). Ukuran pita protein tersebut hasilnya sama dengan yang dilaporkan oleh Utama (2000).
Gambar 5 Elektroforegram SDS-PAGE RNA helikase virus hepatitis
C (1: , #2: % ;
3: 1; 4: 2;
E1: enzim).
) ')" !"# $
Nama BTM diambil dari tempat asal isolat tersebut, yaitu perairan Batam. Angka 11 menunjukkan kode lokasi isolat tersebut diambil. Pertumbuhan isolat mikroalga
ditandai dengan terbentuknya sel yang berbentuk filamen dan berwarna hijau (Gambar 6). Mikroalga tumbuh pada media
(MBM SW) yang mengandung mineral, seperti KNO3, K2HPO4, KH2PO4, NaCl, CaCl2.2 H2O, Fe sitrat, dan air laut steril. Tujuan digunakan air laut yang steril adalah mencegah pertumbuhan mikroorganisme lain selain mikroalga. Derajat kesamaan (pH) pada kondisi kultur berkisar antara 7-8. Kisaran
nilai pH pada kondisi kultur dijaga dengan aerasi. Aerasi menyebabkan pertukaran karbondioksida yang dapat menjaga stabilitas pH. Cahaya yang digunakan berasal dari lampu neon, sedangkan suhu kultur mikroalga berkisar antara 25oC-30oC (Barsanti & Gualtieri 2006).
Pengukuran pola pertumbuhan dari mikroalga menggunakan metode turbidimetri. Metode ini berdasarkan pengukuran kepadatan sel yang sebanding dengan nilai absorbansi pada panjang gelombang tertentu. Panjang gelombang yang digunakan adalah 630 nm. Panjang gelombang tersebut digunakan karena kultur mikroalga mempunyai serapan optimum pada panjang gelombang tersebut (Kusmiyati & Agustin 2006). Pemanenan pada waktu mendekati fase stasioner awal yaitu pada hari ke 50 (Gambar 7). Pada fase tersebut, mikroalga menghasilkan senyawa metabolit sekunder yang diperkirakan mempunyai aktivitas sebagai antivirus hepatitis C (Barsanti & Gualtieri 2006).
Gambar 6 Kultur mikroalga
Gambar 7 Kurva pertumbuhan mikroalga
!('" ! !"# $
Modifikasi metode ekstraksi mikroalga dibandingkan dengan Kusmiyati & Agustini (2006) adalah pelarut yang digunakan. Pelarut yang digunakan pada
;< !
50 kDa- 75 kDa- 100 kDa- 150 kDa-
1 2 3 4 5
ekstraksi ini adalah metanol 80%. Metanol 80% akan melarutkan senyawa-senyawa yang bersifat polar. Selain itu, pemilihan pelarut metanol 80% didasarkan pada hasil penapisan terhadap 50 isolat mikroalga. Berdasarkan hasil penapisan yang dilakukan oleh Laboratorium Virologi dan Bakteriologi Molekuler, ekstrak metanol 80%
memiliki aktivitas penghambatan tertinggi terhadap RNA helikase virus hepatitis C. Sebelum diekstraksi, sel mikroalga terlebih dahulu diendapkan selama semalam karena bentuk sel yang berupa filamen sulit dipisahkan dengan medianya. Setelah diendapkan, sel mikroalga dipisahkan secara sentrifugasi supaya sel benar-benar terpisah dengan media (Kusmiyati & Agustin 2006).
Sel yang telah terendapkan sebagai pelet ditambahkan pelarut metanol 80% dan disonikasi untuk memecah selnya. Pemecahan sel ini akan mengeluarkan metabolit intraseluler yang terdapat di dalam sel. Mikroalga memiliki susbtansi organik yang berlimpah didalam selnya yang disebut metabolit intraseluler, sedangkan produk yang disekresikan ke medium tumbuhnya disebut metabolit ekstraseluler (Barsanti & Gualtieri 2006). Hasil sonikasi selanjutnya dievaporasi yang bertujuan menguapkan pelarut yang tidak berikatan dengan senyawa sehingga diperoleh senyawa hasil ekstraksi yang diinginkan. Evaporasi dilakukan pada suhu 60˚C dalam keadaan vakum untuk memekatkan larutan dalam volume kecil serta tidak merusak senyawa yang terkandung didalamnya. Hasil evaporasi berupa ekstrak kasar mikroalga dengan bobot biomassa sebesar 58.89 g.
( - '#!
Analisis kualitatif ini bertujuan mengetahui senyawa metabolit sekunder yang terdapat dalam ekstrak metanol 80% mikroalga . Kandungan metabolit sekunder yang dianalisis dalam ekstrak kasar mikroalga antara lain; alkaloid, flavonoid, tanin, saponin, kumarin, triterpenoid, dan steroid.
Uji fitokimia yang pada ekstrak mikroalga menunjukkan hasil positif terdapat flavonoid dan kumarin (Tabel 1). Hal ini sesuai dengan Stobiecki & Kachlicki (2006) bahwa flavonoid dan kumarin akan larut dalam pelarut polar, seperti metanol dan air. Hasil negatif ditunjukkan terhadap alkaloid, tanin, saponin, kuinon, dan triterpenoid. Triterpenoid dan steroid bersifat nonpolar sehingga tidak
terekstrak dalam pelarut polar seperti metanol 80%.
Tabel 1 Hasil uji fitokimia ekstrak metanol mikroalga
% 1 3 ( - %'%" $
Alkaloid
-Wagner - Tidak ada
endapan
-Meyer - Tidak ada
endapan
-Dragendorf - Tidak ada
endapan
Tanin - Terbentuk
warna merah muda
Saponin - Tidak
berbusa
Flavonoid + Terbentuk
warna merah
Kumarin + Fluorosensi
warna hijau
Steroid - Warna
kuning
Triterpenoid - Warna
kuning Keterangan: (-): tidak terdeteksi; (+): terdeteksi
( % )" !('" ! ( " !"# $ !' 8 ' ( % $. 2 ' %". / & % ! (%
Ekstrak kasar yang diperoleh merupakan kumpulan dari berbagai senyawa yang terekstrak dalam metanol 80%. Oleh karena itu, perlu dimurnikan untuk mendapatkan senyawa kimia yang berperan sebagai inhibitor. Pemurnian ekstrak kasar menggunakan teknik kromatografi, yaitu kromatografi gel filtrasi dan kromatografi lapis tipis.
bersifat nonpolar akan keluar terlebih dahulu karena senyawa tersebut berinteraksi lemah dengan fase diam (silika gel). Senyawa yang bersifat lebih polar akan keluar paling akhir, senyawa tersebut berikatan lebih kuat dengan fase diam sehingga terelusi paling akhir (Soczewinski & Wawrzynowicz 2003). Fraksi-fraksi yang diperoleh kemudian diuji aktivitas penghambatannya dengan uji kolorimetri ATPase.
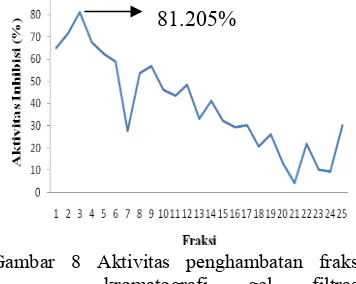
Penentuan aktivitas penghambatan RNA helikase HCV menggunakan uji kolorimetri ATPase. Berdasarkan uji tersebut terhadap 25 fraksi hasil kromatografi gel filtrasi terlihat bahwa fraksi 2, 3, dan 4 mempunyai aktivitas penghambatan tinggi (Gambar 8). Fraksi-fraksi tersebut diuji dengan nilai aktivitas enzim sebesar 1.02333 dan nilai blanko sebesar 0.495, sedangkan kontrol negatif (metanol 80%) sebesar 15.1791% (Lampiran 4). Kontrol negatif ini diuji untuk mengetahui pengaruh dari pelarut yang digunakan yaitu metanol 80% terhadap penghambatan enzim. Pengujian ini tidak menggunakan kontrol positif dikarenakan belum ditemukannya obat atau vaksin yang sesuai untuk infeksi virus hepatitis C. Nilai aktivitas penghambatan terhadap RNA helikase dari fraksi 2, 3, dan 4 masing-masing sebesar 71.726%, 81.205%, dan 67.622%. berdasarkan hasil tersebut diketahui bahwa fraksi 3 mempunyai aktivitas penghambatan tertinggi. Nilai aktivitas tersebut berarti secara % fraksi 3 dapat menghambat aktivitas RNA helikase sebesar 81.205%. konsentrasi RNA helikase sebelum dihambat adalah 0.9925 mM. Konsentrasi enzim yang berhasil dihambat oleh senyawa yang terdapat dalam fraksi 3 sebesar 0.7855 mM.
Uji ATPase digunakan untuk pengujian enzim yang aktivitasnya bergantung pada keberadaan ATP sebagai donor energi. Oleh karena itu, uji ini dapat digunakan untuk pengujian aktivitas penghambatan RNA helikase oleh inhibitor. Prinsip ujinya adalah pengukuran fosfat bebas yang terbentuk dari hasil reaksi antara RNA helikase dengan ATP yang menghasilkan ADP dan Pi (fosfat anorganik). Pi bebas akan membentuk kompleks warna dengan pereaksi amonium molibdat membentuk fosfomolibdat. Fosfomolibdat dapat bereaksi dengan protein (enzim RNA helikase) sehingga protein akan mengendap dan menimbulkan kekeruhan. Protein yang terendapkan dapat terlarut kembali dengan pereaksi polivinil alkohol sehingga kekeruhan tidak terjadi. Kekeruhan dapat menimbulkan rekasi warna yang
berlebih dan menimbulkan kesalahan positif. Warna yang terbentuk sebanding dengan konsentrasi Pi yang dihasilkan dari reaksi antara RNA helikase dan ATP (Chan 1986).
Pengukuran absorbansi dilakukan pada dua panjang gelombang, yaitu panjang gelombang 620 nm dan 405 nm. Panjang gelombang 620 optimum serapan warna hijau kebiruan dan panjang gelombang 405 nm optimum serapan warna kuning. Warna hijau kebiruan merupakan kompleks warna yang dibentuk dari reaksi larutan pewarna dan dengan fosfat bebas hasil hidrolisis ATP, sedangkan warna kuning merupakan warna yang dihasilkan oleh larutan pewarna yang tidak berikatan dengan Pi. Penggunaan dua panjang gelombang supaya perhitungan reaksi antara enzim dengan substrat lebih akurat. Perhitungan konsentrasi Pi yang dihasilkan dengan membandingkan nilai absorbansi dari pembacaan kedua panjang gelombang tersebut (Chan 1986).
Penghentian reaksi warna dengan penambahan Na-sitrat terhadap campuran pereaksi. Penambahan ini bertujuan mencegah proses pembentukan warna yang berlebihan. Molibdat bebas tersebut dapat berikatan dengan ATP yang tidak stabil yang dapat terhidrolisis selama proses uji ATPase berlangsung (Gawronski & Benson 2004). Larutan campuran utama ( )) berguna sebagai blanko dalam pengujian secara kolorimetri ATPase. Asam 4-morfolinopropanafosfat sulfonat (MOPS) digunakan sebagai bufer dalam campuran utama. Bufer tersebut digunakan untuk menjaga stabilitas enzim. ATP yang ditambahkan berperan sebagai substrat untuk RNA helikase. Keberadaan Mg2+ diperlukan sebagai kofaktor RNA helikase sehingga MgCl2 berfungsi sebagai donor kofaktor dalam campuran utama (Utama 2000).
Gambar 8 Aktivitas penghambatan fraksi kromatografi gel filtrasi terhadap RNA helikase HCV.
"#, 3 " !( 1 $ % &) 1 !' 8 ' ( % $. 2 ' %"' $$
%". / & % ! (%
Hasil uji ATPase tiap fraksi yang memiliki aktivitas penghambatan tinggi dianalisis menggunakan kromatografi lapis tipis (KLT) untuk melihat pemisahan senyawanya. Berdasarkan hasil percobaan diperoleh bahwa fraksi 2, 3, dan 4 hasil kromatografi gel filtrasi memiliki aktivitas penghambatan tertinggi sebesar 71.726%, 81.205%, dan 67.622% (Lampiran 4). Kromatogram KLT terlihat bahwa fraksi 2 mempunyai 1 noda pemisahan dengan nilai sebesar 0.8, sedangkan fraksi 3 dan 4 mempunyai 2 noda pemisahan. Nilai untuk noda yang terbentuk pada fraksi 3 berturut-turut adalah 0.8 (noda A) dan 0.37 (noda B), sedangkan pada fraksi 4 adalah 0.7 dan 0.35 (Gambar 9).
Pemurnian lanjutan dengan KLT preparatif hanya dilakukan terhadap fraksi 3 dengan noda A. Hasil preparatif noda A mempunyai aktivitas penghambatan lebih tinggi daripada noda B. Hasil uji penghambatan terhadap RNA helikase HCV oleh noda A sebesar 62.29% dan berhasil menghambat enzim sebesar 0.6002 mM (Lampiran 4). Eluen yang digunakan adalah kloroform : metanol (9:2). Fase gerak tersebut dipilih karena kemampuan metanol dalam meningkatkan polaritas kloroform (Rahman 2009). Noda yang terbentuk dikerok kemudian dilarutkan dengan metanol 80%. Pemisahan senyawa yang terikat dengan silika dilakukan dengan teknik sentrifugasi. Rendemen yang dihasilkan dari KLT preparatif sebesar 12% (b/v).
(a) (b)
Gambar 9 Kromatogram KLT fraksi 2, 3, dan 4; (a) hasil deteksi dengan penampak noda, (b) hasil deteksi spot pada sinar UV 254 nm.
Kromatogram dideteksi pada sinar UV dengan panjang gelombang 254 nm. Pada panjang gelombang ini, plat silika gel akan berpendar dan analit akan terlihat sebagai noda berwarna hitam. Menurut Fernand 2003 yang diacu dalam Puspita 2009, noda yang terlihat pada panjang gelombang 254 nm merupakan senyawa golongan alkaloid, flavonoid, dan senyawa fenolik. Hasil deteksi dengan sinar UV menunjukkan noda pemisahan yang sama dengan hasil penyemprotan lempeng silika dengan serium sulfat.
"# '#$" " !( 1 $ % &) 1 !' 8 ' ( % $. 2 ' %"' $$
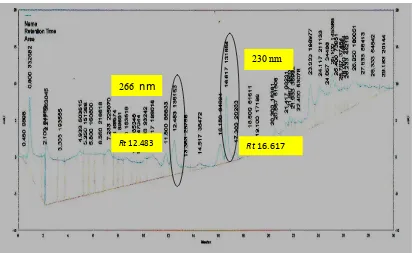
Analisis kualitatif senyawa terhadap fraksi 3 menggunakan kromatografi cair kinerja tinggi (KCKT). Kromatogram KCKT berupa puncak-puncak yang memiliki serapan pada panjang gelombang tertentu. Kromatogram fraksi 3 menunjukkan dua puncak yang memiliki kelimpahan tertinggi pada waktu retensi ( , + menit 12.483 dan 16.617 (Gambar 10). Menurut Stefova 2003, puncak pertama (menit 0.900) yang ditunjukkan pada kromatogram fraksi tersebut diperkirakan merupakan eluen yang digunakan. Dua puncak terpilih pada fraksi 3 selanjutnya dianalisis dengan detektor PDA untuk mengetahui serapan panjang gelombangnya. Fraksi 3 untuk puncak dengan 12.483 menit mempunyai serapan pada panjang gelombang 266 nm (Lampiran 5) sedangkan pada 16.617 serapannya adalah 230 nm (Lampiran 6). Berdasarkan Harbone (1987), kedua serapan puncak tersebut merupakan golongan senyawa flavonoid. Selain itu, hasil KLT yang memperlihatkan adanya noda yang terdeteksi pada panjang gelombang 254 juga mengindikasikan bahwa senyawa yang berhasil diisolasi merupakan golongan flavonoid (Fernand 2003, yang diacu dalam Puspita 2009). Analisis dengan KCKT juga sesuai dengan penapisan awal fitokimia yang menunjukkan hasil positif terhadap flavonoid.
Penelitian ini menggunakan KCKT fase terbalik. Eluen yang digunakan pada KCKT fase terbalik mempunyai tingkat kepolaran yang tinggi, seperti: metanol, air, asetonitril, dan tetrahidrofuran. Eluen yang digunakan dalam penelitian ini adalah metanol dan air dalam berbagai perbandingan. Penggunaan eluen tersebut dikarenakan eluen tersebut relatif lebih murah dan relatif tidak toksik jika dibandingkan dengan asetonitril dan tetrahidrofuran (Stefova
2003). 2 3 4
49
40=
Gambar 10 Kromatogram KCKT fraksi preparatif 3 noda 0.8.
Kromatogram fraksi 3 preparatif belum menunjukkan satu puncak dikarenakan eluen yang digunakan pada fraksinasi ekstrak kasar belum dapat memisahkan senyawa-senyawa dengan baik. kromatogram tidak linier dikarenakan kandungan metanol dalam fraksi (pelarut) yang konsentrasinya lebih besar dari senyawa inhibitor. Namun, secara uji ATPase pelarut yang digunakan hanya berperan kecil dalam menghambat enzim yaitu sebesar 15.1791%. Nilai penghambatan tersebut diperoleh melalui uji ATPase terhadap RNA helikase HCV (Lampiran 4).
Hasil analisis dengan uji fitokimia, KLT, dan KCKT menunjukkan bahwa golongan senyawa yang diperkirakan sebagai inhibitor RNA helikase HCV adalah flavonoid. Flavonoid telah banyak diteliti sebagai agen antivirus terhadap virus herpes, HIV, virus parainfluenza, dan adenovirus (Tapas 2008). Flavonoid menghambat siklus hidup virus pada waktu replikasi. Mekanisme penghambatan dari flavonoid yang melibatkan enzim replikasi virus diperkirakan melalui interaksi flavonoid dengan kofaktor enzim. Enzim replikasi seperti RNA helikase yang aktivitasnya bergantung pada ATP sangat membutuhkan kofaktor (Mg2+) untuk membantu interaksinya dengan substrat. Apabila kofaktor tersebut berikatan dengan flavonoid maka aktivitas enzim replikasi akan terhambat (Narayana 2001).
&)
Enzim RNA helikase yang berhasil diisolasi mempunyai bobot molekul 54 kDa. Enzim tersebut dapat dihambat oleh bahan aktif yang dihasilkan oleh mikroalga . Secara % bahan aktif tersebut dapat menghambat aktivitas enzim sebesar 81.205%. Kromatogram KLT terhadap fraksi 3 menghasilkan dua noda yang mempunyai nilai masing-masing 0.8 dan 0.37. Hasil fitokimia terhadap ekstrak kasar menunjukkan positif flavonoid dan kumarin. Analisis serapan puncak kromatogram KCKT dengan kelimpahan tertinggi pada waktu retensi 12.483 menit dan 16.617 menit adalah 266 nm dan 230 nm. Berdasarkan analisis dengan uji fitokimia, KLT, dan KCKT diperkirakan bahan aktif yang berperan sebagai inhibitor dalam fraksi tersebut merupakan senyawa golongan flavonoid.
"
Optimasi eluen kromatografi gel filtrasi perlu dilakukan. Hal tersebut dikarenakan masih banyaknya spot senyawa pada fraksi yang dianalisis dengan kromatografi cair kinerja tinggi. Selain itu, perlu juga dilakukan optimasi eluen untuk menghasilkan fraksi yang mempunyai daya inhibisi yang lebih tinggi terhadap RNA helikase. Setelah
230 nm
Rt 16.617 266
nm
mendapatkan senyawa murni yang berperan sebagai inhibitor perlu dilakukan identifikasi senyawa tersebut sehingga diperoleh informasi mengenai struktur kimianya.
Adnan M. 1997. , , - . ,
, Yogyakarta: Andi Offset.
Barsanti L, Gualtieri P. 2006. /
# #
. New York: CRC Pr. Borowitzka MA, Borowitzka LJ. 1988.
. Cambridge: Cambridge University Pr.
Borowski 2002. NTPase/helicase of & % % : inhibitors and inhibition of
the enzyme. 49:
497-614.
Chan KM, Delfert D, Junger KD. 1986. A
direct colorimetricc assay for Ca2+
stimulated ATPase activity. 157: 375-380.
Farnswoth NR. 1966. Biological and
phytochemical screening of plant. 0 55:3.
Gawronski JD, Benson DR. 2004. Microtiter assay for gluthamine synthetase biosintetic
activity using inorganic phospate
detection. 327: 114-118.
Hagel L. 1993. Size exclusion chromatography in an analytical perspective. 0 " 648:19-25.
Harjadi W. 1976. 1 - ,.
Bogor: IPB Pr.
Harbone JB. 1987. & , /
Ed 2. Kosasih P , penerjemah. Bandung: ITB Pr.
Hatsu 2002. A japanese enchepalitis virus NS3 inhibitor produced by a
" sp. 16:6-8.
Hostettmann 1986.
-" . Kosasih Padmawinata, penerjemah. Bandung: ITB. Terjemahan
dari: " % "
2
Jawaid A, Khuwaja AK. 2008. Treatment and vaccination for hepatitis C: present and
future. 0 20:
129-133.
Kabinawa INK. 2001. ,
! 3 ! +
! " , , . Bogor:
Puslitbang Bioteknologi, Lembaga Ilmu Pengetahuan Indonesia.
Kadare G, Haenni A. 1997. Virus encoded RNA helicases. 0 4 71: 2583-2590.
DEPKES. Departemen Kesehatan. 2010. Masyarakat dunia peringati hari hepatitis. http://www.depkes.go.id/index.php/berita/ press-release/1156-masyarakat-dunia-peringati-hari-hepatitis.html.
Kusmiyati, Agustini NWS. 2006. Uji aktivitas senyawa antibakteri dari mikroalga
" % 8:
48-53.
Lauer GM, Walker BD. 2001. Review article: hepatitis c virus infection. 5 0 1: 41-50.
Moradpour D, Penin F, Rice CM. 2007. Replication of hepatitis C virus. 5 %
5:453–463.
Mustopa AZ. 2009. Isolation and identification of RNA helicase inhibitor from indonesia microalgae. TORAY,
"
Narayana KR, Sripal R, Chaluvadi, Khrisna. 2001. Bioflavonoids classification, pharmacological, biochemical effect and therapeutical potentials. 1 0
33: 2-16.
Nur MA 1992. , , * .
Bogor: IPB Pr.
Ohta 1998. Anti-herpes simplex virus substances produced by the marine green alga, ! " . 0 ""
10:349-355.
Pelzar MJ, Chan ECS. 1988. ! 6!
, 2. Hadietomo ,
penerjemah. Jakarta: UI Pr. Terjemahan dari:
Puspita MDA. 2009. Pengoptimuman fase gerak KLT menggunakan desain campuran untuk pemisahan komponen
ekstrak meniran ( )
Rahman MN. 2009. Aktivitas antibakteri senyawa hasil biotransformasi kurkumin oleh mikrob endofit asal kunyit [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Sambrook J, Russel DW. 2001.
/ * 4 7 Ed
3. Cold Spring Harbour: Cold Spring Laboratory Pr.
Schawen MD, Melling J. 1985. ,
' . Alan Wiseman,
editor. West Sussex: Ellis Horword Ltd. Shih SR 2003. Inhibition of enterovirus
71-induced apoptosis by allophycocyanin isolated from a blue-green alga " " . 0 4 70:119–125. Soczewinski E, Wawrzynowicz T. 2003. Gel
Filtration Chromatography. Di dalam: Jack Cazes, editor. "
" . New York: Marcel Dekker. hlm 374-385.
Stefova M 2003. High Performance Liquid Chromatography. Di dalam: Jack Cazes, editor. "
" . New York: Marcel Dekker. hlm 236-242.
Stobiecki M, Kachlicki P. 2006.
& % . Erich Grotewold, editor. New York: Springer Science.
Soriano V, Peters JM, Zeuzem S. 2009. New therapies for hepatitis C infection.
1 ! 48:13–20.
Sy T, Jamal M. 2006. Reviews: Epidemiology of hepatitis C virus (HCV) infection. 0
3: 41-46.
Talyshinsky MM, Yelena YS, Mahmoud MH. 2002. Antiviral activity of red microalgal polysaccharides against Retroviruses.
1 2: 1-7.
Tapas AR, DM Darkarrar, Kakde RB. 2008. Flavonoids as nutraceuticals. " 0
7:1089-1099.
Tellinghuisen TL 2001. Studying hepatitis C virus: making the best of a bad virus. 0 4 81: 8853-8867.
Utama A 2000. Identification and characterization of t he RNA helicase activity of japanese enchepalitis virus NS3 protein. & * 456: 74-78.
Vanz 2008. Human granulocyte colony stimulating factor (Hg-CSF): cloning, overexpression, purification, and characterization. &
7:13-15.
Wardell AD 1999. Characterization and mutational analysis of the helicase and NTPase activities of hepatitis C virus full length NS3 protein. 0 8 4 80:701-709.
Wilson K, Walker JM. 1994. "
2 Ed
4. Cambridge: Cambridge University Pr. Worman HJ, Lin F. 2000. Molecular biology
of liver disorders: the hepatitis C virus and molecular targets for drug development.
Lampiran 1 Rancangan Penelitian
Isolasi dan Pemurnian RNA Helikase HCV
Kultur E. coli BL 21 (DE3)
pLysS yang membawa gen
NS3 (RNA Helikase)
Isolasi RNA Helikase
HCV
Pemurnian RNA Helikase HCV
menggunakan kromatografi
afinitas dengan TALON
Lanjutan lampiran 1
Isolasi dan Pemurnian Bahan Aktif dari Mikroalga
Kultur Mikroalga
Analisis bahan aktif
menggunakan KCKT
Analisis bahan aktif
menggunakan
kromatografi lapis tipis
Pemurnian bahan aktif
menggunakan kromatografi
gel filtrasi
Uji ATPase
Ekstraksi mikroalga
Lampiran 2 Bobot molekul relatif enzim RNA helikase HCV
Bobot molekul relatif RNA helikase :
=
4
.
7
8
.
4
= 0.65
y
= -1.091x + 2.44
y
= -1.091(0.65) + 2.44
y
= 1.73
Log BM = 1.73
BM
= 54 kDa
Bobot
molekul
(BM)
,
Log BM
250
150
100
75
50
2.39
2.17
2
1.87
1.69
Lampiran 3 Kurva standar fosfat (Uji ATPase)
Konsentrasi K
2HPO
4(mM)
Absorbasi 620 nm
dengan referensi 405 nm
0.0
0.1
0.2
0.4
0.6
0.8
1.0
0.000
0.102
0.239
0.417
0.622
0.834
1.022
22
Nama Sampel Blanko Enzim Negatif Fraksi 1 Fraksi 2 Fraksi 3 Fraksi 4 Fraksi 5 Fraksi 6 Fraksi 7 Fraksi 8 Fraksi 9 Fraksi 10 Fraksi 11 Fraksi 12 Fraksi 13 Fraksi 14 Fraksi 15 Fraksi 16 Fraksi 17 Fraksi 18 Fraksi 19 Fraksi 20 Fraksi 21 Fraksi 22 Fraksi 23 Fraksi 24 Fraksi 25 E 64.886 71.7269 4 ;
Lanjutan lampiran 4
Keterangan:
A
= selisih absorbansi (λ
620nm-λ
405nm)
B
= A – nilai blanko
C
= (absorbansi enzim tanpa inhibitor – absorbansi enzim dengan inhibitor)
Absorbansi enzim tanpa inhibitor
D (persentase absorbansi inhibisi)
= C x 100%
·
Contoh perhitungan pada fraksi 3:
A
= 0.496
B
= 0.496 – 0.459
= 0.037
C
= (1.02333 – 0.037): 1.02333
= 0.96384
D
= 0.96384 x 100%
= 96.3844%
Absorbansi aktivitas inhibisi dikurangi dengan kontrol negatif
= 96.3844% - 15.1791%
=
9 4
; >
·
Perhitungan inhibisi enzim
y = 1.0207 x + 0.0103
keterangan:
y = absorbansi
x = konsentrasi Pi yang setara dilepaskan oleh 1 molekul RNA helikase
y
= 1.0207 x + 0.0103
1.02333 = 1.0207 x + 0.0103
x
=
477 ;
x
= konsentrasi enzim tanpa inhibitor
·
Konsentrasi enzim yang telah dihambat oleh bahan aktif dari mikroalga
y
= 1.0207 x + 0.0103
0.8121 = 1.0207 x + 0.0103
x
=
4=9;;
24
Lanjutan lampiran 4
persentase
blanko
enzim
metanol
noda A
noda B
62,29562
23,80377
4,996944
67,29256
28,80071
(Abs
enzim-Abs
enzimdgninh ibitor)
0,049969
0,672926
0,288007
Abs-blanko
1,100666
1,045666
0,359999
0,783666
Selisih λ
620-λ
4050,387666
1,488333
1,433333
0,747666
1,171333
Rata-rata
0,814667
2,211333
2,142333
1,210333
1,740667
Ulangan
3
0,762
2,189
2,163
1,238
1,72
2
0,865
2,218
2,151
1,162
1,66
1
Lampiran 5 Serapan puncak pada waktu retensi 12.483.
Lampiran 6 Serapan puncak pada waktu retensi 16.617.
PRABAWATI HYUNITA PUTRI. Isola