UJI AKTIVITAS INHIBISI FRAKSI-FRAKSI HASIL
KOLOM KROMATOGRAFI DARI EKSTRAK KULIT
BUAH MANGGIS (Garcinia mangostana L.)
TERHADAP ENZIM RNA HELIKASE VIRUS
HEPATITIS C
SKRIPSI
YUNITA SARI
NIM.109102000063
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
JAKARTA
ii
UIN SYARIF HIDAYATULLAH JAKARTA
UJI AKTIVITAS INHIBISI FRAKSI-FRAKSI HASIL
KOLOM KROMATOGRAFI DARI EKSTRAK KULIT
BUAH MANGGIS (Garcinia mangostana L.)
TERHADAP ENZIM RNA HELIKASE VIRUS
HEPATITIS C
SKRIPSI
Diajukan Sebagai Salah Satu Syarat untuk Memperoleh Gelar Sarjana Farmasi (S.Far)
YUNITA SARI
NIM.109102000063
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
JAKARTA
iii
HALAMAN PERNYATAAN ORISINILITAS
Skripsi ini adalah hasil karya saya sendiri, dan semua sumber baik yang dikutip maupun dirujuk telah saya nyatakan dengan benar.
Nama : Yunita Sari
NIM : 109102000063
Tanda Tangan :
iv
HALAMAN PERSETUJUAN PEMBIMBING
Nama : Yunita Sari
NIM : 109102000063
Program Studi : Farmasi
Judul Skripsi : Uji Aktivitas Inhibisi Fraksi-Fraksi Hasil Kolom
Kromatografi dari Ekstrak Kulit Buah Manggis (Garcinia
mangostana L.) Terhadap Enzim RNA Helikase Virus
Hepatitis C
Disetujui Oleh :
Pembimbing I Pembimbing II
Lina Elfita, M.Si.,Apt. A. Zaenal Mustopa, M.Si NIP. 197312122011012002 NIP. 197704122005021001
Mengetahui,
Ketua Program Studi Farmasi FKIK UIN Syarif Hidayatullah Jakarta
v UIN Syarif Hidayatullah Jakarta
HALAMAN PENGESAHAN
Skripsi ini diajukan oleh :
Nama : Yunita Sari
NIM : 109102000063
Program Studi : Farmasi
Judul Skripsi : Uji Aktivitas Inhibisi Fraksi-Fraksi Hasil Kolom
Kromatografi dari Ekstrak Kulit Buah Manggis (Garcinia
mangostana L.) terhadap Enzim RNA Helikase Virus
Hepatitis C
Telah berhasil dipertahankan di hadapan Dewan Penguji dan diterima sebagai bagian persyaratan yang diperlukan untuk memperoleh gelar Sarjana Farmasi pada Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan, Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta
DEWAN PENGUJI
Pembimbing I : Lina Elfita, M.Si.,Apt. ( )
Pembimbing II : A. Zaenal Mustopa, M.Si. ( )
Penguji I : Ofa Suzanti Betha, M.Si.,Apt. ( )
Penguji II : Ismiarni Komala, M.Sc.,Ph.D., Apt. ( )
Ditetapkan di : Jakarta
vi UIN Syarif Hidayatullah Jakarta
ABSTRAK
Nama : Yunita Sari
Program Studi : Farmasi
Judul : Uji Aktivitas Inhibisi Fraksi-Fraksi Hasil Kolom Kromatografi dari Ekstrak Kulit Buah Manggis (Garcinia mangostana L.) Terhadap Enzim RNA Helikase Virus Hepatitis C
Virus hepatitis C termasuk anggota dalam genus hepacivirus dan famili flaviviridae yang merupakan penyebab penyakit hepatitis pada manusia di seluruh dunia. Penemuan senyawa-senyawa yang memiliki potensi sebagai inhibitor terhadap enzim yang essensial dalam proses replikasi pada virus HCV seperti enzim protease, RNA helikase, dan polimerase terus dilakukan. Manggis (Garcinia mangostana L.) merupakan pohon berbuah yang terdistribusi di Thailand, India, Srilanka, Myanmar, Indonesia, Malaysia, Philipina, dan China. Pada beberapa penelitian telah dilaporkan bahwa ekstrak kulit buah manggis dan senyawa aktifnya memiliki aktivitas antimikroba, antifungi, antioksidan, antiinflamasi, dan bahkan anti HIV. Penelitian ini bertujuan untuk mengetahui aktivitas inhibisi hasil fraksi-fraksi kolom kromatografi dari ekstrak metanol kulit buah manggis terhadap RNA Helikase HCV. Eluen yang digunakan pada kolom kromatografi ini adalah kloroform-metanol dengan perbandingan (9:1, 8:2, 7:3, 6:4,5:5,4:6,3:7,2:8,1:9). Hasil fraksi kolom kromatografi ekstrak kulit buah manggis dibuat pada konsentrasi 2.500 ppm. Hasil penelitian menunjukkan bahwa aktivitas penghambatan tertinggi pada fraksi ke-sembilan dengan eluen kloroform-metanol perbandingan 7:3 yaitu sebesar 81,2 % dengan aktivitas enzim RNA helikase HCV sebesar 87,36 pmol fosfat/ml/menit/pmol protein. Hasil ini menunjukkan bahwa ekstrak kulit buah manggis berpotensi sebagai inhibitor RNA helikase virus hepatitis C.
vii UIN Syarif Hidayatullah Jakarta
ABSTRACT
Name : Yunita Sari
Program Study : Pharmacy
Title : Inhibition Activity Test of Fractions Result Column Chromatography of Mangosteen (Garcinia mangostana L.) Pericarp Extract Against Hepatitis C Virus RNA Helicase
Hepatitis C virus including members of the Flaviviridae family, Hepacivirus genus and that is the cause of chronic hepatitis in humans worldwide. The discovery of compounds that have potential as inhibitor to essential enzyme in the process of replication HCV viral such as protease, RNA helicase and polymerase continues to be done. Mangosteen (Garcinia mangostana L.) is a fruit tree distributed in Thailand, India, Srilanka, Myanmar, Indonesia, Malaysia, Philippines and China.Recently research has reported that extracts of mangosteen pericarp and active compounds of pharmacological activities such as antimicrobial, antifungal, antioxidant, antiinflammatory, and anti-HIV. This study aims to determine inhibition activity of fractions result column chromatography from methanol pericarp extract of mangosteen of HCV RNA helicase. Eluent used in the column chromatography with the ratio of chloroform-methanol (9:1, 8:2, 7:3, 6:4, 5:5, 4:6, 3:7, 2:8, 1:9). Result of column chromatography fractions of pericarp extract of mangosteen was made with a concentration of 2.500 ppm. The results indicated that the highest inhibitory activity in fraction ninth with eluent chloroform-methanol 7:3 is 81.2% with the enzyme activity of HCV RNA helicase is 87.36 pmol phosphate/ml/min/pmol protein. These results indicate that pericarp extract of mangosteen has potential as inhibitor of HCV RNA helicase.
viii UIN Syarif Hidayatullah Jakarta
KATA PENGANTAR
Alhamdulillah, segala puji dan syukur penulis panjatkan kehadirat Allah
SWT, yang telah melimpahkan rahmat dan karunia-Nya sehingga penulis dapat
menyelesaikan skripsi ini. Penulisan skripsi ini dilakukan dalam rangka
memenuhi salah satu syarat untuk menyelesaikan pendidikan guna memperoleh
gelar Sarjana Farmasi di Fakultas Kedokteran dan Ilmu Kesehatan Universitas
Islam Negeri (UIN) Syarif Hidayatullah Jakarta.
Penulis menyadari bahwa, tanpa bantuan dan dukungan dari berbagai
pihak, sangatlah sulit bagi penulis untuk menyelesaikan skripsi ini. Untuk itu,
penulis mengucapkan terima kasih yang sebesar-besarnya kepada :
(1) Ibu Lina Elfita, M.Si., Apt. selaku pembimbing I dan Bapak Apon Zaenal
Mustopa, M.Si. selaku pembimbing II, yang memiliki andil besar dalam
proses penelitian dan penyelesaian tugas akhir saya ini.
(2) Bapak Prof. Dr. dr.(hc). M. K. Tadjudin, Sp.And selaku Dekan Fakultas
Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri (UIN) Syarif
Hidayatullah Jakarta.
(3) Bapak Drs. Umar Mansur, M,Sc., Apt selaku ketua Program Studi Farmasi
Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri (UIN)
Syarif Hidayatullah Jakarta.
(4) Bapak dan Ibu dosen dan karyawan yang telah memberikan bimbingan dan
bantuan selama saya menempuh pendidikan di Program Studi Farmasi
Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri (UIN)
Syarif Hidayatullah Jakarta.
(5) Tim pengelola beasiswa santri jadi dokter Pemda Musi Banyuasin yang
telah mendukung saya sehingga saya dapat mengenyam pendidikan di UIN
Syarif Hidayatullah Jakarta.
(6) Kedua orang tua tercinta, Ayahanda Balakia dan Ibunda Faridah yang tak
pernah henti mendoakan dan memberikan dukungan kepada penulis, untuk
ix UIN Syarif Hidayatullah Jakarta
(7) Teman seperjuangan selama kuliah dan penelitian Fakhrul Umam.
(8) Keluarga besar Laboratorium Bakteriologi dan Virologi Molekuler LIPI, bu
Rifqiyah, om Ridwan, kak Linda, kak Putri, kak Yuni, kak Meita, kak Hana,
mas Aris, kak Ike, kak Aksar, kak Bugi, Uud, kak Kus, kang Ace yang telah
banyak membantu penulis dalam penelitian.
(9) Teman-teman Farmasi angkatan 2009 khususnya teman EDTA C, SJD
Muba angkatan 2009 dan sahabat-sahabat tercinta Butet, Puput, Dwi, Ika,
Ainul, dan Nurul yang berbagi suka, duka, keceriaan, dan semangat semasa
kuliah hingga penyelesaian tugas akhir ini.
Akhir kata, semoga Allah SWT membalas segala kebaikan semua pihak
yang telah membantu. Penulis menyadari bahwa penulisan skripsi ini masih jauh
dari kata sempurna, untuk itu saran dan kritik tetap penulis harapkan untuk
menjadikan tulisan ini lebih baik. Penulis berharap semoga skripsi ini
memberikan manfaat dan sumbangan bagi kemajuan dan perkembangan ilmu
pengetahuan di masa yang akan datang. Amiin Ya Robbal ‘Alamin.
Jakarta, September 2013
x UIN Syarif Hidayatullah Jakarta
HALAMAN PERNYATAAN PERSETUJUAN PUBLIKASI TUGAS AKHIR UNTUK KEPENTINGAN AKADEMIK
Sebagai sivitas akademik Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta, saya yang bertanda tangan di bawah ini :
Nama : Yunita Sari
NIM : 109102000063
Program Studi : Farmasi
Fakultas : Kedokteran dan Ilmu Kesehatan
Jenis karya : Skripsi
Demi perkembangan ilmu pengetahuan, saya menyetujui skripsi/karya ilmiah
saya, dengan judul :
UJI AKTIVITAS INHIBISI FRAKSI-FRAKSI HASIL KOLOM KROMATOGRAFI DARI EKSTRAK KULIT BUAH MANGGIS (Garcinia
mangostana L.) TERHADAP ENZIM RNA HELIKASE VIRUS HEPATITIS C
Untuk dipublikasikan atau ditampilkan diinternet atau media lain yaitu Digital
Library Perpustakaan Universita Islam Negeri (UIN) Syarif Hidayatullah Jakarta
untuk kepentingan akademik sebatas sesuai dengan Undang-Undang Hak Cipta.
Demikian pernyataan persetujuan pubikasi karya ilmiah ini saya buat dengan
sebenarnya.
Di buat di : Jakarta
Pada Tanggal : 27 September 2013
Yang menyatakan
xi UIN Syarif Hidayatullah Jakarta
DAFTAR ISI
Halaman
HALAMAN JUDUL ... ii
HALAMAN PERNYATAAN ORISINILITAS ... iii
HALAMAN PERSETUJUAN PEMBIMBING ... iv
HALAMAN PENGESAHAN ... v
ABSTRAK ... iv
ABSTRACT ... v
KATA PENGANTAR ... vi
HALAMAN PERSETUJUAN PUBLIKASI KARYA ILMIAH ... x
DAFTAR ISI ... xi
2.1.1 Klasifikasi Tanaman ... 4
2.1.2 Deskripsi Tanaman ... 4
2.1.3 Kandungan Senyawa ... 5
2.1.4 Khasiat Manggis (Garcinia mangostana L.) ... 6
2.2 Ekstraksi ... 7
BAB 3. METODE PENELITIAN ... 15
3.1 Waktu dan Tempat Penelitian ... 15
3.2 Alat dan Bahan ... 15
3.3 Metode Penelitian ... 16
3.3.1 Pengambilan Sampel ... 16
3.3.2 Determinasi Sampel ... 16
3.3.3 Persiapan Simplisia ... 17
3.3.4 Pembuatan Ekstrak Kulit Buah Manggis (Garcinia mangostana L.) ... 17
3.3.5 Rendemen Total Ekstrak Metanol Kulit Buah Manggis (Garcinia mangostana L.) ... 17
xii UIN Syarif Hidayatullah Jakarta
3.3.7 Parameter dan Metode Uji Ekstrak ... 19
3.3.7.1 Parameter Non Spesifik ... 19
3.3.7.2 Parameter Spesifik... 19
3.3.8 Produksi Enzim RNA Helikase Virus Hepatitis C ... 20
3.3.9 Uji Kemurnian Enzim RNA Helikase HCV dengan SDS-PAGE ... 21
3.3.10 Uji Aktivitas Enzim RNA Helikase Virus Hepatitis C ... 22
3.3.11 Pemisahan Senyawa Inhibitor dengan Kolom kromatografi ... 23
3.3.12 Uji Aktivitas Inhibisi Ekstrak Kulit Manggis terhadap RNA Helikase HCV ... 24
3.3.13 Visualisasi Hasil Fraksi Kolom Kromatografi dengan Menggunakan Kromatografi Lapis Tipis ... 25
3.3.14 Perhitungan Aktivitas RNA Helikase Virus Hepatitis C ... 25
BAB 4 HASIL DAN PEMBAHASAN ... 27
4.1 Determinasi Sampel ... 27
4.2 Rendemen Ekstrak ... 27
4.3 Penapisan Fitokimia ... 28
4.4 Parameter dan Metode Uji Ekstrak ... 30
4.5 Produksi Enzim RNA Helikase Virus Hepatitis C ... 31
4.6 Uji Kemurnian Enzim RNA Helikase HCV dengan SDS-PAGE ... 33
4.7 Aktivitas Inhibisi Ekstrak Metanol Kulit Buah Manggis terhadap RNA Helikase HCV ... 35
4.8 Aktivitas Inhibisi Fraksi-Fraksi Hasil Kolom Kromatografi Ekstrak Kulit Buah Manggis terhadap RNA Helikase HCV ... 37
4.9 Perhitungan Aktivitas RNA Helikase Virus Hepatitis C ... 40
BAB 5 KESIMPULAN DAN SARAN ... 43
5.1 Kesimpulan ... 43
5.2 Saran ... 43
DAFTAR PUSTAKA ... 45
xiii UIN Syarif Hidayatullah Jakarta
DAFTAR TABEL
xiv UIN Syarif Hidayatullah Jakarta
DAFTAR GAMBAR
Halaman
Gambar 2.1 Buah Manggis (Garcinia mangostana L.) ... 4
Gambar 2.2 Virus Hepatitis C ... 9
Gambar 2.3 Mekanisme Kerja Enzim RNA Helikase ... 10
Gambar 4.1 Hasil SDS-PAGE RNA Helikase HCV ... 35
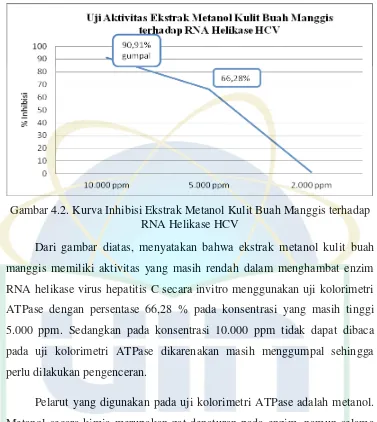
Gambar 4.2 Kurva Inhibisi Ekstrak Metanol Kulit Buah Manggis terhadap RNA Helikase HCV ... 38
Gambar 4.3 Profil Aktivitas Inhibisi Fraksi Kolom Kromatografi Ekstrak Kulit Buah Manggis terhadap Enzim RNA Helikase HCV ... 39
Gambar 4.4 Visualisasi KLT pada Fraksi Hasil Kolom Kromatografi Ekstrak Metanol Kulit Buah manggis terhadap Enzim RNA Helikase HCV ... 40
xv UIN Syarif Hidayatullah Jakarta
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Hasil Determinasi (Garcinia mangostana L.) ... 49
Lampiran 2. Alur Penelitian ... 50
Lampiran 3. Alur Kerja Persiapan Ekstrak Kulit Buah Manggis (Garcinia mangostana L.) ... 51
Lampiran 4. Alur Kerja Produksi Enzim RNA Helikase Virus Hepatitis C . 52 Lampiran 5. Alur Kerja Analisis Kemurnian Enzim RNA Helikase HCV dengan SDS-PAGE ... 53
Lampiran 6. Alur Kerja Uji Aktivitas Enzin RNA Helikase HCV ... 54
Lampiran 7. Alur Kerja Uji Aktivitas Inhibisi Ekstrak Kulit Buah Manggis terhadap RNA helikase HCV ... 55
Lampiran 8. Komposisi larutan-larutan yang digunakan dalam SDS-PAGE ... 56
Lampiran 9. Komposisi Reagen, Dapar, dan Medium yang digunakan ... 57
Lampiran 10. Perhitungan Rendemen Ekstrak Kulit Buah Manggis ... 58
Lampiran 11. Perhitungan Parameter Ekstrak Kulit Buah Manggis. ... 59
Lampiran 12. Perhitungan Pengenceran Fraksi Kolom Kromatografi Ekstrak Kulit Buah Manggis ... 60
Lampiran 13. Hasil Uji Aktivitas Inhibisi Ekstrak Metanol Kulit Buah Manggis (Garcinia mangostana L.) terhadap Enzim RNA Helikase HCV ... 61
Lampiran 14. Hasil Uji Aktivitas Inhibisi Fraksi Kolom Kromatografi Ekstrak Kulit Buah Manggis (Garcinia mangostana L.) terhadap Enzim RNA Helikase HCV ... 62
Lampiran 15. Perhitungan Persen Inhibisi Hasil Fraksi Ekstak Kulit Buah Manggis (Garcinia mangostana L.) terhadap RNA Helikase HCV ... 64
Lampiran 16. Kurva Standar Fosfat (Uji ATPase) ... 65
Lampiran 17. Contoh Perhitungan Aktivitas Enzim RNA Helikase HCV ... 66
Lampiran 18. Tabel Aktivitas Enzim RNA Helikase HCV dengan Penambahan Senyawa Inhibitor Ekstrak Kulit Buah Manggis (Garcinia mangostana L.) ... 67
xvi UIN Syarif Hidayatullah Jakarta
DAFTAR ISTILAH APS : Ammonium Per Sulfat
ATP : Adenosin Trifosfat
IPTG : Isopropyl-β-D-Thiogalaktopiranosidase
IV : Inner volum
HCV : Hepatitis C Virus LB : Media Luria - Bertani
MOPS : 4-asam morfolinopropana sulfonat OD : Optical Density
SDS-PAGE : Sodium Dodecyl Sulfate Polyacrylamide Gel Electrophoresis TEMED : N,N,N’,N’-tetrametiletilendiamin
1
UIN Syarif Hidayatullah Jakarta BAB 1
PENDAHULUAN 1.1 Latar Belakang
Penyakit menular yang disebabkan oleh virus bukan suatu masalah
baru di Indonesia dan juga merupakan masalah global yang perlu ditangani
secara serius. Hepatitis C, misalnya, adalah salah satu penyakit menular
yang disebabkan oleh infeksi virus hepatitis C yang merupakan golongan
flavivirus. Virus hepatitis C ini merupakan penyakit penyebab kematian ke
sepuluh didunia. Sekitar 12.000 orang meninggal pada tahun 2010 akibat
infeksi virus hepatitis C di Amerika Serikat menurut US Centers for
Disease Control And Prevention (CDC, 2012). Sedangkan berdasarkan data
World Health Organization (2012), diperkirakan sekitar sepertiga dari
populasi dunia atau sekitar 2 miliar orang saat ini terinfeksi oleh salah satu
dari virus yang menyebabkan hepatitis, dengan angka kematian 350.000
orang per tahun dan 150 juta orang menderita penyakit virus hepatitis C.
Virus HCV ini dapat menyebar melalui penggunaan jarum suntik yang
berulang, transfusi darah, hubungan seksual, dan hemodialisis (Sy & Jamal,
2006). Hingga saat ini belum ada vaksin dan obat untuk mencegah dan
mengobati infeksi HCV. Terapi pengobatan saat ini untuk hepatitis C kronis
adalah pegylated interferon-α (IFN-α) dikombinasi dengan nukleosida
analog ribavirin. Akan tetapi terapi ini memiliki tingkat efektivitas sekitar
40% – 50% terhadap infeksi HCV. Kombinasi ini memiliki efek samping
seperti flu, anemia, dan depresi, yang sering menyebabkan penghentian
terapi. Dengan demikian, diperlukan penelitian untuk menemukan agen baru
dengan indeks terapi tinggi dan efek samping minimal untuk mengobati
infeksi HCV kronis (Lee et al, 2010, Ravikumar et al, 2011).
Upaya dalam rangka menemukan obat baru yang efektif dalam
pengobatan penyakit hepatitis C terus dilakukan dalam rangka menemukan
obat yang benar-benar efektif untuk menghambat kerja virus HCV ini dan
mengatasi masalah penyakit hepatitis C di Indonesia. Beberapa diantaranya
UIN Syarif Hidayatullah Jakarta terhadap enzim yang essensial dalam proses replikasi pada virus HCV
tersebut. Enzim-enzim essensial seperti enzim protease, RNA helikase, dan
polimerase menjadi target utama peneliti dalam memperoleh senyawa
inhibitor terhadap virus HCV ini.
Seperti pada enzim RNA helikase selain memiliki aktivitas RNA
helikase itu sendiri, juga memiliki aktivitas ikatan RNA (RNA binding) dan
ATPase (RNA-simulated ATPase), dan kedua aktivitas ini berpengaruh
terhadap aktivitas RNA helikase. Dengan adanya inhibitor yang
menghambat kerja RNA helikase, maka dapat menghambat proses replikasi
virus yang merupakan tahapan penting dalam proses pertumbuhan virus.
Oleh karena itu, enzim ini menjadi target yang potensial untuk penemuan
obat antivirus (Utama et al, 2005).
Dalam beberapa tahun terakhir ini konsep “back to nature” terus
menjadi pusat perhatian. Seperti pada penelitian yang telah dilakukan
sebelumnya oleh Syajarwati (2013) menemukan adanya aktivitas inhibisi
terhadap enzim RNA helikase virus hepatitis C dari ekstrak metanol kulit
buah manggis (Garcinia mangostana L.). Aktivitas ekstrak dalam beberapa
fraksi pelarut yang paling optimal dalam menginhibisi RNA helikase pada
virus HCV ini adalah pada fraksi ekstrak metanol sebesar 71,57% dengan
konsentrasi 3.125 ppm. Kulit buah manggis (Garcinia mangostana L.) telah
dilaporkan banyak memberikan aktivitas farmakologis seperti antimikroba,
antioksidan, antifungi, antitumor, antiinflamasi, antialergi, antimalaria dan
antiviral dan terus menaruh perhatian peneliti untuk melakukan isolasi
terhadap senyawa yang memberikan aktivitas (Chaverri et al, 2008).
Penelitian ini memberikan gambaran bahwa ekstrak kulit buah
manggis (Garcinia mangostana L.) mempunyai potensi sebagai kandidat
senyawa baru dalam menghambat kerja virus hepatitis C. Merujuk dari
penelitian tersebut maka peneliti bermaksud untuk melakukan uji aktivitas
inhibisi hasil fraksi-fraksi kolom kromatografi dari ekstrak kulit buah
manggis (Garcinia mangostana L.) terhadap enzim RNA helikase virus
UIN Syarif Hidayatullah Jakarta 1.2 Batasan dan Rumusan Masalah
1.2.1 Batasan penelitian
Batasan penelitian yang dilakukan meliputi uji aktivitas inhibisi pada
hasil fraksi-fraksi kolom kromatografi dari ekstrak metanol kulit buah
manggis (Garcinia mangostana L.) terhadap enzim RNA helikase virus
hepatitis C.
1.2.2 Rumusan masalah
Pemanfaatan bahan alam sebagai kandidat penemuan obat baru untuk
pengobatan penyakit hepatitis C masih terus diteliti sehingga diperoleh
suatu senyawa murni yang benar-benar efektif dalam menghambat enzim
RNA helikase virus hepatitis C. Untuk memperoleh suatu senyawa yang
murni dari senyawa kompleks yang terdapat pada ekstrak bahan alam cukup
sulit dan perlu dilakukan penelitian lebih lanjut. Yang menjadi
permasalahan dalam penelitian ini adalah : fraksi mana yang menghasilkan
aktivitas inhibisi tertinggi terhadap enzim RNA helikase virus hepatitis C
dari hasil kolom kromatografi ekstrak kulit buah manggis (Garcinia
mangostana L.)?
1.3 Tujuan Penelitian
Mengetahui aktivitas inhibisi hasil fraksi-fraksi kolom kromatografi
dari ekstrak metanol kulit buah manggis (Garcinia mangostana L.) terhadap
enzim RNA helikase virus hepatitis C.
1.4 Manfaat Penelitian
Hasil penelitian ini diharapkan memiliki kontribusi dan manfaat
sebagai dasar upaya pemanfaatan bahan alam dalam pengobatan penyakit
4
UIN Syarif Hidayatullah Jakarta BAB 2
TINJAUAN PUSTAKA 2.1 Manggis (Garcinia mangostana L.)
2.1.1 Klasifikasi Tanaman Kingdom : Plantae
Subkingdom : Tracheobionta
Superdivision : Spermatophyta
Division : Magnoliophyta
Class : Magnoliopsida
Subclass : Dilleniidae
Order : Theales
Family : Clusiaceae
Genus : Garcinia L
Species : Garcinia mangostana L.
(United State Departement of Agriculture, 2012)
Gambar 2.1 Buah Manggis (Garcinia mangostana L.)
Sumber : dokumen pribadi
2.1.2 Deskripsi Tanaman
UIN Syarif Hidayatullah Jakarta asam serta aroma yang menyenangkan. Tanaman ini terdistribusi di
Thailand, India, Srilanka, Myanmar, Indonesia, Malaysia, Philipina, dan
China (Yu et al, 2006). Tanaman ini berasal dari Indonesia. Dengan tinggi
pohon 7-8 m dengan dahan yang kuat dan besar, diketahui tumbuhan ini
ditanam di wilayah Asia tenggara dan kemudian di budidayakan di
daerah-daerah yang beriklim panas. Seringkali memerlukan iklim yang lembab
untuk pertumbuhannya. Daun-daunnya kasar. Pohonnya berwarna coklat
gelap, cukup keras dan padat. Warna kulit pohon bagian dalam
kekuning-kuningan. Tangkai daunnya pendek dan tebal. Diameter bunganya 5 cm,
dipisahkan menjadi 4 bagian. Bijinya lebar, gepeng dan melekat pada
buahnya yang putih dan kemerah-merahan (Anthony, 2002).
Batang manggis ini berkulit cokelat dan bergetah. Tanaman ini
berumah dua, bunga jantan dan betinanya dihasilkan oleh tanaman yang
berbeda. Akan tetapi, bunga jantannya tidak berfungsi sebab mengalami
rudimenter, yaitu mengecil dan mengering. Oleh karena itu, buah manggis
selalu dihasilkan dari bunga betina yang berwarna merah muda secara
apomiksis (tanpa proses penyerbukan). Bentuk daunnya merupakan daun
tunggal, duduk daun berhadapan atau bersilang berhadapan. Warnanya
mengkilat dipermukaan, permukaan atas hijau gelap permukaan bawah hijau
terang. Bentuk elips memanjang, 12-23 x 4,5-10 cm, tangkai 1,5-2 cm.
Bunga betina 1-3 di ujung batang, susunan menggarpu, garis tengah 5-6 cm.
Kelopak daun, dua daun kelopak yang terluar hijau kuning, dua yang
terdalam lebih kecil, bertepi merah, melengkung kuat, tumpul. Mahkota
terdiri dari 4 daun mahkota, bentuk telur terbalik, berdaging tebal, hijau
kuning, tepi merah atau hampir semua merah. Benang sari mandul biasanya
dalam kelompok (Astika, 2013).
2.1.3 Kandungan Senyawa
Telah dilaporkan bahwa kulit dari Garcinia mangostana L.
merupakan sumber dari senyawa mangostin, tannin, xanthon, isoflavon,
flavon, dan substansi bioaktif lainnya (Yu et al, 2006). Xanthon yang telah
UIN Syarif Hidayatullah Jakarta
α-, β-, dan ᵧ- mangostin, garcinon E, 8-deoxygartanin dan gartanin adalah yang paling banyak diteliti (Chaverri et al, 2008). Secara fitokimia
pericarpium buah manggis kaya akan berbagai macam xanthon yang
teroksigenasi dan terprenilasi termasuk α- dan ᵧ- mangostin, jenis xanthon
ini menunjukkan sifat-sifat biologis yang unik seperti antimikroba,
antifungi, antioksidan, antiinflamasi dan aktivitas sitotoksik (Watanapokasin
et al, 2009).
2.1.4 Khasiat Manggis (Garcinia mangostana L.)
Masyarakat di berbagai negara sering menggunakan manggis sebagai
pengobatan tradisional termasuk pengobatan nyeri perut, disentri, diare, luka
bernanah, infeksi luka, keputihan, bisul kronis dan gonorhoea (Yu et al,
2006). Buah manggis (Garcinia mangostana L.) yang merupakan famili
Clusiaceae telah digunakan di Asia Tenggara sebagai obat untuk infeksi
kulit, diare, bisul kronis, dan luka. Xanthon yang memiliki aktivitas seperti
antimikroba, antifungi, antioksidan, antiinflamasi, dan aktivitas sitotoksik
(Watanapokasin et al, 2009).
Akhir-akhir ini, beberapa produk yang diproduksi dari Garcinia
mangostana L. mulai digunakan sebagai suplemen diet alami di Amerika
Serikat, karena memiliki potensi sebagai antioksidan. Metabolit sekunder
utama dari manggis yang telah ditemukan adalah derivat xanthon yang
terprenilasi; beberapa golongan senyawa ini telah diisolasi dari tanaman dan
menunjukkan aktivitas antifungi, antimikroba, antioksidan, dan aktivitas
sitotoksik (Jung et al, 2006).
Dari beberapa spesies Garcinia dilaporkan memiliki aktivitas sebagai
inhibitor enzim protease HIV-1. Dan salah satunya adalah Garcinia
mangostana L. yang memiliki senyawa mangostin sebagai senyawa yang
signifikan menghambat enzim protease HIV-1 (Magadula et al, 2009).
Beberapa penelitian telah melakukan uji aktivitas anti kanker terhadap
xanthone yang diisolasi dari pericarpium buah manggis. Kemudian adanya
fakta tentang aktivitas antialergi dan antiinflamasi dari Garcinia
UIN Syarif Hidayatullah Jakarta ekstrak yang diperoleh dari Garcinia mangostana L. memiliki aktivitas
sebagai antibakteri, antifungi, antivirus serta antimalaria (Chaverri et al,
2006).
2.2 Ekstraksi
Ekstraksi adalah kegiatan penarikan kandungan kimia yang dapat larut
sehingga terpisah dari bahan yang tidak dapat larut dengan pelarut cair.
Simplisia yang diekstrak mengandung senyawa aktif yang dapat larut dan
senyawa yang tidak dapat larut seperti serat, karbohidrat, protein dan
lain-lain. Senyawa aktif yang terdapat dalam berbagai simplisia dapat
digolongkan kedalam golongan minyak atsiri, alkaloid, flavonoid dan
lain-lain (Depkes, 2000).
Ekstraksi adalah pemisahan beberapa bagian dari senyawa aktif yang
berasal dari jaringan tumbuhan (dan hewan) dengan menggunakan pelarut
selektif berdasarkan prosedur standar. Produk-produk yang dihasilkan dari
tanaman meliputi senyawa metabolit kompleks, baik berupa cairan,
semisolid atau dalam bentuk serbuk kering yang dapat digunakan untuk
pemakaian oral maupun pemakaian luar (Tiwari et al, 2011).
2.3 Virus Hepatitis C
Virus hepatitis C adalah virus RNA yang memiliki untai nonsitopatik
positif dan menyebabkan hepatitis akut dan kronis serta karsinoma
hepatoseluler (Zhong et al, 2005). Virus hepatitis C termasuk anggota dalam
genus hepacivirus dan famili flaviviridae yang merupakan penyebab
penyakit hepatitis pada manusia di seluruh dunia (Baginski et al, 2000).
Virus famili flaviviridae ini memiliki ukuran kecil, berselubung (envelope),
partikel speris berdiameter 40-50 nm dengan untai tunggal, dan genom RNA
sense positif (Borowski et al 2008). Partikel virus hepatitis C terdiri atas inti
berupa RNA yang merupakan material genetik, kulit yang mengelilingi
material genetik yang terbentuk dari protein berbentuk ikosahedral, dan
terbungkus dalam selubung (envelope) asam lemak (Gambar 2.2 ). Dua
UIN Syarif Hidayatullah Jakarta selubung lipid (Op de Beeck & Dubuisson, 2003). Target alami dari virus
hepatitis C adalah hepatosit dan limfosit B (Lauer & Walker, 2001). Virus
hepatitis C memiliki 3 reseptor yang telah diidentifikasi yaitu CD81
(Cormier et al, 2004), human scavenger class B1 (SR-BI) (Mailard et al,
2006), dan claudin-1 (Evans et al, 2001).
Replikasi virus bersifat kuat dan dapat diperkirakan lebih dari sepuluh
milyar partikel virion diproduksi perhari bahkan pada fase kronis dari
infeksi. Virus hepatitis C mengkode poliprotein tunggal yang terdiri atas
3011 asam amino dan memproses menjadi 10 protein struktural dan
regulator. Komponen struktural terdiri atas inti dan dua selubung protein.
Selain inti dari virus terdapat juga dua daerah dari protein envelope E2
didesain sebagai daerah hipervariabel 1 dan 2 yang memiliki laju yang
tinggi terhadap mutasi dan dipercaya sebagai hasil dari tekanan selektif oleh
antibodi spesifik terhadap virus (Lauer & Walker, 2001).
Virus hepatitis C juga mengkode gen helikase spesifik virus, protease,
dan polimerase. Protein-protein ini memiliki fungsi penting dalam siklus
hidup virus. Protein-protein ini dijadikan target yang menarik untuk terapi
antivirus.
Gambar 2.2 Virus Hepatitis C
UIN Syarif Hidayatullah Jakarta 2.4 RNA Helikase Virus Hepatitis C
Enzim helikase adalah enzim yang terlibat dalam hampir semua aspek
metabolisme DNA dan RNA. meskipun terdapat kemajuan terhadap
pengetahuan mekanisme aksi dari enzim-enzim ini, resolusi yang terbatas
menyebabkan mekanisme rinci seperti penataan ulang struktur asam nukleat
hingga pengikatan dan hidrolisis ATP yang dilakukan pasangan enzim
helikase ini tidak dapat diketahui (Dumont et al, 2006). Fungsi dasar enzim
helikase untuk membuka untai ganda DNA atau RNA melalui coupling
hidrolisis ATP dengan translokasi sepanjang satu untai DNA atau RNA
(Fan et al, 2008).
Seluruh helikase virus memiliki aktivitas NTP/ATPase. Aktivitas ini
tergantung pada adanya ATP dan kation divalen berupa Mg2+. Produk dari
hidrolisis NTP pada setiap pengkajian helikase adalah ADP dan Pi.
Aktivitas ATP dari helikase secara umum distimulasikan oleh keberadaan
asam nukleat untai tunggal. Hal ini memungkinkan enzim berikatan dengan
untai RNA dengan energi yang didapat dari hidrolisis ATP untuk
memisahkan ikatan hidrogen pasangan basa dari struktur dupleks (Kim et al,
1998).
Enzim helikase diperlukan untuk proses replikasi genom organisme
tersebut. Enzim helikase dapat dibagi menjadi DNA helikase dan RNA
helikase, sesuai dengan genom yang dimiliki organisme tersebut. HCV yang
merupakan virus RNA memiliki RNA helikase. Helikase bekerja secara
katalitik memisahkan untai ganda DNA atau RNA menggunakan energi
yang dihasilkan dari hidrolisis nukleosida trifosfat dan merupakan target
pencarian obat karena dibutuhkan dalam replikasi virus. (Utama et al,
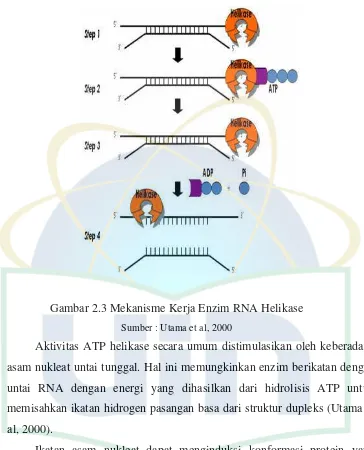
UIN Syarif Hidayatullah Jakarta Gambar 2.3 Mekanisme Kerja Enzim RNA Helikase
Sumber : Utama et al, 2000
Aktivitas ATP helikase secara umum distimulasikan oleh keberadaan
asam nukleat untai tunggal. Hal ini memungkinkan enzim berikatan dengan
untai RNA dengan energi yang dihasilkan dari hidrolisis ATP untuk
memisahkan ikatan hidrogen pasangan basa dari struktur dupleks (Utama et
al, 2000).
Ikatan asam nukleat dapat menginduksi konformasi protein yang
terkarakterisasi dengan pengembangan situs aktif dari domain ATPase dari
ATP. Aktivitas ATPase tidak dapat distimulasi pada kadar garam tinggi. Hal
ini disebabkan kondisi kekuatan ionik kuat asam nukleat tidak dapat terikat
dengan enzim dan enzim membentuk konformasi untuk pelepasan untaian.
Mekanisme kerja enzim RNA atau DNA helikase adalah pertama-tama
helikase akan mengikat untai RNA atau DNA untai ganda pada ujung 3’,
selanjutnya ATP akan berikatan pada suatu sisi aktif dari RNA atau DNA
helikase tersebut. Gugus ATP akan dihidrolisis oleh enzim RNA atau DNA
helikase menjadi ADP dan fosfat inorganik. Proses hidrolisis ini akan
UIN Syarif Hidayatullah Jakarta helikase untuk menguraikan untai ganda RNA atau DNA menjadi untai
tunggal RNA atau DNA (Utama et al, 2000).
Enzim helikase dapat menguraikan RNA atau DNA untai ganda
melalui pemutusan ikatan hidrogen yang mengikat kedua untai tersebut.
Reaksi ini berhubungan dengan hidrolisis ATP, di mana energi yang
dilepaskan selama hidrolisis ATP dibutuhkan dalam proses penguraian
RNA atau DNA (Shuman, 1992; Wagner et al, 1998).
Enzim helikase juga dapat berperan dalam fungsi selular lainnya
seperti membantu proses translasi, mengkoordinasi pembentukan
poliprotein, memutus interaksi RNA-protein, serta menyusun RNA di dalam
pembungkus viral (Lam & Frick, 2006). Enzim helikase juga memiliki
aktivitas ikatan RNA (RNA binding) dan ATPase (RNA-stimulated ATPase),
dan kedua aktivitas ini berpengaruh terhadap aktivitas RNA helikase. Enzim
ini menjadi target yang potensial untuk penemuan obat antivirus karena
penemuan inhibitor RNA helikase dapat dilakukan dengan penemuan
inhibitor terhadap aktivitas RNA binding atau ATPase (Utama et al, 2000).
Beberapa penelitian tentang mutasi dan penghambatan terhadap NS3
diperlukan untuk propagasi virus sehingga pengembangan inhibitor efektif
dari enzim helikase virus hepatitis C adalah bagian penting dalam strategi
antiviral. Pengembangan riset mengenai agen yang berperan sebagai
inhibitor RNA helikase terus ditegakkan, dalam rangka menemukan
kandidat obat untuk menangani infeksi virus hepatitis C. Berikut adalah
tabel riset beberapa agen yang berpotensi sebagai inhibitor RNA helikase
virus hepatitis C.
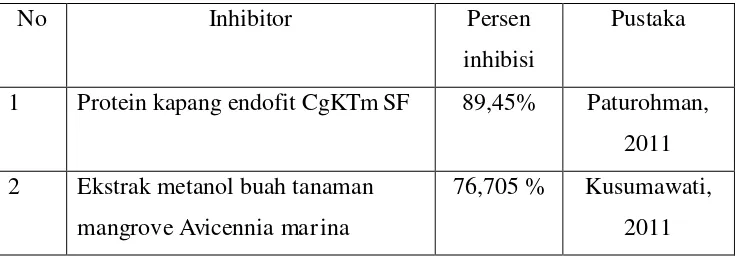
Tabel 2.1. Inhibitor RNA helikase HCV
No Inhibitor Persen
inhibisi
Pustaka
1 Protein kapang endofit CgKTm SF 89,45% Paturohman,
2011
2 Ekstrak metanol buah tanaman
mangrove Avicennia marina
76,705 % Kusumawati,
UIN Syarif Hidayatullah Jakarta (Forsk) Vierb.
3 Mikroalga BTM 11 81,205 % Putri, 2011a
4 Bakteriosin asam laktat S34 64,20 % Putri, 2011b.
5 Ekstrak rimpang temulawak
(Curcuma zanthorrhiza Roxb.)
Sodium Dodecyl Sulphate (SDS) poliakrilamid gel elektroforesis
(PAGE) adalah metode pemisahan protein dalam sampel untuk dianalisa
dan ditentukan berat molekulnya. Protein-protein akan terdenaturasi dan
melepas monomernya karena pemanasan yang ditunjukkan dengan adanya
agen-agen pereduksi (2-merkaptoetanol atau ditiotheitol) dan surfaktan
bermuatan negatif (Sharma, 2009).
Elektroforesis gel Sodium Dodesil Silfat (SDS) poliakrilamid adalah
teknik yang sering digunakan dalam bidang biokimia, forensik, genetika,
dan biologi molekuler untuk memisahkan protein sesuai dengan mobilitas
elektroforesis (fungsi dari panjang rantai polipeptida atau molekul). Sampel
elektroforesis gel SDS dan sampel elektroforesis tersebut di pisahkan
berdasarkan ukuran berat molekul (Gam & Latiff, 2005).
Medan listrik yang digunakan menyebabkan protein bermuatan
negatif bermigrasi menuju anoda. Setiap protein akan bergerak melalui
matriks gel. Protein yang berbobot molekul kecil akan lebih mudah melalui
pori-pori pada gel, sedangkan protein yang berbobot molekul lebih besar
akan memiliki lebih banyak kesulitan untuk melewati pori-pori tersebut.
Setelah waktu yang telah ditentukan protein akan bermigrasi berdasarkan
UIN Syarif Hidayatullah Jakarta sedangkan yang lebih besar akan tetap lebih dekat ke titik asal. Protein dapat
dipisahkan berdasarkan ukuran atau bobot molekul (Gam & Latiff, 2005).
Pewarna yang digunakan dalam teknik ini terdiri atas dua macam
yaitu Coomassie Brilliant Blue dan pewarna perak. Pewarna Coomassie
Brilliant Blue biasanya dapat mendeteksi sebuah band 50 ng protein.
Pewarnaan perak dapat meningkatkan sensitivitas pewarnaan biasanya 50
kali. Banyak variabel yang dapat mempengaruhi intensitas warna. Setiap
protein memiliki karakteristik pewarnaan sendiri (Jovanovic et al, 2007).
2.6 Kolorimetri ATPase
Uji kolorimetrik digunakan untuk menganalisis bahan yang umumnya
tidak berwarna, misalnya untuk mengukur konsentrasi protein dalam suatu
sampel yang tidak menyerap cahaya. Adapun pereaksi yang digunakan
adalah pereaksi yang bewarna seperti malakit hijau dan amonium molibdat.
Uji ATPase dilakukan dengan mengukur konsentrasi fosfat yang terurai dari
ATP menjadi ADP dan P, yang dihasilkan dari reaksi enzim ATPase.
Prinsip uji kolorimetrik adalah perubahan warna yang terjadi dari suatu zat
yang tidak bewarna dengan suatu pereaksi warna ( Utama et al, 2000).
2.7 Prinsip Kromatografi (Yazid, 2005)
Kromatografi adalah cara pemisahan campuran yang didasarkan atas
perbedaan distribusi dari komponen campuran tersebut diantara dua fase,
yaitu fase diam (stationary) dan fase gerak (mobile). Fase diam dapat
berupa zat padat atau zat cair, sedangkan fase gerak dapat berupa zat cair
atau gas.
Dalam teknik kromatografi, sampel yang merupakan campuran dari
berbagai macam komponen ditempatkan dalam situasi dinamis dalam sistem
yang terdiri dari fase diam dan fase gerak. Semua pemisahan pada
kromatografi tergantung pada gerakan relatif dari masing-masing komponen
diantara kedua fase tersebut. Senyawa atau komponen yang tertahan
UIN Syarif Hidayatullah Jakarta komponen yang tertahan lebih kuat. Perbedaan gerakan (mobilitas) antara
komponen yang satu dengan lainnya disebabkan oleh perbedaan dalam
adsorpsi, partisi, kelarutan atau penguapan diantara kedua fase.
Jika perbedaan-perbedaan ini cukup besar, maka akan terjadi
pemisahan secara sempurna. Oleh karena itu dalam kromatografi, pemilihan
terhadap fase gerak maupun fase diam perlu dilakukan sedemikian rupa
sehingga semua komponen bisa bergerak dengan kecepatan yang
berbeda-beda agar dapat terjadi proses pemisahan.
2.8 Kolom Kromatografi (Gritter et al, 1991)
Kolom kromatografi merupakan cara yang paling lama dari
kromatografi yang ada. Fase diam, baik bahan penjerap atau film zat cair
pada penyangga, ditempatkan didalam tabung kaca berbentuk silinder, pada
bagian bawah tertutup dengan katup atau keran, dan fase gerak dibiarkan
mengalir ke bawah melaluinya karena gaya berat.
Pada kromatografi kolom, campuran yang akan dipisahkan diletakkan
berupa pita pada bagian atas kolom penjerap yang berada dalam tabung
kaca, tabung logam, atau bahkan tabung plastik. Pelarut (fase gerak)
dibiarkan mengalir melalui kolom karena aliran yang disebabkan oleh gaya
berat atau didorong dengan tekanan. Pita senyawa linarut bergerak melalui
kolom dengan laju yang berbeda, memisah dan dikumpulkan berupa fraksi
yang keluar dari atas kolom.
Kolom kromatografi atau tabung untuk pengaliran biasanya terbuat
dari kaca yang dilengkapi keran jenis tertentu pada bagian bawahnya untuk
15
UIN Syarif Hidayatullah Jakarta BAB 3
METODE PENELITIAN 3.1 Waktu dan Tempat Penelitian
Penelitian ini dilakukan pada bulan Maret 2013 sampai bulan Agustus
2013. Pembuatan ekstrak kulit buah manggis (Garcinia mangostana L.)
dilakukan di laboratorium Farmakognosi dan Fitokimia, dan laboratorium
Kimia Obat FKIK Jurusan Farmasi UIN Syarif Hidayatullah Jakarta. Uji
aktivitas inhibisi enzim RNA helikase virus HCV dilakukan di
Laboratorium Bakteriologi dan Virologi Pusat Penelitian Bioteknologi LIPI
Cibinong, Bogor.
3.2 Alat dan Bahan
Alat-alat yang digunakan untuk ekstraksi kulit buah manggis
(Garcinia mangostana L.) adalah pisau, kertas polos, maserator, batang
pengaduk, gelas ukur (Duran), kertas saring, kapas, lumpang alu, tabung
reaksi, corong buchner, cawan penguap, timbangan analitik, alat penggiling
simplisia, dan rotary evaporator (Eyela).
Alat-alat yang digunakan untuk ekspresi, pemurnian dan pengujian
aktivitas RNA helikase HCV adalah inkubator goyang (N-Biotek), vortex,
tabung sentrifus 50 ml dengan penutup (Falcon), tabung sentrifus 1,5 ml
(Eppendorf), erlenmeyer (Pyrex), 96-well microtiter plate (Polycarp), pipet
mikro (Gilson), neraca analitik (Acis), peralatan gelas, microplate reader
(Multiscan EX Thermo), vial, Laminar Air Flow (ESCO), lemari pendingin
(Sansio), sonikator (Labsonic), autoklaf tipe vertikal (mode TA-630),
sentrifus (HERMLE), hot plate magnetic stirer (Cimarec), SDS-PAGE
(ATTO).
Alat-alat yang digunakan untuk pemisahan tahap awal senyawa
inhibitor RNA helikase HCV adalah kolom kromatografi, erlenmeyer,
beaker gelas, lempeng KLT, chamber, vial, lampu UV.
Sampel yang digunakan adalah kulit buah manggis. Buah manggis
diperoleh dari daerah Kampung Cengal, Desa Karacak, Kec. Leuwiliang,
Kab. Bogor dan telah dideterminasi di Herbarium Bogoriense Litbang LIPI
UIN Syarif Hidayatullah Jakarta Bahan-bahan yang digunakan untuk ekstraksi dan skrinning fitokimia
kulit buah manggis (Garcinia mangostana L.) adalah pelarut metanol
absolut 96%, aquadest, NaOH, dragendroff’s, mayer’s, asam hidroklorit,
ferri klorida, asam sulfat, dan kloroform.
Bahan-bahan yang digunakan untuk ekspresi, pemurnian, dan
pengujian inhibisi RNA helikase HCV adalah bakteri Escerichia coli BL21
(DE3) pLysS yang membawa gen NS3 RNA helikase HCV dalam plasmid
21b (koleksi Andi Utama, Puslit Bioteknologi LIPI), media Luria Bertani
(LB), aquades, ampisilin, IPTG (isopropil β-D-thiogalaktopiranoside), dapar
B (10 mM Tris HCl pH 8.5, 100 mM NaCl, dan 0,25% Tween 20), resin
Talon, dan dapar elusi (400 mM imidazole dalam buffer B), 0.1 mM ATP
(Adenosin trifosfat), 0.1 mM MOPS (asam 4-morfolinopropana sulfonat), 1
mM MgCl2, larutan hijau malakit, 2.3 % polivinil alkohol, amonium
molibdat, natrium sitrat, sukrosa, TEMED, akrilamid, amonium persulfat,
coomassie brilliant blue, dan marker protein 250 kDa untuk analisis bobot
molekul RNA helikase.
Bahan-bahan yang digunakan untuk pemisahan tahap awal senyawa
inhibitor RNA helikase HCV adalah ekstrak kental kulit buah manggis
(Garcinia mangostana L.), silika gel, kloroform, methanol, kapas,
alumunium foil, dan kertas saring.
3.3 Metode Penelitian 3.3.1 Pengambilan Sampel
Sampel buah manggis sebanyak 5 kg diperoleh dari kampung cengal,
desa karacak, kecamatan Leuwiliang, kabupaten Bogor padabulan Februari.
Bagian yang digunakan dalam penelitian ini adalah kulit buah (pericarp)
manggis.
3.3.2 Determinasi Sampel
Determinasi buah manggis (Garcinia mangostana L.) dilakukan di
Herbarium Bogoriense Bidang Botani, Pusat Penelitian Biologi, LIPI
UIN Syarif Hidayatullah Jakarta 3.3.3 Persiapan Simplisia
Kulit buah manggis sebanyak 2,5 kg yang telah dipisahkan dari
daging buahnya dibersihkan dari kotoran dengan menggunakan air mengalir
(sortasi basah), kemudian dirajang dengan menggunakan pisau menjadi
ukuran yang lebih kecil ± 3 cm. Rajangan kulit buah manggis ini kemudian
dikeringkan dengan cara diangin-anginkan (pemanasan tidak langsung).
Kulit buah manggis kering kemudian digiling dengan menggunakan alat
penggiling dan diayak dengan ayakan 40 mesh sehingga didapat serbuk
kulit buah manggis kering sebanyak 800 g.
3.3.4 Pembuatan Ekstrak Kulit Buah Manggis (Garcinia mangostana L.) Serbuk simplisia ditimbang sebanyak 300 g dimasukkan kedalam
maserator kemudian dimaserasi dengan menggunakan pelarut metanol 96%
sebanyak 900 ml. Proses maserasi didiamkan selama 24 jam, sambil
sesekali dilakukan pengadukan. Setelah 24 jam maserat ditampung didalam
erlenmeyer dengan cara disaring menggunakan corong buchner dan kertas
saring. Kemudian ampas dimasukkan ke dalam maserator, untuk dimaserasi
kembali. Proses maserasi ini dilakukan selama 3 x 24 jam. Seluruh hasil
penampungan pelarut dicampur untuk kemudian dilakukan proses
pemekatan ekstrak dengan menggunakan rotary evaporator suhu 45⁰C. Dan
selanjutnya diperoleh ekstrak kental kulit buah manggis (Garcinia
mangostana L.) sebanyak 70,2984 g.
3.3.5 Rendemen Total Ekstrak Metanol Kulit Buah Manggis (Garcinia mangostana L.)
Rendemen ektrak kulit buah manggis total dihitung dengan
membandingkan berat awal serbuk simplisia dengan berat akhir ekstrak
kulit buah manggis total yang diperoleh.
UIN Syarif Hidayatullah Jakarta 3.3.6 Penapisan Fitokimia
Penapisan fitokimia ini dilakukan untuk melihat kandungan golongan
senyawa yang terdapat didalam ekstrak kulit buah manggis (Garcinia
mangostana L.).
a. Alkaloid
Ekstrak dilarutkan dalam pelarut asam hidroklorit dan kemudian
disaring. Dilakukan uji pada beberapa pereaksi.
1. Test Mayer’s: filtrat ditambahkan dengan pereaksi Mayer’s
(kalium merkuri iodida). Maka akan terbentuk endapan berwarna
kuning yang menunjukkan adanya senyawa alkaloid.
2. Test Dragendroff’s: filtrat ditambahkan pereaksi dragendroff’s
(larutan potassium iodida). Maka akan membentuk endapan merah
yang menunjukkan adanya senyawa alkaloid (Tiwari, P et al,
2011).
b. Saponin
Test busa: 0,5 mg ekstrak dikocok dalam 2 ml aquades. Jika terbentuk
busa yang cukup lama ± 10 menit menunjukkan adanya senyawa
saponin (Tiwari, P et al, 2011).
c. Fenol
Test ferric chlorida: ekstrak ditambahkan 3-4 tetes larutan ferri
klorida. Terbentuk warna hitam kebiru-biruan menunjukkan adanya
senyawa fenol (Tiwari, P et al, 2011).
d. Tannin
Ekstrak sebanyak 0,5 gram dididihkan dalam 10 ml aquadest dalam
tabung reaksi, lalu disaring. Kemudian kedalam filtrat ditambahkan
beberapa tetes ferri klorida 0,1 %. Terbentuk warna hijau kecoklatan
atau biru kehitaman menunjukkan keberadaan tannin (Ayoola, G.A. et
al., 2008).
e. Flavonoid
Larutan ammonia sebanyak 5 ml ditambahkan kedalam filtrat air dari
ekstrak, lalu ditambahkan 1 ml asam sulfat. Terbentuk warna kuning
UIN Syarif Hidayatullah Jakarta f. Terpenoid (Uji Salkowski)
Sebanyak 0,5 gram ekstrak ditambahkan 2 ml kloroform, kemudian
ditambahkan 3 ml asam sulfat (H2SO4) untuk membentuk lapisan.
Adanya warna merah kecoklatan diantara lapisan menunjukkan
adanya senyawa terpenoid (Ayoola, G.A. et al, 2008).
3.3.7 Parameter dan Metode Uji Ekstrak 3.3.7.1Parameter Non Spesifik
a. Susut Pengeringan
Ekstrak ditimbang sebanyak 1,673 g dan dimasukkan kedalam botol
timbang dangkal bertutup yang sebelumnya telah dipanaskan pada suhu
105⁰C selama 30 menit dan ditara. Sebelum ditimbang ekstrak diratakan
dalam botol timbang, dengan cara menggoyangkan botol, hingga
membentuk lapisan setebal lebih kurang 5 mm sampai 10 mm. Jika berupa
ekstrak kental diratakan dengan batang pengaduk. Kemudian dimasukkan
kedalam ruang pengering, buka tutupnya, keringkan pada suhu 105⁰C
hingga bobot tetap. Sebelum setiap pengeringan, biarkan botol dalam
keadaan tertutup mendingin dalam eksikator hingga suhu kamar (Depkes,
2000).
b. Kadar Abu
Untuk penentuan kadar abu, ekstrak sebanyak 1,008 g dipanaskan
pada temperatur 625⁰C di mana senyawa organik dan turunannya
terdestruksi dan menguap sehingga hanya tersisa unsur mineral dan
anorganik. Tujuannya adalah untuk memberikan gambaran tentang
kandungan mineral internal dan eksternal yang berasal dari proses awal
sampai terbentuknya ekstrak. Nilai untuk kadar abu sesuai dengan yang
tertera dalam monografi (Depkes RI, 2000).
3.3.7.2Parameter Spesifik a. Parameter Identitas Ekstrak
Memberikan identitas obyektif dari nama dan spesifik dari senyawa
UIN Syarif Hidayatullah Jakarta I.Deskripsi tata nama :
1. Nama Ekstrak (generik, dagang, paten)
2. Nama lain tumbuhan (sistematika botani)
3. Bagian tumbuhan yang digunakan
4. Nama indonesia tumbuhan
II.Ekstrak dapat mempunyai senyawa identitas, artinya senyawa tertentu
yang menjadi petunjuk spesifik dengan metode tertentu (Depkes, 2000).
b. Parameter Organoleptik Ekstrak
1. Bentuk : padat, serbuk-kering, kental, cair.
2. Warna : kuning, coklat, dll.
3. Bau : aromatik, tidak berbau, dll.
4. Rasa : pahit, manis, kelat, dll.
3.3.8 Produksi Enzim RNA Helikase Virus Hepatitis C (Utama et al, 2000) Produksi enzim RNA helikase virus hepatitis C dilakukan berdasarkan
metode Utama et al, (2000). Sebelum melakukan ekspresi dilakukan
pembuatan media LB (Luria Bertani) cair untuk Escherichia coli BL21
(DE3)pLysS. Media LB dibuat sebanyak 10 ml untuk prekultur dan 400 ml
untuk kultur. Pembuatan media LB 410 ml dengan cara mencampurkan
tryptone 4.1 g, NaCl 4.1 g, yeast ekstrak 2.05 g dalam 410 ml aquades.
Kemudian disterilisasi menggunakan autoklaf pada suhu 121⁰C selama 15
menit.
Langkah pertama ekspresi dan purifikasi RNA helikase virus hepatitis
C adalah prekultur, media LB 10 ml diberi ampisilin 10 µl/ml dan
dimasukkan bakteri E.coli BL21 (DE3) pLysS yang membawa gen RNA
helikase dihomogenkan dan diinkubasi dengan inkubasi goyang suhu 37⁰C
dengan kecepatan 150 rpm dibiarkan selama satu malam.
Langkah kedua adalah kultur, hasil prekultur diinolukasikan kedalam
media LB 400 ml yang telah diberi ampisilin 410 µl Dan diinkubasi dengan
inkubator goyang suhu 37⁰C, 150 rpm selama satu jam. Kemudian
UIN Syarif Hidayatullah Jakarta Dan diinkubasi kembali dengan inkubator goyang selama 3 jam pada suhu
37⁰C 150 rpm.
Selanjutnya hasil kultur dipindahkan dalam tube 50 ml vortex terlebih
dahulu kemudian di sentrifus dengan kecepatan 3500 rpm selama 10 menit.
Endapan dicuci dengan media LB dan disentrifus kembali dengan kecepatan
5000 rpm selama 10 menit. Supernatan dibuang dan diperoleh pelet simpan
pada suhu -20⁰C selama satu malam.
Proses selanjutnya adalah purifikasi, pelet yang diperoleh dilakukan
freeze thawing atau pengeringbekuan sebanyak tiga kali. Setelah itu
dilakukan sonikasi (pemecahan sel dengan menggunakan sonikator)
amplitudo 40 cycle 0,5 selama 15 detik, dilakukan tiga kali dengan interval
1 menit. Selanjutnya disentrifus dengan kecepatan 7000 rpm selama 20
menit. Supernatan dipindahkan dalam tube 50 ml dan pelet disimpan pada
suhu -20⁰C. Sedangkan supernatan ditambahkan resin TALON 200 µl
kemudian diletakkan pada rotary cold room selama 3 jam. Supernatan
disentrifus selama 7 menit kecepatan 3500 rpm.
Supernatan dibuang, pelet ditambahkan 10 ml dapar B diaduk secara
perlahan dan disentrifus kembali selama 5 menit dengan kecepatan 3500
rpm. Supernatan dibuang kembali, pelet ditambahkan 10 ml dapar B dan
disentrifus kembali selama 3 menit dengan kecepatan 3500 rpm. Supernatan
dibuang kembali, pelet diaduk perlahan dipindahkan dalam tube 1,5 ml,
kemudian ditambahkan 100 µl dapar elusi dan diletakkan pada rotary cold
room selama satu malam. Kemudian disentrifus kembali selama 1 menit,
3500 rpm. Endapan dicuci dengan 100 µl larutan dapar elusi dan diletakkan
pada rotary cold room selama satu jam. Kemudian disentrifus kembali
selama 1 menit, 3500 rpm. Setelah itu larutan (enzim) dan resin dipisahkan
dan disimpan pada suhu 4⁰C.
3.3.9 Uji Kemurnian Enzim RNA Helikase HCV dengan SDS-PAGE
Semua alat disiapkan, plat kaca yang digunakan terdiri atas short plate
dan spacer plate dibersihkan terlebih dahulu dengan alkohol 70%. Short
plate ditempatkan pada bagian depan kaca spacer yang sebelumnya diberi
UIN Syarif Hidayatullah Jakarta casting stand. Selanjutnya dibuat larutan separating gel 8% (lampiran 8a).
Larutan tersebut dimasukkan diantara celah short plate dan spacer plate
sampai terisi dua pertiga bagian, kemudian sepertiganya diisi dengan
aquades hingga penuh. Ditunggu hingga terbentuk gel selama ± 30 menit.
Setelah terbentuk gel dibuat larutan gel stacking 8% (lampiran 8b).
Aquades pada separating dibuang dan dimasukkan larutan stacking pada
sepertiga bagian celah. Dan dipasangkan comb, tunggu hingga terbentuk gel
selama ± 30 menit. Gel dipindahkan dari casting frame, gel cassette
sandwich ditempatkan pada electrode assembly dengan posisi short plate
menghadap kedalam, lalu ditempatkan ke dalam clamping frame, dan
ditutup kedua camp levers pada clamping frame. Lower inner chamber
dimasukkan ke dalam tank elektroforesis lalu diisi dengan larutan dapar
elektroforesis SDS 1x pH 8,3.
Sampel yang diperoleh pada produksi RNA helikase HCV ditampung
dalam tube 1,5 ml meliputi pelet, supernatan, inner volum, washing, elusi
enzim dan resin. Masing-masing sampel yang diambil 20 µl dan
ditambahkan 10 µl loading dye (lampiran 8c) kemudian dilakukan
denaturasi yaitu dipanaskan didalam waterbath pada suhu 90⁰C selama 15
menit.
Masing-masing sampel tersebut dimasukkan kedalam well sebanyak
15 µl. Marker protein (BIORAD®) sebanyak 4 µl/gel dimasukan ke dalam
well. Kemudian gel di elektroforesis pada 40 mA selama 90 menit.
Kemudian gel diangkat dan direndam dalam larutan staining comassie blue
G-250 (lampiran 8d) selama 1 jam sambil digoyang diatas rocker.
Kemudian gel dibilas dengan larutan Commassie Blue G-250 Destaining
(lampiran 8e) ± 30 menit, dan dibilas dengan aquades hingga bau asam
hilang, diletakkan didalam kertas mika kemudian di scan.
3.3.10 Uji Aktivitas Enzim RNA Helikase Virus Hepatitis C (Utama et al, 2000)
Uji aktivitas enzim helikase berdasarkan metode ATPase kolorimetri.
UIN Syarif Hidayatullah Jakarta Pengenceran yang dilakukan menggunakan MOPS 10 mM. Kemudian
pembuatan larutan master mix yang terdiri dari ddH2O, MOPS 0.1 M,
MgCl2 0.1 mM, dan ATP 0.1 mM. Selanjutnya dilakukan pengujian dengan
cara mengisi tiap microtiter plate 96-well dengan 5 µl pengenceran enzim
dan 45 µl master mix. Untuk blanko, diisi 5 µl aquades dan 45 µl master
mix. Semua pengujian dilakukan secara triplo.
Campuran reaksi tersebut diinkubasi selama 45 menit pada suhu
ruang. Setelah pada menit ke-35 dibuat larutan pewarna yang terdiri dari
0.081 % malakit hijau, H2O, 5.7 % amonium molibdat dalam HCl 6 M dan
2.3 % polivinil alkohol dengan perbandingan (2:2:1:1). Setelah masa
inkubasi selesai larutan pewarna dimasukkan dalam tiap well sebanyak 100
µl, dan kemudian dilakukan inkubasi selama 5 menit pada suhu ruang.
Setelah masa inkubasi selesai ditambahkan 25 µl Na sitrat untuk
menghentikan reaksi pewarnaan. Selanjutnya hasil reaksi diukur dengan
menggunakan microplate reader pada panjang gelombang 405 nm dan 620
nm.
3.3.11 Pemisahan Senyawa Inhibitor dengan Kolom Kromatografi
Pemisahan tahap awal ekstrak kental kulit buah manggis (Garcinia
mangostana L.) menggunakan kolom kromatografi dengan diameter 2,54
cm dan panjang kolom 65 cm. Kolom kromatografi yang telah dibersihkan,
disiapkan dengan memberi kapas pada ujung kolom untuk menahan silika
gel agar tidak keluar, dipasang tegak lurus pada statif. Selanjutnya silika gel
ditimbang sebanyak 100 g, dilarutkan dengan pelarut organik nonpolar
(kloroform) hingga diperoleh silika dengan konsentrasi seperti bubur,
diaduk hingga terbentuk suspensi.
Bubur silika dimasukkan kedalam kolom sambil diketuk-ketuk agar
silika memadat didalam kolom serta dialiri pelarut kloroform didalam
kolom, pelarut ditampung dan dimasukkan kembali. Dilakukan secara
berulang-ulang sehingga silika gel menjadi padat didalam kolom. Ekstrak
UIN Syarif Hidayatullah Jakarta sebanyak 4 ml. Selanjutnya dimasukkan secara hati-hati kedalam kolom
pada bagian atas dengan cara dialirkan melalui dinding kolom.
Pemisahan ekstrak metanol kulit buah manggis dengan menggunakan
pelarut gradien kloroform-metanol dengan perbandingan (9:1, 8:2, 7:3, 6:4,
5:5, 4:6, 3:7, 2:8, 1:9). Sebanyak 4 ml eluat ditampung didalam
masing-masing vial. Masing-masing-masing fraksi diuapkan dari eluennya untuk kemudian
diuji aktivitas inhibisi RNA helikase virus hepatitis C dengan menggunakan
uji ATPase kolorimetri (Mustopa et al, 2012).
3.3.12 Uji Aktivitas Inhibisi Ekstrak Kulit Buah Manggis terhadap RNA Helikase HCV (Utama et al, 2000)
Uji aktivitas inhibisi ekstrak kulit buah manggis (Garcinia
mangostana L.) terhadap enzim RNA Helikase virus HCV dilakukan
berdasarkan metode ATPase kolorimetri. Fraksi-fraksi yang diperoleh dari
hasil pemisahan dengan kolom kromatografi yang telah diuapkan, dibuat
dalam larutan stok ditimbang sebanyak 0,025 g dilarutkan dengan metanol
sebanyak 1 ml. Untuk uji aktivitas diambil sebanyak 5 µl dan dilarutkan
dengan larutan master mix sebanyak 45 µl sehingga konsentrasi sampel
yang diuji sebesar 2.500 ppm.
Pada pengukuran absorbansi enzim RNA Helikase dilakukan dengan
menambahkan 5 µl ekstrak kulit buah manggis hasil pemisahan pada setiap
well dan 45 µl campuran larutan master mix dan pengenceran enzim. Untuk
blanko dimasukkan 5 µl aquades dan 45 µl larutan master mix. Untuk
kontrol positif berupa campuran larutan master mix dan pengenceran enzim
50 µl, sedangkan kontrol negatif berupa campuran 5 µl metanol dan 45 µl
campuran master mix dan pengenceran enzim. Semua pengujian dilakukan
secara triplo.
Campuran reaksi tersebut diinkubasi selama 45 menit pada suhu
ruang. Setelah pada menit ke-35 dibuat larutan pewarna yang terdiri dari
0.081 % malakit hijau, H2O, 5.7 % amonium molibdat dalam HCl 6 M dan
2.3 % polivinil alkohol dengan perbandingan 2:2:1:1. Setelah masa inkubasi
UIN Syarif Hidayatullah Jakarta kemudian dilakukan inkubasi selama 5 menit pada suhu ruang. Setelah masa
inkubasi selesai ditambahkan 25 µl Na sitrat untuk menghentikan reaksi
pewarnaan. Selanjutnya hasil reaksi diukur absorbansinya menggunakan
microplate reader pada panjang gelombang 405 nm dan 620 nm.
Nilai absorbansi yang diperoleh digunakan untuk menghitung
persentase penghambatan ekstrak kulit buah manggis (Garcinia mangostana
L.) terhadap RNA Helikase HCV. Perhitungan persen penghambatan
sampel ekstrak kulit buah manggis terhadap RNA helikase berdasarkan
perhitungan :
% inhibisi =
Di mana :
A = serapan enzim RNA helikase tanpa adanya senyawa inhibitor.
I = serapan enzim RNA helikase dengan adanya senyawa inhibitor.
3.3.13 Visualisasi Hasil Fraksi Kolom Kromatografi dengan Menggunakan Kromatografi Lapis Tipis
Fraksi hasil pemisahan kolom kromatografi dilihat pola
kromatogramnya dengan menggunakan kromatografi lapis tipis fase diam
silika gel GF254. Eluen yang digunakan adalah kloroform 100 %
dimasukkan kedalam chamber, masing-masing fraksi dototolkan pada plat
silika kemudian di elusi pada eluennya. Hasil pemisahan dengan KLT
dilihat dbawah UV pada panjang gelombang 254 nm.
3.3.14 Perhitungan Aktivitas RNA Helikase Virus Hepatitis C
Fraksi dari hasil kolom kromatografi yang memberikan aktivitas
inhibisi terhadap RNA helikase virus hepatitis C selanjutnya dihitung
aktivitas RNA helikase dengan menentukan kadar fosfat yang dilepaskan.
Fosfat bebas yang dilepaskan berasal dari hasil reaksi antara enzim RNA
helikase dan ATP (Utama et al, 2000). Kadar fosfat yang dilepaskan
berbanding lurus dengan aktivitas enzim RNA helikase, namun berbanding
terbalik dengan aktivitas penghambatan senyawa inhibitor enzim RNA
UIN Syarif Hidayatullah Jakarta Perhitungan kadar fosfat dilakukan dengan menggunakan kurva
kalibrasi dari K2HPO4. Di mana K2HPO4 dibuat dalam larutan dengan
konsentrasi 0,1 mM, 0,2 mM, 0,4 mM, 0,6 mM, 0,8 mM dan 1 mM
(Lampiran 16). Hasil pembacaan absorbansi selisih panjang gelombang 620
nm dan 450 nm dengan menggunakan microplate reader, dimasukkan
27
karacak, kecamatan leuwiliang, kabupaten Bogor dideterminasi di
Herbarium Bogoriense Bidang Botani, Pusat Penelitian Biologi, LIPI
Cibinong. Hasil determinasi menyatakan bahwa sampel merupakan jenis
Garcinia mangostana L. suku Clusiaceae (Lampiran 1).
4.2 Rendemen Ekstrak
Metode ekstraksi yang dilakukan adalah dengan cara maserasi.
Maserasi adalah proses pengekstrakan simplisia dengan menggunakan
pelarut dengan beberapa kali pengocokan atau pengadukan pada temperatur
ruang (Depkes, 2000). Ekstraksi dengan cara maserasi ini biasanya
digunakan untuk senyawa-senyawa yang tidak tahan pemanasan (Tiwari, P
et al, 2011).
Maserasi yang dilakukan terhadap kulit buah manggis menggunakan
pelarut metanol 96%. Hal ini bertujuan untuk menarik senyawa-senyawa
polar yang terkandung dalam simplisia kulit buah manggis (Garcinia
mangostana L.). Merujuk dari penelitian sebelumnya yang telah dilakukan
oleh Syajarwati (2013) bahwa aktivitas inhibisi tertinggi terhadap enzim
RNA helikase HCV dari ekstrak kulit buah manggis pada ekstrak metanol
dengan aktivitas penghambatan tertinggi sebesar 71,57 %.
Dari hasil maserasi diperoleh rendemen ekstrak sebesar 23,4348%.
Nilai tersebut menyatakan bahwa ekstrak yang diperoleh cukup banyak, hal
ini disebabkan karena pelarut metanol adalah pelarut universal yang mampu
menarik banyak senyawa polar (Tiwari, 2011). Prinsip pelarutan yang
dipakai pada metode ini adalah like dissolve like, di mana senyawa yang
bersifat polar akan terlarut dalam pelarut polar dan senyawa yang bersifat
UIN Syarif Hidayatullah Jakarta 4.3 Penapisan Fitokimia
Penapisan fitokimia yang lakukan terhadap ekstrak kulit buah manggis
(Garcinia mangostana L.) bertujuan untuk mengetahui kandungan metabolit
sekunder yang terdapat didalam ekstrak kulit buah manggis pada pelarut
metanol. Pada kulit buah manggis kaya akan metabolit sekunder seperti
tannin, terpenoid, alkaloid dan flavonoid yang dilaporkan memiliki aktivitas
antibakteri (Geetha R.V et al, 2011). Skrining fitokimia pada simplisia kulit
buah manggis dan ekstrak etanol kulit buah manggis mengandung senyawa
kimia golongan alkaloid, flavonoid, glikosida, saponin, tanin dan
steroid/triterpenoid (Pasaribu et al, 2012)
Tabel 4.1 Hasil Penapisan Fitokimia Ekstrak Kulit Buah Manggis
Ekstrak Metanol Keterangan
Dari identifikasi senyawa alkaloid ekstrak metanol kulit buah manggis
memberikan hasil yang positif hal ini dikarenakan adanya endapan merah
bata pada ekstrak dengan penambahan pereaksi Dragendorff, begitu pula
dengan penambahan pereaksi Mayer menghasilkan endapan kuning.
Alkaloid merupakan bahan alam heterosiklik yang mengandung nitrogen.
Sebagai suatu golongan, alkaloid menunjukkan aktivitas biologis yang
sangat luas dan juga tersebar luas, yang terdapat di tanaman, fungi, bakteri,
amfibi, serangga, hewan laut dan manusia (Heinrich, 2009).
Pada identifikasi senyawa flavonoid memberikan hasil yang positif
ditandai dengan terbentuknya warna kuning pada ekstrak dengan
penambahan larutan ammonia dan asam sulfat. Flavonoid merupakan
golongan senyawa terbesar dari senyawa fenol, flavonoid umumnya terdapat