BAB II
TINJAUAN PUSTAKA
2.1 Ibuprofen
2.1.1 Sifat fisikokimia
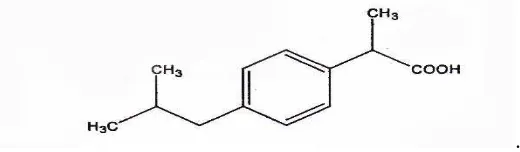
Ibuprofen ((±)-2-(p-isobutilfenil) asam propionat) dengan rumus molekul C13H18O2 dan berat molekul 206,28. Rumus bangun ibuprofen seperti yang
ditunjukkan pada Gambar 2.1.
.
Gambar 2.1 Rumus bangun ibuprofen
Ibuprofen berupa serbuk hablur, putih hingga hampir putih, berbau khas lemah. Ibuprofen praktis tidak larut dalam air, sangat mudah larut dalam etanol, metanol, aseton dan dalam kloroform, sukar larut dalam etil asetat (Ditjen POM, 1995). Larut dalam larutan alkali hidroksida dan karbonat. Senyawa ini mempunyai titik lebur 75-77º C dengan pKa 4,4; 5,2 dan log P (oktanol/air) 4,0 (Moffat, et al., 2005).
2.1.2 Farmakokinetik
90% dari dosis yang diabsorpsi akan dieksresi melalui urin sebagai metabolit atau konyugatnya. Metabolit utama merupakan hasil hidroksilasi dan karboksilasi (Stoelting, 2006; Sinatra, et al., 1992).
2.1.3 Farmakodinamik
Mekanisme kerja ibuprofen melalui inhibisi sintesa prostaglandin dan menghambat siklooksigenase-I (COX I) dan siklooksigenase-II (COX II). Namun tidak seperti aspirin hambatan yang diakibatkan olehnya bersifat reversibel. Dalam pengobatan dengan ibuprofen, terjadi penurunan pelepasan mediator dari granulosit, basofil dan sel mast, terjadi penurunan kepekaan terhadap bradikinin dan histamin, mempengaruhi produksi limfokin dan limfosit T, melawan vasodilatasi dan menghambat agregasi platelet (Stoelting, 2006).
2.1.4 Indikasi dan dosis terapi
Ibuprofen dapat digunakan untuk mengurangi nyeri yang ringan hingga sedang, khususnya nyeri oleh karena inflamasi seperti yang terdapat pada arthritis dan gout (Trevor, et al., 2005; Anderson, et al., 2002). Untuk mengurangi nyeri ringan hingga sedang dosis dewasa penggunaan ibuprofen per oral adalah 200-400 mg, untuk nyeri haid 400 mg per oral kalau perlu. Untuk arthritis rheumatoid 400-800 mg. Untuk demam pada anak-anak 5 mg/kg berat badan, untuk nyeri pada anak-anak 10 mg/ kg berat badan, untuk arthritis juvenil 30-40 mg/ kg berat badan/hari (Anderson, et al., 2002).
2.2 Absorpsi
Untuk dapat diserap, semua zat aktif harus terlarut lebih dahulu. Oleh sebab itu laju penyerapan merupakan fungsi dari laju pelarutan zat aktif didalam cairan tubuh (saluran cerna misalnya) dan laju difusi molekul-molekul yang terlarut dalam cairan tersebut melintasi membran seluler, sesuai dengan skema sebagai berikut:
Proses penyerapan tersebut berkaitan dengan prinsip: sebelum melintasi membran biologik, zat aktif harus terlarut lebih dahulu didalam cairan disekitar membran.
Bila zat aktif berada dalam suatu bentuk sediaan, maka sebelum melarut zat aktif harus terlepas dari sediaan, dan selanjutnya berdifusi dan diserap menurut tahapan sebagai berikut:
Bila proses pelepasan terjadi sangat lambat, maka pelepasan akan mempengaruhi seluruh waktu dan tahapan proses pelarutan, difusi dan penyerapan zat aktif. Jadi tahapan yang paling lambat dari rangkaian predisposisi zat aktif sediaan obat didalam tubuh merupakan tahap penentu.
2.2.1 Membran sel
Membran sel merupakan bagian sel yang mengandung komponen-komponen yang terorganisasi dan dapat berinteraksi dengan mikromolekul secara khas. Struktur membran biologis sangat kompleks dan dapat mempengaruhi intensitas dan masa kerja obat. Sesudah pemberian secara oral, obat harus melewati sel epitel saluran cerna, membran sistem peredaran tertentu, melewati membran kapiler menuju sel-sel organ atau reseptor obat.
Menurut Siswandono dan Soekarjo (2000) membran sel terdiri dari komponen-komponen yang terorganisasi, yaitu:
1. Lapisan lemak bimolekul.
Tebal lapisan lemak bimolekul ± 35 Ǻ, mengandung kolesterol netral dan fosfolipid terionkan, yang terdiri dari fosfatidiletanolamin, fosfatidilkolin, fosfatidilserin dan spingomielin. Berdasarkan sifat kepolarannya lapisan lemak bimolekul dibagi menjadi dua bagian yaitu bagian non polar, terdiri dari rantai hidrokarbon, dan bagian polar yang terdiri dari gugus hidroksil kolesterol dan gugus gliserilfosfat fosfolipid.
2. Protein.
Bentuk protein bervariasi, ada yang besar, berat molekulnya ± 300.000 dan ada pula yang sangat kecil. Protein bersifat ampivil karena mengandung gugus hidrofil dan hidrofob.
3. Mukopolisakarida.
2.2.2 Struktur membran sel
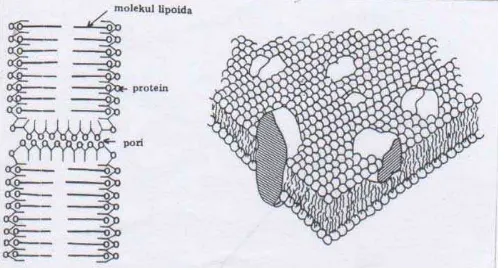
Penelitian Dawson dan Danielli (1936-1943) serta Stein dan Danielli (1956), mengemukakan suatu lembaran lipida protein sebagai model membran. Model membran tersebut terdiri dari dua basal lipida monomolekular (yang terdiri dari fosfolipida, tetapi juga kolesterol) yang kutub hidrofobnya menghadap ke bagian dalam, dan kutub hidrofilnya merupakan basal protein berada di fasa berair. Dua kutub hidrofil mengandung protein dan ujung fosfolipid yang polar (salah satu diantaranya yang berada pada permukaan luar mempunyai lapisan protein globular) mengelilingi daerah pusat hidrofob. Tetapi tampaknya susunan statis tersebut bukan merupakan protein dan lipida dalam membran seluler yang hidup. Struktur membran sel dapat dilihat pada Gambar 2.2.
Dalam konsep mosaik cair, matrik membran terdiri atas dua lapisan lipida protein globular yang tidak berkesinambungan dan saling menyesuaikan menurut susunan yang teratur atau tidak teratur. Gugusan polarnya terletak pada permukaan membran yang kontak dengan cairan intra atau ekstraseluler, sedangkan gugus non polar menghadap ke arah dalam. Pori-pori yang tampak pada sumbu utama protein globuler tebalnya ± 85 Angstrom. Model ‘Mosaik Cair’ konsisten tentang eksistensi dari chanel-chanel ion khusus dan reseptor-reseptor di dalam dan di sepanjang permukaan membran (Syukri, 2002).
2.2.3 Cara penembusan obat melalui membran biologis
Pada umumnya obat menembus membran biologis secara difusi. Mekanisme difusi dipengaruhi oleh struktur kimia, sifat fisika kimia obat dan sifat membran biologis.
Cara penembusan obat ke dalam membran biologis dibagi atas: 1. Difusi pasif
Penembusan membran biologis secara difusi pasif dibedakan menjadi tiga, yaitu difusi pasif melalui pori (cara penyaringan), difusi pasif dengan cara melarut dalam lemak penyusun membran dan difusi pasif dengan fasilitas.
a. Difusi Pasif Melalui Pori
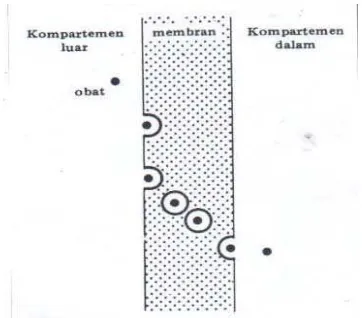
Penembusan air terjadi karena adanya perbedaan tekanan hidrostatik atau osmotik; semua senyawa yang berukuran cukup kecil dan larut dalam air dapat melewati kanal membrane. Sebagian besar membran (membran seluler, epitel usus halus dan lain-lain) berukuran kecil (4-7oA) dan hanya dapat dilalui oleh molekul dengan bobot molekul yang kecil yaitu lebih kecil dari 150 untuk senyawa yang bulat, atau lebih kecil dari 400 jika molekulnya terdiri atas rantai panjang (Aiache, et al., 1993). Untuk lebih jelasnya difusi pasif melalui pori dapat dilihat pada Gambar 2.3.
b. Difusi Pasif dengan Cara Melarut pada Lemak Penyusun Membran
Penembusan terjadi karena adanya perbedaan konsentrasi atau elektrokimia tanpa memerlukan energi, sehingga mencapai keseimbangan di kedua sisi membran. Bila molekul semakin larut lemak, maka koefisien partisinya semakin besar dan difusi transmembran terjadi lebih mudah. Kebanyakan zat aktif merupakan basa atau asam organik, maka dalam keadaan terlarut sebagian molekul berada dalam bentuk terionkan dan sebagian dalam bentuk tak terionkan. Hanya fraksi zat aktif yang terionkan dan larut dalam lemak yang dapat melalui membran dengan cara difusi pasif.
Untuk obat yang zat aktifnya merupakan garam dari asam kuat atau basa kuat, derajat ionisasi berperan pada hambatan difusi transmembran. Sebaliknya untuk elektrolit lemah berupa garam yang berasal dari asam lemah atau basa lemah yang sedikit terionisasi, maka difusi melintasi membran tergantung kelarutan bentuk tak terionkan di dalam lemak, jumlah bentuk yang tak terionkan (satu-satunya yang bergantung pada konsentrasi), serta derajat ionisasi molekul.
c. Difusi Pasif dengan Fasilitas
Beberapa bahan obat dapat melewati membran sel karena ada tekanan osmosa, yang disebabkan adanya perbedaan kadar antar membran, pengangkutan ini berlangsung dari daerah dengan kadar tinggi ke daerah dengan kadar yang lebih rendah dan berhenti setelah mencapai kesetimbangan, gerakan ini tidak memiliki energi dan terjadi secara spontan.
Pembawa dapat berupa enzim atau ion yang muatannya berlawanan dengan muatan molekul obat. Penembusan obat ke dalam membran biologis dapat berjalan dengan cepat bila ada katalisator enzim dan ukuran bentuk kompleks cukup kecil. Penyerapan pasif terjadi hingga tercapainya keseimbangan dan proses akan berhenti bila aliran darah tidak lagi mengangkut zat aktif dalam jumlah yang setara dengan jumlah yang diserap (Aiache, et al., 1993).
2. Transpor Aktif
Pada transpor aktif diperlukan adanya pembawa. Pembawa ini merupakan suatu bagian dari membran, berupa enzim atau paling tidak senyawa protein dengan molekul yang dapat membentuk kompleks pada permukaan membran. Kompleks tersebut melintasi membran dan selanjutnya molekul dibebaskan pada permukaan lainnya, lalu pembawa kembali menuju permukaan asalnya (transpor selalu terjadi dalam arah tertentu, pada bagian usus perjalanan terjadi dari mukosa menuju serosa). Sistem transpor aktif bersifat jenuh, artinya jika semua molekul pembawa telah digunakan maka kapasitas maksimalnya tercapai. Sistem ini menunjukkan adanya suatu kekhususan untuk setiap molekul atau suatu kelompok molekul. Oleh sebab itu dapat terjadi persaingan beberapa molekul yang berafinitas sama pada pembawa tertentu, dan molekul yang mempunyai afinitas tinggi dapat menghambat kompetisi transpor dari molekul yang afinitasnya lebih rendah.
Gambar 2.4 Sistem pengangkutan aktif 3. Pinositosis
Pinositosis merupakan tipe khas pengangkutan aktif dari obat yang mempunyai ukuran molekul besar dan misel-misel seperti lemak, amilum, gliserin, vitamin A,D,E dan K. Pengangkutan ini digambarkan seperti sistem fagositosis pada bakteri (Siswandono dan Soekarjo, 2000)). Mekanisme pinositosis dapat dilihat pada Gambar 2.5.
Gambar 2.5 Sistem pengangkutan secara pinositosis
lipid. Obat asam lemah dan basa lemah mungkin berada dalam keadaan tak terion pada harga pH dari fasa berair pada bagian eksternal dan internal membran. Selama bentuk tak terion dari obat lebih mudah larut dalam lipid dari pada bentuk terion, bentuk tak terion larut ke dalam membran dan seterusnya maka difusi akan lebih cepat dari pada bentuk terion (Wolf, 1994)..
2.3 Usus Halus
Usus halus merupakan lanjutan lambung yang terdiri atas tiga bagian yaitu; duodenum, jejunum dan illeum yang bebas bergerak. Diameter usus halus beragam tergantung pada letaknya yaitu 2 – 3 cm dan panjang keseluruhan antara 5 - 9 m.
Bahan obat dari lambung masuk ke duodenum, fungsi utama duodenum dan bagian pertama jejenum adalah untuk sekresi, sedangkan fungsi bagian kedua dari jejenum dan illeum ialah untuk absorpsi. pH usus halus meningkat dari duodenum 4- 6, jejenum 6-7, illeum 7-8. pH dalam usus halus berperan besar dalam hal absorpsi obat sebagai akibat disolusi berbagai bentuk sediaan (Aiache, et al., 1993).
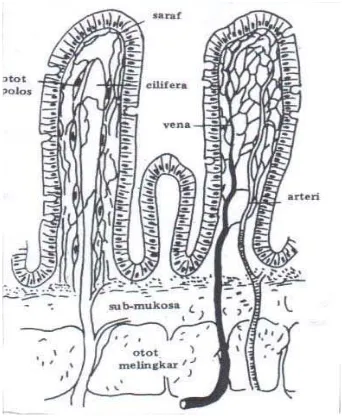
Karakteristik anatomi dan fisiologi usus (dengan makrovilli dan mikrovillinya) lebih menguntungkan untuk penyerapan obat, seperti halnya juga penyerapan zat makanan.
Pentingnya permukaan penyerapan terutama karena banyaknya lipatan-lipatan mukosa usus yang berupa valvula conniventes atau lipatan kerckring, yang terutama banyak terdapat di daerah duodenum dan jejunum. Di daerah tersebut villi-villi usus tertutup oleh epitel bagaikan sikat yang terdiri dari bulu-bulu halus (mikrovilli) dan mempunyai aktivitas yang kuat. Adanya anyaman kapiler darah dan getah bening pada setiap lipatan memungkinkan terjadinya penyerapan yang besar. Gerakan usus dan gerakan villi usus di sepanjang saluran cerna akan mendorong terjadinya penembusan menuju pembuluh darah. Keadaan pH serta tebal dinding yang beragam di setiap bagian usus menyebabkan perbedaan penembusan yang cukup besar pada molekul zat aktif terutama molekul asam yang penyerapannya dipengaruhi oleh pH lambung.
Bagian lain dari usus halus juga merupakan tempat terjadinya pelintasan membran dengan intensitas yang besar, dan disini lebih banyak terjadi difusi pasif.
Difusi pasif berkaitan dengan sejumlah senyawa yang larut lemak atau fraksi-fraski tak terionkan yang larut lemak.
hal yang sama terjadi pula pada bagian usus sebelah bawah dan pada penyerapan susjacent. Skema usus halus dengan villi dan perfusinya dapat dilihat pada Gambar
2.6.
Transpor aktif juga berperan di usus halus dan di sini terjadi persaingan terhadap pembawa yang sama atau terjadi penjenuhan sistem transpor yang dapat membatasi pelintasan membran. Pinositosis juga berperan terutama di ileum terhadap molekul-molekul yang tidak larut (Aiache, et al., 1993).
Gambar 2.6 Skema usus halus dengan villi dan perfusinya
2.4 Metode Kantung Terbalik (Everted Sac)
Preformulasi melibatkan sejumlah pemeriksaan untuk menghasilkan informasi yang bermanfaat untuk tahap formulasi selanjutnya meliputi kestabilan fisikokimia dan kecocokan dosis obat secara biofarmasi.
Suatu teknik dengan menggunakan everted intestinal sac dapat digunakan dalam mengevaluasi karakteristik absorpsi dari zat obat (Ansel,1989).
Pada persiapannya, teknik everted sac menggunakan bagian dari intestin, disayat dari bagian omentum dan sirkulasi mesenterikum. Intestin ini dibalik sehingga permukaannya berada pada bagian luar dan ujung dari bagian ini diikat, larutan buffer dimasukkan melalui kateter pada bagian lainnya, dan bagian luar usus direndam dalam larutan berisis obat dengan suhu 37oC, dialiri oksigen 95% dan CO2
50%. Kedua bagian, baik serosa maupun mukosa dapat dijadikan sampel untuk analisis.
Everted sac merupakan teknik yang sederhana yang menghadirkan kerumitan
yang lebih sedikit bila dibandingkan dengan pengujian konsentrasi obat secara in vivo.
Kondisi dari temperatur, oksigen, ketersediaan makanan sebagai sumber energi dapat diatur dalam metode ini, namun tidak ada lagi sirkulasi mesenterikum dan kehadiran obat secara total pada bagian dalam kantung pada difusi melalui serosa (Swarbrick and Boylan, 1992).
2.5 Kinetika Laju Absorpsi a. Reaksi orde nol
Laju peruraian obat secara matematis dapat digambarkan sebagai berikut :
Laju pengurangan konsentrasi
=
−��� ��=k
Bila data dari suatu studi stabilitas mengikuti reaksi orde nol, grafik x (jumlah yang bereaksi) versus t (waktu) merupakan garis lurus dengan kelandaian menyamai k. Nilai k menyatakan jumlah obat yang terurai per satuan waktu, dan titik potong garis pada waktu nol sama dengan konstanta.
b. Reaksi ode pertama
Laju pengurangan konsentrasi = - ��� ��
=kCa
Dengan memakai persamaan tersebut untuk reaksi orde pertama dihasilkan garis lurus bila dibuat grafik logaritma konsentrasi Ca terhadap waktu. Kecepatan atau konstanta laju reaksi, k, dapat dihitung dari kelandaian garis dikalikan 2,303 (Armstrong, 1995).
2.6 Pengeringan Beku (Freeze Dryer)
Pengeringan beku (freeze drying) adalah salah satu metode pengeringan yang mempunyai keunggulan dalam mempertahankan mutu hasil pengeringan, khususnya untuk produk-produk yang sensitif terhadap panas. Keunggulan pengeringan beku dibandingkan metode lainnya yaitu dapat mempertahankan stabilitas produk, dapat mempertahankan stabilitas struktur bahan dan dapat meningkatkan daya rehidrasi sehingga dapat kembali ke sifat fisiologis, organoleptik dan betuk fisik yang hampir sama dengan sebelum pengeringan (Tambunan dan Manalu, 2000).
2.7 Spektrofotometri Ultraviolet - visibel
Radiasi elektromagnetik, yang mana sinar ultraviolet dan sinar tampak merupakan salah satunya, dapat dianggap sebagai energi yang merambat dalam bentuk gelombang. Beberapa istilah dan hubungan digunakan untuk menggambarkan gelombang ini. Panjang gelombang merupakan jarak linier dari suatu titik pada satu gelombang ke titik yang bersebelahan pada gelombang yang berdekatan. Sinar ultraviolet mempunyai panjang gelombang antara 200 - 400 nm, sementara sinar tampak mempunyai panjang gelombang 400 – 750 nm (Gandjar dan Rohman, 2009).
Sinar ultraviolet dan sinar tampak memberikan energi yang cukup untuk terjadinya transisi elektronik. Dengan demikian, spektra ultraviolet dan spektra tampak dikatakan sebagai spektra elektronik. Keadaan energi yang paling rendah disebut dengan keadaan dasar (ground state). Transisi – transisi elektronik akan meningkatkan energi molekuler dari keadaan dasar ke satu atau lebih tingkat energi tereksitasi (Gandjar dan Rohman, 2009).
Spektra UV – Vis dapat digunakan untuk informasi kualitatif dan sekaligus dapat digunakan untuk analisis kuantitatif.
a. Aspek Kualitatif
Data spektra UV – Vis secara tersendiri tidak dapat digunakan untuk identifikasi kualitatif obat atau metabolitnya. Akan tetapi jika digabung dengan cara lain seperti spektroskopi infra merah, resonansi magnet inti, dan spektroskopi massa, maka dapat digunakan untuk maksud identifikasi/ analisis kualitatif suatu senyawa tersebut. Data yang diperoleh dari spektroskopi UV dan Vis adalah panjang gelombang maksimal, intensitas, efek pH, dan pelarut; yang kesemuanya itu dapat diperbandingkan dengan data yang sudah dipublikasikan (Gandjar dan Rohman, 2009).
b. Aspek Kuantitatif