EFEKTIVITAS RUMPUT LAUT
Gracillaria
sp. DALAM
MENGADSORBSI MERKURI (Hg)
SEPTIANA DWIYANTI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Efektivitas Rumput Laut
Gracillaria sp. dalam Mengadsorbsi Merkuri (Hg) adalah benar karya saya
dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Februari 2017
Septiana Dwiyanti
RINGKASAN
SEPTIANA DWIYANTI. Efektivitas Rumput Laut Gracillaria sp. dalam
Mengadsorbsi Merkuri (Hg). Dibimbing oleh EDDY SUPRIYONO dan DANIEL DJOKOSETIYANTO
Banyaknya pemanfaatan merkuri (Hg) dalam kehidupan sehari-hari salah satunya dalam bidang pertambangan emas skala kecil (PESK) akan menyebabkan limbah merkuri (Hg) tercuci dan masuk ke perairan tawar seperti sungai, danau dan akhirnya akan masuk ke perairan laut yang banyak digunakan untuk kegiatan budidaya. Masuknya limbah merkuri (Hg) ke perairan tidak saja menyebabkan rusaknya kualitas perairan tetapi dapat berdampak pada kematian biota perairan seperti plankton, ikan dan mencemari manusia melalui ikan, air minum atau air sumber irigasi lahan pertanian. Penelitian ini bertujuan untuk mengestimasi nilai LC50 merkuri terhadap Gracillaria sp. serta menganalisis efektivitas Gracillaria
sp. dalam menyerap merkuri (Hg) pada konsentrasi berbeda. Biota uji yang digunakan adalah Gracillaria sp. Bahan pencemar yang digunakan HgCl2 .
Rancangan penelitian menggunakan rancangan acak lengkap (RAL) dengan perlakuan konsentrasi merkuri (Hg) berbeda. Penelitian dilakukan dalam tiga tahap meliputi uji nilai kisaran, uji akut, dan uji bioadsorbsi. Pada uji nilai kisaran digunakan delapan taraf konsentrasi yaitu 0.000354 (sesuai dengan konsentrasi merkuri (Hg) yang ada diperairan setempat), 0.05, 0.25, 0.5, 0.75, 1, 3 dan 5 ppm dengan dua ulangan. Uji akut menggunakan delapan taraf konsentrasi yaitu 0.000354, 0.695, 0.965, 1.341, 1.864, 2.590, 3.598 dan 5 ppm dengan dua ulangan. Uji bioadsorbsi menggunakan 4 taraf konsentrasi yaitu P1 (0.000354 ppm), P2 (0.1 ppm), P3 (0.3ppm) dan P4 (0.7 ppm) dengan dua ulangan.
Hasil penelitian menunjukkan bahwa nilai konsentrasi ambang bawah merkuri (LC0-48 jam) adalah 0.5 ppm dan nilai ambang atas (LC100-24 jam)
adalah 5 ppm. Nilai LC50- 24 ; 48; 72; dan 96 jam merkuri (Hg) terhadap
Gracillaria sp. adalah 3.65 ppm, 2.81 ppm, 1.31 ppm dan 0.96 ppm. Konsentrasi
bioadsorbsi merkuri (Hg) berpengaruh nyata terhadap daya serap Gracillaria sp.
Penyerapan (uptake) tertinggi terjadi pada jam ke-24 setelah pemaparan dan
kesetimbangan terjadi pada minggu pertama. Nilai kapasitas konsentrasi daya serap merkuri (Hg) berkisar 0.09 hingga 0.69 ppm dengan persentase daya serap 71.4-99.8%. Hasil nilai konsentrasi pigmen Klorofil-a berpengaruh nyata pada jam ke-24 dan minggu pertama pemaparan dengan nilai konsentrasi pigmen sebesar 1.7141 hingga 6.6994 mg L-1 sedangkan pigmen fikoeritrin berpengaruh nyata pada jam ke-24 dengan nilai konsentrasi pigmen sebesar 0.00174 hingga 0.0226 mg L-1.
Hasil uji pertumbuhan menunjukkan konsentrasi merkuri (Hg) yang berbeda berpengaruh nyata (p<0.05) terhadap bobot dan laju pertumbuhan
Gracillaria sp. dengan nilai bobot rata-rata sebesar 6.51 hingga10.59 g dan laju
pertumbuhan sebesar -0.93 hingga 0.4%. Berdasarkann hasil penelitian ini, penggunaan Gracillaria sp. sebagai biosorben efektif menyerap merkuri (Hg),
dimana semakin tinggi konsentrasi merkuri (Hg) maka daya serap Gracillaria sp.
semakin tinggi.
SUMMARY
SEPTIANA DWIYANTI. Effectiveness of Seaweed Gracillaria sp. in the
adsorption of Mercury (Hg). Supervised by EDDY SUPRIYONO and DANIEL DJOKOSETIYANTO
The number of mercury (Hg) use in the daily life, such as the artisanal and small-scale gold mining (PESK), will lead to the leaching of mercury (Hg) waste which later will enter the freshwater like rivers, lakes, and finally into the sea that is widely used for aquaculture activities. The entry of mercury (Hg) waste into the waters does not only cause damage to the water quality but also impactson the death of marine organisms such as plankton, fish and contaminates humans through fish, drinking water or water used for irrigation of agricultural land. To neutralize the levels of mercury (Hg) in waste, such effective and efficient method is required. Adsorption method is a method that is effective and efficient for its faster and economical operation. Seaweed Gracillaria sp. is known for its ability
to adsorb other elements or compounds such as heavy metals; thus, it is expected that concentration of mercury in waters can be minimized through this ability. This study was aimed to estimate the LC50 value of mercury (Hg) on Gracillaria
sp. and to analyze the effectiveness of Gracilaria sp. in the adsorption of mercury
(Hg) at different concentrations. The biota test used was Gracillaria sp. while the
pollutant used was HgCl2.
The research design used was a completely randomized design (CRD) with treatment of different concentration of mercury (Hg). The study was conducted in three stages include range finding test, acute test, and bioadsorption test. In range valuetest, eight levels of concentration were used, namely 0.000354 (in accordance withthe concentration of mercury (Hg) in the local waters), 0.05, 0.25, 0.5, 0.75, 1, 3 and 5 ppm with two replications. Acute test used eight levels of concentration those were 0.000354, 0.695, 0.965, 1.341, 1.864, 2.590, 3.598 and 5 ppm with two replications. Test of bioadsorption used four levels of concentration obtained from 10, 30, and 70% of LC50 value, those were P1
(0.000354 ppm), P2 (0.1 ppm), P3 (0.3ppm) and P4 (0.7 ppm) with two replications.
The research result showed that the lower threshold value of mercury (Hg) concentration (LC0-48 hours) was 0.5 ppm while the upper threshold value
(LC100-24 hours) was 5 ppm. The values of LC50-24; 48; 72; and 96 hours of
mercury (Hg) on Gracillaria sp. were 3.65 ppm, 2.81 ppm, 1.31 ppm and 0.96
ppm. The concentration of mercury (Hg) bioadsorption significantly affected the absorption of Gracillaria sp. The highest adsorption (uptake) was at 24 hours
The test result indicated that different concentrations of mercury (Hg) significantly affected (P <0.05) the weight and growth rate of Gracillaria sp. with
value of average weight ranged from 6.51 to 10.59 g and growth rate of -0.93 to 0.4%. Based on this result,the use of Gracillaria sp. as biosorbent is effective in
the adsorption of mercury (Hg) of which higher concentration of mercury (Hg) means higher adsorption of Gracillaria sp.
© Hak Cipta Milik IPB, Tahun 2017
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Akuakultur
EFEKTIVITAS RUMPUT LAUT
Gracillaria
sp. DALAM
MENGADSORBSI MERKURI (Hg)
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2017
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas
segala karunia-Nya sehingga karya ilmiah yang berjudul Efektivitas Rumput Laut
Gracillaria sp. dalam Mengadsorbsi Merkuri (Hg) ini berhasil diselesaikan.
Terima kasih penulis ucapkan kepada Bapak Dr Ir Eddy Supriyono, MSc dan Bapak Prof Dr Ir Daniel Djokosetiyanto, DEA selaku pembimbing selayaknya orang tua yang telah banyak memberikan arahan, waktu, semangat serta masukan baik teknis maupun non teknis kepada penulis sehingga karya ilmiah ini dapat diselesaikan. Terimakasih juga penulis ucapkan kepada Dr Ir Kukuh Nirmala, MSc selaku dosen penguji luar komisi pada ujian tesis dan ibu Dr Ir Widanarni MSi selaku ketua progam studi Ilmu Akuakultur.
Penulis juga mengucapkan terima kasih dan rasa hormat kepada ayahanda Drs H. Jarwan, MPd serta ibunda Hj. Wardiati, SPd dan juga kakak tersayang Titin Eka Suswandi, SPd, Sukriadi SPd dan adik tersayang M. Dhiyaurrahman beserta keluarga besar atas segala dukungan, kesabaran, pengertian, doa dan kasih sayangnya selama penulis menjalani masa studi.
Ucapan terima kasih tak lupa penulis sampaikan kepada rekan–rekan yang selama masa studi menjadi motivasi dan memberikan pengaruh positif bagi penulis Prawita Anggeni, SPi, MSi; Aminatul Zahra, SPi, MSi; Yuliana Asri, SPi, MSi; Chairun Nufus, SPi; Fahmi Akbar, SPi, MSi; Nian Rima, SP, MSi; Vandra Kurniawan SPi, MSi; Aisyah Lukmini, SPi, MSi; Suhaiba Djai, SPi, MSi; Ryan Kurniawati, SPi; One Kris Nur Perdana, SPi. serta keluarga besar Program Studi Ilmu Akuakultur 2014 lain yang tidak bisa disebutkan satu persatu.
Penelitian ini dapat terlaksana atas bantuan dari Balai Perikanan Budidaya Laut Lombok beserta staf. Terimakasih penulis ucapkan dengan hormat kepada Bapak Samsul Bahrawi, SSTPi dan semua tim Fin fish. Bapak Djoko, Ibu Eki, Bapak Idris atas masukan, bimbingan dan bantuan selama penulis melaksanakan penelitian.
Semoga karya ilmiah ini bermanfaat.
Bogor, Februari 2017
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR LAMPIRAN vi
DAFTAR GAMBAR vi
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 3
Tujuan Penelitian 3
Manfaat Penelitian 3
2 METODE PENELITIAN 3
Waktu dan Tempat 3
Pelaksanaan Penelitian 3
Tahapan Penelitian 4
Parameter Pengamatan 5
Analisis Data 7
3 HASIL DAN PEMBAHASAN 7
Hasil 7
Pembahasan 13
4 SIMPULAN DAN SARAN 18
Simpulan 18
Saran 18
DAFTAR PUSTAKA 19
LAMPIRAN 23
DAFTAR TABEL
1 Analisis parameter fisika dan kimia kualitas air penelitian 7
2 Kapasitas adsorbsi (q) Gracillaria sp. 10
3 Persentase kapasitas (R %) adsorbsi Gracillaria sp. 10
4 Bobot rata-rata dan laju pertumbuhan spesifik pada akhir penelitian 12
5 Kisaran nilai kualitas air selama penelitian 13
DAFTAR GAMBAR
1 Metode penanaman rumput laut 4
2 Persentase tingkat kematian Gracillaria sp. pada konsentrasi merkuri
(Hg) yang berbeda selama uji nilai kisaran. 8
3 Persentase tingkat kematian Gracillaia sp. pada konsentrasi merkuri
(Hg) yang berbeda selama uji akut 8
4 Nilai LC50 merkuri (Hg) pada pemaparan 24, 48, 72 dan 96 jam 9
5 Daya serap Gracillaria sp. pada konsentrasi merkuri (Hg) berbeda
selama 4 minggu. 9
6 Konsentrasi merkuri (Hg) pada media air laut selama 4 minggu 11 7 Konsentrasi klorofil-a pada konsentrasi merkuri (Hg) berbeda selama 4
minggu 11
8 Konsentrasi fikoeritrin pada konsentrasi merkuri (Hg) berbeda selama
4 minggu 12
DAFTAR LAMPIRAN
1 Morfologi (warna) talus Gracillaria sp. yang terkontaminasi merkuri
(Hg) 24
2 Prosedur analisis kandungan merkuri (Hg) pada Gracillaria sp. dan air
media penelitian 24
3 Analisis ragam dan uji lanjut (tukey) daya serap Gracillaria sp. dan air 25
1
PENDAHULUAN
Latar Belakang
Logam berat Merkuri/hydragyrum (Hg) atau yang disebut dengan air raksa memiliki nomor atom 80, berat atom 200.59 g/mol, titik beku -39 0C dan titik didih 356.60C yang mempunyai sifat cair pada temperatur ruang dan daya hantar listrik yang tinggi. Karena sifat-sifat tersebut, merkuri banyak digunakan baik dalam kegiatan pertambangan, industri maupun pertanian (Palar 2008). Pada kegiatan pertambangan emas, merkuri banyak dimanfaatkan oleh pertambangan emas skala kecil (PESK) yang dalam pengolahan emas masih dilakukan secara tradisional. Salah satu sentral pertambangan emas tradisional di Indonesia terdapat di daerah Nusa Tenggara Barat yaitu di Kecamatan Sekotong, Kabupaten Lombok Barat. Sejak ditemukannya titik pertambangan emas di daerah Sekotong pada tahun 2008, industri pertambangan emas skala kecil (PESK) mulai berkembang. Merkuri (Hg) banyak digunakan pada proses amalgam atau masyarakat Sekotong menyebutnya dengan istilah pengelundungan. Amalgam atau pengelundungan merupakan pengolahan bahan galian emas menggunakan merkuri (Hg) untuk mengikat bijih emas dan memisahkan bijih emas dengan logam-logam lainnya (Trisnawaty et al. 2013). Berdasarkan laporan Ismawati (2011) diketahui bahwa
terdapat 5000 penambang dengan fasilitas gelundungan sebanyak 100 unit di daerah Sekotong (Desa Buwun Mas, Kerato, Pelangan).
Selain sebagai pusat pertambangan emas skala kecil (PESK), Sekotong juga merupakan pusat perikanan. Beberapa komoditas andalan seperti mutiara, kerapu, kakap, rumput laut di budidayakan di daerah tersebut. Wilayah laut sekotong menjadi daerah penangkapan ikan serta tujuan wisata. Dengan adanya perkembangan pertambangan emas skala kecil (PESK), dimana proses aktifitas pengolahan emas banyak menggunakan merkuri (Hg) dikawatirkan pembuangan limbah pertambangan emas yang mengandung merkuri (Hg) akan masuk ke perairan tawar, payau dan laut yang dapat menyebabkan penurunan kualitas air pada lingkungan perairan, termasuk perairan laut yang banyak digunakan untuk budidaya.
2
No.035725/B/SK/VII/89 dan Standar Nasional Indonesia (SNI) 2009, tentang batas maksimum cemaran logam berat merkuri (Hg) pada pangan (Ikan dan krustasea) yaitu 0.5 ppm dan 0.3 ppm (FAO 2010).
Peristiwa keracunan karena terkontaminasi oleh merkuri (Hg) yang telah dikenal luas adalah tragedi Minamata (Jepang) pada tahun 1953-1960. Sumber utama keracunan merkuri pada peristiwa ini adalah pembuangan limbah pabrik plastik yang mengandung merkuri (Hg) ke air laut (Yasuda 2000). Pencemaran perairan dari limbah merkuri (Hg) dapat diminimalisir jika sebelum limbah merkuri (Hg) tersebut dibuang ke lingkungan perairan dilakukan netralisir kadar merkuri (Hg). Penanganan limbah logam berat dalam lingkungan dapat dilakukan dengan beberapa metode diantaranya metode teknologi plasma, reverse osmosis, metode elektrodialisis, ultrafiltrasi, penukaran ion, namun menurut Volesky dan Holan (2000) penggunaan teknologi tersebut sangat mahal atau tidak efisien dan efektif.
Teknologi alternatif yang saat ini banyak dikembangkan yaitu metode adsorbsi. Adsorbsi merupakan suatu gejala permukaan dimana terjadinya penyerapan atau penarikan molekul-molekul gas atau cairan pada permukaan adsorben (Kusuma et al. 2014). Adsorben merupakan suatu bahan (padatan) yang
dapat mengadsorpsi adsorbat. Beberapa adsorben yang dapat digunakan dalam penanganan limbah adalah abu sekam, serbuk gergaji, zeolit alami, zeolit buatan karbon aktif dan kitosan. Selain itu adsorben yang dapat digunakan dalam mengadsorbsi logam berat yaitu mikroorganisme dikenal dengan istilah bioadsorbsi. Bioadsorbsi merupakan terkonsentrasinya dan terakumulasinya bahan penyebab polusi atau polutan dalam suatu perairan oleh material biologi (Kristaningrum 2006). Keuntungan penggunaan bioadsorben adalah biaya murah, efisien tinggi, dapat diregenerasi, tidak memerlukan nutrisi tambahan, kemampuanya dalam merecovery logam tinggi (Volesky dan Holan 2000). Salah
satu material biologi yang pontesial yang dapat digunakan sebagai bioabsorben dalam menyerap logam berat merkuri (Hg) di perairan yaitu dari golongan makroalga (rumput laut) yaitu Gracillaria sp.
Gracillaria sp. merupakan rumput laut dari divisi Rhodophyta, bersifat euryhalin dan banyak mengandung polisakarida dalam dinding selnya (Jarvis et al.
2015). Sudarshan et al. (2012) melaporkan bahwa rumput laut merah
(Rhodophyta,) memiliki kemampuan yang lebih dalam menyerap logam berat (Fe, Mn, Cu, Ni, Zn, Cr & Pb) dibandingkan dengan rumput laut coklat dan hijau sedangkan Coelho et al. (2005) menyatakan bahwa Gracillaria sp. merupakan rumput laut yang responsif terhadap kontaminasi logam berat. Hasil studi mengenai kemampuan makroalga atau rumput laut dalam menyerap logam berat telah dilakukan diantaranya pada Euchema cattoni mampu untuk mengadsorbsi
ion logam Cd sebesar 33,899 ppm (Raya 2012). Adsorbsi merkuri (Hg) oleh
Sargassum ciberium sebesar 59.898% (Santoso et al. 2010). Sedangkan pada Gracillaria sp. mampu menyerap ion logam berat Cu sebesar 54.486 ppm setelah
pemaparan selama 4 minggu (Yulianto 2006). Berdasarkan uraian dan hasil studi yang dijabarkan, pemanfaatan potensi Gracillaria sp. sebagai adsorben pada
logam berat merkuri (Hg) sampai saat ini belum banyak diketahui. Oleh karena itu, perlu dilakukan penelitian tentang efektivitas Gracillaria sp. dalam mengadsobsi
3
Perumusan Masalah
Semakin banyaknya pemanfaatan merkuri (Hg) dalam kehidupan sehari-hari terutama dalam bidang pertambangan emas skala kecil (PESK) akan meningkatkan volume limbah merkuri (Hg) yang dibuang ke perairan tawar, payau dan laut. Untuk menetralisir kadar merkuri (Hg) dalam limbah tersebut diperlukan metode yang efektif dan efisien. Metode adsorbsi merupakan metode yang efektif dan efisien karena pengoperasiannya lebih cepat dan ekonomis. Rumput laut jenis Gracillaria sp. diketahui dapat mengadsorbsi unsur atau
senyawa lainnya seperti logam berat sehingga diharapkan dengan kemampuan
Gracillaria sp. dalam menyerap logam berat disuatu perairan, konsentrasi logam
berat merkuri (Hg) dapat diminimalisir. Sejauh ini efektitivas atau kemampuan rumput laut jenis Gracillaria sp. menyerap kadar merkuri (Hg) belum banyak
diketahui, sehingga perlu dilakukan penelitian lebih lanjut.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengestimasi nilai LC50 merkuri terhadap
Gracillaria sp. serta menganalisis efektivitas Gracillaria sp. dalam menyerap
merkuri (Hg) pada konsentrasi berbeda.
Manfaat Penelitian
Penelitian ini dapat menjadi acuan pemanfaatan rumput laut Gracillaria sp.
sebagai bioadsorben untuk mengurangi suatu pencemaran dalam lingkungan perairan budidaya yang mengandung merkuri (Hg).
2
METODE
Waktu dan Tempat
Penelitian dilaksanakan pada bulan Desember 2015 - Mei 2016, di Balai Budidaya Laut Sekotong Lombok Barat, Nusa Tenggara Barat. Uji konsentrasi pigmen (klorofil-a dan fikoeritrin) serta kualitas air dilaksanakan di Laboraturium Kesehatan dan Lingkungan Balai Budidaya Laut Sekotong, Lombok Barat, Nusa Tenggara Barat. Analisis logam berat merkuri (Hg) dilaksanakan di Laboraturium Kimia Analitik Universitas Mataram.
Pelaksanaan Penelitian
Penelitian ini meliputi tiga tahapan yaitu (1) uji nilai kisaran (range finding test); (2) uji akut; dan (3) uji bioadsorbsi. Biota uji yang digunakan pada
penelitian ini adalah bibit Gracillaria sp. berumur 25-30 hari (WWF 2014), yang
diperoleh dari pembudidaya rumput laut Sekotong. Bahan pencemar media percobaan yaitu HgCl2. Media percobaan yang digunakan adalah air laut yang
berasal dari perairan Sekotong. Gracillaria sp. diaklimatisasi selama tujuh hari
4
pada bahan uji (Gracillaria sp.) dan media percobaan (air laut) dengan
menggunakan Atomic Absorption Spectrophotometer (AAS).
Metode tanam yang digunakan pada semua tahapan penelitian adalah metode longline seperti dapat dilihat pada Gambar 1. Rumput laut diikat pada tali
nilon dengan panjang 70 cm dan diberi pelampung. Jarak tanam rumput laut dengan rumput laut lainnya adalah 7 cm dengan berat 10±0.5 gr ikat-1 sehingga satu unit penelitian terdapat sepuluh ikatan biota uji Gracillaria sp. Wadah yang
digunakan sterofoam berukuran 70 x 40 x 30 cm3 dengan volume air laut yang
digunakan sebanyak 40 L wadah -1 dan diberikan dua titik aerasi.
Gambar 1 Metode penanaman rumput laut
Tahapan Penelitian
Uji nilai kisaran (range finding test)
Uji penentuan nilai kisaran (range finding test) menggunakan rancangan
acak lengkap (RAL) yang bertujuan untuk menentukan konsentrasi ambang atas (N) dan konsentrasi ambang bawah (n) yang selanjutnya digunakan untuk uji toksisitas akut. Konsentrasi ambang batas atas adalah konsentrasi terendah dari bahan uji yang dapat menyebabkan semua rumput laut mati pada periode waktu pemaparan 24 jam yang ditandai dengan adanya perubahan warna, konsistensi dan tekstur Gracillaria sp. Sedangkan konsentrasi ambang batas bawah adalah
konsentrasi tertinggi dari bahan uji yang dapat menyebabkan semua biota uji hidup setelah pemaparan 48 jam. Gracillaria sp. yang digunakan sebanyak 100 gr
wadah-1. Konsentrasi nilai kisaran (range finding test) merkuri (Hg) pada
penelitian ini tediri dari kontrol yaitu 0.000354 (sesuai dengan konsentrasi merkuri (Hg) yang ada diperairan setempat), 0.05, 0.25, 0.5, 0.75, 1, 3 dan 5 ppm dengan dua ulangan sehingga diperoleh 16 unit perlakuan. Pengamatan kematian
Gracillaria sp. dilakukan pada jam ke-0, 2, 4, 8, 16, 24 dan 48. Perhitungan
kematian berdasarkan jumlah ikatan rumput laut yang mati.
Hasil dari uji penentuan kisaran diperoleh nilai ambang batas atas (N) dan ambang batas bawah (n). Nilai ambang batas atas dan batas bawah ini dimasukkan ke dalam rumus Komisi Pestisida (1983) :
7 cm 7 cm 7 cm
10 gr 10 gr 10 gr 10 gr
5 Log N/n = k log(a/n)……….. (1)
a/n=b/a=c/b=d/c=N/d……….(2)
Keterangan :
N = Konsentrasi ambang atas (ppm) n = Konsentrasi ambang bawah (ppm)
K = jumlah konsentrasi yang diuji (a,b,c,d adalah konsentrasi yang diuji dengan nilai a sebagai konsentrasi terkecil)
Persamaan satu menghasilkan konsentrasi terkecil (a) dan persamaan dua menghasilkan nilai konsentrasi untuk uji akut
Uji toksisitas akut
Uji toksisitas akut bertujuan untuk menentukan LC50. Nilai LC50 yang
dilihat adalah nilai yang dapat mematikan Gracillaria sp. pada 96 jam. Prosedur
pada pengujian ini merujuk pada prosedur uji akut yang dilakukan oleh Supriyono
et al. (2013). Perlakuan pada tahap dua didasarkan pada hasil nilai uji kisaran (range finding test) yang diperoleh dan dirancang dengan rancangan acak lengkap
(RAL). Gracillaria sp. yang digunakan sebanyak 100 gr wadah-1 dengan
konsentrasi 0.000354, 0.695, 0.965, 1.341, 1.864, 2.590, 3.598 dan 5 ppm dengan dua ulangan sehingga diperoleh 16 unit perlakuan. Pengamatan kematian
Gracillaria sp. dilakukan pada jam ke-0, 2, 4, 8, 10, 12, 24, 36, 48, 60, 72, dan 96.
Untuk mengestimasi nilai konsentrasi LC50 pada waktu pemaparan 24, 48, 72 dan
96 jam ditentukan melalui analisis probit dengan perangkat lunak Minitab 16. Analisis
probit adalah suatu cara transformasi statistik dari data persentase kematian ke dalam varian yang disebut probit dan kemudian digunakan untuk menentukan fungsi regresi probit dengan log konsentrasi
Uji bioadsorbsi
Tujuan uji bioadsorbsi yaitu untuk menganalisis pengaruh konsentrasi merkuri (Hg) yang berbeda terhadap daya serap (adsorbsi), pigmen (klorofil-a dan fikoeritrin), pertumbuhan dan kualitas air Gracillaria sp. Gracillaria sp. yang
digunakan sebagai bahan uji pada tahap ini sebanyak 300 gr wadah-1. Rancangan penelitian menggunakan rancangan acak lengkap (RAL) yang terdiri dari 4 perlakuan konsentrasi merkuri (Hg) yaitu P1 (0.000354 ppm), P2 (0.1 ppm), P3 (0.3 ppm) dan P4 (0.7 ppm) dengan dua ulangan. Penentuan konsentrasi perlakuan P2, P3 dan P4 didasarkan 10%, 30%, 70% dari nilai LC50-96 jam sedangkan pada
P1 merupakan perlakuan kontrol yaitu konsentrasi merkuri (Hg) pada perairan lokasi penelitian (Sekotong).
Parameter Pengamatan
Daya serap konsentrasi merkuri (Hg) Gracillaria sp. dan air media penelitian
Untuk mengetahui kapasitas adsorbsi (q) Gracillaria sp. dalam
menyerap merkuri (Hg) pada konsentrasi yang berbeda dalam wadah percobaan, dapat digunakan persamaan sebagai berikut, menurut Saleh (2015):
6
Rumus untuk menghitung persentase adsorben Gracillaria sp. (R%): R = (C0 -Ct) / C0 * 100
Ketereangan :
C0 : Konsentrasi ion awal (mg L-1) Ct : Konsentrasi ion sisa (mg L-1)
Pengambilan sampel dilakukan pada waktu ke 0, 1 jam , 24 jam, 72 jam, 1 minggu, 2 minggu, 3 minggu dan 4 minggu dan dianalisis menggunakan Atomic Absorption Spectrophotometer (AAS)
Konsentrasi Pigmen Klorofil- a
Klorofil-a adalah pigmen warna hijau yang berperan dalam proses fotosintesis dengan menyerap dan mengubah energi cahaya menjadi energi kimia. Analisis klorofil-a bertujuan melihat pengaruh merkuri (Hg) terhadap konsentrasi klorofil-a Gracillaria sp. Pengambilan sampel pada pengukuran klorofil-a
dilakukan pada waktu ke 0, 1 jam, 24 jam, 72 jam, 1 minggu, 2 minggu, 3 minggu dan 4 minggu.
Konsentrasi klorofil-a yang terkandung dalam suatu organ tumbuhan dapat diukur dengan metoda elektrofotometer dengan sampel ditimbang sebanyak 2 g dan digerus sampai halus dengan menggunakan mortar. Setelah halus ditambahkan aseton dingin 80% sebanyak 10 mL. Kemudian disentrifugasi 1.400x selama 2 menit. Konsentrasi klorofil-a dapat dihitug dengan mengikuti dasar rumus Jeffrey dan Humpery (1975):
Klorofil-a (mg L-1)= 11.93* λ664 −1.93*λ647 Fikoeritrin
Fikoeritrin adalah pigmen yang berfungsi membantu klorofil-a dalam menangkap cahaya (Dawes 1981). Pengambilan sampel pada pengukuran kandungan fikoeritrin dilakukan pada waktu ke 0, 1 jam, 24 jam, 72 jam, 1 minggu, 2 minggu, 3 minggu dan 4 minggu. Konsentrasi fikoeritrin yang terkandung dalam suatu organ tumbuhan dapat diukur dengan metoda elektrofotometer dengan sampel ditimbang sebanyak 2 g, kemudian ditambahkan 10 ml 0.1 M buffer fosfat dengan pH 8. Selanjutnya disentrifugasi 1000x selama 2 menit. Konsentrasi fikoeritrin dapat dihitung dengan mengikuti dasar rumus Evans (1988)
Fikoeritrin (mg L-1)= [ �564−�592 − �455−�592 ∗ 0.20] ∗ 0.12
Laju Pertumbuhan Spesifik
Pengukuran pertumbuhan Gracillaria sp. dilakukan sekali dalam sepuluh
7 LPS (%) =LnWt – LnWo
∆t x 100
Keterangan :
LPS : laju pertumbuhan spesifik (%/hari) Wt : bobot ikan akhir pemeliharaan (g) Wo : bobot ikan awal pemeliharaan (g)
∆t : lama waktu pemeliharaan (hari) Kualitas Air
Kualitas air selama penelitian disajikan pada Tabel 1.
Tabel 1. Analisis parameter fisika dan kimia kualitas air penelitian
Parameter Satuan Alat
Suhu Salinitas DO pH
0C
ppt mg L-1 -
Termometer Refraktometer DO meter pH meter
Analisis Data
Data yang telah diperoleh ditabulasi menggunakan Microsoft Excel 2007
dan minitab 16. Parameter daya serap, konsentrasi pigmen (klorofil-a dan fikoeritrin) serta pertumbuhan Gracillaria sp. dianalisis ragam (ANOVA) dengan
selang kepercayaan 95% jika berpengaruh nyata dilanjutkan dengan uji Tukey. Parameter kualitas air dianalisis secara deskriptif.
3
HASIL DAN PEMBAHASAN
Hasil
Uji nilai kisaran (range finding test)
Hasil uji nilai kisaran (range finding test) didapatkan bahwa pada
8
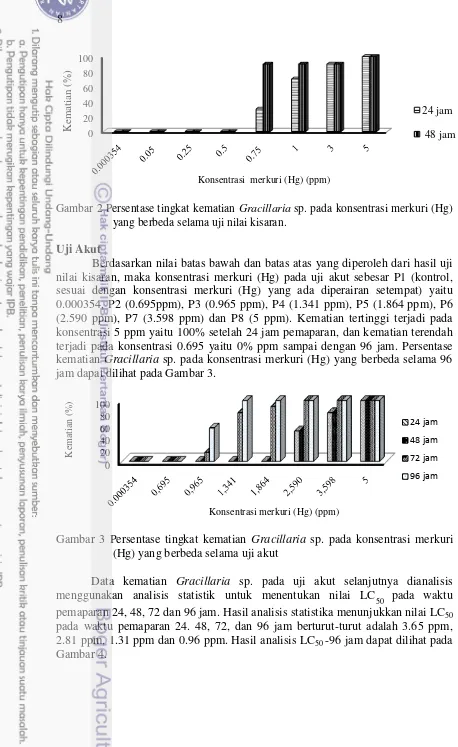
Gambar 2 Persentase tingkat kematian Gracillaria sp. pada konsentrasi merkuri (Hg)
yang berbeda selama uji nilai kisaran.
Uji Akut
Berdasarkan nilai batas bawah dan batas atas yang diperoleh dari hasil uji nilai kisaran, maka konsentrasi merkuri (Hg) pada uji akut sebesar P1 (kontrol, sesuai dengan konsentrasi merkuri (Hg) yang ada diperairan setempat) yaitu 0.000354, P2 (0.695ppm), P3 (0.965 ppm), P4 (1.341 ppm), P5 (1.864 ppm), P6 (2.590 ppm), P7 (3.598 ppm) dan P8 (5 ppm). Kematian tertinggi terjadi pada konsentrasi 5 ppm yaitu 100% setelah 24 jam pemaparan, dan kematian terendah terjadi pada konsentrasi 0.695 yaitu 0% ppm sampai dengan 96 jam. Persentase kematian Gracillaria sp. pada konsentrasi merkuri (Hg) yang berbeda selama 96
jam dapat dilihat pada Gambar 3.
Gambar 3 Persentase tingkat kematian Gracillaria sp. pada konsentrasi merkuri
(Hg) yang berbeda selama uji akut
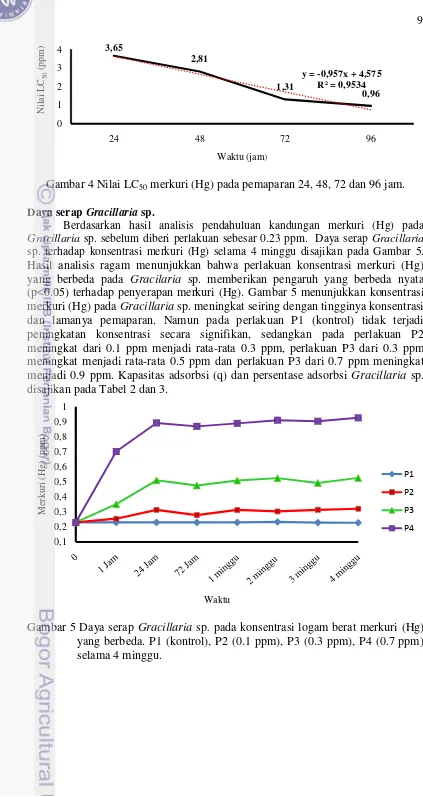
Data kematian Gracillaria sp. pada uji akut selanjutnya dianalisis
menggunakan analisis statistik untuk menentukan nilai LC50 pada waktu pemaparan 24, 48, 72 dan 96 jam. Hasil analisis statistika menunjukkan nilai LC50
pada waktu pemaparan 24. 48, 72, dan 96 jam berturut-turut adalah 3.65 ppm, 2.81 ppm, 1.31 ppm dan 0.96 ppm. Hasil analisis LC50 -96 jam dapat dilihat pada
Gambar 4. 0 20 40 60 80 100
K
em
at
ian
(%
)
Konsentrasi merkuri (Hg) (ppm)
24 jam
48 jam
0 20 40 60 80 100
Kem
atian
(
%)
Konsentrasi merkuri (Hg) (ppm)
9
Gambar 4 Nilai LC50 merkuri (Hg) pada pemaparan 24, 48, 72 dan 96 jam.
Daya serap Gracillaria sp.
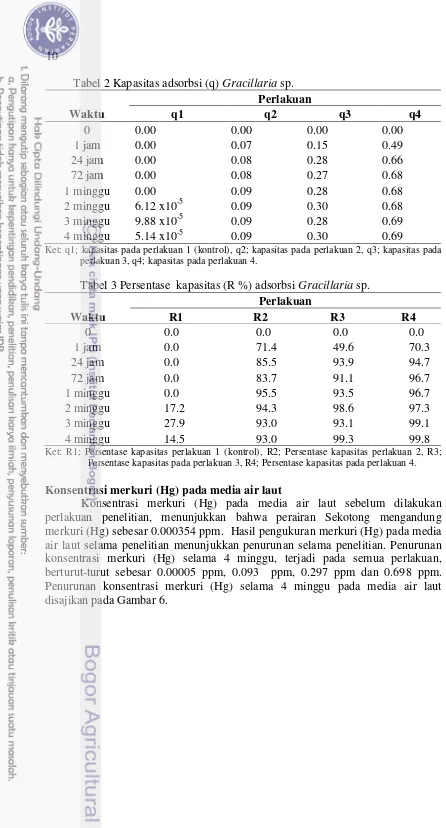
Berdasarkan hasil analisis pendahuluan kandungan merkuri (Hg) pada
Gracillaria sp. sebelum diberi perlakuan sebesar 0.23 ppm. Daya serap Gracillaria
sp. terhadap konsentrasi merkuri (Hg) selama 4 minggu disajikan pada Gambar 5. Hasil analisis ragam menunjukkan bahwa perlakuan konsentrasi merkuri (Hg) yang berbeda pada Gracilaria sp. memberikan pengaruh yang berbeda nyata
(p<0.05) terhadap penyerapan merkuri (Hg). Gambar 5 menunjukkan konsentrasi merkuri (Hg) pada Gracillaria sp. meningkat seiring dengan tingginya konsentrasi
dan lamanya pemaparan. Namun pada perlakuan P1 (kontrol) tidak terjadi peningkatan konsentrasi secara signifikan, sedangkan pada perlakuan P2 meningkat dari 0.1 ppm menjadi rata-rata 0.3 ppm, perlakuan P3 dari 0.3 ppm meningkat menjadi rata-rata 0.5 ppm dan perlakuan P3 dari 0.7 ppm meningkat menjadi 0.9 ppm. Kapasitas adsorbsi (q) dan persentase adsorbsi Gracillaria sp.
disajikan pada Tabel 2 dan 3.
Gambar 5 Daya serap Gracillaria sp. pada konsentrasi logam berat merkuri (Hg)
10
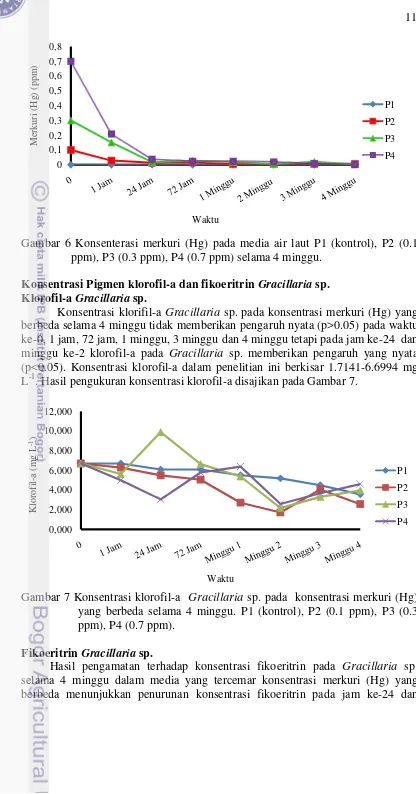
Tabel 2 Kapasitas adsorbsi (q) Gracillaria sp.
Waktu
Perlakuan
q1 q2 q3 q4
0 0.00 0.00 0.00 0.00
1 jam 0.00 0.07 0.15 0.49
24 jam 0.00 0.08 0.28 0.66
72 jam 0.00 0.08 0.27 0.68
1 minggu 0.00 0.09 0.28 0.68
2 minggu 6.12 x10-5 0.09 0.30 0.68
3 minggu 9.88 x10-5 0.09 0.28 0.69
4 minggu 5.14 x10-5 0.09 0.30 0.69
Ket: q1; kapasitas pada perlakuan 1 (kontrol), q2; kapasitas pada perlakuan 2, q3; kapasitas pada perlakuan 3, q4; kapasitas pada perlakuan 4.
Tabel 3 Persentase kapasitas (R %) adsorbsi Gracillaria sp.
Waktu
Perlakuan
R1 R2 R3 R4
0 0.0 0.0 0.0 0.0
1 jam 0.0 71.4 49.6 70.3
24 jam 0.0 85.5 93.9 94.7
72 jam 0.0 83.7 91.1 96.7
1 minggu 0.0 95.5 93.5 96.7
2 minggu 17.2 94.3 98.6 97.3
3 minggu 27.9 93.0 93.1 99.1
4 minggu 14.5 93.0 99.3 99.8
Ket: R1; Persentase kapasitas perlakuan 1 (kontrol), R2; Persentase kapasitas perlakuan 2, R3; Persentase kapasitas pada perlakuan 3, R4; Persentase kapasitas pada perlakuan 4.
Konsentrasi merkuri (Hg) pada media air laut
11
Gambar 6 Konsenterasi merkuri (Hg) pada media air laut P1 (kontrol), P2 (0.1 ppm), P3 (0.3 ppm), P4 (0.7 ppm) selama 4 minggu.
Konsentrasi Pigmen klorofil-a dan fikoeritrin Gracillaria sp. Klorofil-a Gracillaria sp.
Konsentrasi klorifil-a Gracillaria sp. pada konsentrasi merkuri (Hg) yang
berbeda selama 4 minggu tidak memberikan pengaruh nyata (p>0.05) pada waktu ke-0, 1 jam, 72 jam, 1 minggu, 3 minggu dan 4 minggu tetapi pada jam ke-24 dan minggu ke-2 klorofil-a pada Gracillaria sp. memberikan pengaruh yang nyata
(p<0.05). Konsentrasi klorofil-a dalam penelitian ini berkisar 1.7141-6.6994 mg L-1. Hasil pengukuran konsentrasi klorofil-a disajikan pada Gambar 7.
Gambar 7 Konsentrasi klorofil-a Gracillaria sp. pada konsentrasi merkuri (Hg)
yang berbeda selama 4 minggu. P1 (kontrol), P2 (0.1 ppm), P3 (0.3 ppm), P4 (0.7 ppm).
Fikoeritrin Gracillaria sp.
Hasil pengamatan terhadap konsentrasi fikoeritrin pada Gracillaria sp.
selama 4 minggu dalam media yang tercemar konsentrasi merkuri (Hg) yang berbeda menunjukkan penurunan konsentrasi fikoeritrin pada jam ke-24 dan
12
kembali naik setelah 24 jam. Konsentrasi fikoeritrin Gracillaria sp. pada
konsentrasi merkuri (Hg) yang berbeda selama 4 minggu tidak memberikan pengaruh nyata (p>0.05) pada waktu ke-0, 1 jam , 72 jam, 1 minggu, 2 minggu, 3 minggu dan 4 minggu tetapi pada jam ke-24 kandungan fikoeritin pada
Gracillaria sp. memberikan pengaruh yang nyata (p<0.05). Konsentrasi
fikoeritrin dalam penelitian ini berkisar 0.00174-0.0226 mg L-1. Hasil pengukuran konsentrasi fikoeritrin disajikan pada Gambar 8.
Gambar 8 Konsentrasi fikoeritrin Gracillaria sp. pada konsentrasi merkuri (Hg)
yang berbeda selama 4 minggu. P1 (kontrol), P2 (0.1 ppm), P3 (0.3 ppm), P4 (0.7 ppm).
Pertumbuhan Gracillaria sp.
Bobot rata-rata dan laju pertumbuhan spesifik (LPS) Gracillaria sp. selama
penelitian dapat dilihat pada Tabel 4. Hasil analisis statistik menunjukkan bahwa perlakuan pemberian konsentrasi merkuri (Hg) yang berbeda, berpengaruh nyata (p<0.05) terhadap pertumbuhan Gracillaria sp.
Tabel 4 Bobot rata-rata dan laju pertumbuhan spesifik pada akhir penelitian Konsentrasi merkuri * huruf superskrip yang berbeda pada kolom yang sama menunjukkan perbedaan nyata (p<0,05)
Kualitas Air
Pengukuran parameter kualitas air pada penelitian ini meliputi suhu, salinitas, pH dan DO seperti disajikan pada Tabel 5.
13 Tabel 5 Kisaran nilai parameter kualitas air selama penelitian
Parameter Perlakuan Kisaran Optimum
P1 P2 P P3 P4
Suhu (0C) 28.3 28 28 28.2 20-28 0C (WWF 2014) Salinitas (ppt) 35 34 34.4 34.5 15-30 (WWF 2014)
pH 7.8 7.7 8.0 8.0 6-9 (WWF 2014)
DO (mg L-1) 6.5 6.4 6.6 6.6 > 5 mg L-1 (Atmadja et al. 1996)
Pembahasan
Uji nilai kisaran (range finding test) menunjukkan bahwa Gracillaria sp.
mempunyai batas toleransi terhadap perbedaan konsentrasi merkuri (Hg). Hasil uji nilai kisaran didapatkan berupa nilai batas bawah dan batas atas. Batas atas merupakan konsentrasi yang menyebabkan dampak kematian 100% Gracillaria
sp. dalam waktu 24 jam, sedangkan batas bawah adalah konsentrasi merkuri (Hg) dimana 100% Gracillaria sp. yang dicobakan masih dapat hidup setelah 48 jam
pemaparan. Konsentrasi merkuri (Hg) yang ditetapkan sebagai batas atas adalah 5 ppm dan batas bawah adalah 0.5 ppm. Pada konsentrasi 5 ppm, Gracillaria sp.
mengalami kematian 100% setelah pemaparan 24 jam, sedangkan konsentrasi 0.5 ppm tidak menyebabkan kematian Gracillaria sp. (0%) hingga pemaparapan 48
jam. Selanjutnya nilai batas atas dan bawah tersebut digunakan pada uji akut LC50-96 jam.
Respon Gracillaria sp. pada nilai kisaran dan LC50-96 jam menunjukkan
kepekaan kematian yang cukup tinggi dengan gejala klinis sesaat setelah pemaparan merkuri (Hg). Gejala klinis diantaranya perubahan warna rumput laut dimana semakin tinggi konsentrasi merkuri (Hg) warna talus yang dimiliki
Gracillaria sp. tampak semakin pucat yaitu dari warna coklat kemerahan berubah
menjadi hijau muda. Selain itu, talus Gracillaria sp. tidak elastis atau mudah
patah (Lampiran 1). Alamsjah (2007) menyebutkan bahwa talus yang mengalami kerusakan atau kematian akan berwarna pucat, rapuh dan terdapat lendir berlebih. Terjadinya gangguan fisiologis Gracillaria sp. yang mengakibatkan kematian,
diduga karena akibat ketidakmampuan Gracillaria sp dalam mentoleransi
tingginya toksisitas konsentrasi media uji yang tercemar merkuri (Hg). Manoj dan Padhy (2013) menyatakan bahwa diantara logam berat, merkuri (Hg) merupakan logam berat yang paling toksit dibandingkan (Pb), kadmium (Cd), tembaga (Cu), seng (Zn), nikel (Ni), kromium (Cr). Menurut Phillips (1980) bahwa masuknya unsur logam berat ke dalam tubuh rumput laut, mengakibatkan terjadinya persenyawaan antara logam dengan protein dan polisakarida yang selanjutnya mampu menembus dinding sel dan masuk kedalam sitoplasma yang mengganggu fisiologis rumput laut tersebut dan dapat menyebabkan kematian.
Hasil analisis LC50 merkuri (Hg) terhadap Gracillaria sp. pada waktu
pemaparan 24, 48, 72 dan 96 (Gambar 4) menunjukkan bahwa semakin lama waktu pemaparan maka nilai LC50 merkuri (Hg) terhadap Gracillaria sp. akan
semakin rendah. Ini berarti bahwa Gracillaria sp. akan mengalami kematian yang
14
dibandingkan dengan konsentrasi yang lebih rendah. Menurut Sabilu (2010) menunjukkan bahwa nilai LC50 toksisitas merkuri (Hg) terhadap Gracillaria sp.
masuk dalam klasifikasi golongan A yaitu memiliki toksisitas sangat tinggi (LC50
<1 ppm, sangat tinggi).
Untuk mengetahui konsentrasi merkuri (Hg) yang diserap oleh Gracillaria
sp. pada penelitian ini, dapat diperoleh dengan dua basis perhitungan yaitu penurunan konsentrasi merkuri (Hg) pada media penelitian dan konsentrasi yang terserap oleh Gracillaria sp. Pada penelitian ini diketahui konsentrasi awal
merkuri (Hg) pada perairan laut Sekotong sebesar 0.000354 ppm sedangkan konsetrasi awal merkuri (Hg) pada Gracillaria sp. sebesar 0.23 ppm. Adanya
merkuri (Hg) pada perairan Sekotong diduga karena adanya aktivitas pertambangan emas skala kecil (PESK) yang banyak beroperasi, dan limbah dari proses pengolahan emas tersebut banyak dibuang ke sungai dan berujung ke laut.
Berdasarkan hasil penelitian menunjukkan bahwa perlakuan konsentrasi merkuri (Hg) yang berbeda dan waktu pemaparan memberikan pengaruh yang nyata (p<0.05) terhadap daya serap Gracillaria sp. Hal ini menunjukkan bahwa
perbedaan konsentrasi perlakuan (P1: 0.000354 ppm, P2: 0.1 ppm, P3: 0.3 ppm, dan 0.7 ppm) memberikan hasil konsentrasi yang berbeda terhadap merkuri (Hg) yang dikandung oleh Gracillaria sp. pada setiap waktu pengamatan. Analisis daya
serap Gracillaria sp. menggunakan Atomic Absorption Spectrophotometer (AAS),
menunjukkan penyerapan merkuri (Hg) tertinggi oleh Gracillaria sp. terjadi pada
perlakuan P4 (0.7 ppm) dengan kapasitas penyerapan tertinggi (q) 0.69 ppm, diikuti P3 (0.3) dengan kapasitas penyerapan tertinggi (q) 0.3 ppm dan P1 (0.1 ppm) dengan kapasitas penyerapan tertinggi (q) 0.09 ppm sedangkan pada perlakuan kontrol (P1) penyerapan tidak terjadi secara signifikan yaitu 9.88 x10-5 karena rendahnya konsentrasi merkuri (Hg) air laut yang tersedia pada perlakuan tersebut (Tabel 2). Persentase penyerapan (R%) (Tabel 3) pada ketiga perlakuan (P2, P3, P4) berkisar 49.6 hingga 99.8% sedangkan pada perlakuan kontrol (P1) persentase penyerapan 27.9% ini menunjukkan bahwa merkuri (Hg) yang terdapat pada media pemeliharaan dapat terserap semua oleh Gracillaria sp. Sehingga total
merkuri (Hg) yang terkandung pada Gracillaria sp. setelah terjadinya penyerapan
meningkat menjadi 0.3 hingga 0.9 ppm, dikarenakan pada dasarnya Gracillaria sp.
sebelum diberikan perlakuan sudah mengandung merkuri (Hg) sebesar 0.23 ppm. Pada hasil penelitian Santos et al. (2012) menunjukkan persentase kapasitas Gelidium floridanum dalam menyerap cadmium (Cd) sebesar 3.48% pada 0.5 ppm
dan 1.92% pada 1 pmm, tembaga (Cu) dan timbal (Pb) sebesar 68.53 dan 32.86% pada 0.5 ppm sedangkan pada 1 ppm sebesar 67.18 dan 27.73%. Saleh (2015) melaporkan penggunaan rumput laut Ulva lactuca dapat menyerap 70% timbal
(Pb), 50% tembaga (Cu), 30% cadmium (Cd) dan 10% seng (Zn). Sedangkan Montazer et al. (2011) menunjukkan persentase penyerapan nikel (Ni), cadmium
(Cd) dan timbal (Pb) pada rumput laut coklat sebesar 90%. Berdasarkan hasil kapasitas (q) dan persentase kapasitas (R) penyerapan (adsorbsi) menunjukkan bahwa Gracillaria sp. memiliki kemampuan yang tinggi dalam menyerap merkuri
(Hg) sehingga dapat digunakan sebagai biodsorben. Menurut Kusuma et al.
15 Secara umum hasil penelitian ini mengalami peningkatan kandungan merkuri (Hg) dalam Gracillaria sp. sejalan dengan peningkatan konsentrasi
merkuri (Hg) yang terdapat dalam media. Pada Gambar 5 dapat dilihat bahwa penyerapan merkuri (Hg) oleh Gracillaria sp. juga mengalami peningkatan
sejalan dengan lama pemaparan. Hal ini sependapat dengan penelitian yang dilakukan Diantariani (2008) menggunakan Euchema spinosum dan Yulianto
(2006) menggunakan Gracillaria sp. pada logam berat Cr (VI) dan (Cu)
menunjukkan bahwa semakin lama waktu pemaparan sejalan dengan peningkatan kandungan logam logam berat yang terserap. Penyerapan tertinggi merkuri (Hg) terjadi jam ke-24 dan menurun jam ke-72 pada perlakuan P2, P3 dan P4. Turunnya jumlah ion logam yang terserap pada pemaparan 72 jam, kemungkinan disebabkan oleh ketidakstabilan ikatan antara biosorben Gracillaria sp. dengan
ion logam sehingga sebagian kecil dari partikel ion logam merkuri (Hg) terlepas kembali. Raya (2012) menyatakan penurunan konsentrasi ion logam yang terserap seiring bertambahnya waktu juga terjadi karena kemampuan tanaman untuk mengakumulasi logam berat bergantung pada kemampuan penyerapan dan pertumbuhan tanaman.
Penyerapan (adsorbsi) kembali terjadi pada minggu pertama dengan nilai konsentrasi yang konstan sampai minggu keempat sementara pada perlakuan kontrol (P1) perbedaan tidak terlalu terlihat karena hasil penyerapan konsentrasi merkuri (Hg) pada perlakuan tersebut tidak mengalami peningkatan yang signifikan. Sehingga dapat diketahui bahwa titik keseimbangan penyerapan merkuri (Hg) pada penelitian ini terjadi mulai pada minggu pertama pemaparan, hal ini berbeda dengan hasil penelitian yang dilakukan Cossich (2002) keseimbangan penyerapan Cr (III) oleh Sargassum sp. terjadi dalam waktu 6 jam
sedangkan Diantariani (2008) melaporkan bahwa waktu kontak 12 jam rumput laut Eucheuma spinosum dapat menyerap ion logam Cr (VI) paling besar
dibandingkan waktu kontak yang lainnya. Menurut O’Connel et al. (2008) laju
perubahan konsentrasi logam toksik dalam tubuh organisme dapat terjadi dalam 3 proses, yaitu: 1) penyerapan, dimana laju penyerapan lebih besar dari laju pengeluaran/ekskresi; 2) keseimbangan, dimana laju penyerapan sama dengan laju pengeluaran/ekskresi; 3) depurasi, dimana laju penyerapan lebih kecil dari laju pengeluaran/ekskresi.
Kemampuan daya serap Gracillaria sp. terhadap konsentrasi merkuri (Hg)
pada penelitian ini juga dapat dibuktikan dengan konsetrasi merkuri (Hg) yang terdapat pada media air laut penelitian. Dimana kandungan merkuri (Hg) pada media air laut mengalami penurunan hingga akhir penelitian (minggu keempat) dari 0.1 menurun menjadi 0.00698 ppm, P3 dari 0.3 menurun menjadi 0.00204 ppm, P4 dari 0.7 menurun menjadi 0.00164 ppm sedangkan perlakuan P1 tidak banyak mengalami penurunan karena pada dasarnya air media (air laut) yang digunakan memiliki konsentrasi merkuri (Hg) yang rendah. Penurunan konsentrasi merkuri (Hg) pada media pemeliharaan yang diberikan konsentrasi merkuri (Hg) yang berbeda diduga diakumulasi oleh Gracillaria sp. Akumulasi
adalah dimana logam berat akan terkumpul dan meningkat kadarnya dalam jaringan tubuh organisme air yang hidup (Hidayah et al. 2014). Akumulasi
16
merkuri (Hg) dalam Gracillaria sp. pada semua perlakuan selama empat minggu
pemaparan adalah 115 mg kg-1 pada perlakuan kontrol (P1), 160 mg kg-1 (P2), 265 mg kg-1 (P3), 450 mg kg-1 (P4).
Akumulasi tertinggi terjadi pada perlakuan P4, dimana konsentrasi pada P4 merupakan konsentrasi merkuri (Hg) yang paling tinggi (0.7 ppm). Novita (2005) menyatakan pada umumnya jumlah logam berat yang diserap oleh tanaman sebanding dengan konsentrasi logam berat yang ada di dalam media. Semakin tinggi konsentrasi logam, maka semakin banyak logam yang dapat diserap oleh tanaman. Akumulasi merkuri (Hg) pada Gracillaria sp. diduga terjadi
setelah adsorbsi merkuri (Hg) melalui proses penyerapan air yang masuk kedalam tubuhnya. Logam berat dapat terakumulasi ke dalam jaringan makhluk hidup melalui tiga proses utama yaitu (1) dari air melalui permukaan pernafasan (insang); (2) penyerapan dari air ke dalam permukaan tubuh; dan (3) dari makanan, partikel atau air yang dicerna melalui sistem pencernaan (Markus 2009). Penyerapan (adsorbsi) Gracillaria sp. terhadap logam berat merkuri (Hg)
dipengaruhi oleh faktor internal dan eksternal. Buhani et al. (2006) menyatakan
bahwa faktor internal yang berpengaruh antara lain umur, jenis dan karakteristik bagian talus, sedangkan faktor eksternal yag berpengaruh antara lain faktor fisika dan kimia suatu perairan. Faktor fisika dan kimia perairan yang berpengaruh antara lain arus, suhu, salinitas, cahaya dan kandungan atau dosis bahan pencemar logam berat serta lama pemaparan.
Penyerapan merkuri (Hg) secara terus menerus menyebabkan akumulasi merkuri (Hg) pada jaringan Gracillaria sp. Adanya akumulasi merkuri (Hg) juga
memberikan pengaruh terhadap kandungan pigmen Gracillaria sp. yaitu klorofil-a
dan fikoeritrin. Manfaat pigmen tersebut adalah membantu proses fotosintesis. Hasil pengamatan penelitian menunjukkan bahwa konsentrasi merkuri (Hg) yang berbeda mengalami penurunan yanga signifikan pada jam ke-24 dan minggu ke- 2 setelah pemaparan merkuri (Hg). Hasil yang diperoleh pada penelitian ini sejalan dengan penelitian Saleh (2015), dimana konsentrasi pigmen klorofil Ulva lactuca
mengalami penurunan klorofil setelah pemaparan 24 jam logam berat Pb, Cd, Cu dan Zn. Bakar et al. (2015) melaporkan dimana terjadi penurunan konsentrasi
klorifil-a mencapai 15-77% pada Gracilaria salicornia, Sargassum sp. dan Ulva reticulate setelah delapan jam pemaparan merkuri (II) nitrat (Hg(NO3)2) hal ini diduga karena alga mengalami tekanan lingkungan yang berkaitan dengan ketahanan stres.
Selain itu menurunnya konsentrasi klorofil-a pada penelitian ini, diduga disebabkan merkuri (Hg) yang bersifat toksit sehingga proses metabolisme terganggu. Terganggunya metabolisme ini berkaitan dengan proses fotosintesis dalam mensintesis klorofil-a. Hal ini sependapat dengan Rekha et al. (2011) menyatakan bahwa logam berat dapat menghambat biosintesis klorofil sehingga mengakibatkan produksi klorofil berkurang dikarenakan interaksi logam berat dengan kelompok sulfhidril fungsional dari enzim dalam jalur biosintesis klorofil selain itu Santos et al. (2014) melaporkan bahwa penurunan pigmen klorofil a dan b pada Gracillaria domingensis setelah pemaparan logam berat Cd berhubungan dengan kurangnya ketersedian mineral Mg dan Fe yang dihambat oleh logam berat di klorofil pada saat proses biosintesis.
17 turun maka fikoeritrin tinggi dan begitu juga sebaliknya. Fikoeritrin merupakan protein yang bekerja sebagai pigmen pelengkap pada alga merah dan berfungsi dalam sel rumput laut untuk membantu klorofil-a dalam menyerap cahaya pada proses fotosintesis (Chakdar dan Pabbi 2012). Dimana hasil konsentrasi fikoeritrin menunjukkan pada jam ke-24 konsentrasi fikoeritrin meningkat setelah mengalami penurunan pada satu jam pemaparan (Gambar 8) sebaliknya konsentrasi klorofil-a mengalami penurunan pada jam ke-24.
Menurut Rusdani (2013) ketika rumput laut kesulitan dalam membentuk pigmen klorofil-a, maka rumput laut tersebut lebih banyak membentuk fikoeritrin sebagai respon terhadap kondisi tersebut. Salisbury dan Ross (1992), menyatakan fikoeritin selain berfungsi membantu penyerapan cahaya pada saat kondisi stres cahaya, juga berfungsi melindungi pigmen utama dari kerusakan (oksidasi). Secara signifikan adanya fluktuasi konsentrasi pigmen klorofil-a dan fikoeritrin pada jam ke-24 diduga karena pada jam ke-24 merupakan penyerapan merkuri (Hg) tertinggi oleh Gracillaria sp. sehingga dengan adanya merkuri (Hg) pada Gracillaria sp. menyebabkan toksit dan mempengaruhi konsentrasi pigmen pada Gracillaria sp. Menurut Santos et al. (2012) menyatakan bahwa pada tumbuhan
yang telah terpapar logam berat dengan konsentrasi yang lebih tinggi dapat menurunkan level pigmen karena adanya peroksidasi lipid akibat berubahnya permeabilitas membran dan ultrastruktur kloroplas.
Parameter pertumbuhan pada penelitian terdiri dari laju pertumbuhan spesifik dan bobot rata-rata selama empat minggu pemeliharaan. Hasil penelitian menunjukkan bahwa pertumbuhan Gracillaria sp. menurun sejalan dengan
tingginya konsentrasi merkuri (Hg) yang diberikan (Tabel 4). Dimana bobot terendah dan laju pertumbuhan spesifik diperoleh pada perlakuan P4 (0.7 ppm) yang merupakan konsentrasi tertinggi pada perlakuan sedangkan laju pertumbuhan dan bobot tertinggi pada perlakuan P1 (Kontrol). Hal ini sejalan dengan hasil penelitian Unal et al. (2010), dimana penurunan laju pertumbuhan
spesifik Ulva lactuca terjadi pada konsentrasi tertinggi yaitu 5 ppm Cr (IV)
sedangkan hasil penelitian Saleh (2015), Bakar et al. (2015) dan Jiang et al.
(2013) juga menunjukkan bahwa adanya penurunan laju pertumbuhan spesifik pada rumput laut akibat dampak akumulasi logam berat.
Pertumbuhan yang lambat bahkan cenderung menurun pada penelitian ini diduga karena Gracillaria sp. telah terkontaminasi merkuri (Hg) yang
menyebabkan berkurangnya nutrien dalam media pemeliharaan serta energi yang digunakan untuk tumbuh dialihkan untuk beradaptasi pada lingkungan yang tercemar ini sependapat dengan Chino (1981) menyatakan beberapa gejala karena kelebihan logam toksik akan mengakibatkan pengurangan dan penghambatan proses penyerapan nutrien oleh tanaman sehingga kehidupannya menjadi terhambat, pernyataan ini sejalan dengan Chung dan Kim (1992) yang menyatakan efek konsentrasi logam berat pada rumput laut menyebabkan terhambatnya pertumbuhan serta mempengaruhi pigmen fotosintesis.
Menurut Bakar et al. (2015) bahwa penurunan pertumbuhan rumput laut
18
dari menurunnya konsentrasi pigmen klorofil-a dan fikoeritrin akibat adanya penyerapan (adsorbsi) merkuri (Hg) oleh Gracillaria sp, dimana dengan
menurunnya konsentrasi pigmen tersebut yang berfungsi dalam proses fotosintesis. Hal ini sejalan dengan hasil penelitian Rusdani (2013) dan Soriano (2012) menyatakan laju pertumbuhan harian (LPH) K. Alvarezii dan Gracillaria bursapastoris mengikuti pola konsentrasi pigmen (klorofil-a). Semakin tinggi
konsentrasi pigmen maka laju pertumbuhannya juga akan tinggi.
Salah satu penentu keberhasilan budidaya rumput laut Gracilaria sp.
adalah faktor lingkungan. Hasil parameter lingkungan pada penelitian ini meliputi suhu, salinitas, pH dan DO. Suhu selama penelitian ini, rata-rata 27 hingga 29.5
0C. Suhu yang optimal untuk pertumbuhan rumput laut
Gracilaria sp. adalah
berkisar antara 20-28°C (WWF 2014). Gracillaria sp. merupakan rumput laut
yang bersifat euryhalin yaitu mampu hidup pada kisaran salinitas yang luas.
Menurut WWF (2014) salinitas yang baik untuk pertumbuhan rumput laut
Gracilaria sp. berkisar antara 15–30 ppt dan yang optimum adalah berkisar
antara 20-28 ppt. Salinitas rata-rata pada penelitian ini yaitu 31 hingga 39 ppt. Komarawidjaja (2008) menyatakan bahwa penurunan dan peningkatan salinitas di atas batas optimum tidak menyebabkan kematian, tetapi mengakibatkan rumput laut kurang elastis mudah patah dan pertumbuhannya akan terhambat.
Pertumbuhan rumput laut memerlukan pH air laut optimal yang berkisar antara 6-9. Zatnika (1997) menyatakan bahwa hampir seluruh rumput laut menyukai kisaran pH 6-9 sehingga variasi pH yang tidak terlalu besar tidak akan menjadi masalah bagi pertumbuhan rumput laut. pH rata-rata yang diperoleh 7.7 hingga 8. Kelarutan oksigen (DO) di perairan sangat penting dalam mempengaruhi kesetimbangan kimia air laut dan juga dalam kehidupan organisme. Selain itu oksigen dibutuhkan oleh hewan dan tanaman air termasuk mikroorganisme untuk proses respirasinya. Nilai rata-rata DO pada penelitian ini yaitu 6 hingga 7.8 hal ini sesuai dengan yang diungkapkan Atmadja et al. (1996)
menyatakan baku mutu DO untuk rumput laut adalah lebih dari 5 mg L-1. Hal ini berarti jika oksigen terlarut dalam perairan mencapai 5 mg L-1 maka metabolisme rumput laut dapat berjalan dengan optimal.
4
SIMPULAN DAN SARAN
Simpulan
Nilai LC50-96 jam merkuri (Hg) diperoleh sebesar 0.96 ppm. Konsentrasi
merkuri (Hg) yang berbeda memberikan pengaruh nyata (p<0.05) terhadap daya serap, konsentrasi pigmen serta pertumbuhan Gracillaria sp. Penggunaan Gracillaria sp. sebagai bioadsorben efektif menyerap merkuri (Hg) sebesar
0.09-0.69 ppm dengan persentase 71.4-99.8% dan daya serap tertinggi terjadi setelah pemaparan 24 jam.
Saran
Gracillaria sp. dapat diaplikasikan sebagai bioadsorben dalam
19 tepat dalam penggunaannya, sehingga disarankan perlu adanya pengkajian selanjutnya mengenai perbedaan biomassa dalam menyerap logam berat merkuri (Hg).
DAFTAR PUSTAKA
Alamsjah MA. 2007. Isolation and structure determination of algicidal compounds from Ulva fasciata. Biotechnol Biochem. 69(2):2186-2192.
Atmadja WS, Sulistijo, Rachmaniar. 1996. Pengenalan jenis-jenis rumput laut Indonesia. Jakarta. (ID): Puslitbang Oseanologi - LIPI.
Bakar AL, Amin MN, Zakeri AH. 2015. Impact of mercury (II) nitrate on physiological and biochemical characteristics of selected marine algae of different classes.Procedia Environmental Sciences. 30(1):222 – 227.
[BPOM] Badan Pengawasan Obat dan Makanan. 1989. Batas maksimum cemaran logam berat dalam makanan.(ID): BPOM
Buhani, Suharso, Sembiring Z. 2006. Biosorption of metal ions Pb (II), Cd (II), and Cu (II) on S. duplicatum immobilized silica gel matrix. Indonesian Journal of Chemistry. 6(3):245-250.
Chakdar H, Pabbi S. 2012. Extraction and purification of phycoerythrin from
Anabaena variabilis. Phykos. 42(1):25-31.
Chino M. 1981. Heavy metals pollution in soil. Tokyo: Japan Scientific Societies
Press.
Chung IK, Kim GM 1992. Effect of heavy metals on Ulva pertusa. The Korean Journal of Phycology. 7(1):89-99.
Coelho JP, Pereira ME, Duarte A, Pardal AM. 2005. Macroalga respone to a mercury contamination gradient in temprate coastal lagoon (Ria de Aveiro, Portugal).Estuarine, Coastal and Shelf Science. 65(1):492-500.
Cossich ES. 2002. Biosorption of chromium (III) by Sargassum sp. biomass. Journal of Biotechnology. 5(2):132-140.
Dawes CJ. 1981. Marine botany. New York (US): John Willey & Sons. 628p.
Diantariani NP. 2008. Proses biosorpsi dan desorpsi Ion Cr (IV) pada biosorben rumput laut Euchema spinosum. Jurnal Kimia. 2(1):45-52.
[EPA] Environmental Protection Agency. 1973. Water quality criteria.
Washington: Ecological Research Series.
Evans LV. 1988. The effects of spectral composition and irradiance level on pigment levels in seaweeds. Di dalam: Lobban CS, Chapman DJ, Kremer BP, editor. Experimental Phycology. New York (US):123-134.
[FAO] Food and Agriculture Organization of United Nation. 2010. Summary of evaluation performed by the Joint FAO/WHO Expert Committee on food and additives (JECFA). Washington: International Life Sciences Institute Press.
Fogg GE. 1975. Algae Cultures and Phytoplankton Ecology. London: The
Athalone Prios Univ Pr.
Hidayah MA, Purwanto, Soeprobowati RT. 2014. Biokonsentrasi faktor logam berat Pb, Cd, Cr dan Cu pada ikan nila (Oreochromis niloticus Linn.) di
20
Hutagalung HP. 1997. Metode Analisis Air Laut, Sedimen dan Biota. Jakarta.
(ID): Puslitbang Oseanologi – LIPI.
Ismawati Y. (2011). Interviews with importers and ASGM. Denpasar: Balifokus
Jarvis AT, Gretchen K, Fraser B. 2015. Accumulation and effect of metal mixture in two seaweed spesies. Comparative Biochemistry and Physiology.
171(1):8–33.
Jeffrey SW, Humphrey GF. 1975. New spectrophotometric equations for determining chlorophylls a, b, c1, and c2 in higher plants, algae, and natural
phytoplankton. Biochemie und Physiologie der Pflanzen. 167:191-194.
Jiang H, Gao B, Li W, Zhu M, Zheng C, Zheng Q. and Wang C. (2013) Physiological and biochemical responses of Ulva prolifera and Ulva linza to
Cadmium (Cd) stress. Sci. World. J. 289:1-11.
Komarawidjaja W. 2008. Rumput Luat (Gracillaria sp.) sebagai fitoremidiasi
bahan organik perairan budidaya. Teknik Lingkungan B3PL-BPPT. 6(2):
410-415.
Komisi Pestisida. 1983. Pedoman umum pengujian laboratorium toksisitas akut pestisida pada ikan untuk keperluan pendaftaran. Jakarta: Departemen
Pertanian. 18 hal.
Kristianingrum S. 2006. Metode aternatitf untuk mengurangi pencemaran logam berat dalam lingkungan. Yogyakarta. (ID): Universitas Negri Yogyakarta.
Kusuma DP, Wiratini M, Wiratma. 2014. Isoterm adsorpsi Cu2+ oleh biomassa rumput laut Euchema spinosum. Jurnal Kimia Visitalis UNESHA. 2(1):1-10.
Manoj K, Padhy PK. (2013). Oxidative stress and heavy metals: An appraisal with reference to environmental biology. Int. Res. J Biological Sci. 2: 91-101.
Markus T. 2009. Proses Bioakumulasi dan biotransfer merkuri (Hg) pada organisme perairan di dalam wadah terkontrol. Jurnal Matematika dan Sains.14(3):89-96.
Montazer MM, Rabbani P, Abdolali A, Kesthar RA (2011). Kinetics equilibrum studies on biosorption of cadmium lead, and nickel ions from aqueous solutions by Inact and chemically modified brown algae. Journal of Hazardous Materials 185:401–407.
Novita A. 2005. Penyerapan logam Pb dan Cd oleh eceng gondok ( Eichhornia crassipes); pengaruh konsentasi dan lama kontak [Tesis]. Bogor.(ID):
Institut Pertanian Bogor.
O’Connel WD, Birkinshaw C, O’Dwyer FT. 2008. Heavy metal adsorbents
prepared from the modification of celulosa. A review. Bioresource Technology. 99: 6709–6724.
Palar H. 2008. Pencemaran dan toksikologi logam berat. Rineka Cipta. Jakarta.
Phillips DJH. 1980. Quantitative aquatic biologi calindicator and their use monitoring trace metaland organo chlorine pollution. New York: Applied
Science Publisher. 66 p.
Presiden Republik Indonesia. 2001. Peraturan Pemerintah Nomor 82 tahun 2001 tentang Pengelolaan kualitas air dan pengendalian pencemaran air. Jakarta
(ID): Sekretariat Negara
Raya I. 2012. The bioaccumulation of Cd (II) ions on Euchema Cottoni. Marina Chimica Acta. 13(2):13-20.
Rekha PS, Mastan SA. 2011. Toxic effect of mercury on chlorophyll content of
21 Rusdani MM. 2013. Analisis laju pertumbuhan dan kualitas karaginan rumput laut
Kappaphycus alvarezii yang ditanam pada kedalaman berbeda [Tesis]
Bogor. (ID): Institut Pertanian Bogor.
Sabilu K. 2010. Studi toksisitas nikel (Ni) terhadap konsumsi oksigen, kondisi hematologi, hispatologi dan stres sekunder juvenil ikan bandeng Chanos chanos Forsskal. [Tesis]. Bogor. (ID): Institut Pertanian Bogor.
Saleh B. 2015. Physiological respon of the green algae Ulva lactuca
(Chlorophyta) to heavy metals stres. Journal of Stress Physiology & Biochemistry. 11(3).38-51.
Salisbury FB, Ross CW. 1992. Plant physiology, 4th edition. Belmont (US):
Wadsworth Publishing Co. A division of Wadsworth, Inc. 682p
Santos RW, Schmidt ÉC, Martins RP, Latini A, Maraschin M, Horta PA. and Bouzon ZL. 2014. Bioabsorption of Cadmium, Copper and Lead by Red macroalga Gelidium floridanum; physiological respones and ultrastructure
features. Ecotoxicology and Enviroment Safety. 105: 80-89.
Santos RW, Schmidt ÉC, Martins RP, Latini A, Maraschin M, Horta PA, Bouzon ZL. (2012). Effects of cadmium on growth, photosynthetic pigments, photosynthetic performance, biochemical parameters and structure of chloroplasts in the agarophyte Gracilaria domingensis (Rhodophyta, Gracilariales). J. Plant. Sci. 3:1077-1084.
Santoso S, Lestari S, Windyarni D. 2010. Biosorpsi merkuri (Hg) pada leachate
TPA Gunung Tugel menggunakan Sargassum cinereum. J.G. Agardh. Di
dalam RE Prabowo, ER Ardli, MH Sastranegara, W Lestari, G Wijayanti, editor. Biodiversitas dan Bioteknologi Sumberdaya Akuatik. 2010 Juni 26;
Purwokerto, Indonesia:Purwokerto (ID): Universitas Jenderal Soedirman: 441-447.
Simange MS. 2010. Analisis kandungan merkuri (Hg) dan sianida (CN) pada beberapa jenis ikan hasil tangkapan nelayan di Teluk Kao. Halmahera Utara [Tesis]. Bogor. (ID): Institut Pertanian Bogor.
[SNI] Standar Nasional Indonesia. 2009. Batas maksimum cemaran logam berat dalam pangan. Indonesia (ID): BSN
Soriano EM. 2012. Effect of depth on growth and pigment contents of the macroalgae Gracillaria bursapastoris. Revista Brasileira de Farmacognosia Brazilian Journal of Pharmacognosy. 22: 730-735.
Sudarshan S, Seedevi P, Ramasamy SN. 2012. Heavy metal accumulation in seaweed and seagresses along Southeast Coast of India. Journal of Chemical and Pharmaceutical Research. 4(9):4240-4244
Supriyono E, Yosmaniar, Nirmala K, Sukenda. 2013. Toksisitas moluskisida niklosamida terhadap pertumbuhan dan kondisi histopatologi juwana ikan mas (Cyprinus carpio). Jurnal Iktiologi Indonesia. 13(1): 77-84.
Trisnawaty NF, Emiryati, La Ode A. 2013. Hubungan kadar logam berat merkuri (Hg) pada sedimen dengan struktur komunitas makrozoobenthos di perairan Sungai Tahi Ite Kecamatan Rorowatu. Jurnal Mina Laut Indonesia.
3(2):68-80.
Unal D, Isik NO, Sukatar A. (2010) Effects of Chromium VI stress on green alga
Ulva lactuca . Turk J. Biol. 34:119-124.
22
[WWF] World Wide Fund for Nature. 2014. Budidaya rumput laut Gracillaria sp. di tambak. Indonesia. (ID): WWF
Yasuda. 2000. Water pollution control policy and management. Minamata bay, in
Okada M. and SA. Peterson, (Eds.). Japan: The Japanese Experience. 13p.
Yulianto B. 2006. Daya serap rumput laut (Gracillaria sp.) terhadap logam berat
tembaga (Cu) sebagai biofilter. Jurnal Ilmu Kelautan. 11(2):72-78.
Zatnika A. 1997. Profil industri rumput laut Indonesia. Jakarta: Tim Rumput Laut
23
24
Lampiran 1 Morfologi (warna) talus Gracillaria sp. yang terkontaminasi merkuri (Hg)
Hidup Mati
Konsentrasi Berbeda
Lampiran 2 Prosedur analisis kandungan mekuri (Hg) pada Gracillaria sp. dan air media.
A. Prosedur analisis kandungan Hg dalam air preparasi sampel
1. Sampel dihomogenkan dan diambil 100 mL dengan labu takar, tuang dalam erlenmeyer
2. Ditambahkan 5 mL H2SO4 dan 5 mL HNO3
3. Dipanaskan diatas hotplate hingga jernih dan keluar asap putih 4. Didinginkan, disaring dan ditepatkan 100 mL dengan labu takar 5. Dibuat blanko dengan perlakuan sama tanpa sampel
Pembuatan kurva baku dan pembacaan sampel
1. Dipipet 1 mL larutan induk Hg 100 ppm dan dimasukkan dalam labu takar 100 mL, ditepatkan dengan aquadest sampai dengan tanda ( Hg 1000 ppb)
25 3. Dibuat konsentrasi standar dengan rentang (ppb) 0.05 ; 0.1 ; 0.2; 0.4 ; 0.8 ; 1.6 ; 3.2 , dengan cara : dipipet masing-masing (mL) 0.05 ; 0.1 ; 0.2 ; 0.4 ; 0.8 ; 1.6 ; 3.2 dimasukan dalam labu takar 10 mL, ditepatkan 10 mL dengan aquadest, dituang dalam tabung reaksi + KMnO4 0.1 mL+ Hydroxyl-aminehydrochloride
0.1 mL + 0,5 mL SnCl2.2H2O,
4. Sampel diambil 10 mL dengan labu takar, dimasukan dalam tabung reaksi + KMnO4 0.1 mL + Hydroxyl aminehydrochloride 0.1 mL + 0.5 mL SnCl2.
2H2O.
5. Dibaca dengan mecury analyzer
B. Prosedur analisis kandungan Hg dalam tanaman preparasi sampel
1. Sampel ditimbang + 1 gr sampel homogen dalam erlenmeyer 2. Ditambahkan 10 mL HNO3:HCLO4 (1:1)
3. Dipanaskan diatas hotplate hingga jernih dan keluar asap putih 4. Didinginkan, disaring dan ditepatkan 50 mL dengan labu takar 5. Dibuat blanko dengan perlakuan sama tanpa sampel
Pembuatan kurva baku dan pembacaan sampel
1. Dipipet 1 mL larutan induk Hg 100 ppm dan dimasukkan dalam labu takar 100 mL, ditepatkan dengan aquadest sampai dengan tanda ( Hg 1000 ppb)
2. Dipipet 0.1 mL larutan induk Hg 1000 ppb dan dimasukkan dalam labu takar 10 mL, ditepatkan dengan aquadest hingga batas tanda (Hg 10 ppb)
3. Dibuat konsentrasi standar dengan rentang (ppb) 0.05 ; 0.1 ; 0.2; 0.4 ; 0.8 ; 1.6 ;
5. Dibaca dengan mecury analyzer
Lampiran 3 Analisis ragam dan uji lanjut (tukey) daya serap Gracillaria sp.
A. Konsentrasi merkuri (Hg) pada Gracillaria sp.
Sumber
26
0.000001 120866.4 0.000
Uji tukey konsentrasi merkuri (Hg) pada Gracillaria sp.
Waktu P1 (Kontrol) P2 Perlakuan P3 P4
B. Konsentrasi merkuri (Hg) pada media air laut
Sumber
Minggu Perlakuan Error Total
Minggu Perlakuan Error Total
27
Uji tukey konsentrasi merkuri (Hg) pada media air laut
Waktu Perlakuan
Lampiran 4 Analisis ragam dan uji tukey klorofil-a dan fikoeritrin
A. Kandungan klorofil -a pada Gracillaria sp.
Sumber
Uji tukey kandungan klorofil a pada Gracillaria sp.
28
B. Kandungan fikoeritrin pada Gracillaria sp.
Sumber
Minggu Perlakuan Error Total
Uji tukey kandungan fikoeritrin pada Gracillaria sp.