UIN Syarif Hidayatullah Jakarta UIN SYARIF HIDAYATULLAH JAKARTA
UJI TOKSISITAS AKUT GELATIN BABI PADA TIKUS
BETINA GALUR
SPRAGUE DAWLEY
SKRIPSI
ADE RACHMA ISLAMIAH
1112102000037
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
JAKARTA
UIN Syarif Hidayatullah Jakarta UIN SYARIF HIDAYATULLAH JAKARTA
UJI TOKSISITAS AKUT GELATIN BABI PADA TIKUS
BETINA GALUR
SPRAGUE DAWLEY
SKRIPSI
Diajukan sebagai salah satu syarat memperoleh gelar Sarjana Farmasi
ADE RACHMA ISLAMIAH
1112102000037
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
JAKARTA
UIN Syarif Hidayatullah Jakarta ABSTRAK
Nama : Ade Rachma Islamiah Program Studi : Farmasi
Judul Skripsi : Uji Toksisitas Akut Gelatin Babi Pada Tikus Betina Galur
Sprague Dawley
Gelatin babi merupakan salah satu eksipien yang banyak digunakan pada industri farmasi. Berdasarkan tingkat kemurniannya, gelatin babi terbagi menjadi golongan farmasetik dan pro analisis. Adanya perbedaan tingkat kemurnian gelatin babi dapat meningkatkan potensi toksisitas. Tujuan dari penelitian ini adalah menentukan tingkat keamanan dari gelatin babi golongan farmasetik dan pro analisis melalui uji toksisitas akut pada tikus betina Sprague-Dawley dengan metode Up and Down Procedure
(OECD 425). Hewan uji tikus betina galur Sprague Dawley dibagi menjadi kelompok kontrol (akuades ±4 ml), kelompok uji gelatin babi golongan farmasetik dan kelompok uji golongan babi pro analisis. Seluruh hewan uji diamati secara individu untuk melihat adanya perubahan berat badan dan tanda-tanda toksisitas selama 14 hari dan perubahan pada histopatologi hati dan ginjal hewan uji. Hasil dari limit test menunjukkan bahwa nilai LD50 gelatin babi golongan farmasetik ataupun pro analisis adalah >5000
mg/kgBB. Hasil pengamatan menunjukkan tidak ada perubahan bermakna pada berat
badan tikus uji (p≥0,05) dan tidak ada tikus uji yang menunjukkan tanda-tanda toksisitas. Pemeriksan histopatologi menunjukkan bahwa pemberian gelatin babi golongan farmasetik ataupun pro analisis tidak menyebabkan perubahan bermakna
pada histopatologi hati dan ginjal (p≥0,05). Berdasarkan data di atas, gelatin babi
golongan farmasetik ataupun pro analisis bersifat tidak toksik.
UIN Syarif Hidayatullah Jakarta ABSTRACT
Name : Ade Rachma Islamiah
Programme of Study : Pharmacy
Title : Acute Toxicity Study Of Porcine Gelatin in Female
Sprague-Dawley Rats
Porcine gelatin is widely utilized in the pharmaceutical industry as an excipient. Based on the level of purity, porcine gelatin is divided into pharmaceutical grade and pro analysis grade. The different of purity can increase toxicity potent. The present study was aimed to evaluate the safety of porcine gelatin pharmaceutical grade and pro analysis grade by acute oral toxicity study in female Sprague-Dawley rats as per Up and Down Procedure (OECD guideline 425). Female Sprague-Dawley are divided into three groups such as control (aquadest ±4 ml), porcine gelatin pharmaceutical grade and porcine gelatin pro analysis grade. All the animals were individually observed for change in body weight, wellness parameters for 14 days and histopathological effect on liver and kidney of rats. Limit test showed that the porcine gelatin pharmaceutical grade or pro analysis grade LD50 is greater than 5000 mg/kgBW. There were no significant changes were observed in body weight (p≥0,05) and wellness parameters.
Further, histopathological examination showed the porcine gelatin pharmaceutical grade or pro analysis grade did not cause significant change in liver and renal
histopatological (p≥0,05). Overall, the result suggest that the oral administration of
porcine gelatin pharmaceutical grade or pro analysis grade is non toxic.
UIN Syarif Hidayatullah Jakarta KATA PENGANTAR
Alhamdulillahirabbil’alamin, segala puji dan syukur kepada Allah SWT yang telah melimpahkan rahmat, dan hidayah-Nya sehingga penulis dapat menyelesaikan
penelitian dan menyusun skripsi berjudul “Uji Toksisitas Akut Gelatin Babi Pada Tikus Betina Galur Sprague Dawley” dengan baik. Shalawat serta salam senantiasa penulis curahkan kepada Nabi Besar Muhammad SAW beserta keluarga, para sahabat serta para pengikut di jalan yang diridhoi-Nya.
Penulis menyadari bahwa dalam penelitian sampai penyusunan skripsi ini tidak akan terwujud tanpa adanya bantuan, bimbingan, dan dukungan dari berbagai pihak. Oleh karena itu dalam kesempatan ini penulis tidak lupa
mengucapkan terima kasih banyak kepada :
1. Ibu Dr. Nurmeilis, M.Si, Apt selaku Ketua dan Ibu Nelly Suryani, Ph.D, Apt selaku Sekretaris Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan UIN Syarif Hidayatullah Jakarta.
2. Ibu Dr. Azrifitria, M.Si., Apt., dan Zilhadia, M.Si., Apt., selaku pembimbing, yang senantiasa memberikan bimbingan, ilmu, masukan, dukungan, dan semangat kepada penulis.
3. Ibu dr. Dyah Ayu Woro Setyaningrum, M. Biomed, terimakasih telah bersedia memberikan ilmu dan waktu kepada penulis selama penelitian berlangsung 4. Kedua orang tua tercinta Ayahanda Suryadi dan Ibunda Rosnaenah yang
senantiasa memberikan kasih sayang, dukungan baik moril maupun materil, serta doa tiada henti yang selalu menyertai setiap langkah penulis.
5. Kakak dan Adikku Lani Suryani, Yuslam Rochim dan Rizka Amirah serta keluarga besar yang selalu memberikan semangat dan dukungan kepada penulis.
6. Bapak dan Ibu Dosen Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan yang telah memberikan ilmunya kepada penulis.
7. Sahabat terbaik, Nurul Fitri Rukmana yang selalu memberikan semangat, dukungan, doa kepada penulis.
8. Sahabat seperjuangan, Azmi Indillah yang senantiasa menjadi sahabat diskusi, memotivasi dan menemani penulis melewati Up and Down nya penelitian ini. 9. Rekan seperjuangan penulis, Denny Bachtiar, Afina Almas Ghassani, Nita
UIN Syarif Hidayatullah Jakarta 10. Teman-teman yang senantiasa berbagi gelak tawa bersama selama proses
penelitian dan skripsi Nabilah Urwatul, Verona Shaqilla, Anissa Florensia, Fenny Delfiyanti, Zakiyah Zahra, Noni Tri Utami dan Rakha Jati Prasetyo. 11. Kakak-kakak yang senantiasa berbagi pengalaman, ilmu dan waktunya (Kak
aci, Kak eca, Kak Fathiyah, Kak Rian, Kak Rahmi)
12. Laboran Farmasi UIN Syarif Hidayatullah Jakarta, Kak Eris, Kak Tiwi, Kak Walid, Kak Rani, Kak Yaenap, yang membantu penulis selama penelitian. 13. Rekan-rekan pengurus HMPS Farmasi UIN Syarif Hidayatullah Jakarta periode
2014-2015 atas semua pengalaman dan motivasinya kepada penulis.
14. Teman-teman 2012 atas segala bantuan, kebersamaan, motivasi selama pengerjaan skripsi ini maupun selama di bangku perkuliahan.
15. Semua pihak yang telah membantu selama penelitian dan penyelesaian naskah skripsi baik secara langsung maupun tidak langsung yang namanya tidak dapat penulis sebutkan satu persatu.
Penulis menyadari bahwa penyusunan skripsi ini masih belum sempurna dan banyak kekurangan. Oleh karena itu saran serta kritik yang membangun sangat diharapkan. Semoga skripsi ini dapat bermanfaat bagi penulis pada khususnya dan bagi
pembaca pada umumnya. Amin Ya Robbal’alamin.
Jakarta, Juni 2016
UIN Syarif Hidayatullah Jakarta DAFTAR ISI
HALAMAN JUDUL ... ii
HALAMAN PERSYARATAN ORISINILITAS ... iii
HALAMAN PERSETUJUAN PEMBIMBING ... iv
HALAMAN PENGESAHAN ... v
ABSTRAK ... vi
ABSTRACT ... vii
KATA PENGANTAR ... viii
HALAMAN PERSETUJUAN PUBLIKASI KARYA ILMIAH ... x
DAFTAR ISI ... xi
1.4.2 Manfaat Metodologi ... 5
1.4.3 Manfaat Aplikatif ... 5
BAB 2. TINJAUAN PUSTAKA ... 6
2. 1. Eksipien ... 6
2. 2. Gelatin ... 6
2.2.1 Sifat Fisika Kimia Gelatin ... 7
2.2.2 Klasifikasi Gelatin ... 8
2.2.3 Manfaat Gelatin ... 9
2. 3. Toksisitas ... 9
2.5.1.3 Metode Standar OECD 423 ATC ... 14
2.5.1.4 Metode Standar OECD 425 Up and Down Procedure14 2. 6. Penelitian Uji Toksisitas ... 18
2. 7. Pengamatan Tanda Toksisitas Tikus ... 19
2. 8. Efek Toksik Terhadap Organ ... 21
2.8.1 Hati ... 21
UIN Syarif Hidayatullah Jakarta
2. 9. Tinjauan Hewan Uji ... 24
2.9.1 Klasifikasi Tikus Putih... 24
2.9.2 Karakteristik Tikus Betina Sprague-Dawley ... 24
BAB 3. METODE PENELITIAN ... 26
3.1. Tempat dan Waktu Penelitian ... 26
3.2. Alat dan Bahan Penelitian ... 26
3.2.1 Alat Penelitian ... 26
3.2.2 Bahan Penelitian ... 26
3.2.3 Hewan Uji ... 26
3.3 Rancangan Penelitian ... 27
3.3.1 Besar Sampel ... 27
3.3.2 Dosis Perlakuan ... 27
3.4 Prosedur Penelitian ... 28
3.4.1 Penyiapan Larutan Gelatin ... 28
3.4.2 Penyiapan Hewan Uji ... 28
3.4.3 Uji Toksisitas Akut Gelatin Babi ... 28
3.4.4 Pengamatan Toksisitas ... 29
3.4.4.1 Penentuan Nilai LD50 ... 29
3.4.4.2 Pengamatan Berat Badan Tikus ... 29
3.4.4.3 Pengamatan Tanda Toksisitas ... 29
3.4.4.4 Pengamatan Histopatologi Organ Hati dan Ginjal .. 30
3.5 Analisis Data ... 31
BAB IV HASIL DAN PEMBAHASAN ... 32
4.1 Hasil Penelitian ... 32
4.1.1 Penyiapan Bahan Uji ... 32
4.1.2 Penentuan Nilai LD50 ... 33
4.1.3 Hasil Pengukuran Berat Badan Tikus ... 34
4.1.4 Pengamatan Tanda Toksisitas ... 35
4.1.5 Pengamatan Histopatologi ... 36
4.1.5.1 Hati ... 35
4.1.5.2 Ginjal ... 37
4.2 Pembahasan ... 39
BAB V KESIMPULAN DAN SARAN ... 46
5.1 Kesimpulan ... 46
5.2 Saran ... 46
DAFTAR PUSTAKA ... 47
UIN Syarif Hidayatullah Jakarta DAFTAR TABEL
Tabel Halaman
Tabel 2.1 Kriteria Toksisitas Senyawa Berdasarkan GHS ...11
Tabel 2.2 Klasifikasi Toksisitas Akut Loomis ...12
Tabel 2.3 Perbandingan Metode Uji Toksisitas Akut OECD ...17
Tabel 2.4 Data Biologis Tikus ...25
Tabel 3.1 Dosis Perlakuan Pada Tikus ...27
Tabel 3.2 Skoring Derajat Kerusakan Jaringan Hati ...30
Tabel 3.3 Skoring Derajat Kerusakan Jaringan Ginjal...31
Tabel 4.1 Data Respon Hewan Uji Terhadap Dosis ...33
Tabel 4.2 Pengamatan Tanda Toksisitas ...35
Tabel 4.3 Rerata Skoring Histopatologi Jaringan Hati Hewan Uji ...36
Tabel 4.4 Rerata Skoring Histopatologi Jaringan Ginjal Hewan Uji ...37
UIN Syarif Hidayatullah Jakarta DAFTAR GAMBAR
Gambar 2.1 Struktur Kimia Gelatin ... 7
Gambar 2.2 Histologi Hati Normal ... 22
Gambar 2.3 Histologi Ginjal Normal ... 23
Gambar 4.1 Gelatin Babi golongan farmasetik dan pro analisis ... 32
Gambar 4.2 Rerata Berat Badan Tikus Tiap Kelompok ... 34
Gambar 5.1 Serbuk Gelatin Babi Golongan Farmasetik ... 63
Gambar 5.2 Serbuk Gelatin Babi Golongan Pro Analisis ... 63
Gambar 5.3 Proses Penimbangan Serbuk Gelatin Babi ... 63
Gambar 5.4 Proses Pelarutan Gelatin Dengan Akuades Pada Suhu 600C ... 63
Gambar 5.5 Larutan Gelatin Babi Golongan Farmasetik... 63
Gambar 5.6 Larutan Gelatin Babi Golongan Pro Analisis ... 63
Gambar 5.7 Hewan Uji ... 63
Gambar 5.8 Penimbangan Hewan Uji ... 63
Gambar 5.9 Penyondean Larutan Gelatin Babi... 64
Gambar 5.10 Hewan Uji Dibius Dengan Eter ... 64
Gambar 5.11 Pembedahan Hewan Uji ... 64
UIN Syarif Hidayatullah Jakarta DAFTAR LAMPIRAN
Lampiran 1. Surat Keterangan Sehat Hewan Uji ... 56
Lampiran 2. Surat Keterangan Lolos Kaji Etik... 57
Lampiran 3. Alur Penelitian ... 58
Lampiran 4. Rancangan Uji Toksisitas Akut Gelatin Babi dengan Metode Up and Down Procedure ... 60
Lampiran 5.Perhitungan Dosis Gelatin Babi ... 61
Lampiran 6. Penentuan Nilai LD50 pada Limit Test ... 62
Lampiran 7. Gambar Kegiatan Penelitian ... 63
Lampiran 8. Nilai LD50 Bahan Uji ... 65
Lampiran 9. Data Berat Badan Tikus... 67
Lampiran 10. Analisis Data Bobot Tikus ... 68
Lampiran 11. Hasil Pengamatan Tanda-tanda Toksisitas ... 71
Lampiran 12. Pengamatan Tanda Toksisitas ... 72
Lampiran 13. Gambar Histopatologi Hati Tikus ... 73
Lampiran 14. Skoring Derajat Kerusakan Histopatologi Hati Tikus ... 75
Lampiran 15. Analisis Skoring Derajat Kerusakan Histopatologi Hati Tikus ... 76
Lampiran 16. Gambar Histopatologi Ginjal Tikus ... 79
Lampiran 17. . Skoring Derajat Kerusakan Histopatologi Ginjal Tikus ... 81
UIN Syarif Hidayatullah Jakarta BAB I
PENDAHULUAN 1.1 Latar Belakang
Menurut Undang-undang Republik Indonesia No. 36 Tahun 2009 tentang kesehatan, yang termasuk ke dalam sediaan farmasi adalah obat dan bahan obat. Obat merupakan bahan atau campuran bahan yang digunakan untuk mempengaruhi sistem fisiologi atau keadaan patologi dalam rangka penetapan diagnosis, pencegahan, penyembuhan, pemulihan, peningkatan, kesehatan dan kontrasepsi (Departemen Kesehatan RI, 2005). Kandungan obat dapat berupa bahan aktif tunggal atau campuran bahan aktif dengan eksipien.
Eksipien adalah bahan tambahan pada formulasi sediaan yang berfungsi untuk menjaga stabilitas obat atau meningkatkan bioavailabilitas zat aktif (Pifferi, et al., 2002). Karakteristik yang ideal bagi eksipien yang digunakan adalah stabil secara kimia, bersifat inert, ekonomis dan tidak toksik (Chaudhari, et al., 2012). Sifat eksipien yang dianggap inert menjadikan profil keamanannya jarang diperhatikan (Pifferi et al.,2002). Padahal, eksipien yang terdapat dalam obat juga akan dicerna oleh tubuh. Beberapa eksipien dilaporkan dapat menimbulkan efek toksik, yakni pemberian
UIN Syarif Hidayatullah Jakarta Profil keamanan eksipien dapat ditentukan melalui uji toksisitas akut. Uji toksisitas akut adalah suatu pengujian untuk mendeteksi efek toksik yang muncul setelah pemberian sediaan uji dalam dosis tunggal pada hewan uji (BPOM, 2014). Pada uji toksisitas akut, dilakukan pengamatan hewan uji selama 24 jam dan dilanjutkan selama 7-14 hari. Tujuan uji toksisitas akut adalah untuk menentukan nilai Lethal Dose
50 (LD50), yaitu dosis tunggal suatu senyawa yang secara statistik diperkirakan akan
membunuh 50% hewan percobaan (Harmita, 2006). Selain itu, uji toksisitas akut juga bertujuan untuk mengamati berbagai gejala yang dapat timbul karena efek toksik dari senyawa uji (Wahyono et al., 2006). Hewan uji yang digunakan dapat berupa tikus atau mencit betina yang telah diaklimatisasi terlebih dahulu (Organisation for Economic Co-operation and Development, 2008).
Menurut Handbook Of Pharmaceutical Excipient (2006), salah satu eksipien yang banyak digunakan pada sediaan farmasi adalah gelatin. Gelatin merupakan protein yang dihasilkan dari hidrolisis jaringan kolagen hewan yang terdapat pada tulang, kulit dan jaringan ikat (Gimenez et al., 2005). Pada industri farmasi, gelatin umum digunakan sebagai bahan penyusun kapsul keras dan lunak, pengikat pada tablet,
pelapis pada tablet, stabilizer pada vaksin dan pembawa pada sediaan suppositoria. Selain industri farmasi, gelatin juga banyak digunakan pada bidang pangan, kedokteran, kosmetik dan industri fotografi. Pada industri pangan, gelatin dapat
digunakan sebagai pembentuk gel, agen pengikat dan pengemulsi (Gelatin Manufacture Institute Of America, 2012).
Bahan baku gelatin dapat berasal dari mamalia (kulit sapi, tulang sapi, kulit babi) maupun ikan. Gelatin yang beredar di pasaran umumnya berasal dari kulit babi atau sapi (Pranoto et al., 2011) dan diimpor dari negara-negara di Eropa atau Amerika. Produsen Eropa pada tahun 2011 menyatakan bahwa bahan baku gelatin adalah kulit babi sebanyak 80%, kulit sapi 15% dan sebanyak 5% sisanya dapat berasal dari babi, tulang sapi, unggas dan ikan (Jamaludin et al., 2011).
Bagi muslim, penggunaan gelatin babi adalah hal yang haram. Penelitian Choe,
UIN Syarif Hidayatullah Jakarta obesitas, dislipidemia dan kanker. Menurut Sheikhi dan Firoozabadi (2015), pada babi terdapat berbagai bibit penyakit, seperti cacing pita Taenia solium, bakteri Tuberculosis (TBC) dan cacing usus Fasciolopis buski. DNA babi dan manusia juga diketahui memiliki kemiripan sehingga sifat-sifat buruk babi dapat menular ke manusia.
Gelatin sebagai eksipien terdiri dari golongan farmasetik dan non-farmasetik yang dibedakan berdasarkan sifat fisika, kimia dan tingkat kemurniannya. Eksipien golongan farmasetik adalah senyawa atau bahan kimia yang memiliki kemurnian sesuai dengan standar yang tertulis di US Pharmacopeia (USP), British Pharmacopeia (BP) dan Europe Pharmacopiea (Ph.Eur). Sedangkan, golongan non-farmasetik adalah senyawa kimia dengan tingkat kemurnian lebih tinggi atau lebih rendah dibandingkan golongan farmasetik. Golongan non-farmasetik terdiri dari golongan teknis, pro analisis, reagen, food grade dan laboratorium. Tingkat kemurnian gelatin dapat mempengaruhi efek toksik suatu senyawa. Pemberian senyawa kimia golongan non-farmasetik pada hewan uji dilaporkan dapat menimbulkan efek toksik (Institutional Animal Care Use Committe, 2015).
Menurut Handbook Of Pharmaceutical Excipient (2009), gelatin babi yang beredar di pasaran harus memiliki nilai LD50 >5000 mg/kg. Namun, produk gelatin
babi yang beredar di pasaran tidak melampirkan data toksisitasnya. Penelitian tentang
uji toksisitas akut gelatin babi juga belum pernah dipublikasikan. Padahal penggunaan gelatin sebagai pembentuk kapsul dilaporkan dapat menimbulkan efek toksik berupa iritasi esophagus. Selain itu, gelatin yang digunakan sebagai eksipien pada sediaan parenteral diketahui dapat menimbulkan reaksi hipersensitivitas berupa syok anafilaktik (Rowe, Sheskey dan Quinn, 2009). Oleh karena itu, uji toksisitas akut gelatin babi menjadi penting untuk mengetahui profil keamanan gelatin babi.
Pada penelitian ini dilakukan pengujian toksisitas akut gelatin babi golongan farmasetik dan golongan pro analisis dengan menggunakan tikus betina sebagai hewan uji. Metode yang digunakan pada penelitian ini adalah metode Up and Down Procedure (UDP). UDP merupakan metode yang efisien dalam menentukan nilai LD50
UIN Syarif Hidayatullah Jakarta penggunaan hewan uji (Botham, 2003). Adapun parameter pengujiannya, meliputi penentuan nilai LD50, pengamatan berat badan tikus, gejala toksisitas dan histopatologi
organ hati dan ginjal hewan uji. Bahan uji gelatin diberikan secara oral untuk mendekati dengan proses pencernaan dalam tubuh manusia.
1.2 Rumusan Masalah
Berdasarkan latar belakang yang telah dipaparkan diatas, maka dapat diambil rumusan masalah sebagai berikut:
a. Hasil penelitian sebelumnya menyatakan bahwa konsumsi produk babi dapat
menularkan berbagai bibit penyakit, seperti bakteri TBC, cacing pita Taenia solium dan meningkatkan resiko timbulnya penyakti kardiovaskular.
b. Konsumsi produk babi merupakan hal yang haram bagi muslim
c. Gelatin babi merupakan protein yang dihasilkan dari proses hidrolisis jaringan
kolagen babi.
d. Nilai LD50 gelatin babi golongan farmasetik dan pro analisis belum pernah
diteliti sebelumnya.
1.3 Tujuan Penelitian 1.3.1 Tujuan Umum
Penelitian ini bertujuan untuk mengamati efek toksisitas akut gelatin babi golongan farmasetik dan golongan pro analisis yang diukur dengan LD50.
1.3.2 Tujuan Khusus
a. Mengetahui nilai LD50 gelatin babi golongan farmasetik dan golongan pro
analisis.
b. Mengamati tanda toksisitas yang dapat timbul akibat efek toksik setelah pemberian gelatin babi golongan farmasetik dan golongan pro analisis.
UIN Syarif Hidayatullah Jakarta 1.4 Manfaat Penelitian
1.4.1 Manfaat Teoritis
Hasil penelitian ini diharapkan dapat menambah khasanah ilmu pengetahuan tentang uji toksisitas dan tingkat keamanan gelatin babi golongan farmasetik ataupun pro analisis yang sering digunakan sebagai eksipien pada bidang farmasi.
1.4.2 Manfaat Metodologi
Metode yang digunakan pada penelitian ini adalah Up and Down Procedure
(UDP) dan diharapkan dapat dijadikan referensi untuk diaplikasikan pada penelitian uji toksisitas lainnya.
1.4.3 Manfaat Aplikatif
UIN Syarif Hidayatullah Jakarta BAB II
TINJAUAN PUSTAKA 2.1 Eksipien
Menurut International Pharmaceutical Excipients Council Amerika dan Eropa, eksipien adalah substansi selain zat aktif yang terdapat pada sediaan farmasi. Penggunaan eksipien pada sediaan farmasi berfungsi untuk mempermudah proses produksi, menjaga stabilitas sediaan selama penyimpanan dan meningkatkan bioavaibilitas zat aktif (Blecher, 1995). Selain itu, penambahan eksipien ke dalam sediaan farmasi bertujuan untuk menjaga pH pada formula larutan, menjaga reologi sediaan semisolid, pengikat dan penghancur pada tablet, agen pengemulsi, antioksidan, alasan estetika dan pengisi pada sediaan dengan dosis zat aktif yang kecil (Fathima, et al., 2011). Karakteristik yang ideal bagi eksipien yang digunakan adalah stabil secara kimia, bersifat inert, ekonomis dan tidak toksik (Chaudhari, et al., 2012). Salah satu eksipien yang banyak dimanfaatkan pada industri farmasi adalah gelatin.
2.2 Gelatin
Gelatin adalah protein yang diperoleh melalui hidrolisis parsial jaringan kolagen hewan yang terdapat pada bagian kulit dan tulang (Gimenez et al., 2005). Komponen dasar penyusun gelatin terdiri dari 50,5% karbon, 6.8% hidrogen, 17% nitrogen dan 25.2% oksigen. Berat molekul gelatin berkisar antara 15.000-400.000.
Sebagai produk turunan protein, gelatin dapat dihidrolisis oleh enzim proteolitik dan menghasilkan komponen peptida atau asam amino (GMIA, 2012).
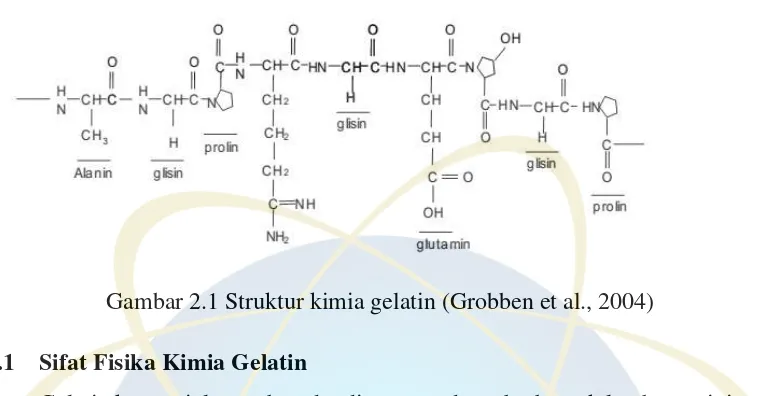
UIN Syarif Hidayatullah Jakarta Gambar 2.1 Struktur kimia gelatin (Grobben et al., 2004)
2.2.1 Sifat Fisika Kimia Gelatin
Gelatin komersial yang beredar di pasaran dapat berbentuk lembaran tipis yang transparan atau granul transparan, berwarna kuning terang hingga kuning pucat, tidak berbau dan tidak berasa (Irwandi, et al., 2009). Kelembaban yang dimiliki oleh gelatin berkisar antara 8-13% dengan densitas relatifnya 1,3-1,4 (GMIA, 2012). Sifat fisika dan kimia gelatin dipengaruhi oleh sumber hewan, jenis hewan, umur hewan, tipe kolagen, karakteristik kolagen, metode pembuatan, temperatur, waktu dan pH selama proses produksi (Kolodziejska et al., 2008).
Menurut Handbook Of Pharmaceutical Excipent (2009), gelatin praktis tidak larut dalam aseton, kloroform, etanol (95%), eter dan metanol. Namun, larut dalam gliserol, propilen glikol asam dan basa lemah. Penambahan asam dan basa kuat dapat mengendapkan gelatin. Gelatin larut dalam air panas dan akan membentuk gel pada suhu 35-400C. Sementara, pada suhu lebih besar dari 400C sistem berada dalam keadaan sol yang bersifat reversibel terhadap pemanasan. Dalam air, gelatin akan mengembang dan melunak, secara perlahan akan menyerap air sebanyak 5-10 kali bobotnya. Larutan gelatin yang steril bila disimpan dalam suhu dingin akan stabil. Tetapi pada suhu tinggi larutan gelatin akan rentan terhadap reaksi hidrolisis.
Menurut Handbook Of Pharmaceutical Excipent (2009), karakteristik gelatin yang umum dimanfaatkan sebagai eksipien adalah kemampuan gelatin mengembang
UIN Syarif Hidayatullah Jakarta tergantung pada konsentrasi gelatin, kekuatan intrinsik dari gelatin, pH, suhu, dan adanya zat tambahan. Kekuatan instrinsik gelatin merupakan fungsi dari struktur dan massa molekul (GMIA, 2012).
Gelatin merupakan senyawa amfoter, dimana titik isoelektrik gelatin tipe A berada diantara pH 7-9 dan titik isoelektrik gelatin tipe B berada pada pH 4,7-5,4. Perubahan pH yang ekstrim dan adanya enzim proteolitik karena kontaminasi mikroorganisme dapat menyebabkan degradasi pada gelatin. Sifat fisika dan kimia gelatin dapat berubah dengan adanya modifikasi struktur gelatin atau reaksi kimia, meliputi seperti asilasi, esterifikasi, deaminasi, cross-linking dan polimerisasi, serta reaksi sederhana dengan asam dan basa. Viskositas larutan gelatin akan sebanding dengan jumlah gelatin yang digunakan (GMIA, 2012).
Terdapat 2 tipe gelatin komersial di pasaran, yaitu gelatin tipe A yang diproduksi melalui hidrolisis asam dan gelatin tipe B yang diproduksi melalui hidrolisis basa. Sifat fisika dan kimia gelatin tipe A dan tipe B tidak banyak berbeda. Perbedaan gelatin tipe A dan tipe B berada pada asam amino penyusunnya. Gelatin tipe A memiliki kandungan glisin dan prolin yang lebih besar dibandingkan gelatin tipe B.
Selain itu, asam amino yang bersifat polar seperti asam aspartat, asam glutamat dan arginin juga lebih banyak terdapat pada gelatin tipe A (Hermanto, et al., 2013).
2.2.2 Klasifikasi Gelatin
Berdasarkan proses produksinya, gelatin dibagi menjadi tipe A dan tipe B. Dalam pembuatan gelatin tipe A, bahan baku direndam dalam larutan asam, sehingga proses ini disebut juga dengan proses asam. Sedangkan pada gelatin tipe B, bahan baku direndam dalam larutan basa dan disebut juga proses basa. Bahan baku gelatin tipe A umumnya berasal dari kulit babi dan bahan baku gelatin tipe B berasal dari tulang dan kulit jangat sapi (Utama, 1997). Gelatin tipe A dibuat dengan menggunakan larutan asam klorida atau asam sulfat (Rachmawati et al., 2011). Sedangkan, gelatin tipe B dapat diproduksi dengan menggunakan larutan basa, seperti air kapur (Poppe, 1992).
UIN Syarif Hidayatullah Jakarta FDA dan tingkat kemurniannya sesuai dengan persyaratan pada USP, BP dan Ph.Eur. Gelatin yang digunakan pada produksi obat adalah gelatin golongan farmasetik (European Pharmacopeia). Gelatin golongan non-farmasetik terbagi menjadi beberapa jenis, salah satunya adalah gelatin pro analisis yang memiliki tingkat kemurnian 99,9%. Pada bidang farmasi, gelatin pro analisis digunakan untuk kebutuhan analisis.
2.2.3 Manfaat Gelatin (GMIA, 2012)
Kemampuan gelatin untuk mengembang dan membentuk gel menjadikan gelatin digunakan secara luas, baik dalam bidang farmasi, pangan ataupun kosmetik. Pada bidang farmasi, gelatin merupakan bahan utama penyusun cangkang kapsul, pengikat pada tablet, penyalut tablet, eksipien pada supposituria dan media untuk pertumbuhan bakteri. Salah satu pemanfaatan gelatin pada bidang farmasi adalah penggunaan gelatin yang berasal dari kulit babi sebagai stabilizer vaksin. Stabilizer
pada vaksin berfungsi untuk menjaga stabilitas vaksin selama penyimpanan sehingga tetap aman dan efektif saat digunakan oleh pasien. Gelatin yang digunakan pada vaksin harus memiliki kemurnian yang tinggi. Penggunaan gelatin tipe lain sebagai eksipien pada vaksin dilaporkan membutuhkan waktu pengembangan yang lama untuk menilai
efektifitas dan keamanannya (Public Health England, 2015).
Pada bidang pangan, gelatin dimanfaatkan untuk membentuk lapisan film pada buah, membentuk gel pada makanan, sebagai campuran pada bubuk agar untuk
meningkatkan ketebalan agar (thickener), memperbaiki tekstur dan konsistensi produk susu. Kemampuan gelatin berperan sebagai emulgator juga dimanfaatkan untuk menjaga stabilitas emulsi pada produk sampo, penyegar, krim, sabun, lipstick, cat kuku (Hastuti,2007).
2.3 Toksisitas
UIN Syarif Hidayatullah Jakarta tersebut, kondisi bioorganisme, dan bentuk efek yang ditimbulkan (Wirasuta et al., 2007).
Pemaparan senyawa kimia terhadap tubuh merupakan hal yang sulit dihindari. Evaluasi toksisitas suatu senyawa perlu dilakukan untuk menentukan nilai pemaparan senyawa kimia yang dapat menimbulkan efek berbahaya (Mansuroh, 2013). Salah satu mekanisme evaluasinya adalah melalui uji toksisitas.
2.4 Uji Toksisitas
Uji toksisitas adalah uji untuk mendeteksi efek toksik yang dapat ditimbulkan oleh suatu zat pada sistem biologi. Pada uji toksisitas akan dihasilkan data berupa dosis-respon dari sediaan uji. Data yang diperoleh dapat digunakan untuk memberi informasi mengenai derajat bahaya sediaan uji tersebut bila terjadi pemaparan pada manusia (BPOM, 2014).
Data toksisitas yang ideal didapatkan dari uji toksisitas pada manusia. Adanya keterbatasan etik membuat uji toksisitas tidak dapat dilakukan pada manusia. Uji toksisitas umumnya dilakukan pada hewan atau sel kultur. Hasil uji toksisitas dapat digunakan untuk mengetahui tingkat toksisitas suatu senyawa, efek samping yang dapat ditimbulkan oleh suatu senyawa dan batasan maksimum penggunaan suatu senyawa (Hodgson, et al., 2000).
Pengujian toksisitas terdiri atas dua jenis, yaitu uji toksisitas umum dan uji toksisitas khusus. Uji toksisitas umum dirancang untuk mengevaluasi keseluruhan efek yang ditimbulkan oleh obat pada hewan uji. Berdasarkan waktu perlakuan, uji toksisitas umum terbagi menjadi uji toksisitas akut, subkronis dan kronis. Sedangkan, uji toksisitas khusus dirancang untuk mengevaluasi dengan rinci tipe toksisitas secara khusus, seperti uji teratogenik, uji mutagenik, dan uji karsinogenik (Ningrum, 2012).
2.5 Uji Toksisitas Akut Oral
UIN Syarif Hidayatullah Jakarta diberikan secara oral dalam dosis tunggal atau dosis berulang yang diberikan dalam waktu kurang dari 24 jam. Setelah pemberian sediaan uji, dilakukan pengamatan terhadap adanya efek toksik dan kematian. Hewan yang mati selama percobaan akan dibedah untuk melihat tanda toksisitas pada histopatologi organ. Sedangkan, hewan uji yang hidup sampai akhir percobaan akan diamati untuk melihat adanya gejala-gejala toksisitas dan diterminasi pada akhir uji (BPOM, 2014). Pengamatan tanda toksisitas dan kematian dilakukan setiap 30 menit selama 4 jam dan dilanjutkan selama 14 hari (OECD, 2008). Uji toksisitas akut dilakukan untuk mengetahui profil keamanan suatu senyawa, menentukan klasifikasi toksisitas suatu senyawa, dan estimasi nilai LD50
(Hau et al., 2003).
Hasil yang bisa didapatkan dari uji toksisitas akut adalah nilai LD50 senyawa
uji (Gupta et al., 2012). LD50 adalah dosis tunggal suatu senyawa yang secara statistik
diperkirakan akan membunuh 50% hewan percobaan (Harmita, 2006). Penentuan LD50
merupakan langkah awal yang digunakan untuk menilai toksisitas dan keamanan senyawa uji.
Toksisitas suatu senyawa dapat diklasifikasikan berdasarkan kategori GHS (Globally Harmonised Classification System for Chemical Substances and Mixtures) yang tercantum dalam Thirteenth Addendum to The OECD Guidelinesfor The Testing of Chemicals (2001). Klasifikasi toksisitas senyawa berdasarkan GHS dapat dilihat
pada tabel 2.1
Tabel 2.1 Kriteria toksisitas senyawa berdasarkan GHS
TOKSISITAS AKUT ORAL
Kategori 1 Kategori 2 Kategori 3 Kategori 4 Kategori 5
LD50 Oral ≤ 5 mg/kg
Istilah Berbahaya Berbahaya Berbahaya Peringatan Peringatan
UIN Syarif Hidayatullah Jakarta Sistem klasifikasi toksisitas lainnya adalah klasifikasi toksisitas Loomis (1978). Menurut Loomis (1978), potensi toksisitas akut suatu senyata uji dapat digolongkan menjadi beberapa kelas, seperti yang terlihat pada tabel 2.2
Tabel 2.2 Klasifikasi Toksisitas Akut Loomis (1978)
No. Kelas LD50 (mg/kgBB)
1 Luar biasa toksik 1 atau kurang
2 Sangat toksik 1-50
3 Cukup toksik 50-500
4 Sedikit toksik 500-5000 5 Praktis tidak toksik 5000-15000
6 Relatif kurang berbahaya Lebih dari 15000
2.5.1 Penentuan Nilai LD50
Panduan uji toksisitas akut dari OECD (Organisation for Economic Co-operation and Development) dilakukan dengan memberikan dosis tunggal sampel uji secara oral kepada hewan uji berusia 8-12 minggu. Pengamatan jangka pendek terhadap hewan uji dilakukan setiap 30 menit pada 4 jam awal setelah pemberian bahan
uji dan dilanjutkan setiap harinya selama 14 hari yang meliputi pengamatan adanya tanda dan gejala toksisitas, penimbangan berat badan. Berat hewan uji yang digunakan harus dalam interval ±20% dari berat rata-rata semua hewan. Adapun metode uji toksisitas akut oral yang telah dipublikasi oleh OECD adalah panduan 401, 420, 423 dan 425. Masing-masing metode yang dipublikasikan oleh OECD memiliki kelebihan dan keterbatasan (Sitzel, et al., 1999). Berikut penjabaran masing-masing metode uji toksisitas akut oral OECD:
2.5.1.1 Metode Standar OECD 401 Acute Oral Toxicity (AOT)
UIN Syarif Hidayatullah Jakarta Setiap kelompok terdiri dari 5 ekor hewan uji yang hanya menerima satu dosis saja. Pemberian dosis dilakukan secara oral dan dengan dosis bertingkat antar kelompok. Setelah uji selesai, dilakukan uji kembali dengan menggunakan hewan uji dari jenis kelamin berbeda. Hewan uji yang digunakan adalah tikus atau mencit (rodentia) dengan jenis kelamin yang sama (OECD, 1987; Sitzel&Carr 1999).
Penentuan LD50 didasarkan pada dosis yang dapat menyebabkan kematian pada
50% hewan uji. Metode penentuan LD50 mengikuti metode dari Bliss, Litchifield, &
Wilcoxon, Finney, Weil, Thompson, maupun Miller & Tainter. Kurva dosis respon dapat dilinearkan dengan persen respon untuk log dosis ke dalam grafik probit.
Metode uji toksisitas akut oral OECD 401 sudah tidak digunakan sejak Desember 2002 karena metode ini menggunakan banyak hewan uji (Schelde, et al., 2005)
2.5.1.2 Metode Standar OECD 420 Fixed Dose Procedure (FDP)
Metode OECD 420 Fixed Dose Procedure (FDP) pertama kali diusulkan oleh
British Toxicology Society pada tahun 1984. Tahun 2001 OECD secara resmi mempublikasikan metode 420 sebagai pengganti metode OECD 401. Tujuan pengembangan metode ini untuk mengurangi penggunaan hewan uji dan menghindari kematian hewan uji sebagai titik akhir dari uji toksisitas (OECD, 2001 Sitzel&Carr
1999).
Prinsip uji toksisitas akut oral OECD 420 adalah mengelompokkan hewan uji dengan jenis kelamin yang sama ke dalam beberapa kelompok dosis yang telah ditetapkan yaitu 5, 50, 300 dan 2000 mg/kgBB. Setiap kelompok terdiri dari 5 ekor hewan uji. Hewan uji yang digunakan dapat berupa tikus atau mencit (rodentia) dengan jenis kelamin betina. Penggunaan hewan uji jantan tidak direkomendasikan karena beberapa penelitian menyatakan bahwa hewan uji betina lebih sensitif (OECD, 2001). Sebelum dilakukan main test, dilakukan uji pendahuluan terlebih dahulu untuk menentukan dosis awal yang akan diberikan kepada hewan uji.
Nilai LD50 yang dihasilkan dari metode OECD 420 berupa suatu rentang dosis,
UIN Syarif Hidayatullah Jakarta dapat dikelompokkan sesuai dengan klasifikasi dari GHS (Globally Harmonized System).
2.5.1.3 Metode Standar OECD 423 Acute Toxic Class Method (ATC)
Tahun 2001, OECD juga mempublikasikan metode standar OECD 423 sebagai alternatif metode OECD 401 (Schelde, et al., 2005). Pada metode OECD 423, hewan uji yang digunakan lebih sedikit (3 hewan uji dengan jenis kelamin yang sama tiap tahap uji) dan titik akhir uji ditentukan berdasarkan kematian hewan uji.
Metode OECD 423 terdiri dari limit test dan main test. Pada limit test dilakukan penentuan dosis awal dengan menggunakan satu hewan uji pada tiap dosis. Dosis awal yang diberikan merupakan dosis dibawah estimasi nilai LD50, namun menimbulkan
gejala toksisitas pada hewan uji. Pada main test dosis diberikan secara bertahap dengan menggunakan 3 hewan uji untuk masing-masing kelompok dosis.. Pemberian dosis berikutnya pada hewan uji didasarkan pada respon fisiologi hewan uji terhadap dosis awal. Jika jumlah hewan uji yang mati lebih dari satu, maka dosis untuk uji berikutnya diturunkan, begitupun sebaliknya (OECD, 2001c).
Dosis yang diberikan sama dengan dosis pada pedoman OECD 420 yaitu 5, 50, 300 dan 2000 mg/kgBB. Nilai LD50 yang dihasilkan juga berupa suatu rentang nilai
dosis. Perbedaan metode OECD 420 dan 423 terletak pada jumlah hewan uji yang
digunakan untuk masing-masing kelompok dosis.
2.5.1.4 Metode Standar OECD 425 Up and Down Procedure (UDP)
Metode UDP pertama kali diusulkan oleh Bruce pada tahun 1985 dan dipublikasikan oleh OECD pada tahun 2001. Metode ini terdiri dari limit test dan main test. Limit test dilakukan ketika diketahui bahwa senyawa uji memiliki toksisitas yang rendah. Sedangkan, main test dilakukan untuk senyawa uji yang diduga toksik atau tidak memiliki informasi toksisitas (OECD, 2008).
UIN Syarif Hidayatullah Jakarta dan Quinn, 2006). Limit test dapat terdiri dari 3 termin. Pada termin pertama limit test,
digunakan satu hewan uji terlebih dahulu untuk diberi dosis 5000 mg/kgBB. Jika hewan uji tersebut mati, maka dilakukan main test. Sedangkan, jika hewan uji tersebut hidup maka dilakukan limit test untuk termin kedua menggunakan 2 hewan uji lainnya dengan dosis yang sama. Jika kedua hewan uji pada termin ke-2 limit test mati, maka uji dilanjutkan ke main test. Namun, jika terdapat salah satu hewan uji yang hidup pada termin kedua, maka limit test dilanjutkan ke termin ke-3 dengan menggunakan 2 hewan uji lainnya. Apabila hasil dari ketiga termin limit test menunjukkan adanya kematian hanya pada 2 ekor tikus, maka limit test dapat dihentikan dan disimpulkan bahwa nilai LD50 gelatin babi adalah >5000 mg/kgBB. Sedangkan jika terdapat lebih dari 2 tikus
yang mati, maka pengujian harus dilanjutkan ke main test (OECD, 2008). Penentuan nilai LD50 melalui limit test dapat dilihat pada lampiran 6.
Pada main test, pemberian dosis dilakukan secara bertahap. Dosis awal yang diberikan merupakan dosis dibawah estimasi nilai LD50. Pemberian dosis berikutnya
bergantung pada respon fisiologis hewan uji pertama. Jika hewan uji pertama bertahan hidup, maka dosis berikutnya ditingkatkan. Sedangkan jika hewan uji pertama mati,
maka dosis berikutnya diturunkan. Peningkatan atau penurunan dosis sesuai dengan faktor 3,2. Adapun urutan dosis yang dianjurkan oleh OECD adalah 5,5; 17,5; 55; 175; 550; 1750; 5000 mg/kgBB (OECD, 2001). Pengamatan tanda, gejala toksisitas dan
kematian hewan uji dilakukan setiap 30 menit selama 4 jam setelah pemberian dosis dan dilanjutkan setiap hari selama 14 hari. Hewan uji yang digunakan dapat berupa tikus atau mencit betina. Hewan uji jantan tidak direkomendasikan karena kurang sensitif jika dibandingkan hewan uji betina (OECD, 2001). Uji dihentikan bila memenuhi kriteria:
a. Tiga hewan uji hidup pada batas atas uji;
b. Lima pembalikan muncul pada 6 hewan yang diujikan. Dimulai dari dosis
UIN Syarif Hidayatullah Jakarta c. Jika ditemukan 3 kematian pada 4 konsentrasi yang sama. (OECD, 2001)
Penentuan LD50 senyawa uji dilakukan dengan menggunakan perangkat lunak
AOT425StatPgm (Acute Oral Toxicity Guideline 425 Statistical Programme). Data yang dimasukkan ke dalam program AOT425StatPgm adalah dosis dan respon hewan uji (mati/hidup). Prosedur penghitungan LD50 dengan AOT425StatPgm berlangsung
secara bertahap. Pengguna dapat memasukkan hasil uji untuk hewan pertama, menyimpan data dan memasukkan hasil uji untuk hewan kedua pada hari yang berbeda. Jika seluruh hasil uji sudah dimasukkan ke dalam program, maka AOT425StatPgm akan menggunakan hasil tersebut untuk menghitung nilai LD50. Program
AOT425StatPgm dapat menghitung dosis rekomendasi untuk hewan uji berikutnya, menentukan waktu penghentian pemberian dosis dan estimasi statistik LD50 (Westat
UIN Syarif Hidayatullah Jakarta Tabel 2.3 Perbandingan Metode Uji Toksisitas Akut Oral OECD
Kriteria OECD 401 “AOT” OECD 420 “FDP” OECD 423 “ATC” OECD 425 “UDP”
Prinsip Pemberian dosis tunggal senyawa uji secara oral pada tikus atau mencit dengan pengamatan tanda dan gejala
toksisitas, berat badan dan kematian hewan uji selama 14 hari Jenis kelamin
hewan uji
Terdapat kelompok hewan uji jantan dan kelompok
hewan uji betina
Hewan uji betina Hewan uji betina Hewan uji betina
Jumlah hewan uji
Minimal 20. 5 hewan uji untuk tiap kelompok dosis
Maksimal 2000 mg/kg bb Kelompok dosis 5, 50, 300, dan 2000
Pengamatan Perubahan berat badan, gejala toksisitas, histopatologi
Output Rentang perkiraan LD50 dan tanda-tanda toksisitas akut Estimasi interval nilai LD50 dan
tanda-tanda toksisitas akut
Masa berlaku metode
UIN Syarif Hidayatullah Jakarta 2.6 Penelitian Uji Toksisitas
Uji toksisitas umumnya dilakukan untuk mengetahui efek toksik yang dapat ditimbulkan oleh suatu ekstrak. Pada tahun 2009, Adeneye melakukan penelitian uji toksisitas akut ekstrak air biji Hunteria umbellata. Metode yang digunakan adalah Up and Down Procedure (UDP) dari protokol OECD 425. Hewan uji yang digunakan adalah 20 ekor tikus betina galur Wistar dengan usia 10-12 minggu dan interval berat badannya 110-140 g. Tahapan uji yang dilakukan terdiri dari limit test dengan dosis 2000 mg/kgBB dan dilanjutkan dengan main test menggunakan dosis 175; 550; 2000 mg/kg. Pada penelitian Adeneye (2009), uji toksisitas akut ditentukan melalui nilai LD50 ekstrak yang dihitung dengan menggunakan software AOT425StatPgm. Hasil
penelitian melaporkan nilai LD50 ekstrak air biji Hunteria umbellata adalah 1020
mg/kgBB (sedikit toksik).
Penelitian uji toksisitas akut dengan metode Up and Down Procedure (UDP) dari protokol OECD 425 juga dilakukan oleh Mohd Saleh (2012). Pada penelitian tersebut dilakukan uji toksisitas akut ekstrak air daun kratom terhadap tikus galur
Sprague Dawley. Sebelum pemberian ekstrak, hewan uji dipuasakan dan ditimbang
berat badannya. Dosis yang digunakan adalah 175, 500, 2000 mg/kgBB dan diberikan secara oral dalam bentuk tunggal.
Hasil uji toksisitas ekstrak daun kratom tidak menunjukkan adanya perubahan
signifikan pada berat badan, konsumsi makanan dan minuman tikus uji. Namun, pada pemeriksaan biokimia darah hewan uji melaporkan adanya penurunan kadar hemoglobin korpuskular, albumin, kalsium dan kolesterol. Pengamatan histopatologi organ hati menunjukkan adanya steatosis (ST) pada beberapa jaringan hati tikus uji betina dan jantan. Pemberian ekstrak kratom dengan dosis 2000 mg/kgBB diketahui dapat menyebabkan nekrosis sentrilobular pada jaringan hati tikus jantan. Ekstrak air daun kratom tidak menimbulkan kematian pada hewan uji dan diklasifikasikan sebagai senyawa agak sedikit toksik.
UIN Syarif Hidayatullah Jakarta uji yang digunakan adalah tikus putih betina dengan berat 150-180 gram. Pada penelitian tersebut dilakukan main test dengan dosis 175, 550 dan 2000 mg/kgBB. Observasi tanda toksisitas dilakukan selama 14 hari meliputi adanya perubahan pada bulu dan kulit, tremor, konvulsi, salivasi, lakrimasi dan adanya kematian pada hewan uji. Hasil observasi menunjukkan tidak adanya tanda toksisitas yang disebabkan oleh pemberian ekstrak etanol daun Derris Scandens dan Pulicaria Wightiana. Nilai LD50
dari ekstrak etanol daun Derris Scandens dan Pulicaria Wightiana adalah lebih dari 2000 mg/kgBB.
Penelitian uji toksisitas terhadap eksipien yang pernah dilakukan adalah uji toksisitas subkronik gelatin kulit ikan patin siam (Pangasius hypophthalmus) terhadap mencit (Mus musculus) oleh Rachmawati, et al (2011). Pada penelitian tersebut digunakan 72 ekor mencit jantan dengan berat 20-30 g yang terbagi dalam 4 kelompok. Dosis gelatin kulit ikan yang diberikan adalah 0 (kontrol negatif), 12, 24 dan 48 mg/gBB mencit. Pemberian bahan uji dilakukan setiap hari selama 4 minggu yang dilanjutkan dengan masa pemulihan (recovery) selama 2 minggu.
Pengamatan toksisitas dilakukan terhadap kondisi serum darah, yaitu Glutamic Oxaloacetic Transaminase (GOT), Glutamic Pyruvic Transaminase (GPT), kreatinin, albumin, dan Blood Urea Nitrogen (BUN) dan tingkat kerusakan organ target (hati, ginjal, dan lambung). Hasil penelitian menunjukkan bahwa pemberian gelatin pada
dosis 48 mg/gBB mencit berpengaruh pada kadar GOT setelah minggu ke-2 perlakuan. Namun, dosis lainnya tidak menunjukkan perbedaan bermakna kerusakan organ target dari kelompok perlakuan dibandingkan dengan kelompok kontrol negatif (Novalia, et al., 2011).
2.7 Pengamatan Tanda Toksisitas Tikus
UIN Syarif Hidayatullah Jakarta Piloereksi merupakan perubahan pada bulu tikus menjadi tegang dan keras yang dapat menandakan adanya efek toksik. Timbulnya konvulsi (kejang) dan tremor (bergetar) mengindikasikan adanya gangguan pada sistem syaraf pusat tikus uji (Hau et al., 2003). Konvulsi biasanya diawali dengan tremor pada bagian kaki, kepala, dahi dan mulut. Jika kejang terjadi berulang sebanyak 5 kali, maka hewan uji dianjurkan untuk diterminasi. Gejala toksisitas lainnya yang dapat timbul adalah tremor pada kaki bagian depan tikus atau bagian kepala tikus (OECD, 2000).
Tanda toksisitas lainnya yang dapat muncul adalah nyeri yang ditandai ketika tikus menyipitkan bagian orbital, melipat daun telinga ke bagian dalam dan menjauhkan kumisnya dari wajah (OECD, 2000). Adanya efek toksik juga dapat mengganggu respon daun telinga tikus. Pada tikus normal yang disentuh daun telinganya, maka tikus akan mengguncangkan bagian kepalanya.
Pada tikus normal, secara berkala tikus akan mensekresikan cairan kemerahan (cairan hardarian) di sekitar kelenjar mata yang akan digosokkan oleh tikus ke bagian tubuhnya untuk menjaga suhu tubuhnya (OECD,2000). Akumulasi cairan kemerahan pada daerah sekitar mata mengindikasikan tikus mengalami stress (Whishaw, et al.,
1999).
Hiperaktivitas atau aktivitas yang berlebihan pada tikus dapat timbul karena efek toksik dari sampel uji. Tanda toksik lainnya yang dapat diamati adalah terjadinya
hipersalivasi pada tikus. Salivasi ditandai dengan produksi air liur berlebihan pada tikus. Efek toksik yang paling parah adalah kematian. Gejala yang sering timbul sebelum tikus uji mati dapat berupa ketidakmampuan tikus uji untuk mencapai air atau makanan, kejang dan tremor.
UIN Syarif Hidayatullah Jakarta 2.8 Efek Toksik Terhadap Organ
2.8.1 Hati
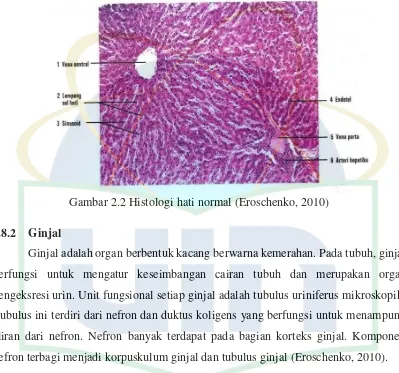
Hati merupakan organ terbesar dalam tubuh dengan berat mencapai 2% dari berat tubuh. Fungsi utama organ hati adalah sebagai pemetabolisme senyawa endogen ataupun xenobiotik. Laju alir darah menuju hati sebesar 1,5 L/menit. Organ hati terletak di kuadran kanan atas rongga abdomen abdomen, di bawah diafragma. Hati tikus memiliki bentuk menyerupai segitiga dengan warna merah tua kecokelatan dan terdiri dari 4 lobus yang dipisahkan oleh ligamentum fasciformis (Sibulesky, 2013). Terdapat 3 jenis jaringan hati yang penting, yaitu sel parenkim hati (hepatosit), susunan pembuluh darah, dan susunan saluran empedu. Ketiga jaringan ini berhubungan erat, sehingga kerusakan satu jenis jaringan dapat mengakibatkan kerusakan jaringan lain (Tortora, 2005).
Secara mikroskopis hati terdiri atas lobulus yang berbentuk heksagonal. Masing-masing lobulus memiliki sel parenkim hati (hepatosit) yang berbentuk kubus dan tersusun radial mengelilingi vena sentralis sebagai pusat lobulus. Pada lobulus hati juga terdapat celah garis endotel sebagai tempat perlintasan darah yang disebut
sinusoid. Pada sinusoid terdapat sel kupfer yang merupakan makrofag dan berfungsi untuk menghancurkan leukosit, sel darah merah yang rusak, bakteri dan senyawa asing yang masuk dari vena porta (Dhillon, 2012). Bagian perifer lobulus hati dikelilingi oleh
vena porta, arteri hepatica dan kapiler empedu. Histologi hati normal dapat dilihat pada gambar 2.2
UIN Syarif Hidayatullah Jakarta menjadi fragmen-fragmen (kariokinesis), lisisnya nukleus dan membrane sel sehingga batas antar sel tidak nampak jelas. (Hastuti, 2006 dalam Anggraini, 2014).
Gambar 2.2 Histologi hati normal (Eroschenko, 2010)
2.8.2 Ginjal
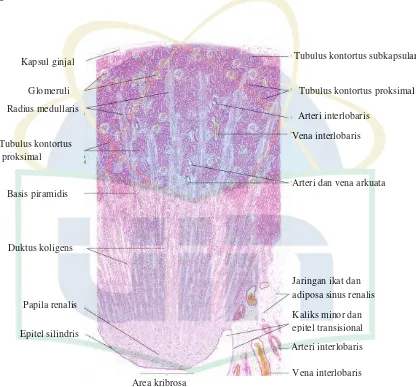
Ginjal adalah organ berbentuk kacang berwarna kemerahan. Pada tubuh, ginjal berfungsi untuk mengatur keseimbangan cairan tubuh dan merupakan organ pengeksresi urin. Unit fungsional setiap ginjal adalah tubulus uriniferus mikroskopik. Tubulus ini terdiri dari nefron dan duktus koligens yang berfungsi untuk menampung aliran dari nefron. Nefron banyak terdapat pada bagian korteks ginjal. Komponen nefron terbagi menjadi korpuskulum ginjal dan tubulus ginjal (Eroschenko, 2010).
Setiap ginjal dilapisi oleh kapsul jaringan ikat padat tidak teratur. Irisan sagital ginjal menunjukkan korteks pada bagian luar dan medula pada bagian dalam. Pada
UIN Syarif Hidayatullah Jakarta distal. Bagian medulla ginjal terdiri dari piramid-piramid ginjal berbentuk kerucut. Basis setiap piramid berbatasan langsung dengan korteks dan apeksnya membentuk papilla renalis. Pada bagian medulla hanya mengandung bagian lurus tubulus dan segmen ansa henle (Eroschenko, 2010).
Gambar 2.3 Histologi ginjal normal (Eroschenko, 2010)
Bentuk kerusakan organ ginjal yang disebabkan oleh pemaparan senyawa toksik dapat berupa atrofi glomerulus, dilatasi sel tubulus, nekrosis, hilangnya brush border dan vakuolisasi sel (Anzini, et al., 2014)
Tubulus kontortus subkapsular
Tubulus kontortus proksimal
Arteri interlobaris Vena interlobaris
Arteri dan vena arkuata
Jaringan ikat dan adiposa sinus renalis
Kaliks minor dan epitel transisional Arteri interlobaris
Vena interlobaris Area kribrosa
Epitel silindris Papila renalis Duktus koligens Basis piramidis Tubulus kontortus proksimal
UIN Syarif Hidayatullah Jakarta 2.9 Tinjauan Hewan Uji
2.9.1 Klasifikasi Tikus Putih
Berikut klasifikasi tikus putih (Rattus novergicus): Kingdom : Animalia
Filum : Chordata Kelas : Mammalia Ordo : Rodentia Subordo : Odontoceti Familia : Muridae Genus : Rattus
Spesies : Rattus norvegicus (Sumber: Krinke, 2000)
2.9.2 Karakteristik Tikus Betina Sprague-Dawley
Pemilihan hewan untuk uji toksisitas didasarkan pada data toksisitas yang tersedia (Hau, et al., 2003). Hewan uji yang banyak digunakan dalam uji toksisitas adalah tikus betina galur Sprague- Dawley atau Wistar. Pada penelitian ini, digunakan tikus betina galur Sprague-Dawley sebagai hewan uji. Tikus dipilih menjadi hewan uji karena data toksisitas gelatin yang tersedia merupakan data toksisitas gelatin pada tikus (Rowe, Sheskey dan Quinn, 2009).
Tikus Sprague-Dawley merupakan tikus putih (Rattus novergicus) yang ideal digunakan sebagai hewan uji, karena perawatannya mudah, tingkat fertilitasnya tinggi, periode kehamilan pendek dan memiliki jalur metabolisme, anatomi dan fisiologi yang mirip dengan manusia (Kacew, et al., 1999). Hewan uji yang direkomendasikan pada uji toksisitas akut adalah tikus betina karena lebih sensitif dibandingkan tikus jantan (OECD, 2008). Galur Sprague-Dawley dipilih karena lebih sensitif dibandingkan tikus galur Wistar (Zmarowski,et al.,2013)
Tikus galur Sprague- Dawley memiliki karakteristik berupa kepala memanjang dan ekor yang lebih panjang dibanding tubuhnya. Kelebihan galur Sprague- Dawley
UIN Syarif Hidayatullah Jakarta Menurut Handbook Of Laboratory Animal Science Second Edition, tikus merupakan hewan model yang mirip dengan manusia karena memiliki kesamaan pada struktur sel, komponen biokimia, membrane sel lipoprotein yang akan mempengaruhi absorbsi xenobiotik dan proses metabolisme (glikolisis dan siklus krebs).
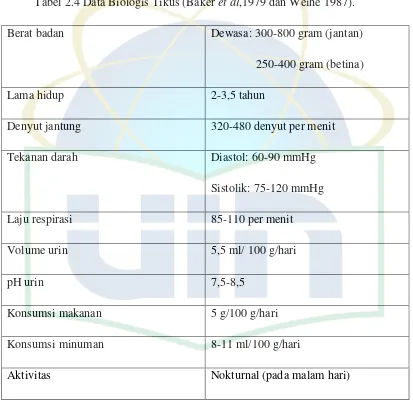
Tabel 2.4 Data Biologis Tikus (Baker et al,1979 dan Weihe 1987).
Berat badan Dewasa: 300-800 gram (jantan)
250-400 gram (betina)
Lama hidup 2-3,5 tahun
Denyut jantung 320-480 denyut per menit
Tekanan darah Diastol: 60-90 mmHg
Sistolik: 75-120 mmHg
Laju respirasi 85-110 per menit
Volume urin 5,5 ml/ 100 g/hari
pH urin 7,5-8,5
Konsumsi makanan 5 g/100 g/hari
Konsumsi minuman 8-11 ml/100 g/hari
UIN Syarif Hidayatullah Jakarta BAB III
METODE PENELITIAN 3.1 Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Januari 2016 hingga April 2016. Pemeliharaan dan perlakuan hewan uji di Animal House (AH), pembuatan larutan gelatin babi dilakukan di Laboratorium Penelitian II dan pengamatan parameter dilakukan di Laboratorium Penelitian I Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah Jakarta, pembuatan preparat histologi di Laboratorium Histologi Universitas Indonesia.
3.2 Alat dan Bahan 3.2.1 Alat Penelitian
Alat-alat yang digunakan pada penelitian ini adalah timbangan analitik (AND GH-202 dan Wiggen Hausner), erlenmeyer, beaker glass, batang pengaduk, spatula, gelas ukur, kaca arloji, cawan penguap, pipet tetes, hot plate (cimarec, US) , timbangan hewan, kandang tikus beserta tempat makanan dan minuman, sonde oral, syringe, wadah pembiusan, alat bedah minor, kaca objek dan cover glass, alumunium foil, mikroskop cahaya (Motic dan Epson).
3.2.2 Bahan Penelitian
Bahan uji yang digunakan dalam penelitian ini adalah gelatin babi golongan farmasetik (Guangzhou Ltd, Shanghay China) dan gelatin babi golongan pro analisis (Sigma-Aldrich).
Bahan kimia yang digunakan dalam penelitian ini adalah akuades, eter, etanol 96%, Buffer Neutral Formalin (BNF) 10 %, NaCl 0,9%, xylen, paraffin, dan pewarna haematoksilin-eosin.
3.2.3 Hewan Uji
Hewan uji yang digunakan pada penelitian ini adalah tikus putih betina galur
UIN Syarif Hidayatullah Jakarta selisih berat badan antar tikus ±20%. Hewan uji diperoleh dari Unit Pengelola Hewan Laboratorium (UPHL) Institut Pertanian Bogor. Tikus betina dipilih karena memiliki sensitivitas lebih tinggi dibandingkan tikus jantan.
3.3 Rancangan Penelitian (OECD, 2008) 3.3.1 Besar Sample
Penelitian ini bersifat eksperimental dengan metode Up and Down dan terdiri dari 2 kelompok perlakuan, yaitu kelompok kontrol dan kelompok uji. Pemilihan
hewan uji dilakukan secara random. Masing-masing kelompok uji gelatin babi golongan farmasetik dan pro analisis terdiri dari 3 ekor tikus putih betina galur Sprague Dawley. Penelitian ini telah lolos kaji etik oleh Komite Etik Penelitian Fakultas Kedokteran Universitas Indonesia (Lampiran 2).
3.3.2 Dosis Perlakuan
Metode Up and Down yang digunakan pada penelitian ini adalah limit test
dengan dosis perlakuan adalah 5000 mg/kgBB tikus. Pemberian dosis dilakukan secara bertahap. Penentuan dosis 5000 mg/kgBB pada limit test disebabkan data persyaratan nilai LD50 untuk gelatin adalah 5000 mg/kgBB (Rowe, Sheskey dan Quinn, 2009).
Perhitungan dosis dapat dilihat pada lampiran 5. Dosis diberikan dalam bentuk tunggal secara oral. Bahan pembawa yang digunakan untuk melarutkan gelatin babi adalah akuades.
Tabel 3.1. Dosis Perlakuan Pada Tikus
Tikus Perlakuan Dosis
1.
Gelatin Babi Golongan Pro Analisis 5000 mg/kgbb
7. 5000 mg/kgbb
UIN Syarif Hidayatullah Jakarta 3.4 Prosedur Kerja
3.4.1 Penyiapan Bahan Uji (Rowe, Sheskey dan Quinn, 2009)
Masing-masing gelatin babi golongan farmasetik dan pro analisis ditimbang sebanyak ±800 mg. Selanjutnya, masing-masing gelatin babi golongan farmasetik dan pro analisis didispersikan dalam 4 ml akuades pada suhu 60oC sambil diaduk. Kemudian larutan dispersi gelatin babi didiamkan pada suhu 250C hingga suhunya turun menjadi 30oC dan diberikan ke tikus secara oral.
3.4.2 Penyiapan Hewan Uji (OECD, 2008)
Tikus betina galur Sprague-Dawley diaklimatisasi di Animal House Fakultas Kedokteran dan Ilmu Kesehatan selama 10 hari. Animal house berada dalam kondisi terang selama 12 jam dan berada dalam kondisi gelap selama 12 jam. Tikus dipelihara pada kandang dengan suhu 220C (±30C) dan diberikan makan dan minum ad libitum. Masing-masing tikus uji ditempatkan dalam kandang yang berbeda (1 kandang berisi 1 tikus).
3.4.3 Uji Toksisitas Akut Gelatin Babi dengan Metode Up and Down (OECD 425, 2008)
Metode uji toksisitas akut yang digunakan pada penelitian ini adalah limit test
dari Up and Down Procedure (UDP). Larutan diberikan dalam dosis tunggal secara oral dengan menggunakan sonde lambung.
Pada limit test digunakan 2 ekor tikus sebagai kontrol dan 3 ekor tikus pada masing-masing kelompok uji. Sebelum perlakuan, tikus tidak diberi makan (dipuasakan) selama 12 jam kemudian ditimbang. Setelah ditimbang, tikus kontrol diberikan akuades dengan volume administrasi 4 ml secara oral. Pada masing-masing kelompok uji, tikus diberikan gelatin babi golongan farmasetik dan pro analisis dengan dosis 5000 mg/kgbb. Setelah perlakuan, tikus dipuasakan selama 4 jam dan diamati adanya tanda toksisitas.
UIN Syarif Hidayatullah Jakarta maka masing-masing larutan gelatin babi golongan farmasetik dan pro analisis diberikan pada 2 ekor tikus lainnya dengan dosis yang sama. Limit test dapat terdiri dari 3 termin. Jika hasil uji pada dua termin awal limit test tidak menunjukkan adanya kematian pada hewan uji, maka limit test dapat dihentikan (lampiran 6). Sedangkan jika terdapat tikus yang mati pada kedua termin awal, maka pengujian harus dilanjutkan ke limit test termin ketiga. Jika hasil dari ketiga termin limit test menunjukkan adanya kematian pada 3 ekor tikus atau lebih, maka uji dilanjutkan ke main test.
3.4.4 Pengamatan Toksisitas
3.4.4.1 Penentuan Nilai LD50 (OECD,2008)
Penentuan nilai LD50 gelatin babi golongan farmasetik dan pro analisis
dilakukan dengan menggunakan software AOT425StatPgm. Data yang didapatkan dari uji toksisitas, yakni respon hewan uji (hidup atau mati) terhadap dosis perlakuan dimasukkan ke dalam software sehingga software akan mengkalkulasikan nilai LD50. Respon hewan uji yang bertahan hidup dilambangkan dengan “O” dan respon hewan uji yang mengalami kematian dilambangkan dengan “X”. Selain untuk menentukan
nilai LD50, software ini juga berfungsi untuk penentuan dosis uji berikutnya dan waktu
penghentian uji toksisitas.
3.4.4.2 Pengamatan Berat Badan Tikus (Jothy, et al., 2011)
Sebelum memulai perlakuan, masing-masing tikus kontrol dan uji ditimbang berat badannya. Setelah perlakuan, berat badan tikus ditimbang setiap hari selama 14 hari untuk melihat adanya kemungkinan perubahan secara bermakna pada berat badan tikus.
3.4.4.3 Pengamatan Tanda Toksisitas
UIN Syarif Hidayatullah Jakarta (gemetar), respon daun telinga, perubahan pada mata, hiperaktivitas, hipersalivasi, lakrimasi dan mati (Sabbani, et al., 2015).
3.4.4.4 Pengamatan Histopatologi Organ Hati dan Ginjal Tikus
Pemeriksaan histopatologi organ hati dan ginjal dilakukan untuk mengamati pengaruh pemberian gelatin babi golongan farmasetik dan pro analisis terhadap organ hati dan ginjal tikus. Pemeriksaan histopatologi organ hati dan ginjal dilakukan pada seluruh tikus uji dan kontrol. Tikus yang masih bertahan hidup hingga hari ke 14, dimatikan dengan cara inhalasi menggunakan eter dan kemudian diambil organ hati dan ginjalnya. Selanjutnya organ hati dan ginjal dicuci dengan NaCl 0,9% dan difiksasi BNF 10%. Organ hati dan ginjal direndam dalam larutan BNF dan kemudian dibuat preparat histologinya.
Bentuk kerusakan yang diamati pada jaringan hati meliputi pelebaran asinus, degenerasi lemak dan nekrosis pada hepatosit. Derajat kerusakan hati dinilai dengan menggunakan sistem skoring (tabel 3.2). Pengamatan preparat dilakukan di bawah mikroskop optik dengan perbesaran 10x40 dan menggunakan 10 lapang pandang. Skoring dilakukan untuk masing-masing lapang pandang dan kemudian dijumlahkan (Andreas, 2015).
Tabel 3.2 Skoring Derajat Kerusakan Jaringan Hati
Skor Keterangan
0 Hepatosit tampak nomal
1 Terdapat pelebaran asinus, degenerasi lemak atau nekrosis terfokus di satu tempat
2 Terdapat pelebaran asinus, degenerasi lemak atau nekrosis terfokus di beberapa tempat
3 Terdapat pelebaran asinus, degenerasi lemak atau nekrosis terfokus di seluruh tempat
Sumber: Andreas, et al., 2015
UIN Syarif Hidayatullah Jakarta mikroskop optik pada perbesaran 10x20. Bentuk kerusakan yang ada dinilai dengan sistem skoring (tabel 3.3).
Tabel 3.3 Skoring Derajat Kerusakan Jaringan Ginjal
Skor Keterangan
0 Struktur glomerulus normal
1 Terdapat dilatasi kapiler glomerulus
2 Terdapat atrofi glomerulus (glomerulus mengkerut) Sumber: Leehey, et al.,2008
3.5 Analisis Data
UIN Syarif Hidayatullah Jakarta BAB IV
HASIL DAN PEMBAHASAN 4.1 Hasil Penelitian
4.1.1 Penyiapan Bahan Uji
Bahan uji yang digunakan pada penelitian ini adalah gelatin babi golongan farmasetik dan pro analisis. Secara organoleptis, gelatin babi golongan farmasetik dan pro analisis berbentuk serbuk dan tidak berbau. Gelatin babi golongan farmasetik berwarna kekuningan dan gelatin babi golongan pro analisis berwarna putih.
(a) (b)
Gambar 4.1. (a) Gelatin babi golongan farmasetik; (b) Gelatin babi golongan pro analisis
Pada penelitian ini, masing-masing serbuk gelatin babi golongan farmasetik dan pro analisis ditimbang sesuai bobot tikus, sehingga diperoleh dosis 5000 mg/kgBB. Kemudian masing-masing gelatin babi golongan farmasetik dan pro analisis didispersikan dalam akuades dengan suhu 600C selama ±8 menit, sehingga membentuk larutan koloid. Dispersi gelatin didiamkan pada suhu 250C hingga suhu dispersi gelatin turun menjadi 300C. Perbandingan gelatin babi dan akuades yang digunakan adalah 1:5 karena gelatin bersifat menyerap air dan akan mengembang di dalam akuades (Rowe, Sheskey dan Quinn, 2009).
UIN Syarif Hidayatullah Jakarta 4.1.2 Penentuan Nilai LD50
Metode uji toksisitas akut yang digunakan pada penelitian ini adalah Up and Down Procedure (UDP). Pada metode ini, nilai LD50 ditentukan dengan menggunakan software AOT 425 statPgm (lampiran 8). Data yang diolah dengan software adalah respon hewan uji (mati atau hidup) terhadap dosis setelah pemberian bahan uji, baik pada pengamatan jangka waktu pendek (48 jam setelah pemberian) dan jangka waktu panjang (14 hari setelah pemberian). Metode UDP yang dilakukan pada penelitian ini adalah limit test dengan dosis 5000 mg/kgBB. Jumlah hewan uji yang digunakan pada penelitian ini adalah 2 ekor sebagai kelompok kontrol, 3 ekor sebagai kelompok uji gelatin babi golongan farmasetik dan 3 ekor sebagai kelompok uji gelatin babi golongan pro analisis. Hasil pengolahan data respon hewan uji terhadap dosis dapat dilihat pada tabel 4.1.
Tabel 4.1 Data Respon Hewan Uji Terhadap Dosis
Bahan Uji Gelatin babi golongan farmasetik
Tipe Tes Limit Test 5000 mg/kgBB
Hewan uji ke- Dosis (mg/kgBB) Respon hewan uji
jangka pendek (48
Bahan Uji Gelatin babi golongan pro analisis
Tipe Tes Limit Test 5000 mg/kgBB
Hewan uji ke- Dosis (mg/kgBB) Respon hewan uji
jangka pendek (48
UIN Syarif Hidayatullah Jakarta Hasil uji toksisitas akut gelatin babi golongan farmasetik menunjukkan tidak adanya kematian pada seluruh hewan uji hingga hari ke-14. Berdasarkan hasil pengolahan data respon hewan uji pada tabel 4.1, maka dapat diestimasikan nilai LD50
gelatin babi golongan farmasetik adalah >5000 mg/kgBB.
Pada uji toksisitas akut gelatin babi golongan pro analisis juga tidak ditemukan adanya kematian pada seluruh hewan uji, sehingga estimasi nilai LD50 gelatin babi
golongan pro analisis adalah >5000mg/kgBB. Berdasarkan klasifikasi toksisitas akut Loomis, senyawa dengan LD50 >5000 mg/kgBB merupakan senyawa yang bersifat
praktis tidak toksik
4.1.3 Hasil Pengukuran Berat Badan Tikus
Pengukuran berat badan tikus dilakukan setiap hari selama 14 hari setelah pemberian bahan uji. Hasil pengukuran berat badan tikus pada kelompok kontrol, kelompok gelatin babi golongan farmasetik dan gelatin babi golongan pro analisis dapat dilihat pada gambar 4.2
Gambar 4.2 Rerata berat badan tikus tiap kelompok
Data berat badan tikus kemudian dianalisis dengan menggunakan uji Kruskal-Wallis. Hasil uji Kruskal-Wallis menunjukkan bahwa tidak terdapat perbedaan bermakna pada berat badan tikus yang diberikan gelatin babi golongan farmasetik,
0
UIN Syarif Hidayatullah Jakarta gelatin babi golongan pro analisis dan kontrol selama 14 hari, nilai p≥0,05 (lampiran 10). Hal ini menunjukkan bahwa pemberian gelatin babi golongan farmasetik ataupun pro analisis tidak mempengaruhi perubahan berat badan tikus uji.
4.1.4 Pengamatan Tanda Toksisitas
Pengamatan tanda toksisitas dilakukan untuk melihat adanya gejala klinis yang mengindikasikan efek toksik pada kelompok uji. Tanda toksisitas yang diamati meliputi adanya piloereksi (tegang pada bulu), konvulsi (kejang), tremor (gemetar), nyeri, mata (grooming), refleks daun telinga, salivasi, lakrimasi, hiperaktivitas dan kematian pada tikus uji (Sabbani, et al., 2015). Tanda toksisitas diamati secara visual selama 4 jam setelah pemberian bahan uji dan dilanjutkan selama 14 hari.
Tabel 4.2. Pengamatan Tanda Toksisitas
UIN Syarif Hidayatullah Jakarta Hasil dari pengamatan setelah pemberian larutan gelatin babi golongan farmasetik ataupun golongan pro analisis dengan dosis 5000 mg/kgbb tidak menunjukkan adanya tanda toksisitas pada seluruh tikus uji. Perubahan tingkah laku juga tidak ditemukan pada seluruh tikus uji. Tikus uji yang diberikan perlakuan mempunyai aktivitas yang sama dengan tikus kontrol (tabel 4.2). Hingga hari ke-14 tidak ditemukan adanya kematian pada seluruh tikus uji.
4.1.5 Pengamatan Histopatologi 4.1.5.1 Hati
Preparat histopatologi hati diamati di bawah mikroskop optik dengan perbesaran 10 x 40. Pengamatan dilakukan pada 10 lapang pandang untuk masing-masing preparat. Hasil pengamatan organ hati menunjukkan bahwa gambaran histopatologi jaringan hati tikus uji dan kontrol serupa yakni sinusoid memancar secara sentrifugal dari vena sentralis dan sel hati (hepatosit) bermuara ke vena sentralis. Selain itu, hepatosit tersusun secara radial dari tepi lobulus hingga ke vena sentralis. Inti hepatosit juga terletak di tengah sel.
Pada beberapa preparat kelompok uji terdapat kerusakan jaringan, namun
secara struktur jaringan hati kelompok uji masih serupa dengan kelompok kontrol. Bentuk kerusakan jaringan yang ditemukan pada pengamatan merupakan kerusakan minor, berupa pelebaran asinus dan degenerasi lemak, terutama pada kelompok uji
gelatin babi golongan pro analisis (lampiran 13).
Penilaian derajat kerusakan histopatologi hati dilakukan dengan sistem skoring Andreas, et al. (2015). Hasil rerata skoring pengamatan histopatologi jaringan hati dapat dilihat pada tabel 4.3
Tabel 4.3 Rerata Skoring Histopatologi Jaringan Hati Hewan Uji
Kelompok Rerata Skoring Histopatologi Hati±SD
Kontrol 0,150±0,212
Gelatin babi golongan farmasetik 0,167±0,288