KHIRANI AFRISHA PRATIWI
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
TIKUS PUTIH GALUR SPRAGUE-DAWLEY
KHIRANI AFRISHA PRATIWI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Program Studi Biokimia
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
NIM
: G44102035
Disetujui
Komisi Pembimbing
Ir. A.E. Zainal Hasan, M.Si
Ketua
Dr. drh. Hasim, DEA
Drh. Hernomoadi Huminto, MVS
Anggota
Anggota
Diketahui
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Dr. Ir. Yonny Koesmaryono, M.S.
NIP 131 473 999
pada Tikus Putih Galur Sprague-Dawley. Dibimbing oleh A.E. ZAINAL
HASAN, HASIM dan HERNOMOADI HUMINTO.
Toksisitas akut angkak dilakukan pada 25 ekor tikus putih galur
Sprague-Dawley jantan berumur dua bulan, dibagi menjadi 5 kelompok dosis tunggal yaitu
kontrol, 2.5 g/kg BB, 5 g/kg BB, 10 g/kg BB dan 15g/kg BB. Efek toksik angkak
terhadap organ hati dan ginjal hewan coba dilakukan dengan analisis biokimiawi
yaitu mengukur aktivitas enzim Alanin Amino Transferase (ALT/ EC 2.6.1.2),
Aspartat Amino Transferase (AST/ EC 2.6.1.1) dan kadar urea dalam darah pada
sehari sebelum perlakuan (H-1), sehari setelah perlakuan (H+1) dan 5 hari setelah
perlakuan (H+5). Tingkat kematian dan gejala klinis hewan coba diamati setelah
24 jam sampai 5 hari setelah perlakuan. Kemudian, tikus dinekropsi untuk melihat
adanya kelainan pada organ hati dan ginjal secara makroskopis dan mikroskopis
(histopatologis).
Hasil penelitian menunjukkan bahwa tidak ditemukan adanya kematian
hewan coba pada semua perlakuan sejak 24 jam sampai 5 hari setelah perlakuan.
Selama perlakuan, bobot badan tikus tidak mengalami kenaikan yang signifikan
(P>0.05). Gejala klinis hewan coba (nafsu makan, keadaan mata, keadaan bulu
dan tingkah laku) tidak menunjukkan adanya perubahan. Namun, pada kelompok
perlakuan fesesnya berwarna kemerahan. Aktivitas enzim ALT, AST serta kadar
urea darah semua kelompok perlakuan meningkat secara signifikan pada H+1 dan
H+5 tidak mengalami perubahan yang signifikan dibandingkan pada H-1
(P>0.05). Organ hati mengalami kongesti, degenerasi lemak dan nekrosa.
Sedangkan organ ginjal mengalami degenerasi protein dan nekrosa pada epitel
tubulusnya.
Rice) in The White Rats Strain
Sprague-Dawley. Supervised by A.E. ZAINAL
HASAN, HASIM dan HERNOMOADI HUMINTO.
Acute toxicity of angkak had been tested on 2 months aged of male white
rats strain
Sprague-Dawley
. The 25 rats were divided into 5 groups of single dose
are control, 2.5 g/kg body weight (bw), 5 g/kg bw, 10 g/kg bw and 15 g/kg bw.
Toxic effect of angkak to liver and kidney were tested by biochemical analysis
which measuring the activity of Alanin Amino Transferase (ALT/ EC 2.6.1.2),
Aspartat Amino Transferase (AST/ EC 2.6.1.1) enzymes and blood urea level at
one day before (H-1) and after (H+1) the treatment also 5 days after the treatment
(H+5). Mortality level and clinical symptoms were observed after 24 hours until 5
days treatment. Then the rats were necropsied to see the lesion on the liver and
kidney both macroscopically and microscopically.
segala karuniaNya sehingga karya ilmiah ini berhasil diselesaikan. Shalawat dan
salam semoga selalu tercurah kepada Nabi Muhamad SAW, keluarga, sahabat,
dan para pengikutnya sampai akhir zaman. Judul yang dipilih dalam penelitian ini
adalah Analisis Keamanan Angkak pada Tikus Putih Galur Sprague-Dawley.
Penelitian tersebut dilaksanakan dari Juli 2005 sampai Maret 2006 di
Laboratorium Biokimia Hewan, Departemen Biokimia, Fakultas Matematika dan
Ilmu Pengetahuan Alam dan Laboratorium Patologi, Fakultas Kedokteran Hewan,
Institut Pertanian Bogor.
Ucapan terima kasih penulis sampaikan kepada Ir. A.E. Zainal Hasan, M.Si,
Dr. drh. Hasim, DEA dan Drh. Hernomoadi Huminto, MVS yang telah
membimbing selama menyelesaikan karya ilmiah ini. Terima kasih kepada semua
staf lab biokimia dan staf lab patologi yang telah banyak membantu selama
penelitian. Terima kasih juga kepada Adjie, Eko INF40, Kak Maman, Kak Metha,
Mbak Itin, Mex 6C dan Biokimia’39 terima kasih atas semua dorongan dan
bantuannya. Kepada ayah, ibu, adik serta keluarga besar, penulis ucapkan terima
kasih atas segala doa, dukungan dan kasih sayangnya.
Semoga karya tulis ini dapat berguna dan bermanfaat bagi penulis dan orang
banyak.
Bogor, Mei 2006
Slamet dan Ibu Tuti Setyowati, sebagai anak pertama dari dua bersaudara.
Tahun 2002, penulis lulus dari Sekolah Menengah Umum Negeri 2
Purworejo dan pada tahun yang sama diterima di IPB melalui jalur Undangan
Seleksi Masuk IPB (USMI). Penulis memilih Program Studi Biokimia, Fakultas
Matematika dan Ilmu Pengetahuan Alam.
Halaman
DAFTAR TABEL ... iii
DAFTAR GAMBAR ... iv
DAFTAR LAMPIRAN ... v
PENDAHULUAN ... 1
TINJAUAN PUSTAKA
Produksi Angkak ... 2
Monascus
purpureus
... 2
Tikus Sprague-Dawley ... 3
Uji Toksisitas Akut ... 2
Penentuan Kelainan Organ Hati ... 4
Penentuan Kelainan Organ Ginjal ... 5
BAHAN DAN METODE
Alat dan Bahan ... 6
Metode Penelitian ... 7
HASIL DAN PEMBAHASAN
Keadaan Awal Hewan Coba ... 9
Pengaruh Angkak Terhadap Aktivitas Enzim ALT dan AST ... 10
Pengaruh Angkak Terhadap Kadar Urea Darah ... 11
Gambaran Histopatologis Hati dan Ginjal... 11
SIMPULAN DAN SARAN ... 15
DAFTAR PUSTAKA ... 15
Halaman
1 Gambaran fisik angkak menghasilkan pigmen berwarna merah ... 2
2 Tikus Sprague-Dawley ...
7
3 Bobot badan tikus Sprague-Dawley selama adaptasi dan perlakuan
dengan berbagai dosis ... 9
4 Feses tikus yang diamati dengan mikroskop ... 9
5 Perbandingan aktivitas AST perlakuan pemberian angkak pada H-1,
H+1, dan H+5 ... 10
6 Perbandingan aktivitas ALT perlakuan pemberian angkak pada H-1,
H+1, dan H+5 ... 11
7 Perbandingan kadar urea darah perlakuan pemberian angkak pada H-1,
H+1, dan H+5 ... 11
8 Gambaran mikroskopis hati tikus yang mengalami kongesti pada
kelompok kontrol pewarnaan HE, 1 bar 30µm. ... 12
9 Gambaran mikroskopis hati tikus yang mengalami degenerasi lemak
pada kelompok dosis angkak 15 g/kgBB pewarnaan HE, 1 bar 30µm ... 12
10 Gambaran mikroskopis hati tikus yang mengalami nekrosa dengan
dosis angkak 15 g/kgBB pewarnaan HE, 1 bar 50µm ... 13
11 Gambaran mikroskopis hati tikus yang normal pada kelompok kontrol
pewarnaan HE, 1 bar 30µm ... 13
12 Gambaran mikroskopis ginjal tikus yang mengalami nekrosa pada sel
tubulus dengan dosis 15 g/kgBB pewarnaan HE, 1 bar 50µm ... 14
13 Gambaran mikroskopis ginjal tikus yang mengalami akumulasi protein
dengan dosis 15 g/kgBB pewarnaan HE,1 bar 30µm ... 14
14 Gambaran mikroskopis ginjal tikus yang normal dengan pewarnaan
1 Komposisi kimiawi angkak ... 2
2 Batasan keracunan oral pada manusia berdasarkan klasifikasi Gleason .. 4
3 Metode skoring histopatologis ginjal ... 8
4 Metode skoring histopatologis hati ... 8
5 Gejala klinis hewan coba selama perlakuan ...
9
6 Rata-rata aktivitas enzimatik pada tikus Sprague-Dawley sebelum
perlakuan ... 10
7 Pengaruh pemberian angkak terhadap rataan aktivitas enzim AST ... 10
8 Pengaruh pemberian angkak terhadap rataan aktivitas enzim ALT ... 10
9 Rata-rata kadar urea darah pada tikus Sprague-Dawley sebelum
perlakuan ... 11
10 Pengaruh pemberian angkak terhadap kadar urea darah ... 12
11 Nilai skoring histopatologis hati ... 12
12 Hasil uji Kruskal-Wallis histopatologis hati ... 13
13 Nilai skoring histopatologis ginjal ... 14
KHIRANI AFRISHA PRATIWI
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
TIKUS PUTIH GALUR SPRAGUE-DAWLEY
KHIRANI AFRISHA PRATIWI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Program Studi Biokimia
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
NIM
: G44102035
Disetujui
Komisi Pembimbing
Ir. A.E. Zainal Hasan, M.Si
Ketua
Dr. drh. Hasim, DEA
Drh. Hernomoadi Huminto, MVS
Anggota
Anggota
Diketahui
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Dr. Ir. Yonny Koesmaryono, M.S.
NIP 131 473 999
pada Tikus Putih Galur Sprague-Dawley. Dibimbing oleh A.E. ZAINAL
HASAN, HASIM dan HERNOMOADI HUMINTO.
Toksisitas akut angkak dilakukan pada 25 ekor tikus putih galur
Sprague-Dawley jantan berumur dua bulan, dibagi menjadi 5 kelompok dosis tunggal yaitu
kontrol, 2.5 g/kg BB, 5 g/kg BB, 10 g/kg BB dan 15g/kg BB. Efek toksik angkak
terhadap organ hati dan ginjal hewan coba dilakukan dengan analisis biokimiawi
yaitu mengukur aktivitas enzim Alanin Amino Transferase (ALT/ EC 2.6.1.2),
Aspartat Amino Transferase (AST/ EC 2.6.1.1) dan kadar urea dalam darah pada
sehari sebelum perlakuan (H-1), sehari setelah perlakuan (H+1) dan 5 hari setelah
perlakuan (H+5). Tingkat kematian dan gejala klinis hewan coba diamati setelah
24 jam sampai 5 hari setelah perlakuan. Kemudian, tikus dinekropsi untuk melihat
adanya kelainan pada organ hati dan ginjal secara makroskopis dan mikroskopis
(histopatologis).
Hasil penelitian menunjukkan bahwa tidak ditemukan adanya kematian
hewan coba pada semua perlakuan sejak 24 jam sampai 5 hari setelah perlakuan.
Selama perlakuan, bobot badan tikus tidak mengalami kenaikan yang signifikan
(P>0.05). Gejala klinis hewan coba (nafsu makan, keadaan mata, keadaan bulu
dan tingkah laku) tidak menunjukkan adanya perubahan. Namun, pada kelompok
perlakuan fesesnya berwarna kemerahan. Aktivitas enzim ALT, AST serta kadar
urea darah semua kelompok perlakuan meningkat secara signifikan pada H+1 dan
H+5 tidak mengalami perubahan yang signifikan dibandingkan pada H-1
(P>0.05). Organ hati mengalami kongesti, degenerasi lemak dan nekrosa.
Sedangkan organ ginjal mengalami degenerasi protein dan nekrosa pada epitel
tubulusnya.
Rice) in The White Rats Strain
Sprague-Dawley. Supervised by A.E. ZAINAL
HASAN, HASIM dan HERNOMOADI HUMINTO.
Acute toxicity of angkak had been tested on 2 months aged of male white
rats strain
Sprague-Dawley
. The 25 rats were divided into 5 groups of single dose
are control, 2.5 g/kg body weight (bw), 5 g/kg bw, 10 g/kg bw and 15 g/kg bw.
Toxic effect of angkak to liver and kidney were tested by biochemical analysis
which measuring the activity of Alanin Amino Transferase (ALT/ EC 2.6.1.2),
Aspartat Amino Transferase (AST/ EC 2.6.1.1) enzymes and blood urea level at
one day before (H-1) and after (H+1) the treatment also 5 days after the treatment
(H+5). Mortality level and clinical symptoms were observed after 24 hours until 5
days treatment. Then the rats were necropsied to see the lesion on the liver and
kidney both macroscopically and microscopically.
segala karuniaNya sehingga karya ilmiah ini berhasil diselesaikan. Shalawat dan
salam semoga selalu tercurah kepada Nabi Muhamad SAW, keluarga, sahabat,
dan para pengikutnya sampai akhir zaman. Judul yang dipilih dalam penelitian ini
adalah Analisis Keamanan Angkak pada Tikus Putih Galur Sprague-Dawley.
Penelitian tersebut dilaksanakan dari Juli 2005 sampai Maret 2006 di
Laboratorium Biokimia Hewan, Departemen Biokimia, Fakultas Matematika dan
Ilmu Pengetahuan Alam dan Laboratorium Patologi, Fakultas Kedokteran Hewan,
Institut Pertanian Bogor.
Ucapan terima kasih penulis sampaikan kepada Ir. A.E. Zainal Hasan, M.Si,
Dr. drh. Hasim, DEA dan Drh. Hernomoadi Huminto, MVS yang telah
membimbing selama menyelesaikan karya ilmiah ini. Terima kasih kepada semua
staf lab biokimia dan staf lab patologi yang telah banyak membantu selama
penelitian. Terima kasih juga kepada Adjie, Eko INF40, Kak Maman, Kak Metha,
Mbak Itin, Mex 6C dan Biokimia’39 terima kasih atas semua dorongan dan
bantuannya. Kepada ayah, ibu, adik serta keluarga besar, penulis ucapkan terima
kasih atas segala doa, dukungan dan kasih sayangnya.
Semoga karya tulis ini dapat berguna dan bermanfaat bagi penulis dan orang
banyak.
Bogor, Mei 2006
Slamet dan Ibu Tuti Setyowati, sebagai anak pertama dari dua bersaudara.
Tahun 2002, penulis lulus dari Sekolah Menengah Umum Negeri 2
Purworejo dan pada tahun yang sama diterima di IPB melalui jalur Undangan
Seleksi Masuk IPB (USMI). Penulis memilih Program Studi Biokimia, Fakultas
Matematika dan Ilmu Pengetahuan Alam.
Halaman
DAFTAR TABEL ... iii
DAFTAR GAMBAR ... iv
DAFTAR LAMPIRAN ... v
PENDAHULUAN ... 1
TINJAUAN PUSTAKA
Produksi Angkak ... 2
Monascus
purpureus
... 2
Tikus Sprague-Dawley ... 3
Uji Toksisitas Akut ... 2
Penentuan Kelainan Organ Hati ... 4
Penentuan Kelainan Organ Ginjal ... 5
BAHAN DAN METODE
Alat dan Bahan ... 6
Metode Penelitian ... 7
HASIL DAN PEMBAHASAN
Keadaan Awal Hewan Coba ... 9
Pengaruh Angkak Terhadap Aktivitas Enzim ALT dan AST ... 10
Pengaruh Angkak Terhadap Kadar Urea Darah ... 11
Gambaran Histopatologis Hati dan Ginjal... 11
SIMPULAN DAN SARAN ... 15
DAFTAR PUSTAKA ... 15
Halaman
1 Gambaran fisik angkak menghasilkan pigmen berwarna merah ... 2
2 Tikus Sprague-Dawley ...
7
3 Bobot badan tikus Sprague-Dawley selama adaptasi dan perlakuan
dengan berbagai dosis ... 9
4 Feses tikus yang diamati dengan mikroskop ... 9
5 Perbandingan aktivitas AST perlakuan pemberian angkak pada H-1,
H+1, dan H+5 ... 10
6 Perbandingan aktivitas ALT perlakuan pemberian angkak pada H-1,
H+1, dan H+5 ... 11
7 Perbandingan kadar urea darah perlakuan pemberian angkak pada H-1,
H+1, dan H+5 ... 11
8 Gambaran mikroskopis hati tikus yang mengalami kongesti pada
kelompok kontrol pewarnaan HE, 1 bar 30µm. ... 12
9 Gambaran mikroskopis hati tikus yang mengalami degenerasi lemak
pada kelompok dosis angkak 15 g/kgBB pewarnaan HE, 1 bar 30µm ... 12
10 Gambaran mikroskopis hati tikus yang mengalami nekrosa dengan
dosis angkak 15 g/kgBB pewarnaan HE, 1 bar 50µm ... 13
11 Gambaran mikroskopis hati tikus yang normal pada kelompok kontrol
pewarnaan HE, 1 bar 30µm ... 13
12 Gambaran mikroskopis ginjal tikus yang mengalami nekrosa pada sel
tubulus dengan dosis 15 g/kgBB pewarnaan HE, 1 bar 50µm ... 14
13 Gambaran mikroskopis ginjal tikus yang mengalami akumulasi protein
dengan dosis 15 g/kgBB pewarnaan HE,1 bar 30µm ... 14
14 Gambaran mikroskopis ginjal tikus yang normal dengan pewarnaan
1 Komposisi kimiawi angkak ... 2
2 Batasan keracunan oral pada manusia berdasarkan klasifikasi Gleason .. 4
3 Metode skoring histopatologis ginjal ... 8
4 Metode skoring histopatologis hati ... 8
5 Gejala klinis hewan coba selama perlakuan ...
9
6 Rata-rata aktivitas enzimatik pada tikus Sprague-Dawley sebelum
perlakuan ... 10
7 Pengaruh pemberian angkak terhadap rataan aktivitas enzim AST ... 10
8 Pengaruh pemberian angkak terhadap rataan aktivitas enzim ALT ... 10
9 Rata-rata kadar urea darah pada tikus Sprague-Dawley sebelum
perlakuan ... 11
10 Pengaruh pemberian angkak terhadap kadar urea darah ... 12
11 Nilai skoring histopatologis hati ... 12
12 Hasil uji Kruskal-Wallis histopatologis hati ... 13
13 Nilai skoring histopatologis ginjal ... 14
1 Diagram alir kerja penelitian ... 19
2 Ekstraksi angkak ... 20
3
Pembuatan sediaan histopatologi ... 21
4 Pewarnaan Hematoksilin Eosin. ... 22
5 Prosedur pengukuran aktivitas AST (Aspartat Amino Transferase) ... 23
6 Prosedur pengukuran aktivitas ALT (Alanin Amino Transferase) ... 23
7 Prosedur pengukuran konsentrasi urea darah ... 24
8 Bobot badan tikus Sprague-Dawley selama adaptasi dan perlakuan ... 25
9 Aktivitas enzim ALT ... 26
10 Aktivitas enzim AST ... 27
11 Kadar urea darah ... 28
PENDAHULUAN
Pemanfaatan mikroorganisme untuk menghasilkan suatu produk melalui fermentasi sudah dilakukan sejak ratusan tahun yang lalu. Awalnya fermentasi banyak digunakan untuk memproduksi makanan dan minuman seperti roti, minuman beralkohol, tape, dan lain-lain. Saat ini, selain untuk memproduksi makanan dan minuman, teknologi fermentasi juga banyak dimanfaatkan untuk menghasilkan senyawa-senyawa yang merupakan metabolit primer maupun sekunder. Senyawa yang dihasilkan tersebut memiliki fungsi yang berbeda-beda, salah satunya sebagai senyawa obat.
Angkak adalah produk fermentasi beras oleh kapang galur Monascus sp. tertentu. Angkak dikenal dengan nama yang berbeda di beberapa negara, misalnya hong-qu (Cina), bheni-koji, aga koji, red koji (Jepang), red fermented rice atau red yeast rice (Inggris), ang-quac, Zhi Tai, Xue Zhi Kang dan anka. Angkak menghasilkan beberapa pigmen antara lain merah, kuning dan ungu (Suwanto 1985). Pigmen yang dihasilkan mempunyai kestabilan yang lebih baik bila disimpan pada pH yang netral maupun alkali. Selain itu, angkak juga menghasilkan metabolit sekunder yaitu monakolin K atau lovastatin yang dapat meningkatkan sirkulasi darah serta menurunkan biosintesis kolesterol pada penderita penyakit jantung dan komplikasi lain dari arterosklerosis.
Angkak sudah digunakan secara luas di negara-negara Asia terutama Cina, Jepang, Taiwan, Thailand dan Filipina sebagai pewarna alami, yang memberikan warna merah yang menarik dan sedikit aroma pada produk-produk fermentasi tertentu, seperti minuman anggur merah, keju kedelai merah pasta ikan, dan kecap ikan (Hesseltine 1979). Angkak juga digunakan sebagai bahan dalam pengawetan daging, mempertahankan kualitas daging dan ikan karena adanya aktivitas antibakteri yaitu dengan cara menghambat pertumbuhan bakteri patogen dan perusak berspora seperti Bacillus cereus dan Bacillus stearothermophilus. (Wong & Koehler 1981). Selain itu digunakan dalam berbagai kepentingan medis misalnya mengobati beberapa penyakit yaitu asma, masalah pencernaan (diare, desentri), mabuk laut, luka memar, obat anti ngompol, serta meningkatkan jumlah trombosit penderita penyakit demam berdarah (Wong & Koehler 1981).
Kapang yang mampu menghasilkan pigmen merah gelap hanya kapang dari Monascus sp. Beberapa galur yang dapat memproduksi pigmen tersebut adalah M purpureus, M. angka, M. barkeri, M. major, serta M. rubroprunctus (Carels & Shepherd 1977). Akan tetapi, tidak semua Monascus sp sesuai untuk memproduksi angkak. Dari berbagai spesies ini, yang paling sering digunakan ialah Monascus purpureus (Hesseltine 1965).
Penggunaan angkak semakin berkembang di masyarakat, terutama untuk kepentingan medis. Akan tetapi, toksisitas dan efektivitas angkak masih perlu diteliti. Penggunaan angkak untuk berbagai keperluan harus diteliti toksisitasnya secara serius terutama pengaruhnya terhadap metabolisme di dalam tubuh. Obat yang digunakan untuk jangka panjang harus aman, jadi harus lolos uji toksisitas akut, subkronis dan kronis terhadap binatang percobaan. Angkak dinyatakan sebagai senyawa obat yang aman dikonsumsi oleh masyarakat. Akan tetapi, senyawa-senyawa yang mungkin berbahaya di dalam angkak yang menimbulkan efek samping bahkan adanya gejala keracunan belum banyak diteliti. Selain itu pengaruh angkak terhadap perubahan fungsi organ-organ tubuh belum banyak diketahui.
Penelitian toksisitas angkak sebelumnya mengunakan metode injeksi peritoneal tikus putih menunjukkan bahwa angkak mempunyai nilai Lethal Dose 50 (LD50)
sebesar 7 gram/kg berat badan (BB), serta dalam uji keracunan subakut tidak menimbulkan gejala yang abnormal pada organ tubuhnya (Steinkraus 1983). Tetapi menurut Su dan Wong (1977), mengkonsumsi angkak dengan dosis 18 gram/kg BB secara oral tidak menyebabkan kematian dan tidak menyebabkan keracunan, dilihat dari uji kecepatan pertumbuhan, efisiensi protein, DNA dan RNA.
TINJAUAN PUSTAKA
Produksi Angkak
Angkak berasal dari negara China. Pembuatan pertama pada masa Dinasti Tang, 800 M. Gambaran yang lengkap dan rinci tentang produksi angkak ditemukan pada farmakopedia Cina kuno (The Ancient Chinese Pharmacopoeia), Ben Coo Gang Mu dan Shi Bu Yi, telah mempublikasikan angkak sebelum Dinasti Ming (1364-1644 M). Berabad-abad yang lalu, angkak digunakan untuk mewarnai dan memberikan aroma pada makanan (John & Stuart 1991; Chen and John 1993).
Pigmen merah angkak terbentuk karena keluarnya cairan granular melewati ujung-ujung hifa M. purpureus. Ketika kultur masih muda, cairan ekstrusinya tidak berwarna, tetapi secara bertahap terjadi perubahan menjadi kemerahan. Hal ini terjadi karena pada waktu kultur masih muda, semua nutrisi dipakai untuk pertumbuhan dan setelah dewasa sebagian nutrisi digunakan untuk membentuk pigmen angkak (Carels & Shepherd 1977). Komponen utama dari pigmen yang dihasilkan oleh M. purpureus adalah rubropunktatin (merah), monaskorubrin (merah), monaskin (kuning), ankaflavin (kuning), dan rubropunktamin (ungu) Suwanto (1985) dan Maolinang et al (2001).
Kondisi fermentasi yang berpengaruh terhadap pigmen yang dihasilkan sudah dipelajari secara menyeluruh. Misalnya optimum pada suhu 30 ºC, pH 6, fermentasi selama 9 sampai 10 hari, kecepatan aerasi 1.5 rpm, dan kecepatan agitasi 300 rpm (Su 1978; Wong et al. 1982; Lin & Demain 1991; Chen & John 1993). Pigmen dari M. purpureus sangat stabil dan cocok untuk digunakan sebagai bahan tambahan makanan (Fink-Gremmels et al. 1991; Fabre et al. 1993; Juzvola et al. 1996).
Angkak juga mengandung metabolit yang digunakan untuk kepentingan medis yaitu Monakolin K atau Lovastatin (Juzvola et al. 1996). Monakolin merupakan metabolit penting yang sudah diidentifikasi dari Monascus sp (Endo 1979) dan digunakan sebagai senyawa yang menghambat sintesis kolesterol (Albert et al. 1980; Endo et a.l 1986). Angkak dapat meningkatkan sirkulasi darah dan dapat menurunkan kadar kolesterol sebesar 11-32% dan kadar trigliserida sebesar 12-19%. Penurunan kadar kolesterol merupakan pencegahan primer dan sekunder
terhadap penyakit jantung dan komplikasi lain dari arterosklerosis (Endo et a.l 1986). Produksi pigmen oleh M. purpureus biasanya menggunakan substrat beras sebagai sumber karbon. Substrat lain yang dapat digunakan sebagai sumber karbon selain beras adalah gandum, tapioka, kentang, suweg, ubi jalar, dan gaplek. Akan tetapi intensitas warna yang dihasilkan tidak sebaik pada beras. Berbagai beras dapat digunakan untuk membuat angkak. Banyak penelitian menunjukkan bahwa beras biasa memberikan hasil yang lebih baik dibandingkan dengan beras ketan. Hal ini terjadi karena pertumbuhan Monascus sp. terhalang oleh melekatnya butiran ketan yang satu dengan yang lain. Beras dengan kandungan amilosa yang lebih tinggi dan amilopektin yang lebih rendah merupakan substrat yang lebih baik untuk produksi angkak dibandingkan dengan beras dengan kandungan amilosa rendah Santoso & Satiawiharja (1985). Komposisi kimiawi angkak dapat dilihat pada Tabel 1.
Tabel 1 Komposisi kimiawi angkak
Kandungan Jumlah (%)
Air 7.0 - 10.0
Pati 53.0 - 60.0
Nitrogen 2.4 - 2.6 Protein Kasar 15.0 -16.0 Lemak Kasar 6.0 - 7.0
Abu 0.9 -1.0
Pigmen/zat warna 1.6 -19.0 Sumber : Suwanto (1985)
Gambar 1 Gambaran fisik angkak yang menghasilkan pigmen berwarna merah.
Monascus purpureus
ordo Eurotiales, famili Monascaceae, genus Monascus, dan spesies M. purpureus.
M. purpureus termasuk dalam kelas Ascomycetes. Jamur dalam kelas Ascomycetes telah ditemukan kurang lebih 30.000 spesies. Anggota kelas ini dicirikan memiliki askus. Askus adalah tipe spesial dari sporangium yang biasanya berisi delapan askospora. Askus yang muda memiliki dua inti haploid, yang selanjutnya mengalami meiosis menghasilkan delapan inti haploid. Miselium dari kelas Ascomycetes bercabang, sel individualnya mengandung satu sampai beberapa inti (Ingold 1984).
Spesies M. purpureus tidak banyak ditemukan di alam, sebagian besar ditemukan pada produk makanan. Mikrob ini menghasilkan warna yang khas. Propagulnya tipis, tumbuh menyebar dengan miselium yang berwarna merah atau ungu, namun dapat menjadi keabu-abuan jika konidia sedang tumbuh akan tetapi akan kembali berwarna merah keunguan serta tumbuh baik pada suhu 27-32 ºC.
Senyawa karbon merupakan sumber energi dalam pembentukan sel kapang dan pigmen. M. purpureus mempunyai aktivitas sakarifikasi dan proteolitik. Oleh karena itu dapat tumbuh baik pada medium yang mengandung pati dan protein. Selain enzim amilase dan protease, Monascus juga menghasilkan enzim maltase, invertase, lipase, oksidase, dan ribonuklease (Steinkraus 1983).
Tikus Sprague-Dawley
Hewan yang paling banyak digunakan untuk keperluan evaluasi atau penelitian adalah tikus putih (Rattus norvegicus), mencit (Mus muculus), tikus hitam (Rattus rattus). Tikus yang sering digunakan ialah tikus Sprague-Dawley.
Kelebihan menggunakan hewan coba tikus karena tikus hidup lebih baik sendiri dalam kurungan, mudah pengaturannya, mudah dipelihara, merupakan hewan yang relatif sehat dan peka terhadap pengaruh kolesterol jika diberikan perlakuan terhadap komponen dietnya. Beberapa karakteristik tikus adalah nocturnal (aktif pada malam hari), tidak mempunyai kantong empedu (gall blader), tidak dapat mengeluarkan isi perutnya (muntah) dan tidak pernah berhenti tumbuh, meskipun kecepatannya menurun setelah berumur 100 hari (Muchtadi 1989). Muchtadi (1989) juga menyatakan bahwa zat-zat gizi yang diperlukan untuk pertumbuhan tikus
hampir sama dengan manusia yaitu karbohidrat, lemak, protein, mineral dan vitamin.
Toksisitas Akut
Toksisitas suatu bahan dapat didefinisikan sebagai kapasitas suatu bahan untuk menciderai suatu organisme hidup. Timbulnya keracunan dapat disebabkan oleh dosis dan cara pemberian yang salah. Toksisitas suatu bahan kimia dilakukan dengan mempelajari efek-efek dari pemaparan bahan kimia terhadap binatang percobaan, pemaparan bahan kimia terhadap organisme tingkat rendah seperti bakteri dan kultur sel-sel dari mamalia di laboratorium.
Uji toksisitas digunakan sebagai uji keamanan suatu senyawa yang akan digunakan oleh manusia. Uji toksisitas suatu senyawa dibagi menjadi dua golongan yaitu toksisitas umum dan toksisitas khusus. Uji toksisitas umum meliputi berbagai pengujian yang dirancang untuk mengevaluasi keseluruhan efek umum suatu senyawa pada hewan uji. Pengujian toksisitas umum meliputi pengujian toksisitas akut, subakut atau subkronik dan kronik. Sedangkan pengujian toksisitas khusus meliputi uji potensiasi, uji kekarsinogenikan, uji reproduksi, kulit, mata, dan perilaku (Loomis 1978).
Toksisitas akut didefinisikan sebagai efek yang ditimbulkan oleh senyawa kimia atau obat terhadap organisme target yaitu dengan memberikan obat atau zat kimia yang sedang diuji sebanyak satu kali atau beberapa kali dalam jangka waktu 24 jam. Kebanyakan pemeriksaan toksisitas akut diarahkan pada penentuan LD50 dari suatu bahan kimia
tertentu. Akan tetapi toksisitas akut tidak selalu mendapatkan nilai LD50 (Chan et al
LD50 adalah dosis dari suatu zat atau obat
yang bila diaplikasikan pada sekelompok hewan percobaan dengan cara dan waktu tertentu dengan mematikan 50% dari jumlah hewan percobaan yang digunakan. Pengujian ini juga dapat menunjukkan organ sasaran yang mungkin dirusak dan efek toksik spesifiknya (Lu 1995). Tingkat keracunan senyawa kimia atau obat berdasarkan nilai LD50nya dan klasifikasi toksisitas akut pada
hewan dapat dilihat pada Tabel 2. Syarat percobaan LD50 yaitu efek yang terjadi
benar-benar karena senyawa kimia, efek bergantung pada dosis (dosis tinggi maka efek bertambah), efek terkuantifikasi atau bisa dihitung. Sedangkan faktor pendukungnya adalah hewan percobaan harus sehat dan seragam ukuran, umur, dan jenis kelamin, diadaptasi sebelum perlakuan kurang lebih 2 minggu, penimbangan bobot badan, konsumsi makanan, dan gejala-gejala klinis (Loomis 1978; Donatus 1998). Jangka waktu pengamatan biasanya 7-14 hari, akan tetapi pada kasus tertentu bisa lebih lama (Lu 1995; Chan et al. 1986). Nekropsi harus dilakukan pada semua hewan yang mati dan beberapa hewan yang hidup, terutama yang tampak sakit pada akhir masa percobaan. Nekropsi dapat memberikan informasi yang berharga mengenai organ sasaran, terutama bila kematian tidak terjadi segera setelah pemberian zat kimia. Mungkin juga diperlukan pemeriksaan histopatologis organ (Lu 1995).
Tabel 2 Batasan keracunan akut pada manusia berdasarkan klasifikasi Gleason
LD 50 (mg/kg)BB Kategori
<5 Super toksik
5 - 50 Amat sangat toksik 50 - 500 Sangat toksik 500 - 5000 Toksik 5000 - 15000 Toksik ringan
>15000 Praktis non toksik Sumber : Lu (1995)
Penentuan Kelainan Organ Hati
Hati merupakan organ terbesar dalam tubuh yaitu sekitar 2-3% dari bobot badan (Weiss 1977; Ressang 1984). Hati berada dalam rongga perut di sebelah kanan, tepat di bawah diafragma berwarna cokelat kemerahan (Kaplan 2002).
Sel hati berbentuk polihedral, berdiameter 20-25 mikron pada hewan dewasa, sedangkan pada hewan muda sekitar 2-7 mikron. Inti
bulat di tengah dan kadang-kadang tampak lebih dari satu inti (Hartono 1992). Pada umumnya hati terbagi dalam beberapa lobus. Secara fungsional unit terkecil hati adalah lobulus. Setiap lobulus hati yang berbentuk heksagonal mempunyai sebuah vena sentral. Dari vena sentral untaian sel-sel hati yang berbentuk balok-balok berderet secara radial ke arah perifer. Sudut-sudut pertemuan antara lobulus disebut segitiga Kiernan yang mengandung tiga unsur yaitu vena sentralis, cabang-cabang arteri hepatika, dan kanalikuli biliaris (Handoko 2003). Sel-sel kuffer yang berada di lumen sinusoid bertindak sebagai makrofag yang mempunyai fungsi fagositik (Ganong 1989). Melalui sinusoid ini darah dari arteri hepatika dan vena porta mengalir dari arah segitiga Kiernan ke vena sentralis sedangkan empedu mengalir dari arah vena sentralis ke segitiga Kiernan (Nabib 1987). Beberapa fungsi hati adalah sebagai tempat pembentukan empedu, penyimpanan dan pelepasan karbohidrat, pembentukan urea, metabolisme lemak, detoksifikasi obat dan toksin. Selain itu juga sebagai tempat pembentukan protein dan metabolisme beberapa hormon polipeptida serta metabolisme kolesterol (Ganong 1998).
Hati merupakan organ yang paling sering mengalami kerusakan (Carlton 1995). Sebagian besar senyawa toksik memasuki tubuh melalui sistem gastrointestinal. Setelah terjadi penyerapan, bahan toksik dibawa oleh vena porta ke hati. Aliran darah yang membawa obat atau senyawa organik asing melewati sel-sel hati secara perlahan-lahan (Siswandono 1995). Kerusakan hati sangat tergantung dari banyaknya faktor seperti jenis senyawa toksik, dosis, durasi pemberian serta status diet hewan yang dapat menjadi faktor penyebab kerusakan tersebut. Misalnya adanya defisiensi protein dan karbohidrat dapat meningkatkan kepekaan hati terhadap kerusakan yang diakibatkan oleh zat toksik. Beberapa jenis kerusakan hati akibat senyawa racun adalah pelemakan (steatosis), nekrosa, dan cirhosis (Lu 1995 & Banks 1981). Peradangan hati dapat terjadi secara infeksius maupun noninfeksius. Peradangan noninfeksius secara umum disebabkan oleh toksin. Hepatitis noninfeksius atau toksik dapat terjadi secara akut maupun kronis. Jenis-jenis kelainan hati akibat obat antara lain antara lain berupa pelemakan (steatosis), nekrosa, kolestatis, kerusakan pada vaskuler, dan hepatitis (Wenas 1996).
tahan terhadap infeksi virus, bakteri, dan bahan-bahan asing yang masuk melalui penyerapan di usus). Hati mempunyai ambang batas dalam melakukan proses detoksifikasi suatu zat kimia yang masuk ke dalam tubuh, maka akan terjadi kerusakan jika melebihi ambang batas tersebut (Lu 1995). Walaupun hampir 80% sel-sel hati rusak, hati ternyata masih sanggup beregenerasi dan bahkan sembuh sama sekali jika penyebab kerusakannya hilang atau musnah (Girindra 1988).
Kelainan yang terjadi di dalam hati dapat menyebabkan penyimpangan konsentrasi enzim tertentu di dalam darah. Penyimpangan ini dapat ditentukan dengan mengukur aktivitas enzim tersebut secara biokimiawi. Turun atau naiknya konsentrasi enzim di dalam darah dapat diakibatkan oleh kerusakan sel parenkim hati atau gangguan permeabilitas membran sel hati sehingga enzim bebas keluar sel. Hal ini menyebabkan enzim yang masuk ke dalam pembuluh darah melebihi dari biasanya sehingga kadarnya dalam darah meningkat. Di antara enzim yang bisa menunjukkan keadaan itu dan dapat diukur aktivitasnya ialah Alanin Amino Transferase (ALT), Aspartat Amino Transferase (AST), Alkalin Phosphatase (AP), Gamma Glutamil Transferase (GGT), 5’nukleotidase, dan Laktat Dehidrogenase (Girindra 1988 & Kaplan 2002).
Menurut Girindra (1988) enzim yang sering digunakan untuk menganalisis kerusakan di hati adalah ALT dan AST. Enzim ALT mengkatalis transaminasi alanin dan α-ketoglutarat menjadi piruvat dan glutamat. Reaksinya adalah:
ALT
L-alanin + α-ketoglutarat L-glutamat + piruvat LD
piruvat + NADH + H+ L-laktat + NAD+
Aktivitas AST lebih banyak dijumpai di dalam mitokondria dan sitosol semua sel di dalam plasma. Enzim ini mengkatalis transaminasi aspartat dan α-ketoglutarat menjadi glutamat dan oksaloasetat. Reaksinya adalah:
AST
L-aspartat +α-ketoglutarat L-glutamat + oksaloasetat
LDH
Oksaloasetat+NADH+H+ L-malat+NAD+
Penentuan Kelainan Organ Ginjal
Ginjal adalah alat tubuh yang mempunyai kemampuan menyaring dan menyerap kembali beberapa bahan dari sirkulasi darah dalam tubuh (Ressang 1984). Secara anatomis, ginjal merupakan alat tubuh yang berpasangan, berwarna cokelat, terletak dorsal di dalam rongga perut di sebelah kanan dan kiri tulang punggung yang umumnya berbentuk kacang dengan hilis renalis (tempat masuknya pembuluh darah dan keluarnya ureter) (Hartono 1992). Ginjal berfungsi untuk mempertahankan keseimbangan susunan darah dengan cara mengeluarkan air yang berlebihan dalam darah, mengeluarkan sisa metabolisme sebagai urea, asam kemih, alantoin dan amonia. Selain itu juga dapat mengeluarkan bahan-bahan asing yang terlarut dalam darah serta mengeluarkan garam-garam anorganik yang kebanyakan berasal dari makanan (Ressang 1984).
Unit fungsional dasar dari ginjal adalah nefron yang dapat berjumlah lebih dari satu juta buah dalam satu ginjal normal manusia dewasa. Nefron berfungsi sebagai regulator air dan zat terlarut (terutama elektrolit) dalam tubuh dengan cara menyaring darah, kemudian mereabsorpsi cairan dan molekul yang masih diperlukan tubuh. Molekul dan sisa cairan lainnya akan dibuang. Reabsorpsi dan pembuangan dilakukan menggunakan mekanisme transpor aktif dan kotranspor. Hasil akhir yang kemudian diekskresikan disebut urin.
Lengkung Henle menjaga gradien osmotik dalam pertukaran lawan arus yang digunakan untuk filtrasi. Sel yang melapisi tubulus memiliki banyak mitokondria yang menghasilkan ATP dan memungkinkan terjadinya transpor aktif untuk menyerap kembali glukosa, asam amino, dan berbagai ion mineral. Sebagian besar air (97.7%) dalam filtrat masuk ke dalam tubulus konvulasi dan tubulus kolektivus melalui osmosis. Cairan mengalir dari tubulus konvulasi distal ke dalam sistem pengumpul yang terdiri atas tubulus penghubung, tubulus kolektivus kortikal dan tubulus kolektivus medularis. Tubulus konvulasi distal bersinggungan dengan arteri aferen disebut aparatus juxtaglomerular, mengandung macula densa dan sel juxtaglomerular. Sel juxtaglomerular adalah tempat terjadinya sintesis dan sekresi renin. Cairan menjadi makin kental di sepanjang tubulus dan saluran untuk membentuk urin, yang kemudian dibawa ke kandung kemih melewati ureter.
Urin merupakan jalur utama ekskresi sebagian besar bahan toksik, akibatnya ginjal mempunyai aliran darah yang tinggi mengkonsentrasi bahan toksik pada filtrat, membawa bahan toksik melalui sel tubulus dan mengaktifkan bahan toksik tertentu. Oleh karena itu, ginjal adalah organ sasaran utama dari efek toksik. Semua bagian nefron secara potensial dapat dirusak oleh bahan toksik (Lu 1995). Perubahan-perubahan pada ginjal dapat berlangsung di dalam glomerulus, tubuli, interstitium dan pembuluh darah (Ressang 1984).
Akibat terjadinya absorbsi dan sekresi aktif tubulus proksimal, kadar bahan toksik pada tubulus proksimal sering lebih tinggi. Selain itu, kadar sitokrom P-450 pada tubulus proksimal lebih tinggi untuk mendetoksifikasi atau mengaktifkan bahan toksik (Lu 1995). Perubahan-perubahan di ginjal dapat terlihat secara mikroskopik adalah degenerasi epitel sederhana hingga nekrosa. Infiltrasi sedikit-sedikit sel-sel radang di dalam glomerulus atau interstitium dapat mempersulit diagnosis. Urea dalam darah (ureum) merupakan hasil metabolisme protein dengan deaminasi asam amino dan dikeluarkan melalui ginjal. Tahap pembentukannya adalah sebagai berikut:
+CO2+ NH2
Ornitin Sitrulin
- H2O
+H2O
Arginin urea
Ada beberapa kelainan yang umum terjadi pada beberapa penyakit ginjal. Sering kali pada beberapa jenis penyakit ginjal ditemukan adanya protein dalam urin, leukosit, sel darah merah dan silinder, yaitu potongan-potongan protein yang mengendap di tubulus dan didorong oleh urin ke vesika urinaria. Akibat penyakit ginjal yang lainnya ialah hilangnya kemampuan pemekatan atau pengenceran urin, uremia (urea dalam darah), asidosis (penurunan kemampuan ginjal untuk mengekskresikan asam-asam pencernaan dan metabolisme) dan retensi Na (Ganong 2002).
Pemeriksaan ureum dengan menggunakan beberapa metode telah berkembang pesat. Sejak menggunakan enzim urease sampai dengan beberapa prosedur seperti urograf dan bunograf yang menggunakan metode kromatografi yang sangat peka terhadap suhu. Fungsi ginjal dapat dievaluasi dengan berbagai uji laboratorium secara mudah. Langkah awal dimulai dengan pemeriksaan urinalisis lengkap, termasuk pemeriksaan sedimen kemih. Berbagai informasi penting mengenai status fungsi ginjal dapat diperoleh dari urinalisis. Pengukuran Blood Urea Nitrogen (BUN) dan kreatinin serum berguna untuk evaluasi gambaran fungsi ginjal secara umum. Dalam keterbatasannya kedua uji tersebut mampu membuat estimasi laju filtrasi glomerulus (LFG) yang akurat. Analisis enzim yang digunakan untuk mengukur kadar nitrogen dalam darah dengan menggunakan enzim urease atau jumlah kreatinin dalam darah dengan pereaksi asam pikrat maupun enzim kreatinin aminohidrolase (Kaplan 2002). Pengukuran urea sebagai salah satu indikator kelainan ginjal dengan metode enzimatis yaitu dibentuk oleh urease dari urea. Indikator Glutamat Dehidrogenase (GLDH) untuk oksidasi NADH ke NAD+ digunakan untuk membuat amonia. Karbondioksida dan amonia dihasilkan dari reaksi urea (Kaplan & Pesce 1989):
Urease
Urea + H2O 2NH3 + CO2
GLDH
2α-ketoglutarat+2NH4+2NADH
2L-glutamat + 2 NAD+ + H2O
BAHAN DAN METODE
Alat dan Bahan
gelas pemanas, mortar, blender, penyaring, tabung reaksi, gelas ukur, autopipet, tip, pipet Mohr, pipet tetes, sonde, gelas pengaduk, dan gelas piala, vial, spektrofotometer, inkubator dan sentrifus klinis.
Hewan percobaan yang digunakan adalah 25 ekor tikus Sprague-Dawley yang sehat berumur 2 bulan. yang diperoleh dari Fakultas Peternakan IPB.
Bahan-bahan yang digunakan ialah angkak dari beras, pereaksi ALT, pereaksi AST, pereaksi urea, BNF 10%, alkohol 70%, alkohol 80%, alkohol 90%, alkohol 95%, alkohol absolut I, alkohol absolut II, parafin, xilol I, xilol II, larutan albumin:gliserin (1:1), pewarna Mayer’s Hematoxylin, Litium Karbonat, pewarna Eosin, permount dan akuades.
Gambar 2 Tikus Sprague-Dawley.
Metode Penelitian
Rancangan Percobaan
Tikus dipelihara pada kandang berukuran 30cmx20cmx20cm. 25 ekor tikus sebagai hewan percobaan diadaptasikan selama 1 bulan. Selama adaptasi, tikus diberi makan, minum, dan ditimbang bobot badannya. Sebelum perlakuan (H-1), dianalisis kadar enzim ALT dan AST serta kadar urea darah.
Selanjutnya, tikus tersebut dikelompokkan menjadi lima kelompok, masing-masing terdiri atas 5 ekor tikus. Kelompok satu digunakan sebagai kontrol, hanya diberikan akuades tanpa pemberian angkak, kelompok dua diberikan angkak dengan dosis tunggal yaitu 2.5 gram/kg BB (10 kali dosis komersial), kelompok tiga diberikan angkak dengan dosis 5 gram/kg BB, kelompok empat diberikan angkak dengan dosis 10 gram/kg BB, dan kelompok lima diberikan angkak dengan dosis 15 gram/kg BB. Pemberian angkak dilakukan secara per oral atau cekok.
Semua hewan pada tiap kelompok diamati, dianalisis kadar enzim ALT, AST, kadar urea
darah serta dilihat tingkat kematiannya pada 24 jam pertama (H+1), dilanjutkan sampai 5 hari (H+5). Selama 5 hari, semua kelompok diamati gejala klinisnya seperti nafsu makan, bobot badan, keadaan mata, feses, bulu dan tingkah laku. Setelah (H+5), hewan dinekropsi untuk mendapatkan gambaran histopatologis atau melihat efek racun pada organ-organ vitalnya terutama hati dan ginjal .
Analisa histopatologis dilakukan di Laboratorium Patologi, Fakultas Kedokteran Hewan, Institut Pertanian Bogor
Pengukuran Kelainan Hati (Metode Bergmeyer 1986)
Analisis enzim dapat digunakan untuk menilai fungsi suatu organ. Kelainan yang terjadi di dalam hati menyebabkan penyimpangan konsentrasi enzim tertentu dalam darah. Transaminase merupakan kelompok enzim yang sering digunakan dalam penentuan fungsi hati yang biasa dikenal sebagai aminotransferase misalnya Alanin Amino Transferase (ALT) dan Aspartat Amino transferase (AST). Menurut Girindra (1984) manusia yang menderita kanker hati, keadaan kedua enzim dalam darah meningkat. Kadar kedua enzim dalam serum yang meningkat, sehingga pengukuran aktivitas enzim tersebut dapat digunakan untuk menentukan fungsi hati
Serum darah diambil sebanyak 0.1 mL dan dicampur dengan 1 mL pereaksi AST, setelah 1 menit pada suhu 30 °C, dibaca absorbansinya pada panjang gelombang 340 nm dan dilanjutkan kembali pembacaannya pada menit ke-1, 2 dan 3 dan 4. Pereaksi AST terdiri atas buffer Tris HCl, L-aspartat, α -oksoglutarat, Malat dehidrogenase, Laktat dehidrogenase, dan NADH.
Pengukuran kadar ALT cara pengukurannya sama. Pereaksinya terdiri atas buffer Tris HCl, L-Alanin, α-oksoglutarat, Laktat dehidrogenase, dan NADH. Penghitungan aktivitas AST dan ALT dilakukan dengan rumus:
1746 x ∆A Hg nm/menit
Pengukuran Kelainan Ginjal (Kaplan&Pesce 1989)
amonia, yang dapat diukur dengan analisis spektrofotometri. Sampel berupa serum darah diambil sebanyak 10µL dan dicampur dengan 1000µL pereaksi urea, setelah 30 detik pada suhu 37 °C, dibaca absorbansinya pada 340 nm dan dilanjutkan kembali pembacaannya setelah 1,2,3 dan 4 menit. Standar diukur pada keadaan yang sama, hanya mengganti serum dengan standar.
Pereaksi urea adalah buffer fosfat, urease, natrium salisilat, natrium nitroprusida, EDTA, sodium hipoklorit, sodium hidroksida. Perhitungan konsentrasi urea diperoleh dengan cara:
[urea](mg/dL) =
ΔAstandar
ΔAsampel
x [standar]
Pembuatan Preparat Histopatologis (Humason 1972; Kiernan 1990)
Organ yang akan dibuat dipotong tipis kemudian direndam di dalam larutan Buffer Neutral Formaline (BNF) 10% selama 6-48 jam. Setelah itu, jaringan diiris dengan ketebalan ±3 mm2 dan dimasukkan ke dalam kaset tisu untuk didehidrasi.
Dehidrasi. Sediaan dimasukkan ke dalam gelas-gelas Mesin Autotehnicon berturut-turut yang berisi alkohol 70% selama 6 jam, alkohol 80%, 90%, dan alkohol 95% selama 2 jam. Setelah itu, sediaan direndam dalam alkohol absolut I tiga kali masing-masing selama 1 jam. Kemudian, dimasukkan ke dalam alkohol absolut II selama 1 jam.
Clearing. Sediaan yang sudah mengalami dehidrasi direndam dalam larutan alkohol 70% kemudian dengan larutan xilol I dan xilol II masing-masing selama 45 menit. Selanjutnya dimasukkan ke dalam parafin pada gelas pemanas dengan suhu 60 °C dua kali masing-masing 45 menit.
Embedding (Pencetakan). Setelah proses clearing, sediaan dimasukkan ke dalam alat pencetak yang berisi parafin cair setengah dari volume, setelah mulai membeku parafin ditambahkan kembali sampai alat pencetak penuh dan dibiarkan sampai dingin dan mengeras.
Sectioning (Pengirisan). Pemotongan dilakukan dengan menggunakan mikrotom setebal 5 mikron. Hasil irisan yang berbentuk pita diletakkan di atas permukaan air yang telah dihangatkan lebih dahulu dengan suhu sekitar 40-45 °C. Tujuannya untuk merentangkan jaringan yang keriput pada saat pengirisan. Setelah itu dilakukan pemilihan irisan preparat yang bagus.
Mounting. Sediaan tersebut diangkat dari permukaan air dengan cara menempelkannya ke atas kaca obyek yang telah diolesi albumin dan gliserin (1:1). Preparat dimasukkan ke dalam inkubator dengan temperatur 60 °C semalam.
Staining (Pewarnaan). Sebelum dilakukan pewarnaan, terlebih dahulu dilakukan proses deparafinasi (penghilangan parafin) dan proses rehidrasi (penambahan air) agar zat warna dapat menyerap dengan sempurna. Deparafinasi dilakukan dengan cara sediaan dimasukkan ke dalam xilol I dan xilol II masing-masing 2 menit. Setiap kali dilakukan pemindahan, daerah sekitar preparat diusap dengan kertas tisu tanpa menyentuh jaringan. Rehidrasi dilakukan dengan cara memasukkan sediaan ke dalam alkohol bertingkat masing-masing 1 menit. Setelah proses rehidrasi, sediaan disimpan dalam air mengalir selama 1 menit lalu dimasukkan ke dalam pewarna Hematoxylin Mayers selama 8 menit dan Litium Karbonat selama 15-30 detik dan kemudian dibilas dengan air mengalir. Selanjutnya sediaan dimasukkan ke dalam pewarna Eosin selama 2-3 menit lalu dibilas kembali dengan air mengalir. Setelah pewarnaan selesai, dilakukan dehidrasi sediaan ke dalam alkohol bertingkat kembali sebanyak 10 celupan xilol I dan xilol II, dikeringkan, ditetesi permount dan ditutup dengan gelas penutup.
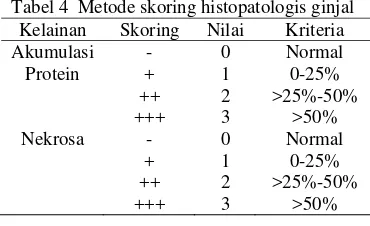
Pengamatan mikroskopis yang dilakukan dengan menggunakan mikroskop cahaya. Penilaian dengan metode skoring berdasarkan tingkat keparahan pada setiap luasan wilayah pengamatan. Skoring histopatologis organ hati dan ginjal ditunjukkan pada Tabel 3 dan 4. Semakin besar persentase skoring, maka tingkat kerusakannya semakin besar.
Tabel 4 Metode skoring histopatologis ginjal Kelainan Skoring Nilai Kriteria Akumulasi Protein Nekrosa - + ++ +++ - + ++ +++ 0 1 2 3 0 1 2 3 Normal 0-25% >25%-50% >50% Normal 0-25% >25%-50% >50% Analisis Data
Rancangan yang digunakan pada penelitian adalah dua faktor dalam rancangan acak lengkap (RAL). Perlakuan yang akan diuji cobakan dibedakan menjadi lima macam perlakuan dengan lima kali ulangan setiap perlakuan. Model rancangan percobaannya ialah sebagai berikut: (Matjik A.A dan Sumertajaya M 2000)
Yij = µ + λij + εij Keterangan :
i = 1, 2, 3,4 5 i = 1, kontrol
2, pemberian angkak dengan dosis 2.5 g/BB
3, pemberian angkak dengan dosis 5 g/BB
4, pemberian angkak dengan dosis 10 g/BB
5, pemberian angkak dengan dosis 15 g/BB
Yij = pengaruh perlakuan ke-i dan ulangan ke-j
µ = pengaruh rata-rata umum
λij = pengaruh perlakuan ke i, i = 1, 2, 3,...5
εij = pengaruh acak perlakuan i, i = 1, 2, 3,...5
HASIL DAN PEMBAHASAN
Keadaan Hewan Coba
Gambar 3 menunjukkan bahwa tidak terlihat adanya perubahan yang berarti pada pola grafik bobot badan tikus kelompok yang diberi perlakuan dengan kelompok kontrol. Demikian juga apabila dibandingkan dengan masa adaptasi (P>0.05). Dengan demikian, dapat dikatakan bahwa pemberian angkak tidak mempengaruhi bobot badan hewan coba. Selain pengamatan bobot badan, gejala klinis yang diamati meliputi nafsu makan, tingkah laku, keadaan mata dan keadaan bulu. Gejala klinis hewan coba menunjukkan bahwa nafsu makan semua hewan coba baik
kelompok perlakuan maupun kontrol tidak menunjukkan perubahan (Tabel 5). Pengamatan terhadap keadaan mata, tingkah laku, dan keadaan bulu tidak menunjukkan adanya perubahan selama perlakuan dan adaptasi. Saat perlakuan, pada kelompok perlakuan fesesnya berwarna kemerah-merahan. Feses yang berwarna merah tersebut diamati dengan mikroskop yang menunjukkan bahwa warna merah yang tampak berasal dari sisa pencernaan angkak setelah diserap di usus, dan dosis yang diberikan cukup besar menyebabkan serat kasar angkak mewarnai feses.
Selama perlakuan, tidak ditemukan hewan coba yang mati. Kelompok kontrol, 2.5 g/kg BB, 5g/kg BB, 10 g/kg BB, dan 15 g/kg BB angkak tidak menunjukkan adanya hewan coba yang mati selama 24 jam pertama hingga 5 hari setelah percobaan.
0 50 100 150 200 250 300 350
-50 -40 -30 -20hari ke--10 0 10 20
bobot ba da n ( gr am )
[image:30.612.333.497.304.423.2]kontrol 2.5 g/kg BB 5 g/kg BB 10 g/kg BB 15 g/kg BB
[image:30.612.330.511.477.618.2]Gambar 3 Bobot badan tikus Sprague-Dawley selama adaptasi dan perlakuan dengan berbagai dosis.
Tabel 5 Gejala klinis hewan coba selama perlakuan Kelompo k nafsu maka n keadaa n mata keadaa n bulu feses
Kontrol - - - hita
m 2.5g/kgB
B
- - - mera
h 5 g/kg
BB
- - - mera
h 10g/kgB
B
- - - mera
h 15g/kgB
B
- - - mera
Gambar 4 Feses tikus yang diamati dengan mikroskop.
Pengaruh Angkak Terhadap Aktivitas Enzim AST dan ALT
Tabel 6 menunjukkan bahwa rataan aktivitas enzim ALT sebesar 30.87±10.68 U/L dan AST sebesar 63.00±20.99 U/L. Menurut Girindra (1984), kisaran normal aktivitas enzim AST tikus sebesar 45.7-80.8 U/L sedangkan aktivitas ALT sebesar 17.0-30.2 U/L. Jadi, aktivitas enzim ALT dan AST tikus sebelum perlakuan masih dalam keadaan normal. Kelompok kontrol tidak digunakan untuk menganalisis karena serumnya mengalami hemolisis.
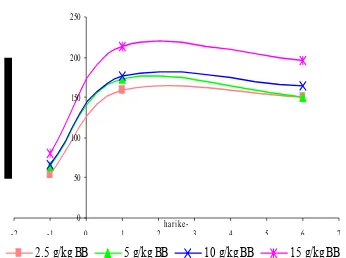
Gambar 5 menunjukkan bahwa aktivitas enzim AST pada semua kelompok perlakuan meningkat secara signifikan pada H+1 dan H+5 terhadap H-1 (P>0.05). Aktivitas enzim AST pada semua kelompok perlakuan pada H+5 naik tidak signifikan terhadap H+1. Perbandingan aktivitas enzim AST ditunjukkan pada Tabel 7, yang menunjukkan bahwa aktivitas enzim AST pada H+1 dan H+5 pada dosis 2.5 g/kg BB, 5 g/kg BB, dan 10 g/kg BB berbeda secara signifikan dengan dosis 15 g/kg BB (P>0.05).
Gambar 6 menunjukkan bahwa aktivitas enzim ALT pada semua kelompok perlakuan meningkat secara signifikan pada H+1 (P>0.05). Aktivitas enzim ALT pada semua kelompok perlakuan pada H+5 naik tidak signifikan terhadap H+1. Perbandingan aktivitas enzim ALT ditunjukkan pada Tabel 8, yang menunjukkan bahwa pada H+1 ada perbedaan yang signifikan pada semua dosis (P>0.05). Sedangkan pada H+5, kelompok 2.5 g/kg BB, 10 g/kg BB, dan 15 g/kg BB menunjukkan perbedaan yang signifikan dengan dosis 5 g/kg BB (P>0.05). Hal ini menunjukkan bahwa dosis berpengaruh pada kerusakan sel-sel hati.
Peningkatan aktivitas enzim AST dan ALT pada semua kelompok perlakuan angkak disebabkan karena pemberian angkak dengan dosis besar akan mengakibatkan hepatolisis sehingga enzim akan keluar, dan jumlah
dalam serum meningkat. Hal itu didukung dengan adanya sel hepatosit yang mengalami nekrosa pada analisa histopatologis. Hal itu sesuai dengan Girindra (1984) yang menyatakan bahwa peningkatan aktivitas enzim AST dan ALT di dalam darah disebabkan adanya perubahan fisiologis hati, sehingga konsentrasi enzim tersebut di dalam darah meningkat. Turun atau naiknya konsentrasi enzim dalam darah dapat diakibatkan oleh kerusakan enzim-enzim parenkim hati atau gangguan permeabilitas membran sel hati sehingga enzim bebas ke luar sel. Hal ini menyebabkan enzim yang masuk ke dalam pembuluh darah melebihi normal sehingga kadarnya dalam darah meningkat, sehingga terjadi peningkatan kadar enzim dalam darah, serta sintesisnya dalam hati menurun karena adanya kerusakan hepatoseluler sehingga aktivitasnya dalam darah menurun.
Tabel 6 Rata-rata aktivitas enzimatik pada tikus Sprague-Dawley sebelum perlakuan
Parameter AST (U/L) ALT(U/L) N = 25 N = 25 Rataan 63.00±20.99 30.87±10.68
Tabel 7 Pengaruh pemberian angkak terhadap rataan aktivitas enzim AST Kelompok
N=25 H+1 (U/L) H+5 (U/L)
2.5g/kgB
B 159.2352±27.16
a
150.6216±30.90a
5g/kg BB 172.5048±14.44
a
b 151.0872±25.80a
10g/kgBB 175.9968±24.69
a
b 164.8224±46.53
a b
15g/kgBB 213.3612±31.99c 196.134±45.10b
Keterangan: huruf yang berbeda pada kolom yang sama menunjukkan nilai yang berbeda nyata (P>0.05)
Tabel 8 Pengaruh pemberian angkak terhadap rataan aktivitas enzim ALT Kelompok
N=25 H+1 (U/L) H+5 (U/L)
2.5 g/ kgBB 66.46±7.63a 63.5544±18.25b
5 g/ kg BB 89.28±29.72b 52..4964±14.49a
10 g/ kg BB 75.18±26.22ab 61.3428±11.70ab
15 g/ kg BB 104.6±25.03c 67.8612±19.41b
[image:31.612.324.514.418.506.2]0 50 100 150 200 250
-2 -1 0 1 2 3 4 5 6 7
ha ri ke
[image:32.612.134.307.80.209.2]-2.5 g/kg BB 5 g/kg BB 10 g/kg BB 15 g/kg BB
Gambar 5 Perbandingan aktivitas AST perlakuan pemberian angkak pada H-1, H+1, dan H+5.
0 20 40 60 80 100 120
-2 0 2 4 6 8
A k tiv ita s e n zi m A L T ( U/ L )
2.5 g/kg BB 5 g/kg BB 10 g/kg BB 15 g/kg BB
Gambar 6 Perbandingan aktivitas ALT perlakuan pemberian angkak pada H-1, H+1, dan H+5.
Pengaruh Angkak Terhadap Kadar Urea Darah
Tabel 9 menunjukkan bahwa kadar urea darah tikus sebesar 19.639±2.143 mg/dL. Menurut Malole dan Pramono (1989) kadar urea darah tikus normal berkisar antara 15.0-21.0 mg/dL. Jadi, kadar urea darah tikus percobaan sebelum perlakuan masih dalam kisaran normal.
Perbandingan kadar urea darah pada (H-1), (H+1), dan (H+5) terdapat pada Gambar 7, yang menunjukkan bahwa kadar urea darah pada semua kelompok perlakuan meningkat secara signifikan pada H+1 (P>0.05). Kadar urea darah pada semua kelompok perlakuan pada H+5 naik tidak signifikan terhadap H+1. Tabel 9 menunjukkan bahwa perbandingan kadar urea dalam darah pada H+1 dosis 5 g/kg BB dan 15 g/kg BB berbeda secara signifikan dengan 2.5 g/kg BB dan 10 g/kg BB. Pada H+5 antara dosis 2.5 g/kg BB dan 5 g/kg BB
menunjukkan nilai yang berbeda secara signifikan dengan dosis 10 g/kg BB dan 15 g/kg BB (P>0.05). Hal ini menunjukkan bahwa dosis berpengaruh pada kerusakan sel-sel ginjal.
[image:32.612.136.308.274.408.2]Kadar urea darah yang meningkat kemungkinan disebabkan karena kerusakan pada sel-sel ginjal. Hal itu didukung pada analisa histopatologis bahwa di dalam lumen tubulus terdapat akumulasi protein dan nekrosa di sel tubulinya. Menurut Ganong (2002), kenaikan kadar urea darah tinggi menunjukkan bahwa jumlah protein di dalam tubuh tinggi serta tidak adanya faktor penghambat pembentukan urea dalam darah.
Tabel 9 Rata-rata kadar urea darah pada tikus Sprague-Dawley sebelum perlakuan
[image:32.612.327.509.346.555.2]Rata-rata Kadar urea darah (mg/dL) 19.639±2.143
Tabel 10 Pengaruh pemberian angkak terhadap kadar urea darah
Kelompok
N=25 H+1 (mg/dL) H+5 (mg/dL)
2.5 g/ kg BB 24.2530±3.70a 25.8554±3.93a
5 g/ kg BB 32.0964±8.17b 30.6024±12.57ab
10 g/ kg BB 38.1807±7.19c 41.2771±12.55cd
15 g/ kg BB 30.7952±6.54b 48.3133±13.35d
0 10 20 30 40 50 60
-2 0 2 Hari ke- 4 6 8
K ad ar U re a da ra h ( m g/ dL )
2.5 g/kg BB 5 g/kg BB 10 g/kg BB 15 g/kg BB
Gambar 7 Perbandingan kadar urea darah perlakuan pemberian angkak pada H-1, H+1, dan H+5.
Gambaran Histopatologis Hati dan Ginjal
yang spesifik pada kelompok kontrol dan perlakuan.
Lesio secara mikroskopis yang ditemukan di hati yaitu perubahan pada sel hepatosit dan interstitium. Hasil pengamatan histopatologis jaringan hati ditunjukkan pada Gambar 8, 9, 10, dan 11. Pada kelompok kontrol, interstitiumnya banyak ditemukan adanya kongesti, sedangkan pada sel hepatosit banyak ditemukan degenerasi lemak dan nekrosa. Begitu pula pada kelompok perlakuan terjadi lesio yang serupa.
Gambar 8 juga menunjukkan adanya kongesti. Kongesti adalah pembendungan secara berlebihan oleh darah di pembuluh darah suatu jaringan tertentu. Pada umumnya, kongesti hati terjadi di vena sentralis dan sinusoid-sinusoid di sekelilingnya Hal ini menyebabkan sinusoid mengalami dilatasi. Perubahan tersebut merupakan respon umum pembuluh darah akibat penggunaan bahan anestesi kloroform ataupun eter sebelum nekropsi karena eter dan kloroform merupakan anestesik kuat yang dapat menyebabkan vasodilatasi pembuluh darah (Ganiswara 1995). Oleh karena itu, kongesti tidak digunakan sebagai kategori kerusakan hati akibat perlakuan pada evaluasi histopatologis.
Gambar 9 menunjukkan adanya degenerasi lemak. Degenerasi merupakan gangguan metabolisme pada sel, sehingga kehilangan struktur dan fungsi normalnya. Degenerasi terjadi pada sel yang hidup dan bersifat reversibel. Sel yang mengalami degenerasi ditandai dengan adanya pengumpulan produk metabolisme seperti molekul lemak, protein dan glikogen dalam jumlah yang abnormal. Degenerasi menunjukkan adanya gangguan biokimiawi sel yang disebabkan karena metabolisme abnormal dan zat kimia yang toksik (Spector 1993). Degenerasi lemak secara mikroskopis terlihat droplet-droplet lemak pada lobulus hati terutama daerah perilobuler (Benirschke 1978; Lawrence 1992). Faktor-faktor penyebab degenerasi misalnya bahan toksik, kekurangan oksigen, atau pakan banyak mengandung lemak.
Gambar 10 menunjukkan adanya nekrosa. Nekrosa adalah kematian sel yang umum setelah sel terpapar stimulus eksogen, seperti rangsangan kimia yang menyebabkan pembengkakan sel, selanjutnya sel pecah, terjadi denaturasi dan koagulasi sitoplasma serta hancurnya sel (Sudiono et al. 2003). Jaringan hati yang mengalami nekrosa dapat sembuh dengan regenerasi sel-sel hati yang masih hidup jika penyebab nekrosa
dihilangkan (Ressang 1984). Secara mikroskopis, nekrosa bersifat koagulatif yang ditandai dengan inti hepatosit berubah menjadi suram dan gelap (pignosis) serta adanya inti hepatosit yang mengalami karioreksis. Karioreksis ditandai dengan penyusutan inti sel dan terjadi peningkatan warna basofilik yang solid dan mengecil. Dalam waktu satu sampai dua hari nukleus akan menghilang total (Sudiono 2003).
Gambar 11 menunjukkan pada kelompok kontrol masih terlihat hepatosit yang masih baik yaitu masih berbentuk lobus yang jelas dengan vena sentralis di tengah. Sitoplasma berwarna merah muda karena mengikat zat warna Eosin dan inti sel berwarna ungu kebiruan karena mengikat zat warna Hematoksilin.
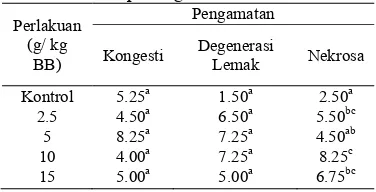
[image:33.612.327.505.540.685.2]Lesio yang terjadi pada organ hati kemudian dianalisis melalui skoring sehingga diberi nilai sesuai tingkat keparahan. Nilai skoring histopatologis hati ditunjukkan pada Tabel 11. Tabel 11 menunjukkan hasil pengamatan terhadap kongesti, nekrosa dan degenerasi lemak pada organ hati. Setelah didapatkan nilai skoring histopatologis hati, kemudian nilai tersebut diuji dengan analisis Kruskal-Wallis. Hasil uji histopatologis organ hati yang dianalisis dengan uji Kruskal-Wallis ditunjukkan pada Tabel 12. Tabel 12 menunjukkan bahwa lesio pada organ hati yaitu kongesti dan degenerasi lemak antara kontrol dan perlakuan tidak berbeda secara signifikan (P>0.05) Sedangkan nekrosa yang terjadi semua perlakuan berbeda nyata dengan kontrol. Kerusakan pada hati disebabkan karena hati berfungsi sebagai penyaring darah terutama dari saluran pencernaan melalui vena porta. Darah yang berasal dari vena porta tidak hanya mengandung bahan makanan tetapi kadang-kadang senyawa toksik (Frenkel 1985).
Gambar 8 Gambaran mikroskopis hati tikus yang mengalami kongesti pada kelompok kontrol pewarnaan HE 1 bar 30 µm.
Gambar 9 Gambaran mikroskopis hati tikus yang mengalami degenerasi lemak pada kelompok dosis angkak 15 g/kg BB pewarnaan HE 1 bar 30 µm.
Gambar 10 Gambaran mikroskopis hati tikus daerah yang mengalami nekrosa dengan dosis angkak 15g/kgBB pewarnaan HE1bar50 µm.
Gambar 11 Gambaran mikroskopis hati tikus daerah yang normal pada kontrol pewarnaan HE, 1 bar 50 µm.
Tabel 11 Nilai skoring histopatologis hati Perlakuan
(g/ kg BB)
Pengamatan
Kongesti Akumulasi
Lemak Nekrosa Kontrol 0.333 0.400 0.333
2.5 0.267 1.267 0.533
5 0.433 1.267 0.533
10 0.233 1.233 1.000 15 0.333 1.033 0.900
Tabel 12 Hasil Uji Kruskal-Wallis histopatologis hati Perlakuan
(g/ kg BB)
Pengamatan
Kongesti Degenerasi
Lemak Nekrosa
Kontrol 5.25a 1.50a 2.50a
2.5 4.50a 6.50a 5.50bc
5 8.25a 7.25a 4.50ab
10 4.00a 7.25a 8.25c
15 5.00a 5.00a 6.75bc
Keterangan: huruf yang berbeda pada kolom yang sama menunjukkan nilai yang berbeda nyata (P>0.05) .
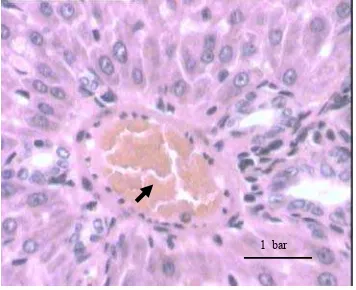
Pengamatan organ ginjal dilakukan terhadap lesio pada sel-sel tubulus. Perubahan yang terjadi pada kontrol yaitu pada kapiler antar tubulus terjadi kongesti, sel tubulusnya mengalami nekrosa (inti sel terlihat berwarna gelap dan suram). Selain itu, lumen tubulusnya mengalami akumulasi protein. Akumulasi protein dan nekrosa juga terjadi pada kelompok perlakuan. Perubahan yang terjadi pada ginjal dapat dilihat pada Gambar 12, 13 dan 14.
Gambar 12 menunjukkan adanya nekrosa. Sel-sel tubulus mengalami nekrosa intinya terlihat suram dan mengalami karioreksis. Nekrosa pada sel-sel epitel tubulus terjadi pada semua perlakuan. Nekrosa dapat terjadi karena adanya racun atau toksin, agen kimia, agen biologis, agen fisik, suhu yang ekstrim dan kerentaan (Rumawas 1989; Soleh 1996). Gambar 13 juga terdapat adanya akumulasi protein di lumen tubulus. Keberadaan protein di dalam lumen tubulus dipengaruhi berbagai faktor diantaranya peningkatan permeabilitas kapiler glomerulus sehingga protein yang berukuran besar dapat lolos. Bila epitel tubulus mengalami degenerasi dan nekrosa maka protein yang lolos tidak mampu untuk diserap kembali secara maksimal yang akhirnya tertimbun di dalam lumen (Carlton & Mc Gavin 1995). Akumulasi protein yang berlebihan di lumen tubulus dapat menyebabkan proteinuria. Permeabilitas glomerulus meningkat sehingga protein ditemukan di dalam urin dalam jumlah besar (Ganong 2002). Gambar 14 menunjukkan sel tubulus yang normal. Sel-selnya masih teratur dan lumen kosong. Setelah dilakukan pengamatan terhadap lesio yang terjadi pada organ ginjal kemudian diberi skor dan diberi nilai sesuai tingkat
1 bar
[image:34.612.324.512.144.240.2] [image:34.612.127.315.642.705.2]keparahan. Nilai skoring histopatologis ginjal ditunjukkan pada Tabel 13. Tabel 13 menunjukkan hasil pengamatan terhadap kelainan pada ginjal yaitu nekrosa dan akumulasi protein. Setelah mendapatkan nilai lesio histopatologis organ ginjal kemudian nilai tersebut diuji dengan uji Kruskal-Wallis. Hasil uji Kruskal-Wallis histopatologis ginjal ditunjukkan pada Tabel 14. Tabel 14 menunjukkan bahwa akumulasi protein dan nekrosa yang terjadi, berbeda nyata antara kontrol dengan perlakuan (P>0.05). Nekrosa yang terjadi signifikan dengan naiknya dosis. Semakin tinggi dosis yang diberikan mengakibatkan nekrosa yang terjadi juga semakin besar.
[image:35.612.329.508.82.419.2]Epitel ginjal merupakan bagian yang sensitif terhadap bahan-bahan yang bersifat toksik. Bahan-bahan toksik yang biasanya masuk ke ginjal melalui aliran darah tersebut dapat menimbulkan perubahan pada ginjal berupa cloudy swelling, degenerasi lemak dan nekrosa. Tingkat perubahan organ tergantung sifat zat toksik (Smith 1974; Thomas 1979). Menurut Lu (1995), tubulus proksimal merupakan bagian yang paling mudah mengalami kerusakan akibat zat toksik. Hal itu dapat disebabkan karena karena pada tubulus proksimal terjadi proses absorbsi dan sekresi berbagai zat. Bila terjadi absorbsi bahan toksik pada epitel tubuli akan mengganggu metabolisme dan absorbsi. Selain itu, kadar sitokrom P-450 pada tubulus proksimal lebih tinggi untuk mendetoksifikasi atau mengaktifkan zat toksik. Jika degenerasi dan nekrosa belum begitu parah, regenerasi sel epitel mungkin terjadi setelah penyebabnya dihilangkan (Smith 1974).
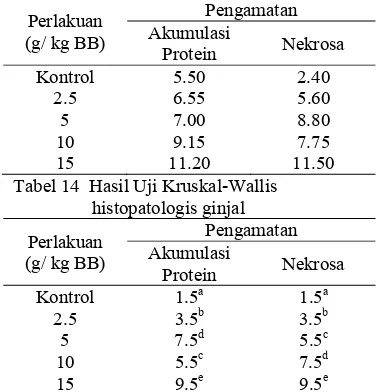
Tabel 13 Nilai skoring histopatologis ginjal Perlakuan
(g/ kg BB)
Pengamatan Akumulasi
Protein Nekrosa Kontrol 5.50 2.40
2.5 6.55 5.60
5 7.00 8.80
10 9.15 7.75
[image:35.612.330.507.455.598.2]15 11.20 11.50
Tabel 14 Hasil Uji Kruskal-Wallis histopatologis ginjal Perlakuan
(g/ kg BB)
Pengamatan Akumulasi
Protein Nekrosa
Kontrol 1.5a 1.5a
2.5 3.5b 3.5b
5 7.5d 5.5c
10 5.5c 7.5d
15 9.5e 9.5e
Keterangan: huruf yang berbeda pada kolom yang
sama menunjukkan nilai yang berbeda nyata (P>0.05).
Gambar 12 Gambaran mikroskopis ginjal tikus yang mengalami nekrosa pada sel tubulus dengan dosis 15 g/kg BB pewarnaan HE 1bar 50 µm.
Gambar 13 Gambaran mikroskopis ginjal tikus yang mengalami akumulasi protein dengan dosis 15 g/kg BB pewarnaan HE 1 bar 30 µm.
Gambar 14 Gambaran mikroskopis ginjal tikus yang normal pewarnaan HE 1 bar 50 µm.
SIMPULAN DAN SARAN
Simpulan
1 bar
1 bar
[image:35.612.126.314.503.699.2]Tidak ditemukan adanya kematian hewan coba pada semua perlakuan sejak 24 jam sampai 5 hari setelah perlakuan, sehingga angkak dikategorikan sebagai senyawa non toksik. Selama perlakuan, bobot badan tikus tidak mengalami kenaikan yang signifikan (P>0.05). Gejala klinis hewan coba (nafsu makan, keadaan mata, keadaan bulu dan tingkah laku) tidak menunjukkan adanya perubahan. Namun, pada kelompok perlakuan fesesnya berwarna kemerahan.
Aktivitas enzim ALT, AST serta kadar urea darah semua kelompok perlakuan pada H+1 dan H+5 meningkat secara signifikan dibandingkan pada H-1 (P>0.05). Peningkatan aktivitas enzim AST, ALT dan kadar urea darah berbanding lurus dengan dosis. Perbedaan antar dosis tersebut menunjukkan bahwa dosis berpengaruh terhadap kerusakan organ hati dan ginjal.
Organ hati mengalami kongesti, degenerasi lemak dan nekrosa. Sedangkan organ ginjal mengalami akumulasi protein dan nekrosa pada sel tubulusnya.
Saran
Perlu penelitian lebih lanjut dengan jangka waktu dan pemakaian yang lebih lama seperti toksisitas kronik atau subkronik dengan menggunakan hewan percobaan dari spesies yang lebih tinggi tingkatannya dan lepas sapih dengan dosis 0.5 g/kg BB (dosis komersial) sampai 2.5 g/kg BB.
DAFTAR PUSTAKA
Albert AW. 1980. Mevinolin: a Highly Potent Competitive Inhibitor of Hydroxymethylglutaryl Coenzyme A Reductase and a Cholesterol-lowering Agent. Proceedings National Academy of Sciences. 77: 3957-3961.
Alexopoulus CJ and Mims CW.1979. Introductory Micology. New York: J Wiley and Sons.
Banks WJ. 1981. Applied Veterinary Histology. New York: William and Wilkins.
Benirschke KF, M Gardner, TC Johnes. 1978. Pathology of Laboratory Animals. Vol 2. New York: Springer Verlag.
Carels M, Shepherd. 1977. The Effect of Different Nitrogen Sources on Pigment Production and Sporulation of Monascus purpureus with regard to Quality and Quantity.J FoodSci. 45:567-569.
Carlton WW, Mc Glavin. 1995. Special Veterinary Pathology.2nd Edition.
Santo Louis: Mosby Year Book.
Cassarent Doull’s.1990. Toxicology The Basic Science of Poison. New York: Mac Milan.
Chan DK, Hayes WA.1982. Prinsiples and Method for acute and Subchronis Toxicity. New York: Ranen.
Chen MH, Johns MR. 1993. Effect of pH and Nitrogen Source on Pigment Production by Monascus purpureus.
Applied Microbiology and Biotechnology Journal. 40:132-138.
Chen MH, Johns MR.1994. Effect of Carbon Source on Ethanol and Pigment Production by Monascus purpureus.
Enzyme and Microbial Technology Journal 16: 584-590.
Endo A. 1979. Monacolin K, a New Hypocholesterolemic Agent Produced by a Monascus Species. Journal of Antibiotics. 32: 852-854.
Endo A, Hasumi K, Negishi S. 1985. Monacolin J and L, New Inhibitors of Cholesterol Biosynthesis Produced by
Monascus ruber. Journal of Antibiotics. 38:420-422.
Endo A, Komagata D, Shimada H. 1986. Monacolin M: A New Inhibitor of Cholesterol Biosynthesis. Journal of antibiotics. 39:1670-1673.
Fabre CE, Santreer AL, Loret MO, Baberian R, Pareilleux A, Goma G, Blanc PJ.
1993. Production and Food Applications of The Red Pigments of Monascus ruber. J. Food Sci. 58(5): 1099-1102.
Fardiaz S, Fauzi DB, Zakaria F.1996.
Toksisitas dan Imunogenitas Pigmen Angkak yang Diproduksi dari Kapang
Fink Gremmels J, Dresel J, Leistner L. 1991. Use of Monascus Extracts as an Alternative to Nitrite in Meat Products. Fleischwirtsch. 71: 1184-1186.
Frenkel MD. 1985. Lectures in Internal Medicine (Ilmu Penyakit Dalam). Editor