ANALISIS KANDUNGAN BESI, KALIUM, KALSIUM, DAN
MAGNESIUM PADA BUNGA KECOMBRANG
(Etlingera elatior) SECARA SPEKTROFOTOMETRI
SERAPAN ATOM
SKRIPSI
OLEH:
WILLIAM DINATA
NIM 111501057
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
ANALISIS KANDUNGAN BESI, KALIUM, KALSIUM, DAN
MAGNESIUM PADA BUNGA KECOMBRANG
(Etlingera elatior) SECARA SPEKTROFOTOMETRI
SERAPAN ATOM
SKRIPSI
Diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
WILLIAM DINATA
NIM 111501057
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
PENGESAHAN SKRIPSI
ANALISIS KANDUNGAN BESI, KALIUM, KALSIUM, DAN
MAGNESIUM PADA BUNGA KECOMBRANG
(Etlingera elatior) SECARA SPEKTROFOTOMETRI
SERAPAN ATOM
OLEH:
WILLIAM DINATA
NIM 111501057
Dipertahankan di hadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada Tanggal : 13 Juni 2015
Disetujui Oleh:
Pembimbing I, Panitia Penguji,
Prof. Dr. rer. nat. E. D. Lux P., S.U., Apt. Prof. Dr. Jansen S., M.App.Sc., Apt. NIP 195306191983031001 NIP 195006071979031001
Pembimbing II, Prof. Dr. rer. nat. E. D. Lux P., S.U., Apt. NIP 195306191983031001
Drs. Fathur Rahman Harun, M.Si., Apt. Dra. Masria Lasma T., M.Si., Apt. NIP 195201041980031002 NIP 195005081977022001
Dra. TutyRoida Pardede, M.Si., Apt. NIP 195401101980032001 Medan, Juni 2015
Fakultas Farmasi
Universitas Sumatera Utara Wakil Dekan I
KATA PENGANTAR
Puji dan syukur kepada Tuhan Yang Maha Kuasa yang telah melimpahkan anugerah dan kemurahan-Nya sehingga penulis dapat meyelesaikan skripsi yang berjudul “Analisis Kandungan Besi, Kalium, Kalsium, dan Magnesium pada Bunga Kecombrang (Etlingera elatior) Secara Spektrofotometri Serapan Atom”.
Skripsi ini diajukan sebagai salah satu syarat guna memperoleh gelar Sarjana Farmasi dari Fakultas Farmasi Universitas Sumatera Utara.
Penulis juga mengucapkan terima kasih dan penghargaan yang tulus dan tak terhingga kepada Ayahanda Lim Eng Tjoan dan Ibunda Oei Soh Kim yang tiada hentinya mendoakan, memberikan semangat, dukungan dan berkorban dengan tulus ikhlas bagi kesuksesan penulis, kepada Kakakku Taranica dan Jessica, teman-teman di Laboratorium Kimia Analisis Kuantitatif, dan sahabat-sahabatku yang selalu memberikan dorongan dan motivasi selama penulis melakukan penelitian.
Penulis menyadari bahwa penulisan skripsi ini masih belum sempurna, sehingga penulis mengharapkan kritik dan saran yang bersifat membangun untuk penyempurnaannya. Harapan penulis semoga skripsi ini dapat bermanfaat bagi ilmu pengetahuan khususnya dibidang farmasi dan berguna bagi alam semesta.
Medan, Juni 2015 Penulis,
ANALISIS KANDUNGAN BESI, KALIUM, KALSIUM, DAN
MAGNESIUM PADA BUNGA KECOMBRANG
(Etlingera elatior) SECARA SPEKTROFOTOMETRI
SERAPAN ATOM
ABSTRAK
Kecombrang (Etlingera elatior) termasuk salah satu anggota familia
Zingiberaceae dan mempunyai kandungan zat kimia yaitu karbohidrat, serat pangan, lemak, protein, air, kalsium, tembaga, besi, magnesium, mangan, seng, natrium, kalium, sulfur, fosfor, boron, fluor, selenium, kobalt, krom, dan molibdenum. Selain itu, bunga kecombrang juga mengandung senyawa alkaloid, flavonoid, polifenol, steroid, saponin, dan minyak atsiri. Tujuan dari penelitian ini adalah untuk mengetahui kadar besi, kalium, kalsium, dan magnesium dari bunga kecombrang.
Penelitian ini menggunakan bunga kecombrang sebagai sampel. Kemudian sampel didestruksi, diabukan, dan dilarutkan dengan akua demineralisata untuk memperoleh larutan sampel. Penetapan kadar dilakukan dengan spektrometer serapan atom (SSA) dengan nyala udara-asetilen pada panjang gelombang berturut-turut untuk besi, kalium, kalsium, dan magnesium yaitu 248,3, 766,5, 422,7, dan 285,2 nm. Keuntungan dari metode ini adalah selektif dan sensitif.
Dari hasil penelitian diperoleh bahwa kadar rata-rata berturut-turut untuk besi, kalium, kalsium, dan magnesium pada bunga kecombrang adalah sebesar (1,5529 ± 0,012) mg/100 g, (697,3036 ± 1,4033) mg/100 g, (1276,2998 ± 17,4448) mg/100 g, dan (162,1079 ± 0,5724) mg/100 g secara berturut-turut. Dapat disimpulkan bahwa kadar mineral ini pada bunga kecombrang cukup tinggi, sehingga dapat dikembangkan menjadi suplemen makanan.
ANALYSIS OF IRON, POTASSIUM, CALCIUM, AND
MAGNESIUM CONTENT OF TORCH GINGER (Etlingera
elatior) FLOWER BY USING ATOMIC ABSORPTION
SPECTROPHOTOMETRY
ABSTRACT
Torch ginger (Etlingera elatior) is included in the family Zingiberaceae
and its content are carbohydrate, dietary fibers, fat, protein, water, calcium, copper, iron, magnesium, manganese, zinc, sodium, potassium, sulfur, phosphor, boron, fluoride, selenium, cobalt, chrome, and molibdenum. Beside that, torch ginger also contain alkaloid, flavonoid, polyphenol, steroid, saponin, and volatile oil. The aim of this study is to determine the content of iron, potassium, calcium, and magnesium from torch ginger (Etlingera elatior) flower.
This experiment used torch ginger flower as the sample. Then the sample is destructed, ashed, and dissolved with aqua demineralisata to get the sample solution. The determination of these minerals was measured by using atomic absorption spectrophotometer with air-acetylene flame at the wavelength for iron, potassium, calcium, and magnesium were 248.3 nm, 766.5 nm, 422.7 nm, and 285.2 nm respectively. The advantage of this method is selective and sensitive.
From the research result is obtained that the average level of iron, potassium, calcium, and magnesium in torch ginger flower was (1.5529 ± 0.012) mg/100 g, (697.3036 ± 1.4033) mg/100 g, (1276.2998 ± 17.4448) mg/100 g, and (162.1079 ± 0.5724) mg/100 g respectively. It can be concluded that the content of these minerals in torch ginger flower are quite high, so it can be developed as food supplement.
DAFTAR ISI
Halaman
JUDUL ... i
HALAMAN PENGESAHAN ... ii
KATA PENGANTAR ... iii
ABSTRAK ... v
ABSTRACT ... vi
DAFTAR ISI ... vii
DAFTAR TABEL ... x
DAFTAR GAMBAR ... xi
DAFTAR LAMPIRAN ... xii
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 3
1.3 Hipotesis ... 3
1.4 Tujuan Penelitian ... 3
1.5Manfaat Penelitian ... 3
BAB II TINJAUAN PUSTAKA ... 4
2.1 Kecombrang ... 4
2.2 Mineral ... 6
2.2.1 Besi ... 6
2.3 Penetapan Kadar Besi, Kalium, Kalsium, dan Magnesium
pada Bunga Kecombrang ... 10
2.4 Spektrofotometri Serapan Atom ... 11
2.4.1 Instrumentasi Spektrofotometri Serapan Atom ... 13
2.4.2 Gangguan-gangguan pada Spektrofotometri Serapan Atom ... 16
2.5 Validasi Metode Analisis ... 18
BAB III METODE PENELITIAN ... 21
3.1 Tempat dan Waktu Penelitian ... 21
3.2 Jenis Penelitian... 21
3.3 Alat ... 21
3.4 Bahan ... 21
3.5 Metode Pengambilan Sampel... 21
3.6 Identifikasi Sampel ... 22
3.7 Pembuatan Pereaksi. ... 22
3.7.1 Larutan HNO3(1:1) ... 22
3.8 Penyiapan Sampel ... 22
3.9 Proses Destruksi ... 22
3.10 Pembuatan Larutan Sampel ... 23
3.11 Pemeriksaan Kuantitatif ... 23
3.11.1 Pembuatan Kurva Kalibrasi Besi ... 23
3.11.2 Pembuatan Kurva Kalibrasi Kalium ... 23
3.11.3 Pembuatan Kurva Kalibrasi Kalsium ... 24
3.11.4 Pembuatan Kurva Kalibrasi Magnesium ... 24
3.12.1 Penetapan Kadar Besi ... 25
3.12.2 Penetapan Kadar Kalium ... 25
3.12.3 Penetapan Kadar Kalsium ... 25
3.12.4 Penetapan Kadar Magnesium ... 26
3.13 Validasi ... 26
3.13.1 Simpangan Baku Relatif ... 26
3.13.2 Uji Perolehan Kembali (Recovery) ... 27
3.13.3 Penentuan Batas Deteksi (Limit of Detection) dan Batas Kuantitasi (Limit of Quantitation) ... 27
3.14 Analisis Data Secara Statistik ... 28
BAB IV HASIL DAN PEMBAHASAN ... 30
4.1 Pemeriksaan Kuantitatif ... 30
4.1.1 Kurva Kalibrasi Besi, Kalium, Kalsium, dan Magnesium ... 30
4.1.2 Kadar Besi, Kalium, Kalsium, dan Magnesium dalam Bunga Kecombrang ... 32
4.1.3 Uji Perolehan Kembali (Recovery)... 34
4.1.4 Simpangan Baku Relatif ... 35
4.1.5 Batas Deteksi dan Batas Kuantitasi ... 35
BAB V KESIMPULAN DAN SARAN ... 37
5.1 Kesimpulan ... 37
5.2 Saran ... 37
DAFTAR PUSTAKA ... 38
DAFTAR TABEL
Halaman Tabel 4.1. Hasil Analisis Kuantitatif Kadar Besi, Kalium, Kalsium dan
Magnesium dalam Sampel ... 33 Tabel 4.2. Persen Uji Perolehan Kembali (recovery) kadar Besi, Kalium,
DAFTAR GAMBAR
Halaman Gambar 2.1. Komponen Spektrofotometer Serapan Atom ... 13 Gambar 4.1. Kurva Kalibrasi Larutan Standar Besi untuk Penetapan
Kadar Besi ... 30 Gambar 4.2. Kurva Kalibrasi Larutan Standar Kalium untuk Penetapan
Kadar Kalium ... 31 Gambar 4.3. Kurva Kalibrasi Larutan Standar Kalsium untuk Penetapan
Kadar Kalsium ... 31 Gambar 4.4. Kurva Kalibrasi Larutan Standar Magnesium untuk
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Hasil Identifikasi Sampel ... 41
Lampiran 2. Sampel yang Digunakan ... 42
Lampiran 3. Gambar alat-alat yang Digunakan ... 43
Lampiran 4. Bagan Alir Proses Destruksi Kering ... 45
Lampiran 5. Bagan Alir Pembuatan Larutan Sampel ... 46
Lampiran 6. Data Kalibrasi Besi dengan Spektrofotometer Serapan Atom, Perhitungan Persamaan Garis Regresi dan Koefisien Korelasi (r) ... 47
Lampiran 7. Data Kalibrasi Kalium dengan Spektrofotometer Serapan Atom, Perhitungan Persamaan Garis Regresi dan Koefisien Korelasi (r) ... 49
Lampiran 8. Data Kalibrasi Kalsium dengan Spektrofotometer Serapan Atom, Perhitungan Persamaan Garis Regresi dan Koefisien Korelasi (r) ... 51
Lampiran 9. Data Kalibrasi Magnesium dengan Spektrofotometer Serapan Atom, Perhitungan Persamaan Garis Regresi dan Koefisien Korelasi (r) ... 53
Lampiran 10. Contoh Perhitungan Kadar Besi dalam Sampel ... 55
Lampiran 11. Data Hasil Analisis Kadar Besi dalam Sampel ... 56
Lampiran 12. Contoh Perhitungan Kadar Kalium dalam Sampel ... 57
Lampiran 13. Data Hasil Analisis Kadar Kalium dalam Sampel ... 58
Lampiran 14. Contoh Perhitungan Kadar Kalsium dalam Sampel ... 59
Lampiran 15. Data Hasil Analisis Kadar Kalsium dalam Sampel ... 60
Lampiran 16. Contoh Perhitungan Kadar Magnesium dalam Sampel .... 61
Lampiran 17. Data Hasil Analisis Kadar Magnesium dalam Sampel ... 62
Lampiran 19. Perhitungan Kadar Kalium dalam Sampel ... 65
Lampiran 20. Perhitungan Kadar Kalsium dalam Sampel ... 67
Lampiran 21. Perhitungan Kadar Magnesium dalam Sampel ... 69
Lampiran 22. Perhitungan Statistik Kadar Besi dalam Sampel ... 71
Lampiran 23. Perhitungan Statistik Kadar Kalium dalam Sampel ... 73
Lampiran 24. Perhitungan Statistik Kadar Kalsium dalam Sampel... 77
Lampiran 25. Perhitungan Statistik Kadar Magnesium dalam Sampel ... 80
Lampiran 26. Data % Recovery Besi ... 83
Lampiran 27. Data % Recovery Kalium ... 84
Lampiran 28. Data % Recovery Kalsium ... 85
Lampiran 29. Data % Recovery Magnesium ... 86
Lampiran 30. Contoh Perhitungan Pengenceran Larutan Standar 1 mcg/ml ... 87
Lampiran 31. Contoh Perhitungan Uji Perolehan Kembali untuk Besi ... 88
Lampiran 32. Contoh Perhitungan Uji Perolehan Kembali untuk Kalium ... 90
Lampiran 33. Contoh Perhitungan Uji Perolehan Kembali untuk Kalsium ... 92
Lampiran 34. Contoh Perhitungan Uji Perolehan Kembali untuk Magnesium ... 94
Lampiran 35. Perhitungan Simpangan Baku Relatif (RSD) Kadar Besi ... 96
Lampiran 36. Perhitungan Simpangan Baku Relatif (RSD) Kadar Kalium ... 97
Lampiran 39. Perhitungan Batas Deteksi dan Batas Kuantitasi Besi ... 100 Lampiran 40. Perhitungan Batas Deteksi dan Batas Kuantitasi
Kalium ... 101 Lampiran 41. Perhitungan Batas Deteksi dan Batas Kuantitasi
Kalsium ... 102 Lampiran 42. Perhitungan Batas Deteksi dan Batas Kuantitasi
ANALISIS KANDUNGAN BESI, KALIUM, KALSIUM, DAN
MAGNESIUM PADA BUNGA KECOMBRANG
(Etlingera elatior) SECARA SPEKTROFOTOMETRI
SERAPAN ATOM
ABSTRAK
Kecombrang (Etlingera elatior) termasuk salah satu anggota familia
Zingiberaceae dan mempunyai kandungan zat kimia yaitu karbohidrat, serat pangan, lemak, protein, air, kalsium, tembaga, besi, magnesium, mangan, seng, natrium, kalium, sulfur, fosfor, boron, fluor, selenium, kobalt, krom, dan molibdenum. Selain itu, bunga kecombrang juga mengandung senyawa alkaloid, flavonoid, polifenol, steroid, saponin, dan minyak atsiri. Tujuan dari penelitian ini adalah untuk mengetahui kadar besi, kalium, kalsium, dan magnesium dari bunga kecombrang.
Penelitian ini menggunakan bunga kecombrang sebagai sampel. Kemudian sampel didestruksi, diabukan, dan dilarutkan dengan akua demineralisata untuk memperoleh larutan sampel. Penetapan kadar dilakukan dengan spektrometer serapan atom (SSA) dengan nyala udara-asetilen pada panjang gelombang berturut-turut untuk besi, kalium, kalsium, dan magnesium yaitu 248,3, 766,5, 422,7, dan 285,2 nm. Keuntungan dari metode ini adalah selektif dan sensitif.
Dari hasil penelitian diperoleh bahwa kadar rata-rata berturut-turut untuk besi, kalium, kalsium, dan magnesium pada bunga kecombrang adalah sebesar (1,5529 ± 0,012) mg/100 g, (697,3036 ± 1,4033) mg/100 g, (1276,2998 ± 17,4448) mg/100 g, dan (162,1079 ± 0,5724) mg/100 g secara berturut-turut. Dapat disimpulkan bahwa kadar mineral ini pada bunga kecombrang cukup tinggi, sehingga dapat dikembangkan menjadi suplemen makanan.
ANALYSIS OF IRON, POTASSIUM, CALCIUM, AND
MAGNESIUM CONTENT OF TORCH GINGER (Etlingera
elatior) FLOWER BY USING ATOMIC ABSORPTION
SPECTROPHOTOMETRY
ABSTRACT
Torch ginger (Etlingera elatior) is included in the family Zingiberaceae
and its content are carbohydrate, dietary fibers, fat, protein, water, calcium, copper, iron, magnesium, manganese, zinc, sodium, potassium, sulfur, phosphor, boron, fluoride, selenium, cobalt, chrome, and molibdenum. Beside that, torch ginger also contain alkaloid, flavonoid, polyphenol, steroid, saponin, and volatile oil. The aim of this study is to determine the content of iron, potassium, calcium, and magnesium from torch ginger (Etlingera elatior) flower.
This experiment used torch ginger flower as the sample. Then the sample is destructed, ashed, and dissolved with aqua demineralisata to get the sample solution. The determination of these minerals was measured by using atomic absorption spectrophotometer with air-acetylene flame at the wavelength for iron, potassium, calcium, and magnesium were 248.3 nm, 766.5 nm, 422.7 nm, and 285.2 nm respectively. The advantage of this method is selective and sensitive.
From the research result is obtained that the average level of iron, potassium, calcium, and magnesium in torch ginger flower was (1.5529 ± 0.012) mg/100 g, (697.3036 ± 1.4033) mg/100 g, (1276.2998 ± 17.4448) mg/100 g, and (162.1079 ± 0.5724) mg/100 g respectively. It can be concluded that the content of these minerals in torch ginger flower are quite high, so it can be developed as food supplement.
BAB I PENDAHULUAN 1.1Latar Belakang
Menurut Wong, et al. (2010), tanaman kecombrang (Etlingera elatior) adalah sejenis tanaman rempah dan merupakan tumbuhan tahunan yang bunga, buah, serta bijinya dapat dimanfaatkan sebagai bahan sayuran. Bunga kecombrang juga termasuk salah satu anggota familia Zingiberaceae. Kecombrang dipetik saat bunganya masih kuncup dan berwarna merah muda. Bunga kecombrang mempunyai kandungan zat kimia antara lain: karbohidrat, serat pangan, lemak, protein, air, kalsium, tembaga, besi, magnesium, mangan, seng, natrium, kalium, sulfur, fosfor, boron, fluor, selenium, kobalt, krom, dan molibdenum (Wijekoon, et al., 2011).
Menurut Jackie, et al. (2011), mahkota bunga dari kecombrang banyak digunakan pada kari, laksa Penang, nasi ulam, nasi kerabu, atau rujak. Di Sumatera Utara, mahkota bunganya digunakan untuk memasak arsik ikan mas dan asam cekala. Buahnya dapat dimakan tetapi asam dan terkenal dengan aktivitas antihipertensinya dan sering diolah menjadi permen atau manisan (Lim, 2014).
Menurut Sutanto (2005), bahan mineral mendominasi tubuh tanah mineral sebagai hasil pelapukan batuan, media tempat tumbuh perakaran tanaman, dan penyedia unsur hara. Komponen mineral termasuk mineral primer, mineral sekunder, dan bahan amorf. Mineral merupakan salah satu unsur yang memegang peranan penting dalam pemeliharaan fungsi tubuh baik pada tingkat sel, jaringan, organ, maupun fungsi tubuh secara keseluruhan (Almatsier, 2004).
Metode kompleksometri dan gravimetri banyak digunakan untuk penetapan kadar besi, kalsium, dan magnesium, sedangkan menurut Ben-Bassat dan Azrad (2013), untuk penetapan kadar kalium dapat digunakan titrasi volumetris dengan metode heterometri secara langsung melalui pembentukan endapan Kalium Tetraphenilboron untuk sampel dengan konsentrasi 40 - 60 ppm K+ dan secara tak langsung melalui pembentukan K2Na[Co(NO2)6] dalam medium asam asetat-etanol untuk sampel dengan konsentrasi 4 - 10 mg K+. Akan tetapi, semua mineral ini dapat ditentukan metode spektrofotometri serapan atom dan pada penelitian ini dilakukan dengan menggunakan spektrofotometri serapan atom karena mempunyai kepekaan yang tinggi (batas deteksi kurang dari 1 ppm), pelaksanaannya relatif cepat dan sederhana, dan interferensinya sedikit (Rohman, 2007).
1.2Perumusan Masalah
1. Berapakah kadar besi, kalium, kalsium, dan magnesium yang terdapat pada bunga kecombrang ?
1.3Hipotesis
1. Bunga kecombrang memiliki kandungan mineral besi, kalium, kalsium, dan magnesium pada kadar tertentu.
1.4Tujuan Penelitian
1. Untuk mengetahui berapa kadar mineral besi, kalium, kalsium, dan magnesium pada bunga kecombrang.
1.5 Manfaat Penelitian
BAB II
TINJAUAN PUSTAKA 2.1 Kecombrang
Menurut Adliani, dkk. (2012), kedudukan kecombrang dalam taksonomi tumbuhan diklasifikasikan sebagai berikut:
Kingdom : Plantae
Divisi : Spermatophyta Kelas : Dicotyledonae Ordo : Zingiberales Famili : Zingiberaceae Genus : Etlingera
Spesies : Etlingera elatior Jack.
Kecombrang merupakan tanaman asli pulau Sumatera dan Jawa. Tanaman ini tersebar di Pulau Jawa dan Sumatera terutama di daerah pegunungan tumbuhnya di hutan. Bunga dan buah dikumpulkan dari hutan, di dekat permukiman, dibudidayakan di pekarangan yang tanahnya tanpa persiapan penggarapan tanah terlebih dahulu atau tanpa pemeliharaan. Kecombrang diperbanyak dengan rimpang. Pada umur 2 tahun, kecombrang akan berbunga dan berbuah (Heyne, 1913).
Akarnya berbentuk tunggang dan berwarna kuning gelap (Tampubolon, dkk., 1983).
Bunga Kecombrang sering ditambahkan pada masakan khas suku Batak, yaitu arsik ikan mas, masakan pucuk ubi tumbuk, dan juga digunakan sebagai peredam bau amis pada ikan (Heyne, 1913).
Kecombrang memiliki beberapa nama sinonim antara lain Nicolaia elatior
Jack, Phaeomeria speciosa, dan Phaeomeria magnifika. Penyebaran kecombrang di Indonesia sangat luas dengan berbagai nama pada masing-masing daerah seperti kecombrang (Jawa), terpuk (Gayo), combrang (Sunda), kincung (Melayu), honje (Sunda), atimengo (Gorontalo), puwar kijung (Minangkabau), Katimbang (Makasar), Salahawa (Seram), dan kantan (Malaysia) (Tampubolon, dkk., 1983).
Bunga kecombrang mempunyai kandungan zat kimia antara lain: karbohidrat, serat pangan, lemak, protein, air, kalsium, tembaga, besi, magnesium, mangan, seng, natrium, kalium, sulfur, fosfor, boron, fluor, selenium, kobalt, krom, dan molibdenum (Wijekoon, et al., 2011).
Kalium yang terkandung dalam bunga kecombrang bermanfaat untuk melancarkan air seni, mengobati penyakit ginjal (Heyne, 1913).
2.2 Mineral
Menurut Poedjiadi (1994), mineral adalah unsur-unsur yang berada dalam bentuk sederhana, sedangkan dalam ilmu gizi biasanya disebut unsur-unsur mineral atau nutrien/zat gizi anorganik. Mineral merupakan kebutuhan tubuh manusia yang mempunyai peranan penting dalam pemeliharaan fungsi tubuh, baik pada tingkat sel, jaringan, organ, maupun fungsi tubuh secara keseluruhan. Mineral digolongkan ke dalammineral makro dan mineral mikro. Mineral makro adalah mineral yang dibutuhkan tubuh dalam jumlah lebih dari 100 mg sehari, sedangkan mineral mikro dibutuhkan kurang dari 100 mg sehari. Yang termasuk mineral makro antara lain: natrium, klorida, kalium, kalsium, fosfor, dan magnesium, sedangkan yang termasuk mineral mikro antara lain: besi, mangan, dan tembaga (Almatsier, 2004).
Secara tidak langsung, mineral banyak yang berperan dalam proses pertumbuhan. Peran mineral dalam tubuh kita berkaitan satu sama lainnya, dan kekurangan atau kelebihan salah satu mineral akan berpengaruh terhadap kerja mineral lainnya (Almatsier, 2004).
2.2.1 Besi
Kebutuhan akan zat besi untuk berbagai jenis kelamin dan golongan usia adalah sebagai berikut: untuk laki-laki dewasa 10 mg/ hari, wanita yang mengalami haid 12 mg/hari, dan anak-anak 8-15 mg/hari. Zat besi yang tidak mencukupi bagi pembentukan sel darah, akan mengakibatkan anemia, menurunkan kekebalan tubuh, sehingga sangat peka terhadap serangan penyakit (Budianto, 2009).
Beberapa faktor diet menghindari penyerapan zat besi sedangkan yang lain membantunya. Makanan yang tinggi kadar Vitamin C-nya meningkatkan penyerapan baik zat besi heme maupun non-heme. Namun demikian, dimasukkannya teh hitam atau etylenediaminetetraacetic acid (EDTA) pada makanan dapat mengurangi ketersediaan zat besi non-heme sebesar 50%. Telur, produk-produk kedelai, dan kopi pun menghambat penyerapan zat besi (Tan, 1996).
Sumber besi dari hewani adalah daging, udang, hati sapi, ayam, ikan, dan telur. Sedangkan sumber dari nabati adalah kacang-kacangan dan sayuran hijau. Di samping kadar besi, perlu diperhatikan juga kualitas besi di dalam makanan yang dinamakan ketersediaan biologik. Pada umumnya besi yang berada dalam daging, hati sapi, ayam, dan ikan mempunyai ketersediaan biologik yang tinggi, besi yang berada di dalam kacang-kacangan mempunyai ketersediaan biologik yang sedang, dan besi dalam sebagian besar sayuran, seperti bayam mempunyai ketersediaan biologik yang rendah (Almatsier, 2004).
2.2.2 Kalium
keseimbangan cairan dan elektrolit serta keseimbangan asam basa serta isotonis sel, selain itu kalium juga mengaktivasi banyak reaksi enzim dan proses fisiologi, seperti transmisi impuls di saraf dan otot, kontraksi otot dan metabolisme karbohidrat (Almatsier, 2004; Tan dan Rahardja, 2007).
Kekurangan kalium dapat terjadi karena kebanyakan kehilangan melalui saluran cerna dan ginjal. Kekurangan kalium menyebabkan lemah, lesu, kehilangan nafsu makan dan konstipasi. Kelebihan kalium akut dapat terjadi bila konsumsi tanpa diimbangi oleh kenaikan ekskresi (Winarno, 1992).
Kalium terdapat di dalam semua makanan yang berasal dari tumbuhan dan hewan. Sumber utama kalium adalah makanan mentah/segar, terutama buah, sayuran, dan kacang-kacangan. Kebutuhan minimum akan kalium ditaksir sebanyak 2000 mg sehari (Almatsier, 2004).
2.2.3 Kalsium
Kalsium merupakan mineral yang paling banyak terdapat di dalam tubuh, yaitu 1,5-2 % dari berat badan orang dewasa atau kurang lebih sebanyak 1 kg. Dari jumlah ini, sebanyak 99% berada di dalam jaringan keras, yaitu tulang dan gigi, selebihnya tersebar luas di dalam tubuh. Di dalam cairan ekstraselular dan intraselular, kalsium memegang peranan penting dalam mengatur fungsi sel, seperti untuk transmisi impuls di saraf, kontraksi otot, penggumpalan darah, dan menjaga permeabilitas membran sel (Almatsier, 2004).
anak-anak hingga usia remaja dan pada saat hamil untuk memenuhi kebutuhan janin (Budianto, 2009).
Angka kecukupan rata-rata sehari untuk kalsium bagi orang Indonesia yang ditetapkan adalah 300 – 400 mg pada bayi, 500 mg pada anak-anak, 600 – 700 mg pada remaja, 500 – 800 mg pada orang dewasa, serta lebih besar 400 mg dari kebutuhan orang dewasa pada ibu hamil dan menyusui. Kekurangan kalsium pada masa pertumbuhan dapat menyebabkan gangguan pertumbuhan seperti tulang kurang kuat, mudah bengkok, dan rapuh (Almatsier, 2004).
Sumber kalsium utama adalah susu dan hasil olahan susu seperti keju. Ikan yang dimakan dengan tulang, termasuk ikan kering merupakan sumber kalsium yang baik. Sereal, kacang-kacangan dan hasil olahan kacang-kacangan, tahu, tempe, serta sayuran hijau merupakan sumber kalsium yang baik (Almatsier, 2004).
2.2.4 Magnesium
Menurut Montgomery, et al. (1993), kebanyakan pangan terutama pangan nabati seperti kentang, padi-padian, dan buah-buahan, mengandung magnesium. Magnesium juga esensial dalam metabolisme terutama reaksi yang melibatkan
Adenosine Triphosphate (ATP). Magnesium adalah salah satu mineral terbanyak di dalam tubuh. Sekitar 50% dari magnesium total yang terdapat dalam tubuh berada dalam tulang. Sisanya terdapat dalam sel-sel jaringan dan organ. Hanya 1% magnesium tubuh yang berada dalam darah. Tubuh kita selalu bekerja keras untuk mempertahankan kadar magnesium yang konstan (Almatsier, 2004).
Tubuh manusia mengandung kurang lebih 25 gram magnesium, 50 – 60 % daripadanya terdapat dalam kerangka, sedangkan sisanya terdapat dalam cairan intraseluler, juga sebagai ko-faktor enzim yang menghasilkan energi. Fungsi magnesium adalah memegang peranan penting pada relaksasi otot, mungkin juga untuk myocard, pada otot jantung orang yang meninggal ditemukan kadar magnesium dan kalium yang rendah. Oleh karena itu, magnesium digu nakan untuk terapi infark jantung (Tan dan Rahardja, 2007).
2.3 Penetapan Kadar Besi, Kalium, Kalsium, dan Magnesium pada Bunga Kecombrang
halus (ukuran mesh 30) menggunakan blender. Serbuk sampel kemudian disimpan pada suhu 4°C. Sampel yang telah dikeringkan (masing-masing ditimbang 1 g pada setiap tiga kali pengulangan) didestruksi dengan asam nitrat 70% dan dibiarkan hingga dingin sebelum diencerkan hingga 50 ml dengan air deionisasi. Larutan kemudian disaring dengan kertas Whatmann no. 4 dan diinjeksikan pada ICP – OES.
Dari hasil penelitian Wijekoon, et al. (2011), diperoleh kadar besi, kalium, kalsium, dan magnesium dari bunga kecombrang yang berasal dari Penang, Malaysia adalah 2,4 mg/ 100 g, 541 mg/ 100 g, 775,3 mg/ 100 g, dan 327,1 mg/ 100 g secara berturut-turut. Sedangkan untuk mineral lain yang dianalisis seperti sulfur, natrium, fluor, seng, tembaga, mangan, dan fosfor diperoleh hasil yaitu 4,5 mg/ 100 g, 166,6 mg/ 100 g, 1,4 mg/ 100 g, 2,8 mg/ 100 g, 0,6 mg/ 100 g, 8,3 mg/ 100 g, dan 286 mg/ 100 g secara berturut-turut. Untuk mineral selenium, kobalt, krom, dan molibdenum diperoleh hasil < 0,1 mg/ 100 g.
2.4 Spektrofotometri Serapan Atom
Spektrofotometri serapan atom lebih cenderung digunakan untuk pengujian kuantitatif dibandingkan kualitatif. Panjang gelombang dibaca melalui rentang yang diinginkan dan spektrum yang tercatat. Panjang gelombang yang absortif dibandingkan dengan nilai panjang gelombang yang diketahui untuk elemen – elemen yang diperkirakan (Braun, 1982).
tinggi (batas deteksi kurang dari 1 ppm), pelaksanaannya relatif sederhana. Spektrofotometri serapan atom didasarkan pada penyerapan energi sinar oleh atom-atom netral dan sinar yang diserap biasanya sinar tampak atau ultraviolet. Dalam garis besarnya prinsip spektrofotometri serapan atom sama saja dengan spektrofotometri sinar tampak dan ultraviolet. Perbedaannya terletak pada bentuk spektrum, cara pengerjaan sampel dan peralatannya. Metode spektrofotometri serapan atom mendasarkan pada prinsip absorbsi cahaya oleh atom. Atom-atom akan menyerap cahaya pada panjang gelombang tertentu, tergantung pada sifat unsurnya (Rohman, 2007).
Jika suatu larutan yang mengandung suatu garam logam (atau suatu senyawa logam) dialirkan ke dalam suatu nyala maka terbentuklah uap yang mengandung atom-atom logam itu. Atom logam bentuk gas tersebut tetap berada dalam keadaan tak tereksitasi atau dalam keadaan dasar. Jika cahaya dengan panjang gelombang yang khas dengan logam tersebut dilewatkan pada nyala yang mengandung atom yang bersangkutan, maka sebagian cahaya tersebut akan diserap dan penyerapan tersebut menyebabkan elektron tereksitasi ke tingkat yang lebih tinggi. Inilah asas yang mendasari spektrofotometri serapan atom (Rohman, 2007).
Teknik ini digunakan untuk menetapkan kadar ion logam dan mineral tertentu dengan jalan mengukur intensitas emisi atau serapan cahaya pada panjang gelombang tertentu oleh uap atom unsur yang ditimbulkan dari bahan, misalnya dengan mengalirkan larutan zat ke dalam api (Ditjen POM, 1995).
logam dan mineral dimasukkan ke dalam nyala. Menurut Basset, et al. (1994), peristiwa yang terjadi secara singkat setelah sampel dimasukkan ke dalam nyala adalah:
1. Penguapan pelarut yang meninggalkan residu
2. Penguapan zat padat dengan dissosiasi menjadi atom – atom penyusunnya, yang mula – mula akan berada dalam keadaan dasar.
3. Beberapa atom dapat tereksitasi oleh energi panas nyala ke tingkatan-tingkatan energi yang lebih tinggi, dan mencapai kondisi dimana atom-atom tersebut akan memancarkan energi,
2.4.1 Instrumentasi Spektrofotometri Serapan Atom
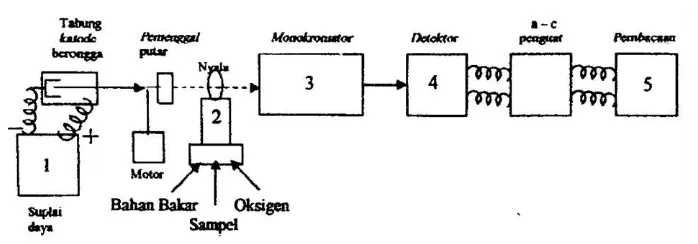
[image:30.595.146.495.410.532.2]Sistem peralatan spektrofotometer serapan atom dapat dilihat pada gambar di bawah ini:
Gambar 2.1.Komponen Spektrofotometer Serapan Atom (Basset, et al., 1994) Menurut Rohman (2007), bagian-bagian dari spektrofotometer serapan atom adalah sebagai berikut:
a. Sumber Sinar
suatu katoda dan anoda. Katoda berbentuk silinder berongga yang dilapisi dengan logam tertentu.
b. Tempat Sampel
Sampel yang akan dianalisis harus diuraikan menjadi atom-atom netral yang masih dalam keadaan azas. Ada berbagai macam alat yang digunakan untuk mengubah sampel menjadi uap atom-atomnya, yaitu:
1. Dengan Nyala (Flame)
Nyala digunakan untuk mengubah sampel yang berupa cairan menjadi bentuk uap atomnya dan untuk proses atomisasi. Suhu yang dapat dicapai oleh nyala tergantung pada gas yang digunakan, misalnya untuk gas asetilen – udara suhunya sebesar 2200°C.
2. Tanpa Nyala (Flameless)
Pengatoman dilakukan dalam tungku dari grafit. Sejumlah sampel diambil sedikit (hanya beberapa µ l), lalu diletakkan dalam tabung grafit, kemudian tabung tersebut dipanaskan dengan sistem elektris dengan cara melewatkan arus listrik pada grafit. Akibat pemanasan ini, maka zat yang akan dianalisis berubah menjadi atom – atom netral dan pada fraksi atom ini dilewatkan suatu sinar yang berasal dari lampu katoda sehingga terjadilah proses penyerapan energi sinar yang memenuhi kaidah analisis kuantitatif.
c. Monokromator
Monokromator merupakan alat untuk memisahkan dan memilih spektrum sesuai dengan panjang gelombang yang digunakan dalam analisis dari sekian banyak spektrum yang dihasilkan lampu katoda.
Detektor digunakan untuk mengukur intensitas cahaya yang melalui tempat pengatoman.
e. Amplifier
Amplifier merupakan suatu alat untuk memperkuat signal yang diterima dari detektor sehingga dapat dibaca sebagai alat pencatat hasil (Readout).
f. Readout
Readout merupakan suatu alat penunjuk atau dapat juga diartikan sebagai pencatat hasil. Hasil pembacaan dapat berupa angka atau berupa kurva yang menggambarkan absorbansi atau intensitas emisi.
Fungsi nyala adalah untuk memproduksi atom-atom yang dapat mengabsorpsi radiasi yang dipancarkan oleh lampu katoda tabung. Pada umumnya, peralatan yang digunakan untuk mengalirkan sampel menuju nyala adalah nebulizer yang dihubungkan dengan pembakar (burner). Sebelum menuju nyala, sampel mengalir melalui pipa kapiler dan menghasilkan aerosol oleh aliran gas pengoksidasi. Kemudian, aerosol yang terbentuk bercampur dengan bahan bakar menuju ke burner. Sampel yang menuju ke burner hanya berkisar 5 – 10 % sedangkan sisanya (90 – 95 %) menuju ke tempat pembuangan. Sampel yang berada pada nyala lalu diatomisasi dan cahaya dari lampu katoda tabung dilewatkan melalui nyala. Sampel yang berada pada nyala akan menyerap cahaya tersebut (Rohman, 2007).
Menurut Rohman (2007), terdapat 3 jenis nyala dalam spektrofotometri serapan atom yaitu:
Jenis nyala ini relatif lebih dingin (1800°C) dibandingkan jenis nyala lainnya. Nyala ini akan menghasilkan sensitifitas yang baik jika elemen yang akan diukur mudah terdisosiasi seperti Na, K, Cu.
2. Asetilen – Udara
Jenis nyala ini adalah yang paling umum digunakan dalam spektrofotometri serapan atom. Nyala ini menghasilkan temperatur sekitar 2200°C yang dapat mengatomisasi hampir semua elemen.
3. Asetilen – Dinitrogen oksida
Jenis nyala ini paling panas (3000°C) dan sangat baik digunakan pada spektrofotometri serapan atom untuk menganalisis sampel yang membentuk oksida yang sangat stabil dan sukar diatomkan pada suhu rendah seperti Al, Si, Ti.
2.4.2 Gangguan-gangguan pada Spektrofotometri Serapan Atom
Menurut Rohman (2007), gangguan-gangguan (interference) pada SSA adalah peristiwa yang menyebabkan pembacaan absorbansi unsur yang dianalisis menjadi lebih kecil atau lebih besar dari nilai yang sesuai dengan konsentrasinya dalam sampel. Gangguan-gangguan yang dapat terjadi pada SSA adalah sebagai berikut:
a. Gangguan oleh penyerapan non-atomik (non atomic absorption)
b. Gangguan kimia yang dapat mempengaruhi banyaknya atom dalam nyala Menurut Rohman (2007), pembentukan atom-atom netral yang masih dalam keadaan asas di dalam nyala sering terganggu oleh dua peristiwa kimia, yaitu:
1. Disosiasi senyawa-senyawa yang tidak sempurna
Disosiasi ini disebabkan oleh terbentuknya senyawa refraktorik (sukar diuraikan dalam api), sehingga akan mengurangi jumlah atom netral yang ada di dalam nyala.
2. Ionisasi atom-atom di dalam nyala
Ionisasi terjadi akibat suhu yang digunakan terlalu tinggi. Prinsip analisis dengan spektrofotometri serapan atom adalah mengukur absorbansi atom-atom netral yang berada dalam keadaan asas. Jika terbentuk ion maka akan mengganggu pengukuran absorbansi atom netral karena spektrum absorbansi atom-atom yang mengalami ionisasi tidak sama dengan spektrum atom dalam keadaan netral.
c. Gangguan spektrum
Gangguan spektrum dalam spektrofotometri serapan atom timbul akibat terjadinya tumpang tindih antara frekuensi-frekuensi garis resonansi unsur yang dianalisis dengan garis-garis yang dipancarkan oleh unsur lain. Hal ini disebabkan karena rendahnya resolusi monokromator pada spektrofotometri serapan atom. d. Gangguan yang berasal dari matriks sampel yang dapat mempengaruhi
Sifat-sifat matriks sampel yang dapat mengganggu analisis adalah yang mempengaruhi laju aliran bahan bakar/gas pengoksidasi. Sifat-sifat tersebut adalah viskositas dan berat jenis (Rohman, 2007).
2.5 Validasi Metode Analisis
Validasi metode analisis adalah suatu tindakan penilaian terhadap parameter tertentu, berdasarkan percobaan laboratorium untuk membuktikan bahwa parameter tersebut memenuhi persyaratan untuk penggunaannya (Harmita, 2004).
Beberapa parameter analisis yang harus dipertimbangkan dalam validasi metode analisis adalah sebagai berikut:
1. Kecermatan (accuracy)
Menurut Harmita (2004), kecermatan adalah ukuran yang menunjukkan derajat kedekatan hasil analisis dengan kadar analit yang sebenarnya. Kecermatan dinyatakan sebagai persen perolehan kembali (recovery) analit yang ditambahkan. Kecermatan hasil analisis sangat tergantung kepada sebaran galat sistematik di dalam keseluruhan tahapan analisis. Oleh karena itu, untuk mencapai kecermatan yang tinggi hanya dapat dilakukan dengan cara mengurangi galat sistematik tersebut seperti menggunakan peralatan yang dikalibrasi, menggunakan pereaksi dan pelarut yang baik, pengontrolan suhu, dan pelaksanaannya yang cermat, taat asas sesuai prosedur. Kecermatan dapat ditentukan dengan dua cara yaitu:
a. Metode simulasi (spiked-placebo recovery)
tersebut dianalisis dan hasilnya dibandingkan dengan kadar analit yang ditambahkan (kadar yang sebenarnya) (Harmita, 2004).
b. Metode penambahan baku (standard addition method)
Dalam metode penambahan baku, sampel dianalisis lalu sejumlah tertentu analit yang diperiksa ditambahkan ke dalam sampel lalu dicampur dan dianalisis lagi. Selisih kedua hasil dibandingkan dengan kadar yang sebenarnya (hasil yang diharapkan) (Harmita, 2004).
Dalam kedua metode tersebut, persen perolehan kembali dinyatakan sebagai rasio antara hasil yang diperoleh dengan hasil yang sebenarnya. Persen perolehan kembali dapat ditentukan dengan cara membuat sampel plasebo (eksipien obat, cairan biologis) kemudian ditambah analit dengan konsentrasi tertentu (biasanya 80 % sampai 120 % dari kadar analit yang diperkirakan), kemudian dianalisis dengan metode yang akan divalidasi. Tetapi bila tidak memungkinkan membuat sampel plasebo karena matriksnya tidak diketahui seperti obat-obatan paten, atau karena analitnya berupa suatu senyawa endogen misalnya metabolit sekunder pada kultur halus, maka dapat digunakan metode adisi. Metode adisi dapat dilakukan dengan menambahkan sejumlah analit dengan konsentrasi tertentu pada sampel yang diperiksa, lalu dianalisis dengan metode tersebut. Persen perolehan kembali ditentukan dengan menentukan berapa persen analit yang ditambahkan tadi dapat ditemukan (Harmita, 2004).
2. Keseksamaan / Ketelitian (precision)
campuran yang homogen. Ketelitian diukur sebagai keterulangan (repeatability) atau ketertiruan (reproducibility). Keterulangan adalah ketelitian metode jika dilakukan berulang kali oleh analisis yag sama pada kondisi yang sama dan dalam waktu interval yang pendek (Harmita, 2004).
3. Selektivitas (Spesifisitas)
Selektivitas atau spesifisitas suatu metode adalah kemampuannya yang
hanya mengukur zat tertentu saja secara cermat dan seksama dengan adanya
komponen lain yang mungkin ada dalam matriks sampel. Selektivitas seringkali
dapat dinyatakan sebagai derajat penyimpangan metode yang dilakukan terhadap
sampel yang mengandung bahan yang ditambahkan berupa cemaran, hasil urai,
senyawa sejenis, senyawa asing lainnya, dan dibandingkan terhadap hasil a nalisis
sampel yang tidak mengandung bahan lain yang ditambahkan (Harmita, 2004).
4. Linearitas dan Rentang
Linearitas adalah kemampuan metode analisis yang memberikan respon
yang secara langsung atau dengan bantuan transformasi matematik yang baik,
proporsional terhadap konsentrasi analit dalam sampel. Rentang metode adalah
pernyataan batas terendah dan tertinggi analit yang sudah ditunjukkan dapat
ditetapkan dengan kecermatan, keseksamaan, dan linearitas yang dapat diterima
(Harmita, 2004).
5. Batas Deteksi dan Batas Kuantitasi
BAB III
METODE PENELITIAN
3.1.Tempat dan Waktu Penelitian
Penelitian dilakukan di Laboratorium Penelitian Fakultas Farmasi Universitas Sumatera Utara pada bulan Oktober 2014 – Desember 2014.
3.2. Jenis Penelitian
Jenis penelitian yang dilakukan adalah penelitian deskriptif yang bertujuan menggambarkan sifat dari suatu keadaan secara sistematis, yaitu untuk memeriksa kandungan mineral besi, kalium, kalsium, dan magnesium pada bunga kecombrang.
3.3. Alat
Alat-alat yang digunakan adalah alat-alat gelas, alat tanur, blender, hot plate, kertas saring Whatmann no. 42, krus porselen, neraca analitik, dan spektrofotometri serapan atom (Hitachi).
3.4. Bahan
Bahan-bahan yang digunakan berkualitas pro analisis keluaran E. Merck yaitu asam nitrat 65% b/v, larutan standar besi 1000 mcg/mL, larutan standar kalium 1000 mcg/mL, larutan standar kalsium 1000 mcg/mL, larutan standar magnesium 1000 mcg/mL, kecuali akua demineralisata yang digunakan diperoleh dari Fakultas Farmasi USU.
3.5.Metode Pengambilan Sampel
Sampel yang digunakan adalah bunga kecombrang (Etlingera elatior) yang berasal dari daerah Brastagi, Dataran Tinggi Karo pada bulan Oktober-Desember 2014.
3.6. Identifikasi Sampel
Identifikasi sampel (bunga kecombrang) dilakukan di Pusat Penelitian Biologi LIPI Bogor.
3.7.Pembuatan Pereaksi 3.7.1 Larutan HNO3 (1:1)
Larutan HNO3 65% b/v sebanyak 500 mL diencerkan dengan 500 mL air suling (Isaac, 1988).
3.8. Penyiapan Sampel
Sebanyak 1 kg bunga kecombrang (Nicolaia speciosa Horan) yang segar dicuci bersih, ditiriskan, lalu dikeringkan dengan cara diangin-anginkan selama 1 jam. Bunga kecombrang kemudian dipotong-potong kecil dandihaluskan dengan blender.
3.9. Proses Destruksi
dimasukkan ke dalam tanur dan diabukan selama 1 jam dengan suhu 500°C, kemudian didinginkan (Isaac, 1988).
3.10. Pembuatan Larutan Sampel
Sampel hasil destruksi dilarutkan dalam 10 mL HNO3 (1:1), lalu dituangkan ke dalam labu tentukur 100 mL dan diencerkan dengan akua demineralisata hingga garis tanda (Isaac, 1988). Kemudian disaring dengan Kertas Whatmann No. 42. Sebanyak 5 mL filtrat pertama dibuang untuk menjenuhkan kertas saring kemudian filtrat selanjutnya ditampung ke dalam botol. Larutan ini digunakan untuk analisis kuantitatif.
3.11. Pemeriksaan Kuantitatif
3.11.1 Pembuatan Kurva Kalibrasi Besi
Larutan baku besi (1000 mcg/mL) dipipet sebanyak 2 mL, dimasukkan ke dalam labu tentukur 100 mL, dan dicukupkan hingga garis tanda dengan akua demineralisata (konsentrasi 20 mcg/mL).
Larutan untuk kurva kalibrasi besi dibuat dengan memipet 2,5, 5, 7,5, 10, dan 12,5 mL larutan baku 20 mcg/mL, masing-masing dimasukkan ke dalam labu tentukur 50 mL dan dicukupkan hingga garis tanda dengan akua demineralisata (Larutan ini mengandung 1,0, 2,0, 3,0, 4,0, dan 5,0 mcg/mL) dan diukur pada panjang gelombang 248,3 nm dengan tipe nyala udara-asetilen.
3.11.2 Pembuatan Kurva Kalibrasi Kalium
Larutan untuk kurva kalibrasi kalium dibuat dengan memipet 1, 2, 3, 4, dan 5 mL larutan baku 50 mcg/mL, masing-masing dimasukkan ke dalam labu tentukur 25 mL dan dicukupkan hingga garis tanda dengan akua demineralisata (Larutan ini mengandung 2,0, 4,0, 6,0, 8,0, dan 10,0 mcg/mL) dan diukur pada panjang gelombang 766,5 nm dengan tipe nyala udara-asetilen.
3.11.3 Pembuatan Kurva Kalibrasi Kalsium
Larutan baku kalsium (1000 mcg/mL) dipipet sebanyak 5 mL, dimasukkan ke dalam labu tentukur 100 mL, dan dicukupkan hingga garis tanda denga n akua demineralisata (konsentrasi 50 mcg/mL).
Larutan untuk kurva kalibrasi kalsium dibuat dengan memipet 1, 2, 3, 4, dan 5 mL larutan baku 50 mcg/mL, masing-masing dimasukkan ke dalam labu tentukur 25 mL dan dicukupkan hingga garis tanda dengan akua demineralisata (Larutan ini mengandung 2,0, 4,0, 6,0, 8,0, dan 10,0 mcg/mL) dan diukur pada panjang gelombang 422,7 nm dengan tipe nyala udara-asetilen.
3.11.4 Pembuatan Kurva Kalibrasi Magnesium
Larutan baku magnesium (1000 mcg/mL) dipipet sebanyak 1 mL, dimasukkan ke dalam labu tentukur 100 mL, dan dicukupkan hingga garis tanda dengan akua demineralisata (konsentrasi 10 mcg/mL).
3.12 Penetapan Kadar Besi, Kalium, Kalsium, dan Magnesium dalam Sampel
3.12.1 Penetapan Kadar Besi
Larutan sampel hasil destruksi diukur absorbansinya dengan menggunakan spektrofotometer serapan atom pada panjang gelombang 248,3 nm. Absorbansi yang diperoleh sebaiknya berada dalam rentang kurva kalibrasi larutan baku besi. Konsentrasi besi dalam sampel ditentukan berdasarkan persamaan garis regresi dari kurva kalibrasi.
3.12.2 Penetapan Kadar Kalium
Diperlukan pengenceran larutan sampel agar nilai absorbansi yang diperoleh berada dalam rentang kurva kalibrasi larutan baku kalium. Larutan sampel hasil destruksi dipipet sebanyak 0,1 mL, dimasukkan ke dalam labu tentukur 50 mL dan dicukupkan hingga garis tanda dengan akua demineralisata. Kemudian diukur absorbansinya dengan menggunakan spektrofotometer serapan atom pada panjang gelombang 766,5 nm. Konsentrasi kalium dalam sampel ditentukan berdasarkan persamaan garis regresi dari kurva kalibrasi.
3.12.3 Penetapan Kadar Kalsium
atom pada panjang gelombang 422,7 nm. Konsentrasi kalsium dalam sampel ditentukan berdasarkan persamaan garis regresi dari kurva kalibrasi.
3.12.4 Penetapan Kadar Magnesium
Diperlukan pengenceran larutan sampel agar nilai absorbansi yang diperoleh berada dalam rentang kurva kalibrasi larutan baku magnesium. Larutan sampel hasil destruksi dipipet sebanyak 0,1 mL, dimasukkan ke dalam labu tentukur 50 mL dan dicukupkan hingga garis tanda dengan akua demineralisata. Kemudian diukur absorbansinya dengan menggunakan spektrofotometer serapan atom pada panjang gelombang 285,2 nm. Konsentrasi magnesium dalam sampel ditentukan berdasarkan persamaan garis regresi dari kurva kalibrasi.
Kadar besi, kalium, kalsium, dan magnesium dalam sampel dapat dihitung dengan cara sebagai berikut:
Kadar (mcg/g) = Konsentrasi(
mcg mL
⁄ )x Volume mL x Faktor pengenceran Berat sampel (g)
3.13. Validasi
3.13.1 Simpangan Baku Relatif
RSD = SD
ẋ x 100%
Keterangan: ẋ = Kadar rata-rata sampel SD = Standar Deviasi
RSD = Relative Standard Deviation (Simpangan Baku Relatif)
3.13.2 Uji Perolehan Kembali (Recovery)
Uji perolehan kembali atau recovery dilakukan dengan metode penambahan larutan baku (standard addition method). Dalam metode ini, kadar logam dalam sampel ditentukan terlebih dahulu, selanjutnya dilakukan penentuan kadar logam dalam sampel setelah penambahan larutan baku dengan konsentrasi tertentu (Ermer dan McB. Miller, 2005).
Bunga kecombrang yang telah dihaluskan ditimbang secara seksama sebanyak 10 gram, lalu ditambahkan 1 ml larutan baku besi, 10 ml larutan baku kalium, 10 ml larutan baku kalsium, dan 10 ml larutan baku magnesium kemudian dilanjutkan dengan prosedur destruksi kering seperti yang telah dilakukan sebelumnya.
Menurut Harmita (2004), persen perolehan kembali dapat dihitung dengan rumus di bawah ini:
=Jumlah logam setelah ditambah bakuKadar larutan baku yang ditambahkan- Jumlah logam dalam sampel awal x %
3.13.3 Penentuan Batas Deteksi (Limit of Detection) dan Batas Kuantitasi (Limit of Quantitation)
merupakan kuantitas terkecil analit dalam sampel yang masih dapat memenuhi kriteria cermat dan seksama.
Menurut Harmita (2004), batas deteksi dan batas kuantitasi dapat dihitung dengan rumus sebagai berikut:
S y⁄x =
√
Σ Y-Yin
-Batas Deteksi (LOD) = 3 x S
y x ⁄
slope
Batas Kuantitasi (LOQ) = 10 x S y x⁄
slope
3.14 Analisis data Secara Statistik
Menurut Sudjana (2005), kadar besi, kalium, kalsium, dan magnesium yang diperoleh dari hasil pengukuran masing-masing larutan sampel dianalisis dengan metode standar deviasi dengan rumus:
SD =
√
Σ xi−ẋ2 n−1
Keterangan : xi = Kadar sampel
ẋ = Kadar rata-rata sampel n = Jumlah perulangan Untuk mencari thitung digunakan rumus: thitung=
x-ẋ
SD
√n ⁄
dan untuk menentukan kadar logam di dalam sampel dengan interval kepercayaan
Kadar logam μ =ẋ± ( t(α/2, dk) x SD/√n ) Keterangan: ẋ = Kadar rata-rata sampel
SD = Standar Deviasi
dk = Derajat Kebebasan (dk = n-1)
BAB IV
HASIL DAN PEMBAHASAN 4.1 Pemeriksaan Kuantitatif
4.1.1 Kurva Kalibrasi Besi, Kalium, Kalsium, dan Magnesium
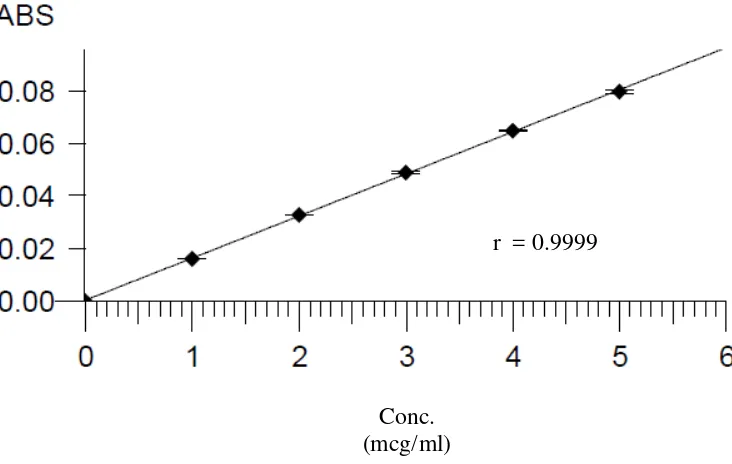
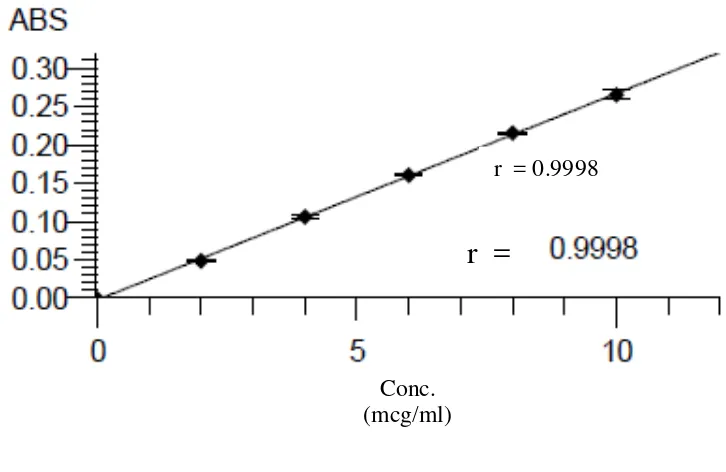
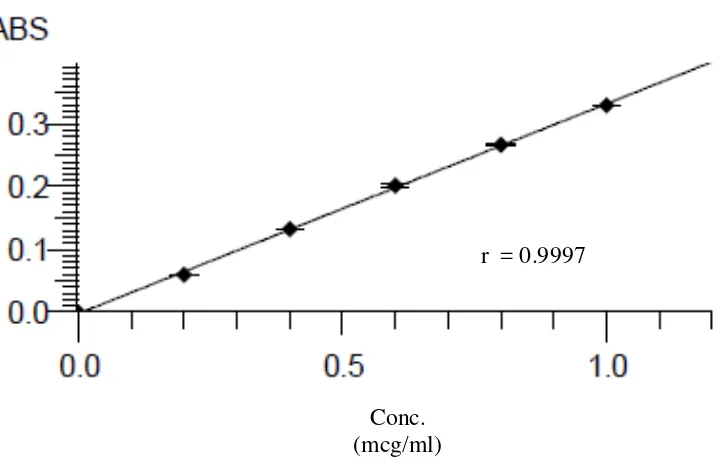
Kurva kalibrasi besi, kalium, kalsium dan magnesium diperoleh dengan cara mengukur absorbansi dari larutan standar pada panjang gelombang masing-masing yaitu 248,3 nm untuk besi, 766,5 nm untuk kalium, 422,7 untuk kalsium, dan 285,2 nm untuk magnesium. Dari pengukuran kurva kalibrasi diperoleh persamaan garis regresi yaitu Y= 0.01602X + 0,00025 untuk besi, Y= 0,0368X + 0,0016 untuk kalium, Y= 0,02696X - 0,0023 untuk kalsium, dan Y= 0,33415X – 0,0023 untuk magnesium.
Kurva kalibrasi larutan standar besi, kalium, kalsium, dan magnesium dapat dilihat pada Gambar 4.1 sampai dengan Gambar 4.4.
Gambar 4.1. Kurva Kalibrasi Seri Larutan Standar Besi untuk Penetapan Kadar Besi
Conc. (mcg/ml)
[image:47.595.129.495.460.692.2]Gambar 4.2. Kurva Kalibrasi Seri Larutan Standar Kalium untuk Penetapan Kadar Kalium
Gambar 4.3. Kurva Kalibrasi Seri Larutan Standar Kalsium untuk Penetapan Kadar Kalsium
Conc. (mcg/ml)
r = 0.9998
r =
r = 0.9998
[image:48.595.142.505.405.641.2]Gambar 4.4. Kurva Kalibrasi Seri Larutan Standar Magnesium untuk Penetapan Kadar Magnesium
Berdasarkan kurva di atas diperoleh hubungan yang linear antara konsentrasi dengan absorbansi, dengan koefisien korelasi (r) besi sebesar 0,9999, kalium
sebesar 0,λλλ8, kalsium sebesar 0,λλλ8, dan magnesium sebesar 0,λλλ7. Nilai r ≥
0,97 menunjukkan adanya korelasi linier yang menyatakan adanya hubungan antara X (Konsentrasi) dan Y (Absorbansi) (Ermer dan McB. Miller, 2005). Data hasil pengukuran absorbansi larutan standar kalsium, kalium, dan magnesium dan perhitungan persamaan garis regresi dapat dilihat pada Lampiran 6 - 9, halaman 47 - 54.
4.1.2 Kadar Besi, Kalium, Kalsium, dan Magnesium dalam Bunga Kecombrang
Penentuan kadar kalsium, kalium, dan magnesium dilakukan secara spektrofotometri serapan atom dimana sampel terlebih dulu didestruksi kering dengan HNO3(1:1) kemudian dilarutkan dan diukur pada spektrofotometri serapan atom. Konsentrasi mineral kalsium, kalium, dan magnesium dalam sampel
Conc. (mcg/ml)
[image:49.595.138.498.105.336.2]ditentukan berdasarkan persamaan garis regresi kurva kalibrasi larutan standar masing-masing mineral. Data dan contoh perhitungan dapat dilihat pada Lampiran 10 - 21, halaman 55 - 70.
Analisis dilanjutkan dengan perhitungan statistik (Perhitungan dapat dilihat pada Lampiran 22 - 25, halaman 71 - 82). Hasil analisis kuantitatif kadar besi, kalium, kalsium, dan magnesium dalam sampel dapat dilihat pada Tabel 4.1.
Tabel 4.1. Kadar Besi, Kalium, Kalsium dan Magnesium dalam Sampel No Sampel Kadar Besi
(mg/100 g) Kadar Kalium (mg/100 g) Kadar Kalsium (mg/100 g) Kadar Magnesium (mg/100 g) 1. Bunga
Kecombrang 1,5529 ± 0,012 697,3036 ± 1,4033 1276,2998 ± 17,4448 162,1079 ± 0,5724 Keterangan: Hasil ini adalah rata-rata yang diperoleh dengan 6 kali pengulangan
Menurut Wijekoon, et al. (2011), hasil penetapan kadar besi, kalium, kalsium, dan magnesium secara berturut-turut menggunakan Inductively Coupled Plasma Optical Emission Spectrophotometer (ICP-OES) adalah 2,4 mg, 541 mg, 775,3 mg, dan 327,1 mg yang menunjukkan terdapat perbedaan hasil dimana kadar besi dan magnesium yang diperoleh lebih rendah sedangkan kadar kalium dan kalsium yang diperoleh lebih tinggi. Hal ini mungkin disebabkan oleh tempat pengambilan sampel bunga kecombrang dan metode yang berbeda. Adapun bunga kecombrang yang dipilih dalam penelitian Wijekoon, et al. (2011) memiliki kualitas yang sama dengan penelitian ini yaitu segar, kuncup, dan memiliki tingkat kematangan yang seragam.
terdapat dalam jumlah yang cukup dapat bertindak sebagai antioksidan dan terlibat dalam memperkuat sistem imunitas. Adanya mineral-mineral ini dalam bunga kecombrang menyajikan dasar informasi untuk penggunaannya dalam aplikasi pangan seperti pembuatan suplemen makanan.
4.1.3 Uji Perolehan Kembali (Recovery)
Hasil uji perolehan kembali (recovery) kadar besi, kalium, kalsium, dan magnesium setelah penambahan masing-masing larutan standar besi, kalium, kalsium, dan magnesium dalam sampel dapat dilihat pada Lampiran 26 - 29, halaman 83 - 86. Persen recovery besi, kalium, kalsium, dan magnesium dalam sampel dapat dilihat pada Tabel 4.2.
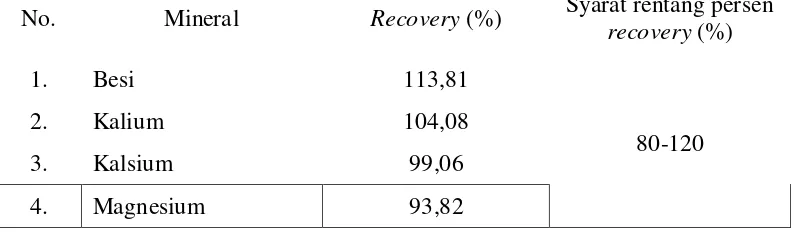
Tabel 4.2. Persen Uji Perolehan Kembali (recovery) Kadar Besi, Kalium, Kalsium, dan Magnesium
No. Mineral Recovery (%) Syarat rentang persen
recovery (%)
1. Besi 113,81
80-120
2. Kalium 104,08
3. Kalsium 99,06
4. Magnesium 93,82
[image:51.595.115.512.400.516.2]perolehan kembali (recovery) berada pada rentang 80-120 % (Ermer dan McB. Miller, 2005).
4.1.4 Simpangan Baku Relatif
Dari perhitungan yang dilakukan terhadap data hasil pengukuran kadar besi, kalium, kalsium, dan magnesium diperoleh nilai simpangan baku (SD) sebesar 0,6507 untuk besi, 3,4692 untuk kalium, 7,5251 untuk kalsium, 9,2815 untuk magnesium dan nilai simpangan baku relatif (RSD) sebesar 0,57% untuk besi, 3,33% untuk kalium, 7,59% untuk kalsium, dan 9,89% untuk magnesium. Perhitungan dapat dilihat pada lampiran halaman . Menurut Harmita (2004), nilai simpangan baku relatif (RSD) untuk analit dengan kadar part per million (ppm) adalah tidak lebih dari 16%. Kecermatan atau presisi dapat dilihat dari nilai simpangan baku relatif (RSD). Dari hasil yang diperoleh menunjukkan bahwa metode yang dilakukan memiliki presisi yang baik.Perhitungan simpangan baku relatif (RSD) dapat dilihat pada Lampiran 35 - 38, halaman 96– 99.
4.1.5 Batas Deteksi dan Batas Kuantitasi
kuantitasi sebesar 0,3564 mcg/ml untuk besi, 0,7364 mcg/ml untuk kalium, 0,8123 mcg/ml untuk kalsium dan 0,1080 mcg/ml untuk magnesium.
BAB V
KESIMPULAN DAN SARAN 5.1 Kesimpulan
1. Hasil penetapan kadar dengan menggunakan spektrofotometri serapan atom menunjukkan bahwa kadar besi, kalium, kalsium, dan magnesium pada bunga kecombrang adalah 1,5529 ± 0,012 mg/100 g untuk besi; 697,3036 ± 1,4033 mg/100 g untuk kalium; 1276,2998 ± 17,4448 mg/100 g untuk kalsium dan 162,1079 ± 0,5724 mg/100 g untuk magnesium.
5.2 Saran
DAFTAR PUSTAKA
Adliani, N., Nazliniwaty., dan Purba, D. (2012). Formulasi Lipstik Menggunakan Zat Warna dari Ekstrak Bunga Kecombrang (Etlingera elatior (Jack) R.M.Sm.). Journal of Pharmaceutics and Pharmacology. 1(2): 89.
Almatsier, S. (2004). Prinsip Dasar Ilmu Gizi. Jakarta: PT. Gramedia Pustaka Utama. Halaman 241-243.
Basset, J., Denney, R.C., Jeffery, G.H., dan Mendham, J. (1991). Vogel’s
Textbook of Quantitative Inorganic Analysis Including Elementary Instrumental Analysis. Penerjemah: Setiono, L., dan Pudjaatmaka, A.H. (1994). Kimia Analisis Kuantitatif Anorganik. Edisi IV. Jakarta: Penerbit Buku Kedokteran EGC. Halaman 942.
Belitz, H.-D., Grosch, W., dan Schieberle, P. (2009). Food Chemistry. Edisi IV. Heidelberg: Springer-Verlag Berlin. Halaman 421.
Ben-Bassat, A.H.I., dan Azrad, A. (2013). The Volumetric Determination of Potassium by Heterometric Titration. Israel Journal of Chemistry. 9(5): 557.
Braun, R.D. (1982). Introduction To Chemical Analysis. New York: McGraw-Hill. Halaman 381.
Budianto, A.K. (2009). Dasar-dasar Ilmu Gizi. Cetakan keempat. Malang: UMM Press. Halaman 82.
Chan, E.W.C, Lim, Y.Y., dan Wong, S.K. (2011). Phytochemistry and Pharmacological Properties of Etlingera elatior: A Review.
Pharmacognosy Journal. 3(22): 6-7.
Ditjen POM. (1979). Farmakope Indonesia. Edisi III. Jakarta: Departemen Kesehatan RI. Halaman 744,748.
Ditjen POM. (1995). Farmakope Indonesia. Edisi IV. Jakarta: Departemen Kesehatan RI. Hal. 1122, 1173.
Ermer, J., dan McB. Miller, J.H. (2005). Method Validation in Pharmaceutical Analysis. A Guide to Best Pratice. Weinheim: Wiley-Vch Verlag GmbH & Co. KGaA. Halaman 171.
Fifield, F.W., dan Kealey, D. (2000). Principles and Practice of Analytical Chemistry. Edisi V. London: Blackwell Science Limited. Hal. 271, 276. Harmita. (2004). Petunjuk Pelaksanaan Validasi Metode dan Cara
Heyne, K. (1913). De Nuttige Planten Van Nederlandsch-Indië. Penerjemah: Badan Litbang Kehutanan (1987). Tumbuhan Berguna Indonesia. Jilid II, Cetakan Ke-1. Jakarta: Badan Penelitian dan Pengembangan Kehutanan, Departemen Kehutanan. Halaman 183.
Isaac, R.A. (1988). Metal in Plants: Atomic Absorption Spectrophotometry Method dalam Helrich, K. (1990). Official Methods of Analysis of The Association of Official Analytical of Chemist. Edisi XV. Virginia: AOAC International. Halaman 42.
Jackie, T., Haleagrahara, N., dan Chakravarthi, S. (2011). Antioxidant Effects of
Etlingera elatior Flower Extract Against Lead Acetate – Induced Perturbations in Free Radical Scavenging Enzymes and Lipid Peroxidation in Rats. Biomed Central Research Notes. 4(67): 2.
Lim, T.K. (2014). Edible Medicinal and Non Medicinal Plants. Volume VIII. Dordrecht: Springer Science and Business Media. Halaman 835.
Montgomery, R., Dryer, R.L., Conway, T.W., dan Spector, A.A. (1993).
Biokimia: Suatu Pendekatan Berorientasi-Kasus. Jilid I. Edisi Keempat. Yogyakarta: Gadjah Mada University Press. Hal. 38.
Poedjiadi, A. (1994). Dasar-dasar Biokimia. Edisi Revisi. Jakarta: UI-Press. Halaman 417.
Rohman, A. (2007). Kimia Farmasi Analisis. Cetakan Pertama. Yogyakarta: Pustaka Pelajar. Halaman 18,22-23, 298-232.
Sudjana. (2005). Metode Statistika. Edisi VI. Bandung: Tarsito. Halaman 93, 168-169.
Sutanto, R. (2005). Dasar-dasar Ilmu Tanah. Yogyakarta: Kanisius. Halaman 23. Tampubolon, O.T., Suhatsyah, S., dan Sastrapradja, S. (1983). Penelitian
Pendahuluan Kimia Kecombrang (Nicolaia speciosa Horan). Risalah Simposium Penelitian Tumbuhan Obat III. Yogyakarta: Fakultas Farmasi Universitas Gajah Mada. Halaman 452-453.
Tan, A. (1996). Wanita dan Nutrisi. Jakarta: Bumi Aksara. Halaman 21.
Tan, H.T., dan Rahardja, K. (2007).Obat-obat Penting. Edisis VII. Cetakan I. Jakarta: PT. Elex Media Komputindo. Halaman 625, 698.
Wijekoon, J.O., Karim, M.M., dan Bhat, R. (2011). Evaluation of Nutritional Quality of Torch Ginger (Etlingera elatior Jack.) Inflorescence.
International Food Research Journal. 18(4): 1415-1420.
Winarno, F.G. (1992). Kimia Pangan dan Gizi. Jakarta: PT. Gramedia Pustaka Utama. Halaman 153.
Wong, K.C., Sivasothy, Y., Boey, P.L., dan Osman, H. (2010). Essential Oils of
Lampiran 2. Sampel yang Digunakan
Gambar 1. Tanaman Kecombrang (Etlingera elatior)
Lampiran 3. Gambar alat-alat yang Digunakan
[image:60.595.185.433.407.704.2]Lampiran 3. (Lanjutan)
Lampiran 4. Bagan Alir Proses Destruksi Kering
Ditambahkan 5 ml HNO3 (1:1) Bunga kecombrang
Ditimbang ± 10 gram dalam krus porselen
Dimasukkan kembali ke dalam tanur selama 1 jam dengan suhu 500ºC dan dibiarkan hingga dingin pada desikator
Diarangkan di atas hot plate selama 7 jam
Dilakukan selama ± 16 jam dan dibiarkan hingga dingin dalam desikator
Hasil
Dicuci bersih
Ditiriskan dan dikeringkan dengan cara diangin-anginkan selama 1 jam
Dipotong-potong kecil dan dihaluskan dengan blender
Diabukan dalam tanur dengan temperatur awal 100°C dan perlahan-lahan temperatur dinaikkan hingga suhu 500ºC dengan interval 25°C setiap 5 menit
Sampel yang telah dihaluskan
Abu
Dibasahi dengan 10 tetes akua demineralisata Ditambahkan 5 ml HNO3 (1:1)
Lampiran 5. Bagan Alir Pembuatan Larutan Sampel
Dipindahkan ke dalam labu tentukur 100 ml
Diencerkan dengan akua demineralisata hingga garis tanda
Dimasukkan ke dalam botol Larutan sampel
Disaring dengan kertas saring Whatmann No.42
Filtrat
Dibuang 5 ml filtrat untuk menjenuhkan kertas saring
Dilakukan analisis kuantitatif dengan Spektrofotometer Serapan Atom pada 248,3 nm untuk kadar besi, pada 766,5 nm untuk kadar kalium, pada 422,7 nm untuk kadar kalsium,dan pada 285,2 nm untuk kadar magnesium
Hasil
Dipindahkan ke dalam labu tentukur 100 ml
Dilarutkan dalam 10 ml HNO3 (1:1) Sampel yang telah
Lampiran 6. Data Kalibrasi Besi dengan Spektrofotometer Serapan Atom, Perhitungan Persamaan Garis Regresi dan Koefisien Korelasi (r) No. Konsentrasi (mcg/ml)
(X)
Absorbansi (Y)
1. 0,0000 -0,0001
2. 1,0000 0,0160
3. 2,0000 0,0327
4. 3,0000 0,0488
5. 4,0000 0,0647
6. 5,0000 0,0796
No. X Y XY X2 Y2 x10-4
1. 0,0000 -0,0001 0,0000 0,0000 0,0001
2. 1,0000 0,0160 0,0160 1,0000 2,5600
3. 2,0000 0,0327 0,0654 4,0000 10,6929
4. 3,0000 0,0488 0,1464 9,0000 23,8144
5. 4,0000 0,0647 0,2588 16,0000 41,8609 6. 5,0000 0,0796 0,3980 25,0000 63,3616
15,0000
X = 2,5000
0,2417
Y= 0,0403
0,8846 55,0000 68,1342
a =
X
n X n Y X XY / / 2 2
=
0,2417
/6= 0,01602
Lampiran 6. (Lanjutan)
Y = a X + b b = Y a X
= 0,0403 – (0,01602)(2,5000) = 0,00025
Maka persamaan garis regresinya adalah: Y = 0,01602X +0,00025
Lampiran 7. Data Kalibrasi Kaliumdengan Spektrofotometer Serapan Atom, Perhitungan Persamaan Garis Regresi dan Koefisien Korelasi (r). No. Konsentrasi (mcg/ml)
(X)
Absorbansi (Y)
1. 0,0000 -0,0002
2. 2,0000 0,0747
3. 4,0000 0,1515
4. 6,0000 0,2253
5. 8,0000 0,2928
6. 10,0000 0,3694
No. X Y XY X2 Y2 x10-4
1. 0,0000 -0,0002 0,0000 0,0000 0,0004
2. 2,0000 0,0747 0,1494 4,0000 55,8009
3. 4,0000 0,1515 0,6060 16,0000 229,5225 4. 6,0000 0,2253 1,3518 36,0000 507,6009 5. 8,0000 0,2928 2,3424 64,0000 857,3184 6. 10,0000 0,3694 3,6940 100,0000 1364,5636
30,0000
X = 5,0000
1,1135
Y= 0,1856
8,1436 220,0000 3014,8067
a =
X
n X n Y X XY / / 2 2
=
(1,1135
)/6Lampiran 7. (Lanjutan)
Y = a X + b b = Y a X
= 0,1856 – (0,0368)(5,0000) = 0,0016
Maka persamaan garis regresinya adalah: Y = 0,0368X + 0,0016
=
220
,
000
30
,
0000
/
6
3014,8067
x10
1
,
1135
/
6
Lampiran 8. Data Kalibrasi Kalsiumdengan Spektrofotometer Serapan Atom, Perhitungan Persamaan Garis Regresi dan Koefisien Korelasi (r). No. Konsentrasi (mcg/ml)
(X)
Absorbansi (Y)
1. 0,0000 -0,0012
2. 2,0000 0,0487
3. 4,0000 0,1061
4. 6,0000 0,1604
5. 8,0000 0,2155
6. 10,0000 0,2653
No. X Y XY X2 Y2 x10-4
1. 0,0000 -0,0012 0,0000 0,0000 0,0144
2. 2,0000 0,0487 0,0974 4,0000 23,7169
3. 4,0000 0,1061 0,4244 16,0000 112,5721 4. 6,0000 0,1604 0,9624 36,0000 257,2816 5. 8,0000 0,2155 1,7240 64,0000 464,4025 6. 10,0000 0,2653 2,6530 100,0000 703,8409
30,0000
X = 5,0000
0,7948
Y= 0,1325
5,8612 220,0000 1561,8284
a =
X
n X n Y X XY / / 2 2
=
(0,7948
)/6Lampiran 8. (Lanjutan)
Y = a X + b b = Y a X
= 0,1325 – (0,02696)(5,0000) = - 0,0023
Maka persamaan garis regresinya adalah: Y = 0,02696X - 0,0023
=
220
,
000
30
,
0000
/
6
1561,8284
x10
0
,
7948
/
6
Lampiran 9. Data Kalibrasi Magnesium dengan Spektrofotometer Serapan Atom, Perhitungan Persamaan Garis Regresi dan Koefisien Korelasi (r).
No. Konsentrasi (mcg/ml) (X)
Absorbansi (Y)
1. 0,0000 -0,0003
2. 0,2000 0,0594
3. 0,4000 0,1322
4. 0,6000 0,2017
5. 0,8000 0,2666
6. 1,0000 0,3293
No. X Y XY X2 Y2 x10-4
1. 0,0000 -0,0003 0,00000 0,0000 0,0009 2. 0,2000 0,0594 0,01188 0,4000 35,2836 3. 0,4000 0,1322 0,05288 0,1600 174,7684 4. 0,6000 0,2017 0,12102 0,3600 406,8289 5. 0,8000 0,2666 0,21328 0,6400 710,7556 6. 1,0000 0,3293 0,32930 1,0000 1084,3849
3,0000
X = 0,5000
0,9889
Y= 0,1648
0,72836 2,2000 2412,0223
a =
X
n X n Y X XY / / 2 2
3,0000
(0,9889)/6 72836,