SINTESIS BaTiO
3DARI BaCl
2DAN TiCl
4DENGAN METODE
HIDROTERMAL
DWI PUTRI UTAMI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
DWI PUTRI UTAMI. Sintesis BaTiO
3dari BaCl
2dan TiCl
4dengan Metode
Hidrotermal. Dibimbing oleh IRMA H. SUPARTO dan AGUS SAPUTRA.
Seiring dengan kemajuan teknologi saat ini, peralatan elektronik semakin
berkembang. Salah satu komponen penyusun peralatan elektronik adalah
kapasitor. Salah satu bahan penyusun kapasitor, ialah barium titanat (BaTiO
3).
Penelitian ini bertujuan mensintesis dan mencirikan BaTiO
3dari campuran BaCl
2dan TiCl
4dengan mengamati perubahan suhu dan tahapan reaksi. Penelitian ini
meliputi beberapa tahap, yaitu sintesis BaTiO
3dengan metode hidrotermal,
perubahan tahapan reaksi, perubahan pH, dan membandingkan hasil sintesis
menggunakan metode nonhidrotermal, serta pencirian dengan difraksi sinar-X
(XRD). Berdasarkan hasil XRD, sintesis BaTiO
3menggunakan metode
hidrotermal (T = 120-150
oC), perubahan tahapan reaksi, dan perubahan pH
belum bisa menghasilkan BaTiO
3murni
.Hal ini dapat dilihat dari rendahnya
intensitas BaTiO
3yang terbentuk serta masih terdapatnya pengotor lain berupa
TiO
2, seperti pada metode nonhidrotermal (T = 600
oC).
ABSTRACT
DWI PUTRI UTAMI. Synthesis and Characterization of BaTiO
3from BaCl
2and
TiCl
4by Hydrothermal Method. Supervised by IRMA H. SUPARTO and AGUS
SAPUTRA
SINTESIS BaTiO
3DENGAN METODE HIDROTERMAL DARI
BaCl
2DAN TiCl
4SERTA KARAKTERISASINYA
DWI PUTRI UTAMI
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul : Sintesis BaTiO
3dari BaCl
2dan TiCl
4dengan Metode Hidrotermal
Nama : Dwi Putri Utami
NIM : G44070057
Disetujui
Pembimbing I
Pembimbing II
Dr. dr. Irma H Suparto, MS
Agus Saputra, SSi, MSi
NIP 19581123 198603
NIP 19761101 2005011002
Diketahui
Ketua Departemen Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor,
Prof. Dr. Ir. Tun Tedja Irawadi, MS
NIP 19501227 197603 2 002
PRAKATA
Puji syukur penulis panjatkan kepada Allah SWT atas berkat dan
hidayah-Nya penulis dapat menyelesaikan karya ilmiah dengan judul Sintesis BaTiO
3dari
BaCl
2dan TiCl
4dengan metode hidrotermal. Salawat serta salam semoga selalu
tercurah kepada Nabi Muhammad SAW beserta keluarganya.
Penulis mengucapkan terimakasih banyak kepada Ibu Dr. dr. Irma H
Suparto, MS dan Bapak Agus Saputra, SSi, MSi selaku pembimbing yang
senantiasa memberikan arahan, dorongan, masukan, serta doa selama penelitian.
Penulis juga mengucapkan terimakasih kepada Pak Sawal, Pak Mul, Pak Caca,
Mba Nurul para staf laboran Laboratorium Kimia Anorganik atas bantuan selama
penelitian.
Terimakasih tak terhingga penulis ucapkan kepada Almarhum Ayah, Ibu,
kakak, adik atas doa dan kasih sayangnya. Juga ucapkan terima kasih kepada Putu
Lilik, Mega, Cusna, Dian, Nina, Annisa, Octa, Nosen, Kak Karin, dan Prestiana
yang telah membantu memberi masukan, serta Jamil atas saran, semangat dan
kasih sayang yang diberikan kepada penulis.
Semoga karya ilmiah ini dapat bermanfaat bagi perkembangan ilmu
pengetahuan.
Bogor, November 2011
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 7 Desember 1989 dari ayah Saban
Karto Utomo dan Ibu Mardianingsih, sebagai putri kedua dari tiga bersaudara.
Tahun 2007, penulis lulus dari SMA Negeri 27 Jakarta dan pada tahun yang
sama lulus seleksi masuk Institut Pertanian Bogor (IPB) melalui Undangan
Seleksi Masuk IPB (USMI) dan diterima di Departemen Kimia, Fakultas
Matematika dan Ilmu Pengetahuan Alam.
Selama mengikuti perkuliahan, pernah menjadi asisten praktikum Kimia
Tingkat Persiapan Bersama (TPB) pada tahun 2009 sampai 2011. Penulis juga
aktif mengajar mata kuliah Kimia TPB privat dan bimbingan belajar Avogadro
dari tahun 2008 sampai 2010. Selain itu, mengajar pada bimbingan belajar
PRIMAGAMA untuk mata pelajaran Ilmu Pengetahuan Alam (IPA) dan Kimia.
Penulis juga pernah aktif sebagai staf Pengembangan Sumber Daya Mahasiswa
(PSDM) di IMASIKA (Ikatan Mahasiswa Kimia) pada tahun 2009/2010.
DAFTAR ISI
Halaman
DAFTAR GAMBAR ... vii
DAFTAR LAMPIRAN ... vii
PENDAHULUAN ... 1
METODE ... 1
Alat dan Bahan ... 1
Lingkup Kerja ... 1
Pembuatan Larutan Ti(OH)
4dan BaCl
2... 1
Pembuatan Larutan BaTiO
3dengan Metode Hidrotermal ... 1
Perubahan Tahapan Reaksi ... 2
Peningkatan pH ... 2
Metode Non Hidrotermal ... 2
Karakterisasi dengan XRD ... 2
HASIL ... 2
Metode Hidrotermal ... 2
Perubahan Tahapan Reaksi ... 2
Peningkatan pH ... 3
Metode Non Hidrotermal ... 3
PEMBAHASAN ... 3
SIMPULAN DAN SARAN ... 5
Simpulan ... 5
Saran ... 5
DAFTAR PUSTAKA ... 5
DAFTAR GAMBAR
Halaman
1
Kristal hasil sintesis dari BaCl
2dan TiCl
4... 2
2
Pola difraksi BaTiO
3T = 120 - 150
oC metode hidrotermal ... 2
3
Pola difraksi struktur kristal T = 120
oC perubahan tahapan reaksi ... 3
4
Pola difraksi struktur kristal T = 600
oC metode non hidrotermal ... 3
5
Pola difraksi struktur kristal T = 150
oC peningkatan pH ... 3
DAFTAR LAMPIRAN
Halaman
1
Diagram alir penelitian semua tahapan dan perubahan tahapan reaksi ... 8
2
Contoh perhiyungan pembuatan larutan Ti(OH)
4dan BaTiO
3... 10
3
Data JCPDS ... 11
4
Pola difraksi standar BaTiO
3dan TiO
2... 12
5
Pola difraksi BaTiO
3pada T = 120 - 150
oC dengan metode hidrotermal . 13
6
Pola difraksi BaTiO
3menggunakan perubahan tahapan reaksi ... 15
7
Pola difraksi BaTiO
3menggunakan metode non hidrotermal ... 16
PENDAHULUAN
Seiring dengan kemajuan teknologi saat ini, peralatan elektronik semakin berkembang. Hal ini dipengaruhi oleh meningkatnya kebutuhan konsumen akan peralatan yang semakin canggih. Salah satu komponen
penyusun peralatan elektronik adalah
kapasitor. Kapasitor memiliki sifat
menyimpan energi listrik/muatan listrik, serta memiliki banyak kegunaan diantaranya adalah untuk menghindari terjadinya loncatan listrik pada rangkaian-rangkaian yang mengandung kumparan. Salah satu bahan yang dapat digunakan sebagai penyusun kapasitor adalah barium titanat (BaTiO3) (Hamonangan 2009). BaTiO3 yang memiliki struktur tetragonal dan berukuran lebih kecil, baik digunakan sebagai dielektrik (Wahyudi 2007).
BaTiO3 dapat digunakan sebagai penyusun kapasitor karena memiliki sifat dielektrik yang
baik. Awalnya, BaTiO3 dapat disintesis
dengan mereaksikan TiO2 dan BaCO3 pada
suhu tinggi (Boulous et al. 2005) sekitar 1200 o
C (Deshpande et al. 2005). Sintesis dengan suhu tinggi pada skala besar membutuhkan biaya produksi yang cukup besar. Kekurangan ini dapat diatasi dengan menggunakan metode hidrotermal yang dapat mengurangi biaya produksi (Sun et al. 2006). Metode sintesis ini mempunyai beberapa kelebihan antara lain menghasilkan partikel dengan kristanilitas tinggi, menggunakan suhu rendah untuk reaksi, kemurnian tinggi, serta distribusi ukuran partikel yang homogen (Lee et al.
2000). Selain itu, metode hidrotermal juga dapat menghasilkan kristal yang berukuran nanometer (nm) (Moon & Cho 2007).
Sintesis BaTiO3 yang telah dilakukan oleh
para peneliti sebelumnya menggunakan
Ba(OH)2.8H2O dan TiO2 dengan metode hidrotermal (Retnantiti 2010). Akan tetapi,
hasil sintesis tersebut masih terdapat
kekurangan, diantaranya menghasilkan
endapan BaCO3 dan ukuran partikel yang tidak homogen (masih terdapat bentuk tetragonal dan kubik), sifat dielektrik yang kurang baik serta menggunakan suhu yang tinggi. Oleh karena itu, pada penelitian ini
akan dilakukan modifikasi dengan
menggunakan bahan baku sintesis, yaitu
BaCl2 dan TiCl4 menggunakan metode
hidrotermal dengan mengamati perubahan pada suhu, dan perubahan pH.
Penelitian ini, BaCl2 menggantikan
Ba(OH)2.8H2O dan TiO2 dengan TiCl4. Jika dibandingkan dengan Ba(OH)2.8H2O, BaCl2 memiliki nilai kelarutan yang lebih besar
sehingga diharapkan akan menghasilkan
BaTiO3 dengan ukuran yang lebih seragam
serta nilai konstanta dielektrik tinggi. Hasil sintesis BaTiO3 selanjutnya dikarakterisasi dengan difraksi sinar-X (X-ray difraction). Difraksi sinar-X berfungsi mengidentifikasi
fasa kristalin (Girolami et al. 1999).
Diharapkan dengan adanya perubahan pada bahan baku dapat menghasilkan kristal BaTiO3 dengan intensitas yang lebih tinggi.
METODE
Alat dan Bahan
Alat-alat yang digunakan adalah neraca analitik, pengaduk magnetik, tanur, oven, alat hidrotermal, alat-alat kaca, cawan porselen, dan difraksi sinar-X Shimadzu XRD-7000.
Bahan-bahan yang digunakan adalah
BaCl2.H2O, TiCl4, HCl, NH4OH pekat, dan air
bebas ion.
Lingkup Kerja
Penelitian ini terbagi menjadi dua tahapan. Tahap pertama adalah sintesis BaTiO3 dengan
bahan baku BaCl2 dan TiCl4 menggunakan
metode hidrotermal, non hidrotermal,
perubahan tahapan reaksi, dan perubahan pH.
Tahap kedua adalah hasil sintesis
dikarakterisasi menggunakan XRD (Lampiran 1).
Pembuatan Larutan Ti(OH)4 dan BaCl2
BaCl2 sebagai sumber ion Ba2+ dan TiCl4
sebagai sumber ion Ti4+. Rasio mol Ba
terhadap Ti (Ba/Ti) dibuat satu (Lee et al. 2000). Pembuatan larutan Ti(OH)4. Larutan
Ti(OH)4 dapat dibuat dengan mereaksikan
TiCl4 dan NH4OH pekat. Sebanyak 0,03 mol TiCl4 dan 0,12 mol NH4OH pekat masing-masing dilarutkan ke dalam 100 mL air bebas ion. Untuk pembuatan larutan BaCl2, yaitu ditimbang 4,4460 g BaCl2 (Lampiran 2) dilarutkan ke dalam 15 mL air bebas ion dan diaduk menggunakan pengaduk magnetik sampai homogen.
Pembuatan BaTiO3 dengan Metode
Hidrotermal
Larutan TiCl4 (50 mL) ditambahkan
suhu ruang. Setelah larutan homogen, larutan dimasukkan ke dalam alat hidrotermal pada
suhu 120 sampai dengan 150 oC (dengan
kisaran suhu 10 oC) selama 7 jam dan dicuci menggunakan air bebas ion dan dikeringkan
menggunakan oven pada suhu 100 oC (Sahoo
et al. 2007 ).
Perubahan Tahapan Reaksi
Larutan TiCl4 (50 mL) ditambahkan
dengan larutan BaCl2 dan diaduk
menggunakan pengaduk magnetik. Saat
proses pengadukan ditambahkan sedikit demi sedikit NH4OH pekat sebanyak 10,60 mL. Ketiga larutan tersebut diaduk selama 2 jam sampai homogen. Setelah larutan bercampur sempurna larutan dimasukkan ke dalam alat hidrotermal pada suhu 120oC selama 7 jam yang selanjutnya dicuci menggunakan air bebas ion dan dikeringkan menggunakan oven pada suhu 100 oC (Sahoo et al. 2007 ).
Peningkatan pH
Larutan TiCl4 (50 mL) ditambahkan
NH4OH pekat berlebih hingga 20 mL. Setelah terjadi perubahan larutan menjadi berwarna putih, kemudian ditambahkan dengan larutan BaCl2. Ketiga larutan tersebut diaduk selama 2 jam sampai homogen dengan bantuan pengaduk magnetik. Setelah homogen, larutan dimasukkan ke dalam alat hidrotermal pada suhu 150 oC selama 7 jam kemudian dicuci menggunakan air bebas ion dan dikeringkan
menggunakan oven pada suhu 100 oC (Sahoo
et al. 2007 ).
Metode Non Hidrotermal
Prosedur sama seperti sintesis BaTiO3 menggunakan metode hidrotermal, namun
tidak menggunakan radas hidrotermal
melainkan menggunakan tanur (T=600 oC)
pada saat proses sintesis BaTiO3.
Karakterisasi dengan XRD
Serbuk kristal BaTiO3 yang terbentuk pada seluruh tahapan reaksi, dianalisis lebih lanjut dengan dilakukan karakterisasi menggunakan XRD. Sebelumnya sampel dimasukkan ke dalam pelat dan dipadatkan sampai tidak
terdapat rongga. Setelah sampel siap,
selanjutnya pelat dimasukkan ke dalam XRD. Hasil yang diperoleh dibandingkan dengan data XRD JCPDS (Joint Comitee of Powder
Difraction Standar).
HASIL
[image:10.595.381.469.181.265.2]Sintesis dari BaCl2 dan TiCl4 dengan metode hidrotermal dan non hidrotermal menghasilkan kristal berwarna putih, halus permukaannya, dan tidak larut dalam air yang diduga BaTiO3 (Gambar 1).
Gambar 1 Kristal hasil sintesis dari BaCl2 dan TiCl4.
Metode Hidrotermal
Karakterisasi pada berbagai suhu (T= 120 - 150 °C) dapat dilihat pada Gambar 2.
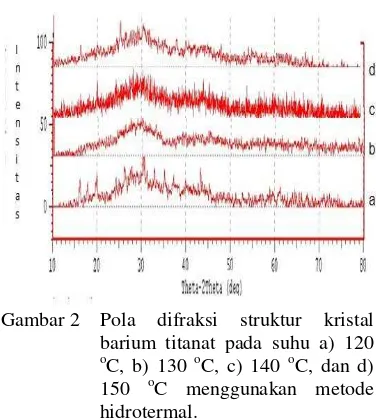
Gambar 2 Pola difraksi struktur kristal barium titanat pada suhu a) 120 o
C, b) 130 oC, c) 140 oC, dan d)
150 oC menggunakan metode
hidrotermal.
Gambar tersebut menunjukkan bentuk difraktogram dengan intensitas puncak yang hampir sama (intensitas rendah). Namun pada keempat suhu perlakuan, tampak pola difraksi
menunjukkan kecenderungan intensitas
puncak meningkat pada 2 sudut 30.
Perubahan Tahapan Reaksi
Suhu metode hidrotermal yang dipilih untuk uji perubahan tahap reaksi pencampuran
adalah pada suhu 120 oC, karena
menghasilkan puncak-puncak dengan
intensitas tinggi jika dibandingkan dengan
[image:10.595.323.511.355.565.2]difraktogram untuk perubahan tahapan reaksi dapat dilihat pada Gambar 3.
*
• ° * * • •
Gambar 3 Pola difraksi struktur kristal pada suhu 120 °C dengan perubahan tahapan reaksi. (*TiO2) (°BaTiO3)
(•Senyawa yang belum
diketahui).
Berdasarkan hasil tersebut dapat dilihat beberapa puncak dengan intensitas 50, yaitu disekitar 16o, 23o, 30 o, 37 o, 40 o, 44o, dan 68o, sedangkan intensitas pada 32o mencapai 175.
Peningkatan pH
Hasil difraktogram hasil sintesis metode hidrotermal dengan peningkatan pH pada suhu 150 °C dapat dilihat pada Gambar 4.
*
[image:11.595.106.301.44.842.2]• • ° • * °
Gambar 4 Pola difraksi struktur kristal pada suhu 150 °C dengan perubahan pH
menggunakan metode
hidrotermal (*TiO2) (°BaTiO3)
(•Senyawa yang belum diketahui).
Hasil XRD tersebut menunjukkan
beberapa puncak dengan intensitas 50 disekitar 20°, 27°, dan 44°, sedangkan untuk 2 pada sudut 16°, 31°, dan 36° dengan intensitas 60. Intensitas tertinggi pada 100 dihasilkan pada sudut 32°.
Metode non hidrotermal
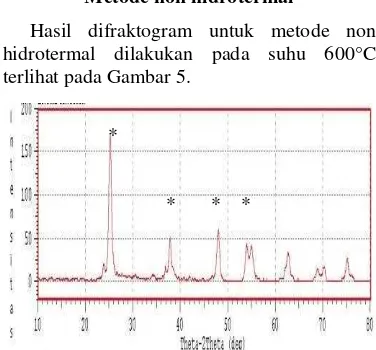
Hasil difraktogram untuk metode non hidrotermal dilakukan pada suhu 600°C terlihat pada Gambar 5.
*
* * *
Gambar 5 Pola difraksi struktur kristal pada
suhu 600°C menggunakan
metode non hidrotermal.
Pada Gambar 5 terlihat, beberapa puncak dengan intensitas disekitar 50, yaitu disekitar 38°, 48°, 53°, dan 55°, sedangkan intensitas tertinggi dihasilkan pada 2 sudut 25°.
PEMBAHASAN
Sintesis BaTiO3 menggunakan bahan baku BaCl2 dan TiCl4 dengan metode hidrotermal menghasilkan kristal berwarna putih, dengan permukaan halus, dan tidak larut dalam air. Kristal tersebut kemudian dianalisis dengan XRD. Pola difraksi yang dihasilkan berbeda satu sama lainnya.
Tahap awal sintesis menggunakan suhu
120 sampai dengan 150 oC dihasilkan
difraktogram yang hampir sama, yaitu menghasilkan pola difraksi dengan banyak puncak dan intensitas yang rendah. Kondisi ini sudah menunjukkan terbentuk BaTiO3, namun intensitas yang dihasilkan masih terlalu rendah. Hal ini dapat dilihat puncak-puncak yang mirip dengan data JCPDS.
Namun dari keempat perlakuan suhu,
intensitas yang lebih tinggi dihasilkan pada suhu 120 oC. Berdasarkan hasil ini maka pada
suhu 120 oC, dibuat perubahan dalam tahapan
reaksi untuk mensintesis BaTiO3 yang
diharapkan dapat menghasilkan puncak
BaTiO3 dengan intensitas yang lebih tinggi. Perubahan tahapan reaksi, yaitu dengan
mereaksikan TiCl4 dengan BaCl2 terlebih
[image:11.595.322.510.93.268.2]TiCl4 + BaCl2 + NH4OH BaTiO3
Ti4+ +Ba2+ +OH- BaTiO3
Hasil reaksi antar ion-ion Ti4+, Ba2+ dan
OH- dapat dilihat pada difraktogram
sebelumnya (perubahan tahapan reaksi). Hasil difraktogram pada hasil perubahan tahapan reaksi menunjukkan puncak-puncak dengan intensitas yang lebih tinggi jika dibandingkan dengan perlakuan sebelumnya
(pemanasan pada suhu 120-150 oC). Akan
tetapi, selain puncak-puncak untuk BaTiO3 juga terdapat puncak-puncak pengotor berupa TiO2 dan senyawa yang belum diketahui. Intensitas yang spesifik untuk BaTiO3 sekitar 22° masih rendah jika dibandingkan dengan TiO2 yang dihasilkan pada 2 sekitar 30°, 32°, dan 37° dengan intensitas tertinggi pada 32° mencapai 175. Selain pengotor berupa TiO2, juga masih terdapat pengotor yang belum diketahui di sekitar sudut 16°, 39°, dan 58°.
Adanya puncak-puncak TiO2 diduga telah terbentuknya TiO2 pada saat mereaksikan TiCl4 dengan air bebas ion dan HCl pekat.
TiCl4 yang ditambahkan tetes demi tetes
kedalam air bebas ion (T = 0 oC) akan langsung menghasilkan endapan putih TiO2. Ketika ditambahkan HCl pekat ke dalam larutan, maka HCl akan bereaksi dengan TiO2 membentuk senyawa intermediet TiOCl2. Larutan yang telah homogen disimpan ke dalam suhu ± 2 °C (lemari es) sampai larutan berubah warna, dari putih menjadi bening atau tak berwarna. Penyimpanan larutan pada suhu sekitar 2 °C dapat menstabilkan senyawa TiOCl2 dalam beberapa hari. Hal ini sesuai dengan Holleman & Wiberg (2001) yang menyatakan bahwa senyawa TiOCl2 stabil pada suhu di bawah 4°C dan akan berubah menjadi TiO2 pada suhu 40°C atau suhu kamar setelah 24 jam.
Masih terdapatnya pengotor berupa TiO2 maka dilakukan proses sintesis kembali dengan meingkatkan nilai pH menjadi 13 menggunakan metode hidrotermal pada suhu 150 oC. Hasil keempat difraktogram tidak menghasilkan difraktogram yang cukup baik, maka dipilih suhu yang paling tinggi, yaitu 150 oC. Sesuai pernyataan Saputra (2010), bahwa semakin tinggi suhu maka sumber energi untuk memutus ikatan Ba dan Cl pada BaCl2, serta juga dapat membantu difusi ion Ba2+ masuk ke struktur Ti(OH)4. Pada tahapan ini, NH4OH pekat dibuat berlebih. Hal ini dimaksudkan untuk menaikkan nilai pH
sampai dengan 13. Karena menurut Lee etal.
(2003), pH larutan berhubungan langsung dengan reaktivitas ion Ba2+ dan pembentukan kristal BaTiO3 hanya dapat terjadi jika pH lebih dari 13. Akan tetapi, pH larutan tidak bisa mencapai 13 hanya mencapai pH 11. Hal ini diduga karena sifat NH4OH yang merupakan basa lemah sehingga larutan TiOCl2 yang bersifat sangat asam (pH=1) ketika ditambahkan larutan NH4OH pekat
(pH=10) menghasilkan larutan dengan
keadaan yang tidak terlalu basa (mendekati
pH normal). pH yang tidak sesuai
menyebabkan reaktivitas ion Ba2+ rendah
sehingga endapan putih yang diperoleh
bukanlah BaTiO3 melainkan TiO2 (Saputra
2010).
Berdasarkan penelitian Saputra (2010), larutan KOH dapat meningkatkan pH menjadi 13. Hal ini juga dapat dilihat dari sifat KOH yang merupakan basa kuat sehingga dapat menghasilkan larutan dengan keadaan basa (menjauhi pH normal). Reaksi yang terjadi adalah:
TiCl4 + 2H2O TiO2 + HCl
[TiO2 + HCl TiOCl2]
TiOCl2+ NH4OH Ti(OH)4 + NH4Cl (eksoterm)
Ti(OH)4 + BaCl2 BaTiO3 + 2HCl + 2H2O
Berdasarkan reaksi diatas diduga proses perubahan TiCl4 menjadi Ti(OH)4 terjadi dua tahap atau tidak langsung menjadi senyawa TiOCl2, tetapi melewati proses pembentukan TiO2. Hal ini dapat dilihat pada pola difraksi dengan peningkatan pH menggunakan metode hidrotermal pada suhu 150 oC yang masih terdapat puncak-puncak yang mirip dengan TiO2. Walaupun pada tahapan ini intensitas dari TiO2 menurun 50 dari 175 menjadi 125 dan intensitas dari BaTiO3 meningkat dari 50 menjadi 70. Hal ini diduga larutan NH4OH pekat yang digunakan tidak dapat membantu proses pelarutan TiO2 menjadi Ti(OH)x4-x, sehingga ketika TiO2 bereaksi dengan BaCl2 maka tidak menghasilkan BaTiO3 yang murni.
Berbeda dengan KOH, menurut Lee et al.
(2003), KOH memiliki beberapa peranan dalam proses sintesis, yaitu dapat membantu proses pelarutan TiO2 menjadi Ti(OH)x4-x dan meningkatkan pH larutan.
Masih terdapatnya pengotor berupa TiO2 dan senyawa lain, maka dilakukan perubahan dalam proses sintesis menggunakan metode non hidrotermal pada suhu 600 oC. Dengan
merubah bahan baku Ba(OH)2 dengan BaCl2
diharapkan dapat menaikkan ion Ba2+ menjadi
lebih banyak. Hal ini dapat dilihat dari kelarutan BaCl2 yang lebih tinggi jika dibandingkan dengan Ba(OH)2. Ion-ion Ba2+, Ti4+, dan OH- akan terikat secara langsung
membentuk BaTiO3. Namun pada
kenyataannya ion Ti4+ telah berubah menjadi TiO2, sehingga ketika di reaksikan dengan ion Ba2+ dan OH- tidak akan terbentuk BaTiO3. Hal ini dapat dilihat dari pola difraksi yang seluruhnya spesifik untuk TiO2. Hal ini dapat dilihat dari puncak-puncak yang mirip dengan standar dan data JCPDS untuk TiO2. Ketika larutan dicuci menggunakan air bebas ion diduga ion Ba2+ yang terdapat pada larutan terlepas, sehingga hanya TiO2 yang tersisa di
dalam larutan. TiO2 yang terbentuk dapat
dilihat dari pola difraksi yang dihasilkan. Berdasarkan penelitian sebelumnya oleh Hadiwijaya (2010) puncak-puncak untuk TiO2 dapat diperkecil intensitasnya dengan cara
menaikkan suhu hingga mencapai 1000 oC,
namun pada penelitian tersebut menggunakan metode sol gel untuk mensintesis BaTiO3.
SIMPULAN DAN SARAN
Simpulan
Berdasarkan hasil penelitian, BaTiO3 dapat disintesis menggunakan BaCl2 dan TiCl4
dengan metode hidrotermal. Namun,
berdasarkan hasil XRD, intensitas yang dihasilkan untuk BaTiO3 tidak terlalu tinggi dan kristal yang dihasilkan tidak murni. Masih terdapat pengotor berupa TiO2 dan pengotor lain yang belum diketahui. Modifikasi sintesis dengan meningkatkan pH dapat menurunkan intensitas TiO2 dan meningkatkan intensitas dari BaTiO3.
Saran
Berdasarkan penelitian yang telah
dilakukan dapat diajukan beberapa saran, yaitu perlu dilakukan pengadukan lebih lama, peningkatan pH menggunakan basa kuat, dan waktu yang lebih lama dalam proses sintesis.
DAFTAR PUSTAKA
Boulos M, Fritsch SG, Mathieu F, Durand B, Lebey T, Bley V. 2005. Hydrothermal synthesis of nanosized BaTiO3 powders and dielectric properties of corresponding
ceramics. Solid State Ionics 176: 1301-1309.
Desphande SB, Godbole PD, Khollam YB, Potdar HS. 2005. Characterization of Barium Titanate: BaTiO3 (BT) Ceramics Prepared from Sol-Gel Derived BT Powders. Journal of Electroceramics 15: 103-108.
Girolami GS, Rauchfuss TB, Angelici RJ.
1999. Synthesis and Technique in
Inorganic Chemistry. USA.: University
Science Book.
Holleman AF, Wiberg E. 2001. Inorganic Chemistry. Acad. Press. San Diego.
Hadiwijaya H. 2010. Sintesis BaTiO3 dari Campuran Ba(OH)2 dan TiO2 dengan
Tambahan PbO [Skripsi]. Fakultas
Matematika dan Ilmu Pengetahuan Alam. Bogor: Institut Pertanian Bogor.
Hamonangan A. 2009. Kapasitor-Prinsip
Dasar dan Spesifikasi Elektriknya.
[terhubung berkala]. http://electroniclab .com. [11 Feb 2010].
Lee JH, Won CW, Kim TS. 2000.
Characteristic of BaTiO3 powders
synthesized by hidrothermal process.
Materials Science 35: 4271-4274.
Lee SK, Park TJ, Choi GJ, Koo KK, Kim SW. 2003. Effect of KOH/BaTi and Ba/Ti ratios on synthesis of BaTiO3 powder by
corecipitation/hydrothermal reaction.
Materials Chemistry and Physics 82:
742-749.
Moon SM, Cho NH. 2007. Investigation of phase distribution in nanoscale BaTiO3
powders prepared by hydrothermal
synthesis. Journal of Electroceramics
DOI 10.1007/s10832-007-9323-z.
Retnantiti MD. 2010. Sintesis Hidrotermal
dan Karakterisasi Barium Titanat
(BaTiO3) [Skripsi]. Fakultas Matematika dan Ilmu Pengetahuan Alam. Bogor: Institut Pertanian Bogor.
TiO2-Ba(OH)2-H2O system. Journal of
Materials Letters 61: 1323-1327.
Saputra A. 2010. Sintesis dan Karakterisasi
Barium Titanat dengan Modifikasi
Metode LTDS (Low Temperature Direct
Synthesis) [Tesis]. Fakultas Matematika
dan Ilmu Pengetahuan Alam. Bogor: Institut Pertanian Bogor.
Sun W, Liu W, Li J. 2006. Effects of chloride ions on hydrothermal synthesis of tetragonal BaTiO3 by microwave heating
and conventional heating. Journal of
Power Technology 166: 55-59.
Wahyudi AFN. 2007. Barium Titanat.
[terhubung berkala]. http://www.
wordpress.com [10 Feb 2011].
Lampiran 1 Diagram alir penelitian semua tahapan dan perubahan tahapan reaksi
a.
Diagram alir untuk semua tahapan
Metode Hidrotermal
120-150
oC selama 7
jam (Boulos
et al
2005)
NH
4OH
(aq)(Lee 2000)
TiCl
4(aq)(Lee 2000)
XRD
Larutan Ti(OH)
4(aq),Didekantasi dan
dioven T = 100
oC
Larutan
Larutan BaCl
2(aq),Peningkatan pH
(NH
4OH berlebih)
T= 150
oC selama 7
Metode Non hidrotermal
T= 600
oC selama 3 jam
Lanjutan Lampiran 1
b.
Diagram alir penelitian menggunakan perubahan tahapan reaksi
Metode Hidrotermal
120
oC selama7 jam (Boulos
et al
2005)
BaCl
2 (aq)(sumber Ba
2+)
TiCl
4(aq)(sumber Ti
4+)
XRD
Larutan NH
4OH
(aq)(Sumber
OH-)
Serbuk BaTiO
3Didekantasi dan
dioven T = 100
oC
Larutan BaTiO
3(aq),Lampiran 2 Contoh perhitungan pembuatan larutan Ti(OH)
4dan BaTiO
3a.
Pembuatan larutan Ti(OH)
4TiCl
4+ 4NH
4OH
Ti(OH)
4+ 4NH
4Cl
m
= 0.0182 mol 0.072 mol
-
-
r
= 0.0182 mol 0.072 mol
0.0182 mol
0.0182 mol
s
= -
-
0.0182 mol
0.0182 mol
b.
Pembuatan larutan BaTiO
3BaCl
2+ Ti(OH)
4BaTiO
3+ 2HCl + H
2O
m
= 0.0182 mol 0.0182 mol
-
-
-
r
= 0.0182 mol 0.0182 mol 0.0182 mol 0.0182 mol 0.0182 mol
s
= -
- 0.0182 mol 0.0182mol 0.0182 mol
c.
Mol TiCl
42 mL TiCl
4= mL x Mr
= 2 x 189,71
= 3.456 g
Mol TiCl
4= g/Mr
= 3.456 g/189.71
= 0.0182
d.
Mol NH
4OH
= 0.0182 mol x 4
= 0.072
e.
Rasio Ti : Ba = 1 : 1
Ti(OH)
4: BaCl
20.082 mol : 0.082 mol
g BaCl
2= mol x Mr
= 0,082 x 244.28
= 4.4459 g
Lampiran 3 Data JCPDS
a.
Barium titanat 5-626
I
d
2d
Sin
2
1.5404
100
2.838
5.676
0.2713883
15.7469
31.4938
1.5404
100
2.825
5.65
0.2726372
15.8212
31.6424
1.5404
46
2.134
4.268
0.3609185
21.1566
42.3132
1.5404
37
1.997
3.994
0.3856785
22.6859
45.3718
1.5404
35
1.634
3.268
0.4713586
28.1225
56.245
1.5404
25
3.99
7.98
0.1930326
11.1298
22.2596
1.5404
12
4.03
8.06
0.1911166
11.018
22.036
b.
Titanium dioksida 10-63
I
d
2d
Sin
2
1.5404
100
1.704
3.408
0.451994
26.8718
53.7436
1.5404
60
2.572
5.144
0.299456
17.4249
34.8498
1.5404
50
2.712
5.424
0.283997
16.4989
32.9978
c.
Titanium dioksida 16-617
I
d
2d
Sin
2
1.5404
100
3.512
7.024
0.219305
12.6682
25.3364
1.5404
90
2.9
5.8
0.265586
15.4018
30.8036
1.5404
80
3.465
6.93
0.22228
12.843
25.686
d.
Titanium dioksida 21-1272
I
d
2d
Sin
2
1.5404
100
3.52
7.07
0.218807
12.639
25.278
1.5404
35
1.892
3.784
0.407082
24.0217
48.0434
1.5404
20
2.378
4.756
0.323886
18.8981
37.7962
1.5404
20
1.6999
3.3998
0.453085
26.9418
53.8836
1.5404
20
1.6665
3.333
0.462166
27.527
55.054
e.
Titanium 21-1726
I
d
2d
Sin
2
1.5404
100
3.247
6.494
0.237204
13.7215
27.443
1.5404
60
1.6874
3.3748
0.456442
27.1578
54.3156
1.5404
50
2.487
4.974
0.30969
18.0405
36.081
Lampiran 4 Pola difraksi standar BaTiO
3dan TiO
2a.
Pola difraksi standar BaTiO
3b.
Pola difraksi standar TiO
2Lampiran 5 Pola difraksi BaTiO
3pada T=120-150
oC dengan metode hidrotermal
a.
Pola difraksi BaTiO
3hasil sintesis pada T=120
oC selama 7 jam
2-Theta
d(A)
I%
FWHM
16.278
5.441
77
0.220
17.977
4.930
77
0.177
20.066
4.422
85
0.180
24.392
3.646
54
0.150
26.244
3.396
62
0.800
26.354
3.379
69
0.100
27.906
3.195
62
0.190
30.319
2.946
62
0.700
30.772
2.903
100
0.132
35.279
2.542
69
0.150
37.342
2.406
54
0.100
b.
Pola difraksi BaTiO
3hasil sintesis pada suhu 130
oC selama 7 jam
2-Theta
d(A)
I%
FWHM
27.213
3.274
78
0.800
27.542
3.236
100
0.120
27.778
3.209
78
0.073
28.980
3.079
78
0.160
29.769
2.998
89
0.140
30.107
2.966
100
0.197
Lanjutan Lampiran 5
c.
Pola difraksi BaTiO
3hasil sintesis pada suhu 140
oC selama 7 jam
2-Theta
d(A)
I%
FWHM
29.049
3.071
86
0.571
30.275
2.949
71
0.073
31.558
2.833
100
0.068
44.066
2.053
79
0.045
46.275
1.960
86
0.050
d.
Pola difraksi BaTiO
3hasil sintesis pada suhu 150
oC selama 7 jam
2-Theta
d(A)
I%
FWHM
16.262
5.446
73
0.200
25.244
3.525
100
0.177
27.462
3.245
64
0.080
29.087
3.067
73
0.160
30.359
2.942
82
0.160
Lampiran 6 Pola difraksi BaTiO
3menggunakan perubahan tahapan reaksi
Pola difraksi BaTiO
3hasil sintesis pada T=120
oC selama 7 jam
2-Theta
d(A)
I%
FWHM
16.022
5.527
16
0.200
16.216
5.462
19
0.268
19.766
4.488
13
0.140
20.066
4.422
13
0.240
22.945
3.873
22
0.141
29.095
3.066
12
0.11
30.554
2.923
13
0.152
30.736
2.906
17
0.143
32.664
2.740
100
0.181
33.086
2.705
12
0.100
35.224
2.546
13
0.140
37.302
2.409
16
0.165
39.976
2.254
15
0.230
43.334
2.086
13
0.150
46.855
1.940
13
0.123
58.260
1.582
19
0.181
Lampiran 7 Pola difraksi BaTiO
3menggunakan metode non hidrotermal
Pola difraksi BaTiO
3hasil sintesis pada suhu 600
oC selama 3 jam
2-Theta
d(A)
I%
FWHM
25.277
3.521
100
0.644
37.882
2.373
25
0.460
47.976
1.895
28
0.660
54.044
1.695
20
0.720
55.004
1.668
18
0.660
Lampiran 8 Pola difraksi BaTiO
3menggunakan perubahan pH
g.
Pola difraksi BaTiO
3hasil sintesis pada T=150
oC selama 7 jam
2-Theta
d(A)
I%
FWHM
16.293
5.435
65
0.177
17.992
4.926
35
0.173
19.806
4.479
24
0.140
20.076
4.200
47
0.150
22.966
3.870
21
0.174
24.367
3.649
30
0.120
25.044
3.553
21
0.116
26.326
3.383
38
0.155
30.350
2.943
38
0.115
32.701
2.736
100
0.134
33.044
2.708
36
0.134
35.267
2.543
53
0.186
35.567
2.522
21
0.107
37.314
2.408
24
0.157
43.392
2.084
30
0.193