SINTESIS NANOSILIKA DARI ABU KETEL MENGGUNAKAN
METODE HIDROTERMAL DENGAN VARIASI WAKTU DAN
SUHU PROSES
AJI WIBOWO
DEPARTEMEN TEKNOLOGI INDUSTRI PERTANIAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Sintesis Nanosilika dari Abu Ketel Menggunakan Metode Hidrotermal dengan Variasi Waktu dan Suhu Proses adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, September 2015
ABSTRAK
AJI WIBOWO. Sintesis Nanosilika dari Abu Ketel Menggunakan Metode Hidrotermal dengan Variasi Waktu dan Suhu Proses. Dibimbing oleh NASTITI SISWI INDRASTI dan ANDES ISMAYANA.
Abu ketel memiliki kandungan silika yang tinggi sehingga sangat potensial menjadi bahan baku pembuatan nanosilika. Salah satu metode yang digunakan untuk mendapatkan nanosilika adalah metode hidrotermal. Tujuan dari penelitian ini yaitu sintesis nanosilika dari abu ketel menggunakan metode hidrotermal, mengetahui pengaruh perlakuan suhu dan waktu proses terhadap karakteristik nanosilika dan mengetahui aplikasi dari nanosilika yang dihasilkan sesuai karakteristiknya. Tahapan dari penelitian ini yaitu meliputi persiapan abu ketel dan pembuatan nanosilika dengan menggunakan metode hidrotermal. Waktu proses yang digunakan yaitu 2 jam, 4 jam dan 6 jam. Sedangkan suhu proses yang digunakan yaitu 120oC, 150oC dan 180oC. Abu ketel mengandung silika sebanyak 49,69% dan setelah dilakukan pengabuan dalam tanur pada suhu 700oC kadar silika menjadi 78,75%. Nanosilika yang dihasilkan memiliki derajat kristalinitas antara 18-51%, ukuran kristal 40-70 nm, ukuran partikel 329-1378 nm dan PDI 0,07-0,561. Nanosilika yang dihasilkan pada penelitian ini dapat diaplikasikan pengisi produk karet, resin komposit dan membran penyerap zat warna, serta bahan aditif produk keramik.
Kata Kunci: Abu ketel, derajat kristalinitas, hidrotermal, nanosilika ukuran partikel.
ABSTRACT
AJI WIBOWO. Synthesis of Nanosilica from Boiler Ash Using Hydrothermal Method with a Variance of Time and Temperature Process. Supervised by NASTITI SISWI INDRASTI and ANDES ISMAYANA.
Boiler ash contains high silica so it is potential to become raw material in making nanosilica. One of the methods to obtain nanosilica is hydrothermal method. This research aimed to synthesize nanosilica from boiler ash by using hydrothermal method, determine the influence of temperature treatment and processing time on the characteristics of nanosilica and determine the application of generated nanosilica correspond to its characteristics. Stages of this research were the preparation of boiler ash and the making of nanosilica by using hydrothermal method. The processing time on the research were 2 hours, 4 hours, and 6 hours, while the temperature of the process were 120oC, 150oC, and 180oC. Silica content on boiler ash was 49.69% and the percentage was increasing to be 78.75% after it was burned in a furnace at a temperature of 700°C. Nanosilica produced has a degree of crystallinity between 18-51%, the crystal size of 40-70 nm, 329-1378 nm particle size and PDI 0.07 to 0.561. Nanosilica synthesized in this study can be applied as a filler rubber products, composite resins and dye absorber membrane products, and additives ceramic products.
AJI WIBOWO
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Teknologi Pertanian
pada
Departemen Teknologi Industri Pertanian
DEPARTEMEN TEKNOLOGI INDUSTRI PERTANIAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
2015
SINTESIS NANOSILIKA DARI ABU KETEL MENGGUNAKAN
METODE HIDROTERMAL DENGAN VARIASI WAKTU DAN
PRAKATA
Puji dan syukur penulis panjatkan ke hadirat Allah SWT atas segala berkat rahmat dan hidayah-Nya sehingga penulis dapat menyelesaikan skripsi yang berjudul Sintesis Nanosilika dari Abu Ketel Menggunakan Metode Hidrotermal dengan Variasi Waktu dan Suhu Proses dengan baik. Penelitian mengenai tema ini dilaksanakan pada bulan Februari hingga bulan Juni 2015 di Laboratorium Departemen Teknologi Industri Pertanian.
Penulis mengucapkan terima kasih kepada Prof Dr Ir Nastiti Siswi Indrasti dan Dr Ir Andes Ismayana MT selaku pembimbing, serta Wahyu Kamal Setiawan STP M Si yang telah banyak memberi saran, ide dan arahan. Terima kasih juga penulis sampaikan kepada keluarga, staf Laboratorium Departemen Teknologi Industri Pertanian, Laboratorium Biomaterial Membran Departemen Fisika, rekan satu bimbingan serta teman-teman TIN 48 dan Kopadjo atas doa, semangat dan bantuan yang diberikan kepada penulis.
Semoga skripsi ini bermanfaat bagi banyak pihak.
Bogor, September 2015
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Ruang Lingkup Penelitian 3
Manfaat Penelitian 3
2 METODOLOGI PENELITIAN 3
Waktu dan Tempat 3
Alat 3
Bahan 3
Tahapan Penelitian 4
3 HASIL DAN PEMBAHASAN 6
Preparasi Abu Ketel 6
Sintesis Nanosilika 8
Pola Difraksi dan Fase Kristal 8
Derajat Kristalinitas 11
Ukuran Kristal 14
Ukuran Partikel dan Distribusi Ukuran Partikel 15
Morfologi Partikel 19
Potensi Aplikasi 20
4 SIMPULAN DAN SARAN 24
Simpulan 24
Saran 24
DAFTAR TABEL
1 Kandungan senyawa pada abu ketel sebelum dan setelah pembakaran 7
2 Rata-rata dan range ukuran kristal nanosilika 14
3 Potensi aplikasi nanosilika berdasarkan karakteristiknya 20
DAFTAR GAMBAR
1 Diagram alir preparasi abu ketel 4
2 Diagram alir pembuatan nanosilika dengan metode hidrotermal 5
3 Difraktogram nanosilika yang disintesis pada suhu 120oC 8
4 Difraktogram nanosilika yang disintesis pada suhu 150oC 9
5 Difraktogram nanosilika yang disintesis pada suhu 180oC 10
6 Derajat kristalinitas nanosilika 12
7 Grafik ukuran partikel nanosilika 16
8 Grafik PDI nanosilika pada suhu 120oC 17
9 Grafik PDI nanosilika pada suhu 150oC 17
10Grafik PDI nanosilika pada suhu 180oC 18
11Morfologi partikel nanosilika perbesaran (a) 100x, (b) 500x, (c) 1000x, (d)
PENDAHULUAN
Latar Belakang
Silika (SiO2) merupakan salah satu bahan yang termasuk ke dalam golongan oksida yang memiliki potensi pemanfaatan pada berbagai aplikasi. Selain dapat digunakan sebagai bahan baku industri gelas dan kaca, silika juga dapat digunakan sebagai bahan baku pembuatan sel surya (Munasir et al 2013). Silika juga banyak dimanfaatkan pada industri lainnya, seperti industri pasta gigi, perawatan kulit, pemrosesan bir, pelapis kertas (paper coating), desikan, pendukung katalis hingga pada bidang farmasi (Imanuel dan Yohan 2011).
Sumber silika di alam cukup banyak, mulai dari pasir, tanah liat, kuarsa, batuan (Renjanadevi 2008) hingga pada beberapa jenis biomassa. Biomassa yang biasa digunakan sebagai sumber silika yaitu abu sekam padi (Thuadaij dan Nuntiya 2008; Le, Chi dan Huy 2013) dan abu tongkol jagung (Mohanraj et al 2012). Jenis biomassa lain yang dapat digunakan sebagai sumber silika adalah abu ketel dari industri gula. Pada industri gula, abu boiler atau abu ketel merupakan limbah yang dihasilkan dari pembakaran bagase dan jumlahnya sebanyak 1,5-2% (Ismayana 2014). Abu ketel industri gula kaya akan silika yang membuatnya menjadi bahan baku yang murah untuk menghasilkan silika gel ataupun silika dalam bentuk serbuk. Kandungan silika dalam abu ketel sebanyak 50,36% dan sisanya merupakan mineral lainnya seperti Al2O3, Fe2O3, CaO, Na2O, K2O, MnO, TiO2, MgO, BaO dan P2O5 (Affandi et al 2009).
Berkembangnya teknologi saat ini, membuat aplikasi silika di industri semakin meningkat terutama silika yang memiliki ukuran mikron hingga nanometer (Jayanti 2014). Partikel berukuran nanometer memang sedang menjadi fokus perhatian saat ini, karena partikel berukuran nano memiliki karateristik fisika dan kimia yang berbeda jika dibandingkan dengan partikel serupa dengan ukuran yang lebih besar (Nejad dan Aboali 2011). Menurut Munasir et al (2013), ukuran partikel yang diperkecil membuat produk memiliki sifat yang berbeda sehingga dapat meningkatkan kualitas material. Shahmiri et al (2013) menambahkan bahwa salah satu karakteristik menarik dari partikel berukuran nano yaitu perbandingan luas area dengan volum yang besar.
yaitu dapat menghasilkan material dengan derajat kristalinitas tinggi pada suhu rendah.
Proses hidrotermal menghendaki perumbuhan kristal yang pada awalnya memiliki kelarutan yang rendah pada kondisi normal menjadi memiliki kelarutan yang tinggi pada kondisi hidrotermal dan dengan bantuan air atau mineralizer. Parameter-parameter seperti suhu, tekanan, mol dan komposisi sampel harus diatur dan dijaga. Pada awal proses, energi yang berada dalam reaktor digunakan untuk melarutkan campuran yang heterogen. Setelah kondisi jenuh tercapai, proses rekristalisasi dan pertumbuhan produk terjadi (Byrappa dan Masahiro 2001).
Parameter seperti suhu dan waktu reaksi merupakan parameter yang memiliki peranan penting dalam proses hidrotermal ini (Nejad dan Aboali 2011). Pada penelitian yang dilakukan oleh Nejati dan Zabihi (2012), suhu terbaik untuk melakukan sintesis kristal nikel ferit adalah 150oC. Pada saat suhu sintesis dibawah 150oC, yang terbentuk adalah nikel ferit fase amorf. Sama halnya dengan penelitian yang dilakukan oleh Deepesh et al (2013) yang melakukan sintesis zeolit dengan berbagai suhu proses pada waktu 72 jam. Pada saat menggunakan suhu 75oC, 100oC dan 125oC zeolit yang dihasilkan bertipe amorf. Namun saat suhu ditingkatkan menjadi 150oC, zeolit yang terbentuk memiliki sifat kristal yang baik. Sementara itu, Kristiyanti (2011) melakukan sintesis TiO2 dengan menggunakan waktu proses 4 jam. Menurut Karakas et al (2012), parameter suhu dan waktu proses yang digunakan dapat diatur untuk memelihara laju nukleasi yang tinggi dan untuk mengontrol pertumbuhan partikel. Oleh karena itu dalam penelitian ini akan melihat pengaruh variasi suhu dan waktu reaksi hidrotermal terhadap sifat dan karakteristik nanosilika yang dihasilkan serta mengetahui potensi nanosilika yang dihasilkan pada berbagai aplikasi.
Perumusan Masalah
Suhu dan waktu reaksi merupakan parameter yang berpengaruh dalam reaksi hidrotermal. Suhu dan waktu reaksi yang digunakan akan mengontrol proses nukleasi dan pertumbuhan partikel sehingga akan menentukan sifat dan karakterisitk nanosilika yang dihasilkan seperti ukuran kristal, derajat kristalinitas, pola difraksi, fase kristal, ukuran partikel dan distribusi ukuran partikel (Karakas et al 2012). Penelitian ini terfokus pada pengaruh variasi suhu dan waktu reaksi yang digunakan terhadap sifat dan karakteristik nanosilika yang dihasilkan. Penggunaan suhu dan waktu reaksi tertentu akan menghasilkan nanosilika dengan sifat dan karakterisik yang berbeda-beda. Sifat dan karakteristik yang khas dari nanosilika ini akan menentukan aplikasinya pada berbagai bidang.
Tujuan Penelitian
Ruang Lingkup Penelitian
Ruang lingkup penelitian ini meliputi sintesis nanosilika dari abu ketel industri gula dengan metode hidrotermal yang menggunakan berbagai perlakuan suhu dan waktu proses. Karakterisasi nanosilika yang dianalisis meliputi distribusi ukuran partikel, pola difraksi, kristalinitas, ukuran kristal dan morfologi. Serta menyesuaikan aplikasi dari nanosilika berdasarkan sifat dan karakteristiknya.
Manfaat Penelitian
Manfaat penelitian ini yaitu memberikan informasi mengenai proses sintesis nanosilika dengan menggunakan metode hidrotermal. Selain itu, penelitian ini juga memberi informasi berupa karakteristik nanosilika yang dihasilkan melalui metode hidrotermal pada variasi suhu dan waktu reaksi serta potensi pengaplikasiannya berdasarkan sifat dan karakteristiknya.
METODOLOGI PENELITIAN
Waktu dan Tempat
Penelitian ini dilakukan di Laboratorium Teknik dan Manajemen Lingkungan, Laboratorium Dasar Ilmu Terapan, Laboratorium Pengawasan Mutu, Laboratorium Teknik Kimia Departemen Teknologi Industri Pertanian Fateta IPB dan Laboratorium Biofisika Membran Departemen Fisika FMIPA IPB. Beberapa analisis dan karakterisasi dilakukan di Laboratorium Analisis Bahan Departemen Fisika FMIPA IPB, Laboratorium Nanotech Herbal Indonesia, dan Laboratorium Terpadu Balitbang Kehutanan Gunung Batu Bogor. Penelitian dilakukan dari bulan Februari hingga Juni 2015
Alat
Alat yang digunakan dalam penelitian ini adalah tanur, peralatan refluks, magnetic stirrer, pH meter dan seperangkat reaktor hidrotermal. Peralatan analisis meliputi PSA (Particle Size Anayzer) Vasco, XRF (X-Ray Fliorescence) ARL OPTX-2050, XRD (X-Ray Diffractometer) GBC Emma, dan SEM (Scanning Electron Microscope) Zeiss EVO MA 10.
Bahan
Tahapan Penelitian
Tahapan penelitian dibagi menjadi dua bagian, yaitu persiapan abu ketel dan pembuatan nanosilika dengan metode hidrotermal.
Preparasi Abu Ketel
Tahap pertama diawali dengan pencucian abu ketel dari hasil samping industri gula menggunakan akuades. Selanjutnya, abu ketel dikeringkan dalam oven 105oC selama 5 jam. Setelah kering, abu ketel disaring menggunakan saringan kasar dan diabukan pada suhu 700oC selama 6 jam menggunakan tanur (Thuadaij dan Nuntiya 2008). Diagram alir preparasi abu ketel ditampilkan pada Gambar 1.
Gambar 1 Diagram Alir Preparasi Abu Ketel
Pembuatan Nanosilika
dilakukan pembilasan sebanyak 6-8 kali dengan menggunakan akuades hangat untuk menghilangkan zat pengotor yang ada di dalam produk. Produk yang telah bebas dari pengotor selanjutnya di-aging selama 3 jam dengan suhu 60 oC kemudian dikeringkan dalam oven dengan suhu 105 oC selama 24 jam. Produk hasil pengeringan kemudian dimortar untuk mendapatkan nanosilika dengan bentuk serbuk halus (Nejati dan Zabihi 2012; Deepesh et al 2013; Jayadevan dan Tseng 2004; Kristiyanti 2011). Diagram alir pembuatan nanosilika dengan metode hidrotermal ditampilkan pada Gambar 2.
Karakterisasi Abu Ketel dan Abu Furnace
Kandungan senyawa dan elemen dari abu ketel dan abu furnace dianalisis menggunakan XRF (X-Ray Fliorescence) ARL OPTX-2050 yang dioperasikan dengan arus 10 mA tegangan 50 kV. Sebanyak 5 gram sampel dipindai dan dikalibrasikan sesuai energi dan intensitasnya. Analisis unsur dari Na hingga U dengan detektor Si (Li) (Sintilation).
Karakterisasi Nanosilika
Ukuran partikel dan distribusi ukuran partikel diamati dengan PSA (Particle Size Analyzer) Vasco. Sebanyak 0.002 gram nanosilika didispersikan dalam 100 ml aquades. Selanjutnya diputar menggunakan magnetic stirrer selama 15-20 menit. Pemindaian partikel nanosilika dilakukan dengan PSA selama 2-5 menit.
Ukuran kristal, derajat kristalinitas, dan fase kristal diamati dengan XRD ( X-Ray Diffraction) GBC Emma yang dioperasikan pada 35 kV dan 25 mA. XRD GBC Emma menggunakan radiasi Cu-Kα dengan panjang gelombang (λ) 1.54056 Å.
Difraktogram dipindai mulai 10˚ sampai 80˚ (2θ) dengan laju pemindaian 3˚ per
menit. Perhitungan derajat kristalinitas menggunakan software PowderX dan ukuran kristal menggunakan persamaan Scherrer.
� = � ������
Konstanta Scherrer disimbolkan dengan k dengan nilai 0.9, λ adalah panjang
gelombang Cu-Kα (0.154056 nm), β merupakan Full Width at Half Maximum
(FWHM) dan θ adalah sudut difraksi. Pola difraksi dan fase kristal akan
diidentifikasi dan dihitung kemurniannya melalui pencocokkan dengan kartu PDF (Powder Diffraction File) menggunakan software Match! 2. PDF [96-900-0076] merupakan kartu PDF dari fase quartz. PDF [96-900-0521] merupakan kartu PDF dari fase tridimit dan PDF [96-900-1579] merupakan kartu PDF dari fase kristobalit.
SEM Zeiss EVO MA 10 digunakan untuk karakterisasi morfologi nanosilika. Sedikit sampel diambil dan diletakkan pada plat logam yang telah diberi doubletape agar sampel menempel dengan sempurna. Lalu, dilakukan proses pemompaan untuk menyedot sampel yang tidak menempel secara sempurna agar tidak merusak pompa vakum pada alat SEM. Sampel tersebut kemudian dilapisi dengan emas, untuk selanjutnya dipindai dengan perbesaran mulai 100 kali hingga 10 000 kali. Perbesaran rendah digunakan untuk mengamati keseragaman ukuran agregasi partikel sedangkan perbesaran tinggi digunakan untuk mengamati bentuk partikel.
HASIL DAN PEMBAHASAN
Preparasi Abu Ketel
menjadi gas CO2 dan H2O dengan menyisakan abu yang merupakan komponen anorganik (Hanafi dan Nandang 2010). Komponen-komponen anorganik dalam abu ketel diantaranya adalah mineral Si, K, Ca, Ti, V, Mn, Fe, Cu, Zn dan P. Diantara mineral-mineral pada abu ketel tersebut, Si merupakan mineral dengan kandungan paling besar yaitu sebesar 50,36% (Affandi et al 2009). Hasil karakterisasi abu ketel dari pabrik gula GMP menggunakan XRF (X-Ray Flourescence) disajikan pada Tabel 1.
Tabel 1.Kandungan senyawa pada abu ketel sebelum dan setelah pembakaran
No Senyawa Sebelum pembakaran (%) Setelah pembakaran (%)
1 SiO2 49,69 78,75
Karakteristik dari abu ketel ini yaitu berwarna hitam dan memiliki tekstur yang kasar. Berdasarkan hasil XRF terhadap abu ketel, dapat diketahui bahwa kandungan silika (SiO2) sebesar 49,69%. Selain silika, masih terdapat kandungan mineral lain yang jumlahnya cukup banyak. Hal ini menyebabkan tingkat kemurniannya menjadi rendah. Untuk meningkatkan kemurnian, abu ketel ini dibakar dengan menggunakan tanur pada suhu +700oC selama 6 jam untuk menghilangkan senyawa organik dan pengotor lain. Abu ketel yang telah dibakar dalam tanur memiliki karakteristik fisik yang berbeda dengan abu ketel sebelum pembakaran. Warna abu ketel yang pada awalnya hitam, setelah pembakaran berubah menjadi warna coklat kemerah-merahan hingga abu-abu. Hal ini disebabkan karena menurun/hilangnya kandungan senyawa karbon dalam abu (Setiawan 2015). Rompas et al (2013) mengatakan bahwa abu ampas tebu yang dihasilkan harus dibakar kembali dengan suhu pembakaran lebih dari 600oC sehingga abu ketel mengalami perubahan warna dari yang semula berwarna hitam karena masih mengandung karbon berubah warna menjadi coklat agak kemerahan dimana dalam keadaan ini abu ketel memiliki kandungan silikat yang tinggi. Selain perubahan pada karakteristik fisik, kandungan dari abu ketel pun berubah.
Sintesis Nanosilika
Pola Difraksi dan Fase Kristal
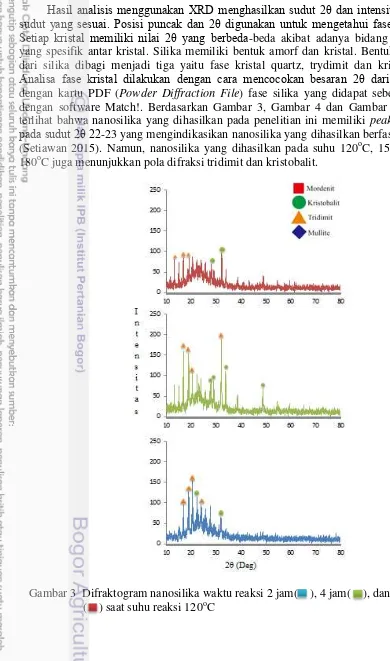
Hasil analisis menggunakan XRD menghasilkan sudut 2θ dan intensitas pada sudut yang sesuai. Posisi puncak dan 2θ digunakan untuk mengetahui fase kristal. Setiap kristal memiliki nilai 2θ yang berbeda-beda akibat adanya bidang difraksi yang spesifik antar kristal. Silika memiliki bentuk amorf dan kristal. Bentuk kristal dari silika dibagi menjadi tiga yaitu fase kristal quartz, trydimit dan kristobalit.
Analisa fase kristal dilakukan dengan cara mencocokan besaran 2θ dari sampel dengan kartu PDF (Powder Diffraction File) fase silika yang didapat sebelumnya dengan software Match!. Berdasarkan Gambar 3, Gambar 4 dan Gambar 5 dapat terlihat bahwa nanosilika yang dihasilkan pada penelitian ini memiliki peak terkuat
pada sudut 2θ 22-23 yang mengindikasikan nanosilika yang dihasilkan berfase amorf (Setiawan 2015). Namun, nanosilika yang dihasilkan pada suhu 120oC, 150oC dan 180oC juga menunjukkan pola difraksi tridimit dan kristobalit.
Pada Gambar 3 terlihat bahwa terjadi perubahan fase kristal serta intensitas dan letak puncak seiring berjalannya waktu reaksi. Pada sampel yang disintesis dengan
waktu 2 jam, intensitas tertinggi terletak pada 2θ 20,54o yang mengindikasikan fase tridimit. Sampel yang disintesis dengan waktu 4 jam, intensitas tertinggi terletak
pada 2θ 32,181o yang mengindikasikan fase tridimit. Saat reaksi berlanjut menjadi 6 jam, terjadi kehilangan beberapa fase dan puncak, sehingga merubah intensitas
tertinggi menjadi kristobalit yang terletak pada 2θ 32,332o.
Gambar 4 Difraktogram nanosilika waktu reaksi 2 jam( ), 4 jam( ), dan 6 jam ( ) saat suhu reaksi 150oC
Pada Gambar 4 terlihat bahwa terjadi perubahan fase kristal pada suhu 150oC serta intensitas dan letak puncak seiring berjalannya waktu reaksi. Pada sampel yang
tertinggi terletak pada 2θ 32,215o yang mengindikasikan fase kristobalit. Saat reaksi berlanjut menjadi 6 jam, terjadi kehilangan beberapa fase dan puncak, sehingga
merubah intensitas tertinggi menjadi tridimit yang terletak pada 2θ 19,094o.
Gambar 5 Difraktogram nanosilika waktu reaksi 2 jam( ), 4 jam( ), dan 6 jam ( ) saat suhu reaksi 180oC
Pada Gambar 5 terlihat bahwa terjadi perubahan fase kristal pada suhu 180oC serta intensitas dan letak puncak seiring berjalannya waktu reaksi. Pada sampel yang
disintesis dengan waktu 2 jam, intensitas tertinggi terletak pada 2θ 32,186o yang mengindikasikan fase kristobalit. Sampel yang disintesis dengan waktu 4 jam,
intensitas tertinggi terletak pada 2θ 19,079o yang mengindikasikan fase tridimit. Namun saat reaksi berlanjut menjadi 6 jam, terjadi kehilangan beberapa fase dan puncak, sehingga merubah intensitas tertinggi kembali menjadi kristobalit yang
Berdasarkan analisis pola difraksi, peningkatan suhu reaksi dari 120oC menjadi 150oC memberikan peningkatan jumlah puncak, intensitas puncak difraksi dan memunculkan beberapa fase baru. Hal ini disebabkan karena peningkatan suhu akan menyediakan energi bagi terbentuknya inti kristal (nukleasi) dan memunculkan kristal baru serta meningkatkan jumlah puncak (Byrappa dan Masahiro 2001). Namun saat suhu proses ditingkatkan menjadi 180oC terjadi kehilangan beberapa puncak serta fase kristal. Hal ini dipengaruhi oleh suhu dan tekanan yang digunakan. Suhu dan tekanan merupakan faktor penting dalam sintesis kristal. Peningkatan suhu tanpa diiringi peningkatan tekanan akan menyebabkan sampel tidak stabil dan kehilangan beberapa puncak dan fase kristal serta menurunkan intensitasnya (Cao et al 2013).
Peningkatan waktu reaksi akan merubah pola difraksi dari nanosilika. Saat waktu reaksi ditambah dari 2 menjadi 4 jam, akan menyebabkan munculnya beberapa puncak dan fase kristal baru pada difraktogram yang dihasilkan. Namun, saat waktu reaksi ditambah dari 4 jam menjadi 6 jam, terjadi hilangnya beberapa puncak dan fase kristal. Selain itu, bila membandingkan pola difraksi pada waktu yang sama dengan suhu reaksi yang berbeda, maka terlihat terjadinya kenaikan intensitas pada beberapa puncak diiringi dengan munculnya beberapa puncak baru, kemudian menurun saat waktu reaksi bertambah.
Pada awal reaksi, terjadi proses nukleasi untuk menghasilkan kristal-kristal yang baru. Cao et al (2013) mengatakan bahwa terjadi pembentukan kristal pada kondisi yang jenuh. Seiring meningkatnya waktu reaksi, terjadi pembentukan partikel primer akibat adanya reaksi kondensasi, sehingga terbentuk partikel baru akibat adanya reaksi kondensasi antar kristal. Hal inilah yang menyebabkan munculnya puncak dan fase kristal baru. Namun, saat waktu reaksi berlanjut menjadi 6 jam, terjadi penurunan beberapa puncak dan hilangnya beberapa fase kristal. Hal ini disebabkan karena adanya pelarutan kristal kembali dan reaksi berjalan negatif, sehingga cenderung akan menurunkan intensitas dan menyebabkan hilangnya beberapa puncak serta fase kristal yang telah terbentuk (Cao et al 2013).
Dari hasil analisis fase kristal, terjadi perubahan fase dominan seiring dengan perubahan kondisi proses. Hal ini disebabkan karena pada metode hidrotermal ini terjadi proses pelarutan kristal untuk membentuk kristal yang baru. Hal ini akan menyebabkan perubahan pada pola difraksi dan fase kristal dominan. Byrappa dan Masahiro (2001) mengatakan bahwa quartz memiliki persen kelarutan kembali yang rendah sedangkan kristobalit memiliki persen kelarutan yang lebih tinggi pada kondisi basa. Hal ini juga menjadi penyebab terjadinya perubahan pola difraksi dan fase dominan, karena nanosilika yang dihasilkan tidak memiliki fase quartz dan cenderung mengandung banyak fase kristobalit sehingga memiliki persen kelarutan kembali yang tinggi. Namun, secara keseluruhan dapat disimpulkan bahwa nanosilika yang dihasilkan pada penelitian ini bersifat multifase, ditandai dengan keberadaan fase tridimit dan kristobalit pada setiap sampel. Keberadaan puncak kristal dan intensitas kristal akan berpengaruh terhadap derajat kristalinitas.
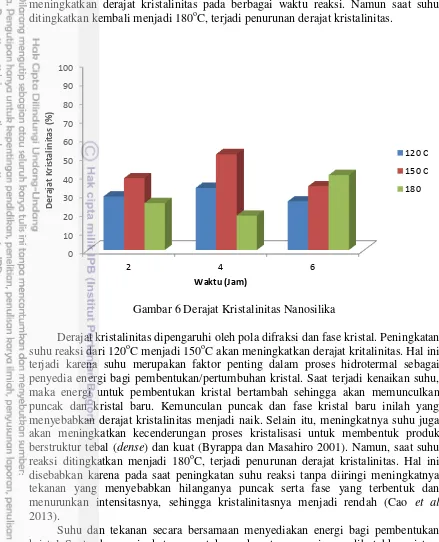
Derajat Kristalinitas
meningkatkan derajat kristalinitas pada berbagai waktu reaksi. Namun saat suhu ditingkatkan kembali menjadi 180oC, terjadi penurunan derajat kristalinitas.
Gambar 6 Derajat Kristalinitas Nanosilika
Derajat kristalinitas dipengaruhi oleh pola difraksi dan fase kristal. Peningkatan suhu reaksi dari 120oC menjadi 150oC akan meningkatkan derajat kritalinitas. Hal ini terjadi karena suhu merupakan faktor penting dalam proses hidrotermal sebagai penyedia energi bagi pembentukan/pertumbuhan kristal. Saat terjadi kenaikan suhu, maka energi untuk pembentukan kristal bertambah sehingga akan memunculkan puncak dan kristal baru. Kemunculan puncak dan fase kristal baru inilah yang menyebabkan derajat kristalinitas menjadi naik. Selain itu, meningkatnya suhu juga akan meningkatkan kecenderungan proses kristalisasi untuk membentuk produk berstruktur tebal (dense) dan kuat (Byrappa dan Masahiro 2001). Namun, saat suhu reaksi ditingkatkan menjadi 180oC, terjadi penurunan derajat kristalinitas. Hal ini disebabkan karena pada saat peningkatan suhu reaksi tanpa diiringi meningkatnya tekanan yang menyebabkan hilanganya puncak serta fase yang terbentuk dan menurunkan intensitasnya, sehingga kristalinitasnya menjadi rendah (Cao et al 2013).
Suhu dan tekanan secara bersamaan menyediakan energi bagi pembentukan kristal. Saat suhu meningkat namun tekanan konstan, energi yang dibutuhkan sistem untuk pembentukan kristal menjadi berkurang dan reaksi berjalan negatif sehingga cenderung menyebabkan hilangnya puncak dan fase kristal. Suhu lebih tinggi juga akan menyebabkan kapasitas dari larutan menjadi rendah sebagai akibat dari menurunnya densitas air, sehingga akan menurunkan jumlah total alkali (Byrappa dan Masahiro 2001). Hal ini akan menyebabkan jumlah fase kristal yang terbentuk pun rendah. Sedangkan derajat kristalinitas pada sampel dengan suhu 180oC dan waktu reaksi 6 jam tetap mengalami peningkatan meskipun suhu reaksi meningkat. Hal ini dapat terjadi karena terdapat beberapa senyawa lain pada sistem yang berasal
dari bahan baku. Senyawa jenis tertentu memiliki sifat reaktif pada suhu dan waktu tertentu, sehingga akan dihitung sebagai total komponen. Hal ini tentunya akan meningkatkan nilai mol. Selain suhu dan tekanan, mol juga merupakan faktor penting dalam menyediakan energi bagi sistem. Keberadaan senyawa dengan karakter spesifik pada suhu dan waktu tertentu juga akan menyebabkan terjadinya defect/deformasi kimia yang akan merubah sifat sampel dengan cara memunculkan fase atau senyawa baru.
Senyawa lain yang berada pada sistem berasal dari bahan baku yang berupa natrium silika. Di dalam natrium silika, terdapat beberapa jenis senyawa selain SiO2 dan salah satunya adalah Al2O3. Amalia et al (2013) mengatakan bahwa saat proses ekstraksi dengan menggunakan NaOH, terdapat beberapa senyawa yang terbawa seperti SiO2, Al2O3, Fe2O3 dan TiO2. Jadi, hasil ekstraksi dari abu tanur tidak hanya natrium silika (Na2SiO3), namun juga natrium alumina (NaAl(OH)4). Jika kedua senyawa tersebut bereaksi, akan dihasilkan natrium alumina silika atau zeolit (Balandis dan Tradaraite 2007). Berdasarkan penelitian yang dilakukan Fansuri et al (2009), zeolit dapat disintesis pada berbagai suhu reaksi mulai dari 100oC hingga kristalisasi yang sempurna dan memiliki derajat kristalinitas tinggi. Penelitian yang dilakukan Insuwan dan Rangsriwatananon (2012) melakukan sintesis zeolit pada suhu 180oC yang memiliki derajat kristalinitas tinggi. Dengan terbentuknya zeolit pada suhu 180oC dan waktu 6 jam yang memiliki intensitas dan proses kristalisasi baik, maka akan menyebabkan derajat kristalinitas meningkat.
Waktu reaksi akan berpengaruh terhadap adanya reaksi kondensasi antar kristal. Pada saat waktu reaksi ditambah dari 2 jam menjadi 4 jam, terjadi kenaikan derajat kristalinitas. Semakin lama waktu reaksi semakin banyak pula partikel primer yang terbentuk akibat reaksi kondensasi. Mizutani et al (2008) mengatakan bahwa semakin lama waktu reaksi, semakin banyak kristal yang bergabung membentuk partikel, sehingga akan meningkatkan kristalinitas. Pada saat waktu reaksi ditambah menjadi 6 jam, terjadi penurunan derajat kristalinitas. Hal ini terkait dengan menurunnya reaktivitas permukaan partikel sehingga terjadi pemisahan antar kristal penyusun partikel dan semakin lama reaksi berjalan negatif yang menyebabkan derajat kristalinitas menurun (Cao et al 2013). Pada sampel dengan suhu reaksi 180oC, peningkatan waktu reaksi dari 2 jam menjadi 4 jam menyebabkan penurunan derajat kristalinitas. Hal ini terjadi karena tekanan konstan akan menyebabkan kristal tidak stabil dan kehilangan energi sehingga cenderung terjadi kehilangan puncak dan kristal (Cao et al 2013). Namun saat waktu reaksi ditingkatkan menjadi 6 jam terjadi kenaikan derajat kristalinitas kembali yang disebabkan karena keberadaan senyawa lain yang berasal dari bahan baku sehingga akan memunculkan puncak, fase dan senyawa baru (Byrappa dan Masahiro 2001).
meningkatnya intensitas puncak. Kemunculan puncak baru dan meningkatnya intensitas puncak menyebabkan meningkatnya derajat kristalinitas. Sedangkan derajat kristalinitas terendah didapat pada kondisi suhu 180oC dan waktu reaksi 4 jam yaitu sebesar 18,47%. Hal ini membuktikan bahwa pada kondisi seperti itu akan menghasilkan partikel yang tidak stabil dan cenderung menghilangkan puncak dan fase kristal, sehingga akan menurunkan derajat kristalinitas.
Ukuran Kristal
Ukuran kristal dihitung menggunakan persamaan Scherrer dan software PowderX. Tabel 2 memperlihatkan pengaruh suhu dan waktu reaksi terhadap ukuran kristal nanosilika. Dari tabel tersebut terlihat bahwa pada saat peningkatan suhu pada berbagai waktu reaksi terjadi penurunan ukuran kristal secara keseluruhan. Hal ini disebabkan karena pada suhu yang lebih tinggi terjadi proses pembentukan sejumlah kristal dengan ukuran yang kecil secara cepat akibat mobilitas ionik yang lebih tinggi pada kelarutan yang tinggi yang berkompetisi untuk nutrisi kimia yang tersedia yang tidak terjadi pada suhu yeng lebih rendah pada saat proses nukleasi terjadi. Hal inilah yang menyebabkan ukuran kristal yang dihasilkan pada suhu 150oC pada berbagai waktu proses lebih kecil dibanding ukuran kristal yang dihasilkan pada suhu 120oC. Namun seiring bertambahnya suhu reaksi dari 150o menjadi 180oC, terjadi kenaikan ukuran kristal kembali. Hal ini dapat terjadi karena kenaikan suhu akan mengakselerasi pertumbuhan kristal yang melibatkan proses kondensasi. Selain itu, menurunnya kelarutan pun dapat mempengaruhi. Pada kelarutan yang lebih rendah, mobilitas ionik menjadi rendah dan cenderung menyebabkan ukuran kristal menjadi lebih besar karena adanya proses penggabungan kristal. (Byrappa dan Masahiro 2001). Proses kondensasi atau penggabungan antar kristal dapat menghasilkan kristal dengan ukuran yang lebih besar. Liang et al (2012) pun menambahkan bahwa kenaikan suhu akan menyebabkan meningkatnya reaktivitas permukaan, sehingga kecendrungan kristal satu dengan yang lain untuk berikatan semakin tinggi.
Tabel 2 Rata-rata dan range ukuran kristal nanosilika
Suhu (C)
nukleasi terjadi proses agregasi pada prekursor menghasilkan benih inti kristal yang tidak stabil. Beberapa inti kristal tumbuh menjadi besar dan stabil dan secara spontan bergabung dengan inti lainnya menghasilkan kristal yang lebih besar (Byrapaa dan Masahiro 2001). Liang et al (2012) menambahkan bahwa semakin lama waktu reaksi akan menyebabkan terjadinya evaporasi pada pelarut sehingga kondisi super jenuh dapat terjaga. Hal tersebut menyebabkan terjadinya pertumbuhan kristal. Namun, saat reaksi dilanjutkan selama 6 jam terjadi penurunan ukuran kristal. Hal ini terjadi karena pada saat terjadi penambahan waktu reaksi, dapat terjadi pelarutan kembali kristal dengan ukuran yang besar dan menyebabkan reaksi berjalan negatif sehingga cenderung menyebabkan penurunan ukuran kristal (Cao et al 2013).
Berdasarkan hasil tersebut dapat terlihat bahwa kristal dengan ukuran terbesar dihasilkan pada suhu 120oC dan waktu 4 jam. Hal ini mengindikasikan bahwa pada suhu 120oC proses nukleasi dan pembentukan kristal berjalan lambat sehingga menghasilkan kristal dengan ukuran yang besar. Selain itu, kecenderungan reaksi kondensasi yang tinggi juga menyebabkan semakin besarnya ukuran kristal. Sedangkan ukuran kristal terkecil dihasilkan pada suhu 150oC dan waktu 6 jam. Hal ini mengindikasikan bahwa pada suhu 150oC proses nukleasi dan pembentukan tersebut kristal cenderung berjalan cepat serta kecenderungan terjadinya penggabungan antar kristal yang rendah sehingga ukuran kristal cenderung kecil. Selain itu, adanya proses pelarutan kristal kembali juga akan menyebabkan semakin menurunnya ukuran kristal.
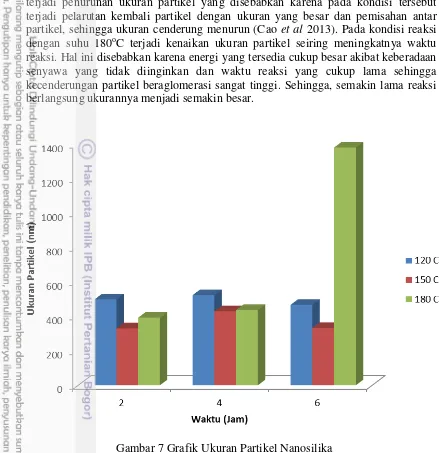
Ukuran Partikel dan Distribusi Ukuran Partikel
Ukuran partikel merupakan hasil proses aglomerasi dari partikel primer (kristal) sehingga dalam satu partikel terdiri dari lebih satu kristal. Hasil pengukuran ukuran partikel dapat dilihat pada Gambar 7. Dari hasil tersebut terlihat bahwa bertambahnya suhu reaksi dari 120oC menjadi 150oC menyebabkan ukuran partikel cenderung menurun. Namun, saat suhu reaksi ditingkatkan menjadi 180oC, terjadi kenaikan ukuran partikel. Hal ini dapat terjadi karena silika memiliki kecenderungan kelarutan yang bersifat positif dan negatif. Artinya, saat suhu meningkat, kelarutan akan meningkat. Namun saat suhu ditingkatkan lagi, kelarutan cenderung menurun. Pada kondisi kelarutan yang tinggi akan menghasilkan mobilitas ionik yang tinggi, viskositas yang rendah dan konsentrasi ion yang lebih banyak yang akan mengakibatkan terpisahnya aglomerat sehingga akan menghasilkan ukuran partikel lebih kecil (Byrappa dan Masahiro 2001). Mohammadikish et al (2013) menambahkan bahwa suatu aglomerat partikel dapat berpisah satu sama lain pada suhu tertentu yang menyebabkan menurunnya ukuran partikel. Namun saat suhu ditingkatkan kembali, ukuran partikel kembali meningkat dengan kristalinitas yang lebih baik.
terjadi penurunan ukuran partikel yang disebabkan karena pada kondisi tersebut terjadi pelarutan kembali partikel dengan ukuran yang besar dan pemisahan antar partikel, sehingga ukuran cenderung menurun (Cao et al 2013). Pada kondisi reaksi dengan suhu 180oC terjadi kenaikan ukuran partikel seiring meningkatnya waktu reaksi. Hal ini disebabkan karena energi yang tersedia cukup besar akibat keberadaan senyawa yang tidak diinginkan dan waktu reaksi yang cukup lama sehingga kecenderungan partikel beraglomerasi sangat tinggi. Sehingga, semakin lama reaksi berlangsung ukurannya menjadi semakin besar.
Gambar 7 Grafik Ukuran Partikel Nanosilika
Gambar 8 Grafik PDI Nanosilika Pada Suhu 120oC
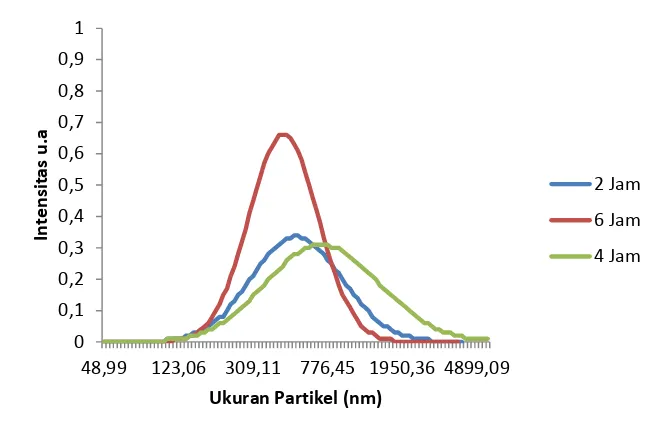
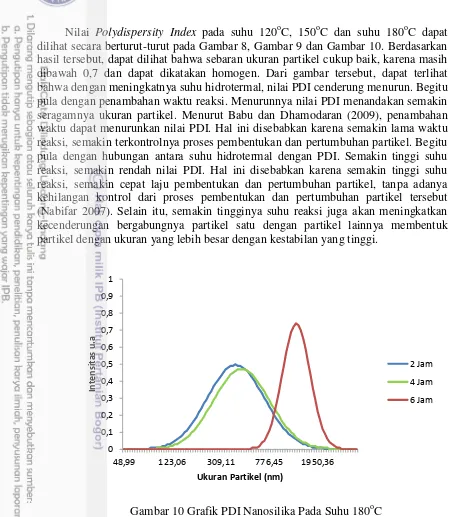
Distribusi ukuran partikel berkaitan dengan polidispersitas dan biasanya dinyatakan dalam bentuk PDI (Polydispersity Index). PDI merupakan ukuran homogenitas dari sistem dispersi dan memiliki range dari 0 hingga 1. Dispersi yang homogen memiliki nilai PDI mendekati nol sementara nilai PDI yang lebih besar dari 0,3 menyatakan dispersi yang heterogen (Kafshgari et al 2010). Sedangkan Nidhin et al (2007) mengatakan bahwa polidispersiti index (PDI) merupakan parameter yang mendefinisikan distribusi ukuran partikel. Nilai PDI antara 0,01 hingga 0,5-0,7 merupakan partikel yang monodispers (homogen). Partikel yang memiliki nilai PDI > 0,7 menandakan distribusi ukuran yang lebar dan tidak seragam (heterogen). Nilai PDI yang rendah menandakan banyaknya dispersi mono dalam larutan. Untuk mengukur PDI dapat diamati dengan menggunakan media pendispersi, dan media pendispersi nanosilika berupa air (Gilliand, Carpenter dan Shultz 2014).
Gambar 9 Grafik PDI Nanosilika Pada Suhu 150oC
0 dilihat secara berturut-turut pada Gambar 8, Gambar 9 dan Gambar 10. Berdasarkan hasil tersebut, dapat dilihat bahwa sebaran ukuran partikel cukup baik, karena masih dibawah 0,7 dan dapat dikatakan homogen. Dari gambar tersebut, dapat terlihat bahwa dengan meningkatnya suhu hidrotermal, nilai PDI cenderung menurun. Begitu pula dengan penambahan waktu reaksi. Menurunnya nilai PDI menandakan semakin seragamnya ukuran partikel. Menurut Babu dan Dhamodaran (2009), penambahan waktu dapat menurunkan nilai PDI. Hal ini disebabkan karena semakin lama waktu reaksi, semakin terkontrolnya proses pembentukan dan pertumbuhan partikel. Begitu pula dengan hubungan antara suhu hidrotermal dengan PDI. Semakin tinggi suhu reaksi, semakin rendah nilai PDI. Hal ini disebabkan karena semakin tinggi suhu reaksi, semakin cepat laju pembentukan dan pertumbuhan partikel, tanpa adanya kehilangan kontrol dari proses pembentukan dan pertumbuhan partikel tersebut (Nabifar 2007). Selain itu, semakin tingginya suhu reaksi juga akan meningkatkan kecenderungan bergabungnya partikel satu dengan partikel lainnya membentuk partikel dengan ukuran yang lebih besar dengan kestabilan yang tinggi.
Gambar 10 Grafik PDI Nanosilika Pada Suhu 180oC
Morfologi Partikel
a b
c d
e
Gambar 11 Morfologi Partikel Nanosilika Perbesaran (a) 100x , (b) 500x, (c) 1000x, (d) 5000x, dan (e) 10 000x
Gambar 11 menunjukkan morfologi nanosilika yang dihasilkan dari analisis dengan SEM. Morfologi partikel yang teramati merupakan satu atau beberapa partikel nanosilika yang diambil secara acak dengan perbesaran 100 kali hingga 10 000 kali. Perbesaran 100 kali digunakan untuk mengamati sebaran ukuran partikel sedangkan perbesaran 10 000 kali digunakan untuk mengamati morfologi partikel tunggal.
disebabkan karena proses nukleasi yang terjadi bersifat heterogen akibat keberadaan senyawa lain (impurities). Selain itu, hal tersebut juga menyebabkan komposisi dari produk menjadi heterogen (Byrappa dan Masahiro 2001). Gambar diatas juga memperlihatkan bahwa pada permukaan beberapa kristal terdapat kristal kecil yang menempel (Gambar 11b, 11c, 11d dan 11e). Berdasarkan hasil pengamatan EDX
Tabel 3 Potensi Aplikasi Nanosilika Berdasarkan Karakteristiknya
No Kondisi Proses Derajat Kristalinitas
(%)
Nanosilika memiliki sejumlah potensi aplikasi pada beberapa bidang dan teknologi. Penggunaan nanosilika pada berbagai bidang aplikasi tidak lepas dari keberagaman sifat dan karakteristiknya. Sifat dan karakteristik nanosilika ditentukan oleh metode yang digunakan serta kondisi proses. Pada sub bab ini akan dibahas potensi aplikasi dari nanosilika yang dihasilkan melalui metode hidrotermal berdasarkan karakteristiknya.
Bahan Aditif dalam Produk Keramik
Silika dapat digunakan sebagai bahan aditif dalam produk keramik guna menambah kekuatan lentur adonan keramik dan kekuatan produk keramik (Hanafi dan Nandang 2010). Pada proses pembakaran adonan keramik yang terdiri dari lempung, kapur dan pasir, silika dari pasir berfungsi sebagai penguat badan keramik dimana pada kondisi suhu titik leburnya silika akan mengisi ruang kosong (pori) yang dibentuk antara partikel tanah liat dan mineral akibat adanya penguapan air dari bahan lainnya sedemikian hingga produk menjadi lebih rapat.
Dari hasil penelitian Hanafi dan Nandang (2010), penambahan silika amorf pada adonan keramik dapat meningkatkan kekuatan patah dari keramik dibanding silika dengan fase kristalin. Hal ini membuktikan bahwa silika amorf lebih mampu mengisi ruang dalam pori yang terbentuk akibat menguapnya air dibanding silika fase kristalin, sehingga keramik menjadi lebih padat. Padatnya keramik menyebabkan nilai porositas menurun, sehingga nilai kuat patah menjadi tinggi.
Nanosilika yang dihasilkan pada suhu 150oC dan waktu 4 jam tidak dapat digunakan sebagai bahan aditif dalam keramik karena bersifat semi kristalin (derajat kristalinitas > 45%). Jika dilihat dari segi ukuran, nanosilika yang dihasilkan pada suhu 180oC dan waktu reaksi 6 jam pun tidak dapat digunakan sebagai bahan aditif produk keramik karena ukurannya yang terlalu besar. Sedangkan jika dilihat dari nilai PDI, nanosilika yang dihasilkan dengan metode hidrotermal cocok digunakan sebagai bahan aditif produk keramik karena nilai PDI yang masih dibawah 0,7 sehingga masih memiliki keseragaman yang cukup baik. Jadi, nanosilika yang cocok digunakan sebagai bahan aditif produk keramik adalah nanosilika yang dihasilkan pada kondisi selain 150oC-4 jam dan 180oC-6 jam.
Pengisi (Filler) dalam Produk Karet (Rubber)
Silika dapat digunakan sebagai pengisi dalam produk karet, salah satunya karet ban yang dimaksudkan untuk meningkatkan kinerja wet traction dan wear resistance serta mengurangi dampak rolling resistance permukaan ban. Dalam morfologi pengisi kompon karet, nanosilika dalam bentuk kristal mempunyai pengaruh meningkatkan kemampuan porses dibandingkan bentuk silika yang heterogen dan amorf (Siswanto et al 2012).
sebagai pengisi, bahkan sebagai pengisi dalam produk karet yang bersifat hidrofobik (Dominic et al 2013).
Dari uraian diatas, dapat dipastikan bahwa nanosilika yang dihasilkan dari metode hidrotermal dapat digunakan sebagai filler dalam produk karet. Nanosilika yang dapat digunakan sebagai filler produk karet haruslah yang memiliki derajat kristalinitas cukup tinggi, keseragaman ukuran yang baik dan ukuran tertentu. Jika dilihat dari nilai derajat kristalinitas, nanosilika yang dihasilkan pada suhu 150oC dan waktu 4 jam dapat digunakan sebagai filler dalam produk karet. Selain itu, nanosilika yang dihasilkan pada suhu 150oC dan waktu 4 jam juga memiliki keseragaman ukuran baik (PDI<0,7) dan ukuran partikel yang termasuk dalam orde nano, sehingga dapat digunakan sebagai filler dalam produk karet.
Filler Resin Komposit
Komposit merupakan salah satu metode perbaikan (restoration) langsung (ADA Council On Scientific Affairs 2003) yang dapat digunakan pada saat terjadinya kerusakan gigi/karies yang disebabkan oleh bakteri sehingga menyebabkan demineralisasi gigi (Kidd et al 2003). Perkembangan nanoteknologi secara signifikan meningkatkan evolusi dari komposit gigi. Teknologi ini memproduksi permukaan yang lebih lembut dengan tingkat transparansi dan kemampuan menggosok yang lebih baik dibanding komposit dengan ukuran lebih besar. Bahan pengisi nanosilika merupakan tipe pengisi yang digunakan pada komposit gigi. Ukuran nanopartikel yang kecil akan menurunkan opacity dari komposit gigi yang akan meningkatkan segi keindahan perbaikan gigi. Nanosilika digunakan untuk meningkatkan dispersi bahan pengisi dan meningkatkan hubungan gaya adhesi antara matriks polimer dengan bahan pengisi. Hal ini akan meningkatkan karakteristik permukaan dan mekanik. Penggunaan pengisi dalam skala nano yang memiliki keseragaman yang baik pada matriks polimer akan memberikan karakteristik mekanik dan proses yang baik serta transparansi yang tinggi pada material nanokomposit (Rahim et al 2011).
Karakter lain yang penting pada komposit gigi adalah tingkat kekasaran. Kekasaran merupakan dampak dari penampilan keindahan dan penghilangan warna pada proses perbaikan. Kekasaran yang tinggi pada permukaan akan menyebabkan timbulnya bakteri dan plak gigi, akumulasi noda pada gigi yang akan mendorong terjadinya karies lanjutan dan radang gusi. Bahan pengisi sekala nano akan menurunkan tingkat kekasaran ini karena bahan tersebut dapat terdispersi lebih homogen pada matriks polimer dibading pengisi dengan ukuran lebih besar. Penambahan nanosilika sebagai bahan pengisi dapat meningkatkan karakteristik fisik dan mekanis dari material nanokomposit. Penambahan nanosilika sebagai filler juga akan meningkatkan nilai kekuatan fleksural, kekuatan kompresif, kekerasan dan modulus elastis (Rahim et al 2011).
cukup tinggi dan bersifat semi kristalin. Selain itu, keseragaman ukurannya pun baik (PDI <0,7) dan memiliki ukuran partikel dalam skala nano sehingga akan meningkatkan nilai kekuatan fleksural, kekuatan kompresif, kekerasan dan modulus elastis (Rahim et al 2011).
Filler pada Membran Penyerap Zat Warna
Limbah cair industri tekstil yang dihasilkan dari proses pewarnaan (dyeing) merupakan salah satu limbah yang menyebabkan pencemaran pada badan perairan. Badan perairan tidak mampu mendegradasi zat warna tersebut sehingga daerah aliran sungai menjadi berwarna dan tidak dapat mendukung sistem kehidupan perairan (Suyata dan Kurniasih 2012). Limbah dari zat warna yang biasanya hanya dibuang ke lingkungan tanpa penanganan/pengolahan lanjutan akan menyebabkan banyak penyakit seperti mual, daire, muntah, iritasi hingga kanker (Prameswari 2013).Beberapa penelitian telah memanfaatkan sekam padi untuk penyerapan zat warna tekstil. Gugus –OH selulosa dalam sekam padi mampu bereaksi dengan gugus-gugus yang ada pada zat warna tekstil sehingga zat warna tersebut terikat pada sekam padi.
Saat ini telah banyak teknik yang digunakan untuk mengurangi intensitas warna pada limbah diantaranya dengan koagulasi, filtrasi, elektrodialisis dan adsorpsi. Filtrasi dengan menggunakan membran mempunyai beberapa keunggulan dibandingkan dengan metode pemisahan konvensional, antara lain pemisahan dapat dilakukan pada suhu kamar, relatif, bersih dan ramah lingkungan (Prameswari 2013). Membran yang cukup banyak dikembangkan adalah membran yang berbahan dasar kitosan. Salah satu kendala yang ditemukan untuk pemanfaatan kitosan adalah kelarutan yang terbatas pada kitosan sehingga menyebabkan keterbatasan dalam aplikasinya. Modifikasi dilakukan terhadap gugus hidroksil dan amina pada unit glukosamin pada kitosan. Pengikatsilangan kitosan adalah solusi yang dapat ditawarkan untuk mengatasi permasalahan sifat mekanik kitosan. Silika digunakan karena bersifat nontoksik dan biokompatibel sehingga banyak dimanfaatkan dalam berbagai aplikasi. Matrik silika secara kimia stabil, bersifat hidrofilik, mudah disintesis dan memiliki kekuatan mekanik (Maharani et al 2012).
Silika yang dapat digunakan sebagai pengisi membran adalah silika dengan sifat amorf. Menurut Dominic et al (2013) silika amorf cocok digunakan sebagai bahan pengisi karena memiliki gugus –OH yang hidrofilik sehingga lebih mudah larut dibandingkan silika kristalin. Saat silika ditambahkan, akan terjadi pengembangan pada membran, hal ini disebabkan karena pada saat silika ditambahkan konsentrasi kitosan akan menurun maka semakin banyak pelarut yang digunakan atau semakin sedikit zat terlarutnya, maka pori-pori membran yang terbentuk akan semakin besar. Hal ini akan meningkatkan daya serapnya sehingga dapat digunakan dalam proses adsorpsi atau filtrasi. Penambahan silika menyebabkan membran kitosan yang sangat rapat menjadi berongga karena muatan negatif dari kitosan yaitu –OH bereaksi dengan silika sehingga akan menarik dan membentuk rongga-rongga kecil (Prameswari 2013).
karena sifatnya yang semi kristalin dan ukuran partikel yang terlalu besar (tergolong orde mikro). Jadi, nanosilika yang dapat digunakan sebagai pengisi dalam membran penyerap zat warna adalah nanosilika yang dihasilkan selain pada kondisi suhu 150oC dan waktu 4 jam serta suhu 180oC dan waktu 6 jam, karena bersifat amorf, ukuran partikel yang tergolong orde nano dan nilai PDI yang sesuai (<0,7).
SIMPULAN DAN SARAN
Simpulan
Nanosilika dapat disintesis dari abu ketel industri gula dengan menggunakan metode hidrotermal. Peningkatan suhu hingga 150oC akan meningkatkan derajat kristalinitas yang ditandai dengan meningkatnya pola difraksi, intensitas puncak, dan jumlah fase. Namun, peningkatan suhu hingga 180oC justru akan menurunkan pola difraksi, intensitas puncak, dan jumlah fase kristal sehingga derajat kristalinitas menurun. Selain itu, peningkatan waktu reaksi hingga 4 jam akan meningkatkan pola difraksi, intensitas puncak, puncak difraksi dan jumlah fase kristal. Namun, saat waktu ditingkatkan hingga 6 jam justru akan menurunkan pola difraksi, intensitas puncak, dan jumlah fase kristal. Nanosilika yang dihasilkan memiliki sifat multifase, dimana terdapat fase kristal tridimit dan kristobalit pada nanosilika yang disintesis pada berbagai perlakuan. Peningkatan waktu dan suhu reaksi juga cenderung membuat keseragaman ukuran partikel nanosilika semakin baik, ditandai dengan semakin sempitnya grafik PDI seiring bertambahnya waktu dan suhu reaksi. Peningkatan waktu reaksi juga akan membuat peningkatan ukuran kristal dan partikel nanosilika. Namun, saat reaksi dilanjutkan menjadi 6 jam, ukuran kristal dan partikel kembali turun. Selain itu, peningkatan suhu hingga batas tertentu akan menyebabkan penurunan ukuran kristal dan partikel dan kembali meningkat saat suhu ditingkatkan. Nanosilika yang dihasilkan dapat diaplikasikan sebagai bahan aditif produk keramik, filler produk karet dan membran penyerap zat warna serta pada resin komposit.
Saran
DAFTAR PUSTAKA
ADA Council on Scientific Affairs. 2003. Direct and Indirect Restorative Materials. JADA. Vol 134.
Affandi S, Heru S, Sugeng W, Agus P, Ratna B. 2009. A Facile Method for Production of High-Purity Silica Xerogels from Baggase Ash. Advanced Powder Technology. 20 (2009): 468-472
Amalia D, Aziz M, Yuhelda. 2013. Pengaruh Penambahan Kalsium Klorida, Kalsium Hidroksida dan Karbon Akif Terhadap Penurunan Silika Terlarut Dalam Larutan Sodium Aluminat. Jurnal Teknologi Mineral dan Batubara. Vol 9, No. 3: 157-164
Atai M, Pahlavan A, Moin M. 2012. Nano-porous thermally sintered nano silica as novel fillers for dental composites. Dental Materials. 28:133–145.
Babu K, Dhamodaran R. 2009. Synthesis of Polymer Grafted Magnetite Nanoparticle With The Highest Grafting Density Via Controlled Radical Polymerization. India (ID): Indian Institute of Technology
Balandis A, Traidaraite A. 2007. The Influence of Al Containing Component On Synthesis of Analcime of Various Crystallographic Systems. Materials Science-Poland. Vol 25, No. 3.
Byrappa K, Masahiro Y. 2001. Handbook of Hydrothermal Technology. New Jersey: Noyes Publications
Cao X, Yong-Chun S, Yong-Neng H, Guang-Ping L, Liu C. 2013. Integrated Process of Large-Scale and Size-Controlled SnO2 Nanoparticles by Hydrothermal Method. Transactions of Nonferrous Metlas Society of China. 23: 725-730 Deepesh B, Radha T, Purnima K S, Yogesh G, Pankaj S. 2013. Hydrothermal
Synthesis and Characterization of Zeolite: Effect of Crystallization Temperature. Research Journal of Chemical Sciences. Vol 3(9): 1-4
Dominic M C D, Begum P M S, Joseph R, Joseph D, Kumar P, Ayswarya E P. 2013. Synthesis, Characterization and Application of Rice Husk Nanosilica In Natural Rubber. International Journal of Science, Environment and Technology. Vol 2, No. 5: 1027-1035
Durrani S K, Syed Z H, Khalid S, Yaqoob K, Mohammad A, Nisar A. 2011. Hydrothermal Synthesis and Characterization of Nanosized Transition Metal Chromite Spinels. Turk J Chem. 36 (2012): 111-120
Fansuri H, Prasetyoko D, Muasyaroh D. 2009. Effect of Initial Hydrothermal Temperature to Zeolites From Coal Fly Ash. CHEMECA, CD-ROM Proceeding. 27-30 September 2009, Perth
Gao-Feng F, Wang J, Xu B, Gao H, Xu-Lin X, Cheng H. 2010. Influence of Hydrothermal Temperature on Structure and Microstructure of Boehmite. Transactions of Nonferrous Metlas Society of China. 20: 221-225
Gilliand S E, Carpenter E E, Shultz M D. 2014. Modified Seed Growth of Iron Oxide Nanoparticles in Benzyl Alcohol – Optimization for Heating and Broad Stability in Biomedical Applications. Nanobiomedicine. 1:9 I. DOI: 10.5772/60035
Imanuel A, Yohan Y. 2011. Pembuatan Silika Berpori dari Water Glass Melalui Metode Pemisahan Fasa Menggunakan Gelatin Sebagai Template. Institut Teknologi Surabaya
Insuwan W, Rangsriwatananon K. 2012. Morphology-Controlled Synthesis of Zeolite L and Physicochemical Properties. Engineering Journal. Vol 16 Issue 3
Ismayana A. 2014. Perancangan peoses co-composting dan nanoteknologi untuk penanganan limbah padat industri gula [Disertasi]. Bogor(ID): Insitut Pertanian Bogor.
Jayadevan K P, Tseng T Y. 2004. Oxide Nanoparticles. Encyclopedia of Nanoscience and Nanotechnology. Vol. 8: 333-376
Jayanti D N. 2014. Optimalisasi Parameter pH Pada Sintesis Nanosilika dari Pasir Besi Merapi dengan Ekstraksi Magnet Permanen Menggunakan Metode Kopresipitasi. [Skripsi]. Yogyakarta(ID): Universitas Islam Negeri Sunan Kalijaga
Junaidi R, Arief S, Syukri. 2013. Sintesis dan Karakterisasi Komposit yang Berbahan Dasar Kitosan, Silika dan Kalsium Fosfat. Jurnal Kimia Unand. Vol 2, No 1. Kafshgari M H, Mohammad K, Mobina K, Sahar K. 2010. Reinforcement of
Chitosan Nanoparticles Obtained by An Ionic Cross-Linking Process. Iranian Polymer Journal. 20 (5): 445-456
Karakas Z K, Bocukcuoglu R, Karakas I H, Yilmaz M T. 2012. The Effect of pH in Nickel Ferrite Nanoparticles Synthesis by Hydrothermal Method. Proceedings of The International Conference Nanomaterials: Applications and Properties. Vol 1, No. 1, pp: 4
Kidd E A M, Smith B G N, Watson T. 2003. Pickard’s Manual of Operative Dentistry8th Ed. New York: Oxford University Press Inc
Kristiyanti P L P. 2011. Pengaruh pH Pada Sintesis Titanium Dioksida (TiO2) dengan Metode Hidrotermal. [Skripsi]. Bogor (ID): Institut Pertanian Bogor Le V H, Chi N H, Huy H T. 2013. Synthesis of Silica Nanoparticles from
Vietnamese Rice Husk by Sol-Gel Method. Nanoscale Reserach Letter. 8:58 Liang W, Yunfei N, Shuhua G, Shaojun S, Jiacan S, Zhuojing L. 2012. Effect of
Hydrotermal Treatment on The Properties of Nanoapatite Crystals. International Journal of Medicine. 7: 5151-5158
Liao J, Zhao X, Zeng L, Song Y, Wang L, Wu A. 2014. Stuies of TiO2 Nanoparticles and Their Precursors for The Photocatalytic Degradation of Dihydroxybenzenes. Biochemical and Biophysical Journal of Neutron Therapy & Cancer Treatments. Vol 2, No. 1
Maharani D K, Cahyaningrum S E, Amaria, Rusmini. 2012. Preparasi dan karakterisasi Nano Komposit Kitosan-Silika dan Kitosan-Silika Titania. J. Manusia dan Lingkungan. Vol 19, No.1: 52-55
Mizutani N, Iwasaki T, Watano S, Yanagida T, Tanaka H, Kawai T. 2008. Effect of Ferrous/Ferric Ions Molar Ratio on Reaction Mechanism for Hydrothermal Synthesis of Magnetite Nanoparticles. Bull Mater. Sci. Vol 31, No. 5: 713-317 Mohammadikish M. 2014. Hydrothermal Synthesis, Characterization and Optical
Mohanraj K, Kannan S, Barathan S, Sivakumar G. 2012. Preparation and Characterization of Nano SiO2 from Corn Cob Ash by Precipitation Method. Optoelectronics and Advanced Materials. Vol 6, No. 3-4: 394-397
Munasir, Widodo, Triwikantoro, Zainuri M , Darminto. 2013. Perbandingan Massa Kalium Hidroksida Pada Ekstraksi SiO2 Orde Nano Berbasis Bahan Alam Pasir Kuarsa. Prosiding Seminar Nasional Sains dan Pendidikan VII UKSW. Institut Teknologi Surabaya
Nabifar A. 2007. Investigations of Kinetic Aspect In Nitroxide-Mediated Radical Polymerization of Styrene. [Thesis]. Canada (ID): University of Waterloo Nejad S J, Aboali G. 2011. Experimental Design for The Optimization of
Hydrothermal Synthesis of Samarium Oxide (Sm2O3) Nanoparticles Under Supercritical Water Condition. International Journal of Chemical Engineerin and Application. Vol2, No. 4
Nejati K, Zabiha R. 2012. Preparation and Magnetic Properties of Nano Size Nickel Ferrtite Particles Using Hydrothermal Method. Chemistry Central Journal. 6:23
Nidhin M, Indumathy R, Sreeram K, Nair BU. 2008. Synthesis of iron oxide nanoparticles of narrow size distribution on polysaccharide templates. Bull. Mater. Sci. 31:93–96.
Padmini O S, Sri W, Brotodjojo R R R. 2014. Pemanfaatan Limbah Tebu dan Agen Hayati Bagi Peningkatan Kualitas Beras. J Agrivet. 18: 17-22
Prameswari T. 2013. Sintesis Membran Kitosan-Silika Abu Sekam Pai Untuk Dekolorisasi Zat Warna Congo Red. [Skripsi]. Semarang (ID): Universitas Negeri Semarang
Rahim T N A T, Mohamad D, Ismail A R, Akil H M. 2011. Synthesis of Nanosilica Fillers for Experimental Dental Nanocomposite and Their Characterisations. Journal of Physical Science. Vol 22, No. 1: 93-105
Renjanadevi B. 2008. Modification of Plypropylene and Polystyrene Using Nanosilica. [Thesis]. India (ID): Cochin University of Science and Technology Rompas G P, Pangouw J D, Pandaleke R, Mangare J B. 2013. Pengaruh Pemanfaatan Abu Ampas Tebu Sebagai Substitusi Parsial Semen dalam Campuran Beton Ditinjau Terhadap Kuat Tarik Lentur dan Modulus Elastisitas. Jurnal Sipil Statik. Vol 1, No 2: 82-89
Santara B, Giri P K. 2013. Impact of Reaction Temperature, Stirring and Cosolvent on The Solvothermal Syntehsis of Anatase TiO2 and TiO2/Titanate Hybrid Nanostructures: Elucidating The Growth Mechanism. Materials Chemistry and Physics. 137: 928-936
Setiawan W K. 2015. Preparasi Nanosilika dari Abu Ketel dengan Metode Kopresipitasi sebagai Aditif Membran Elektrolit Berbasis Kitosan [Thesis]. Bogor (ID): Institut Pertanian Bogor.
Shahmiri M, Nor A I, Norhazlin Z, Nilofar A, Bakhtyar B, Zaharim A, Sopian K. 2013. Effect of pH on The Synthesis of CuO Nanosheets by Quick Precipitation Method. Wseas Transactions on Environment and Devepoment. Vol 9. ISSN: 2224-3496
Suyata, Kurniasih M. 2012. Degradasi Zat Warna Kongo Merah Limbah Cair Industri Tekstil Di Kabupaten Pekalongan Menggunakan Metode Elektrodekolorisasi. Molekul. Vol 7. No 1: 53-60
Thuadaij N, Nuntiya A. 2008. Preparation of nanosilica powder from rice husk ash by precipitation method. Chiang Mai J. Sci. 35(1):206-211.
Tuan H T, Bae I K, Jang Y N, Chae S C, Chae Y B, Suhr, D S. 2010. Hydrothermal Synthesis of ZSM-5 Zeolite Using Siliceous Mudstone. Journal of Ceramic Processing Research. Vol 11, No. 2: 204-208
RIWAYAT HIDUP
Aji Wibowo lahir di Bogor pada tanggal 12 Maret 1993, merupakan putra pertama pasangan Lamidi dan Suyati. Penulis mulai mengenyam pendidikan di TK Kartika XI – 6 (1998-1999), SDN Lawang Gintung II Bogor (1999-2005), SMPN 9 Bogor (2005-2008) dan SMAN 3 Bogor (2008-2011). Setelah itu penulis melanjutkan pendidikan ke perguruan tinggi di Institut Pertanian Bogor pada tahun 2011 melalui jalur SNMPTN Tulis 2011 dan diterima di Departemen Teknologi Industri Pertanian, Fakultas Teknologi Pertanian.
Penulis aktif sebagai asisten praktikum Mata Kuliah Pengawasan Mutu (2015) dan Peralatan Industri (2015) di program sarjana Teknologi Industri Pertanian Institut Pertanian Bogor. Penulis juga aktif dalam berbagai kegiatan kepanitiaan seperti panitia Hagatri 2013 sebagai anggota divisi medis dan TOGETHER 2013 sebagai anggota divisi logistik dan transportasi. Penulis melaksanakan kegiatan Praktik Lapangan pada bulan Juni hingga Agustus 2014 di PT Jakarana Tama dengan