EFEKTIVITAS BEBERAPA UJI PEMALSUAN MADU KAPUK
SKRIPSI
MAYA RACHMAWATY
DEPARTEMEN ILMU PRODUKSI DAN TEKNOLOGI PETERNAKAN FAKULTAS PETERNAKAN
RINGKASAN
Maya Rachmawaty D14070069. 2011. Efektivitas Beberapa Uji Pemalsuan Madu Kapuk. Skripsi. Departemen Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan, Institut Pertanian Bogor.
Pembimbing Utama : Ir. B. N. Polii, S.U.
Pembimbing Anggota : Ir. Hotnida C.H Siregar, M.Si.
Pola hidup sehat menyarankan konsumsi madu setiap hari sehingga permintaan madu semakin meningkat. Bersamaan dengan meningkatnya konsumsi madu, banyak pihak tertentu yang melakukan pemalsuan madu untuk keuntungan berlimpah. Secara fisik madu palsu cenderung sama dengan madu asli akan tetapi komposisi madu asli dan madu palsu berbeda sehingga manfaat nya pun tidak sama. Pemalsuan madu merugikan konsumen sehingga diperlukan cara-cara sederhana untuk membedakan madu asli dan madu palsu. Beberapa cara uji pemalsuan madu telah diketahui masyarakat akan tetapi efektivitasnya belum diketahui. Penelitian ini dilakukan untuk mengetahui nilai efektivitas beberapa uji pemalsuan madu yang biasa digunakan oleh distributor dan konsumen madu.
Penelitian ini menggunakan tujuh sampel yang terdiri dari madu asli dan enam sampel madu palsu. Madu palsu yang digunakan terdiri dari tiga modus pemalsuan madu yakni madu yang dipalsukan dengan penambahan gula (madu sukrosa, madu glukosa dan madu fruktosa), dipalsukan dengan penambahan pengental (madu CMC (Carboxy Methyl Celulose) dan madu gelatin) serta dipalsukan dengan pengental dan gula (madu sagu dan sukrosa). Uji pemalsuan madu yang digunakan adalah uji semut, uji larut, uji keruh, uji buih, uji pemanasan, uji tarik, uji lengket, uji segi enam, uji iod, dan uji ikan mentah. Uji kimia juga dilakukan diantaranya pengukuran kadar air, nilai pH, kadar HMF (Hidroksimetilfurfural) dan kadar gula dilakukan untuk mendukung hasil uji pemalsuan madu.
Pengolahan data dilakukan dengan model Rancangan Acak Kelompok (RAK). Peubah yang diamati adalah nilai efektifitas uji pemalsuan madu. Perlakuan yang diberikan adalah sepuluh uji pemalsuan madu kapuk, dan kelompok terdiri dari tiga yakni modus pemalsuan madu. Nilai efektifitas diuji ANOVA dengan model Rancangan Acak Kelompok (RAK) dan diuji lanjut dengan uji Duncan.
Uji kimia menunjukkan madu yang dipalsukan dengan penambahan gula meningkat kadar gulanya, sedangkan nilai HMF, pH, dan kadar air hampir sama dengan madu asli. Madu yang dipalsukan dengan penambahan pengental memiliki kadar air yang lebih dari 40%, dan kadar gula nya rendah, sedangkan nilai pH dan HMF cenderung sama dengan madu asli. Madu yang dipalsukan dengan pengental dan gula memiliki kadar sukrosa yang tinggi 50,13%, kadar air cukup tinggi 32,72%, nilai pH yang basa yakni 8,23 sedangkan nilai HMF nya sama seperti madu asli.
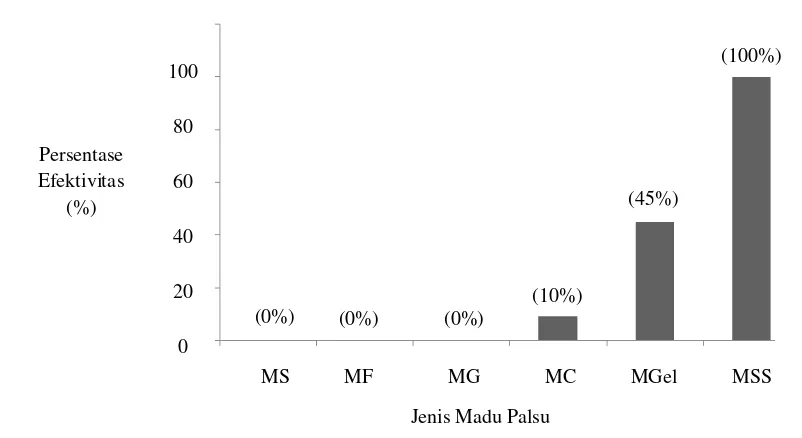
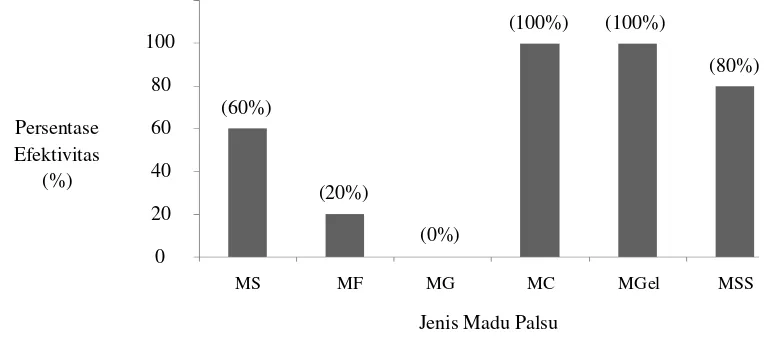
ii Berdasarkan uji pemalsuan madu yang telah dilakukan, terdapat jenis madu palsu yang lebih mudah dideteksi. Madu dengan pemalsuan menggunakan pengental dan gula seperti MSS (madu sagu dan sukrosa) merupakan jenis madu palsu yang lebih mudah diketahui karena dapat dideteksi dengan efektivitas tinggi oleh uji pemanasan, uji segi enam, uji ikan mentah, uji buih, dan uji keruh serta dapat dideteksi dengan mengukur nilai pH dan kadar air. Madu dengan penambahan pengental (MC (Madu CMC) dan MGel (Madu Gelatin)) lebih sulit dideteksi dari pada MSS. Madu dengan penambahan pengental dapat dideteksi dengan uji larut, uji pemanasan, uji segi enam, uji ikan mentah dan pengukuran kadar air. Madu palsu dengan penambahan gula (MS (Madu Sukrosa), MF (Madu Fruktosa), dan MG (Madu Glukosa)) adalah jenis madu palsu yang paling sulit dideteksi dari pada madu palsu lainnya dalam penelitan ini. Madu palsu dengan penambahan gula hanya bisa dideteksi dengan uji larut dan uji keruh.
iii ABSTRACT
The Effectiveness of Several Adulteration Tests Cotton Tree Honey Rachmawaty, M., B. N. Polii and H. C. H. Siregar
This study was conducted to determine the effectiveness of several adulteration tests for honey. There were many adulteration tests usually done by people to distinguish between pure and artificial honey. This experiment studied several adulteration tests such as ant test, soluble test, turbidity test, foam test, heated test, pull test, sticky test, hexagon test, raw fish test, and iodine test. The artificial honey were divided into three, namely artificial honey with thickener (CMC and gelatin), artificial honey with sugar (sucrose, fructose and glucose), and artificial honey with sugar and thickener (sugar and sago). Chemical analysis such as pH, moisture, HMF (Hidroxymethylfurfural) and sugar content (sucrose, fructose and glucose) were also conducted to support the result of adulteration tests. From all adulteration tests, the most effective test was soluble test with number of effectiveness 83,3%. The other effective tests that can be applied to distinguish between pure honey and artificial honey were raw fish test (60%), turbidity test (52,5%), and heated test (49,2%). Artificial honey with sugar dan thickener (sugar and sago) was the most easily to be detected, and artificial honey with sugar (sucrose, fructose, and glucose) was the most difficult to be detected.
iv EFEKTIVITAS BEBERAPA UJI PEMALSUAN MADU KAPUK
LEMBAR PERNYATAAN
MAYA RACHMAWATY D14070069
Skripsi ini merupakan salah satu syarat untuk memperoleh gelar Sarjana Peternakan pada
Fakultas Peternakan Institut Pertanian Bogor
DEPARTEMEN ILMU PRODUKSI DAN TERKNOLOGI PETERNAKAN FAKULTAS PETERNAKAN
v Judul : Efektivitas Beberapa Uji Pemalsuan Madu Kapuk
Nama : Maya Rachmawaty
NIM : D14070069
Menyetujui,
Pembimbing Utama, Pembimbing Anggota,
(Ir. B. N. Polii, SU) (Ir. Hotnida C. H. Siregar, M.Si) NIP. 19480402 198003 2 001 NIP. 19620617 199003 2 001
Mengetahui: Ketua Departemen
Ilmu Produksi dan Teknologi Peternakan
(Prof. Dr. Ir. Cece Sumantri, M.Agr.Sc) NIP. 19591212 198603 1 004
vi RIWAYAT HIDUP
Penulis merupakan anak ke dua dari tiga bersaudara, pasangan Ibu Sita Dewi dan Bapak Muslihat Ibrahim. Penulis dilahirkan pada 30 April 1990 di Bogor. Penulis memulai pendidikan pada tahun 1994 di TK Al-Munawar Bogor. Penulis menyelesaikan pendidikan dasar di SDN Pengadilan 4 Bogor pada tahun 2001, kemudian menyelesaikan sekolah di SMPN 7 Bogor pada tahun 2004. Penulis menyelesaikan sekolah menengah atas di SMA PGRI 4 Bogor pada tahun 2007. Penulis menjabat sebagai Ketua OSIS dan aktif dalam dunia bela diri KATEDA saat duduk di bangku SMA. Pada tahun 2007, Penulis diterima menjadi mahasiswa Institut Pertanian Bogor, Fakultas Peternakan, Departemen Ilmu Produksi dan Teknologi Peternakan (IPTP) melalui jalur Undangan Seleksi Masuk IPB (USMI).
Selama menjadi mahasiswa di IPB, Penulis sangat aktif mengikuti kegiatan kemahasiswaan. Pada Tingkat Persiapan Bersama, Penulis menjadi penyiar di Agri FM, bergabung dalam Dormitory English Club, Taekwondo IPB, dan Badan Eksekutif Mahasiswa Keluarga Mahasiswa (BEM-KM). Pada Tingkat Dua, Penulis berhasil menjadi Juara I Lomba Newscaster Journalistic Fair SCTV dan juara 3 lomba siaran KISI FM Bogor. Selanjutnya Penulis bekerja sebagai penyiar training di radio KISI FM, dan menjadi bendahara biro Public Relation BEM-D Fapet, serta Duta Lingkungan BEM-KM IPB, dan asisten pelatih Tae Kwon Do IPB.
vii KATA PENGANTAR
Puji syukur atas kehadirat Allah SWT karena atas rahmat dan petunjuk-Nya Penulis dapat menyelesaikan skripsi yang menjadi syarat untuk kelulusan studi di Departemen Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan, Institut Pertanian Bogor. Shalawat dan salam juga selalu tercurah kepada junjungan besar Nabi Muhammad SAW.
Skripsi ini berjudul “Efektivitas Beberapa Uji Pemalsuan Madu” ditulis
berdasarkan penelitian yang dilaksanakan pada bulan Oktober sampai Desember 2010. Penelitian tersebut dilaksanakan di Laboratorium Terpadu, Laboratorium Teknologi Hasil Ternak, Laboratorium Non Ruminansia dan Satwa Harapan, Departemen Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan, Laboratorium Bersama, Departemen Kimia, Fakultas Matematikan dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor dan Balai Besar Industri Agro Kota Bogor. Skripsi ini berisikan persentase efektivitas dari berbagai uji pemalsuan madu kapuk yang biasa dilakukan oleh distributor dan konsumen madu.
Penulis menyadari bahwa penulisan skripsi ini terdapat banyak kekurangan dan masih jauh dari sempurna. Penulis berharap skripsi ini dapat memberikan manfaat bagi masyarakat luas, khususnya bagi penulis dan bagi dunia peternakan serta pembaca pada umumnya.
Bogor, April 2011
viii
Carboxy Methyl Cellulose (CMC) ... 12
Soda Kue ... 13
Perbedaan Madu Asli dan Madu Palsu ... 28
Hasil Uji Pemalsuan pada Madu Asli ... 32
Uji Kimia ... 36
Uji Pemalsuan Madu ... 41
ix
KESIMPULAN DAN SARAN ... 59
Kesimpulan ... 59
Saran ... 59
UCAPAN TERIMA KASIH ... 60
DAFTAR PUSTAKA ... 61
x DAFTAR GAMBAR
Nomor Halaman
1. Reaksi Penguraian Sukrosa oleh Enzim Invertase……….. 5
2. Reaksi Pembentukan HMF, Asam Levulinat, dan Asam Format dari Monosakarida (Heksosa) dalam Suasana Asam………. 5
11. Sampel Madu Asli dan Madu Palsu……… 29
12. Hasil Uji Semut………... 42
13. Efektivitas Uji Semut pada Berbagai Madu Palsu……….. 42
14. Hasil Uji Larut……… 43
15. Efektivitas Uji Larut pada Berbagai Madu Palsu………... 44
16. Hasil Uji Keruh………... 45
17. Efektivitas Uji Keruh pada Berbagai Madu Palsu……….. 46
18. Efektivitas Uji Buih pada Berbagai Madu Palsu……… 47
19. Hasil Uji Pemanasan………... 48
20. Efektivitas Uji Pemanasan pada Berbagai Madu Palsu……….. 49
21. Hasil Uji Tarik……… 50
22. Efektivitas Uji Tarik pada Berbagai Madu Palsu………... 51
23. Hasil Uji Segi Enam……… 52
24. Efektivitas Uji Segi Enam pada Berbagai Madu Palsu………... 53
25. Hasil Uji Iod……… 54
26. Efektivitas Uji Iod pada Berbagai Madu Palsu………... 54
27. Hasil Uji Ikan Mentah………. 55
xi DAFTAR TABEL
Nomor Halaman
1. Komposisi Madu ……… 3
2. Standar Nasional Mutu Madu di Indonesia ………... 4
3. Warna Madu ……….. 29
4. Aroma Madu ……….. 30
5. Rasa Madu ………. 31
6. Hasil Uji Pemalsuan yang Diterapkan pada Madu Asli ………. 32
7. Hasil Uji Kimia………... 37
xii DAFTAR LAMPIRAN
Nomor Halaman
1. Gambar Sampel Madu Asli dan Madu Palsu ……….…… 66
2. Hasil Uji Larut……… 67
3. Hasil Uji Keruh………... 68
4. Hasil Uji Pemanasan……….……….. 69
5. Hasil Uji Tarik……… 70
6. Hasil Uji Segi Enam……… 71
7. Komunikasi Pribadi dengan National Honey Board USA……..…… 72
8. Hasil Uji Iod ………... 73
9. Hasil Uji Ikan Mentah………. 74
10. Hasil Uji Pemalsuan dan Persentase Efektivitas Uji Pemalsuan…… 75
11. Perhitungan Persentase Efektivitas Uji Pemalsuan Madu………….. 76
1 PENDAHULUAN
Latar Belakang
Madu mengandung banyak nutrisi yang sangat bermanfaat untuk kesehatan manusia. Zat-zat atau senyawa yang terkandung dalam madu sangat kompleks dan kini telah diketahui tidak kurang dari 181 macam zat atau senyawa terdapat dalam madu (Sihombing, 2005). Keunggulan madu terdapat pada kandungan enzim-enzim dan karbohidratnya. Enzim yang dominan terdapat pada madu adalah enzim diastase dan invertase yang berfungsi mengubah karbohidrat kompleks menjadi karbohidrat yang lebih sederhana. Karbohidrat yang terdapat dalam madu merupakan karbohidrat sederhana dengan kandungan utamanya adalah monosakarida, sehingga lebih mudah diserap oleh tubuh. Berbagai kandungan nutrisi madu membuat madu sangat bermanfaat untuk kesehatan.
Fungsi madu untuk kesehatan manusia diantaranya sebagai penambah stamina, kecantikan kulit, antibakteri dan penumbuh jaringan pada luka dan lain sebagainya. Pola hidup sehat membudayakan konsumsi madu setiap hari, sehingga banyak masyarakat semakin tertarik mengkonsumsi madu. Seiring dengan peningkatan konsumsi madu, berkembanglah cara-cara pemalsuan madu oleh pihak tertentu untuk mendapatkan keuntungan yang berlimpah. Berdasarkan Simamora (2010), pada saat ini madu yang terdapat di pasar Indonesia hampir 80% merupakan madu palsu. Pemalsuan madu biasanya dilakukan dengan penambahan gula dan pengental. Gula yang sering ditambahkan dalam pemalsuan madu adalah glukosa, fruktosa, dan sukrosa, sedangkan pengental yang biasa digunakan adalah Carboxy Methyl Cellulose (CMC) dan gelatin. Ada juga madu palsu yang dibuat dari campuran sagu, gula pasir, dan soda kue.
2 bahwa uji larut memiliki tingkat akurasi sebesar 83,3%. Menurut Lee (2008), selain uji tersebut masih banyak uji pemalsuan madu lainnya yang belum diketahui kebenarannya. Dengan demikian diperlukan penelitian untuk mengukur keefektifan berbagai uji pemalsuan madu. Nilai efektivitas dari uji pemalsuan madu dapat menunjukkan bahwa uji tersebut efektif digunakan atau tidak untuk membedakan madu asli dan madu palsu.
Tujuan
3 TINJAUAN PUSTAKA
Madu
Madu adalah cairan alami yang umumnya mempunyai rasa manis yang dihasilkan oleh lebah madu dari sari bunga tanaman (floral nektar) atau bagian lain dari tanaman (ekstra floral nektar) atau ekskresi serangga (Badan Standarisasi Nasional, 2004). Berdasarkan Sumoprastowo dan Suprapto (1980), pada jaman dahulu madu dipakai untuk mengawetkan daging dan kulit. Orang mesir pada waktu itu mempergunakan madu sebagai bagian dari ramuan rahasianya untuk mengawetkan jenazah raja-raja. Madu juga digunakan untuk makanan kesehatan, obat-obatan serta kosmetika. Banyak bukti yang mendukung madu dapat digunakan untuk luka yakni sebagai antimikroba dan dapat mempercepat pertumbuhan jaringan pada luka (Molan, 2006).
Komposisi dan Mutu Madu
Komposisi madu ditentukan oleh dua faktor utama yakni, komposisi nektar asal madu bersangkutan dan faktor-faktor eksternal tertentu (Sihombing, 2005). Komposisi madu tercantum dalam Tabel 1.
5 Maltosa dan disakarida tereduksi lainnya 7,31
4 lebih 85% dari gula yang terdapat dalam madu adalah fruktosa dan glukosa selebihnya adalah polisakarida dan oligosakarida (White, 1979).
Masing-masing negara memiliki standar mutu madu tersendiri untuk dapat dijual dan dikonsumsi masyarakat. Standar mutu madu di Indonesia tercantum dalam Standar Nasional Indonesia (SNI) 2004 dan dapat dilihat dalam Tabel 2.
Tabel 2. Standar Nasional Mutu Madu di Indonesia
No Jenis Uji Satuan Persyaratan
1 Aktivitas enzim diastase Diastase Number Minimal 3 2 Hidroksimetilfurfural (HMF) mg/kg Maksimal 50
5 Gambar 1. Reaksi Penguraian Sukrosa oleh Enzim Invertase (Achmadi, 1991)
Hidroximetilfurfural (HMF)
Hidroximetilfurfural (HMF) yang terdapat dalam madu merupakan senyawa kimia yang dihasilkan dari perombakan monosakarida madu yang jumlah atom C-nya enam (glukosa dan fruktosa), dalam suasana asam dan dengan bantuan kalor (panas) (Achmadi, 1991). Kadar HMF dapat menjadi indikator kerusakan madu oleh pemanasan yang berlebihan atau karena pemalsuan dengan gula invert. Kedua perlakuan tersebut akan meningkatkan kadar HMF (Winarno, 1982). Semakin lama penyimpanan semakin tinggi kadar HMF madu, tetapi kenaikan kadar HMF tersebut tergantung pada suhu penyimpanan. Hal tersebut didukung oleh hasil penelitian Almayanthy (1998) yang menunjukkan bahwa kadar HMF madu yang disimpan pada suhu 28 oC lebih tinggi dibandingkan pada suhu 3 dan 5 oC. Reaksi pembentukan HMF dapat dilihat pada Gambar 2.
Gambar 2. Reaksi Pembentukan HMF, Asam Levulinat, dan Asam Format dari Monosakarida (Heksosa) dalam Suasana Asam (Achmadi, 1991)
Enzim Invertase
Sukrosa
6 Kadar Air
Kadar air dalam madu menentukan keawetan madu. Madu yang kadar airnya tinggi, mudah berfermentasi. Fermentasi terjadi karena khamir dari genus Zygosaccharomyces yang tahan terhadap konsentrasi gula tinggi, sehingga dapat hidup dalam madu. Sel khamir akan mendegradasi gula dalam madu (khususnya glukosa dna fruktosa) menjadi alkohol (etanol). Jika alkohol bereaksi dengan oksigen, alkohol tersebut akan membentuk asam asetat yang mempengaruhi kadar keasaman, rasa dan aroma madu. Pada akhir proses fermentasi akan terbentuk karbon dioksida dan air (White, 1979; Achmadi, 1991). Madu tidak mudah larut dalam air. Berdasarkan Rahmani (2004) rendahnya kelarutan madu asli disebabkan rheologi asli madu yang berbentuk kental dengan viskositas tinggi serta adanya komponen-komponen lain dalam madu (meski dalam jumlah yang sangat sedikit) seperti protein, vitamin dan mineral yang tidak dimiliki oleh madu buatan atau madu palsu.
Menurut Sumoprastowo dan Suprapto (1980), madu bersifat higroskopis (mudah menarik air), oleh karena itu penyimpanan madu harus memakai tempat Indonesia yang tinggi (Gojmerac, 1983). Kelembaban relatif (RH) Indonesia berkisar 60% hingga 90%, menghasilkan kadar air madu sekitar 18,3% sampai 33,1% (Sihombing, 2005).
Karbohidrat
7 Sihombing (2005) gula-gula madu (candy honey) dapat dilelehkan dengan memanaskan pada suhu 50 oC.
Kandungan karbohidrat madu juga berpengaruh terhadap sifat fisik madu. Sifat higroskopis madu disebabkan madu merupakan larutan jenuh gula. Fruktosa merupakan gula yang paling bertanggung jawab akan sifat higroskopis madu karena fruktosa lebih mudah larut dibandingkan glukosa (White, 1992). Glukosa akan membuat madu berkristal membentuk madu-permanen. Kandungan glukosa akan menentukan lama dan bentuk kristal (Sihombing, 2005). Kristalisasi adalah peristiwa pembentukan glukosa monohidrat dan kristal tersebut lalu memisahkan diri dari air dan fruktosa. Hal tersebut terjadi karena madu merupakan larutan yang lewat jenuh dan tidak stabil (Achmadi, 1991). Kandungan karbohidrat juga berpengaruh terhadap warna madu. Perubahan warna madu dapat disebabkan oleh reaksi mailard antara nitrogen amino dan gula pereduksi atau oleh kombinasi polifenol dengan zat besi, maupun oleh ketidakstabilan fruktosa dalam larutan asam ataupun terjadinya karamelisasi (Sihombing, 2005).
Madu mengandung berbagai gula pereduksi sehingga bila disimpan lama akan mengalami perubahan. Bila madu disimpan dua tahun di tempat bersuhu kamar, maltosa akan meningkat mencapai 69%, dan glukosa serta fruktosa turun mencapai 86% dari aslinya. Perubahan fraksi karbohidrat pertama yang terjadi selama penyimpanan madu adalah peningkatan kadar disakarida pereduksi (maltosa) akibat penggabungan monosakarida pereduksi (glukosa dan fruktosa). Perubahan selanjutnya yang mungkin terjadi adalah peningkatan kadar karbohidrat berantai panjang (oligosakarida) (White, 1979). Penyebabnya antara lain adalah suhu penyimpanan dan kadar air madu (Sihombing, 2005).
8 fruktosa, dan madu semuanya dapat dipakai dalam berbagai teknik pengawetan bahan pangan (Winarno, 1997).
Gula banyak digunakan dalam pengawetan buah-buahan dan sayuran serta sebagai bumbu untuk produk daging. Produk yang dilapisi gula dan sirup biasanya untuk produksi dalam kaleng. Daya larut yang tinggi dari gula, kemampuan mengurangi keseimbangan kelembaban relatif (RH) dan daya mengikat air adalah sifat-sifat yang menyebabkan gula sering dipakai dalam pengawetan bahan pangan (Buckle et al., 1987). Jackson (1995) menyatakan bahwa tingkat kelarutan gula ke dalam air yang bersuhu 22 – 27 oC (suhu ruang) yaitu 72%, tingkat kelarutan gula akan meningkat menjadi 83% pada suhu 100 oC. Menurut Vail et al. (1978), apabila gula dipanaskan maka akan melebur (berubah menjadi bentuk cair) pada suhu sekitar 160 oC, dan pada suhu sekitar 170 oC terjadi karamelisasi.
Jika gula dipanaskan sederet reaksi akan terjadi yang pada akhirnya membentuk karamel. Tahap awal deretan reaksi ini adalah pembentukan gula anhidro. Karamelisasi sukrosa memerlukan suhu sekitar 200 oC. Pada suhu 160 oC, sukrosa meleleh dan membentuk anhidrida glukosan dan anhidrida fruktosa. pada 200 oC, urutan reaksi terdiri atas tiga tahap yang jelas terpisah waktunya. Tahap pertama memerlukan pemanasan 35 menit dan kehilangan bobot 4,5%, sesuai dengan kehilangan satu molekul air per molekul sukrosa. Setelah dipanaskan lebih lanjut selama 55 menit, kehilangan bobot menjadi 9% dan pigmen yang terbentuk disebut karamelan. Pemanasan lebih lanjut lagi selama 55 menit menyebabkan terbentuknya karamelen. Seyawa ini sesuai dengan kehilangan berat 14%, yang kira-kira 8 molekul air per 3 molekul sukrosa. Pemanasan lebih lanjut menyebabkan pembentukan pigmen sangat gelap yang hampir tidak larut, bahan ini disebut karamelin (deMan, 1997).
9 manis. Daya larut sukrosa sebesar 67,1% dalam suhu 20 oC, dan 72,4% dalam suhu 50 oC (Buckle et al., 1987).
Glukosa. Glukosa merupakan monosakarida yakni karbohidrat sederhana yang terdiri dari satu gugus cincin. Glukosa dalam industri pangan lebih dikenal sebagai dekstrosa atau juga gula anggur. Glukosa dapat ditemukan pada sayur-sayuran, buah, madu dan bahan pangan lainnya. Gula (glukosa) mudah larut dalam air, penyebab kelarutan karbohidrat sederhana dalam air adalah adanya grup hidroksil yang mudah bereaksi dengan air disekelilingnya (Irawan, 2007). Daya larut glukosa adalah 50% dalam suhu 20 oC, dan naik menjadi 70% pada suhu 60 oC (Shallenberger dan Birch, 1975).
Fruktosa. Fruktosa dikenal juga dengan nama gula buah, banyak terdapat pada buah-buahan. Fruktosa merupakan molekul yang mengandung gugus hidroksil dan gugus karbonil keton pada C-2 dari rantai enam karbon. Fruktosa adalah karbohidrat sederhana berupa monosakarida yang memiliki rasa manis yang tinggi bila dibandingkan dengan sukrosa dan glukosa. Menurut Irawan (2007), fruktosa adalah gula yang memiliki rasa paling manis. Kemanisan relatif berbagai gula secara berurutan dari yang paling manis adalah fruktosa, sukrosa, glukosa, maltosa, galaktosa dan laktosa (Gaman dan Sherrington, 1992). Fruktosa lebih mudah larut dibandingkan glukosa (White, 1992). Fruktosa memiliki daya larut sebesar 80% pada suhu 20 oC, dan naik menjadi 90% pada suhu 60 oC (Shallenberger dan Birch, 1975). Protein
10 pecahnya gelembung buih (Cherry dan McWatters, 1981). Krell (1996) menambahkan bahwa bersama-sama dengan kekentalan, tegangan permukaan berperan dalam membentuk karakteristik buih pada madu. Pengocokan pada saat uji buih menurunkan tegangan permukaan madu dan dengan adanya kandungan protein dalam madu maka terbentuklah buih. Berdasarkan Wasitaatmadja (1997) buih yang tidak cepat hilang atau cenderung stabil disebabkan adanya zat pembuih atau surfaktan.
Nilai pH
Madu bersifat asam dengan pH 3,2-4-5. Nilai pH madu yang rendah ini mendekati pH cuka, tetapi kandungan gula yang tinggi membuat madu terasa manis, bukan kecut seperti cuka (Mathenson, 1984). Cita rasa (flavor) dan aroma madu sebagian disumbang oleh asam-asam yang dikandungnya. Aroma madu disebabkan adanya senyawa asam-asam terbang (volatile acids) yakni formaldehida, asetaldehida, aseton, isobutiraldehida dan diasetil. Keasaman madu ditentukan oleh disosiasi ion hidrogen dalam larutan air, namun sebagian besar juga oleh kandungan pelbagai mineral (antara lain Ca, Na, K). Madu yang kaya akan mineral, pH-nya akan tinggi. Asam yang terdapat pada madu antara lain asam asetat, butirat, format,
glukonat, laktat, malat, maleat, oksalat, piroglutamat, sitrat, suksinat, glikolat, α
-ketoglutaral, piruvat, 3-fosfogliserat, β-gliserofaosfat dan glukose-6-fosfat. Rasa madu disebabkan oleh kandungan gula, dan asam organik seperti asam glukonat dan prolin, pada madu dengan rasa spesifik tak terhitung banyaknya variasi penyebab rasa tersebut seperti glukosida dan alkaloid yang khas bagi tumbuhan sumber nektar (Sihombing, 2005).
Madu dapat menjadi agen antimikroba. Hal tersebut disebabkan kandungan gulanya yang tinggi, pH madu yang relatif asam, dan kandungan proteinnya yang rendah. Dengan demikian madu dapat membatasi jumlah air yang tersedia untuk pertumbuhan mikroba dan dapat menghalangi pertumbuhan bakteri (National Honey Board, 1997).
Vitamin dan Mineral
11 piridoksin (B6), asam pantotenat, niasin dan asam askorbat, vitamin-vitamin lain seperti biotin, asam folat, kholin, dan asetil kholin terdapat juga dalam madu. Vitamin larut lemak seperti vitamin K juga ditemukan. Kandungan mineral pada madu juga mempengaruhi warna yang ditunjukkan madu, semakin banyak kandungan mineral seperti Fe, Mg, dan K maka warna madu akan semakin gelap (Sihombing, 2005). Mineral yang terkandung di dalam madu yang terpenting ialah Na, Ca, Mg, Cu, Al, Mn, Fe, K dan P (Sumoprastowo dan Suprapto, 1980).
Zat penyebab warna madu sebagian besar belum diketahui, namun ada yang menduga terdiri dari fraksi yang larut air dan larut lemak. Pada madu berwarna cerah warna oleh zat larut air lebih sedikit dari yang larut lemak. Ada juga yang menduga oleh pelbagai senyawa polifenol, terutama pada madu berwarna pekat. Oksidasi yang berlangsung akan zat-zat ini akan semakin menimbulkan warna. Warna yang timbul pada madu yang tersimpan lama disebabkan oleh kombinasi beberapa faktor, misalnya gabungan tannat dan polifenol lain-lain dengan zat besi dari kemasan atau alat pengolah, reaksi dari gula tereduksi dengan senyawa mengandung nitrogen amino (asam amino, polipeptida, protein), ketidakstabilan fruktosa dalam larutan asam (karamelisasi). Madu cerah hampir tak mengandung tirosin dan triptofan, sedang pada madu berwarna pekat hal sebaliknya yang terdapat (Sihombing, 2005).
Gelatin
12 gelatin tipe B menggunakan basa dan tipe A menggunakan asam (Igoe dan Hui, 1996). Nilai pH dari gelatin bervariasi 3,8 sampai 6,0 untuk gelatin tipe B dan kisaran 5 sampai 7,1 untuk gelatin tipe A (Tourtellote, 1980).
Tepung Sagu
Sifat fisik dan komposisi kimia pati sagu memiliki sifat yang tergantung pada panjang rantai karbonnya dan bercabang atau lurusnya rantai molekulnya. Pati terdiri dari dua fraksi yang dapat dipisahkan dengan air panas. Fraksi terlarut disebut dengan amilosa dan fraksi tidak terlarut disebut amilopektin. Amilosa mempunyai
stuktur lurus dengan ikatan α-1,4-D-glukosa, sedangkan amilopektin mempunyai
rantai cabang dengan ikatan α-1,6-D-glukosa. Pati sagu mengandung 27% amilosa
dan 73% amilopektin. Perbandingan amilosa dan amilopektin ini mempengaruhi sifat kelarutan dan derajat gelatinisasi pati. Semakin besar kandungan amilosa, maka pati makin bersifat kering dan kurang lengket cenderung menyerap air lebih banyak sedangkan semakin tinggi kandungan amilopektin maka pati akan bersifat tidak kering dan lengket (Wirakartakusumah et al, 1984). Amilosa dengan iodin akan membentuk kompleks biru, sedangkan amilopektin dengan iodin akan membentuk warna merah ungu (Mustahib, 2011).
Pada proses gelatinisasi pati, energi panas akan melemahkan ikatan H sehingga air akan terserap, meyusup diantara molekul-molekulnya. Jika suspensi pati dalam air dipanaskan, air akan menembus lapisan luar granula dan granula ini mulai membesar. Ini terjadi saat temperatur meningkat dari 60 oC sampai 80 oC. Granula-granula dapat membesar hingga volumenya lima kali lipat dari volume semula. Ketika ukuran granula pati membesar, campurannya menjadi kental. Pada suhu kira-kira 85 oC granula pati pecah dan isinya terdispersi merata ke seluruh air di sekelilingnya. Molekul berantai panjang mulai membuka atau terurai dan campuran pati atau air menjadi semakin kental (Gaman dan Sherrington, 1992).
Carboxy Methyl Cellulose (CMC)
13 tekstur, dan sering digunakan untuk melengkapi sifat hidrokoloid lainnya. Nilai pH CMC berkisar antara 6 sampai 8 (Hebei, 2011). CMC mudah larut dalam air hangat atau air dingin (Masfufatun, 2009). Hal tersebut disebabkan CMC memiliki daya mengikat air yang tinggi. CMC mampu mengikat air dan membentuk struktur gel dalam air yang kemudian meningkatkan viskositas (Arbuckle dan Marshall, 1996).
Soda Kue
Nama lain dari soda kue adalah natrium hidrogen karbonat, natrium bikarbonat, atau bikarbonat soda. Larutan soda kue dalam air bersifat basa lemah. Senyawa ini membantu menetralkan asam dalam tubuh manusia (menetralkan asam lambung) (Wahyudi, 2010). Soda kue bersifat basa. Soda Kue akan mengeluarkan gelembung udara jika bertemu dengan cairan dan bahan yang sifatnya asam (buah-buahan, yoghurt, madu, buttermilk, coklat, dan lain-lain). Soda kue biasa digunakan pada adonan kue atau bahan pangan yang bersifat asam (Riana, 2005).
Semut
Sleigh (2003), menyatakan bahwa semut merupakan serangga berkoloni, ketika daerahnya didatangi oleh koloni semut lain maka semut akan menunjukkan sifat agresif untuk mempertahankan daerahnya. Semut dapat melawan koloni lain untuk mendapatkan makanan. Menurut Newman dan Dalton (1967), sulit untuk mengkategorikan semut berdasarkan makanannya. Semut memakan protein dan karbohidrat yang bervariasi. Sebagian semut adalah vegetarian pemakan nektar, dan sebagian lainnya memakan makanan yang kecil dari hewan atau serangga lain yang telah mati. Semut membawa makanan ke sarang seperti lebah madu, serangga yang telah mati dipotong dalam ukuran kecil dan dibawa ke sarang, sedangkan gula atau makanan cair lainnya disimpan dalam swollen crops di dalam perutnya kemudian didistribusikan ke sarang dari mulut ke mulut.
Madu Palsu
14 seperti fruktosa, glukosa, sirup dan bahan pengental. Pemalsuan mutu biasanya dilakukan dengan memodifikasi kadar air. Pemalsuan menyeluruh yakni madu yang dibuat tanpa menggunakan madu asli sebagai bahan utama, biasanya menggunakan campuran sagu, gula pasir dan pewarna. Madu palsu tidak memiliki kandungan Kromatografi Cair Kinerja Tinggi (KCKT) atau High Peformance Liquid Cromatografi (HPLC) (Ratnayani et al., 2008). Pengujian dengan HPLC terutama dimaksudkan untuk mengetahui kadar fruktosa dan glukosa madu. Uji kimia lain yang dapat digunakan adalah uji dua parameter umum yang dipandang menjadi ciri utama keaslian madu yakni keaktifan enzim diastase dan kadar HMF (Moermanto, 1986). Hadisoesilo (1986) menyatakan bahwa dalam rangka mencegah pemalsuan madu dengan air dan gula maka madu harus diuji dulu kandungan sukrosanya. Pengujian kadar sukrosa dilakukan karena sebagian besar pemalsuan pada madu dilakukan dengan penambahan gula pasir, gula merah dan gula lain dari berbagai sumber, sehingga dapat meningkatkan kandungan sukrosa madu mencapai lebih dari 8% sedangkan berdasarkan Gojmerac (1983) rata-rata kandungan sukrosa pada madu hanya 1,31%.
16 MATERI DAN METODE
Lokasi dan Waktu
Penelitian ini telah dilaksanakan di lima tempat yaitu Laboratorium Terpadu, Laboratorium Teknologi Hasil Ternak, Laboratorium Non Ruminansia dan Satwa Harapan, Departemen Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan dan Laboratorium Kimia Bersama, Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, IPB serta Balai Besar Industri Agro (BBIA) Bogor. Pelaksanaan penelitian ini dua bulan dimulai sejak tanggal 11 Oktober sampai dengan 11 Desember 2010.
Materi
Bahan utama yang digunakan adalah madu kapuk asli yang diperoleh dari Pasuruan, Jawa Timur. Madu tersebut diproduksi dan dipanen pada musim hujan. Bahan untuk madu palsu dan campurannya antara lain sukrosa, fruktosa, glukosa, Carboxy Methyl Cellulose (CMC), gelatin, air, pewarna makanan (warna coklat), sagu dan soda kue. Bahan yang digunakan untuk pengujian yaitu semut, ikan mentah (bibit ikan mas), larutan iod, akuades, larutan tepung jagung, feroksianida, seng asetat, natrium bisulfit (NaHSO3) 0,2% dan 0,1%, serta asetonitril dan air yang telah disaring dengan membran 0,45 mm.
17 Prosedur
Penelitian ini dibagi tiga tahapan yakni : (1) Pembuatan madu palsu, (2) Uji pemalsuan madu, dan (3) Uji Kimia.
Pembuatan Madu Palsu
Sampel yang digunakan adalah madu asli dan madu palsu. Madu palsu yang dibuat terbagi atas tiga modus pemalsuan, yakni pemalsuan dengan penambahan gula (fruktosa, glukosa dan sukrosa), pemalsuan dengan penambahan pengental (CMC dan gelatin), dan pemalsuan dengan pengental serta gula (sagu dan sukrosa). Berdasarkan tiga modus pemalsuan tersebut didapatkan enam sampel madu palsu yang selanjutnya disebut, madu sukrosa (MS), madu glukosa (MG), madu fruktosa (MF), madu CMC (MC) dan madu gelatin (MGel) serta madu sagu dan sukrosa (MSS). Sampel yang digunakan ada tujuh, yang terdiri dari satu sampel madu asli (madu kapuk) dan enam sampel madu palsu.
Madu asli. Madu asli yang digunakan adalah madu kapuk. Madu asli ini diproduksi pada musim hujan sehingga kadar air saat panen cukup tinggi yakni sebesar 23%. Madu asli untuk diuji disiapkan sebanyak 2 kg, dan madu asli juga digunakan untuk membuat madu palsu. Madu asli disimpan pada suhu ruang.
Madu sukrosa (MS). Madu sukrosa merupakan madu palsu yang terdiri dari campuran madu asli dan sukrosa. Sukrosa yang digunakan berbentuk kristal. Sukrosa dilarutkan dengan cara dipanaskan dengan air. Kadar air sukrosa dikondisikan mencapai 23%, jika kadar air di atas 23% maka sukrosa dipanaskan kembali dan jika kurang dari 23% ditambahkan air. Sukrosa berkadar air 23% dibiarkan agar suhunya turun mencapai suhu ruang, kemudian dilakukan pencampuran dengan madu asli dengan komposisi 1 : 1, yakni madu asli 1 kg dicampur dengan sukrosa 1 kg.
18 Madu glukosa (MG). Madu Glukosa adalah madu palsu yang terdiri dari campuran madu asli dengan glukosa. Glukosa yang digunakan berbentuk cair dengan kadar air 25%. Glukosa dikondisikan berkadar air 23% dengan dipanaskan. Glukosa yang sudah berkadar air 23% didiamkan dingin sampai mencapai suhu ruang, kemudian dicampurkan dengan madu asli dengan komposisi 1 : 1, yakni madu asli 1 kg dicampur dengan glukosa sebanyak 1 kg.
Madu CMC (MC). Madu CMC adalah madu palsu yang terdiri dari campuran madu asli dengan larutan Carboxy Methyl Cellulose (CMC) sebagai pengental. CMC yang digunakan berbentuk serbuk, sehingga harus dilarutkan dalam air panas kemudian diaduk hingga mengental secara merata. Komposisi pembuatan larutan CMC adalah 50 g CMC dan 1600 g air (97% air dan 3% CMC), dengan komposisi ini CMC secara fisik sudah mirip dengan kekentalan madu asli. Madu asli dan larutan CMC dicampurkan pada suhu ruang, kemudian dilakukan pengocokan dengan mixer agar CMC dapat bercampur rata dengan madu. Komposisi pencampuran madu asli dan CMC adalah 3 : 2, yakni 1,2 kg madu asli dicampur dengan 0,8 kg larutan CMC. Kadar air madu CMC tidak dikondisikan 23% karena adanya bahan pengental yang mengikat air sehingga menyebabkan kadar air tinggi dan sulit untuk diturunkan, akan tetapi penampilan fisik madu CMC sudah serupa dengan madu asli.
Madu gelatin (MGel). Madu gelatin merupakan madu palsu yang terdiri dari campuran madu asli dengan gelatin. Gelatin yang digunakan berbentuk kristal. Kristal gelatin dilarutkan dalam air panas. Komposisi pembuatan gelatin cair adalah 200 g gelatin dan 1600 g air (89% air dan 11% gelatin), dengan komposisi ini gelatin secara fisik sudah mirip dengan kekentalan madu asli. Kadar air tidak dikondisikan 23% karena sifat gelatin sebagai pengental yang tidak dapat dikondisikan berkadar air 23% dengan kekentalan yang sama dengan madu asli. Madu asli dan gelatin dicampurkan pada suhu ruang. Komposisi pencampuran madu asli dan gelatin adalah 3 : 2, yakni 1,2 kg madu asli dicampur dengan 0,8 kg larutan gelatin.
19 sebanyak 600 g (70% gula pasir dan 30% air). Kemudian gula yang sudah cair dicampur dengan sagu yang telah dikentalkan. Campuran gula dan sagu dipanaskan dan ditambahkan pewarna coklat sebanyak 5 ml, dan soda kue 50 g untuk memberikan buih, kemudian diaduk-aduk dan dibiarkan dingin serta ditambahkan 50 g madu asli untuk membantu memberikan aroma. Kadar air madu palsu tidak dikondisikan 23% karena adanya bahan pengental yakni sagu, akan tetapi secara fisik madu palsu ini sudah mirip dengan madu asli.
Uji Pemalsuan Madu
Uji pemalsuan madu secara konvensional dilakukan dengan sepuluh uji yang biasa dilakukan oleh masyarakat yakni uji semut, uji larut, uji keruh, uji buih, uji pemanasan, uji tarik, uji lengket, uji segi enam, uji ikan mentah, dan uji iod. Masing-masing pengujian dilakukan sebanyak 20 kali ulangan, kecuali uji ikan mentah dilakukan sebanyak 5 kali ulangan. Metode pengambilan data yang digunakan adalah one zero sampling. Semua uji pemalsuan madu dilakukan terlebih dahulu pada madu asli, setelah diketahui hasil yang ditunjukkan madu asli maka uji dilakukan pada semua sampel madu palsu, jika hasil uji (respon) berbeda dengan madu asli maka diberikan nilai 1, dan jika sama diberikan nilai 0.
Uji semut. Plastik berukuran 5 x 3 cm dioleskan sampel dan disimpan di tempat yang terdapat semut merah kecil dan semut lain. Setelah 90 menit diamati semut yang datang. Cara uji semut dapat dilihat pada Gambar 3.
Gambar 3. Uji Semut
20 larut ditandai dengan keruhnya air disekitar madu. Cara uji pemalsuan dengan uji larut dapat dilihat pada Gambar 4.
Gambar 4. Uji Larut
Uji keruh. Madu sebanyak 10 g dicampur dengan 200 ml air dalam gelas kaca bening, kemudian diaduk hingga tercampur secara merata. Sampel yang telah dicampur dengan air diamati berwarna keruh atau tidak. Kertas berwarna putih diletakkan dibelakang gelas agar lebih mudah diamati. Cara uji pemalsuan dengan uji keruh dapat dilihat pada Gambar 5.
Gambar 5. Uji Keruh
21 Uji pemanasan. Sampel madu dituangkan pada sendok makan (sekitar ¾ bagian), kemudian dipanaskan selama ±40 detik di atas lilin yang menyala dengan jarak 1 cm. Sampel madu diamati ketika telah berbuih, apakah buih meluber keluar dari sendok atau tidak. Cara pengujian madu palsu dengan uji pemanasan dapat dilihat pada Gambar 6.
Gambar 6. Uji Pemanasan
Uji tarik. Sampel madu dari uji pemanasan didiamkan selama 60 detik. Lidi dicelupkan ke dalam madu dan ditarik secara vertikal sejauh 10 cm. Sampel diamati apakah ketika ditarik membentuk benang tipis atau tidak. Cara pengujian madu palsu dengan menggunakan uji tarik dapat dilihat pada Gambar 7.
Gambar 7. Uji Tarik
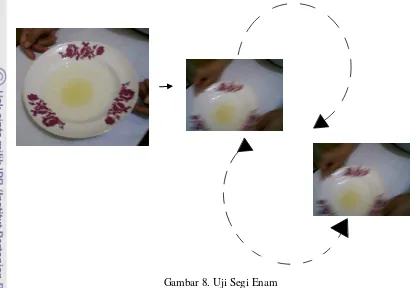
22 atau tidak. Cara pengujian dengan menggunakan uji segi enam dapat dilihat pada Gambar 8.
Gambar 8. Uji Segi Enam
Uji ikan mentah. Satu ekor anak ikan yang masih segar dengan berat sekitar 15 g dimasukkan ke dalam gelas kemudian dituangkan 50 g madu sampai ikan tenggelam. Gelas ditutup plastik dan diikat dengan karet, kemudian disimpan selama 2 minggu pada suhu kamar. Setelah 2 minggu ikan diamati keadaanya, apakah berkerut dan kaku atau lembek dan hancur. Cara pengujian madu palsu dengan menggunakan uji ikan mentah dapat dilihat pada Gambar 9.
23 Uji iod (Nesta, 2008). Pengujian dengan iod dilakukan dengan cara mencampurkan 20 g madu dengan 5 ml larutan tepung maizena (sebanyak 5 g tepung maizena dilarutkan dalam 200 ml air) kemudian diaduk. Tahap selanjutnya campuran tersebut ditetesi larutan iod sebanyak 3 tetes kemudian diaduk dan diamati, apakah larutan tersebut menjadi berwarna ungu (biru kemerahan) atau tidak. Cara pengujian madu palsu dengan menggunakan uji iod dapat dilihat pada Gambar 10.
Gambar 10. Uji Iod
Uji Kimia
Uji kimia yang dilakukan yakni pengukuran nilai pH, kadar air, kadar HMF (Hidroksimetilfurfural) dan kadar gula madu (sukrosa, fruktosa dan glukosa).
Nilai pH. Nilai pH diukur dengan pH-meter digital SCHOTT dengan ketelitian empat angka di belakang koma. Ujung sensor pH meter dikalibrasi dengan akuades kemudian dilap dan dikeringkan dengan tisu. Ujung sensor pH meter dimasukkan ke dalam sampel madu, kemudian dibiarkan sampai nilai pH stabil. Ujung sensor pH meter dibersihkan dengan akuades dan dikeringkan lagi dengan tisu, kemudian dicelupkan kembali dalam akuades. Pengukuran nilai pH dilakukan sebanyak 5 kali ulangan.
24 Kadar hidroksimetilfurfural (HMF) (Penyederhanaan SNI 01-3545-2004). Kadar HMF diukur dengan alat Spektrofotometer HP 8453. Spektrofotometer yang biasa dipakai harus mempunyai panjang gelombang 284 nm dan 336 nm, mempunyai sel 1 cm. Tahap pertama larutan Carez I (15 g ferosianida K4Fe(CN)6.3H2O dilarutkan dengan air dan diencerkan sampai 100 ml) dan larutan Carez II (30 g seng asetat Zn(CH3COO)2.2H2O dilarutkan dengan air dan diencerkan sampai 100 ml) dipersiapkan. Sebanyak lima gram sampel madu ditimbang dalam labu ukur 50 ml, kemudian ditambahkan akuades sampai larutan dalam labu ukur mencapai kurang lebih 25 ml. Sebanyak 0,5 ml larutan Carez I ditambahkan ke dalam labu ukur kemudian diaduk. Tahap selanjutnya larutan Carez II ditambahkan ke dalam labu ukur kemudian diaduk kembali. Volume campuran ditepatkan hingga tanda tera dengan akuades, kemudian disaring dengan kertas saring abu.
Filtrat hasil penyaringan dipipet 5 ml ke dalam dua tabung reaksi berukuran 18 x 100 mm. Tabung pertama ditambahkan 5 ml akuades, sedangkan tabung kedua (pembanding) ditambahkan 5 ml NaHSO3 0,2%. Campuran diaduk rata dengan menggunakan pengaduk vortex. Tahap berikutnya sampel diukur absorbannya dengan menggunakan spektrofotometer pada panjang gelombang 284 nm dan 336 nm dengan sel satu cm. Apabila absorbansi di atas 0,6 larutan sampel diencerkan lagi dengan akuades, sedangkan larutan pembanding diencerkan dengan cara sama dengan menggunakan larutan NaHSO3 0,1%. Nilai absorbansi yang diperoleh dikalikan dengan faktor pengencer sebelum perhitungan.
Perhitungan :
25 Liquid Cromatografi) CTO-20A. Uji gula dilakukan dengan tiga tahapan yakni stabilisasi alat (HPLC), penyuntikan standar, dan penyuntikan sampel dengan syringe 100F-LC. Stabilisasi alat dilakukan dengan cara mengalirkan fase gerak (25% air dan 75% acetonitril) dalam instrumen HPLC selama satu jam.
Tahap selanjutnya adalah penyuntikan standar. Standar yang digunakan adalah sukrosa, fruktosa, dan glukosa murni. Sebanyak 10 gram sampel dari masing-masing standar dilarutkan dalam 100 ml air (air bebas ion yang telah disaring dengan membran 0,45 mikrometer). Selanjutnya 10 ml hasil larutan diambil disaring dengan membran 0,2 mikrometer. Sampel yang telah disaring diambil dengan menggunakan syringe gelas sebanyak 100 mikroliter kemudian disuntikkan pada HPLC dan diamkan agar tekanan pada HPLC stabil (pada pengukuran ini tekanan berada pada 75 kgF). Pada saat tekanan telah stabil kembali, semua kandungan standar telah keluar dalam bentuk grafik (telihat dalam monitor). Pada penelitian ini, semua kandungan standar fruktosa, sukrosa dan glukosa sudah keluar sebelum 16 menit. Berdasarkan penyuntikan standar diketahui bahwa puncak fruktosa akan keluar kurang lebih pada menit ke 7 lebih 24 detik, kemudian puncak glukosa keluar pada menit ke 8 lebih 30 detik, dan puncak sukrosa keluar pada menit ke 11 lebih 30 detik. Setelah HPLC distandarisasi untuk pengujian sukrosa, glukosa dan fruktosa, dilakukan penyuntikan sampel madu. Semua sampel madu diencerkan dengan cara satu gram madu diencerkan dalam 10 ml air (yang telah disaring dengan membran 0,45 mikrometer). Sampel yang telah diencerkan diambil dengan syringe gelas sebanyak 100 mikroliter dan disuntikkan dalam HPLC. Sebelumnya sampel madu diukur terlebih dahulu berat jenisnya untuk data perhitungan kadar gula. Puncak atau grafik fruktosa, glukosa dan sukrosa akan keluar dan kemudian dihitung konsentrasinya dalam persen dengan rumus : enam, uji iod dan uji ikan mentah), serta data dari hasil uji kimia (nilai pH, kadar air,
Berat jenis Bobot sampel Luas grafik daerah sampel
26 kadar HMF dan kadar gula). Data hasil uji kimia digunakan untuk mendukung hasil uji pemalsuan madu. Hasil uji pemalsuan madu diolah dengan dibuat persentase untuk mengetahui efektivitas masing-masing uji. Semakin tinggi nilai persentase suatu uji maka semakin efektif uji tersebut. Persentase hasil uji pemalsuan madu
20 : Banyaknya ulangan dalam satu perlakuan
Data terdiri dari 10 perlakuan (uji pemalsuan madu yaitu uji semut, uji larut, uji keruh, uji buih, uji pemanasan, uji tarik, uji lengket, uji segi enam, uji iod, dan uji ikan mentah) dan 3 kelompok sampel yakni, madu yang dipalsukan dengan penambahan gula (rataan dari MS, MF, dan MG), dipalsukan dengan penambahan pengental (rataan MC dan MGel) serta dipalsukan secara menyeluruh (MSS). Data yang didapatkan tidak memenuhi syarat kehomogenan sehingga ditransformasi dengan model ln(X+100), dimana X adalah data yang diamati. Data kemudian diuji ANOVA menggunakan RAK dan diuji dengan uji lanjut Duncan. Model rancangan acak kelompok (RAK) yang digunakan adalah sebagai berikut (Gasperz, 1991).
Yij = µ + Kj + Pi + €ij
Keterangan :
Yij = Hasil pengamatan persentase efektivitas pada sampel madu palsu yang berbeda.
µ = Nilai tengah umum persentase efektivitas uji pemalsuan madu ke-i pada kelompok sampel madu palsu ke-j.
Kj = Pengaruh kelompok sampel madu palsu ke-j.
Pi = Pengaruh taraf perlakuan uji pemalsuan ke-i.
€ij = Pengaruh galat percobaan dari uji pemalsuan madu.
Pada uji lanjut Duncan, uji terbaik adalah uji pemalsuan madu yang memiliki nilai rataan tertinggi. Uji pemalsuan madu yang memiliki subskrip A dinyatakan sangat efektif, subskrip AB dinyatakan efektif, subskrip ABC dinyatakan cukup efektif, subskrip BC dinyatakan tidak efektif, dan subskrip C dinyatakan sangat tidak
28 HASIL DAN PEMBAHASAN
Hasil penelitian disajikan dalam beberapa sub bab pembahasan. Penjelasan disajikan secara bertahap dimulai dari perbedaan madu asli dan madu palsu, hasil uji pemalsuan pada madu asli, hasil uji kimia, hasil uji pemalsuan madu, dan efektivitas uji pemalsuan pada setiap jenis madu palsu.
Perbedaan Madu Asli dan Madu Palsu
Pemalsuan madu dilakukan oleh pihak tertentu untuk meningkatkan keuntungan. Pemalsuan yang dilakukan dapat secara volume, fisik, dan keseluruhan. Pemalsuan volume biasanya dilakukan dengan cara menambahkan gula seperti sukrosa, fruktosa dan glukosa, akan tetapi kandungannya berbeda dengan madu asli. Madu mengandung bahan-bahan lain seperti protein, enzim, vitamin dan mineral yang tidak dimiliki oleh gula. Pemalsuan dengan gula mudah dilakukan, dan hasil campuran antara madu dan gula pun memiliki sifat fisik yang cenderung sama dengan madu asli.
Pemalsuan madu secara fisik biasanya dengan cara menambahkan pengental agar madu yang memiliki kadar air tinggi terlihat lebih kental dan lebih berat. Pengental yang digunakan untuk pemalsuan madu biasanya merupakan bahan pangan yang bersifat mengentalkan seperti CMC dan gelatin. Pemalsuan menyeluruh yakni dengan membuat madu dari bahan-bahan lain. Bahan yang biasanya digunakan untuk membuat madu palsu ini adalah sagu dan gula pasir (sukrosa). Campuran antara sagu dan gula pasir dapat memberikan viskositas yang cenderung sama dengan madu asli. Campuran sagu dan gula pasir selanjutnya ditambahkan soda kue agar berbuih dan memiliki aroma, serta ditambahkan pewarna agar terlihat seperti madu asli. Penambahan essence madu juga kerap dilakukan agar madu palsu memiliki aroma seperti madu asli. Secara fisik semua jenis madu palsu sulit dibedakan sehingga hal ini merugikan konsumen madu.
29 pemalsuan menyeluruh yakni madu sagu dan sukrosa (MSS). Secara fisik semua jenis madu palsu yang digunakan dalam penelitian ini cenderung sama. Penampilan fisik madu asli dan madu palsu yang digunakan dalam penelitian ini dapat dilihat pada Gambar 11.
Gambar 11. Sampel Madu Asli dan Madu Palsu (secara berurutan dari samping kiri : Madu Gelatin (MGel), Madu Sagu dan Sukrosa (MSS), Madu Fruktosa (MF), Madu Glukosa (MG), Madu CMC (MC), Madu Sukrosa (MS), dan Madu Asli).
{{{{
Madu asli dan palsu memiliki kesamaan secara fisik dilihat dari warna, rasa, aroma dan kekentalan. Warna madu asli dan semua sampel madu palsu cenderung sama. Warna masing-masing madu palsu terdapat dalam Tabel 3.
Tabel 3. Warna Madu
Madu Warna
Madu Asli Coklat kekuningan
Madu Sukrosa (MS) Coklat kekuningan lebih jernih Madu Fruktosa (MF) Coklat kekuningan lebih jernih Madu Glukosa (MG) Coklat kekuningan lebih jernih
Madu CMC (MC) Kuning terang
30 Tidak adanya standar untuk warna madu asli menyebabkan sulitnya membedakan madu asli dan palsu berdasarkan warna. Standar untuk warna madu tidak ditentukan, karena madu memiliki warna yang berbeda-beda sesuai dengan jenis nektar yang menyusunnya. Sihombing (2005) menyatakan bahwa warna madu asli juga ditentukan oleh kandungan mineral madu, semakin tinggi mineralnya maka warna madu semakin gelap. Sukrosa, fruktosa, glukosa dan CMC tidak berwarna atau bening sehingga campuran madu asli dengan bahan-bahan tersebut terlihat lebih terang warnanya. Gelatin berwarna kuning sehingga MGel memiliki warna yang tidak jauh berbeda dengan madu asli. Madu palsu MSS berwarna coklat kemerahan karena ditambahkan pewarna coklat kemerahan.
Berdasarkan aroma yang dihasilkan, semua sampel madu memiliki aroma tersendiri. Aroma semua sampel madu dapat dilihat pada Tabel 4.
Tabel 4. Aroma Madu
Madu Aroma
Madu Asli Harum segar khas madu
Madu Sukrosa (MS) Harum khas madu (tidak terlalu tajam) Madu Fruktosa (MF) Harum khas madu (tidak terlalu tajam) Madu Glukosa (MG) Harum khas madu (tidak terlalu tajam) Madu CMC (MC) Harum khas madu (tidak terlalu tajam) Madu Gelatin (MGel) Harum khas gelatin
Madu Sagu dan Sukrosa (MSS) Harum soda kue
31 dominan daripada aroma madu asli sehingga aroma madu gelatin lebih menyengat dibandingkan madu palsu lainnya. MSS juga memiliki aroma yang tidak sama seperti madu asli, aroma yang tercium seperti aroma soda kue. Hal ini disebabkan MSS diberi tambahan soda kue agar memiliki aroma dan berbuih.
Kekentalan semua sampel madu sama, akan tetapi MGel jika didiamkan lebih dari 12 jam pada suhu ruang akan membentuk gel, sehingga harus dipanaskan terlebih dahulu apabila ingin diuji. Viskositas yang cenderung sama menyulitkan konsumen untuk membedakan madu asli dan madu palsu. Berdasarkan Mey (2010), viskositas sendiri adalah sebuah ukuran penolakan cairan terhadap perubahan bentuk di bawah tekanan shear, dapat juga dikatakan kekentalan atau penolakan tehadap penuangan. Hal yang mempengaruhi viskositas yaitu suhu dan sifat fisik serta kimia suatu fluida.
Berdasarkan rasa, madu asli dan semua sampel madu palsu memiliki rasa tersendiri. Rasa masing-masing sampel madu terdapat dalam Tabel 5.
Tabel 5. Rasa Madu
Madu Rasa
Madu Asli Manis dan asam
Madu Sukrosa (MS) Manis dan asam
Madu Fruktosa (MF) Sangat manis dan asam
Madu Glukosa (MG) Manis dan asam
Madu CMC (MC) Tidak terlalu manis
Madu Gelatin (MGel) Tidak terlalu manis Madu Sagu dan Sukrosa (MSS) Manis gula pasir
32 sukrosa, glukosa, maltosa, galaktosa dan laktosa (Gaman dan Sherrington, 1992). MS dan MG memiliki rasa manis seperti gula dan terasa sedikit asam. MC dan MGel memiliki rasa yang tidak terlalu manis dan terasa lengket di mulut, sedangkan MSS memiliki rasa manis seperti gula pasir dan juga terasa agak lengket di mulut. Lengketnya MC, MGel, dan MSS karena gelatin, CMC, dan sagu merupakan bahan yang bersifat lengket yang sering digunakan sebagai perekat.
Hasil Uji Pemalsuan pada Madu Asli
Uji pemalsuan yang digunakan dalam penelitian ini adalah uji semut, uji larut, uji keruh, uji buih, uji pemanasan, uji tarik, uji lengket, uji segi enam, uji ikan mentah, dan uji iod. Semua uji tersebut terlebih dahulu dilakukan pada madu asli. Hasil uji pemalsuan yang ditunjukkan oleh madu asli dapat dilihat pada Tabel 6. Tabel 6. Hasil Uji Pemalsuan yang Diterapkan pada Madu Asli
Jenis Uji Pemalsuan Hasil
Semut Didatangi semut merah kecil
Larut Tidak larut
Keruh Keruh
Buih Berbuih dan tidak cepat hilang
Pemanasan Luber dari sendok
Legket Terasa lengket
Tarik Tidak membentuk benang tipis
Segi Enam Membentuk segi enam
Iod Tidak berubah warna
Ikan Mentah Ikan berkerut dan tidak bau
33 semut lain maka semut akan menunjukkan sifat agresif untuk mempertahankan daerahnya. Semut dapat berselisih dengan koloni lain untuk mendapatkan makanan. Perginya semut hitam kecil diduga karena semut merah kecil telah lebih dahulu menguasai daerah madu dan mengusir semut hitam kecil. Semut lain tidak banyak datang diduga karena gula-gula yang terdapat dalam madu bukan merupakan gula yang menjadi makanan semut lain. Newman dan Dalton (1967) menyatakan sulit untuk mengkategorikan semut berdasarkan makanannya. Sebagian semut adalah vegetarian pemakan sirup nektar, dan sebagian lainnya memakan makanan yang berasal dari hewan atau serangga lain yang telah mati. Semut memakan protein dan karbohidrat yang bervariasi. Semut membawa makanan ke sarang seperti lebah madu.
Respon madu asli pada uji larut adalah madu tidak langsung larut ketika dituangkan ke dalam gelas yang berisi air bersuhu 35 oC. Kelarutan tergantung pada suhu, tekanan, konsentrasi bahan-bahan lain dalam larutan dan komposisi kelarutannya. Kelarutan bergantung juga pada sifat dan konsentrasi zat-zat lain, terutama ion-ion dalam campuran tersebut (Winarno, 1997). Rahmani (2004) menyatakan bahwa kelarutan madu asli rendah disebabkan rheologi asli madu yang berbentuk kental dengan viskositas tinggi dan adanya komponen-komponen lain dalam madu (meski dalam jumlah yang sangat sedikit) seperti protein, vitamin dan mineral yang tidak dimiliki oleh madu palsu.
Madu asli memberikan respon keruh ketika dilakukan uji keruh. Hal tersebut disebabkan madu mengandung beberapa zat warna. Zat penyebab warna madu sebagian besar belum diketahui, namun ada yang menduga terdiri dari fraksi yang larut air dan larut lemak. Pada madu berwarna cerah, zat warna larut air lebih sedikit dari yang larut lemak. Ada juga yang menduga penyebabnya adalah berbagai senyawa polifenol, terutama pada madu berwarna pekat (Sihombing, 2005).
34 terdenaturasi. Udara ditangkap dan dikelilingi oleh film dan membentuk gelembung. Pembentukan mono layer kedua dilanjutkan di sekitar gelembung untuk mengganti bagian film yang terkoagulasi. Film protein dari gelembung yang berdekatan akan berhubungan dan mencegah keluarnya cairan. Peningkatan kekuatan interaksi antara polipeptida akan menyebabkan agregasi (pengumpulan) protein dan melemahnya permukaan film yang diikuti dengan pecahnya gelembung buih (Cherry dan McWatters, 1981). Menurut Sukartiko (1986), protein menyebabkan kecenderungan membentuk gelembung udara kecil dan buih pada madu. Kandungan protein pada madu 0,26% (Gojmerac, 1983). Krell (1996) menambahkan bahwa bersama-sama dengan kekentalan, tegangan permukaan berperan dalam membentuk karakteristik buih pada madu. Pengocokan pada saat uji buih menurunkan tegangan permukaan madu dengan adanya kandungan protein dalam madu maka terbentuklah buih. Berdasarkan Wasitaatmadja (1997), buih yang tidak cepat hilang atau cenderung stabil disebabkan adanya zat pembuih atau surfaktan. Zat ini terabsorbsi ke daerah antar-fase dan mengikat gelembung-gelembung gas sehingga diperoleh suatu kestabilan. Surfaktan memiliki sifat mengubah energi permukaan dengan cara menurunkan tegangan permukaan cairan. Buih yang bertahan lama diduga karena adanya zat pembuih pada madu asli.
Hasil yang ditunjukkan madu asli ketika dilakukan uji pemanasan terjadi letupan-letupan gelembung yang kemudian tumpah dari sendok (meluber). Buih atau gelembung yang timbul akibat pemanasan menunjukkan adanya protein dalam madu asli. Pada saat dipanaskan kadar air madu berkurang, protein terdenaturasi, dan terjadi penurunan tegangan permukaan sehingga terbentuk buih yang meletup dan meluber dari sendok. Terbentuknya buih sampai meluber dari sendok disebabkan juga oleh kandungan gula pada madu asli. Jika gula dipanaskan sederet reaksi akan terjadi yang pada akhirnya membentuk karamel (deMan, 1997). Pada proses tersebut terjadi pengurangan kadar air yang ditunjukkan dengan terbentuknya buih.
35 31,28%, sukrosa 1,31%, dan gula lain 8,81%. Hasil analisis kimia menunjukkan bahwa madu asli mengandung sukrosa 0%, fruktosa 46,62%, dan glukosa 16,87%.
Hasil lainya yang ditunjukkan madu asli terhadap uji tarik adalah madu tidak membentuk benang tipis. Tidak terbentuknya benang tipis disebabkan suhu pemanasan dalam uji ini sekitar 60 oC sehingga pada suhu ini gula-gula dalam madu leleh, maka bentuk madu cair dan tidak menempel pada lidi ketika ditarik. Menurut Sihombing (2005), permen madu dapat dilelehkan dengan memanaskan pada suhu 50 oC.
Respon yang diberikan madu asli pada uji segi enam ini adalah madu membentuk segi enam seperti sarang lebah. Segi enam yang ditunjukkan oleh madu asli terlihat jelas dan tahan lama. Hal tersebut diduga karena madu terbentuk dalam sarang lebah yang berbentuk segi enam dan adanya pengaruh dari gelombang air ketika piring diputar membentuk angka delapan (gaya yang berpengaruh adalah gaya sentripetal) karena jika putaran dihentikan maka segi enam perlahan-lahan tidak terlihat kembali. Wulan (2009) menyatakan bahwa terbentuknya segi enam karena hal tersebut merupakan sifat madu asli. Komunikasi pribadi dengan National Honey Board United States of America (NHB-USA) menyatakan bahwa penyebab pasti terbentuknya segi enam oleh madu pada uji segi enam belum diketahui.
36 dalam madu menjadi gula-gula sederhana sehingga ketika iod diteteskan tidak terjadi perubahan warna. Madu asli memberikan respon tidak berubah warna ketika dilakukan uji iod karena madu asli mengandung enzim invertase dan diastase yang berfungsi memecah pati menjadi gula yang sederhana. Diastase berperan dalam mengubah polisakarida menjadi karbohidrat yang lebih sederhana (Achmadi, 1991). Sihombing (2005) menambahkan bahwa enzim invertase akan mengubah sukrosa menjadi glukosa dan fruktosa.
Hasil yang ditunjukkan oleh madu asli ketika dilakukan uji ikan mentah adalah ikan berkerut. Hal tersebut disebabkan sifat higroskopis madu. Madu bersifat higroskopis (mudah menarik air) karena secara alami mengandung konsentrasi gula yang tinggi (Sihombing, 2005). Kadar air daging ikan emas yang belum mendapat perlakuan penyimpanan adalah 75,18% (Murniyani et al., 2008), sedangkan kadar air madu asli 25,08%. Madu akan menarik air dari ikan karena ikan memiliki kadar air yang lebih tinggi dari madu, sehingga semakin lama kadar air ikan menurun dan ikan semakin berkerut atau kaku. Kadar air madu yang rendah menyebabkan mikroba pembusuk tidak dapat hidup di dalamnya, ditambah lagi madu juga mengandung zat antimikroba (Molan, 2006). Madu dapat menjadi agen anti mikroba, antara lain karena kandungan gulanya yang tinggi, sehingga dapat membatasi jumlah air yang tersedia untuk pertumbuhan mikroba. Nilai pH madu yang rendah berkisar antara 3,2-4-5 dan kandungan protein madu yang rendah sekitar 0,26%, yang dapat menghalangi pertumbuhan bakteri (National Honey Board, 1997). Menurut Buckle et al. (1987), bakteri dapat tumbuh pada bahan pangan yang memiliki aktivitas air (aw) 0,95-0,99 dan umumnya mikroorganisme dapat tumbuh pada pH sekitar 5-8. Madu
37 Standarisasi Indonesia (2004) menyebutkan bahwa kadar air madu yang baik maksimal 22%, dengan HMF maksimal 50 mg/kg, gula sukrosa maksimal 5% dan gula pereduksi (dihitung sebagai kadar fruktosa dan glukosa) minimal 65%. Nilai pH madu berdasarkan Mathenson (1984) berkisar antara 3,2-4-5. Hasil uji fisik dan kimia dari madu asli dan berbagai sampel madu palsu dapat dilihat pada Tabel 7. Tabel 7. Hasil Uji Kimia
Madu palsu dengan penambahan gula dan pengental
MSS 8,23 32,72 0 50,13 4,59 3,30
Keterangan : * = berdasarkan bobot segar, MA = Madu Asli, MS = Madu Sukrosa, MF = Madu Fruktosa, MG = Madu Glukosa, MC = Madu CMC, MGel = Madu Gelatin, MSS = Madu Sagu dan Sukrosa.
38 penambahan gelatin menaikan nilai pH madu. Nilai pH CMC berkisar antara 6 sampai 8 (Hebei, 2011), sehingga penambahan CMC tidak banyak meningkatkan nilai pH. Nilai pH MC dan MGel berada pada kisaran madu asli sehingga pengukuran nilai pH juga tidak dapat untuk membedakan MC dan MGel dengan madu asli. Madu dengan pemalsuan menyeluruh yakni MSS memiliki pH basa yakni 8,23 karena tidak dilakukan penambahan asam pada MSS dan berdasarkan Riana (2005) soda kue bersifat basa. MSS menggunakan soda kue sehingga pH nya basa. Hal tersebut menunjukkan bahwa pengukuran pH dapat digunakan untuk membedakan MSS dengan madu asli.
39 dibuat dengan kadar air yang sama dengan madu asli ternyata memiliki kekentalan yang jauh lebih tinggi dari madu asli. Agar mendapatkan kekentalan yang sama dengan madu asli, air yang ditambahkan cukup banyak sehingga kadar air MSS menjadi lebih tinggi dari madu asli.
Pengukuran kadar air ini menunjukkan bahwa madu yang dipalsukan dengan gula MS, MF dan MG tidak dapat dideteksi berdasarkan pengukuran kadar air, karena kadar air madu palsu ini sama dengan kadar air madu asli. MC, MGel dan MSS dapat dibedakan dengan madu asli secara mudah dari pengukuran kadar air karena kadar air madu palsu ini lebih tinggi dibandingkan kadar air madu asli meskipun kekentalannya hampir sama.
Pengujian HMF (hidroxymetilfurfural) menunjukkan bahwa semua sampel madu memiliki nilai HMF nol, dengan demikian pengukuran kadar HMF tidak dapat digunakan untuk membedakan madu palsu dan madu asli (madu kapuk). Hidroximetilfurfural (HMF) yang terdapat dalam madu merupakan senyawa kimia yang dihasilkan dari dekomposisi monosakarida madu yang jumlah atom C-nya enam (glukosa dan fruktosa), dalam suasana asam dan dengan bantuan kalor (panas) (Achmadi, 1991). Hal ini menunjukkan bahwa madu asli (kapuk) yang digunakan tidak mengandung HMF karena pada saat pemanenan dan penanganan tidak terjadi pemanasan. Madu asli yang digunakan merupakan madu yang baru dipanen dengan lama simpan belum sampai satu bulan sehingga HMF belum sempat terbentuk. Semua sampel madu palsu pun tidak memiliki HMF karena madu asli yang digunakan dalam pembuatan MS, MG, MF, MC, dan MGel belum mengandung HMF. Madu asli dalam pembuatan sampel madu palsu pun tidak melalui proses pemanasan karena pencampuran bahan pemalsuan dilakukan pada suhu ruang. MSS juga tidak mengandung HMF karena memiliki kandungan monosakarida hanya sedikit dan memiliki pH basa.
40 karbohidrat yang terdapat dalam madu. Berdasarkan hasil uji gula, madu asli mengandung 46,62% fruktosa dan 16,87% glukosa serta tidak mengandung sukrosa. Jumlah maksimal sukrosa dalam madu pada standar mutu madu Indonesia adalah 5%. Dengan demikian kadar sukrosa madu asli tidak melebihi standar mutu madu.
Kandungan gula masing-masing madu palsu sesuai dengan bahan-bahan yang digunakan dalam pembuatan madu palsu. MS mengandung nilai sukrosa 27,08% sedangkan pada madu asli sama sekali tidak mengandung sukrosa. Hasil ini menunjukkan adanya penambahan sukrosa pada MS. Nilai glukosa MG sebesar 24,34%, lebih besar dari pada kadar glukosa madu asli disebabkan penambahan glukosa cair dalam pembuatan madu MG. Nilai glukosa pada MF lebih tinggi dibandingkan madu asli, karena fruktosa cair yang digunakan tidak murni sehingga memungkinkan terdapat gula lain selain fruktosa. Kadar fruktosa dan glukosa pada MF dan MG, masih dalam kisaran kadar gula madu asli yakni fruktosa sekitar 38,19% dan glukosa 31,28% (Gojmerac, 1983).
MC dan MGel memiliki kandungan fruktosa maupun glukosa yang rendah (9,44%-15,30%) karena kadar air madu CMC dan gelatin sangat tinggi. Kadar gula MC dan MGel jauh dibawah SNI, dimana kadar gula pereduksi (dihitung sebagai glukosa dan fruktosa) minimal 65% (Badan Standarisasi Nasional, 2004). MSS mengandung nilai glukosa dan fruktosa yang rendah sedangkan nilai sukrosa sangat tinggi sebesar 50,13%, melebihi standar sukrosa pada SNI yakni maksimal 5% (Badan Standarisasi Nasional, 2004). Hal tersebut disebabkan penggunaan gula pasir (sukrosa) yang banyak dalam pembuatan madu palsu.
41 Uji Pemalsuan Madu
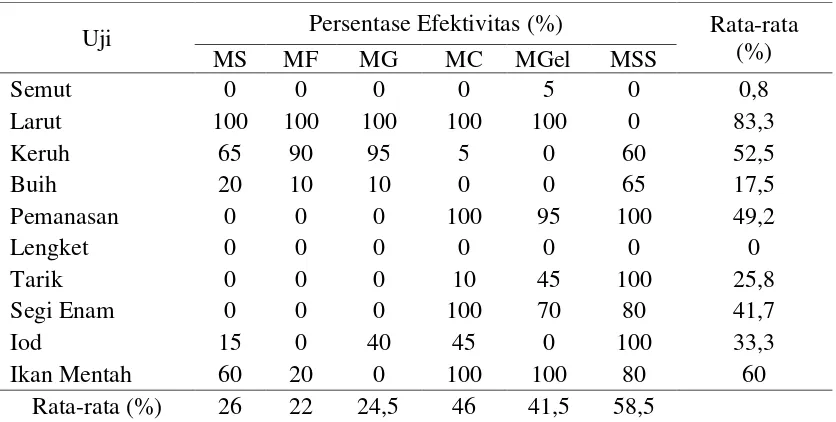
Uji pemalsuan madu yang digunakan adalah uji semut, uji larut, uji keruh, uji buih, uji pemanasan, uji lengket, uji tarik, uji segi enam, uji iod, dan uji ikan mentah. Efektivitas uji pemalsuan madu yang dilakukan pada setiap madu palsu dapat dilihat pada Tabel 8. Semakin tinggi nilai persentase efektivitas maka uji tersebut semakin efektif untuk membedakan madu asli dan palsu.
Tabel 8. Efektivitas Uji Pemalsuan pada Sampel Madu Palsu
Keterangan : MS = Madu Sukrosa, MF = Madu Fruktosa, MG = Madu Glukosa, MC = Madu CMC, MGel = Madu Gelatin, MSS = Madu Sagu dan Sukrosa.
Uji Semut
Terdapat dua respon yang ditunjukkan pada uji semut. Madu palsu didatangi semut merah kecil, kecuali MGel juga didatangi semut hitam kecil. Semut hitam kecil pun sempat mendatangi MGel tetapi tidak lama, semut hitam kecil hanya berkeliling kemudian mencium MGel sebentar dan pergi. Semut hitam kecil pergi diduga karena adanya dominasi dari semut merah kecil. Berdasarkan Sleigh (2003) semut merupakan serangga berkoloni, ketika daerahnya didatangi oleh koloni semut lain maka semut akan menunjukkan sifat agresif untuk mempertahankan daerahnya. Hasil uji semut dapat dilihat pada Gambar 12.
42 (A) (B)
Gambar 12. Hasil Uji Semut : (A) Madu Didatangi Semut Merah Kecil dan (B) Madu Didatangi Semut Hitam Kecil
Presentase madu palsu yang didatangi semut merah kecil yaitu MS 75%, MF 100%, MG 20%, MC 35%, MGel 15% dan MSS 75%.
Madu palsu didatangi banyak semut merah kecil diduga karena gula-gula yang terdapat pada madu palsu merupakan makanan dari semut merah kecil. Tidak datangnya semut hitam kecil secara berkoloni diduga karena bahan yang terdapat dalam madu palsu bukan merupakan makannya. Seperti yang terlihat dari pengamatan sehari-hari bahwa semut hitam kecil lebih banyak memakan gula dalam bentuk kristal.
Persentase efektivitas uji semut terhadap semua sampel madu palsu dapat dilihat pada Gambar 13.
Keterangan : MS = Madu Sukrosa, MF = Madu Fruktosa, MG = Madu Glukosa, MC = Madu CMC, MGel = Madu Gelatin, dan MSS = Madu Sagu dan Sukrosa.
43 Nilai persentase efektivitas uji semut rendah (0%-5%) karena respon yang ditunjukkan madu asli dan madu palsu sama yakni didatangi semut merah kecil. Hal tersebut menunjukkan bahwa uji semut tidak efektif digunakan untuk membedakan madu asli dan madu palsu.
Uji Larut
Respon yang ditunjukkan oleh madu palsu pada uji larut ada dua, yakni madu langsung larut dan madu tidak larut ketika dituangkan ke dalam gelas. Seperti yang dapat dilihat pada Gambar 14.
(A) (B)
Gambar 14. Hasil Uji Larut : (A) Madu Larut dan (B) Madu Tidak Larut
Semua MS, MF, MG, MC, dan MGel langsung larut pada saat dituangkan ke dalam gelas berisi air bersuhu 35 oC, ditandai dengan keruhnya air ketika madu sampai di dalam gelas, kecuali MSS tidak larut pada saat dituangkan ke dalam gelas.