KARAKTERISTIK KETAHANAN BAKTERI ASAM LAKTAT
INDIGENOUS DADIAH SEBAGAI KANDIDAT PROBIOTIK
PADA KONDISI SALURAN PENCERNAAN in vitro
SKRIPSI DEWI SUNARYO
DEPARTEMEN ILMU PRODUKSI DAN TEKNOLOGI PETERNAKAN FAKULTAS PETERNAKAN
RINGKASAN
Dewi Sunaryo. D14061004. 2011. Karakteristik Ketahanan Bakteri Asam Laktat Indigenous Dadiah sebagai Kandidat Probiotik pada Kondisi Saluran Pencernaan in vitro. Skripsi. Departemen Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan, Institut Pertanian Bogor.
Pembimbing Utama : Dr. Ir. Rarah Ratih Adjie Maheswari, DEA. Pembimbing Anggota : Irma Isnafia Arief, S.Pt., MSi.
Dadiah merupakan makanan tradisional khas Sumatra Barat yang memiliki potensi untuk dikembangkan sebagai pangan fungsional, bila ditunjang dengan adanya kandungan bakteri probiotik. Dadiah diperoleh dengan cara memfermentasi-kan susu kerbau secara tradisional dalam bambu dan ditutup dengan daun pisang. Isolasi bakteri asam laktat (BAL) indigenous dadiah dari susu kerbau mendapatkan Lactobacillus plantarum D-01 dan Lactococcus lactis D-01 (Maheswari, 2008) yang berpotensi sebagai bakteri probiotik, sehingga dapat digunakan dalam pembuatan dadiah untuk menghasilkan pangan fungsional. Bakteri probiotik harus memiliki sifat non patogen, menghasilkan asam dengan cepat, tahan terhadap garam empedu, tahan terhadap antibiotik, mampu menempel pada epitel dinding saluran pencernaan, serta mampu memproduksi substansi antimikroba termasuk asam organik, hidrogen peroksida dan bakteriosin. Apabila kedua kultur starter dadiah tersebut tidak terbukti sebagai bakteri probiotik, maka Bifidobacterium longum Y-01 dan Lactobacillus acidophilus Y-01 yang merupakan hasil isolasi dari produk olahan susu sapi (Maheswari, 2008) dapat ditambahkan untuk menghasilkan kultur starter campuran, sehingga sangat menarik untuk diteliti juga peluangnya sebagai bakteri probiotik.
Penelitian ini bertujuan untuk mempelajari potensi L. plantarum D-01, L. lactis D-01, B. longum Y-01 dan L. acidophilus Y-01 sebagai bakteri probiotik melalui kemampuannya untuk dapat bertahan pada kondisi keasaman lambung yang berbeda (pH 2; 2,5; 3,2 dan 7,2), toleransi pada garam empedu di usus halus, bertahan terhadap antibiotik serta menghasilkan antimikroba yang menankan pertumbuhan bakteri patogen (Escherichia coli ATCC 25922, Staphylococcus aureus ATCC 25923 dan Salmonella Typhimurium ATCC 14028). Penelitian ini dilaksanakan di Laboratorium Mikrobiologi Bagian Teknologi Hasil Ternak dan Laboratorium Terpadu, Departemen Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan, Institut Pertanian Bogor serta Laboratorium Kimia Analitik, Fakultas Matematika dan IPA, Institut Pertanian Bogor mulai bulan Maret 2010 sampai bulan Agustus 2010.
Penelitian ini didahului dengan persiapan kultur starter yang terdiri atas pengujian morfologi melalui pewarnaan Gram, uji katalase dan standardisasi populasi bakteri asam laktat. Penelitian utama melaksanakan pengujian ketahanan BAL indigenous dadiah dan produk olahan susu sapi terhadap berbagai kondisi keasaman lambung, keberadaan garam empedu atau antibiotik berbeda dan pengujian aktivitas antagonistik BAL terhadap bakteri patogen. Data yang diperoleh dianalisis dengan uji-t dan Rancangan Acak Lengkap (RAL).
ii hidup pada kondisi keasaman lambung yang berbeda, adanya garam empedu dan antibiotik ditunjukkan oleh jumlah bakteri yang hidup adalah lebih dari 75%. Bakteri B. longum Y-01 dan L. acidophilus Y-01 selain mampu bertahan, juga mampu mengalami peningkatan jumlah populasi pada kondisi keasaman lambung yang berbeda, adanya garam empedu dan antibiotik. Keempat BAL yang diujikan lebih tahan terhadap antibiotik kloramfenikol daripada amoksisilin.
Pengujian aktivitas antagonistik BAL indigenous dadiah dan olahan susu sapi menunjukkan kemampuannya dalam menghambat bakteri patogen indikator. Diameter zona penghambatan yang dihasilkan nyata dipengaruhi oleh filtrat bebas sel dari spesies BAL yang dikonfrontasikan terhadap Escherichia coli ATCC 25922 dan Salmonella Typhimurium ATCC 14028 (P<0,01) atau Staphylococcus aureus ATCC 25923 (P<0,05). Hasil penelitian menyimpulkan bahwa L. plantarum D-01, L. lactis D-01, B. longum Y-01 dan L. acidophilus Y-01 memenuhi kriteria sebagai bakteri probiotik yaitu mampu bertahan (>75% bakteri yang hidup) di dalam kondisi keasaman lambung yang berbeda, toleransi terhadap garam empedu atau antibiotik dan menghasilkan senyawa antimikroba yang bersifat antagonistik terhadap bakteri patogen indikator.
ABSTRACT
Resistency of Lactic Acid Bacteria Indigenous Dadiah as Probiotics Candidate at in vitro Gastrointestinal Tract Conditions
Sunaryo, D., R.R.A. Maheswari and I.I. Arief
Probiotic bacteria defined as living microorganisms which will confer health benefit to the host when administered in adequate amounts. The aims of this research were to study the potential of Lactobacillus plantarum D-01, Lactococcus lactis D-01, Bifidobacterium longum Y-01, and Lactobacillus acidophilius Y-01 as probiotic bacteria through its ability to survive in gastrointestinal conditions (acid conditions of stomach and the presence of bile salts in the small intestine), its resistance to antibiotics, and its antimicrobial properties against pathogen bacterias. This study initiated with assays of four tested Lactic Acid Bacterias for its ability to grow and survive in acid conditions and the presence of bile salts or antibiotics, also its antagonistic activities against indicator strains of pathogen bacterias (Escherichia coli ATCC 25922, Staphylococcus aureus ATCC 25923 and Salmonella Thypimurium ATCC 14028). Result showed the ability of L. plantarum D-01, L. lactis D-01, B. longum Y-01 and L. acidophilus Y-01 to grow in acid conditions and tolerance at the presence of bile salts and antibiotics (t-test). Research found that difference species LABs tested influenced diameter of the inhibition zone against pathogen indicator bacterias (P<0.01). L. acidophilus Y-01 had the largest inhibition
zone against S. Thypimurium ATCC 14028 and E. coli ATCC 25922, while B. longum Y-01 was able to produce the largest inhibition zone against S. aureus
ATCC 25923 (P<0,05). Based on the characterization of four species LAB, it could
be concluded that L. plantarum D-01, L. lactis D-01, B. longum Y-01, and L. acidophilius Y-01 can be used as probiotic.
KARAKTERISTIK KETAHANAN BAKTERI ASAM LAKTAT
INDIGENOUS DADIAH SEBAGAI KANDIDAT PROBIOTIK
PADA KONDISI SALURAN PENCERNAAN in vitro
DEWI SUNARYO D14061004
Skripsi ini merupakan salah satu syarat untuk memperoleh gelar Sarjana Peternakan pada
Fakultas Peternakan Institut Pertanian Bogor
DEPARTEMEN ILMU PRODUKSI DAN TEKNOLOGI PETERNAKAN FAKULTAS PETERNAKAN
Judul : Karakteristik Ketahanan Bakteri Asam Laktat Indigenous Dadiah sebagai Kandidat Probiotik pada Kondisi Saluran Pencernaan in vitro Nama : Dewi Sunaryo
NIM : D 14061004
Menyetujui,
Pembimbing Utama, Pembimbing Anggota,
(Dr. Ir. Rarah. R. A. Maheswari, DEA.) (Irma Isnafia Arief, S. Pt. MSi.) NIP. 19620504198703 2 002 NIP. 19750304199903 2 001
Mengetahui Ketua Departemen,
Ilmu Produksi dan Teknologi Peternakan
(Prof. Dr. Ir. Cece Sumantri, M.Agr.Sc.) NIP. 19591212198603 1 004
RIWAYAT HIDUP
Penulis dilahirkan di Bogor, Jawa Barat pada tanggal 11 Juli 1987 dari pasangan yang sangat berbahagia Bapak Djoni Junianto Sunaryo dan Ibu Velly Folandia. Penulis merupakan anak keempat dari empat bersaudara. Penulis mengenal pendidikan formal di Taman Kanak-kanak Regina Pacis Bogor pada tahun 1992-1994, kemudian melanjutkan ke pendidikan dasar pada tahun 1994-2000 di SD Regina Pacis Bogor, pendidikan lanjutan menengah pertama ditempuh pada tahun 2000-2003 di SMP Mardi Waluya Bogor dan pendidikan lanjutan menengah atas pada tahun 2003-2006 di SMU Budi Mulia Bogor. Penulis diterima sebagai mahasiswa dengan mayor Teknologi Produksi Ternak, Departemen Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan, dan minor Gizi Masyarakat, Fakultas Ekologi Manusia, Institut Pertanian Bogor melalui jalur Undangan Seleksi Masuk IPB (USMI) pada tahun 2006.
KATA PENGANTAR
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas segala limpahan nikmat dan rahmat-Nya hingga akhirnya penulisan skripsi ini dapat diselesaikan dengan baik. Penulis juga mengucapkan terima kasih kepada seluruh pihak yang telah memberi dukungan, baik secara moril maupun material sehingga skripsi yang berjudul “Karakteristik Ketahanan Bakteri Asam Laktat Indigenous Dadiah sebagai Kandidat Probiotik pada Kondisi Saluran Pencernaan in vitro” ini dapat diselesaikan guna memenuhi salah satu syarat memperoleh gelar Sarjana Peternakan pada Fakultas Peternakan Institut Pertanian Bogor.
Penelitian ini didasarkan pada pentingnya konsumsi pangan fungsional yang mampu meningkatkan status kesehatan manusia. Produk susu fermentasi yang mengandung bakteri probiotik dianggap sebagai pangan fungsional. Salah satu produk susu fermentasi tradisional yang memiliki potensi untuk dikembangkan sebagai pangan fungsional adalah dadih (dadiah dalam bahasa Minangkabau). Dadih merupakan makanan tradisional khas Sumatra Barat. Dadiah memiliki tekstur semi padat yang diakibatkan oleh proses fermentasi bakteri asam laktat indigenous berbahan baku susu kerbau. BAL yang berhasil diisolasi dari dadiah susu kerbau yaitu bakteri L. plantarum dan L. lactis (Maheswari, 2008). Kedua bakteri tersebut memiliki peluang sebagai bakteri probiotik dengan persyaratan harus memenuhi beberapa kriteria diantaranya mampu bertahan atau berkembang di dalam saluran pencernaan. Produk probiotik dapat mengandalkan kultur starter tunggal untuk menghasilkan produk probiotik ataupun dapat juga dikombinasikan dengan kultur indigenous lainnya seperti L. acidophilus dan B. longum. Terciptanya dadiah probiotik akan meningkatkan status produk tidak hanya untuk memenuhi rasa lapar, tetapi mempunyai nilai tambah untuk meningkatkan kesehatan masyarakat.
Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan. Semoga skripsi ini memberikan kontribusi pada kemajuan ilmu pengetahuan dan bermanfaat bagi seluruh pihak khususnya dalam peningkatan produk-produk pangan fungsional melalui penggunaan bakteri probiotik.
DAFTAR ISI
Halaman
RINGKASAN ... i
ABSTRACT ... iii
LEMBAR PERNYATAAN ... iv
LEMBAR PENGESAHAN ... v
RIWAYAT HIDUP ... vi
KATA PENGANTAR ... vii
DAFTAR ISI ... viii
DAFTAR TABEL ... x
DAFTAR GAMBAR ... xi
DAFTAR LAMPIRAN ... xii
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan ... 2
TINJAUAN PUSTAKA ... 3
Dadih ... 3
Bakteri Asam Laktat ... 3
Bifidobacterium longum ... 4
Lactobacillus acidophilus ... 5
Lactobacillus plantarum ... 5
Lactococcus lactis ... 5
Mikroflora Usus Manusia ... 5
Probiotik ... 7
Antibiotik ... 9
Kloramfenikol ... 10
Amoksisilin ... 10
Aktivitas Antimikroba Bakteri Asam Laktat ... 11
Bakteri Patogen ... 12
Escherichia coli ... 12
Staphylococcus aureus ... 13
Salmonella enteritidis serotipe Typhimurium ... 13
METODE ... 15
Waktu dan Lokasi ... 15
Materi ... 15
Prosedur ... 16
Persiapan Kultur Bakteri ... 16
ix
Metode Hitungan Cawan ... 17
Metode Turbidimetrik ... 18
Pengujian Ketahanan Kultur Starter BAL Indigenous Dadiah terhadap Kondisi Keasaman Lambung yang Berbeda ... 18
Pengujian Ketahanan Kultur Starter BAL Indigenous Dadiah terhadap Garam Empedu ... 19
Pengujian Ketahanan Kultur Starter BAL Indigenous Dadiah terhadap Antibiotik Berbeda ... 19
Pengujian Aktivitas Antagonistik BAL Indigenous Dadiah terhadap Bakteri Patogen ... 20
Diagram Alir Penelitian ... 22
Rancangan Percobaan ... 22
HASIL DAN PEMBAHASAN ... 24
Konfirmasi Kultur Starter BAL Indigenous Dadiah dan Bakteri Patogen Indikator ... 24
Ketahanan Kultur Starter BAL Indigenous Dadiah terhadap Kondisi Keasaman Lambung yang Berbeda ... 28
Ketahanan Kultur Starter BAL Indigenous Dadiah terhadap Garam Empedu ... 34
Ketahanan Kultur Starter BAL Indigenous Dadiah terhadap Antibiotik Berbeda ... 39
Aktivitas Antagonistik BAL Indigenous Dadiah terhadap Bakteri Patogen ... 46
KESIMPULAN DAN SARAN ... 51
Kesimpulan ... 51
Saran ... 51
UCAPAN TERIMA KASIH ... 52
DAFTAR PUSTAKA ... 53
DAFTAR TABEL
Nomor Halaman
1. Persamaan Linier BAL Indigenous Dadiah dan Produk Olahan
Susu Sapi ... 18 2. Karakteristik Kultur Starter BAL Indigenous Dadiah dan
Bakteri Patogen Indikator ... 25 3. Jumlah Populasi BAL Indigenous Dadiah dan Produk Olahan Susu
Sapi pada Kondisi Keasaman Lambung yang Berbeda ... 29 4. Persentase BAL yang Hidup pada Kondisi Keasaman Lambung
yang Berbeda ... 30 5. Jumlah Populasi BAL Indigenous Dadiah dan Produk Olahan Susu
Sapi tanpa atau dengan Penambahan Garam Empedu ... 35 6. Persentase BAL yang Hidup pada Media tanpa atau dengan
Penambahan Garam Empedu ... 36 7. Jumlah Populasi BAL Indigenous Dadiah dan Produk Olahan Susu
Sapi tanpa atau dengan Penambahan Antibiotik ... 40 8. Persentase BAL yang Hidup pada Media tanpa atau dengan
Penambahan Antibiotik ... 42 9. Aktivitas Antagonistik BAL Indigenous Dadiah dan Produk
Olahan Susu Sapi terhadap S. TyphimuriumATCC 14028 ... 46 10. Aktivitas Antagonistik BAL Indigenous Dadiah dan Produk
Olahan Susu Sapi terhadap E. coli ATCC 25922 ... 47 11. Aktivitas Antagonistik BALIndigenous Dadiah dan Produk
DAFTAR GAMBAR
Nomor Halaman
1. Waktu yang Dibutuhkan Makanan dan Panjang Saluran
Pencernaan Manusia ... 6 2. Populasi Bakteri pada Berbagai Saluran Pencernaan
Manusia ... 7 3. Cara Pengukuran Zona Hambat Antimikroba ... 21 4. Diagram Alir Penelitian ... 22 5. Grafik Pertumbuhan Kultur Starter BAL Indigenous Dadiah
dan Produk Olahan Susu Sapi pada Kondisi Keasaman Lambung
yang berbeda ... 32 6. Grafik Pertumbuhan Kultur Starter BAL Indigenous Dadiah
dan Produk Olahan Susu Sapi dalam Garam Empedu dan
Kontrol ... 37 7. Grafik Kurva Pertumbuhan Kultur Starter BAL Indigenous
Dadiah dan Produk Olahan Susu Sapi dalam Antibiotik Berbeda
dan Kontrol ... 43 8. Zona penghambatan BAL Indigenous Dadiah dan Produk Olahan
Susu Sapi terhadap S. Typhimurium ATCC 14028 ... 47 9. Zona penghambatan BAL Indigenous Dadiah dan Produk Olahan
Susu Sapi terhadap E. coli ATCC 25922 ... 48 10. Zona penghambatan BAL Indigenous Dadiah dan Produk Olahan
DAFTAR LAMPIRAN
Nomor Halaman
1. Hasil Uji-t Jumlah Populasi Bakteri L. plantarum D-01 dalam
pH 2 ... 58 2. Hasil Uji-t Jumlah Populasi Bakteri L. lactis D-01dalam pH 2 .... 58 3. Hasil Uji-t Jumlah Populasi Bakteri B. longum Y-01 dalam
pH 2 ... 58 4. Hasil Uji-t Jumlah Populasi Bakteri L. acidophilus Y-01 dalam
pH 2. ... 58 5. Uji Kruskal Wallis Persentase BAL yang Hidup pada pH 2 ... 58 6. Hasil Uji-t Jumlah Populasi Bakteri L. plantarum D-01 dalam
pH 2,5 ... 59 7. Hasil Uji-t Jumlah Populasi Bakteri L. lactis D-01dalam pH 2,5 . 59 8. Hasil Uji-t Jumlah Populasi Bakteri B. longum Y-01 dalam
pH 2,5 ... 59 9. Hasil Uji-t Jumlah Populasi Bakteri L. acidophilus Y-01 dalam
pH 2,5 ... 59 10. Uji Kruskal Wallis Persentase BAL yang Hidup pada pH 2,5 ... 59 11. Hasil Uji-t Jumlah Populasi Bakteri L. plantarum D-01 dalam
pH 3,2 ... 60 12. Hasil Uji-t Jumlah Populasi Bakteri L. lactis D-01dalam
pH 3,2 ... 60 13. Hasil Uji-t Jumlah Populasi Bakteri B. longum Y-01 dalam
pH 3,2 ... 60 14. Hasil Uji-t Jumlah Populasi Bakteri L. acidophilus Y-01 dalam
pH 3,2 ... 60 15. Analisis Ragam Persentase BAL yang Hidup pada pH 3,2 ... 60 16. Hasil Uji-t Jumlah Populasi Bakteri L. plantarum D-01 dalam
pH 7,2 ... 61 17. Hasil Uji-t Jumlah Populasi Bakteri L. lactis D-01dalam
pH 7,2 ... 61 18. Hasil Uji-t Jumlah Populasi Bakteri B. longum Y-01 dalam
pH 7,2 ... 61 19. Hasil Uji-t Jumlah Populasi Bakteri L. acidophilus Y-01 dalam
xiii 21. Hasil Uji-t Jumlah Populasi Bakteri L. plantarum D-01 dalam
Media tanpa Garam Empedu ... 62 22. Hasil Uji-t Jumlah Populasi Bakteri L. lactis D-01 dalam
Media tanpa Garam Empedu ... 62 23. Hasil Uji-t Jumlah Populasi Bakteri B. longum Y-01 dalam
Media tanpa Garam Empedu ... 62 24. Hasil Uji-t Jumlah Populasi Bakteri L. acidophilus Y-01 dalam
Media tanpa Garam Empedu ... 62 25. Analisis Ragam Persentase BAL yang Hidup pada Media tanpa
Garam Empedu ... 62 26. Hasil Uji-t Jumlah Populasi Bakteri L. plantarum D-01 dalam
Garam Empedu ... 63 27. Hasil Uji-t Jumlah Populasi Bakteri L. lactis D-01dalam
Garam Empedu ... 63 28. Hasil Uji-t Jumlah Populasi Bakteri B. longum Y-01 dalam
Garam Empedu ... 63 29. Hasil Uji-t Jumlah Populasi Bakteri L. acidophilus Y-01 dalam
Garam Empedu ... 63 30. Uji Kruskal Wallis Persentase BAL yang Hidup dalam Garam
Empedu ... 63 31. Hasil Uji-t Jumlah Populasi Bakteri L. plantarum D-01 dalam
Media tanpa Antibiotik ... 64 32. Hasil Uji-t Jumlah Populasi Bakteri L. lactis D-01 dalam
Media tanpa Antibiotik ... 64 33. Hasil Uji-t Jumlah Populasi Bakteri B. longum Y-01 dalam
Media tanpa Antibiotik ... 64 34. Hasil Uji-t Jumlah Populasi Bakteri L. acidophilus Y-01 dalam
Media tanpa Antibiotik ... 64 35. Uji Kruskal Wallis Persentase BAL yang Hidup dalam Media
tanpa Antibiotik ... 65 36. Hasil Uji-t Jumlah Populasi Bakteri L. plantarum D-01 dalam
Antibiotik Amoksisilin ... 65 37. Hasil Uji-t Jumlah Populasi Bakteri L. lactis D-01dalam
Antibiotik Amoksisilin ... 65 38. Hasil Uji-t Jumlah Populasi Bakteri B. longum Y-01 dalam
Antibiotik Amoksisilin ... 65 39. Hasil Uji-t Jumlah Populasi Bakteri L. acidophilus Y-01 dalam
xiv 40. Analisis Ragam Persentase BAL yang Hidup pada Media dengan
Antibiotik Amoksisilin ... 66
41. Hasil Uji-t Jumlah Populasi Bakteri L. plantarum D-01 dalam Antibiotik Kloramfenikol ... 66
42. Hasil Uji-t Jumlah Populasi Bakteri L. lactis D-01dalam Antibiotik Kloramfenikol ... 66
43. Hasil Uji-t Jumlah Populasi Bakteri B. longum Y-01 dalam Antibiotik Kloramfenikol ... 66
44. Hasil Uji-t Jumlah Populasi Bakteri L. acidophilus Y-01 dalam Antibiotik Kloramfenikol ... 67
45. Analisis Ragam Persentase BAL yang Hidup pada Media dengan Antibiotik Kloramfenikol ... 67
46. Analisis Ragam Aktivitas Antagonistik BAL Indigenous Dadiah dan Produk Olahan Susu Sapi terhadap E. coli ATCC 25922 ... 67
47. Analisis Ragam Aktivitas Antagonistik BAL Indigenous Dadiah dan Produk Olahan Susu Sapi terhadap S. aureus ATCC 25923 .. 67
48. Analisis Ragam Aktivitas Antagonistik BAL Indigenous Dadiah dan Produk Olahan Susu Sapi terhadap S. TyphimuriumATCC 14028 ... 67
49. Komposisi de Man Rogosa Sharpe (MRSB) ... 68
50. Komposisi Mueller Hinton Agar (MHA) ... 68
51. Komposisi Buffered Peptone Water (BPW) ... 68
52. Komposisi Nutrient Broth (NB) ... 69
PENDAHULUAN Latar Belakang
Penekanan untuk hidup sehat telah banyak dipromosikan oleh industri pangan melalui produk-produk pangan fungsional yang dihasilkan, salah satunya adalah produk yang mengandung bakteri probiotik. Penambahan bakteri probiotik bertujuan untuk mengimbangi komposisi antara bakteri patogen dan bakteri yang menguntungkan dalam usus manusia. Salah satu pangan fungsional yang sedang berkembang dan cukup diminati oleh masyarakat adalah produk fermentasi yang mengandung bakteri probiotik.
Di Indonesia khususnya di Sumatra Barat, terdapat satu produk hasil fermentasi yang disebut dengan dadih (dadiah dalam bahasa Minangkabau). Dadiah merupakan pangan tradisional masyarakat Sumatra Barat yang diperoleh dengan cara memfermentasi susu kerbau secara tradisional dalam bambu dan ditutup dengan daun pisang. Isolasi bakteri asam laktat indigenous dadiah susu kerbau mendapatkan Lactobacillus plantarum D-01 dan Lactococcus lactis D-01 (Maheswari, 2008), sehingga dapat digunakan dalam pembuatan dadiah secara terkontrol. Pembuatan dadiah secara terkontrol dilakukan dengan tujuan khusus agar masyarakat merasa aman untuk mengkonsumsinya serta mendapatkan produk dadiah dengan kualitas yang seragam.
2 digunakan sebagai kultur campuran bila isolat asal dadiah susu kerbau tidak terbukti sebagai probiotik. Apabila bakteri B. longum Y-01 dan L. acidophilus Y-01 terbukti memenuhi kriteria sebagai bakteri probiotik, maka penggunaannya dalam kultur campuran akan dihasilkan dadiah probiotik sebagai salah satu pangan fungsional. Oleh karena itu, keempat BAL tersebut sangat menarik dipelajari karakteristiknya sebagai bakteri probiotik.
Tujuan
Penelitian ini bertujuan untuk mempelajari secara in vitro potensi L. plantarum D-01 dan L. lactis D-01 yang merupakan isolat asal dadiah susu
TINJAUAN PUSTAKA Dadih
Dadih (dadiah dalam bahasa Minangkabau) merupakan salah satu makanan tradisional Sumatra Barat. Suku Minangkabau memproses susu kerbau yang baru diperah tanpa dimasak, kemudian dimasukkan susu kerbau tersebut ke dalam potongan tabung bambu kira-kira sebanyak 150 ml, ditutup dengan daun pisang atau plastik dan didiamkan semalam hingga dua malam pada suhu ruang hingga menjadi kental menyerupai yogurt (Surono, 2004). Produk dadiah berbentuk semi padat seperti tahu atau gel yang dapat dengan mudah dipotong atau diiris, berwarna putih sampai krem, dengan rasa asam dan aroma yang khas (Winarno dan Fernandez, 2007).
Surono (2004) juga menjelaskan bahwa susu kerbau tersebut bisa menjadi kental menyerupai yogurt dikarenakan bakteri asam laktat indigenous dalam susu kerbau berperan dalam fermentasi dadiah dan mengalahkan bakteri kontaminan yang terkandung dalam susu kerbau mentah tersebut, mengingat bahwa proses pembuatannya dilakukan secara tradisional, sederhana dan tidak memperhatikan faktor higienis. Spesies bakteri yang mendominasi fermentasi dadiah diantaranya adalah Lactobacillus casei subsp. casei, Leuconostoc paramesenteroides, Leuconostoc mesenteroides, Lactobacillus brevis dan Lactococcus lactis subsp. lactis biovar diacetylactis.
Bakteri Asam Laktat
4 Buckle et al. (2007) menyatakan bahwa BAL merupakan sebutan umum untuk bakteri yang memfermentasikan gula seperti laktosa atau glukosa untuk menghasilkan sejumlah besar asam laktat. Bakteri asam laktat dibagi menjadi dua kelompok kecil yaitu homofermentatif dan heterofermentatif. Produk akhir dari proses metabolisme homofermentatif sebagian besar berupa asam laktat sedangkan produk akhir dari proses metabolisme heterofermentatif adalah asam laktat, etanol, asam asetat dan CO2. Goldin (1998) menambahkan, bahwa BAL diklasifikasikan
ke dalam beberapa genus antara lain Streptococcus, Leuconostoc, Pediococcus, Lactobacillus. Diantara genus dan spesies, ada beberapa BAL yang berpotensi sebagai bakteri probiotik. Hasil-hasil penelitian menunjukkan bahwa spesies BAL yang berpotensi sebagai bakteri probiotik cukup banyak, diantaranya bakteri Lactobacillus acidophilus, Lactobacillus rhamnosus, Lactobacillus reuteri,
Lactobacillus casei, Lactobacillus plantarum, Lactococcus lactis subsp. lactis, Lactobacillus fermentum, Steptococcus lactis, Streptococcus cremoris,
Streptococcus salivarious subsp. thermophilus dan Streptococcus intermedius. Beberapa bakteri yang diidentifikasikan sebagai bakteri probiotik selain BAL adalah Bifidobacterium bifidum, Bifidobacterium longum, Bifidobacterium breve, Enterococcus faecalis, Enterococcus faecium dan Saccharomyces boulardii (Tamime, 2005).
Bifidobacterium longum
5 Lactobacillus acidophilus
Wahyudi dan Samsundari (2008) menjelaskan, bahwa L. acidophilus umumnya ditemukan di dalam usus halus. L. acidophilus termasuk ke dalam famili Lactobacillaceae. Bakteri ini tergolong ke dalam bakteri Gram positif, berbentuk batang tunggal maupun rantai pendek, bersifat anaerob fakultatif, tidak berspora dan katalase negatif (Ray, 2004). L. acidophilus merupakan bakteri paling umum dikenal sebagai bakteri probiotik. Hal ini diperkuat dengan pernyataan Surono (2004) yang menyatakan bahwa L. acidophilus merupakan BAL yang resisten terhadap asam lambung dan masih dapat mempertahankan jumlah bakteri hidup sampai 107 koloni/ml.
Lactobacillus plantarum
L. plantarum merupakan salah satu BAL yang penting dalam fermentasi daging, susu maupun sayuran. L. plantarum merupakan BAL dari famili Lactobaciliceae, genus Lactobacillus dan subgenus Streptobacterium (Pelczar dan Chan, 2007). L. plantarum tergolong ke dalam bakteri Gram positif, berbentuk batang tunggal maupun rantai pendek, tidak berspora, katalase negatif dan bersifat anaerob fakultatif (Ray, 2004).
Lactococcus lactis
L. lactis dahulu dikenal sebagai Streptococcus lactis yang mempunyai kemampuan mensintesis folat dan riboflavin. L. lactis merupakan salah satu jasad renik yang paling utama digunakan pada industri pengolahan susu karena L. lactis mampu menghasilkan sejumlah laktat berlimpah (Wahyudi dan Samsundari, 2008). Bakteri ini termasuk ke dalamfamili Streptococcaceae yang memiliki bentuk bulat berantai pendek, katalase negatif, tidak berspora, tergolong ke dalam bakteri Gram postif dan memiliki suhu pertumbuhan optimum 28-310C (Surono, 2004).
Mikroflora Usus Manusia
6 hidup bakteri, adanya infeksi dan dosis konsumsi makanan suplemen probiotik (Wahyudi dan Samsundari, 2008).
Wahyudi dan Samsundari (2008) menjelaskan bahwa Lactobacillus merupakan penghuni normal saluran pencernaan dan saluran reproduksi manusia. Lactobacillus sebagai penghasil utama asam laktat di dalam saluran pencernaan. Beberapa jenis BAL yang juga menjadi penghuni saluran pencernaan diantaranya adalah Bifidobacterium bifidum, Bifidobacterium longum, Bifidobacterium infantis (pada bayi), Bifidobacterium adolescentris yang menempati usus besar manusia, Lactobacillus acidophilus, Lactobacillus gasseri, Lactobacillus crispatus,
Lactobacillus johnsonii, Lactobacillus salivarius, Lactobacillus ruminis,
Lactobacillus vitulinus dan Lactobacillus reuteri yang hidup dalam usus halus. Surono (2004) menambahkan, bahwa bakteri yang mendominasi saluran pencernaan bayi yang diberi ASI adalah Bifidobacterium, sedangkan bayi yang diberi susu formula adalah L. acidophilus.
Sistem pencernaan manusia diawali dari mulut hingga rektum. Waktu yang dibutuhkan makanan dan panjang saluran pencernaan dari mulut sampai rektum yang harus ditempuh dapat dilihat pada Gambar 1.
7 Mikrobiota usus berbeda pada tiap individu tergantung dari nutrisi, kesehatan, obat yang dimakan dan kondisi lingkungan hidupnya. Mitsuoka (1990) menjelaskan, bahwa mikrobiota usus lansia yang panjang umur sama dengan pada orang dewasa sehat. Populasi bakteri dan jenis bakteri yang ada pada saluran pencernaan dapat dilihat pada Gambar 2.
Gambar 2. Populasi Bakteri pada Berbagai Saluran Pencernaan Manusia (Surono, 2004)
Probiotik
8 2) mampu tumbuh dan melakukan metabolisme dengan cepat dan terdapat dalam jumlah yang banyak dalam usus, 3) dapat mengkolonisasi beberapa bagian dari saluran usus untuk sementara, 4) dapat memproduksi asam-asam organik secara efisien dan memiliki sifat antimikroba terhadap bakteri merugikan, serta 5) mudah diproduksi, mampu tumbuh dalam sistem produksi skala besar dan hidup selama kondisi penyimpanan. Widodo (2002) juga menambahkan bahwa salah satu syarat BAL yang perlu dimiliki oleh bakteri probiotik adalah memiliki ketahanan terhadap antibiotik.
Bron et al. (2004) menjelaskan bahwa ketika bakteri probiotik ditelan, maka bakteri pertama kali akan menghadapi keasaman lambung. Berrada et al. (1991) menyatakan bahwa waktu yang diperlukan mulai saat bakteri masuk sampai keluar dari lambung sekitar 90 menit. Bakteri asam laktat tidak hanya tumbuh dengan lambat pada pH rendah, tetapi kerusakan akibat asam dan hilangnya viabilitas juga dapat terjadi pada sel bakteri yang terpapar pada pH rendah. Tiap galur memiliki ketahanan yang berbeda terhadap asam atau pH rendah. Contohnya pada penelitian yang dilakukan oleh Susanti et al. (2007), sebanyak 20 isolat yang berasal dari galur yang berbeda-beda memiliki ketahanan yang berbeda-beda pada pH 2,5 selama 90 menit. Keseluruhan isolat yang diteliti ternyata mampu hidup di pH 2,5 namun isolat yang berasal dari galur feses bayi dan air kelapa penurunan populasinya lebih rendah daripada isolat yang berasal dari galur dadiah, keju, tape dan moromi kecap.
Bakteri yang mampu bertahan pada kondisi keasaman lambung akan dialirkan menuju ke usus bagian atas, dimana pada usus bakteri akan menghadapi tekanan yang berhubungan dengan ketersediaan O2 yang rendah, garam empedu dan
9 Seperti halnya ketahanan terhadap asam, menurut Zavaglia et al. (1998) semua mikroba yang berhasil hidup setelah ditumbuhkan dalam MRSA yang ditambah 0,3% ox gall, dinyatakan bersifat tahan terhadap garam empedu. Konsentrasi garam empedu sebesar 0,3% merupakan konsentrasi yang kritikal, nilai yang cukup tinggi untuk melakukan seleksi terhadap isolat yang resisten terhadap garam empedu.
Antibiotik
Pelczar dan Chan (2008) mengatakan bahwa kata antibiotik diberikan pada produk metabolik yang dihasilkan suatu organisme tertentu, yang dalam jumlah amat kecil bersifat merusak atau menghambat mikroorganisme lain, sehingga antibiotik merupakan suatu zat kimia yang dihasilkan oleh suatu mikroorganisme yang menghambat mikroorganisme lain. Setiap antibiotik sangat beragam keefektifannya dalam melawan berbagai jenis bakteri, ada antibiotika yang membidik kelompok bakteri Gram negatif, bakteri Gram positif ataupun kedua kelompok bakteri tersebut. Keefektifan suatu antibiotik sangat tergantung pada lokasi infeksi dan kemampuan antibiotik mencapai lokasi tersebut.
10 kandisidin, 6) antibiotik yang aktif terhadap neoplasma (antikanker), contohnya aktinomisin, bleomisin, daunorubisin, doksorubisin, mitomisin dan mitramisin. Selain itu, antibiotik juga dibedakan berdasarkan mekanisme kerja antibakteri yaitu penghambatan sintesis dinding sel, penghambatan sintesis protein, kerusakan membran sel dan penghambatan sintesis DNA atau RNA (Volk dan Wheeler, 1993).
Kloramfenikol
Schunack et al. (1990) menjelaskan bahwa kloramfenikol merupakan antibiotik berspektrum luas yang aktif terhadap banyak bakteri Gram positif dan Gram negatif yang bekerja secara bakteriostatik. Antibiotik kloramfenikol ini bekerja dengan cara bergabung bersama dengan sub unit-sub unit ribosom sehingga mengganggu sintesis protein. Kloramfenikol relatif tidak beracun bagi mamalia bila digunakan secara terapeutik. Namun, apabila pemberiannya berlebihan maka akan menyebabkan beberapa kelainan yang gawat di dalam darah seseorang. Penggunaan antibiotik sangat dianjurkan hanya pada kasus-kasus yang tidak dapat diobati secara efektif dengan antibiotik lain (Pelczar dan Chan, 2008).
Amoksisilin
Amoksisilin merupakan antibiotik dengan spektrum luas yang aktif terhadap bakteri Gram positif dan bakteri Gram negatif. Amoksisilin digunakan untuk mengatasi infeksi yang disebabkan oleh bakteri Gram negatif seperti Haemophilus influenza, Escherichia coli, Proteus mirabilis, Salmonella serta untuk mengatasi infeksi yang disebabkan oleh bakteri Gram positif seperti Streptococcus pneumoniae, enterococci, nonpenicilinase-producing Staphylococci, Listeria.
Meskipun demikian, amoksisilin secara umum tidak dapat digunakan secara tunggal untuk pengobatan yang disebabkan oleh infeksi streptococcus dan staphylococcal (Siswandono, 2000).
11 Aktivitas Antimikroba Bakteri Asam Laktat
BAL memproduksi senyawa asam organik (asam laktat, asam format, dan asam asetat), diasetil, hidrogen peroksida, karbondioksida dan bakteriosin yang berpotensi untuk menghambat beberapa mikroorganisme lain termasuk bakteri pembusuk dan bakteri patogen (Onilude et al., 2005). Antimikroba yang terdapat di dalam bakteri digunakan untuk inaktivasi bakteri patogen. Mekanisme aktivitas penghambatan antimikroba dilakukan dengan cara perusakan dinding sel bakteri. Selain itu penghambatan antimikroba juga dapat dilakukan dengan cara penghambatan pembentukan dinding sel yang sedang tumbuh, mengubah permeabilitas membran sitoplasma yang menyebabkan kebocoran nutrien di dalam sel, denaturasi protein sel serta perusakan sistem metabolisme dalam sel dengan cara menghambat kerja enzim intraseluler (Pelczar dan Chan, 2008).
Hardiningsih et al. (2006) menjelaskan bahwa Lactobacillus yang tergolong ke dalam bakteri probiotik mampu menghambat pertumbuhan bakteri merugikan atau patogen, seperti bakteri Streptococcus, Staphylococcus aureus dan Escherichia coli. Fuller (1997) juga menambahkan bahwa Lactococci, Lactobacilli, Pediococci, Leuconostocs, Carnobacteria, Streptococci dan Enterococci mampu memproduksi senyawa bakteriosin. Substansi antimikroba yang dihasilkan oleh bakteri probiotik, misalnya L. acidophilus menghasilkan acidotin, acidophilin, bakteriosin dan lactocidin, L. bulgaricus menghasilkan bulgarican, L. plantarum menghasilkan lactolin, plantacin dan plantaricin (Todorov, 2009), L. brevis menghasilkan lactobullin dan lactobrevin, L. reuteri menghasilkan reuterin dan L. lactis menghasilkan nisin (Tamime, 2005).
12 B. longum mampu menghambat secara langsung pertumbuhan bakteri patogen yakni bakteri yang berasal dari genus Salmonella, Shigella, Listeria, Escherichia, Vibrio, Campylobacter, Clostridium dan Bacteroides.
Bakteri Patogen
Bakteri yang tumbuh dalam bahan pangan terbagi menjadi bakteri pembusuk yang dapat menyebabkan kerusakan makanan dan bakteri patogen penyebab penyakit pada manusia. Bakteri pembusuk pada umumnya lebih dominan dibandingkan dengan bakteri patogen. Bakteri patogen secara umum dibagi menjadi dua yaitu berdasarkan penyebab infeksi dan intoksikasi. Infeksi merupakan racun yang dihasilkan oleh bakteri di dalam saluran pencernaan manusia, sedangkan intoksikasi merupakan racun yang dihasilkan oleh bakteri patogen yang berkembang di dalam makanan. Beberapa contoh bakteri pembusuk dan patogen yang sering terdapat pada produk fermentasi adalah dari famili Enterobacteriaceae, termasuk dari famili Enterobacter, Escherichia, Erwinia, Citrobacter, Salmonella, Shigella dan Yersinia (Fardiaz, 1992).
Escherichia coli
Escherichia coli terdapat secara normal dalam alat-alat pencernaan manusia dan hewan. Bakteri E. coli merupakan bakteri yang tergolong dalam Gram negatif, bergerak, berbentuk batang, katalase positif, bersifat fakultatif anaerob dan termasuk golongan Enterobacteriaceae (Buckle et al., 2007). E.coli mempunyai kisaran suhu pertumbuhan antara 30-40 C dengan suhu optimum 37 C. Nilai pH optimum untuk pertumbuhan E.coli adalah 7,0–7,5 dan aw optimum adalah 0,96. Pertumbuhan bakteri ini meningkat dengan pesat selama 12-18 jam pertama dan kemudian meningkat perlahan-lahan sampai 48-72 jam masa pertumbuhannya (Ray, 2004).
13 E. coli dibedakan ke dalam empat kelompok patogenik penyebab diare yaitu EPEC (Enteropatogenik Escherichia coli), ETEC (Enterotoksigenik Escherichia coli), EIEC (Enteroinvasif Escherichia coli) dan VTEC (E. coli penghasil verotoksin). EIEC menyebabkan diare berdarah dengan gejala mirip disentri (Shigella), sedangkan ETEC menyebabkan diare pada bayi (infantile diarrhea) diare yang disebabkan oleh Vibrio cholerae. Penyakit yang disebabkan oleh grup EPEC adalah diare berair yang disertai dengan muntah dan demam. Diare sering bersifat sembuh sendiri, tetapi EPEC dapat menyebabkan enteritis kronis berkepanjangan yang mengganggu pertumbuhan. VTEC menyebabkan hemoragik colitis (HC) dan sindroma hemolitik uremik (HUS). Gejala HC sering dimulai dengan sakit perut dan diare berair, diikuti dengan diare berdarah umumnya tanpa demam. Diare baik berdarah atau tidak, diikuti oleh munculnya HUS. HUS terjadi pada semua kelompok umur tetapi paling umum pada anak-anak (Ray, 2004).
Staphylococcus aureus
S. aureus termasuk genus Staphylococcus dan family Micrococcaceae. Selnya berbentuk bulat, termasuk gram positif, katalase positif, tidak bergerak, fakultatif anaerob dan dapat tumbuh pada produk-produk yang mengandung NaCl sampai 16%. Kisaran suhu untuk pertumbuhan S. aureus adalah 6,5–46 C, dengan suhu optimumnya adalah 30–37 C. Nilai pH untuk pertumbuhan bakteri ini adalah antara 4,2–9,3, dengan pH optimum 7,0–7,5 (Buckle et al., 2007).
Pertumbuhan organisme ini dalam bahan pangan menghasilkan enterotoksin yang mengakibatkan keracunan makanan, yaitu apabila termakan dapat mengakibatkan serangan mendadak yaitu kejang perut, muntah-muntah yang hebat dan diare. Penyembuhan keracunan makanan yang disebabkan oleh S. aureus relatif cukup cepat dan pada umumnya hanya membutuhkan waktu satu hari (Buckle et al., 2007).
Salmonella enteritidis serotipeTyphimurium (S. Typhimurium)
14 Viabilitas Salmonella akan menurun selama penyimpanan beku (Pelczar dan Chan, 2007).
METODE Waktu dan Lokasi
Penelitian ini dilaksanakan di Laboratorium Mikrobiologi Bagian Teknologi Hasil Ternak serta Laboratorium Terpadu, Fakultas Peternakan, Institut Pertanian Bogor dan Laboratorium Penelitian Kimia Analitik, Fakultas Matematika dan IPA, Institut Pertanian Bogor. Penelitian ini berlangsung dari bulan Maret sampai
Agustus 2010.
Materi
Bahan-bahan utama yang digunakan dalam penelitian ini adalah kultur bakteri hasil isolasi dadiah susu kerbau yaitu bakteri L. plantarum D-01 dan L. lactis D-01, bakteri hasil isolasi dari produk olahan susu sapi yaitu B. longum Y-01 dan L. acidophilus Y-01 (Maheswari, 2008), serta E. coli ATCC 25922, S. aureus ATCC 25923 dan S. Typhimurium ATCC 14028. Semua kultur bakteri
16 Prosedur
Penelitian Pendahuluan
Persiapan Kultur Bakteri (Pelczar dan Chan, 2007). Kultur bakteri koleksi Bagian Teknologi Hasil Ternak meliputi L. plantarum D-01, L. lactis D-01, B. longum Y-01, L. acidophilus Y-01, E. coli ATCC 25922, S. aureus ATCC 25923 dan S. TyphimuriumATCC 14028 diperiksa sifat morfologi dan biokimianya untuk mengetahui kemurniaannya. Pengujian morfologi starter dengan bantuan pewarnaan Gram dan pengamatan dengan mikroskop pada perbesaran 100x.
Pengujian pewarnaan Gram dilakukan dengan cara kultur bakteri dioleskan pada gelas objek dengan jarum Ose, kemudian ditetesi dengan kristal violet, dibiarkan selama 1 menit. Preparat selanjutnya dibilas dengan akuadestilata dan dikeringudarakan. Preparat yang sudah kering ditetesi dengan larutan lugol iodin dan didiamkan selama ±1 menit, kemudian dibilas kembali dengan akuades dan preparat selanjutnya ditetesi dengan alkohol 95% sebagai bahan pemucat selama ±5 detik, dibilas kembali dengan akuades dan dikeringudarakan. Pewarnaan terakhir menggunakan safranin selama ±30 detik dan dibilas kembali dengan akuades, lalu preparat dikeringudarakan. Bakteri yang telah diwarnai diperiksa di bawah mikroskop. Bakteri dikelompokkan menjadi bakteri Gram positif, bila dapat mempertahankan zat warna ungu kristal dan tampak berwarna ungu tua. Kelompok bakteri Gram negatif akan terlihat berwarna merah, karena pada saat dicuci dengan alkohol tidak dapat mempertahankan warna ungu yang berasal dari kristal violet, sehingga sewaktu diberi pewarna tandingan dengan warna merah safranin bakteri menyerap warna tersebut dan mengakibatkan tampak berwarna merah.
Karakteristik biokimia kultur bakteri salah satunya ditentukan melalui pengujian katalase dengan cara sebanyak satu jarum Ose bakteri diambil dan dioleskan pada gelas objek, kemudian ditetesi dengan satu tetes H2O2. Apabila
dihasilkan gelembung-gelembung gas O2, maka bakteri yang diperiksa termasuk
17 Penentuan Populasi BAL Indigenous Dadiah (Waluyo, 2008). Tahap ini bertujuan untuk menentukan jumlah populasi BAL selama diberikan perlakuan (ketahanan terhadap keasaman lambung yang berbeda, keberadaan garam empedu dan adanya antibiotik) yang dihitung dengan pendekatan dua metode yaitu metode pour plate (hitungan cawan) dan metode turbidimetrik dengan spektrofotometer. Metode pour plate digunakan untuk penentuan populasi BAL sebelum dan sesudah perlakuan, sedangkan metode turbidimetrik digunakan untuk penentuan perubahan populasi BAL selama perlakuan.
Metode Hitungan Cawan (Bakteriological Analytical Manual, 2001). Tahap ini diawali dengan pengenceran yang dilakukan dengan cara sebanyak 1 ml sampel yang sudah homogeny diambil dengan pipet steril, lalu dimasukkan ke dalam tabung reaksi berisi 9 ml laruran pengencer yaitu BPW, sehingga terbentuk pengenceran 10-1. Pengenceran terus dilakukan sampai pada pengenceran 10-9. Pemupukan dilakukan dengan pipet steril yaitu sebanyak 1 ml pada pengenceran 10-6, 10-7, 10-8 dan 10-9 diambil dan dipindahkan ke dalam cawan Petri steril secara duplo. Media agar sebanyak 15 ml ditambahkan ke dalam cawan Petri den dihomogenkan sampai merata (metode tuang atau pour plate). Cawan tersebut diinkubasi dengan posisi terbalik dalam inkubator bersuhu 37 C selama 24-48 jam. Koloni mikroba yang terbentuk dihitung berdasarkan Standard Plate Count (SPC) dengan rumus sebagai berikut :
Jumlah Populasi (cfu/ml) = N cawan (n1 + (0,1 x n2)) x d
Keterangan :
N = Jumlah koloni yang berbeda dalam kisaran hitung (25-250 koloni) n1 = Jumlah cawan pertama yang koloninya dapat dihitung
n2 = Jumlah cawan kedua yang koloninya dapat dihitung
18 Metode Turbidimetrik (Waluyo, 2008). Tahap ini diawali dengan penentuan korelasi antara nilai optical density (OD) dengan populasi bakteri hasil pemupukan dengan metode pour plate. Semakin tinggi nilai OD maka jumlah populasi bakteri yang dipupukkan juga semakin banyak, sehingga membentuk persamaan linier y = a + bx dengan y jumlah populasi BAL, x nilai OD BAL sedangkan a dan b konstanta persamaan. Persamaan linier yang didapat (Tabel 1) digunakan
untuk konversi OD dalam jumlah populasi dari L. plantarum D-01, L. lactis D-01, B. longum Y-01 serta L. acidophilus Y-01 selama pengamatan untuk pengujian ketahanan terhadap kondisi keasaman lambung yang berbeda, garam empedu dan antibiotik yang berbeda.
Tabel 1. Persamaan Linier BAL Indigenous Dadiah dan Produk Olahan Susu Sapi
No. Bakteri Persamaan Linier R2
1. L. plantarum D-01 y = 6,873 + 2,522x 0,978
2. L. lactis D-01 y = 7,074 + 1,169x 0,936
3. B. longum Y-01 y = 6,684 + 1,093x 0,957
4. L. acidophilus Y-01 y = 7,205 + 1,812x 0,976
Penelitian Utama
Pengujian Ketahanan Kultur Starter BAL Indigenous Dadiah terhadap Kondisi Keasaman Lambung yang Berbeda (Chou dan Weimer, 1999). Kultur starter bakteri segar diperoleh dengan menumbuhkan ke dalam MRSB dan diinkubasi selama 24 jam pada suhu 37 C. Sel-sel bakteri dipanen dengan cara disentrifuse dengan kecepatan 5000 rpm selama 10 menit pada suhu 4 C, lalu
dipisahkan dari supernatannya. Sel-sel kultur starter bakteri distandarisasi untuk mendapatkan populasi awal 107 cfu/ml, lalu diinokulasikan ke dalam larutan PBS (Phosphate Buffer Saline) steril yang telah dikondisikan pada pH 2; 2,5; 3,2; dan 7,2. Kultur starter bakteri dalam larutan PBS diinkubasi pada suhu 37 C selama 180 menit. Populasi kultur starter bakteri dihitung dengan cara dipupukkan sebelum diinkubasi (t0) dan sesudah diinkubasi selama 180 menit (t180). Selisih
antara populasi t180 dengan t0 merupakan jumlah BAL yang mampu bertahan pada
19 diperoleh nilai turbiditasnya atau optical density (OD) melalui spektrofotometer pada panjang gelombang 620 nm. Jumlah populasi bakteri dapat diperkirakan melalui konversi nilai OD ke dalam persamaan kurva standar yang telah diperoleh (Tabel 1). Ketahanan bakteri terhadap keasaman lambung yang berbeda ditentukan berdasarkan jumlah populasi BAL yang mampu bertahan, yaitu bila selisih antara kultur starter BAL sebelum dan sesudah pengamatan minimal 50% atau kematian bakteri maksimal 50%.
Pengujian Ketahanan Kultur Starter BAL Indigenous Dadiah terhadap Garam Empedu (Lin et al., 2006). Uji ketahanan terhadap garam empedu dilakukan terhadap isolat kultur starter BAL yang dapat tumbuh pada pH 2,0. Pengujian disesuaikan dengan kadar garam empedu pada saluran pencernaan yaitu dengan menggunakan bile salt sebanyak 0,3% oxgall b/v dalam media PBS basal dengan pH 7,2 yang telah disterilisasi pada suhu 121 C selama 15 menit. Kultur starter bakteri yang sudah distandarisasi dengan populasi awal ± 107 cfu/ml diinokulasikan pada media PBS steril yang telah ditambahkan garam empedu 0,3%, lalu diinkubasi pada suhu 37 C selama 24 jam. Populasi kultur starter bakteri dihitung dengan cara dipupukkan sebelum diinkubasi (t0) dan sesudah diinkubasi
selama 24 jam (t24). Selisih antara populasi t24 dengan t0 merupakan jumlah BAL
20 dan kloramfenikol. Kultur starter BAL yang sudah distandarisasi dengan populasi awal ±107 cfu/ml ditumbuhkan ke dalam media MRSB yang telah ditambahkan antibiotik sebanyak 30 µg/ml, lalu diinkubasi pada suhu 37 C selama 24 jam. Populasi kultur starter bakteri dihitung dengan cara dipupukkan sebelum diinkubasi (t0) dan sesudah diinkubasi selama 24 jam (t24). Selisih antara populasi t24 dengan t0
merupakan jumlah BAL yang mampu bertahan pada antibiotik. Perubahan populasi kultur starter BAL selama diinkubasi diamati dengan cara sampel diambil setiap 1 jam untuk diperoleh nilai turbiditasnya atau optical density (OD) melalui spektrofotometer pada panjang gelombang 620 nm. Jumlah populasi bakteri dapat diperkirakan melalui konversi nilai OD ke dalam persamaan kurva standar yang telah diperoleh (Tabel 1). Ketahanan bakteri terhadap antibiotik ditentukan berdasarkan jumlah populasi BAL yang mampu bertahan, yaitu bila selisih antara kultur starter BAL sebelum dan sesudah pengamatan minimal 50% atau kematian bakteri maksimal 50%.
Pengujian Aktivitas Antagonistik BAL Indigenous Dadiah terhadap Bakteri Patogen (Modifikasi Wiryawan et al., 2009)
Persiapan Filtrat Bebas Sel (FBS) dan FBS Terkonsentrasi. Kultur bakteri yang sudah disegarkan distandarisasi dengan populasi awal ± 107 cfu/ml. Filtrat bebas sel (FBS) diperoleh melalui penyaringan steril dengan filter 0,22 m (Millipore). FBS dikonsentrasikan dengan cara menambahkan ke dalam FBS metanol (MeOH) dengan rasio 1:1, kemudian dievaporasi dalam rotary evaporator pada suhu 40-45 C selama 60 menit atau hingga mencapai 1/5 volume awal. Pemekatan FBS bertujuan untuk meningkatkan aktivitas antimikroba dari BAL. FBS terkonsentrasi segera disimpan dalam refrigerator (4 C) sebelum digunakan.
21 Konfrontasi Filtrat Bebas Sel dengan Bakteri Indikator. Pengujian aktivitas
antimikroba kultur L. plantarum D-01, L. lactis D-01, B. longum Y-01 dan L. acidophilus Y-01 terhadap bakteri patogen dilakukan dengan metode difusi agar
sumur. Sebanyak masing-masing 1 ml kultur bakteri patogen yang telah diencerkan dengan populasi 105 cfu/ml dipipet ke dalam cawan Petri, lalu ditambahkan media Muller Hinton Agar dengan suhu 50 C sebanyak 20 ml/cawan dan dihomogenkan dengan cara digerakkan membentuk angka delapan. Media MHA berisi bakteri patogen indikator dibiarkan padat, kemudian dibuat sumur difusi berdiameter 7 mm dengan alat pelubang atau cork borer, lalu bagian bawah sumur dilapisi dengan media Bacteriological Agar untuk menghindari filtrat merembes di dasar sumur. Sebanyak 50 l FBS terkonsentrasi dipipet ke dalam sumur, lalu cawan beserta isi diletakkan dalam refrigerator untuk memberi kesempatan FBS berdifusi ke dalam agar. Cawan selanjutnya diinkubasi pada 37 C selama 24 jam. Diameter penghambatan berupa zona bening yang muncul di sekeliling sumur diukur dengan jangka sorong pada empat tempat yang berbeda, lalu hasil pengukuran dirata-ratakan (Gambar 3).
Diameter penghambatan (mm) = diameter rata-rata (mm) – 7 mm
Gambar 3. Cara Pengukuran Zona Hambat Antimikroba
A B C D
Koloni bakteri patogen indikator
Zona Bening
Sumur diisi FBS
Diameter rata-rata = A+B+C+D 4
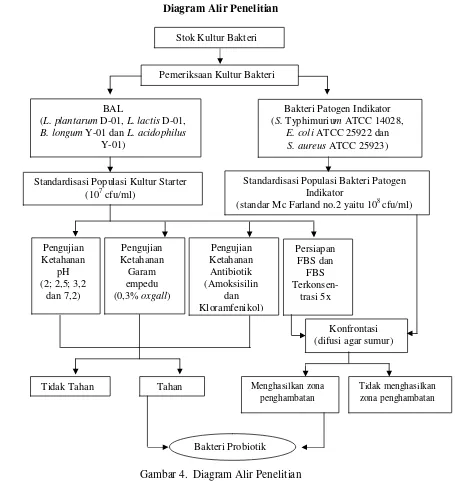
22 Diagram Alir Penelitian
Gambar 4. Diagram Alir Penelitian Rancangan Percobaan
Data yang diperoleh dianalisis dengan uji-t dan Rancangan Acak Lengkap (RAL). Analisis uji t digunakan untuk analisis ketahanan BAL indigenous dadiah terhadap 1) kondisi keasaman lambung yang berbeda, 2) garam empedu dan 3) antibiotik berbeda. Data dianalisis dengan uji t untuk membandingkan dua perlakuan yaitu sebelum diberi perlakuan dan setelah diberi perlakuan untuk melihat pengaruh perlakuan terhadap peubah yang diamati dengan masing-masing
Stok Kultur Bakteri B. longum Y-01 dan L. acidophilus
Y-01)
Standardisasi Populasi Kultur Starter
(107 cfu/ml)
Standardisasi Populasi Bakteri Patogen Indikator
(standar Mc Farland no.2 yaitu 108 cfu/ml)
Tahan Menghasilkan zona
penghambatan
Bakteri Probiotik
Tidak Tahan Tidak menghasilkan
23 perlakuan terdiri atas tiga ulangan. Rumus yang digunakan menurut Walpole (1995) sebagai berikut :
Keterangan :
µi = rata-rata perlakuan ke-i µj = rata-rata perlakuan ke-j s = simpangan baku n = jumlah data
Rancangan Acak Lengap dengan dua kali pengulangan untuk analisis aktivitas antagonistik terhadap bakteri patogen serta tiga kali pengulangan untuk analisis persentase bakteri yang hidup pada kondisi keasaman lambung yang berbeda, garam empedu dan antibiotik berbeda. Model matematika untuk Rancangan Acak Lengkap berdasarkan Steel dan Torrie (1995) adalah :
Yij = μ + i+ ij
Keterangan :
Yij = Pengamatan pada perlakuan ke-i dan ulangan ke-j µ = Rataan Umum
i = Pengaruh perlakuan ke-i
ij = Pengaruh galat percobaan pada perlakuan ke-i ulangan ke-j
Uji aktivitas antagonistik terhadap bakteri patogen i = BAL yang berbeda, j = ulangan ke-1 dan 2.
Uji persentase bakteri yang hidup pada kondisi keasaman lambung yang berbeda, garam empedu dan antibiotik berbeda
i = BAL yang berbeda, j = ulangan ke-1, 2 dan 3.
HASIL DAN PEMBAHASAN
Konfirmasi Kultur Starter BAL Indigenous Dadiah dan Bakteri Patogen Indikator
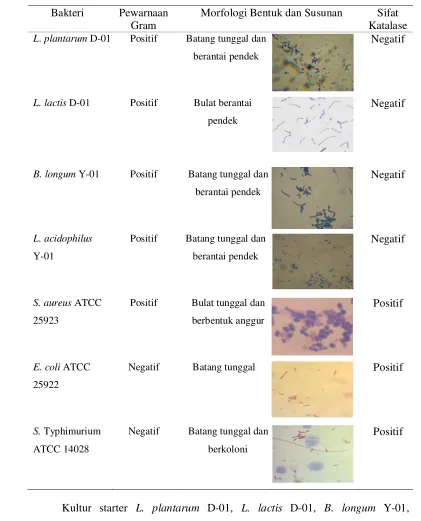
Pemeriksaan terhadap kultur starter sebelum diolah menjadi suatu produk sangatlah penting. Hal ini bertujuan untuk memastikan bahwa kultur starter yang akan digunakan tidak terkontaminasi oleh kapang, khamir ataupun oleh mikroorganisme lain. Kemurnian suatu kultur starter dapat dibuktikan melalui pemeriksaan morfologi menggunakan pewarnaan Gram dan pengujian sifat katalase menggunakan hidrogen peroksida (H202).
Pewarnaan Gram merupakan salah satu teknik pewarnaan diferensial yang paling penting dan sering digunakan untuk pengujian kemurnian suatu bakteri. Pada pewarnaan Gram ini, bakteri dibedakan menjadi dua kelompok berdasarkan susunan dinding selnya yaitu bakteri Gram positif dan bakteri Gram negatif (Pelczar dan Chan, 2007). Pemeriksaan kultur starter yang dilakukan dalam penelitian ini terdiri atas bakteri L. plantarum (Lp D-01) dan L. lactis (Ll D-01) yang merupakan isolat asal dadiah susu kerbau, L. acidophilus (La Y-01) dan B. longum (Bl Y-01) yang merupakan isolat dari produk olahan susu sapi (Maheswari, 2008) serta bakteri
patogen indikator yaitu E. coli ATCC 25922, S. aureus ATCC 25923, dan S. Typhimurium ATCC 14028. Pemeriksaan kultur starter dengan bantuan metode
pewarnaan Gram didapatkan hasil bahwa kultur starter memiliki bentuk yang seragam (tidak terdapat kontaminasi) dan tergolong ke dalam bakteri Gram positif
untuk kultur starter L. plantarum D-01, L. lactis D-01, B. longum Y-01, L. acidophilus Y-01 dan S. aureus ATCC 25923 serta bakteri Gram negatif untuk
25 Tabel 2. Karakteristik Kultur Starter BAL Indigenous Dadiah dan Bakteri Patogen
Indikator
Bakteri Pewarnaan Gram
Morfologi Bentuk dan Susunan Sifat Katalase
L. plantarum D-01 Positif Batang tunggal dan berantai pendek
Negatif
L. lactis D-01 Positif Bulat berantai pendek
Negatif
B. longum Y-01 Positif Batang tunggal dan berantai pendek
Negatif
L. acidophilus
Y-01
Positif Batang tunggal dan
berantai pendek
Negatif
S. aureus ATCC 25923
Positif Bulat tunggal dan
berbentuk anggur
Positif
E. coli ATCC 25922
Negatif Batang tunggal Positif
S. Typhimurium
ATCC 14028
Negatif Batang tunggal dan
berkoloni
Positif
Kultur starter L. plantarum D-01, L. lactis D-01, B. longum Y-01, L. acidophilus Y-01 dan S. aureus ATCC 25923 tergolong kedalam bakteri Gram
26 menjelaskan bahwa bakteri Gram positif dapat mempertahankan warna ungu disebabkan ketika ditetesi oleh alkohol 95%, dinding sel mengalami dehidrasi, pori-pori menciut, daya rembes dinding sel dan membran menurun sehingga membuat zat pewarna kristal violet tidak dapat keluar dari sel dan ketika ditetesi dengan zat pewarna safranin, warna merah yang berasal dari safranin tidak berpengaruh (tidak masuk ke dalam dinding sel). Fardiaz (1992) juga menambahkan bahwa bakteri Gram positif dapat mempertahankan warna ungu disebabkan pada bakteri Gram positif memiliki dinding sel yang tebal dengan ukuran dari 18 sampai 80 nm. Tebal dinding sel sangat bergantung pada peptidoglikan asam teikoat yaitu polimer dari ribitol fosfat yang dihubungkan dengan N asetilglukosamin. Bakteri Gram postif tersusun atas dua lapisan dinding selnya yaitu 90% lapisan peptidoglikan yang dapat mempertahankan warna ungu dan 10% lapisan tipis yakni asam teikoat.
Kultur starter E. coli ATCC 25922 dan S. Typhimurium ATCC 14028 tergolong ke dalam bakteri Gram negatif, disebabkan bakteri tersebut tidak dapat mempertahankan zat pewarna kristal violet ketika diberi alkohol 95%. Pelczar dan Chan (2007) mengatakan bahwa bakteri Gram negatif tidak dapat mempertahankan zat pewarna kristal violet disebabkan ketika ditetesi dengan alkohol 95%, lipid dari dinding sel terekstraksi, pori-pori mengembang sehingga membuat zat pewarna kristal violet keluar dari sel dan membuat sel menjadi tidak berwarna. Sel bakteri yang tidak berwarna tersebut apabila ditetesi dengan safranin maka sel tersebut akan menyerap zat pewarna safranin sehingga sel bakteri akan tampak berwarna merah ketika dilihat di bawah mikroskop. Fardiaz (1992) juga menambahkan bahwa dinding sel bakteri Gram negatif terdiri dari peptidoglikan dengan ukuran 10 sampai 15 nm sehingga dinding selnya lebih tipis. Bakteri Gram negatif ini dikelilingi oleh membran luar yang terpisah dari tubuh bakteri dengan suatu ruang periplasmik yaitu terdiri atas bagian dalam fosfolipid dan bagian luar lipopolisakharida.
27 B. longum berbentuk batang. Hasil pengamatan morfologi L. lactis D-01 didapatkan hasil bahwa bakteri tersebut berbentuk bulat berantai pendek dan hal ini sesuai dengan pernyataan Surono (2004) yaitu L. lactis termasuk ke dalam famili Streptococcaceae yang memiliki bentuk bulat berantai pendek.
Buckle et al. (2007) menjelaskan bahwa bakteri E. coli dan S. Typhimurium memiliki bentuk morfologi batang, sedangkan bakteri S. aureus memiliki bentuk morfologi bulat dengan susunan tunggal maupun berbentuk anggur. Hal ini sesuai dengan hasil pengamatan yaitu E. coli ATCC 25922 berbentuk batang dengan susunan tunggal, S. Typhimurium ATCC 14028 berbentuk batang dengan susunan tunggal dan berkoloni serta S. aureus ATCC 25923 berbentuk bulat dengan susunan tunggal dan berbentuk anggur.
Pengujian katalase bertujuan untuk mengetahui keberadaan enzim katalase yang terdapat pada kultur starter bakteri. Produksi enzim katalase dapat diketahui dengan cara larutan H2O2 diteteskan di atas preparat bakteri yaitu apabila terbentuk
gelembung-gelembung gas hal ini menunjukkan bahwa bakteri tersebut melepaskan gas O2 dan dinyatakan sebagai bakteri katalase positif. Bakteri yang tidak
menghasilkan gas O2 setelah ditetesi H2O2 menunjukkan bahwa bakteri tersebut
memiliki enzim peroksidase yang dapat mencegah produksi gas O2 dan bakteri
tersebut dinyatakan sebagai bakteri katalase negatif (Surono, 2004).
Hasil pengamatan menunjukkan bahwa kultur starter indigenous dadiah yakni L. plantarum D-01, L. lactis D-01 serta BAL produk olahan susu sapi yaitu L. acidophilus Y-01 dan B. longum Y-01 tidak menghasilkan gelembung-gelembung gas O2 setelah ditetesi dengan H202 sehingga digolongkan sebagai
bakteri katalase negatif sedangkan kultur bakteri patogen indikator yaitu E. coli ATCC 25922, S. aureus ATCC 25923 dan S. Typhimurium ATCC 14028 menghasilkan gelembung gas O2 setelah ditetesi dengan H2O2 sehingga
digolongkan sebagai bakteri katalase positif. Hal ini sesuai dengan Buckle et al. (2007) yang menyatakan bahwa L. plantarum, L. lactis, L. acidophilus dan B. longum tergolong ke dalam bakteri katalase negatif sedangkan E. coli, S. aureus
28 Ketahanan Kultur Starter BAL Indigenous Dadiah terhadap Kondisi
Keasaman Lambung yang Berbeda
Salminen et al. (2004) menjelaskan bahwa suatu bakteri dapat dikatakan sebagai bakteri probiotik apabila bakteri tersebut masih aktif pada kondisi asam lambung. Stress yang pertama terjadi pada sel bakteri yang memasuki saluran pencernaan adalah terpapar pada asam lambung. Pada kondisi pH rendah, BAL tidak hanya tumbuh lambat tetapi mungkin juga mengalami kerusakan asam dan menurun viabilitasnya jika sel bakteri berada pada kondisi pH rendah. Surono (2004) mengatakan bahwa pH lambung dalam keadaan istirahat sangatlah rendah yaitu sekitar 2.
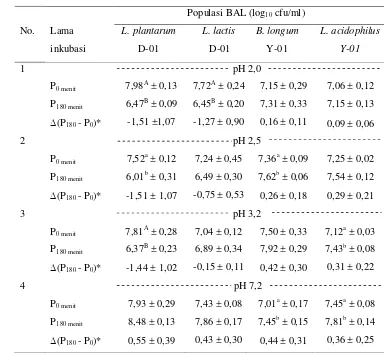
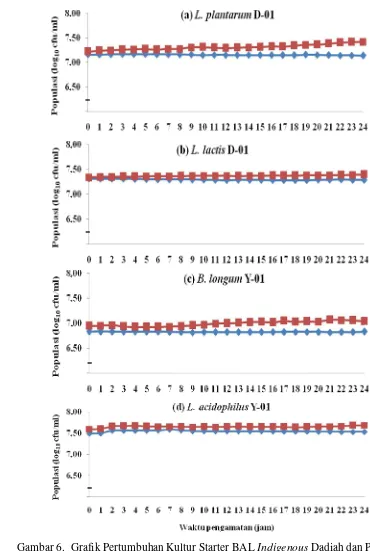
Pengujian ketahanan BAL indigenous dadiah dan produk olahan susu sapi terhadap kondisi keasaman lambung in vitro dilakukan pada pH medium 2; 2,5; 3,2 dan 7,2 selama 180 menit. Penentuan nilai pH yang berbeda berdasarkan pada kondisi keasaman saluran pencernaan pada lambung yang selalu berubah yaitu pH lambung dalam keadaan istirahat atau kosong sangatlah rendah sekitar 2,0, berubah menjadi 2,5 ketika enzim pepsin menghidrolisis protein (Surono, 2004), meningkat menjadi 3,2 ketika asam lambung disekresikan dan berada sekitar 7,2 ketika mulai memasuki usus (Mitsuoka, 1990). Waktu yang diperlukan mulai saat bakteri masuk sampai keluar lambung adalah sekitar 90 menit (Berrada et al., 1991). Waktu yang digunakan dalam penelitian ini lebih panjang yaitu 180 menit disebabkan bakteri untuk mencapai usus halus memerlukan waktu dan selama perjalanan menuju usus pH pencernaan masih berada pada kondisi yang asam. Kemampuan L. plantarum D-01, L. lactis D-01, B. longum Y-01 dan L. acidophilus Y-01 tumbuh atau bertahan pada keasaman lambung yang berbeda selama 180 menit dapat dilihat Tabel 3.
Bakteri L. plantarum D-01 dan L. lactis D-01 mengalami penurunan
populasi ketika berada pada pH 2, sedangkan bakteri B. longum Y-01 dan L. acidophilus Y-01 mampu bertahan dan beradapatasi ketika berada pada pH 2
(Tabel 3). Bakteri L. plantarum D-01 mengalami penurunan populasi sebesar 1,51 log10 cfu/ml dan L. lactis D-01 mengalami penurunan sebesar 1,27 log10 cfu/ml
29 bakteri yang berhasil bertahan pada kondisi pH rendah, maka bakteri tersebut dinyatakan bersifat tahan/resisten terhadap asam, sehingga walaupun penurunan jumlah koloni lebih dari 1 log cfu/ml bukan berarti bakteri tersebut tidak tahan terhadap pH 2, kecuali BAL tersebut memang tidak mampu bertahan pada pH 2, ditunjukkan oleh tidak dijumpai populasi bakteri pada kondisi tersebut.
Tabel 3. Jumlah Populasi BAL Indigenous Dadiah dan Produk Olahan Susu Sapi pada Kondisi Keasaman Lambung yang Berbeda
No. Lama
inkubasi
Populasi BAL (log10 cfu/ml)
L. plantarum
Keterangan :*hasil P yang (-) menunjukkan adanya kematian BAL
Superskrip (A,B) pada kolom dan kondisi pH yang sama menunjukkan perbedaan yang sangat nyata (P<0,01)
Superskrip (a,b) pada kolom dan kondisi pH yang sama menunjukkan perbedaan yang nyata (P<0,05)
Uji t dilakukan dengan membandingkan populasi pada menit ke-0 dengan ke-180 menit
30 lambung tersebut. Bakteri L. plantarum D-01 mengalami penurunan jumlah populasi sebesar 1,51 log10 cfu/ml pada pH 2,5, sedangkan bakteri B. longum Y-01
mampu tumbuh dan meningkatkan jumlah populasi sebesar 0,26 log10 cfu/ml pada
kondisi yang sama. Bakteri L. plantarum D-01 tetap dikatakan mampu bertahan hidup di media dengan pH 2,5 meskipun mengalami penurunan populasi disebabkan bakteri tersebut masih dapat mempertahankan jumlah populasinya sebesar 79%.
Pada pH 3,2, bakteri L. plantarum D-01 dan L. lactis D-01 mengalami penurunan jumlah populasi, sedangkan bakteri B. longum Y-01 dan L. acidophilus Y-01 mengalami peningkatan jumlah populasi. Bakteri L. acidophilus Y-01 mengalami peningkatan sebesar 0,31 log10 cfu/ml serta bakteri L. plantarum D-01
mengalami penurunan sebesar 1,44 log10 cfu/ml. Bakteri L. plantarum D-01 tetap
dikatakan mampu bertahan pada pH 3,2 disebabkan sebagian besar bakteri (81%) mampu bertahan pada pH rendah, meskipun mengalami penurunan tetap dikatakan bakteri tersebut tahan terhadap pH (Jacobsen et al., 1999).
Pada pH 7,2, keempat BAL yang diuji dapat tumbuh serta memiliki ketahanan yang sangat baik dan tidak mengalami penurunan jumlah populasi. Populasi B. longum Y-01 mampu meningkatkan sebesar 0,44 log10 cfu/ml dan
L. acidophilus sebesar 0,36 log10 cfu/ml ketika ditumbuhkan pada pH 7,2. Bakteri
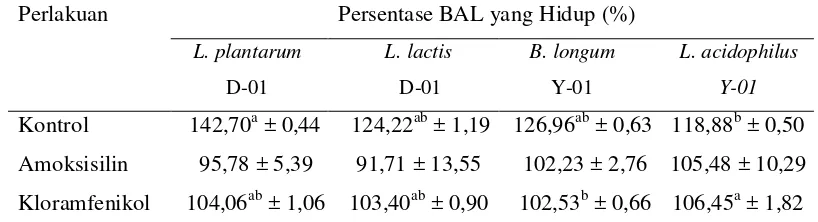
L. plantarum D-01, L. lactis D-01, B. longum Y-01 dan L. acidophilus Y-01 memiliki ketahanan yang baik pada kondisi keasaman lambung yang berbeda baik pada pH 2, 2,5, 3,2 serta 7,2 disebabkan jumlah persentase bakteri yang hidup lebih dari 75% yang dapat dilihat pada Tabel 4.
Tabel 4. Persentase BAL yang Hidup pada Kondisi Keasaman Lambung yang Berbeda
Perlakuan Persentase BAL yang Hidup (%)
L. plantarum
31 Pada pH 2 dan 2,5, persentase bakteri L. plantarum D-01, L. lactis D-01, B. longum Y-01 dan L. acidophilus Y-01 secara nyata berbeda-beda, yakni bakteri B. longum Y-01 mempunyai jumlah persentase bakteri hidup terbesar pada pH 2 yang nilainya tidak berbeda dengan L. acidophilus Y-01. Pada pH 2,5 jumlah persentase bakteri hidup terbesar adalah L. acidophilus Y-01 yang nilainya tidak berbeda dengan L. lactis D-01 dan B. longum Y-01. Pada pH 3,2, persentase kemampuan BAL yang hidup secara nyata sangat berbeda yaitu B. longum Y-01 mempunyai jumlah persentase bakteri hidup terbesar yang nilainya tidak berbeda dengan L. lactis D-01 dan L. acidophilus Y-01.
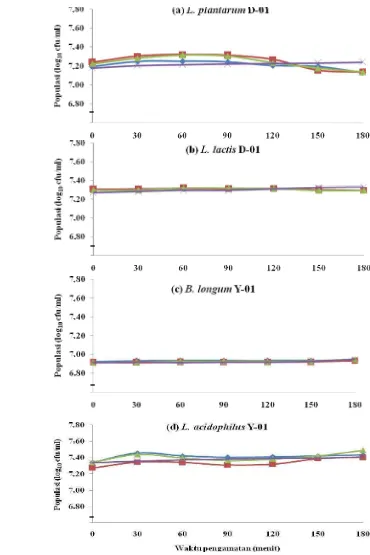
Bakteri B. longum Y-01 dan L. acidophilus Y-01 memiliki persentase bakteri hidup lebih besar dibandingkan bakteri L. plantarum D-01 dan L. lactis D-01 (Tabel 4) disebabkan Bifidobacteria dan L. acidophilus merupakan mikroba yang berkarakteristik mampu mencapai dan hidup dalam keadaan utuh di dalam usus dengan jumlah yang cukup tinggi (Nakazawa dan Hosono, 1992). Pada penelitian ini selain mengetahui jumlah populasi dan persentase bakteri yang dapat bertahan dan tumbuh, juga diamati perubahan populasi selama perlakuan yang dapat dilihat pada Gambar 5.
32 Gambar 5. Grafik Pertumbuhan Kultur Starter BAL Indigenous Dadiah dan Produk Olahan Susu Sapi pada Kondisi Keasaman Lambung yang Berbeda dengan pH 2 ( ), pH 2,5 ( ), pH 3,2 ( ) dan 7,2 ( )
=
=
=
= , , ,
, , ,
, , ,
, , ,
, , ,
, , ,
, , ,