PENCIRIAN ELEKTRODE PASTA KARBON
TERMODIFIKASI ZEOLIT-BESI SEBAGAI MEDIA DETEKSI
KROMIUM(VI)
ROFIQOH INAYATI AGUSTINA
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
ROFIQOH INAYATI AGUSTINA. Pencirian Elektrode Pasta Karbon
Termodifikasi Zeolit-Besi sebagai Media Deteksi Kromium(VI). Dibimbing oleh
ETI ROHAETI dan ZULHAN ARIF.
Kromium di lingkungan berada dalam dua spesi dominan, yaitu Cr(III) dan
Cr(VI). Keduanya bersifat stabil, namun Cr(VI) memiliki toksisitas lebih tinggi
daripada Cr(III). Metode pengukuran yang telah ada tidak dapat membedakan
kedua spesi kromium tersebut. Oleh karena itu, metode pengukuran yang lebih
sensitif dan selektif diperlukan untuk spesiasi keduanya, terutama untuk
pengukuran Cr(VI). Pada penelitian ini elektrode pasta karbon termodifikasi
zeolit-besi dikembangkan untuk pengukuran Cr(VI) menggunakan metode
voltametri. Elektrode dibuat dengan mencampurkan grafit, zeolit
termodifikasi-besi, dan parafin cair. Pengukuran dilakukan menggunakan metode voltametri
siklik pada rentang potensial -1.2 V sampai 1.2 V. Larutan KCl 0.05 M digunakan
sebagai larutan elektrolit. Pencirian elektrode dilakukan terhadap tiga parameter,
yaitu pengaruh pH analit, waktu prakonsentrasi, dan komposisi zeolit-besi.
Pengukuran Cr(VI) optimum dilakukan pada larutan Cr(VI)
50 μM
pH 3,
menggunakan elektrode pasta karbon termodifikasi zeolit-besi sebesar 20%
dengan waktu prakonsentrasi selama 25 menit. Arus puncak katodik sebesar 5.22
μ
A, dihasilkan pada kondisi optimum tersebut.
Kata kunci: arus katodik, elektrode pasta karbon, kromium(VI), voltametri siklik,
zeolit termodifikasi-besi.
ABSTRACT
ROFIQOH INAYATI AGUSTINA. Characterization of Zeolites-Iron Modified
Carbon Paste Electrode as a Detection Medium for Chromium(VI). Supervised by
ETI ROHAETI and ZULHAN ARIF.
Chromium exists in the environment especially in two stable species,
namely Cr(III) and Cr(VI). Cr(VI) has a higher toxicity than Cr(III). The existing
determination method could not distinguish the two species of chromium. It is
necessary to differentiate the two, especially for Cr(VI) measurement.
Zeolites-iron modified carbon paste electrode was developed for the voltammetric
determination of Cr(VI). The electrode was made by mixing graphite powder, iron
modified zeolites, and paraffin oil. The measurement of Cr(VI) was carried out by
cyclic voltammetry at -1.2 V to 1.2 V. KCl 0.05 M solution was used as the
electrolyte solution. The electrodes were characterized based on the effect of
analyte acidity, preconcentration time, and zeolite-iron composition. The optimum
measurement of the Cr (VI) was at pH 3, 25 minutes preconcentration time, and
20% weight composition of zeolites-iron, that yield the highest reduction current
was 5.22
μ
A at Cr
(VI) 50 μM.
PENCIRIAN ELEKTRODE PASTA KARBON
TERMODIFIKASI ZEOLIT-BESI SEBAGAI MEDIA DETEKSI
KROMIUM(VI)
ROFIQOH INAYATI AGUSTINA
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Pencirian Elektrode Pasta Karbon Termodifikasi Zeolit-Besi
sebagai Media Deteksi Kromium(VI)
Nama
: Rofiqoh Inayati Agustina
NIM
: G44080021
Disetujui oleh
Pembimbing I
Dr. Eti Rohaeti, MS
NIP 19600807 198703 2 001
Pembimbing II
Zulhan Arif, M.Si
Diketahui oleh
Ketua Departemen
Prof. Dr. Ir. Tun Tedja Irawadi, MS
NIP 19501227 197603 2 002
PRAKATA
Alhamdulillah, puji dan syukur penulis panjatkan ke hadirat Allah SWT
yang senantiasa melimpahkan rahmat dan karunia-Nya sehingga penulis dapat
menyelesaikan k
arya ilmiah yang berjudul “
Pencirian Elektrode Pasta Karbon
Termodifikasi Zeolit-Besi sebagai Media Deteksi Kromium(VI)
”. Karya ilmiah
ini disusun berdasarkan penelitian yang telah dilaksanakan oleh penulis sejak
bulan Maret hingga September 2012 di Laboratorium Kimia Analitik dan
Laboratorium Bersama, Departemen Kimia, Institut Pertanian Bogor.
Penulis mengucapkan terima kasih kepada Ibu Dr. Eti Rohaeti, MS dan
Bapak Zulhan Arif, M.Si selaku pembimbing atas bimbingan, dukungan,
motivasi, dan doa yang diberikan kepada penulis selama melaksanakan penelitian.
Penghargaan juga penulis sampaikan kepada Bapak Drs. Sulistioso Giat Sukaryo,
MT dan Kak Budi Riza Putra, S.Si atas diskusi dan saran berkaitan dengan
penelitian. Kepada Bapak Budi Arifin, S.Si, M.Si, Ibu Dr. Tetty Kemala, M.Si,
dan Ibu Betty Marita Soebrata, S.Si, M.Si, terima kasih atas saran dan perbaikan
yang diberikan terkait penulisan karya ilmiah ini. Ucapan terima kasih penulis
sampaikan pula kepada Pak Eman Suherman, Bu Nunung Nuryanti, Pak Kosasih,
Pak Edi Suhendar, dan Mas Eko, atas bantuan yang diberikan selama penulis
melaksanakan penelitian.
Terima kasih yang tak terhingga penulis ucapkan kepada M
a’e
, Bapak,
Kakak-kakak, Mba Ely (alm), serta seluruh keluarga, atas segala doa, dukungan,
dan kasih sayang yang diberikan. Ungkapan terima kasih juga penulis sampaikan
kepada teman-teman satu bimbingan, yaitu Eko Prabowo, Mutiara Wide, dan
Restu Widyastuti atas diskusi dan masukan yang diberikan selama mengerjakan
tugas akhir ini. Akhir kata, semoga karya ilmiah ini dapat bermanfaat bagi
kemajuan ilmu pengetahuan
.
Bogor, November 2012
RIWAYAT HIDUP
Penulis dilahirkan di Banjarnegara pada tanggal 4 Agustus 1990 dari
pasangan Bapak Sukadir dan Ibu Juchanah. Penulis merupakan anak kedelapan
dari delapan bersaudara. Penulis lulus dari SMA Negeri 1 Banjarnegara pada
tahun 2008 dan pada tahun yang sama lulus seleksi masuk IPB melalui jalur
Undangan Seleksi Masuk IPB (USMI). Penulis memilih Departemen Kimia,
Fakultas Matematika dan Ilmu Pengetahuan Alam.
Selama menjalani perkuliahan, penulis aktif menjadi asisten praktikum
Kimia TPB pada tahun 2009−
2012, Kimia Analitik untuk mahasiswa Biologi
pada tahun ajaran 2010/2011, Elektroanalitik dan Teknik Pemisahan pada tahun
ajaran 2011/2012, dan Spektrofotometri dan Aplikasi Kemometrik pada tahun
ajaran 2011/2012. Penulis juga aktif dalam kegiatan organisasi Ikatan Mahasiswa
Kimia (Imasika) pada tahun 2009/2010 sebagai staf Departemen Peningkatan
Kualitas dan Keprofesian Mahasiswa (PK2M) dan pada tahun 2010/2011 sebagai
Kepala Departemen PK2M. Penulis pernah berkesempatan menjadi perwakilan
IPB dalam Olimpiade Nasional Matematika dan Ilmu Pengetahuan Alam
(ON-MIPA) Perguruan Tinggi Bidang Kimia Tingkat Wilayah III pada tahun 2011.
Penulis juga berkesempatan menjalani praktik lapangan di Laboratorium
Quality
Control
, PT Novell Pharmaceutical Laboratories pada tahun 2011 dengan judul
laporan “Uji Kinerja Kolom LiChrospher 100 RP
-18 pada Kromatografi Cair
DAFTAR ISI
Halaman
DAFTAR TABEL ... vii
DAFTAR GAMBAR ... vii
DAFTAR LAMPIRAN ... vii
PENDAHULUAN... 1
METODE ... 1
Bahan dan Alat ... 1
Prosedur Penelitian ... 2
HASIL DAN PEMBAHASAN ... 3
Hasil Preparasi, Aktivasi, dan Identifikasi Zeolit ... 3
Pembuatan Zeolit Termodifikasi-besi dan Uji Adsorpsi ... 4
Pembuatan Elektrode dan Uji Kinerja dengan Voltametri ... 6
SIMPULAN DAN SARAN ... 8
Simpulan ... 8
Saran ... 9
DAFTAR PUSTAKA ... 9
DAFTAR TABEL
Halaman
1
Bahan dan komposisi elektrode ... 3
2
Puncak 2θ zeolit alam morde
nit dan zeolit alam Cikalong setelah aktivasi... 4
DAFTAR GAMBAR
Halaman
1
Skema pembuatan elektrode pasta karbon ... 2
2
Contoh reaksi pelepasan Al dari kerangka zeolit oleh HCl... 4
3
Kerangka (a) 3 dimensi zeolit mordenit dan (b) struktur tetrahedral zeolit;
atom Si ( ), atom Al ( ), atom O ( ) ... 5
4
Zeolit termodifikasi-besi ... 5
5
Morfologi permukaan (a) zeolit sebelum modifikasi dan (b) zeolit
termodifikasi-besi pada perbesaran 3000× ... 5
6
Reaksi Cr(VI) dengan DPC ... 6
7
Voltamogram EPK ( ) dan EPKZB ( ) pada larutan elektrolit KCl
0.05 M ... 7
8
Nilai arus puncak EPKZB pada larutan Cr(VI) 50 μM pH 1−6
... 7
9
Diagram Pourboix spesi ion Cr(VI) pada suhu 25 °C ... 7
10
Pengaruh waktu prakonsentrasi terhadap arus reduksi Cr(VI) ... 8
11
Pengaruh komposisi zeolit-besi terhadap arus reduksi Cr(VI) ... 8
DAFTAR LAMPIRAN
Halaman
1
Diagram alir penelitian ... 12
2
Difraktogram sinar-X zeolit alam asal Cikalong setelah aktivasi ... 13
3
Data
2θ
difraktogram sinar-X zeolit alam asal Cikalong setelah aktivasi ... 14
4
Basis data puncak 2θ nomor arsip
49-0924 pada JCPDS untuk zeolit alam
jenis mordenit ... 15
5
Reaksi stoikiometri antara Fe(NO
3)
3dengan NaOH ... 16
Halaman
7
Penentuan panjang gelombang maksimum pengukuran Cr(VI) ... 18
8
Hasil uji adsorpsi larutan Cr(VI) oleh zeolit sebelum dan setelah
PENDAHULUAN
Kromium merupakan logam berat yang dapat ditemukan di alam terutama dalam 2 tingkat oksidasi, yaitu Cr(III) dan Cr(VI). Cr(III) merupakan senyawa yang sangat diperlukan untuk metabolisme karbohidrat dan lipid. Cr(III) telah terbukti sebagai unsur esensial yang dibutuhkan oleh mamalia dalam
jumlah kecil yang berperan dalam
metabolisme glukosa, lipid, dan protein (Vincent 2000). Sementara itu, Cr(VI)
dilaporkan bersifat karsinogenik dan
mutagenik serta mudah diserap melalui kulit
(Patlolla et al. 2009). Oleh karena perbedaan
toksisitas kedua spesi kromium tersebut, penting untuk menentukan konsentrasi Cr(VI) di samping konsentrasi total kromium dalam
menduga toksisitas suatu sampel (Liu et al.
2008).
Teknik analitik untuk penentuan kromium
telah banyak dilakukan, antara lain
spektrofotometri, spektrometri serapan atom (AAS), spektrometri emisi atom plasma
gandeng induktif (ICP-AES), dan
kromatografi cair kinerja tinggi (HPLC)
(Narin et al. 2006). Desain peralatan tersebut
cukup rumit dan harganya mahal sehingga tidak cocok digunakan untuk analisis rutin. Selain itu, teknik-teknik tersebut tidak dapat digunakan untuk membedakan kedua spesi kromium. Oleh karena itu, diperlukan suatu teknik atau metode yang sederhana, murah, sensitif, dan spesifik untuk deteksi dan spesiasi kromium di lingkungan.
Salah satu teknik yang dapat digunakan adalah elektrode selektif ion (ESI). ESI
merupakan suatu sensor elektrokimia
potensiometrik yang banyak digunakan karena mudah disiapkan, peralatannya sederhana, selektif, waktu respons cepat, dan biayanya murah. ESI memberikan respons secara selektif terhadap spesi ion tertentu dan bagian permukaannya melakukan kontak dengan ion yang akan ditentukan. ESI berbasis pasta karbon seperti yang dibuat pada penelitian ini
dipilih karena lebih murah, memiliki
keunggulan resistans ohmik jauh lebih rendah, respons sangat stabil, dan pembaharuan permukaan yang lebih mudah.
Aplikasi ESI berbasis pasta karbon yang dapat digunakan untuk penentuan kromium adalah dengan memanfaatkan elektrode zeolit termodifikasi. Keuntungan utama elektrode zeolit termodifikasi dibandingkan dengan elektrode kimia termodifikasi adalah bentuk dan ukurannya yang unik, adanya selektivitas muatan, dan memiliki kapasitas pertukaran
ion yang tinggi (Ardakani et al. 2009). Secara
empiris telah terbukti bahwa reaksi pertukaran ion yang terjadi pada elektrode zeolit termodifikasi merupakan hal yang paling utama dalam aplikasinya sebagai sensor
elektrokimia (Ardakani et al. 2007).
Penelitian menunjukkan bahwa modifikasi
zeolit alam dengan Fe(OH)3 meningkatkan
kapasitas tukar anionnya (Syafii 2011). Modifikasi permukaan zeolit alam dengan kation besi juga terbukti telah mengubah permukaan zeolit alam menjadi bermuatan positif dan menunjukkan kemampuan adsorpsi terhadap Cr(VI) yang lebih baik daripada zeolit sintetik termodifikasi-besi (Arif 2011). Pada penelitian ini, zeolit alam yang berasal dari Cikalong, Jawa Barat, dimodifikasi dengan besi dan dibuat elektrode berbasis
pasta karbon, kemudian dilakukan
karakterisasi berupa pengujian kinerja
elektrode tersebut dengan melihat pengaruh pH analit, waktu prakonsentrasi, serta komposisi zeolit-besi terhadap pengukuran arus katodik Cr(VI) dengan teknik voltametri siklik.
METODE
Metode penelitian mengikuti diagram alir pada Lampiran 1 yang meliputi preparasi dan
aktivasi zeolit, pembuatan zeolit
termodifikasi-besi, penentuan kadar Fe dalam
zeolit termodifikasi-besi, uji adsorpsi
kromium, pembuatan elektrode, uji kinerja elektrode menggunakan metode voltametri, analisis difraksi sinar-X (XRD) terhadap zeolit aktif, serta analisis mikroskop elektron payaran (SEM) terhadap zeolit sebelum modifikasi, zeolit termodifikasi-besi, dan pasta karbon termodifikasi zeolit-besi.
Bahan dan Alat
Bahan-bahan yang digunakan meliputi zeolit alam asal Cikalong, Jawa Barat, larutan
HCl 3 M, NaOH 0.075 M, Fe(NO3)3 0.05 M,
HNO3 5%, H2SO4 pekat, H3PO4 pekat,
1,5-difenilkarbazida (DPC), K2Cr2O7, HCl 1 N,
NaOH 1 N, KCl, grafit, dan parafin cair. Alat-alat yang digunakan meliputi mortar, ayakan 200 mesh, pengaduk magnet, sentrifus, spektrofotometer ultraviolet-tampak (UV-Vis) Thermo Spectronic Genesys 10UV, AAS
Shimadzu AA-7000, tabung elektrode,
2
Prosedur Penelitian
Preparasi Zeolit (Suwardi 2000)
Zeolit asal Cikalong, Jawa Barat, digiling lalu diayak hingga diperoleh zeolit dengan ukuran butir lolos ayakan 200 mesh. Setelah itu, zeolit dicuci dengan akuades dan dikeringankan di dalam oven pada suhu 105
o
C selama 24 jam.
Aktivasi Zeolit (Arif 2011)
Aktivasi zeolit dilakukan secara kimia dan
fisika, yaitu dengan pengasaman dan
pemanasan. Sampel zeolit siap pakai
ditimbang sebanyak 100 g dan ditambah larutan HCl 3 M sebanyak 250 mL. Campuran diaduk dengan pengaduk magnet selama 60 menit, kemudian disaring dan dibilas dengan
akuades hingga menunjukkan pH sekitar 5−6.
Selanjutnya zeolit dikeringkan dalam tanur pada suhu 300 °C selama 3 jam. Pencucian dihentikan apabila sudah tidak terdapat endapan pada filtrat ketika ditambah dengan
AgNO3.
Pembuatan Zeolit Termodifikasi-Besi (Arif 2011)
Preparasi larutan besi dilakukan dengan mencampur 50 mL larutan NaOH 0.075 M
dengan 50 mL larutan Fe(NO3)3 0.05 M.
Pencampuran dilakukan dengan meneteskan larutan NaOH secara perlahan-lahan ke dalam larutan besi, sambil diaduk dengan kecepatan rendah menggunakan pengaduk magnet. Larutan yang telah tercampur sempurna
kemudian diukur tingkat keasamannya.
Larutan yang sudah siap, ditambahkan sebanyak 75 mL pada contoh zeolit sebanyak 1 g dan dikocok selama 12 jam. Hasilnya dicuci dengan air dan dikeringkan dalam oven pada suhu 40 °C.
Penentuan Kadar Fe pada Zeolit
Termodifikasi-Besi
Kadar Fe dalam zeolit termodifikasi-besi
ditentukan menggunakan AAS. Zeolit
sebelum dan setelah dimodifikasi
masing-masing ditimbang sebanyak 50 mg,
ditambahkan 10 mL larutan HNO3 5%,
kemudian didiamkan selama 60 menit. Selanjutnya campuran disaring dan filtrat ditepatkan dengan labu takar menjadi 50 mL. Larutan selanjutnya diukur menggunakan AAS. Penentuan kadar Fe dilakukan secara triplo.
Uji Adsorpsi Kromium (Arif 2011)
Uji adsorpsi dilakukan dengan
menggunakan larutan standar Cr(VI) dengan
konsentrasi 1.5−250 μM dengan keasamaan
diatur di sekitar pH 3. Contoh zeolit termodifikasi-besi sebanyak 50 mg ditambah dengan 5 mL larutan standar Cr(VI) kemudian dikocok selama 6 jam. pH akhir larutan diukur dan larutan dipisahkan dari endapannya
dengan menggunakan sentrifus pada
kecepatan 1500 rpm. Larutan kemudian
ditambahkan 0.1 mL H2SO4 pekat dan 0.03
mL H3PO4 pekat, dikocok dan dibiarkan
selama 5 menit. Selanjutnya sebanyak 0.1 mL DPC 1% dalam aseton ditambahkan ke dalam larutan dan diaduk dengan baik. Setelah 10 menit, larutan diukur serapannya dengan
spektrofotometer UV-Vis pada panjang
gelombang 543 nm.
Pembuatan Elektrode (modifikasi Alpat et al. 2005)
Elektrode pasta karbon (EPK) dibuat dengan mencampurkan grafit dan parafin cair,
sementara elektrode pasta karbon
termodifikasi zeolit-besi (EPKZB) dibuat
dengan mencampurkan grafit, zeolit
termodifikasi-besi, dan parafin cair. Semua bahan dicampur hingga membentuk pasta homogen. Sebuah tabung kaca dengan diameter 2.5 mm digunakan sebagai badan
elektrode. Kawat tembaga sebagai
penghubung elektrode ke sumber listrik dimasukkan ke dalam tabung hingga tersisa ruang kosong sekitar 3 mm pada ujung tabung. Pasta dimasukkan ke ujung tabung tersebut hingga penuh dan padat (Gambar 1).
Permukaan elektrode lalu digosok
menggunakan kertas minyak.
Uji Kinerja Elektrode dengan Metode Voltametri (modifikasi Alpat et al. 2005)
Pada uji kinerja ini, 3 parameter dilihat pengaruhnya terhadap respons arus dari elektrode. Parameter tersebut adalah pH larutan analit, waktu prakonsentrasi, dan
komposisi zeolit-besi. Pengukuran pada
elektrode dilakukan dengan teknik voltametri siklik menggunakan perangkat lunak EChem v2.1. EPK dan EPKZB sebagai elektrode kerja, elektrode Ag/AgCl digunakan sebagai
elektrode pembanding, dan elektrode Pt
sebagai elektrode tambahan. Potensial yang digunakan dari -1.2 V sampai 1.2 V dengan kecepatan pemayaran sebesar 100 mV/s.
Sebelum dilakukan pengukuran, larutan
dialirkan gas N2 terlebih dahulu selama 20
detik. Pengolahan data voltametri dilakukan dengan perangkat lunak Origin 7.
Pengaruh pH Larutan Analit. Larutan
analit Cr(VI)50 μM dalam KCl 0.05 M dibuat
pada beberapa tingkat keasaman, yaitu pada pH 1−6. Larutan dimasukkan ke dalam sel voltametri yang berisi larutan analit Cr(VI) dan respons arus diamati menggunakan voltametri siklik pada selang potensial -1.2 V sampai 1.2 V.
Pengaruh Waktu Prakonsentrasi.
Larutan Cr(VI) 50 μM yang memiliki pH
terbaik ditentukan waktu prakonsentrasi
optimumnya dengan pengadukan secara
magnetik pada suhu kamar. Variasi waktu yang digunakan adalah 5−35 menit dengan selang waktu 5 menit. Setelah dilakukan
pengadukan, elektrode dibilas dengan
akuabides dan dimasukkan ke dalam sel voltametri yang berisi larutan elektrolit.
Respons arus diamati menggunakan
voltametri siklik pada selang potensial -1.2 V sampai 1.2 V.
Pengaruh Komposisi Zeolit-Besi.
EPKZB dibuat dengan mencampurkan grafit, zeolit termodifikasi-besi, dan parafin cair dalam beberapa komposisi, seperti tersaji pada Tabel 1. Hal ini dilakukan untuk melihat pengaruh komposisi zeolit-besi terhadap
kinerja EPK. Elektrode dilakukan
prakonsentrasi terlebih dahulu dengan larutan analit Cr(VI) yang memiliki pH optimum
pada waktu prakonsentrasi terbaik.
Selanjutnya respons arus diamati
menggunakan voltametri siklik pada selang potensial -1.2 V sampai 1.2 V.
Tabel 1 Bahan dan komposisi elektrode
Elektrode Komposisi Grafit (mg) Zeolit-besi (mg) Parafin cair (mg)
EPKZB 10 60 10 30
EPKZB 20 50 20 30
EPKZB 30 40 30 30
EPKZB 40 30 40 30
EPKZB 50 20 50 30
Analisis XRD
Identifikasi dengan XRD dilakukan untuk mengidentifikasi jenis mineral yang terdapat di dalam zeolit. Sekitar 200 mg sampel dicetak langsung pada aluminium ukuran
2×2.5 cm2. Sampel dicirikan dengan lampu
radiasi Cu pada kisaran 2θ 5−80°.
Analisis SEM
Pencirian dengan SEM dilakukan untuk
menentukan morfologi sampel zeolit.
Pencirian dilakukan terhadap zeolit Cikalong sebelum modifikasi dan zeolit termodifikasi-besi.
HASIL DAN PEMBAHASAN
Hasil Preparasi, Aktivasi, dan Identifikasi Zeolit
Zeolit alam yang digunakan pada
penelitian ini masih berbentuk bongkahan, berasal dari Cikalong, Jawa Barat. Zeolit asal Cikalong umumnya berwarna putih kehijauan sampai keabuan, berbintik-bintik putih dan kuning, berbutir halus sampai agak kasar, agak keras namun sebagian mudah hancur bila
dipukul dengan palu. Preparasi dilakukan
dengan menghancurkan dan mengayak zeolit menjadi butir yang lolos ayakan 200 mesh.
Aktivasi zeolit bertujuan untuk
menghilangkan pengotor (mineral
pengganggu) yang berupa oksida logam dari
alam yang menutupi rongga sehingga
kapasitas tukar ion dan kapasitas adsorpsinya menjadi maksimal (Fatimah 2000).
Aktivasi zeolit pada penelitian ini
dilakukan secara kimia dan fisika. Prinsip aktivasi secara kimia adalah menambahkan pelarut tertentu yang bertujuan membersihkan
permukaan pori, membuang senyawa
4
(Suwardi 2000). Hal ini bertujuan
menghilangkan air yang terperangkap dalam pori-pori zeolit sehingga dapat meningkatkan luas permukaan zeolit.
Aktivasi secara kimia pada penelitian ini dilakukan dengan pengasaman menggunakan HCl 3 M selama 1 jam. Menurut Weitkamp
dan Puppe (1999),aktivasi menggunakan HCl
pada konsentrasi 0.1−11 M menyebabkan
zeolit mengalami dealuminasi dan
dekationisasi, yaitu keluarnya Al dan kation-kation dari pori zeolit. Contoh reaksi pelepasan Al dari kerangka zeolit oleh HCl dapat dilihat pada Gambar 2. Aktivasi-asam
ini menyebabkan bertambahnya luas
permukaan zeolit karena berkurangnya
pengotor yang menutupi pori-pori zeolit. Bertambahnya luas permukaan ini diharapkan dapat meningkatkan kemampuan adsorpsinya.
Zeolit yang telah diaktivasi selanjutnya diidentifikasi jenis mineralnya menggunakan XRD. Prinsipnya adalah jika seberkas sinar-X dijatuhkan pada sampel kristal, maka bidang kristal akan membiaskan sinar-X dan sinar tersebut akan ditangkap oleh detektor yang kemudian diterjemahkan sebagai sebuah puncak difraksi. Makin banyak bidang kristal yang terdapat dalam sampel, makin kuat intensitas pembiasan yang dihasilkan. Tiap puncak yang muncul pada pola XRD mewakili satu bidang kristal yang memiliki orientasi tertentu dalam sumbu 3 dimensi.
Identifikasi dilakukan dengan
membandingkan puncak-puncak 2θ yang khas dari sampel dengan puncak 2θ standar.
Hasil difraktogram (Lampiran 2)
menunjukkan bahwa nilai 2θ sampel memiliki kemiripan dengan data standar dari Joint Committee on Powder Diffraction Standards (JCPDS) dengan nomor arsip 49-0924 yang merupakan jenis zeolit mordenit. Hal ini menunjukkan bahwa zeolit alam asal Cikalong ini memiliki jenis mineral mordenit. Hasil ini sejalan dengan beberapa penelitian yang telah
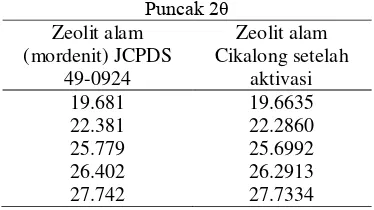
dilakukan sebelumnya bahwa zeolit alam asal Cikalong hanya mempunyai 1 jenis mineral yang dominan, yaitu mordenit (Sutopo 1991; Wyantuti 2008; Arif 2011) dengan pengotor berupa kuarsa (Rohaeti 2007; Wyantuti 2008). Perbandingan beberapa nilai 2θ tertinggi sampel dan standar ditampilkan pada Tabel 2. Rujukan data asli hasil XRD dapat dilihat pada Lampiran 3 dan Lampiran 4.
Tabel 2 Puncak 2θ zeolit alam mordenit dan zeolit alam Cikalong setelah aktivasi
Puncak 2θ Zeolit alam (mordenit) JCPDS 49-0924 Zeolit alam Cikalong setelah aktivasi
19.681 19.6635
22.381 22.2860
25.779 25.6992
26.402 26.2913
27.742 27.7334
Pembuatan Zeolit Termodifikasi-besi dan Uji Adsorpsi
Zeolit merupakan suatu mineral
aluminosilikat terhidrasi yang terdiri atas
satuan-satuan tetrahedral SiO4 dan AlO4
dengan kerangka struktur berongga yang ditempati oleh molekul-molekul air dan kation. Kation pada rongga zeolit dapat bergerak bebas sehingga memungkinkan pertukaran ion tanpa merusak struktur zeolit (Wang & Peng 2010). Struktur kristal zeolit
membentuk suatu kerangka tetrahedron
berantai dalam bentuk 3 dimensi (Gambar 3a). Pada kristal zeolit, kedudukan atom pusat tetrahedron ditempati oleh atom Si dan Al, sedangkan atom-atom oksigen berada pada sudut-sudutnya (Gambar 3b).
5
(a)
(b)
Gambar 3 Kerangka (a) 3 dimensi zeolit
mordenit dan (b) struktur
tetrahedral zeolit; atom Si ( ),
atom Al ( ), atom O ( ) (Las
2005).
Beberapa atom Si dalam zeolit digantikan
oleh atom Al, menghasilkan struktur
bermuatan negatif yang berasal dari perbedaan
antara tetrahedron (AlO4)
dan (SiO4)
4-. Adanya muatan negatif ini menyebabkan zeolit memiliki kemampuan yang rendah atau bahkan tidak memiliki daya jerap terhadap anion. Guna meningkatkan fungsi zeolit sebagai media spesiasi kromium, khususnya untuk deteksi spesi Cr(VI) yang bersifat anion, maka zeolit perlu dimodifikasi.
Pada penelitian ini, zeolit dimodifikasi dengan kation besi, yang merupakan hasil
reaksi antara Fe(NO3)3 dan NaOH. Reaksi
keduanya dilakukan secara perlahan-lahan sehingga menghasilkan larutan berwarna merah yang mengandung kation besi. Reaksi perlahan dimaksudkan untuk menghindari
terbentuknya endapan merah Fe(OH)3. Reaksi
antara Fe(NO3)3 dan NaOH serta
stoikiometrinya disajikan pada Lampiran 5. Hasil modifikasi zeolit dengan besi berupa serbuk berwarna jingga (Gambar 4). Untuk membuktikan keberadaan kation besi dalam
zeolit yang telah termodifikasi, maka
dilakukan pengujian kadar Fe menggunakan AAS. Kadar Fe dalam zeolit termodifikasi-besi dibandingkan dengan kadar Fe dalam
zeolit sebelum modifikasi. Terjadi
peningkatan kadar Fe yang signifikan, yaitu sebesar 95.6%, dari 0.2200 ppm menjadi 5.0013 ppm. Hal ini memperlihatkan bahwa modifikasi zeolit dengan kation besi berhasil
dilakukan. Data selengkapnya untuk
penentuan kadar Fe diberikan di Lampiran 6.
Gambar 4 Zeolit termodifikasi-besi.
Analisis morfologi menggunakan SEM dilakukan terhadap permukaan zeolit sebelum dan setelah modifikasi dengan besi. Hasil analisisnya dapat dilihat pada Gambar 5.
Gambar 5 Morfologi permukaan (a) zeolit sebelum modifikasi dan (b)
zeolittermodifikasi-besi pada
perbesaran 3000×.
Morfologi permukaan zeolit sebelum dan setelah dimodifikasi dengan besi pada
perbesaran 3000× menunjukkan adanya
6
termodifikasi-besi yang diperoleh pada
penelitian ini cukup berpori sehingga sangat berpotensi sebagai media adsorpsi Cr(VI) dan diaplikasikan sebagai elektrode selektif ion.
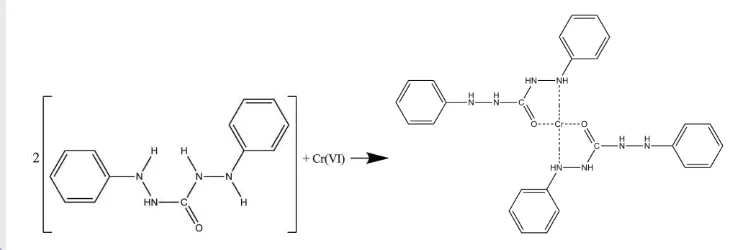
Uji adsorpsi terhadap Cr(VI) dilakukan pada zeolit sebelum dan setelah modifikasi menggunakan metode uji DPC. Metode ini didasarkan pada pengukuran serapan larutan berwarna ungu kemerahan yang menunjukkan
terjadinya kompleks antara
1,5-difenilkarbazida [(C6H5NHNH)2CO (DPC)]
dan Cr(VI) (Gambar 6). Kompleks kromium dengan DPC sangat sensitif jika diukur pada panjang gelombang 540 nm (Eaton & Franson
2005). Berdasarkan penentuan panjang
gelombang maksimum yang dilakukan pada rentang 500−600 nm, diperoleh panjang
gelombang maksimum untuk kompleks
tersebut adalah 543 nm. Data penentuan
panjang gelombang maksimum untuk
pengukuran Cr(VI) disajikan pada Lampiran 7.
Hasil uji adsorpsi pendahuluan
membuktikan bahwa modifikasi permukaan zeolit dengan kation besi mengubah sifat permukaan zeolit menjadi bermuatan positif sehingga meningkatkan adsorpsi terhadap Cr(VI). Zeolit tanpa modifikasi memiliki daya adsorpsi terhadap Cr(VI) yang sangat kecil,
terlihat dari terbentuknya warna ungu
kemerahan pada larutan yang menunjukkan terbentuknya kompleks antara Cr(VI) dengan DPC. Berbeda halnya dengan zeolit yang dimodifikasi dengan besi, daya adsorpsi zeolit ini terhadap Cr(VI) cukup tinggi, terlihat dari
berkurangnya intensitas warna ungu
kemerahan pada larutan setelah reaksi dengan DPC (Lampiran 8a).
Uji adsorpsi untuk menentukan kapasitas adsorpsi zeolit termodifikasi-besi dilakukan terhadap Cr(VI) pada rentang konsentrasi 1.5 hingga 250 μM, dengan jumlah zeolit-besi dan waktu pengocokan yang tetap. Hasilnya
menunjukkan bahwa semakin tinggi
konsentrasi Cr(VI) yang digunakan, kapasitas
adsorpsi juga meningkat. Kenaikan
konsentrasi akan meningkatkan jumlah ion adsorbat yang dapat diadsorpsi oleh adsorben selama tapak aktif masih memungkinkan untuk mengadsorpsinya (Sari 2012). Hasil ini memperlihatkan bahwa tapak aktif zeolit-besi masih mampu mengadsorpsi zeolit pada rentang konsentrasi yang digunakan, sehingga
pada konsentrasi yang semakin besar
diperkirakan kapasitas adsorpsinya pun akan semakin tinggi. Kapasitas adsorpsi paling tinggi diperoleh saat konsentrasi Cr(VI)
254.0952 μM, yaitu sebesar 25.1674 mg/g.
Data selengkapnya untuk uji adsorpsi zeolit termodifikasi-besi disajikan pada Lampiran 8b dan Lampiran 8c.
Pembuatan Elektrode dan Uji Kinerja dengan Voltametri
Analisis secara elektrokimia dengan
voltametri ini menggunakan sistem 3
elektrode, yaitu EPK dan EPKZB sebagai elektrode kerja, elektrode Ag/AgCl sebagai elektrode pembanding, dan elektrode Pt sebagai elektrode tambahan. Larutan KCl 0.05 M digunakan sebagai larutan elektrolit dalam
pengukuran Cr(VI). Larutan elektrolit
berfungsi mengurangi gaya tarik-menarik elektrostatik antara muatan elektrode dan muatan ion-ion analit serta mempertahankan kekuatan ion (Wang 2001). Gambar 7
memperlihatkan voltamogram EPK dan
EPKZB pada larutan elektrolit KCl 0.05 M. Dari potensial -1.2 V sampai 1.2 V, larutan KCl tidak memberikan respons arus puncak pada EPK maupun EPKZB. Hal ini berarti bahwa KCl baik digunakan sebagai larutan elektrolit karena tidak mengalami reaksi
oksidasi maupun reduksi pada selang
potensial yang digunakan.
7
-1.5 -1.0 -0.5 0.0 0.5 1.0 1.5
-25.0µ -20.0µ -15.0µ -10.0µ -5.0µ 0.0 5.0µ 10.0µ 15.0µ A ru s (A )
Potensial (V) vs Ag/AgCl
Gambar 7 Voltamogram EPK ( ) dan EPKZB ( ) pada larutan elektrolit KCl 0.05 M.
Pengaliran gas nitrogen dilakukan pada larutan elektrolit selama 20 detik sebelum pengukuran. Hal ini bertujuan menghilangkan oksigen terlarut yang terdapat di dalam larutan. Oksigen terlarut dapat menyebabkan reaksi redoks pada permukaan elektrode sehingga akan terlihat puncak oksigen pada voltamogram. Puncak ini dapat mengganggu analisis terutama jika oksigen memiliki puncak pada potensial yang mirip dengan
analit (Alpat et al. 2005). Potensial reduksi
standar oksigen dalam air pada 25 °C ialah
+0.40 V (versus elektode hidrogen standar
(SHE)). Reaksi reduksinya adalah sebagai berikut:
O2(g) + 2H2O(l) + 4e-→ 4OH-(aq) (Cotton &
Wilkinson 2007).
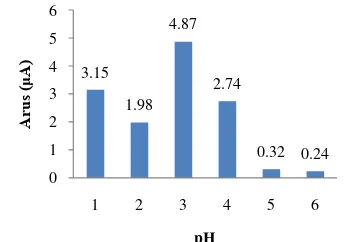
Pengujian kinerja EPK dan EPKZB terhadap larutan Cr(VI) dilakukan pada 3 parameter, yaitu pengaruh pH analit, waktu prakonsentrasi, dan komposisi zeolit-besi. Pengaruh pH analit terhadap sinyal arus
katodik dipelajari pada rentang pH 1−6 pada
larutan Cr(VI) 50 μM dalam KCl 0.05 M.
Puncak arus tertinggi diperoleh saat pH 3, yaitu sebesar 4.87 μA (Gambar 8). Arus ini
merupakan respons yang muncul saat
terjadinya reaksi reduksi Cr(VI) di dalam elektrode. Menurut Cotton dan Wilkinson (2007), reaksi reduksi Cr(VI) menjadi Cr(III)
terjadi pada potensial +1.33 V (vs SHE),
sedangkan reduksi Fe3+ menjadi Fe2+ terjadi
pada potensial +0.77 V (vs SHE). Pada
penelitian ini arus reduksi Cr(VI) muncul
pada potensial -0.62 V (vs Ag/AgCl).
Ion kromium dapat berada dalam keadaan
polivalen dengan muatan listrik yang
bergantung pada kondisi pH sistem. Fraksi
spesi Cr(VI) yang dominan berdasarkan pH larutan disajikan pada Gambar 9.
Gambar 8 Nilai arus puncak EPKZB pada larutan Cr(VI) 50 μM pH 1−6.
Gambar 9 Diagram Pourboix spesi ion Cr(VI)
pada suhu 25 °C (Welch et al.
2005).
Saat pH larutan antara 1 dan 6, kromium berada dalam kesetimbangan sebagai bentuk
HCrO4
dan Cr2O7
2-. Saat larutan berada pada kondisi pH di atas 6, Cr(VI) berada dalam
bentuk ion CrO42-, sedangkan saat pH kurang
dari 1 spesi yang utama adalah H2CrO4
(Cotton & Wilkinson 2007). Selain itu, Welch
et al. (2005) menyatakan bahwa pada rentang pH 0.75−6.25 terdapat 2 spesi Cr(VI) yang
dominan, yaitu HCrO4
jika konsentrasi
rendah (kurang dari 0.01 g/L) dan Cr2O72- jika
konsentrasi tinggi (di atas 0.01 g/L). Oleh karena pH optimum yang diperoleh adalah pH
3 dan larutan K2Cr2O7 yang digunakan untuk
penentuan pengaruh pH ini memiliki
konsentasi 50 μM atau setara dengan 0.0147 g/L, spesi Cr(VI) yang dominan di dalam
larutan adalah spesi Cr2O7
2-. Voltamogram
larutan Cr(VI) pada rentang pH 1−6 disajikan pada Lampiran 9a.
3.15 1.98 4.87 2.74 0.32 0.24 0 1 2 3 4 5 6
1 2 3 4 5 6
Parameter selanjutnya adalah waktu
prakonsentrasi. Prakonsentrasi merupakan
suatu tahapan yang bertujuan mengumpulkan
analit pada permukaan elektrode.
Prakonsentrasi dapat memberikan pengaruh
terhadap pengukuran arus analit pada
elektrode kerja. Pengaruh waktu
prakonsentrasi terhadap sinyal arus katodik dilakukan pada larutan Cr(VI) dengan pH 3. Prakonsentrasi dilakukan dengan merendam elektrode dalam larutan Cr(VI) sambil dilakukan pengadukan secara magnetik pada suhu kamar. Variasi waktu yang digunakan adalah 3−35 menit dengan selang waktu 5 menit.
Hasilnya menunjukkan bahwa waktu prakonsentrasi optimum untuk pengukuran Cr(VI) adalah 25 menit dengan menghasilkan arus sebesar 5.52 μA (Gambar 10). Voltamogram EPKZB untuk penentuan waktu
prakonsentrasi optimum disajikan pada
Lampiran 9b. Saat waktu prakonsentrasi 5−20 menit, arus yang dihasilkan rendah. Hal ini diduga disebabkan oleh belum sempurnanya permukaan elektrode dalam menjerap Cr(VI). Sementara itu, pada waktu prakonsentrasi yang lebih tinggi, permukaan elektrode sudah terlalu jenuh dalam menjerap Cr(VI) sehingga Cr(VI) yang sudah terjerap kembali terlepas
dan menghasilkan arus yang rendah (Alpat et
al. 2005).
Gambar 10 Pengaruh waktu prakonsentrasi terhadap arus reduksi Cr(VI).
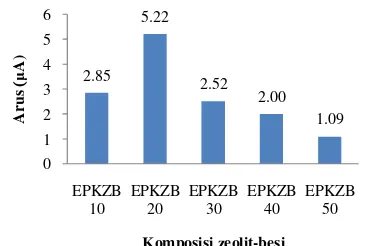
Parameter terakhir yang diuji pada penelitian ini adalah komposisi zeolit-besi. Uji ini dilakukan untuk menentukan komposisi zeolit-besi optimum yang memberikan sinyal paling baik untuk analisis Cr(VI). Larutan Cr(VI) yang digunakan memiliki pH 3 dan digunakan waktu prakonsentrasi 25 menit. Komposisi zeolit-besi divariasikan terhadap komposisi grafit. Variasi komposisi yang
dilakukan ialah 10%, 20%, 30%, 40%, dan 50%.
Voltamogram EPKZB akibat pengaruh komposisi zeolit-besi disajikan pada Lampiran 9c dan memperlihatkan bahwa komposisi
zeolit-besi yang optimum adalah 20%
(EPKZB 20) dengan arus puncak sebesar 5.22 μA. Komposisi zeolit-besi lainnya, yaitu EPKZB 10, EPKZB 30, EPKZB 40, dan EPKZB 50 memberikan arus puncak
berturut-turut sebesar 2.85, 2.52, 2.00, dan 1.09 μA
(Gambar 11).
Gambar 11 Pengaruh komposisi zeolit-besi terhadap arus reduksi Cr(VI).
Hasil ini memperlihatkan bahwa
komposisi zeolit-besi yang semakin banyak, tidak berkorelasi positif dengan arus puncak yang dihasilkan. Semakin besar komposisi
zeolit-besi, komposisi grafit di dalam
elektrode menjadi berkurang. Grafit di dalam elektrode memiliki fungsi sebagai penghantar listrik. Saat komposisi zeolit-besi sebesar 10%, arus yang dihasilkan kecil walaupun jumlah grafit yang ditambahkan merupakan jumlah yang paling besar. Hal ini diduga disebabkan pada komposisi tersebut zeolit-besi belum cukup optimal untuk menjerap Cr(VI). Sementara itu, saat komposisi zeolit-besi 30−50%, jumlah grafit di dalam elektrode sedikit sehingga proses penghantaran listrik tidak dapat berjalan dengan baik sehingga
menghasilkan arus yang rendah (Alpat et al.
2005).
SIMPULAN DAN SARAN
Simpulan
Zeolit alam asal Cikalong didominasi oleh jenis mineral mordenit. Modifikasi besi pada zeolit ini mampu meningkatkan kapasitas
2.85 5.22 2.52 2.00 1.09 0 1 2 3 4 5 6 EPKZB 10 EPKZB 20 EPKZB 30 EPKZB 40 EPKZB 50 A r u s (μ A) Komposisi zeolit-besi 2.63 2.77 3.62 4.05 5.52 3.94 3.97 0 1 2 3 4 5 6
5 10 15 20 25 30 35
A r u s ( μ A)
adsorpsi terhadap Cr(VI), seiring dengan meningkatnya konsentrasi Cr(VI). Kapasitas adsorpsi tertinggi sebesar 25.1674 mg/g diperoleh pada konsentrasi Cr(VI) 254.0952 μM. Zeolit termodifikasi-besi dapat digunakan sebagai pemodifikasi EPK untuk pengukuran Cr(VI) pada voltametri siklik menggunakan larutan elektrolit KCl 0.05 M pada rentang potensial -1.2 V sampai 1.2 V. Pengukuran Cr(VI) dengan voltametri siklik optimum
dilakukan pada larutan Cr(VI) 50 μM pH 3,
menggunakan elektrode pasta karbon
termodifikasi zeolit-besi sebesar 20% dengan waktu prakonsentrasi selama 25 menit. Arus
puncak katodik sebesar 5.22 μA, dihasilkan
pada kondisi optimum tersebut.
Saran
Tahapan selanjutnya yang perlu dilakukan
adalah penentuan pengaruh kecepatan
pemayaran terhadap arus reduksi Cr(VI). Perlu dilakukan pula pengujian EPKZB untuk pengukuran Cr(VI) dengan variasi konsentrasi dan dengan adanya gangguan, serta penentuan limit deteksi untuk pengukuran Cr(VI). Selain itu, dilakukan pula pengujian EPKZB untuk spesiasi kromium.
DAFTAR PUSTAKA
Alpat SK, Yuksel U, Akcay H. 2005. Development of a novel carbon paste electrode containing a natural zeolite for the voltammetric determination of copper.
Electrochem Commun. 7:130-134.
Ardakani MM, Akrami Z, Kazemian H, Zare
HR. 2009. Preconcentration and
electroanalysis of copper at zeolite
modified carbon paste electrode. Int J
Electrochem Sci. 4:308-319.
Ardakani MM et al. 2007. Potentiometric
determination of monohydrogen arsenate
by zeolite-modified carbon-paste
electrode. Int J Environ Anal Chem.
87(4):285-294.
Arif Z. 2011. Karakterisasi dan modifikasi
zeolit alam sebagai bahan media
pendeteksi. Studi kasus: kromium
heksavalen [tesis]. Bogor: Fakultas
Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Cotton FA, Wilkinson G. 2007. Kimia
Anorganik Dasar. Suharto S, penerjemah.
Jakarta: UI Pr. Terjemahan dari: Basic
Inorganic Chemistry.
Eaton AD, Franson MAH. 2005. Standard
Methods for The Examination of Water and Wastewater. Ed ke-21. Washington DC: APHA Pub.
Fatimah I. 2000. Penggunaan Na-zeolit alam
teraktivasi sebagai penukar ion Cr3+ dalam
larutan. Logika 4(5):25-34.
Fauziah Hanifah. 2011. Penentuan Iodida menggunakan elektroda pasta karbon termodifikasi magnetit [skripsi]. Bogor:
Fakultas Matematika dan Ilmu
Pengetahuan Alam, Institut Pertanian Bogor.
Las T. 2005. Potensi Zeolit untuk Mengolah
Limbah Industri dan Radioaktif. Tangerang: Pusat Teknologi Limbah Radioaktif-Badan Tenaga Nuklir Nasional
(PTLR-BATAN), Kawasan Puspiptek
Serpong.
Liu B, Lu L, Wang M, Zi Y. 2008. A study of
nanostructured gold modified glassy
carbon electrode for the determination of
trace Cr(VI). J Chem Sci. 120:493-498.
Narin I, Surme Y, Soylak M, Dogan M. 2006. Speciation of Cr(III) and Cr(VI) in environmental samples by solid phase
extraction on Ambersorb 563 resin. J
Hazard Mater B 136:579-584.
Patlolla AK, Barnes C, Hackett D,
Tchounwou PB. 2009. Potassium
dichromate induced cytoxicity,
genotoxicity and oxidative stress in human
liver carcinoma (HepG2) cells. Int J
Environ Res Public Health. 6:643-653.
Rohaeti E. 2007. Pencegahan pencemaran lingkungan oleh logam berat krom limbah cair penyamakan kulit (studi kasus di Kabupaten Bogor) [disertasi]. Bogor:
Fakultas Matematika dan Ilmu
Pengetahuan Alam, Institut Pertanian Bogor.
10
Sutopo FXR. 1991. Pengkajian karakteristik
zeolit Cikalong Tasikmalaya dan
pemanfaatan dalam pengolahan air.
Bandung: Pusat Penelitian dan
Pengembangan Teknologi Mineral dan Batubara.
Suwardi. 2000. Prospek Pengolahan Zeolit di
Indonesia. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Syafii F. 2011. Modifikasi zeolit melalui
interaksi dengan Fe(OH)3 untuk
meningkatkan kapasitas tukar anion
[skripsi]. Bogor: Fakultas Matematika dan
Ilmu Pengetahuan Alam, Institut
Pertanian Bogor.
Vincent JB. 2000. The biochemistry in
chromium. J Nutr. 130:715-718.
Wang J. 2001. Analytical Electrochemistry.
Ed ke-2. New York (US): J Willey.
Wang S, Peng Y. 2010. Natural zeolites as
effective adsorbents in water and
wastewater treatment. Chem Eng J.
Weitkamp J, Puppe L. 1999. Catalysis and
Zeolites: Fundamentals and Applications. Berlin: Spinger-Verlag.
Welch CM, Nekrassova O, Compton RG. 2005. Reduction of hexavalent chromium at solid electrodes in acidic media:
reaction mechanism and analytical
application. Talanta 65:74-80.
Wyantuti S. 2008. Karakterisasi zeolit alam asal Cikalong Tasikmalaya. Bandung:
Fakultas Matematika dan Ilmu
Pengetahuan Alam, Universitas
12
Lampiran 1 Diagram alir penelitian
Zeolit asal Cikalong
Zeolit aktif
Zeolit
termodifikasi-besi
Preparasi zeolit dan
aktivasi dengan HCl 3 M
Perlakuan dengan NaOH
dan Fe(NO
3)
3Analisis XRD
dan SEM
Analisis SEM
dan analisis
kadar Fe
Elektrode pasta
karbon termodifikasi
zeolit-besi
Uji kinerja elektrode dengan
metode voltametri
Uji adsorpsi Cr(VI)
13
14
Lampiran 3
Data
2θ
difraktogram zeolit alam asal Cikalong setelah aktivasi
2θ d(A) Intensity Integrated
Int 2θ d(A) Intensity
Integrated Int
9.6278 9.17902 13 71 46.5121 1.95091 12 94
9.8547 8.96819 37 450 46.7520 1.94146 9 72
13.1099 6.74778 11 139 46.9919 1.93211 7 64
13.5038 6.55182 54 865 48.1130 1.88967 7 49
13.9671 6.33552 8 142 48.4662 1.87672 20 323
14.6626 6.03653 17 165 48.8893 1.86146 7 37
15.1439 5.84574 9 80 50.2055 1.81571 7 56
15.3335 5.77388 25 284 50.4154 1.80864 11 102
17.4094 5.08980 9 129 50.7386 1.79787 8 30
19.0921 4.64483 8 49 50.9527 1.79082 20 185
19.3967 4.57257 17 182 54.0841 1.69429 8 109
19.6635 4.51113 60 894 56.7931 1.61974 8 114
20.9722 4.23249 8 85 57.7828 1.59433 9 135
21.4727 4.13495 24 263 59.8522 1.54405 11 112
21.8120 4.07139 45 1042 60.0621 1.53916 7 53
22.2860 3.98586 131 2367 60.4820 1.52947 8 67
22.7899 3.89885 17 266 60.8185 1.52181 13 213
23.2448 3.82357 27 300 64.0410 1.45279 7 80
23.7431 3.74444 28 291 64.3209 1.44714 10 173
24.5366 3.62512 9 90 64.5409 1.44274 12 0
25.0658 3.54977 10 288 64.7408 1.43876 11 162
25.6992 3.47369 217 2729 66.2320 1.40994 9 152
26.1041 3.41088 42 585 67.5501 1.38560 9 62
26.2913 3.38702 87 1125 67.7766 1.38152 7 65
26.7032 3.33570 13 151 68.2765 1.37261 10 172
27.1626 3.28032 14 99 69.4096 1.35295 7 173
27.7334 3.21409 126 2654 70.0244 1.34257 7 131
28.1412 3.16843 24 297
28.5407 2.12498 7 101
28.8653 2.09057 7 46
29.9790 2.97825 13 174
30.2187 2.95517 12 121
30.4924 2.92926 11 64
30.9390 2.88799 52 685
31.9810 2.79623 17 174
32.6962 2.73668 9 102
32.9160 2.71891 8 104
33.2107 2.69545 15 169
35.0591 2.55746 8 97
35.7269 2.51117 30 379
36.5795 2.45457 8 78
37.0126 2.42684 12 181
39.5009 2.27951 7 84
41.8195 2.15833 7 43
44.2315 2.04606 15 226
44.9628 2.01447 11 176
45.4926 1.99223 7 48
15
16
Lampiran 5 Stoikiometri reaksi antara Fe(NO
3)
3dan NaOH
Persamaan reaksi:
Fe
3+(aq)+ OH
-(aq)→
Fe(OH)
2+(aq)mol mula-mula
2.5
×
10
-23.75
×
10
-2mol reaksi
2.5
×
10
-22.5
×
10
-22.5
×
10
-2mol sisa
-
1.25
×
10
-22.5
×
10
-2Perhitungan:
mol Fe(NO
3)
3·9H
2O
=
g
BM
=
10.1254 g
404 g/mol
=
2.5×10
-2
mol
mol Fe
3+≈
mol Fe(NO
3)
3·9H
2O
=
2.5×10
-2mol
sjr Fe
3+=
2.5×10
-2
1
= 2.5×10
-2
(reaktan pembatas)
m
ol NaOH
=
M×V
=
0.075 M×0.5 L
=
3.75×10
-2mol
mol
OH
-≈
mol NaOH
=
3.75×10
-2mol
sjr OH
-=
3.75×10
-2
1
=
3.75×10
17
Lampiran 6 Hasil analisis kadar Fe pada zeolit termodifikasi-besi menggunakan
AAS
a.
Kurva standar untuk penentuan kadar Fe
Konsentrasi standar (ppm) Absorbans Absorbans terkoreksi
0.0000 0.0026 0.0000
0.2000 0.0236 0.0210
0.5000 0.0566 0.0540
1.0000 0.1081 0.1055
2.0000 0.2144 0.2118
b.
Kadar Fe dalam zeolit termodifikasi-besi
Sampel Absorbans Kadar Fe kurva
(ppm)
Bobot
sampel (g) fp
Kadar Fe sebenarnya (ppm)
ZA 1 0.0264 0.2335 0.0509 1 0.2293
ZA 2 0.0249 0.2193 0.0510 1 0.2150
ZA 3 0.0248 0.2183 0.0506 1 0.2157
Rerata 0.2200
ZB 1 0.1112 1.0350 0.0510 5 5.0734
ZB 2 0.1084 1.0085 0.0506 5 4.9827
ZB 3 0.1087 1.0113 0.0511 5 4.9479
Rerata 5.0013
Keterangan: ZA = zeolit aktif, ZB = zeolit termodifikasi-besi
Contoh perhitungan:
Kadar Fe sebenarnya
=
ppm kurva×volume contoh×fp
g contoh
Kadar Fe sebenarnya
=
0.2335 ppm×0.05 L×1
0.0509 g
=
0.2293 ppm
% peningkatan kadar Fe
=
Kadar Fe ZB-Kadar Fe ZA
Kadar Fe ZB
×100%
=
5.0013-0.2200
5.0013
×100%
=
95.6%
y= 0.1058x+ 0.0017
R² = 1.0000
0 0.05 0.1 0.15 0.2 0.25
0 0.5 1 1.5 2 2.5
A
b
so
rb
a
n
s
18
Lampiran 7 Penentuan panjang gelombang maksimum pengukuran Cr(VI)
Panjanggelombang (nm) Absorbans
Panjang
gelombang (nm) Absorbans
500 0.944 552 1.583
502 0.994 554 1.560
504 1.038 556 1.537
506 1.080 558 1.511
508 1.121 560 1.481
510 1.157 562 1.456
512 1.194 564 1.412
514 1.233 566 1.372
516 1.279 568 1.327
518 1.329 570 1.28
520 1.375 572 1.233
522 1.425 574 1.194
524 1.477 576 1.152
526 1.515 578 1.113
528 1.541 580 1.072
530 1.563 582 1.035
532 1.584 584 1.004
534 1.601 586 0.990
536 1.616 588 0.889
538 1.628 590 0.828
540 1.639 592 0.753
542 1.645 594 0.678
544 1.645 596 0.615
546 1.637 598 0.563
548 1.622 600 0.507
550 1.604
0 0.2 0.4 0.6 0.8 1 1.2 1.4 1.6 1.8
500 504 508 512 516 520 524 528 532 536 540 544 548 552 556 560 564 568 572 576 580 584 588 592 596 600
A
b
so
rb
a
n
s
Panjang gelombang (nm)
19
Lampiran 8 Hasil uji adsorpsi larutan Cr(VI) oleh zeolit sebelum dan setelah
termodifikasi-besi
a.
Hasil uji adsorpsi pendahuluan
Keterangan:
A
kontrol positif, Cr(VI)+DPC
B
kontrol negatif, akuades+DPC
C
zeolit tanpa modifikasi pada Cr(VI) 10
μ
M
D
zeolit-besi pada Cr(VI) 10
μ
M
E
zeolit-besi pada Cr(VI) 25
μ
M
b.
Kurva standar untuk uji adsorpsi Cr(VI)
Konsentrasi Cr(VI) (μM) Absorbans Absorbans terkoreksi
0 0.069 0
1.7687 0.453 0.384
3.5374 0.809 0.740
7.0748 1.519 1.450
10.6122 2.387 2.318
y= 70,0653x+ 0,0407
R² = 0,9914
0 0.5 1 1.5 2 2.5 3
0 2 4 6 8 10 12 14 16
A
b
so
rb
a
n
s
20
lanjutan Lampiran 8
c.
Kapasitas adsorpsi zeolit termodifikasi-besi terhadap Cr(VI)
Sampel Bobot zeolit
(g)
Konsentrasi awal
(μM) Absorbans Absorbans terkoreksi
Konsentrasi akhir
(μM) Konsentrasi teradsorp (μM) fp Q (mg/g)
Blanko - 0 0.069 0
1 0.0506 1.5565 0.108 0.039 0 1.5565 1 0.1600
2 0.0504 3.3252 0.109 0.040 0 3.3252 1 0.3431
3 0.0501 7.0041 0.111 0.042 0 7.0041 1 0.7270
4 0.0505 13.1592 0.162 0.093 0.0007 13.1585 1 1.3549
5 0.0503 24.5497 1.283 1.214 0.0335 24.5162 2 2.5345
6 0.0500 32.5442 1.524 1.455 0.0404 32.5038 2 3.3804
7 0.0506 40.2204 1.935 1.866 0.0521 40.1683 2 4.1280
8 0.0500 80.8299 2.351 2.282 0.0640 80.7659 2 8.3997
9 0.0502 157.7333 0.234 0.165 0.0018 157.7315 1 16.3387
10 0.0525 254.0952 0.202 0.133 0.0013 254.0939 1 25.1674
Contoh perhitungan:
Konsentrasi teradsorpsi = Konsentrasi awal-Konsentrasi akhir
=
254.0952
μ
M-0.0013
μ
M
=
254.0939
μ
M
Konsentrasi teradsorpsi
ppm
= 254.0939×10
-6mol L×104 g mol× 1000
mg g
= 26.4258 mg L
Kapasitas adsorpsi
Q
=
Volume larutan×Konsentrasi teradsorpsi
Bobot zeolit
=
0.05 L×26.4258 mg L
21
Lampiran 9 Voltamogram EPKZB pada beberapa parameter pengukuran
a.
Voltamogram EPKZB akibat pengaruh pH analit
-1.5 -1.0 -0.5 0.0 0.5 1.0 1.5
-35.0µ -30.0µ -25.0µ -20.0µ -15.0µ -10.0µ -5.0µ 0.0 5.0µ 10.0µ 15.0µ
A
ru
s
(A
)
Potensial (V) vs Ag/AgCl pH 1 pH 2 pH 3 pH 4 pH 5 pH 6
b.
Voltamogram EPKZB akibat pengaruh waktu prakonsentrasi
-1.5 -1.0 -0.5 0.0 0.5 1.0 1.5
-20.0µ -15.0µ -10.0µ -5.0µ 0.0 5.0µ 10.0µ
A
ru
s
(A
)
Potensial (V) vs Ag/AgCl
5 menit 10 menit 15 menit 20 menit 25 menit 30 menit 35 menit
c.
Voltamogram EPKZB akibat pengaruh komposisi zeolit-besi
-1.5 -1.0 -0.5 0.0 0.5 1.0 1.5
-20.0µ -15.0µ -10.0µ -5.0µ 0.0 5.0µ
A
ru
s
(A
)
Potensial (V) vs Ag/AgCl