ELEKTRODE PASTA KARBON ZEOLIT ALAM
TERMODIFIKASI HEKSADESILTRIMETILAMONIUM
BROMIDA UNTUK DETEKSI KROMIUM(VI)
BUDI RIZA PUTRA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Elektrode Pasta Karbon Zeolit Termodifikasi Heksadesiltrimetilamonium Bromida untuk Deteksi Kromium(VI) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Mei 2013
Budi Riza Putra
RINGKASAN
BUDI RIZA PUTRA. Elektrode Pasta Karbon Zeolit Alam Termodifikasi HDTMABr untuk Deteksi Kromium(VI). Dibimbing oleh LATIFAH K DARUSMAN dan ETI ROHAETI.
Penggunaan kromium yang luas dalam metalurgi, penyamakan kulit, elektroplating, kayu, penghasil listrik, dan industri lainnya telah menimbulkan masalah lingkungan yang besar terutama pada sejumlah daerah yang terkontaminasi oleh kromium. Kromium memiliki 2 spesi yang dominan, yaitu Cr(III) dan Cr(VI). Perhatian lebih berfokus pada bahaya yang diakibatkan Cr(VI) dibandingkan Cr(III) disebabkan Cr(VI) 1000 kali lebih toksik daripada Cr(III). Maka, metode untuk diferensiasi dan kuantifikasi spesi kromium ini sangat penting dalam analisis lingkungan.
Penelitian mengenai elektrode pasta karbon termodifikasi kimia telah banyak dilakukan dimulai dari tahun 1990 khususnya dalam bidang elektroanalisis disebabkan keuntungan yang diakui lebih baik dibandingkan elektrode konvensional. Penelitian terus menerus mengenai elektrode pasta karbon termodifikasi kimia telah meningkatkan penggunaan material anorganik sebagai bahan pemodifikasi elektrode. Diantara material anorganik, zeolit telah banyak digunakan sebagai penukar ion disebabkan ukuran, bentuk dan selektivitas muatan yang unik, kemampuan penukar ion yang tinggi, stabilitas termal yang tinggi, harganya murah dan tahan terhadap kondisi ekstrim.
Zeolit memiliki muatan negatif yang permanen pada struktur kristalnya sehingga cocok sebagai penukar kation. Muatan negatif ini juga memungkinkan untuk dilakukan modifikasi pada permukaan zeolit menggunakan surfaktan kationik yaitu ion heksadesiltrimetilamonium (HDTMABr). Nilai kapasitas tukar kation zeolit alam asal Cikembar (23.7 mek/100 g), Cikalong (47.6 mek/100 g), Bayah (39.7 mek/100 g), dan Lampung (42.4 mek/100 g). Setelah diaktivasi dengan NaOH, nilai kapasitas tukar kation pada zeolit teraktivasi basa menunjukkan peningkatan masing-masing adalah Cikembar (60.4 mek/100 g), Cikalong (60.4 mek/100 g), Bayah (42.5 mek/100 g), dan Lampung (107.5 mek/100 g). Sehingga zeolit Lampung dipilih untuk dilakukan modifikasi dengan surfaktan dan diperoleh jumlah adsorpsi tertinggi pada konsentrasi 200 mM HDTMABr sebesar 3.9923 mmol/g zeolit.
Uji adsorpsi Cr(VI) menggunakan metode difenilkarbazida (DPC) terhadap zeolit Lampung, zeolit Lampung teraktivasi basa termodifikasi HDTMABr 100 mM dan zeolit teraktivasi basa termodifikasi HDTMABr 200 mM menunjukkan adanya peningkatan kapasitas adsorpsi (Q). Kapasitas adsorpsi kromium(VI) saat keadaan tunak (steady state) diperoleh pada zeolit Lampung,
zeolit-basa-HDTMABr 100 mM dan 200 mM berturut-turut adalah 58.0457, 134.0522, dan 148.5602 mg Cr(VI)/g zeolit. Hal ini menunjukkan adanya peningkatan jumlah Cr(VI) yang dapat terikat pada permukaan zeolit.
alam dan zeolit termodifikasi. Derajat kristalinitas yang menurun dengan urutan zeolit alam, zeolit termodifikasi basa, dan zeolit teraktivasi basa termodifikasi HDTMABr menunjukkan hilangnya sebagian pengotor yang terdapat zeolit alam dan adanya adsorpsi molekul HDTMABr pada permukaan zeolit. Pencirian zeolit alam termodifikasi HDTMABr menunjukkan adanya penggabungan puncak serapan yang berasal dari zeolit yaitu tekukan δH-O-H (1637.65 cm-1), vibrasi vT-O
(T= Si,Al) simetrik (1055.56 cm-1), vT-O asimetrik (793.17 cm-1), δSi-O-Al (608.86
cm-1 dan 525.67 cm-1), dan δO-T-O (468.41 cm-1) serta serapan puncak yang berasal
dari HDTMABr adalah uluran vC-H metilena asimetrik (2920.05 cm-1) dan tekukan
δC-H metilena (2851.01 cm-1, 1489.21 cm-1). Pencirian dengan analisis termal
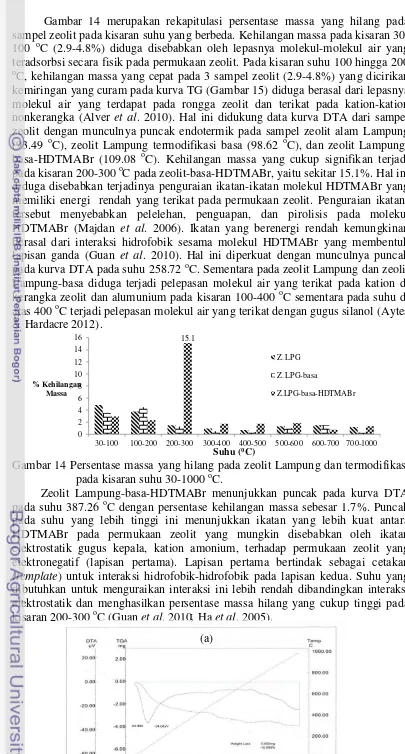
(TG-DTA) menunjukkan persentase massa yang hilang yang cukup besar sebesar 15.1 % pada kisaran suhu 200-300 oC. Hal ini menunjukkan adanya lapisan ganda surfaktan yang terbentuk akibat adanya interaksi hidrofobik-hidrofobik gugus nonpolar HDTMABr di permukaan zeolit alam Lampung. Adanya interaksi elektrostatik antara molekul HDTMABr dengan permukaan zeolit membentuk lapisan tunggal ditunjukkan pada kisaran 300-400 oC dengan persentase massa yang hilang sebesar 1.7%. Hal ini disebabkan energi yang cukup tinggi dibutuhkan memutuskan interaksi elektrostatik antara HDTMABr dengan permukaan zeolit dibandingkan interaksi hidrofobik antara sesama molekul HDTMABr.
Zeolit Lampung termodifikasi HDTMABr digunakan sebagai bahan pemodifikasi untuk membuat elektrode pasta karbon. Komposisi optimum zeolit Lampung termodifikasi HDTMABr pada campuran grafit dan minyak parafin diperoleh sebesar 2.5% dengan dilakukan pengujian pengukuran terhadap analit Cr(VI) dengan teknik voltametri siklik. Larutan elektrolit pendukung untuk pengukuran Cr(VI) terbaik adalah HNO3 0.3 M dengan pH 0.5. Selanjutnya
pengukuran Cr(VI) pada elektrode komposit ini didasarkan pada prinsip reduksi Cr(VI) menjadi Cr(III) atau sistem redoks irreversibel sehingga dipelajari teknik
voltametri yang lebih sederhana. Pengukuran Cr(VI) 13 mM dengan teknik voltametri sapuan linier (VSL) memberikan sensitivitas tertinggi dengan arus terbaca adalah 31.45 µA dibandingkan voltametri gelombang persegi (VGP) sebesar 12.80 µA dan voltametri pulsa diferensial (VPD) sebesar 1.98 µA. Uji kinerja elektrode komposit menggunakan teknik VSL menghasilkan daerah respons linier pada kisaran konsentrasi 0.2-1.0 mM dengan koefisien determinasi (r2) sebesar 0.9669. Sensitivitas, limit deteksi, limit kuantisasi, dan ketelitian
pengukuran Cr(VI) yang diperoleh berturut-turut sebesar 0.4294 µA mM, 3.63 x 10-4 M, 1.197 x 10-3 M dan 4.49%.
SUMMARY
BUDI RIZA PUTRA. Carbon Paste Electrode
Hexadecyltrimethylammonium bromida modified Natural Zeolite for Chromium(VI) Detection. Supervised by LATIFAH K DARUSMAN and ETI ROHAETI.
The extensive use of chromium in metallurgic, leather tanning, electroplating, lumber, electricity generating and other industries have promoted enormous ecological impact in numerous sites that are being contaminated by chromium. Chromium has two dominant species, namely Cr(III) and Cr(VI). Among them, attention concerning the possible hazards arising from the use of Cr(VI) than Cr(III) because hexavalent chromium is around 1000 times more toxic than trivalent one. Therefore, methods for differentiation and quantification of these species are very important in water analysis.
Research on chemical modified carbon paste electrode have been carried out starting from 1990 especially in electroanalysis field caused by better improvement than conventional electrode. Continuous research on chemical modified carbon paste electrode has been increasing use of inorganic materials as a modifiers of electrode material. Among inorganic materials, zeolites have been widely used as an ion exchanger due to size, shape, and unique charge selectivity, high capacity ion exchangers, high thermal stability, low cost resistance to extreme conditions.
Zeolites have a permanent negative charge on its crystal structure making it suitable as a cation exchanger. This negative charge is also possible to do modifications on the zeolite surface using cationic surfactant of hexadecyltrimethylammonium (HDTMA) ions. Cation exchange capacity value of zeolite origin from Cikembar (23.7 meq/100 g), Cikalong (47.6 meq/100 g), Bayah (39.7 meq/100 g), and Lampung (42.4 meq/100 g). After activation with NaOH, all cation exchange capacity values showed increasing were Cikembar (60.4 meq/100 g), Cikalong (60.4 meq/100 g), Bayah (42.5 meq/100 g), and Lampung (107.5 meq/100 g). Therefore, Lampung zeolite was selected to do modification with surfactant and was obtained highest adsorption amount of 200 mM HDTMABr as 3.9923 mmol/g zeolit.
Cr(VI) adsorption test using diphenylcarbazide (DPC) method toward Lampung zeolite, 100 mM and 200 mM HDTMABr modified NaOH activated Lampung zeolite showed increasing adsorption capacity (Q). Cr(VI) adsorption capacity (Q) at steady state were obtained toward Lampung zeolite, 100 mM and 200 mM zeolite-NaOH-HDTMABr as 58.0457, 134.0522, 148.5602 mg Cr(VI)/g zeolite, respectively. This showed an increase of Cr(VI) amount bound on the zeolite surface.
originating from bending δH-O-H (1637.65 cm-1), vibration vT-O (T= Si,Al)
symmetric (1055.56 cm-1), vT-O asymmetric (793.17 cm-1), δSi-O-Al (608.86 cm-1
and 525.67 cm-1), and δO-T-O (468.41 cm-1) also peak absorption originating from
HDTMABr were stretching vC-H methylene asymmetric (2920.05 cm-1) and
bending δC-H methylene (2851.01 cm-1, 1489.21 cm-1). Characterization by
thermal analysis (TG-DTA) showed percentage of loss mass was quite large aat 15.1% in temperature range of 200-300 oC. This result indicates surfactant double layer formed by hydrophobic-hydrophobic interaction of nonpolar groups on the surface of HDTMABr modified Lampung zeolite. The existence of electrostatic interactions between HDTMABr molecules on zeolite surface forming s single layer were shown at 300-400 oC with percentage of mass loss 1.7%. This due to
higher energy was required to break electrostatic interactions between HDTMA and zeolite surface than hydrophobic-hydrophobic interactions among HDTMA molecules.
Zeolite-NaOH-HDTMABr was used as modifiers in carbon paste electrode. Optimum composition of HDTMABr modified zeolite in mixture of graphite and paraffin oil was obtained 2.5% with Cr(VI) analyte measurement by cyclic voltammetry technique. Supporting electrolyte solution for Cr(VI) measurement was 0.3 M HNO3 with pH 0.5. Further measurement of analyte in
composite electrode were based on principle of Cr(VI) into Cr(III) or irreversible redox system thus investigated a simpler voltammetric technique. Measurement of 13 mM Cr(VI) with Linear Sweep Voltammetry (LSV) provided highest sensitivity by reduction peak current as 31.45 µA compared with Square Wave Voltammetry (SWV) as 12.80 µA and Differential Pulse Voltammetry (DPV) as 1.98 µA. Performance of composite electrode was investigated using LSV technique provided linear response range at 0.2-1.0 mM with determination coefficient (r2) as 0.9669. Sensitivity, detection and quantification limit, also
precision of Cr(VI) measurements were obtained 0.4294 µA mM, 3.63 x 10-4 M, 1.197 x 10-3 M, 4.49%, respectively.
© Hak Cipta Milik IPB, Tahun 2013
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
ELEKTRODE PASTA KARBON ZEOLIT ALAM
TERMODIFIKASI HEKSADESILTRIMETILAMONIUM
BROMIDA UNTUK DETEKSI KROMIUM(VI)
BUDI RIZA PUTRA
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
Pada
Program Studi Kimia
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Judul Tesis : Elektrode Pasta Karbon Zeolit Alam Termodifikasi Heksadesiltrimetilamonium Bromida untuk Deteksi Kromium(VI)
Nama : Budi Riza Putra
NIM : G451100041
Disetujui oleh
Komisi Pembimbing
Prof Dr Ir Latifah K Darusman, MS Dr Eti Rohaeti, MS
Ketua Anggota
Diketahui oleh
Ketua Program Studi S2 Kimia Dekan Sekolah Pascasarjana
Prof Dr Purwantiningsih Sugita, MS Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji syukur penulis panjatkan kepasa Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Februari 2012 hingga April 2013 ialah sensor Cr(VI), dengan judul Elektrode Pasta Karbon Zeolit Alam Termodifikasi Heksadesiltrimetilamonium Bromida ntuk Deteksi Kromium(VI).
Terima kasih penulis ucapkan kepada Prof Dr Ir Latifah K Darusman, MS, Dr Eti Rohaeti, MS selaku komisi pembimbing. Di samping itu, penghargaan penulis juga disampaikan kepada seluruh Keluarga Laboratorium Kimia Analitik Departemen Kimia IPB atas bantuan dan masukan yang diberikan. Ungkapan terima kasih juga disampaikan kepada kedua orang tua dan keluarga penulis atas doa, kasih sayang, dan dorongan semangatnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Juni 2013
DAFTAR ISI
Halaman
DAFTAR TABEL xii
DAFTAR GAMBAR xiii
PENDAHULUAN
Latar Belakang 1
Tujuan Penelitian 2
Manfaat Penelitian 2
Hipotesis 3
Waktu dan Tempat 3
TINJAUAN PUSTAKA
Kromium 4
Spesiasi Kromium 5
Zeolit 6
Elektrode Pasta Karbon Termodifikasi Zeolit 8
Zeolit Termodifikasi HDTMABr 9
Difraksi Sinar-X 11
Analisis Termal 11
Voltametri 12
BAHAN DAN METODE
Bahan dan Alat 13
Metode 13
HASIL DAN PEMBAHASAN 18
Aktivasi Zeolit 18
Kapasitas Tukar Kation Zeolit 18
Konsentrasi Admisel Kritik Zeolit 20
Adsorpsi Cr(VI) Terhadap Zeolit-HDTMABr 22
Pencirian Zeolit-HDTMA-Br dengan XRD 24
Pencirian Zeolit-HDTMA-Br dengan FTIR 24
Pencirian Zeolit-HDTMA-Br dengan TG-DTA 26
Pembuatan dan Kinerja Elektrode dengan Voltametri 28
Pengaruh Larutan Elektrolit terhadap Elektrode Pasta Karbon (EPK) 28
Pengaruh pH terhadap Arus Puncak Reduksi Cr(VI) 29
Pengaruh Komposisi Zeolit-HDTMABr pada EPK 30
Perbandingan Arus Puncak dengan Teknik VSL, VGP, dan VPD 31
Pengaruh Kecepatan Payar terhadap Arus Puncak Cr(VI) 32
Linearitas, Limit Deteksi, Limit Kuantisasi, dan Ketelitian 32
SIMPULAN DAN SARAN
Simpulan 33
Saran 33
LAMPIRAN 39
Bagan Alir Penelitian 40
DAFTAR GAMBAR
Halaman
1 Diagram Pourbaix untuk spesi kromium pada suhu 150 oC dan
[Cr(aq)]total = 10-8 M (Ball & Nordstrom 1998) 5
2 Kelimpahan spesi kromium (VI) dalam larutan encer
pada konsentrasi total Cr(VI) 1 x 10-6 M dan kisaran pH 1-14
(Kotas & Stasicka 2000) 6
3 Representasi struktur kerangka zeolit 2 dan 3 dimensi
(Valdes et al. 2006) 7
4 Struktur kimia surfaktan HDTMA-Br
(Nezamzadeh-Ejhieh & Nematollahhi 2011) 9
5 Diagram skematis pembentukan misel HDTMA dalam larutan
(Malek 2007) 10
6 Skema pembuatan elektrode pasta karbon 16
7 KTK zeolit yang berasal dari 4 daerah 19
8 Adsorpsi molekul HDTMA dalam (a) lapisan tunggal, (b) setengah
lapisan ganda, dan (c) lapisan ganda (Li & Bowman 1997) 21
9 Jumlah HDTMA+ teradsorbsi pada permukaan zeolit Lampung 21
10 Reaksi DPC dengan Cr(VI) (Eaton & Franson 2005) 23
11 Kurva adsorpsi Cr(VI) terhadap (a) zeolit Lampung tanpa modifikasi (b) zeolit Lampung-HDTMABr 100 mM,
(c) zeolit Lampung-HDTMABr 200 mM 23
12 Profil pola difraksi zeolit alam Lampung (a) tanpa aktivasi, (b) zeolit basa
(c) zeolit basa HDTMABr 200 mM 24
13 Spektrum FTIR pada (a) zeolit Lampung (b) zeolit Lampung teraktivasi
Basa (c) HDTMABr (d) zeolit-Lampung-basa-HDTMABr 200 mM 25
14 Persentase massa yang hilang pada zeolit Lampung dan termodifikasi
Pada kisaran 30-1000 oC 26
15 Kurva TG-DTA pada (a) zeolit Lampung (b) zeolit Lampung-basa
(c) zeolit Lampung-basa-HDTMABr 200 mM 27
18 Voltamogram siklik Cr(VI) 13 mM pada kisaran pH 0.5-3
pada kecepatan payar 100 mV/detik 30
19 Komposisi Z-HDTMABr pada arus reduksi Cr(VI) pada
EPK-Z-HDTMABr 31
20 Arus puncak reduksi Cr(VI) 13 mM menggunakan teknik
Voltametri Sapuan Linear (VSL), Voltametri Gelombang Persegi (VGP) Voltametri Pulsa Differensial (VPD) pada kecepatan payar 100 mV/detik 31 21 Voltamogram kecepatan payar Cr(VI) 5 mM berbeda pada
EPK-Z-HDTMABr 32
22 Voltamogram dan kurva kalibrasi Cr(VI) pada kisaran 0.2-1.0 mM
PENDAHULUAN
Latar BelakangElektrokimia memainkan peran penting dalam penentuan ion logam berat sejak penemuan teknik polarografi. Pemantauan ion logam menggunakan teknik elektrokimia dapat menghemat waktu pengukuran yang signifikan dan biaya operasi dengan menggunakan unit-unit yang dapat digunakan di lapangan (Buffle & Tercier-Waeber 2005). Elektrode termodifikasi kimia dapat digunakan untuk meningkatkan sensitivitas deteksi ion logam (Zen et al. 2003).
Penggunaan kromium yang luas dalam metalurgi, penyamakan kulit, elektroplating, kayu, penghasil listrik, dan industri lainnya telah menimbulkan pengaruh ekologi yang sangat kuat pada sejumlah daerah yang terkontaminasi oleh kromium (Cespon-Romero et al. 1996; Kotas & Stasicka 2000). Kromium
memiliki 2 spesi yang dominan, yaitu Cr(III) dan Cr(VI). Perhatian lebih berfokus pada bahaya yang diakibatkan Cr(VI) dibandingkan Cr(III). Perbedaan signifikan dalam toksisitas kedua spesi ion tersebut adalah Cr(VI) 1000 kali lebih beracun daripada Cr(III) (Cespon-Romero et al. 1996). Maka, metode untuk diferensiasi
dan kuantifikasi spesies ini sangat penting dalam analisis air.
Beberapa metode analitik untuk penentuan Cr(VI) telah dijelaskan seperti spektroskopi atom (Nielsen & Hansen 1998; Prokisch et al. 1998),
spektrofotometri (Padarauskas et al. 1998), fluorimetri (Paleologos et al. 1998),
dan kemiluminesens (Gammelgaard et al. 1997). Metode elektroanalitik yang
memainkan peran penting dalam spesiasi redoks Cr(VI) telah dipelajari (Safavi et al. 2006; Welch et al. 2005). Bergamini et al. (2007) telah mengembangkan
sensor voltammetri untuk penentuan kromium(VI) dalam limbah perairan dan diperoleh daerah respons linear, sensitivitas, dan limit deteksinya berturut-turut adalah 0.1-150 μmol/L, 1.13 μA μmol/L, dan 0.046 μmol/L.
Penelitian mengenai elektrode pasta karbon termodifikasi kimia telah banyak dilakukan dimulai dari tahun 1990 (Valdes et al. 2006) khususnya dalam
bidang elektroanalisis disebabkan keuntungan yang diakui lebih baik dibandingkan elektrode konvensional. Fokus secara kontinu mengenai elektrode pasta karbon termodifikasi kimia telah meningkatkan penggunaan material anorganik sebagai bahan pemodifikasi elektrode. Diantara material anorganik, zeolit telah banyak digunakan sebagai penukar ion disebabkan ukuran, bentuk dan selektivitas muatan yang unik, kemampuan penukar ion yang tinggi, stabilitas termal yang tinggi, harganya murah, dan tahan terhadap kondisi ekstrim (Walcarius 1999).
Zeolit memiliki muatan negatif permanen pada struktur kristalnya sehingga cocok sebagai penukar kation. Muatan negatif ini juga memungkinkan untuk dilakukan modifikasi pada permukaan zeolit menggunakan surfaktan kationik yaitu ion heksadesiltrimetilamonium (HDTMABr) (Nezamzadeh-Ejhieh & Nematollahi 2011). Pada konsentrasi surfaktan lebih tinggi dari konsentrasi misel kritis (KMK) dan jumlah surfaktan mencukupi, molekul-molekul surfaktan akan teradsorbsi membentuk lapisan ganda pada permukaan zeolit terluar (Li & Bowman 1997). Pembentukan lapisan ganda ini akan menghasilkan pembalikan muatan pada permukaan zeolit terluar, menyediakan tapak tempat anion akan tertahan dan kation akan tertolak sementara spesies netral dapat terpisah ke dalam bagian hidrofobik (Nezamzadeh-Ejhieh & Nematollahi 2011).
Penentuan kromium (VI) menggunakan sensor voltametri telah banyak dikerjakan hingga saat ini (Gevorgyan et al. 2004; Safavi et al. 2006; Borges et al.
2011). Deteksi spesi ini dengan teknik voltametri didasarkan pada pembentukan kompleks kromium (VI) dengan difenilkarbazida (Paniagua et al. 1993),
pirokatekol violet (Dominguez & Arcos 2000), HDTMABr dan Septonex® (Svancara et al. 2003), poli-L-histidina (Bergamini et al. 2007), reduksi kromium
(VI) menjadi kompleks Cr(III)-asam dietilenatriaminapentaasetat (DTPA) (Li & Xue 2001; Bobrowski et al. 2004), penopengan kromium(III)-asam nitrilotriasetat
(NTA) (Grabarczyk et al. 2003). Selain itu telah dilaporkan penentuan simultan
kromium (III) dan kromium (VI) dengan teknik voltametri dengan menggunakan campuran pirokatekol violet (PCV)-asam
N-(2-hidroksietil)etilenadiamina-N,N’,N’-triasetat (HEDTA) sebagai senyawa pengkompleks (Dominguez & Arcos 2002) dan elektroda pasta karbon screen-printed termodifikasi nanopartikel emas
dan film merkuri (Calvo-Pérez et al. 2010).
Namun hingga saat ini belum pernah dilaporkan pembuatan elektrode pasta karbon termodifikasi zeolit-HDTMABr untuk penentuan spesi Cr(VI) secara individual dengan teknik voltammetri. Sehingga penelitian ini akan berfokus pada pembuatan dan optimasi kinerja elektrode pasta karbon termodifikasi zeolit-HDTMABr untuk penentuan Cr(VI) secara individual. Selain itu, hasil optimasi kinerja pada elektrode pasta karbon termodifikasi zeolit-HDTMABr akan diuji responsnya terhadap sampel lingkungan.
Tujuan Penelitian
Penelitian ini bertujuan untuk membuat elektrode pasta karbon termodifikasi zeolit-HDTMABr dan menentukan respon yang dihasilkan terhadap Cr(VI) menggunakan teknik voltammetri. Tujuan kedua adalah menguji kinerja elektrode pasta karbon termodifikasi zeolit-HDTMABr yang telah dioptimasi menggunakan teknik voltametri.
Manfaat Penelitian
Hipotesis
Elektrode pasta karbon termodifikasi zeolit-HDTMABr bisa mendeteksi spesi Cr(VI) dalam larutan sintetik.
Waktu dan Tempat
TINJAUAN PUSTAKA
Kromium
Kromium merupakan unsur logam transisi dengan nomor atom 24 dan massa atomik 51.996 dengan simbol kimia adalah Cr. Kromium merupakan salah satu logam toksik yang telah banyak dipelajari karena dapat membentuk baik spesi kation maupun anion di dalam air. Kromium mempunyai bilangan oksidasi +2, +3, +4, +5, dan +6 tetapi bentuk yang paling umum dijumpai, stabil, dan melimpah di alam adalah Cr(III) dan Cr(VI) (Kotas & Stasicka 2000).
Keberadaan Cr(III) di lingkungan dalam bentuk kation Cr3+ dan Cr(VI) dalam bentuk anion (kromat) dihasilkan dari proses industri seperti reagen laboratorium dan penyamakan kulit. Setiap bentuk dari spesi kromium memiliki sifat dan perilaku kimiawi yang unik, sebagai contoh bentuk kromium yang diketahui memiliki toksisitas tinggi, yaitu Cr(VI) sedangkan Cr(III) merupakan mikronutrien esensial bagi tubuh manusia dan berkerjasama dengan berbagai enzim untuk penguraian gula, protein, dan lemak. Kromium (VI) yang diketahui memiliki bentuk HCrO4-, CrO42-, Cr2O72-, HCr2O7- bergantung pada pH media
diketahui memiliki sifat karsinogen, mutagenik, dan menginduksi dermatitis (Gomez & Callao 2006). Konsentrasi maksimum Cr(VI) dan kromium total di dalam air yang diizinkan adalah 0.05 dan 0.5 mg/L (Sardohan et al. 2010).
Cr(III) dan Cr(VI) cenderung stabil di alam. Cr(IV) dan Cr(V) terbentuk sebagai zat antara dalam reaksi oksidasi Cr(III) atau reduksi Cr(VI) yang berturut-turut merupakan senyawa oksidator dan reduktor. Bilangan oksidasi Cr(III) adalah yang paling stabil dan sejumlah besar energi dibutuhkan untuk mereduksi atau mengoksidasi kromium tersebut. Potensial standar negatif (E0) Cr(III)/Cr(II) menunjukkan bahwa Cr(II) mudah teroksidasi menjadi Cr(III) dan spesi Cr(III) hanya stabil tanpa keberadaan oksidator (Kotas & Stasicka 2000). Potensial reduksi Cr(II) adalah -0.91 V dan Cr(III) adalah -0.74 V (Malek 2007).
Spesi Cr(VI) memiliki potensial redoks yang cukup tinggi (E0 diantara 1.33 sampai 1.38 V) di dalam larutan asam (Ball & Nordstrom 1998) menandakan bahwa spesi tersebut merupakan oksidator kuat dan tidak stabil dengan keberadaan donor elektron. Ketika reduksi HCrO4- diikuti dengan konsumsi H+
(Reaksi 1) maka keasaman akan menurun dan menurunkan potensial formal senyawa tersebut (Gambar 2). Potensial reduksi ion hidrogen kromat menjadi Cr(III) adalah 1.35 V dalam media oksidator kuat. Reduksi ion CrO4- (Reaksi 2)
menjadi OH- terjadi di dalam larutan basa. Potensial reduksi CrO4- menjadi
Cr(OH)3 adalah -0.13 V dalam media basa (Kotas & Stasicka 2000).
HCrO4- + 7H+ + 3e- Cr3+ + 4H2O (1)
CrO42- + 4H2O + 3e- Cr(OH)3 +5OH- (2)
Gambar 1 Diagram Pourbaix untuk spesi kromium pada suhu 150 oC dan [Cr(aq)]total = 10-8 M (Ball & Nordstrom 1998).
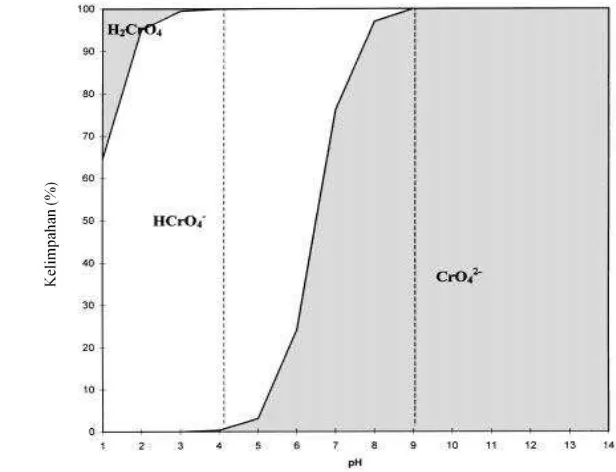
Spesiasi Kromium(VI)
Cr(VI) dapat membentuk beberapa spesi yaitu CrO4-, HCrO4- atau Cr2O7
2-bergantung pada pH media dan konsentrasi total Cr(VI). Ke2-bergantungan pada pH ditunjukkan dalam Gambar 2 (Kotas & Stasicka 2000). H2CrO4 merupakan asam
kuat dan saat pH di atas 1 Cr(VI) berada dalam bentuk deprotonasi yang dominan. Ion CrO4- akan stabil pada pH di atas 1 dalam seluruh kisaran konsentrasi dan
ketika pH antara 1-6 spesi HCrO4- merupakan bentuk yang dominan dan ketika
Cr(VI) 10-2 M akan mulai mengendap menghasilkan ion dikromat berwarna jingga kemerahan. Spesi CrO42-, HCrO4-, dan Cr2O72- merupakan spesi yang
paling banyak ditemukan pada di bawah pH normal air. Ion-ion tersebut merupakan senyawaan Cr(VI) yang mudah larut dan mobil di dalam lingkungan. Namun, oksianion Cr(VI) sangat mudah tereduksi menjadi Cr(III) oleh donor elektron seperti bahan organik atau spesi anorganik tereduksi yang ada dalam sistem tanah, air, dan atmosfer (Kotas & Stasicka 2000).
Gambar 2 Kelimpahan spesi kromium (VI) dalam larutan encer pada konsentrasi total Cr(VI) 1 x 10-6 M dan kisaran pH 1-14 (Kotas & Stasicka 2000).
Zeolit
Zeolit merupakan senyawa anorganik dengan struktur aluminasilikat yang memiliki kerangka tiga dimensi dan pori-pori yang memiliki rumus umum M2/nO.Al2O3.x(SiO2).yH2O. Senyawa ini merupakan suatu senyawa
aluminosilikat terhidrasi, dengan unsur utama alkali dan alkali tanah, n merupakan valensi kation yang logam, x merupakan suatu bilangan 2-10, dan y merupakan suatu bilangan 2-7 (PPTM 1997).
Mineral ini termasuk ke dalam keluarga tektosilikat yang tetrahedra SiO4
membentuk supersangkar 3 dimeni (Gambar 3). Beberapa atom Si disubstitusi dengan atom Al menghasilkan struktur yang bermuatan negatif yang berasal dari tetrahedra (AlO4)5- dan (SiO4)4-. Tapak bermuatan negatif ini diseimbangkan
dengan ion lawan biasanya kation alkali dan alkali tanah yang dapat disubstitusi dengan kation lain dan memberikan sifat penukar ion pada zeolit. Kerangka kristalin dapat terbentuk dengan kombinasi 3 dimensi tetrahedra TO4 (T= Si, Al,
Gambar 3 Representasi struktur kerangka zeolit 2 dan 3 dimensi (Valdes et al.
2006).
Zeolit memiliki sejumlah karakteristik yang dapat dimanfaatkan dalam mendesain sensor elektrokimia diantaranya adalah selektivitas penyaringan molekul, kemampuan penukar kation, dan sifat katalitik. Pada pertengahan dekade 1980 penelitian berbasis elektrode termodifikasi zeolit mulai dikembangkan hingga saat ini. Keuntungan utama dari elektrode termodifikasi zeolit adalah menggabungkan sifat spesifisitas reaksi transfer muatan dengan penyaringan molekuler dan sifat pertukaran ion dari aluminosilikat (Muresan 2011). Karakter unik dari elektrode termodifikasi zeolit telah digunakan dalam berbagai aplikasi yaitu, prakonsentrasi dan pengenalan dan pemisahan molekuler, elektrokatalisis, elektrolisis dispersi, deteksi amperometrik taklangsung, biosensor, potensiometri, penyimpanan energi, dan fotoelektrokimia (Walcarius et al. 2003). Aplikasi elektrode termodifikasi zeolit yang paling menonjol dalam
bidang elektroanalisis dan kebanyakan penelitian dalam bidang ini yang telah dilakukan menggunakan elektrode pasta karbon termodifikasi zeolit (Walcarius 1996; 1999).
Titik kritis dalam memanfaatkan elektrode pasta karbon dalam ilmu elektrokimia adalah tahap persiapannya. Zeolit merupakan material insulator sehingga implikasinya dalam elektrokimia membutuhkan kontak dekat dengan alat elektronik yang mampu menghantarkan substrat. Zeolit berbentuk serbuk halus yang terbuat dari kristal-kristal individu dalam ukuran mikrometer dan pencetakan zeolit ke susunan tiga dimensi yang homogen (contohnya permukaan elektroda) tidaklah mudah (Walcarius et al. 2003). Ada tiga pendekatan yang
dapat dilakukan untuk pembuatan elektrode termodifikasi zeolit yaitu, film zeolit-polimer yang dilapiskan pada permukaan elektrode padat, elektrode termodifikasi zeolit bebas pengikat berbasis pada campuran zeolit-grafit kering yang dicetak pada wadah baja tahan karat, dan elektrode pasta karbon termodifikasi zeolit yang partikel-partikel zeolitnya didispersikan dalam campuran bubuk grafit dan pengikat minyak mineral (Walcarius 2003).
Salah satu parameter dalam menentukan kualitas zeolit ialah Kapasitas Tukar Kation (KTK). Menurut Standar Nasional Indonesia (SNI) 1994, suatu bahan dikategorikan sebagai zeolit memiliki KTK tinggi apabila nilai tukar kationnya berkisar 80 hingga 200 mek/100 g zeolit. Nilai KTK pada zeolit alam biasanya lebih rendah dibandingkan zeolit sintetis karena dalam proses
Sangkar
pembentukannya selalu berasosiasi dengan dengan mineral di lingkungannya. KTK pada zeolit asal Cikalong, Lampung, dan Cikembar berturut-turut adalah 92.14 me/100g; 89.62 me/100g, dan 79.70 me/100g (Rohaeti 2007) sementara zeolit asal Bayah adalah 48 me/100g (Arif 2011). Sementara luas pori zeolit Lampung (38 m2/g) lebih tinggi dibandingkan zeolit Cikalong (25 m2/g) dan zeolit Cikembar (13 m2/g). Sehingga berdasarkan luas pori zeolit Lampung merupakan zeolit terbaik dibandingkan zeolit Cikalong dan Cikembar. Hal ini dibuktikan dengan kapasitas jerapan tertinggi Cr(III) pada zeolit Lampung sebesar 2.466 mg/kg, zeolit Cikalong sebesar 1.749 mg/kg, dan zeolit Cikembar 1.150 mg/kg (Rohaeti 2007).
Kapasitas penjerapan Cr(III) yang tinggi pada zeolit Lampung kemudian diaplikasikan untuk penjerapan Cr(VI) dengan sebelumnya melakukan modifikasi permukaan zeolit dengan HDTMA. Furi (2010) melaporkan kapasitas penjerapan HDTMABr 1000 ppm selama 30 jam pada zeolit Lampung adalah 40.99 mg/g. Kemudian zeolit termodifikasi HDTMABr digunakan untuk mengabsorpsi Cr(VI) dan diperoleh kapasitas penjerapannya sebesar 1.9 mg/g. Hal ini tidak berbeda jauh dengan penelitian Suprayogi (2009) yang melaporkan kapasitas penjerapan Cr(VI) dengan zeolit-HDTMABr adalah 1.40 mg/g.
Elektrode Pasta Karbon Termodifikasi Zeolit
Sifat fisikokimia pasta karbon yang diaplikasikan dalam bidang elektroanalisis memiliki keuntungan, yaitu arus latar belakang yang rendah, polarizabilitas individual. Keuntungan lainnya ialah aktivitas elektrode pada permukaan pasta karbon sama dengan ruahan (bulk) pasta karbon, variabilitas
dalam memanfaatkan berbagai interaksi dan efek sinergisnya baik pada elektrode pasta karbon maupun elektrode pasta karbon termodifikasi kimia. Selain itu, fleksibilitas prosedur untuk praperlakuan, pengkondisian dan regenerasi permukaan elektrode maupun pasta karbon itu sendiri (Švancara et al. 2004).
Elektroda pasta karbon termodifikasi zeolit telah banyak diaplikasikan dalam bidang elektroanalisis diantaranya adalah analisis voltametri setelah prekonsentrasi (Morgensen & Kryger 1998), deteksi amperometri taklangsung dalam aliran arus (Walcarius 1999; Walcarius et al. 2003), biosensor (Wang &
Walcarius 1996), elektrokatalisis (Creasy & Shaw 1988). Namun jika elektroda direndam dalam larutan encer untuk jangka panjang terjadi impregnasi signifikan dalam ruahan pasta karbon disebabkan karakter hidrofilik pada partikel zeolit (Wang & Walcarius 1996) yang akan menginduksi pengaruh memori yang tidak diinginkan ketika melakukan percobaan berturut-turut dengan permukaan elektroda yang sama. Bagian yang basah pada elektroda pasta karbon termodifikasi zeolit diketahui meningkat seiring dengan waktu perendaman elektroda dalam larutan khususnya disebabkan karakter zeolit yang hidrofilik (Marko-Varga et al. 1996).
Cara yang bisa dilakukan untuk menghindari pembentukan impregnasi dengan membuat karakter zeolit lebih hidrofobik (sebagai contoh dealuminasi) tetapi ini berlaku pada padatan yang sifat penukar ionnya terbatas atau tidak ada sama sekali sehingga kurang menarik sebagai pemodifikasi elektroda (Walcarius
et al. 2003). Strategi lain adalah dengan mengurangi ketebalan elektroda komposit
pakai dengan screen printing tinta karbon berbasis zeolit ke substrat keramik
(Walcarius et al. 1999). Hasilnya adalah strip film komposit karbon-zeolit yang
dicetak dengan teknik screen-printing dengan ketebalan 200 m dan mengandung
partikel zeolit yang tertanam dalam matriks polimer karbon. Komposit ini menunjukkan kinerja yang lebih baik dibandingkan elektroda pasta karbon termodifikasi zeolit (prekonsentrasi yang lebih cepat dan regenerasi yang lebih baik) tetapi tidak bebas sepenuhnya dari pengaruh memori ketika diaplikasikan ke analisis voltametri berturut-turut setelah prakonsentrasi (Walcarius et al. 2003).
Zeolit Termodifikasi HDTMABr
Adsorben yang dapat digunakan untuk mengabsorpsi anion kromium heksavalen harus mempunyai sifat penukar anion. Permukaannya harus dimodifikasi agar memiliki tapak penukar yang bermuatan positif dengan tujuan untuk menjerap anion. Zeolit biasa tidak dapat mengikat atau menjerap spesi anion karena permukaannya yang bermuatan negatif. Oleh karena itu, zeolit dimodifikasi dengan surfaktan kationik (HDTMABr) yang dapat dibuat berdasarkan percobaan yang berhasil dilakukan oleh Li dan Bowman (1997) yaitu zeolit klinoptilolit termodifikasi HDTMABr yang disebut zeolit termodifikasi surfaktan. Uji batch dan kolom menunjukkan bahwa surfaktan termodifikasi zeolit
dapat menyingkirkan secara simultan berbagai jenis kontaminan dari air terdiri dari anion anorganik seperti Cr(VI) dan senyawaan organik hidrofobik seperti pelarut terklorinasi dan senyawaan minyak bumi (Li et al. 1998).
Surfaktan yang digunakan dalam penelitian ini yang akan terikat pada permukaan zeolit adalah HDTMABr (Heksadesiltrimetilamonium bromida). HDTMABr memiliki bobot molekul 364.46 g/mol, densitas 0.89 kg/L, titik nyala 15 oC, dan konsentrasi misel kritis sebesar 473.798 ppm (Merck 1.023420100). Senyawa ini merupakan surfaktan kationik rantai panjang yang memiliki muatan positif permanen. HDTMABr merupakan grup surfaktan kationik yang memiliki bagian kepala hidrofobik umumnya adalah grup amina terikat ke ekor hidrokarbon yang bersifat hidrofobik yang terdiri atas 16 rantai karbon (Gambar 4).
Gambar 4 Struktur kimia surfaktan HDTMABr (Nezamzadeh-Ejhieh & Nematollahi 2011).
Ketika HDTMABr dengan konsentrasi rendah terekspos pada permukaan zeolit yang bermuatan negatif, maka senyawa tersebut akan tertahan dengan penukar ion dan akan membentuk lapisan tunggal pada antarmuka padat-cair. Pada tahap ini, molekul-molekul surfaktan muncul sebagai monomer dalam larutan encer pada konsentrasi di bawah KMK yang umumnya berada di bawah 1 mmol/L. Ketika konsentrasi surfaktan di atas KMK, molekul-molekul surfaktan bersama-sama membentuk misel-misel dengan penambahan monomer. Ketika konsentrasi HDTMABr meningkat dan konsentrasi awal surfaktan lebih besar dibandingkan KMK, interaksi diantara ekor hidrokarbon menyebabkan pembentukan lapisan ganda atau setengah lapisan ganda dengan lapisan pertama tertahan dengan pertukaran ion dan lapisan kedua terbentuk dengan ikatan hidrofobik dan distabilisasi oleh ion-ion lawan. Surfaktan yang teradsorbsi membentuk lapisan kaya senyawa organik pada permukaan zeolit dan muatan pada permukaan dibalik dari negatif menjadi positif. Bagian kepala yang bermuatan positif kemudian diseimbangkan dengan ion lawan (Malek 2007). Model untuk interaksi HDTMABr pada permukaan zeolit terluar ditunjukkan pada Gambar 5.
Fenomena teoretis menunjukkan bahwa anion yang diseimbangkan oleh muatan positif dari HDTMABr akan ditukar dengan ion lawan yang terikat lebih kuat sementara dinding hidrofobik akan menjerap senyawaan organik dan kation terluar akan digantikan dengan kation yang menetralkan zeolit dari pori-pori internal. Sehingga zeolit termodifikasi HDTMABr yang dihasilkan mampu menjerap anion, kation, molekul organik nonpolar secara simultan dari air.
Gambar 5 Diagram skematis pembentukan misel HDTMABr dalam larutan (Malek 2007).
Penelitian mengenai elektrode pasta karbon termodifikasi zeolit sintetik-HDTMABr telah banyak dilakukan untuk aplikasi deteksi spesi anorganik dalam air. Nezamzadeh-Ejhieh & Masoudipour (2010) melaporkan pembuatan elektrode pasta karbon termodifikasi zeolit-HDTMABr untuk penentuan ion fosfat secara potensiometri. Elektrode yang mengandung 20% zeolit sintetik-HDTMABr menunjukkan daerah respons linear terhadap spesi fosfat dalam kisaran 1.58 x 10-5
tetap konstan dalam kisaran pH 4-12 dan dengan keberadaan 1 x 10-4 sampai 4 x
10-3 M NaNO3. Selanjutnya tahun 2011 Nezamzadeh-Ejhieh dan Nematollahi
melakukan penelitian elektrode pasta karbon termodifikasi zeolit-HDTMABr untuk penentuan ion nitrat secara selektif dengan potensiometri. Elektrode yang mengandung 10% zeolit-HDTMABr menunjukkan daerah respons linear terhadap spesi nitrat dalam kisaran 1.00 x 10-6 sampai 1.00 x 10-3 M dengan batas deteksi 1.00 x 10-6 M dengan slope Nernst 59.40.7 mV per dekade konsentrasi nitrat. Respons elektrode terhadap nitrat terjaga konstan dalam kisaran pH 3.5-9.8 dan 1.7-10.5 untuk konsentrasi nitrat 1.00 x 10-4 hingga 1.00 x 10-2 M, berturut-turut dengan keberadaan 1 x 10-4 sampai 1 x10-3 M NaCl.
Nezamzadeh-Ejhieh & Esmaelian (2012) melaporkan pembuatan elektrode pasta karbon termodifikasi zeolit-HDTMA untuk penentuan sulfat secara potensiometri. Elektrode yang mengandung 10% zeolit-HDTMA menunjukkan daerah respons linear terhadap spesi sulfat dalam kisaran 2.0 x 10-6 sampai 3.1 x 10-3 M dengan batas deteksi 2.0 x 10-6 M dan slope Nernst 29.80.8 mV per dekade konsentrasi sulfat. Respons elektrode terjaga konstan dalam kisaran pH 4-10 dengan keberadaan 1 x 4-10-4 sampai 2 x 10-3 M NaNO3. Penelitian terbaru yang
dilaporkan oleh Nezamzadeh-Ejhieh & Raja (2013) telah berhasil membuat elektrode membran selektif Cr(VI) yang terdiri dari nanoklinoptilolit termodifikasi HDTMABr: PVC: dioktil ftalat (DOP) dengan nisbah komposisi 4:32:64. Membran ini bekerja dengan efektif pada kisaran 5 x 10-6 hingga 1.0 x 10-2 M CrO42- dengan kemiringan Nernstian -29.38 ± 0.29 mV per dekade
konsentrasi CrO4- dengan limit deteksi 2 x 10-6 M dalam kisaran pH 6.8-10.7.
Difraksi Sinar-X
Salah satu cara untuk menentukan struktur kristal suatu kristalin seperti zeolit adalah dengan menggunakan instrumen difraksi sinar-X. Berdasarkan pola difraksi sinar-X yang disebut difraktogram diperoleh data berupa indeks Miller
hkl, intensitas relatif (I/I0), jarak interplanar d (mm), dan parameter unit sel (a, b,
c, α, , dan ). Selain itu, difraktogram juga menyediakan informasi mengenai kemurnian, zeolit, derajat kristalinitas, perubahan parameter unit sel dengan perubahan komposisi sehingga memungkinkan untuk menentukan sistem kristal (kubik, heksagonal, tetragonal, ortorombik, monoklin, dan triklinik (Jenkins 2000).
Analisis Termal
Analisis termal dapat dilakukan dengan menggunakan alat
Thermogravimetric Analysis (TGA). Melalui analisis termal, dapat diketahui
beberapa sifat termal bahan diantaranya titik kristalisasi, suhu transisi gelas (Tg),
suhu pelelehan (Tm), perubahan kalor, (ΔH), suhu dekomposisi, dan stabilitas
panas.
dan perubahan berat biasanya dicatat sebagai kenaikan temperatur. Temperatur dekomposisi suatu material dapat diamati dari kurva TGA (Cheremisinoff 1996).
Voltametri
Voltametri merupakan teknik analitik yang didasarkan pada pengukuran arus yang mengalir pada elektrode yang dicelupkan ke dalam larutan yang mengandung analit elektroaktif sementara payaran potensial dikenakan ke elektrodanya. Teknik voltametri terdiri dari 3 elektrode yaitu elektrode kerja, pembanding dan tambahan (counter). Secara umum, elektrode menyediakan
seluruh antarmuka tempat muatan dapat dipindahkan atau pengaruhnya dapat terjadi. Elektrode kerja merupakan tempat terjadinya reaksi atau transfer analit terjadi. Reduksi atau oksidasi analit pada permukaan elektrode kerja dengan potensial kerja yang sesuai berakibat pada transpor massa material baru ke elektrode kerja dan menghasilkan arus (Skoog et al. 2004).
Sel voltametri mengandung larutan dan elektrode kerja. Larutan mengandung analit elektroaktif, Aoks, yang dapat direduksi sebagaimana yang
ditunjukkan dalam reaksi berikut:
Aoks + ne Ared
Oks dan red merupakan bentuk analit dalam keadaan teroksidasi dan tereduksi dan n menunjukkan jumlah elektron yang terlibat dalam proses reaksi.
Pemberian potensial eksternal E mempengaruhi perbandigan Aoks dan Ared
pada permukaan elektrode yang dijelaskan oleh persamaan Nernst:
E0 adalah potensial standar reaksi redoks, R adalah tetapan gas mutlak, T adalah
suhu mutlak (K), F adalah bilangan Faraday. Ketika analit teroksidasi pada elektrode kerja, arus melewatkan elektron melalui sirkuit listrik eksternal menuju elektrode tambahan tempat reduksi pelarut atau komponen lain dalam di matriks larutan. Reduksi analit pada elektrode kerja membutuhkan sumber elektron menghasilkan arus yang dihasilkan dari reaksi redoks pada elektrode kerja dan tambahan yang disebut arus Faraday. Plot arus Faraday (iF) terhadap potensial
BAHAN DAN METODE
Bahan dan Alat
Bahan yang digunakan adalah contoh zeolit alam, pasta karbon, minyak parafin, K2CrO4, NH4Cl, H2SO4, HNO3, NaOH, HCl, indikator Conway, H3BO3,
HCl, bufer fosfat, bufer asetat, heksadesiltrimetilamonium bromida (HDTMABr) sebagai surfaktan. Alat-alat yang digunakan adalah peralatan gelas, mortar, sentrifusa Kokusan H-107, water shaker bath, spektrofotometer
ultraviolet-tampak Thermo Spectronic Genesys 10UV, Shimadzu XRD-7000, Fourier Transform Infrared (FTIR) Perkin Elmer, eDAQ Advanced Electrochemistry System Model ERZ101, 2200 Kjeltec Auto Distillation, Differential Thermal Analysis/Thermogravimetry (DTA-TG) Shimadzu tipe DTG-60/60H, elektrode
platina, elektrode pembanding Ag/AgCl.
Metode
Penelitian diawali dengan mengaktivasi zeolit yang berasal dari 4 daerah, yaitu Bayah, Cikembar, Cikalong, dan Lampung dengan perlakuan masing-masing asam (HCl 1 M), NaOH (1 M), dan termal (suhu 200 oC). Selanjutnya ditentukan zeolit modifikasi yang memiliki KTK tertinggi yang kemudian akan dimodifikasi permukaannya dengan HDTMABr. Kemudian zeolit termodifikasi HDTMABr ditentukan konsentrasi admisel kritiknya. Zeolit yang memiliki kapasitas adsorpsi HDTMABr dicirikan dengan XRD, FTIR, dan TG-DTA. Selanjutnya zeolit tersebut dicampurkan dengan grafit dan minyak parafin dengan berbagai komposisi. Elektrode komposit tersebut kemudian dievaluasi pengaruh elektrolit, pH, rentang konsentrasi Cr(VI), teknik voltametri, kecepatan payar, dan kinerjanya. Bagan alir penelitian disajikan dalam Lampiran 1.
Aktivas Zeolit (Cordoves et al. 2008)
Zeolit diambil dari 4 daerah, yaitu Bayah, Cikembar, dan Cikalong Jawa Barat, serta Lampung. Zeolit dikeringkan, digiling dan disaring sampai didapatkan ukuran 200 mesh. Sebanyak masing-masing 50 g zeolit dari masing-masing daerah diaktivasi dengan HCl 1 M, NaOH 1 M, suhu 200 oC selama 12 jam dengan 3 kali ulangan. Masing-masing zeolit kemudian diendapkan dengan sentrifusa dan dicuci dengan air deionisasi sampai pH mendekati 7. Zeolit kemudian dikeringkan di dalam oven sampai kering dan bebas air. Selanjutnya masing-masing zeolit ditentukan nilai KTKnya. Zeolit yang akan dipilih adalah yang memiliki nilai KTK tertinggi.
Penentuan Kapasitas Tukar Kation (Klute 1986)
Sebanyak 2.5 g contoh zeolit ditimbang dan ditambahkan 20 mL CH3COONH4 pH 7.0 kemudian diaduk selama 24 jam menggunakan water
shaker bath. Selanjutnya campuran disentrifusa pada kecepatan 2000 rpm selama
30 menit untuk memisahkan zeolit dari campuran. Zeolit yang telah menjerap CH3COONH4 kemudian dipindahkan ke dalam labu destilasi dan ditambahkan
yang telah ditambahkan 5-6 tetes indikator Conway. Proses destilasi dijalankan selama 4 menit sampai volume menjadi 150 mL dan larutan destilat berubah warna dari merah menjadi hijau. Blanko akuades juga didestilasi sebagai kontrol negatif. Larutan hasil destilasi kemudian dititrasi dengan HCl 0,1 N yang sebelumnya distandardisasi dengan boraks. Volume hasil titrasi contoh dan blanko kemudian dicatat. KTK zeolit dihitung menggunakan rumus berikut:
KTK (mek/100 g) =
Keterangan:
Vb = volume NaOH yang dibutuhkan pada titrasi blanko (mL) Vc = volume NaOH yang dibutuhkan pada titrasi contoh (mL) N NaOH = normalitas NaOH
Modifikasi Zeolit dengan HDTMABr (Nezamzadeh-Ejhieh & Esmaeilian 2012)
Persiapan zeolit termodifikasi dilakukan dengan mencampur zeolit alam yang sudah teraktivasi (2.5 g) dengan 10 mL larutan 0.1, 1, 10, 100, dan 200 mM HDTMABr dalam botol yang terpisah. Kemudian botol yang berisi campuran diaduk selama 24 jam dengan pengaduk magnet dan dibiarkan selama 48 jam. Campuran kemudian disentrifugasi pada kecepatan 3500 rpm selama 20 menit dan zeolit termodifikasi HDTMABr yang dihasilkan kemudian dikeringudarakan.
Pembuatan Larutan Induk HDTMABr
Sebanyak 0.3645 g HDTMABr dilarutkan dengan akuades dalam labu takar 100 mL sampai tanda batas sehingga diperoleh larutan induk HDTMABr 10 mM. Kemudian dari larutan induk tersebut diencerkan menjadi konsentrasi 0.01 hingga 0.10 mM ke dalam labu takar 25 mL yang berbeda.
Pembuatan Buffer Fosfat 0.1 M pH 8
Sebanyak 0,9583 g NaH2PO4.H2O dan 7.6633 g Na2HPO4.2H2O dilarutkan
dengan akuades dalam labu takar 25 mL yang berbeda. Kemudian larutan NaH2PO4.H2O dicampurkan dengan Na2HPO4.2H2O sehingga diperoleh buffer
fosfat pH 8 yang diatur dengan menggunakan pH meter.
Pembuatan Larutan Bromofenol Biru (BPB)
maksimum kompleks [HDTMA]2BPB ditentukan dengan menggunakan salah satu
larutan campuran. Larutan sisanya diukur pada panjang gelombang maksimum kompleks [HDTMA]2BPB yaitu 605 nm.
Penentuan KAK (Konsentrasi Admisel Kritik) Zeolit Lampung Teraktivasi Basa (Wibowo 2011 dengan modifikasi)
Sebanyak masing-masing 0.5 gram zeolit Lampung teraktivasi basa ditambahkan 10 mL HDTMABr dengan konsentrasi masing-masing 0.1; 1; 10; 100; 200 mM. Kemudian campuran diaduk selama 8 jam dan didiamkan selama 48 jam. Filtrat kemudian dipisahkan dari endapan. Sebanyak 4 mL BPB 0.03 mM ditambahkan dengan 4 mL filtrat tersebut di dalam labu takar 10 mL dengan pH campuran diatur menjadi 8 dengan buffer fosfat 0.1 M. Sebanyak 5 mL campuran dipipet ke dalam corong pisah ditambah dengan 5 mL kloroform kemudian diekstraksi selama 20 menit. Fasa kloroform diukur dengan spektrofotometer UV-Tampak pada 605 nm.
Uji Adsorpsi Cr(VI) (Arif 2011)
Sebanyak 50 mg masing-masing zeolit alam Lampung dan termodifikasi HDTMABr 200 mM dimasukkan ke dalam botol film. Kemudian 5 mL standar
Cr(VI) dengan konsentrasi 10 sampai β00 μM dimasukkan ke dalam botol dan
dikocok selama 6 jam. Filtrat dipisahkan dari endapan dengan cara disaring. Filtrat hasil adsorpsi dimasukkan ke dalam tabung reaksi dan ditambahkan berturut-turut 1 mL H2SO4 pekat dan 0.3 mL H3PO4 pekat. Larutan divortex dan
dibiarkan selama 5 menit. Kemudian 0.5 mL DPC 1% (b/v) dimasukkan ke dalam tabung reaksi dan dibiarkan selama 10 menit. Larutan diukur pada panjang gelombang maksimum 543 nm.
Analisis XRD
Identifikasi zeolit alam asal Lampung, zeolit teraktivasi basa, zeolit teraktivasi basa termodifikasi HDTMABr 200 mM dengan XRD dilakukan untuk mengidentifikasi jenis mineral yang terdapat di dalam zeolit. Sekitar 200 mg sampel dicetak langsung pada aluminium berukuran 2 x 2.5 cm2. Sampel dicirikan
dengan lampu radiasi Cu pada kisaran βθ pada kisaran 5-60 o.
Analisis Gugus Fungsi
Penyiapan sampel dilakukan dengan menggerus zeolit dengan mortar yang ditambahkan KBr anhidrat. Kemudian campuran dicetak hingga membentuk pelat. Pelat dianalisis menggunakan spektroskopi inframerah Transformasi Fourier (FTIR).
Analisis Termal
Sebanyak 22 mg sampel zeolit digerus dalam mortar kemudian dicetak ke dalam pelat platina. Analisis termal dilakukan pada suhu 35-1000 oC dengan kecepatan pemanasan 20 oC/menit. Data yang diperoleh berupa termogram yang
menggambarkan perilaku zeolit teraktivasi basa termodifikasi HDTMABr ketika dipanaskan dari suhu 35-1000 oC.
Elektrode pasta karbon (EPK) dibuat dengan mencampurkan grafit dan parafin cair sementara elektrode pasta karbon–zeolit termodifikasi HDTMABr (EPK-Z-HDTMABr) dibuat dengan mencampurkan grafit, zeolit termodifikasi surfaktan, dan parafin cair. Semua bahan dicampur, disonikasi, dan digerus dalam mortar hingga membentuk pasta yang homogen. Sebuah tabung kaca dengan diameter 2.5 mm digunakan sebagai badan elektrode. Kawat tembaga digunakan sebagai penghubung elektrode ke sumber listrik dimasukkan ke dalam tabung hingga tersisa ruang kosong sekitar 3 mm pada ujung tabung. Pasta dimasukkan ke ujung tabung tersebut hingga penuh dan padat (Gambar 6). Permukaan elektrode kemudian digosok menggunakan kertas minyak.
Gambar 6 Skema pembuatan elektrode pasta karbon.
Uji Kinerja Elektrode dengan Metode Voltametri
Pada uji kinerja ini, dilakukan pengamatan terhadap 3 parameter terhadap respons arus dari elektrode yang dibuat, yaitu pengaruh arus latar belakang larutan elektrolit, waktu perendaman, dan komposisi zeolit termodifikasi HDTMABr. Pengukuran pada elektrode dilakukan dengan teknik voltametri siklik menggunakan perangkat lunak EChem v2.1. EPK dan EPK-Z-HDTMABr sebagai elektrode kerja, elektrode Ag/AgCl sebagai elektrode pembanding, dan elektrode platina (Pt) sebagai elektrode tambahan. Potensial yang digunakan dari -0.5 V
sampai 1.0 V dengan laju selusur sebesar 150 mV/detik. Pengolahan data
voltametri siklik dilakukan dengan perangkat lunak Origin 7.
Pengaruh pH terhadap Arus Reduksi Cr(VI) (Kachoosangi & Compton 2013)
Larutan analit Cr(VI) 13 mM dibuat dalam HNO3 kemudian diatur pada
tingkat konsentrasi 0.3 hingga 10-4 M. Larutan dimasukkan ke dalam sel voltametri yang berisi larutan analit Cr(VI) dan respons arus diamati menggunakan voltametri siklik pada selang potensial -0.5 V sampai 1.0 V.
Pengaruh Kecepatan Payar (Kachoosangi & Compton 2013)
Larutan Cr(VI) 13 mM dibuat dalam HNO3 0.3 M diukur dengan
EPK-Z-HDTMABr 200 mM 2.5% dengan komposisi 2.5 mg. Respons arus diamati pada selang -0.5 V sampai 1.0 V. Kecepatan payar yang digunakan berkisar antara
25-250 mV/detik.
Pengaruh Komposisi Zeolit Termodifikasi HDTMABr (modifikasi dari Alpat
et al. 2005)
Kawat tembaga
Tabung kaca
EPK zeolit termodifikasi HDTMABr dibuat dengan mencampurkan grafit, zeolit termodifikasi HDTMABr 200 mM, dan parafin cair dalam berbagai komposisi seperti yang tersaji pada Tabel 1. Hal ini dilakukan untuk melihat pengaruh komposisi zeolit termodifikasi HDTMABr terhadap kinerja EPK. Selanjutnya respons arus diamati menggunakan voltametri siklik pada selang potensial -0.5 V sampai 1.0 V.
Tabel 1 Bahan dan komposisi elektrode
EPK-SMZ Komposisi
Grafit (mg) SMZ (mg) Parafin (mg)
1 69 1 30
2.5 67.5 2.5 30
5 65 5 30
7.5 62.5 7.5 30
10 60 10 30
Pengukuran Larutan Cr(VI)
Larutan Cr(VI) 13 mM dibuat dalam HNO3 0.3 M diukur menggunakan 3
EPK-Z-HDTMA 200 mM 2.5% yang berbeda. Larutan tersebut diukur dengan menggunakan 3 teknik yang berbeda yaitu, voltametri sapuan linear (VSL), voltametri pulsa diferensial (VPD), dan voltametri gelombang persegi (VGP) dengan laju selusur 25 sampai 250 mV/detik.
Pengaruh Konsentrasi Cr(VI)
Kurva kalibrasi dibuat dengan mengalurkan konsentrasi Cr(VI) (0-1.0 mM) dengan arus puncak. Pengujian voltametri siklik dilakukan dengan menggunakan EPK-Z-HDTMABr 200 mM 2.5% dengan komposisi 2.5 mg. Respons arus diamati pada selang -0.5 V sampai 1.0 V dengan kecepatan payar 150 mV/detik.
Linearitas kurva ditentukan berdasarkan koefisien korelasi kurva standar. Berdasarkan kurva standar yang diperoleh, ditentukan pula limit deteksi dan limit kuantitasi elektrode.
Penentuan Ketelitian Pengukuran
Larutan Cr(VI) 13 mM dibuat dalam HNO3 0.3 M. Larutan kemudian
dimasukkan ke dalam sel voltametri dan diukur menggunakan dengan teknik voltametri siklik pasa selang potensial -0.5 V sampai 1.0 V dengan kecepatan
payaran 150 mV/detik. Setelah elektrode digunakan untuk 1 kali pengukuran,
elektrode tersebut dicuci dan digosok di kertas minyak. Ulangan pengukuran dilakukan sebanyak 10 kali dan dicatat arus puncak reduksi yang muncul.
HASIL DAN PEMBAHASAN
Sumber zeolit alam yang digunakan dalam penelitian ini berasal dari Jawa Barat yaitu Cikembar, Cikalong, dan Bayah serta Lampung. Zeolit alam memiliki ukuran pori yang tidak seragam dan mengandung banyak pengotor sehingga perlu dilakukan preparasi dan aktivasi sebelum digunakan. Proses preparasi dilakukan dengan cara penggilingan dan pengayakan menggunakan saringan 200 mesh. Kemudian masing-masing zeolit tersebut diaktivasi secara kimia maupun fisika. Aktivasi secara kimia dilakukan dengan menambahkan asam HCl 1 M dan basa NaOH 1 M, sementara aktivasi fisika dilakukan dengan cara pemanasan.
Proses aktivasi zeolit dengan perlakuan asam dan basa akan mengubah permukaan zeolit alam. Secara umum, asam dan basa akan membersihkan zeolit dari beberapa pengotor yang ada di zeolit alam. Selain itu, asam dan basa juga akan bereaksi dengan permukaan zeolit yang terdiri atas atom-atom Si dan Al. Menurut Arif (2011) reaksi yang terjadi terhadap zeolit yang teraktivasi asam dan basa adalah sebagai berikut:
Zeolit alam + HCl → zeolit teraktivasi + AlCl3(aq)
Zeolit alam + NaOH → zeolit teraktivasi + Al(OH)4-(aq) + SiO32-(aq)
Perlakuan zeolit secara fisika dilakukan dengan pemanasan pada suhu 200
oC dalam oven selama 4 jam. Proses ini bertujuan untuk menguapkan air yang
terperangkap dalam pori-pori kristal zeolit sehingga pori-porinya dapat digunakan untuk pertukaran ion dan proses adsorpsi (Kurniasari et al. 2011).
Kapasitas Tukar Kation Zeolit
Kapasitas tukar kation (KTK) merupakan salah satu parameter sifat kimia yang penting pada zeolit dalam fungsinya sebagai bahan adsorben. KTK merupakan jumlah maksimum miliekuivalen (mek) kation yang dapat dipertukarkan oleh 100 g bahan zeolit pada kondisi kesetimbangan. Kation yang dapat dipertukarkan dari zeolit adalah kation yang tidak terikat kuat di dalam kerangka tetrahedral sehingga akan mudah dipertukarkan dengan ion positif lainnya. Nilai KTK juga menunjukkan tingkat substitusi Al terhadap Si sehingga zeolit akan kekurangan muatan positif atau dengan kata lain zeolit akan lebih bermuatan negatif. Nilai KTK zeolit akan meningkat apabila semakin banyak kation yang diperlukan untuk menetralkan muatan negatif dari zeolit.
Penentuan KTK metode tumpak (batch) dilakukan dengan menambahkan
pelarut amonium asetat pada zeolit dengan tujuan untuk membersihkan dan membuka pori zeolit. Umumnya pori-pori zeolit alam utamanya terisi oleh ion Na+, K+, Ca2+, dan molekul H2O serta ion Mg2+, Ti4+, Pd2+, dan Ba2+ dalam
jumlah renik. Di antara ion-ion tersebut, ion-ion Na+, K+. Ca2+, dan Mg2+ dapat dipertukarkan dengan ion NH4+ (Ates & Hardacre 2012). Waktu pengocokan
selama 24 jam dimaksudkan agar terjadi kesetimbangan pertukaran kation yang di dalam zeolit dengan ion NH4+ yang berasal dari amonium asetat. Kemudian untuk
menentukan jumlah ion NH4+ yang terjerap di dalam zeolit dilakukan dengan cara
destilasi. Larutan NaOH pekat ditambahkan sebelum destilasi supaya terbentuk NH4OH yang kemudian didestilasi sehingga menghasilkan air dan uap NH3. Uap
NH3 yang terbentuk ditangkap oleh larutan H2SO4 sehingga membentuk
(NH4)2SO4. Jumlah NH3 yang terbentuk dapat ditentukan dengan titrasi asam basa
Proses aktivasi zeolit bertujuan meningkatkan kemampuan tukar kation pada zeolit alam. Hasil penentuan KTK yang dilakukan pada zeolit asal Cikembar, Cikalong, Bayah, dan Lampung dengan aktivasi kimia dan fisika ditunjukkan pada Gambar 7. Nilai KTK tertinggi pada zeolit alam yang berasal dari daerah Cikalong yang 2 kali lebih besar dari zeolit Cikembar. Ketika zeolit yang berasal dari 4 daerah tersebut masing-masing diaktivasi dengan HCl 1 M diperoleh semua nilai KTK zeolit mengalami penurunan dengan urutan KTK tertinggi setelah teraktivasi asam adalah Cikalong, Lampung, Bayah, dan Cikembar.
Perlakuan asam pada zeolit alam tidak hanya menghilangkan senyawa pengotor seperti oksida logam yang terdapat pada pori-pori zeolit namun juga menyebabkan proses dealuminasi. Proses dealuminasi merupakan pemutusan ikatan Al-O pada kerangka zeolit yang mengakibatkan tingkat substitusi Al terhadap Si menjadi turun sehingga rasio Si/Al mengalami peningkatan. Dengan demikian, muatan negatif pada zeolit menjadi berkurang sehingga banyaknya kation yang dapat dipertukarkan pada zeolit menjadi lebih sedikit. Hasil percobaan menunjukkan bahwa zeolit asal Cikalong dan Lampung lebih tahan asam karena penurunan nilai KTKnya tidak setajam dibandingkan zeolit asal Cikembar dan Bayah.
Gambar 7 KTK zeolit yang berasal dari 4 daerah.
Aktivasi zeolit dengan NaOH memberikan nilai KTK yang lebih tinggi dibandingkan aktivasi zeolit dengan HCl. Urutan kenaikan KTK tertinggi diperoleh dari zeolit Lampung (5 kali), Cikembar (3 kali), Cikalong dan Bayah yang sama (1.5 kali). Aktivasi zeolit dengan NaOH akan mengakibatkan proses pelarutan silika yang merupakan salah satu komponen dalam kerangka zeolit (Jozefaciuk & Bowanko 2002). Silika yang terlarut ini akan menyebabkan perubahan struktur zeolit serta berkurangnya silika dalam kerangka zeolit sehingga rasio Si/Al menurun. Penurunan rasio ini akan mengakibatkan kenaikan kapasitas adsorpsi dan selektivitas zeolit terhadap molekul-molekul polar seperti uap air (Bonenfant et al. 2008).
Selain penurunan rasio Si/Al, aktivasi zeolit alam dengan NaOH juga mengakibatkan hilangnya ion-ion tertentu pada kerangka zeolit dan diganti oleh
23.7
ion Na+ sehingga zeolit alam mempunyai kondisi yang semakin mendekati
homoionik (Inglezakis et al. 2001). Bentuk Na-zeolit ini diharapkan akan
mempunyai ukuran pori yang relatif sama sehingga akan mendukung pada saat modifikasi zeolit dengan surfaktan heksadesiltrimetilamonium bromida (HDTMABr) karena bagian kepala senyawa tersebut bermuatan positif (H3C(CH2)15N(CH3)3)+ akan bertukar muatan terutama dengan ion Na+. Sehingga
kemampuan dan selektivitas adsorpsinya terhadap HDTMABr juga akan lebih baik.
Proses aktivasi secara termal dilakukan pada suhu 200 oC selama 4 jam. Hal ini bertujuan untuk menghilangkan molekul-molekul air serta zat-zat organik volatil yang ada pada pori-pori dan kerangka zeolit alam. Perlakuan secara termal ini dapat pula mengakibatkan perpindahan kation sehingga mempengaruhi letak kation serta ukuran pori yang pada akhirnya akan mempengaruhi kesetimbangan serta kinetika adsorpsi (Ackley et al. 2003).
Nilai KTK yang diperoleh pada aktivasi zeolit alam dengan suhu 200 oC . Aktivasi zeolit alam asal Cikalong dan Bayah secara termal menghasilkan nilai KTK paling tinggi dibandingkan aktivasi secara kimiawi. Hal ini menandakan bahwa kedua zeolit tersebut banyak mengandung pengotor yaitu uap air dan senyawa-senyawa yang dapat lepas pada suhu di bawah 200 oC.
Hasil percobaan ini menunjukkan nilai KTK tertinggi diperoleh pada zeolit alam asal Lampung dengan aktivasi NaOH yaitu 107.5 mek/100 g. Nilai KTK pada zeolit termodifikasi ini sudah memenuhi kategori zeolit dengan kualitas tinggi (minimal 100 mek/100 g) dengan kandungan zeolit di atas 50% (SNI 2006). Pengubahan karakter permukaan zeolit ini dimaksudkan agar zeolit dapat berinteraksi dengan anion khususnya adalah kromium(VI) yang bermuatan negatif. Sebelum dilakukan adsorpsi zeolit terhadap kromium(VI), terlebih dahulu dilakukan modifikasi permukaan zeolit dengan senyawa HDTMABr supaya dapat berinteraksi dengan anion tersebut. Nilai KTK yang tinggi ini diharapkan semakin banyak ion-ion positif terutama ion Na+ yang mampu bertukar muatan dengan bagian kepala HDTMABr yang bermuatan positif.
Konsentrasi Admisel Kritik Zeolit
Secara alamiah zeolit mempunyai muatan negatif pada permukaannya dan dengan aktivasi dengan NaOH menghasilkan zeolit homoionik (Na-zeolit). Menurut Wibowo et al. (2011) zeolit alam yang berasal dari Lampung termasuk
dalam klinoptilolit yang memiliki ukuran rongga sekitar 4.2-7.2 Å sementara bagian kepala surfaktan HDTMA+ memiliki ukuran 7 Å. Hal ini akan menyebabkan adsorpsi HDTMA+ hanya terjadi pada permukaan zeolit klinoptilolit. Adsorpsi surfaktan kationik HDTMABr pada permukaan zeolit terjadi karena adanya pertukaran ion antara HDTMA+ dengan kation-kation Na+ yang ada di permukaan zeolit.
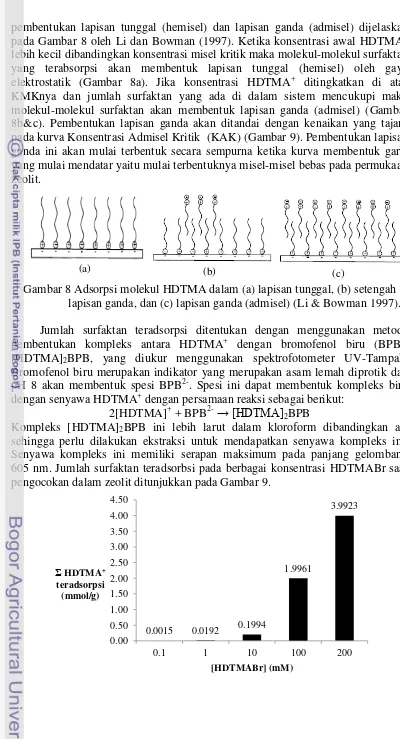
Mekanisme pembentukan lapisan surfaktan pada permukaan padat secara umum dijelaskan oleh Chen et al. (1992). Pada konsentrasi HDTMA di atas
pembentukan lapisan tunggal (hemisel) dan lapisan ganda (admisel) dijelaskan pada Gambar 8 oleh Li dan Bowman (1997). Ketika konsentrasi awal HDTMA+ lebih kecil dibandingkan konsentrasi misel kritik maka molekul-molekul surfaktan yang terabsorpsi akan membentuk lapisan tunggal (hemisel) oleh gaya elektrostatik (Gambar 8a). Jika konsentrasi HDTMA+ ditingkatkan di atas KMKnya dan jumlah surfaktan yang ada di dalam sistem mencukupi maka molekul-molekul surfaktan akan membentuk lapisan ganda (admisel) (Gambar 8b&c). Pembentukan lapisan ganda akan ditandai dengan kenaikan yang tajam pada kurva Konsentrasi Admisel Kritik (KAK) (Gambar 9). Pembentukan lapisan ganda ini akan mulai terbentuk secara sempurna ketika kurva membentuk garis yang mulai mendatar yaitu mulai terbentuknya misel-misel bebas pada permukaan zeolit.
Gambar 8 Adsorpsi molekul HDTMA dalam (a) lapisan tunggal, (b) setengah lapisan ganda, dan (c) lapisan ganda (admisel) (Li & Bowman 1997).
Jumlah surfaktan teradsorpsi ditentukan dengan menggunakan metode pembentukan kompleks antara HDTMA+ dengan bromofenol biru (BPB), [HDTMA]2BPB, yang diukur menggunakan spektrofotometer UV-Tampak.
Bromofenol biru merupakan indikator yang merupakan asam lemah diprotik dan pH 8 akan membentuk spesi BPB2-. Spesi ini dapat membentuk kompleks biru
dengan senyawa HDTMA+ dengan persamaan reaksi sebagai berikut: 2[HDTMA]+ + BPB2-→ [HDTMA]2BPB
Kompleks [HDTMA]2BPB ini lebih larut dalam kloroform dibandingkan air
sehingga perlu dilakukan ekstraksi untuk mendapatkan senyawa kompleks ini. Senyawa kompleks ini memiliki serapan maksimum pada panjang gelombang 605 nm. Jumlah surfaktan teradsorbsi pada berbagai konsentrasi HDTMABr saat pengocokan dalam zeolit ditunjukkan pada Gambar 9.
Gambar 9 Jumlah HDTMA+ teradsorbsi pada permukaan zeolit Lampung.
Gambar diatas menunjukkan bahwa semakin besar konsentrasi HDTMABr yang diaplikasikan pada zeolit Lampung teraktivasi basa maka semakin tinggi pula jumlah HDTMA+ yang teradsorpsi pada permukaan zeolit. Jumlah HDTMA+ teradsorpsi mengalami peningkatan dari 0.1994 menjadi 1.9961 mmol/g pada kisaran 10-100 mM (10 kali lipat). Hal ini menunjukkan pada kisaran konsentrasi terjadi pembentukan lapisan tunggal (hemisel) HDTMA+ pada permukaan zeolit Lampung. Sementara pada kisaran konsentrasi 100-200 mM HDTMABr terjadi kenaikan adsorpsi yaitu 1.9961 mmol/g hingga 3.9923 mmol/g atau kira-kira 2 kali lipatnya. Sehingga dapat diperkirakan bahwa pada kisaran konsentrasi HDTMABr ini sudah mulai terbentuk lapisan ganda (admisel). Keadaan lapisan ganda (admisel) ini belum sepenuhnya tercapai pada permukaan zeolit disebabkan belum diperolehnya jumlah HDTMA+ teradsorpsi dalam keadaan tunak (steady state) pada kurva konsentrasi admisel kritik. Namun demikian, diputuskan untuk
tidak menaikkan konsentrasi HDTMABr di atas disebabkan Wibowo et al. (2011)
melaporkan bahwa KAK pada zeolit klinoptilolit Lampung teraktivasi 350 oC pada 70 mM HDTMABr dengan jumlah HDTMA+ teradsorpsi adalah 0.1967 mmol/g.
Adsorpsi Cr(VI) Terhadap Zeolit-HDTMABr
Metode adsorpsi Cr(VI) pada zeolit Lampung yang digunakan adalah metode tumpak (batch). Pada metode tumpak, larutan contoh Cr(VI) dan zeolit
Lampung dicampur dan dikocok sampai waktu tertentu hingga tercapai kesetimbangan. Keadaan setimbang tercapai apabila zeolit telah jenuh oleh Cr(VI). Tahap berikutnya adalah penyaringan zeolit sehingga diperoleh konsentrasi sisa Cr(VI) dalam larutan, selisih konsentrasi digunakan untuk menentukan kapasitas adsorpsi. Kapasitas adsorpsi menyatakan bahwa jumlah Cr(VI) (mg) yang dapat teradsorpsi dalam tiap gram zeolit. Penentuan uji adsorpsi Cr(VI) pada zeolit ini mengikuti prosedur yang dikerjakan oleh Arif (2011) yang melaporkan bahwa pH optimum adsorpsi Cr(VI) yaitu 3 dengan waktu pengocokan selama 6 jam. Menurut Cordoves et al. (2008) bentuk Cr(VI) yang
paling dominan pada pH 2-6 adalah HCrO4- sehingga dalam percobaan ini yang
paling banyak diadsorpsi adalah ion tersebut.